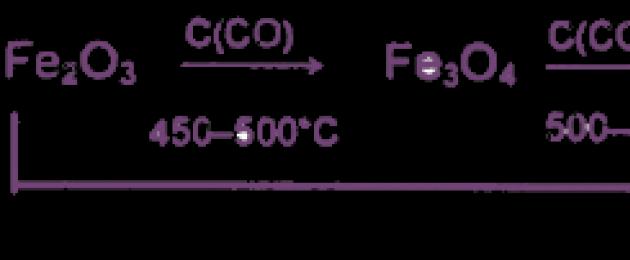Το ανθρώπινο σώμα περιέχει περίπου 5 g σιδήρου, τα περισσότερα από(70%) είναι μέρος της αιμοσφαιρίνης του αίματος.
Φυσικές ιδιότητες
Στην ελεύθερη του κατάσταση, ο σίδηρος είναι ένα ασημί-λευκό μέταλλο με γκριζωπή απόχρωση. Ο καθαρός σίδηρος είναι όλκιμος και έχει σιδηρομαγνητικές ιδιότητες. Στην πράξη, συνήθως χρησιμοποιούνται κράματα σιδήρου - χυτοσίδηρος και χάλυβας.
Ο Fe είναι το πιο σημαντικό και πιο άφθονο στοιχείο από τα εννέα d-μέταλλα της υποομάδας της Ομάδας VIII. Μαζί με το κοβάλτιο και το νικέλιο σχηματίζει την «οικογένεια σιδήρου».
Όταν σχηματίζει ενώσεις με άλλα στοιχεία, χρησιμοποιεί συχνά 2 ή 3 ηλεκτρόνια (B = II, III).
Ο σίδηρος, όπως σχεδόν όλα τα στοιχεία d της ομάδας VIII, δεν εμφανίζει υψηλότερο σθένος ίσο με τον αριθμό της ομάδας. Το μέγιστο σθένος του φτάνει στο VI και εμφανίζεται εξαιρετικά σπάνια.
Οι πιο τυπικές ενώσεις είναι εκείνες στις οποίες τα άτομα Fe βρίσκονται σε καταστάσεις οξείδωσης +2 και +3.
Μέθοδοι λήψης σιδήρου
1. Ο τεχνικός σίδηρος (κράμα με άνθρακα και άλλες προσμίξεις) λαμβάνεται με ανθρακοθερμική αναγωγή των φυσικών του ενώσεων σύμφωνα με το ακόλουθο σχήμα:

Η ανάρρωση γίνεται σταδιακά, σε 3 στάδια:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3 FeO + CO 2
3) FeO + CO = Fe + CO 2
Ο χυτοσίδηρος που προκύπτει από αυτή τη διαδικασία περιέχει περισσότερο από 2% άνθρακα. Στη συνέχεια, ο χυτοσίδηρος χρησιμοποιείται για την παραγωγή κραμάτων χάλυβα - σιδήρου που περιέχουν λιγότερο από 1,5% άνθρακα.
2. Ο πολύ καθαρός σίδηρος λαμβάνεται με έναν από τους ακόλουθους τρόπους:
α) αποσύνθεση πεντακαρβονυλίου Fe
Fe(CO) 5 = Fe + 5СО
β) αναγωγή του καθαρού FeO με υδρογόνο
FeO + H 2 = Fe + H 2 O
γ) ηλεκτρόλυση υδατικά διαλύματαΆλατα Fe +2
FeC 2 O 4 = Fe + 2CO 2
οξαλικός σίδηρος (II).
Χημικές ιδιότητες
Ο Fe είναι μέταλλο μέσης δραστικότητας, εκθέματα γενικές ιδιότητες, χαρακτηριστικό των μετάλλων.
Ένα μοναδικό χαρακτηριστικό είναι η ικανότητα «σκουριάς» σε υγρό αέρα:
Ελλείψει υγρασίας με ξηρό αέρα, ο σίδηρος αρχίζει να αντιδρά αισθητά μόνο στους T > 150°C. κατά την πύρωση, σχηματίζεται "λέπια σιδήρου" Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
Ο σίδηρος δεν διαλύεται στο νερό απουσία οξυγόνου. Σε πολύ υψηλές θερμοκρασίες, ο Fe αντιδρά με τους υδρατμούς, εκτοπίζοντας το υδρογόνο από τα μόρια του νερού:
3 Fe + 4H 2 O(g) = 4H 2
Ο μηχανισμός της σκουριάς είναι η ηλεκτροχημική διάβρωση. Το προϊόν σκουριάς παρουσιάζεται σε απλοποιημένη μορφή. Πράγματι, σχηματίζεται ένα χαλαρό στρώμα μίγματος οξειδίων και υδροξειδίων μεταβλητής σύστασης. Σε αντίθεση με το φιλμ Al 2 O 3, αυτό το στρώμα δεν προστατεύει το σίδηρο από περαιτέρω καταστροφή.
Τύποι διάβρωσης

Προστασία του σιδήρου από τη διάβρωση

1. Αλληλεπίδραση με αλογόνα και θείο σε υψηλές θερμοκρασίες.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 = FeI 2
Σχηματίζονται ενώσεις στις οποίες κυριαρχεί ο ιοντικός τύπος δεσμού.
2. Αλληλεπίδραση με φώσφορο, άνθρακα, πυρίτιο (ο σίδηρος δεν συνδυάζεται άμεσα με Ν2 και Η2, αλλά τα διαλύει).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = Fe x Si y
Σχηματίζονται ουσίες μεταβλητής σύνθεσης, όπως βερτολλίδες (η ομοιοπολική φύση του δεσμού κυριαρχεί στις ενώσεις)
3. Αλληλεπίδραση με «μη οξειδωτικά» οξέα (HCl, H 2 SO 4 αραι.)
Fe 0 + 2H + → Fe 2+ + H 2
Δεδομένου ότι ο Fe βρίσκεται στη σειρά δραστηριότητας στα αριστερά του υδρογόνου (E° Fe/Fe 2+ = -0,44 V), είναι ικανός να εκτοπίσει το H 2 από τα συνηθισμένα οξέα.
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
4. Αλληλεπίδραση με «οξειδωτικά» οξέα (HNO 3, H 2 SO 4 συμπ.)
Fe 0 - 3e - → Fe 3+
Το συμπυκνωμένο HNO 3 και το H 2 SO 4 «παθητικοποιούν» τον σίδηρο, έτσι σε συνηθισμένες θερμοκρασίες το μέταλλο δεν διαλύεται σε αυτά. Με ισχυρή θέρμανση, εμφανίζεται αργή διάλυση (χωρίς να απελευθερωθεί H 2).
Στο τμήμα Ο σίδηρος HNO 3 διαλύεται, διοχετεύεται σε διάλυμα με τη μορφή κατιόντων Fe 3+ και το όξινο ανιόν ανάγεται σε NO*:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
Πολύ διαλυτό σε μείγμα HCl και HNO 3
5. Σχέση με αλκάλια
Ο Fe δεν διαλύεται σε υδατικά διαλύματα αλκαλίων. Αντιδρά με λιωμένα αλκάλια μόνο σε πολύ υψηλές θερμοκρασίες.
6. Αλληλεπίδραση με άλατα λιγότερο ενεργών μετάλλων
Fe + CuSO 4 = FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Αντίδραση με αέριο μονοξείδιο του άνθρακα (t = 200°C, P)
Fe (σκόνη) + 5CO (g) = Fe 0 (CO) 5 σίδηρος πεντακαρβονύλιο
Ενώσεις Fe(III).
Fe 2 O 3 - οξείδιο σιδήρου (III).
Κόκκινο-καφέ σκόνη, n. R. σε Η 2 Ο. Στη φύση - «κόκκινο σιδηρομετάλλευμα».
Τρόποι απόκτησης:
1) αποσύνθεση υδροξειδίου του σιδήρου (III).
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
2) ψήσιμο πυρίτη
4FeS 2 + 11O 2 = 8SO 2 + 2Fe 2 O 3
3) αποσύνθεση νιτρικών
Χημικές ιδιότητες
Το Fe 2 O 3 είναι ένα βασικό οξείδιο με σημάδια αμφοτερικότητας.
I. Οι κύριες ιδιότητες εκδηλώνονται στην ικανότητα αντίδρασης με οξέα:
Fe 2 O 3 + 6H + = 2Fe 3+ + ZH 2 O
Fe 2 O 3 + 6HCI = 2FeCI 3 + 3H 2 O
Fe 2 O 3 + 6HNO 3 = 2Fe(NO 3) 3 + 3H 2 O
II. Ασθενείς ιδιότητες οξέος. Το Fe 2 O 3 δεν διαλύεται σε υδατικά διαλύματα αλκαλίων, αλλά όταν συντήκεται με στερεά οξείδια, αλκάλια και ανθρακικά, σχηματίζονται φερρίτες:
Fe 2 O 3 + CaO = Ca(FeO 2) 2
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 = Mg (FeO 2) 2 + CO 2
III. Fe 2 O 3 - πρώτη ύλη για την παραγωγή σιδήρου στη μεταλλουργία:
Fe 2 O 3 + ZS = 2Fe + ZSO ή Fe 2 O 3 + ZSO = 2Fe + ZSO 2
Fe(OH) 3 - υδροξείδιο σιδήρου (III).
Τρόποι απόκτησης:
Λαμβάνεται από τη δράση των αλκαλίων σε διαλυτά άλατα Fe 3+:
FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
Κατά τη στιγμή της παρασκευής, το Fe(OH) 3 είναι ένα κόκκινο-καφέ βλεννώδες-άμορφο ίζημα.
Το υδροξείδιο Fe(III) σχηματίζεται επίσης κατά την οξείδωση του Fe και του Fe(OH) 2 σε υγρό αέρα:
4Fe + 6H 2 O + 3O 2 = 4Fe(OH) 3
4Fe(OH) 2 + 2H 2 O + O 2 = 4Fe(OH) 3
Το υδροξείδιο Fe(III) είναι το τελικό προϊόνυδρόλυση αλάτων Fe 3+.
Χημικές ιδιότητες
Fe(OH) 3 - πολύ αδύναμο θεμέλιο(πολύ ασθενέστερο από το Fe(OH) 2). Παρουσιάζει αξιοσημείωτες όξινες ιδιότητες. Έτσι, το Fe(OH) 3 έχει αμφοτερικό χαρακτήρα:
1) οι αντιδράσεις με οξέα συμβαίνουν εύκολα:
2) φρέσκο ίζημα Fe(OH) 3 διαλύεται σε θερμό συμπ. διαλύματα ΚΟΗ ή NaOH με σχηματισμό υδροξοσυμπλοκών:
Fe(OH) 3 + 3KOH = K 3
Σε ένα αλκαλικό διάλυμα, το Fe(OH) 3 μπορεί να οξειδωθεί σε φερρατικά (άλατα του οξέος σιδήρου H 2 FeO 4 που δεν απελευθερώνονται σε ελεύθερη κατάσταση):
2Fe(OH) 3 + 10KOH + 3Br 2 = 2K 2 FeO 4 + 6KBr + 8H 2 O
Άλατα Fe 3+
Τα πιο πρακτικά σημαντικά είναι: Fe 2 (SO 4) 3, FeCl 3, Fe(NO 3) 3, Fe(SCN) 3, K 3 4 - κίτρινο άλας αίματος = Fe 4 3 Πρωσικό μπλε (σκούρο μπλε ίζημα)
β) Fe 3+ + 3SCN - = Fe(SCN) 3 θειοκυανικός Fe(III) (ερυθρό διάλυμα αίματος)
Λεπτομέρειες Κατηγορία: Προβολές: 9555 ΣΙΔΕΡΟ, Fe, χημικό στοιχείο, ατομικό βάρος 55,84, αύξων αριθμός 26; που βρίσκεται στην ομάδα VIII Περιοδικός Πίνακαςστο ίδιο επίπεδο με το κοβάλτιο και το νικέλιο, σημείο τήξεως - 1529°C, σημείο βρασμού - 2450°C. σε στερεά κατάσταση έχει γαλαζωπό-ασημί χρώμα. Στην ελεύθερη του μορφή, ο σίδηρος βρίσκεται μόνο σε μετεωρίτες, οι οποίοι όμως περιέχουν ακαθαρσίες Ni, P, C και άλλα στοιχεία. Στη φύση, οι ενώσεις του σιδήρου είναι ευρέως διαδεδομένες παντού (έδαφος, μέταλλα, ζωική αιμοσφαιρίνη, φυτική χλωροφύλλη), κεφ. αρ. με τη μορφή οξειδίων, ένυδρων οξειδίων και ενώσεων θείου, καθώς και ανθρακικού σιδήρου, από τον οποίο αποτελούνται τα περισσότερα μεταλλεύματα σιδήρου.
ΣΙΔΕΡΟ, Fe, χημικό στοιχείο, ατομικό βάρος 55,84, αύξων αριθμός 26; που βρίσκεται στην ομάδα VIII Περιοδικός Πίνακαςστο ίδιο επίπεδο με το κοβάλτιο και το νικέλιο, σημείο τήξεως - 1529°C, σημείο βρασμού - 2450°C. σε στερεά κατάσταση έχει γαλαζωπό-ασημί χρώμα. Στην ελεύθερη του μορφή, ο σίδηρος βρίσκεται μόνο σε μετεωρίτες, οι οποίοι όμως περιέχουν ακαθαρσίες Ni, P, C και άλλα στοιχεία. Στη φύση, οι ενώσεις του σιδήρου είναι ευρέως διαδεδομένες παντού (έδαφος, μέταλλα, ζωική αιμοσφαιρίνη, φυτική χλωροφύλλη), κεφ. αρ. με τη μορφή οξειδίων, ένυδρων οξειδίων και ενώσεων θείου, καθώς και ανθρακικού σιδήρου, από τον οποίο αποτελούνται τα περισσότερα μεταλλεύματα σιδήρου.
Ο χημικά καθαρός σίδηρος λαμβάνεται με θέρμανση οξαλικού σιδήρου, ο οποίος στους 440°C παράγει πρώτα ματ σκόνη οξειδίου του σιδήρου, που έχει την ικανότητα να αναφλέγεται στον αέρα (το λεγόμενο πυροφορικό σίδηρο). Με την επακόλουθη αναγωγή αυτού του οξειδίου, η σκόνη που προκύπτει γίνεται γκρι χρώμα και χάνει τις πυροφορικές της ιδιότητες, μετατρέποντας σε μεταλλικό σίδηρο. Όταν το οξείδιο του σιδήρου ανάγεται στους 700°C, ο σίδηρος απελευθερώνεται με τη μορφή μικρών κρυστάλλων, οι οποίοι στη συνέχεια συντήκονται σε κενό. Ένας άλλος τρόπος λήψης χημικά καθαρού σιδήρου είναι με ηλεκτρόλυση ενός διαλύματος αλάτων σιδήρου, για παράδειγμα FeSO 4 ή FeCl 3 σε μείγμα με MgSO 4, CaCl 2 ή NH 4 Cl (σε θερμοκρασίες πάνω από 100 ° C). Ωστόσο, στην περίπτωση αυτή ο σίδηρος αποφράσσει σημαντική ποσότητα ηλεκτρολυτικού υδρογόνου, με αποτέλεσμα να αποκτά σκληρότητα. Όταν θερμαίνεται στους 700°C, απελευθερώνεται υδρογόνο και το σίδερο γίνεται μαλακό και μπορεί να κοπεί με ένα μαχαίρι, όπως ο μόλυβδος (η σκληρότητα στην κλίμακα Mohs είναι 4,5). Πολύ καθαρός σίδηρος μπορεί να ληφθεί αλουμινοθερμικά από καθαρό οξείδιο του σιδήρου. (βλ. Αλουμινοθερμία). Οι καλοσχηματισμένοι κρύσταλλοι σιδήρου είναι σπάνιοι. Μερικές φορές σχηματίζονται κρύσταλλοι σε σχήμα οκτάεδρου στις κοιλότητες μεγάλων τεμαχίων χυτοσιδήρου. Χαρακτηριστική ιδιότητα του σιδήρου είναι η απαλότητα, η ολκιμότητα και η ελαττότητά του σε θερμοκρασία σημαντικά χαμηλότερη από το σημείο τήξης του. Όταν εκτίθεται σε ισχυρό σίδηρο νιτρικό οξύ(δεν περιέχει κατώτερα οξείδια του αζώτου), ο σίδηρος καλύπτεται με μια επικάλυψη οξειδίων και γίνεται αδιάλυτος στο νιτρικό οξύ.
Ενώσεις σιδήρου
Συνδυάζοντας εύκολα με το οξυγόνο, ο σίδηρος σχηματίζει πολλά οξείδια: FeO - οξείδιο του σιδήρου, Fe 2 O 3 - οξείδιο σιδήρου, FeO 3 - ανυδρίτης τρισθενούς οξέος και FeO 4 - ανυδρίτης υπεραδενικού οξέος. Επιπλέον, ο σίδηρος σχηματίζει επίσης ένα μικτό οξείδιο Fe 3 O 4 - οξείδιο του σιδήρου, το λεγόμενο. οξείδιο του σιδήρου. Σε ξηρό αέρα, ωστόσο, ο σίδηρος δεν οξειδώνεται. Η σκουριά είναι υδατικά οξείδια σιδήρου που σχηματίζονται με τη συμμετοχή της υγρασίας του αέρα και του CO 2 . Το οξείδιο του σιδήρου FeO αντιστοιχεί στον ένυδρο Fe(OH) 2 και έναν αριθμό δισθενών αλάτων σιδήρου που μπορούν, κατά την οξείδωση, να μετατραπούν σε άλατα οξειδίου του σιδήρου, Fe 2 O 3, στο οποίο ο σίδηρος εκδηλώνεται ως τρισθενές στοιχείο. στον αέρα, ένυδρο οξείδιο του σιδήρου, που χαρακτηρίζεται από ισχυρό αποκαταστατικές ιδιότητες, οξειδώνεται εύκολα, μετατρέπεται σε ένυδρο οξείδιο του σιδήρου. Το υδροξείδιο του σιδήρου είναι ελαφρώς διαλυτό στο νερό και αυτό το διάλυμα έχει μια καθαρά αλκαλική αντίδραση, υποδεικνύοντας τη βασική φύση του δισθενούς σιδήρου. Το οξείδιο του σιδήρου βρίσκεται στη φύση (βλέπε Κόκκινο μόλυβδο), αλλά μπορεί να βρεθεί τεχνητά. που λαμβάνεται με τη μορφή κόκκινης σκόνης με φρύξη σκόνης σιδήρου και καύση θειούχων πυριτών για την παραγωγή διοξειδίου του θείου. Άνυδρο οξείδιο του σιδήρου, Fe 2 O 3, m.b. λαμβάνεται σε δύο τροποποιήσεις και η μετάβαση της μίας από αυτές στην άλλη συμβαίνει όταν θερμαίνεται και συνοδεύεται από σημαντική απελευθέρωση θερμότητας (αυτοθέρμανση). Όταν πυρώνεται έντονα, το Fe 2 O 3 απελευθερώνει οξυγόνο και μετατρέπεται σε μαγνητικό οξείδιο - Fe 3 O 4. Όταν τα αλκάλια δρουν σε διαλύματα αλάτων σιδήρου σιδήρου, κατακρημνίζεται ένα ίζημα ένυδρου Fe 4 O 9 H 6 (2Fe 2 O 3 · 3H 2 O). όταν το βράζουμε με νερό, σχηματίζεται το ένυδρο Fe 2 O 3 ·H 2 O, το οποίο είναι δύσκολο να διαλυθεί σε οξέα. Ο σίδηρος σχηματίζει ενώσεις με διάφορα μεταλλοειδή: με C, P, S, με αλογόνα, καθώς και με μέταλλα, για παράδειγμα με Mn, Cr, W, Cu κ.λπ.
Τα άλατα σιδήρου χωρίζονται σε άλατα σιδήρου - δισθενή σίδηρο (σιδηρο-άλατα) και οξείδιο - σίδηρο σίδηρο (άλατα σιδήρου).
Άλατα σιδήρου . Χλωριούχος σίδηρος, FeCl 2, λαμβάνεται με τη δράση ξηρού χλωρίου σε σίδηρο, με τη μορφή άχρωμων φύλλων. Όταν ο σίδηρος διαλύεται σε HCl, ο χλωριούχος σίδηρος λαμβάνεται με τη μορφή ένυδρου FeCl 2 · 4H 2 O και χρησιμοποιείται με τη μορφή υδατικών ή αλκοολικών διαλυμάτων στην ιατρική. Το ιωδιούχο σίδηρο, FeJ 2, λαμβάνεται από σίδηρο και ιώδιο κάτω από το νερό με τη μορφή πράσινων φύλλων και χρησιμοποιείται στην ιατρική (Sirupus ferri jodati). με περαιτέρω δράση του ιωδίου, σχηματίζεται FeJ 3 (Liquor ferri sesquijodati).
Θειικός σίδηρος, θειικός σίδηρος, FeSO 4 ·7H 2 O (πράσινοι κρύσταλλοι) σχηματίζεται στη φύση ως αποτέλεσμα της οξείδωσης του πυρίτη και του θειούχου πυρίτη. Αυτό το αλάτι σχηματίζεται επίσης ως υποπροϊόν κατά την παραγωγή στυπτηρίας. όταν ξεπεραστεί ή θερμανθεί στους 300°C, μετατρέπεται σε λευκό άνυδρο αλάτι - FeSO 4. σχηματίζει επίσης ένυδρα με 5, 4, 3, 2 και 1 σωματίδια νερού. διαλύεται εύκολα σε κρύο νερό (σε ζεστό νερό έως 300%). το διάλυμα είναι όξινο λόγω υδρόλυσης. οξειδώνεται στον αέρα, ιδιαίτερα εύκολα παρουσία άλλης οξειδωτικής ουσίας, για παράδειγμα, οξαλικών αλάτων, τα οποία το FeSO 4 εμπλέκει σε μια συζευγμένη αντίδραση οξείδωσης, αποχρωματίζει το KMnO 4. Σε αυτή την περίπτωση, η διαδικασία προχωρά σύμφωνα με την ακόλουθη εξίσωση:
2KMnO 4 + 10FeSO 4 + 8H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5Fe 2 (SO 4) 2 + 8H 2 O.
Για το σκοπό αυτό, ωστόσο, χρησιμοποιείται το διπλό άλας του Mohr (NH 4) 2 Fe(SO 4) 2 6H 2 O, το οποίο είναι πιο σταθερό στον αέρα, ο θειικός σίδηρος χρησιμοποιείται στην ανάλυση αερίων για τον προσδιορισμό του οξειδίου του αζώτου που απορροφάται από ένα διάλυμα FeSO 4 με το σχηματισμό σκουρόχρωμου-καφέ χρώματος του συμπλέγματος (FeNO)SO 4, καθώς και για την παραγωγή μελανιού (με ταννικά οξέα), ως μέσο για τη βαφή, για τη δέσμευση των βλαβερών αερίων (H 2 S, NH 3) σε αποχωρητήρια κ.λπ.
Τα άλατα οξειδίου του σιδήρου χρησιμοποιούνται στη φωτογραφία λόγω της ικανότητάς τους να αποκαθιστούν ενώσεις αργύρου στη λανθάνουσα εικόνα που λαμβάνεται σε μια φωτογραφική πλάκα.
Ανθρακικός σίδηρος, FeCO 3 , εμφανίζεται φυσικά ως σιδερίτης ή σίδηρος. Ο ανθρακικός σίδηρος, που λαμβάνεται με καθίζηση υδατικών διαλυμάτων σιδήρου αλάτων σιδήρου με ανθρακικά, χάνει εύκολα CO 2 και οξειδώνεται στον αέρα σε Fe 2 O 3.
Διττανθρακικός σίδηρος, H 2 Fe(CO 3) 2, είναι διαλυτό στο νερό και εμφανίζεται φυσικά σε σιδηρούχα πηγές, από τις οποίες, όταν οξειδώνεται, απελευθερώνεται στην επιφάνεια της γης με τη μορφή ένυδρου οξειδίου του σιδήρου, Fe(OH) 3, που μετατρέπεται σε καφέ σιδηρομετάλλευμα.
Φωσφορικός σίδηρος, Fe 3 (PO 4) 2 8H 2 O, λευκό ίζημα. βρίσκεται στη φύση ελαφρώς χρωματισμένο, λόγω της οξείδωσης του σιδήρου, σε μπλε χρώμα, σε μορφή βιβιανίτη.
Άλατα οξειδίου του σιδήρου . Το χλωριούχο σίδηρο, FeCl 3 (Fe 2 Cl 6), λαμβάνεται από τη δράση περίσσειας χλωρίου στο σίδηρο με τη μορφή εξαγωνικών κόκκινων δισκίων. Το χλωριούχο σίδηρο διαλύεται στον αέρα. κρυσταλλώνεται από το νερό με τη μορφή FeCl 3 6H 2 O (κίτρινοι κρύσταλλοι). Τα διαλύματα είναι όξινα. κατά την αιμοκάθαρση σταδιακά υδρολύεται σχεδόν μέχρι το τέλος με το σχηματισμό κολλοειδές διάλυμαΈνυδρο Fe(OH)3. Το FeCl 3 διαλύεται σε αλκοόλη και σε μείγμα αλκοόλης και αιθέρα όταν θερμαίνεται, το FeCl 3 ·6H 2 O αποσυντίθεται σε HCl και Fe 2 O 3. χρησιμοποιείται ως μυρωδάτο και ως αιμοστατικό παράγοντα (Liquor ferri sesquichlorati).
Οξείδιο θειικού σιδήρου, Fe 2 (SO 4) 3, στην άνυδρη κατάσταση έχει κιτρινωπό χρώμα, υδρολύεται έντονα σε διάλυμα. Όταν το διάλυμα θερμαίνεται, τα βασικά άλατα καθιζάνουν. στυπτηρία σιδήρου, MFe(SO 4) 2 12H 2 O, M - μονοσθενές αλκαλιμέταλλο; Η στυπτηρία αμμωνίου, NH 4 Fe(SO 4) 2 12H 2 O, κρυσταλλώνεται καλύτερα.
Το οξείδιο FeO 3 είναι ανυδρίτης τρισθενούς οξέος, καθώς και το ένυδρο άλας αυτού του οξειδίου H 2 FeO 4 - οξύ σιδήρου- σε ελεύθερη κατάσταση, δεν είναι δυνατό. που λαμβάνονται λόγω της εξαιρετικής ευθραυστότητάς τους. αλλά σε αλκαλικά διαλύματα μπορεί να υπάρχουν άλατα οξέος σιδήρου, φερρικά (για παράδειγμα, K2 FeO 4), που σχηματίζονται όταν η σκόνη σιδήρου θερμαίνεται με νιτρικό άλας ή KClO 3. Το κακώς διαλυτό άλας βαρίου του οξέος σιδήρου BaFeO 4 είναι επίσης γνωστό. Έτσι, το οξύ σιδήρου είναι από ορισμένες απόψεις πολύ παρόμοιο με το θειικό και το χρωμικό οξύ. Το 1926, ο χημικός του Κιέβου Goralevich περιέγραψε ενώσεις οκτασθενούς οξειδίου σιδήρου - υποφερτικός ανυδρίτης FeO 4, που λαμβάνεται με σύντηξη Fe 2 O 3 με νιτρικό άλας ή άλας Berthollet με τη μορφή άλατος καλίου του υπεραδενικού οξέος K 2 FeO 5. FeO 4 - αέρια ουσία, το οποίο δεν σχηματίζει υπεραδενικό οξύ H 2 FeO 5 με νερό, το οποίο όμως μπορεί. απομονώθηκε σε ελεύθερη κατάσταση με αποσύνθεση του άλατος K 2 FeO 5 με οξέα. Αλάτι βαρίου BaFeO 5 · 7H 2 O, καθώς και άλατα ασβεστίου και στροντίου, ελήφθησαν από τον Goralevich με τη μορφή μη αποσυντιθέμενων λευκών κρυστάλλων που απελευθερώνουν νερό μόνο στους 250-300°C και ταυτόχρονα γίνονται πράσινοι.
Ο σίδηρος δίνει ενώσεις: με άζωτο - σίδηρος νιτρώδες(νιτρίδιο) Fe 2 N όταν η σκόνη σιδήρου θερμαίνεται σε ρεύμα NH 3, με άνθρακα - καρβίδιο Fe 3 C όταν ο σίδηρος είναι κορεσμένος με άνθρακα σε ηλεκτρικό κλίβανο. Επιπλέον, έχει μελετηθεί ένας αριθμός ενώσεων σιδήρου με μονοξείδιο του άνθρακα - καρβονύλια σιδήρου, για παράδειγμα, το πεντακαρβονύλιο Fe(CO) 5 είναι ένα ελαφρώς χρωματισμένο υγρό με περίπου 102,9 ° C (στα 749 mm, ειδικό βάρος 1,4937), μετά πορτοκαλί στερεός Fe 2 (CO) 9, αδιάλυτο σε αιθέρα και χλωροφόρμιο, με ειδικό βάρος 2,085.
Έχουν μεγάλη σημασία ενώσεις κυανιούχου σιδήρου. Εκτός από τα απλά κυανιούχα Fe(CN) 2 και Fe(CN) 3, ο σίδηρος σχηματίζει έναν αριθμό πολύπλοκων ενώσεων με κυανιούχα άλατα, όπως άλατα δισθενούς θείου οξέος H 4 Fe(CN) 6 και άλατα σιδήρου θείου οξέος H 3 Fe(CN) 6, για παράδειγμα, κόκκινο άλας αίματος, το οποίο, με τη σειρά του, εισέρχεται σε αντιδράσεις αποσύνθεσης ανταλλαγής με άλατα σιδήρου και οξειδίου σιδήρου, σχηματίζοντας έγχρωμο Μπλε χρώμαενώσεις - Πρωσικό μπλε και μπλε Turnbull. Κατά την αντικατάσταση μιας ομάδας CN στα άλατα του σιδήρου θειούχου οξέος H 4 Fe(CN) 6 με μονοσθενείς ομάδες (NO, NO 2, NH 3, SO 3, CO), σχηματίζονται άλατα Prusso, για παράδειγμα, νιτροπρωσσικό νάτριο (νιτροσιδηρούχο νάτριο σουλφίδιο) Na 2 2H 2 O, που λαμβάνεται με τη δράση του ατμίσματος HNO 3 σε K 4 Fe(CN) 6, ακολουθούμενη από εξουδετέρωση με σόδα, με τη μορφή ρουμπινί κρυστάλλων, που διαχωρίζονται με κρυστάλλωση από το νιτρικό που σχηματίζεται ταυτόχρονα. το αντίστοιχο νιτροφερικό οξύ Η2 κρυσταλλώνεται επίσης με τη μορφή σκούρων κόκκινων κρυστάλλων. Το νιτροπρωσσικό νάτριο χρησιμοποιείται ως ευαίσθητο αντιδραστήριο για το υδρόθειο και τα μέταλλα του θείου, με τα οποία δίνει ένα κόκκινο-κόκκινο χρώμα που στη συνέχεια γίνεται μπλε. Όταν ο θειικός χαλκός αντιδρά με το νιτροπρωσσικό νάτριο, σχηματίζεται ένα ωχροπράσινο ίζημα, αδιάλυτο στο νερό και την αλκοόλη, το οποίο χρησιμοποιείται για τον έλεγχο των αιθέριων ελαίων.
Αναλυτικά, ο σίδηρος ανιχνεύεται από τη δράση του άλατος του, σε αλκαλικό διάλυμα, κίτρινο άλας αίματος. Τα άλατα σιδήρου σχηματίζουν ένα μπλε ίζημα του μπλε της Πρωσίας. Τα άλατα σιδήρου σχηματίζουν ένα μπλε ίζημα του μπλε του Turnbull όταν εκτίθενται σε κόκκινο αλάτι αίματος. Με το θειοκυανικό αμμώνιο NH 4 CNS, τα άλατα σιδήρου σιδήρου σχηματίζουν ροδανικό σίδηρο Fe(CNS) 3, διαλυτό σε νερό με χρώμα κόκκινο του αίματος. Με την τανίνη, τα άλατα οξειδίου του σιδήρου σχηματίζουν μελάνι. Για το έντονο χρώμα τους διακρίνονται και τα άλατα χαλκού του θειούχου σιδήρου που βρίσκουν εφαρμογή (μέθοδος Uvachrome) στην έγχρωμη φωτογραφία. Από τις ενώσεις σιδήρου που χρησιμοποιούνται στην ιατρική, εκτός από τις αναφερόμενες ενώσεις αλογονιδίου σιδήρου, σημαντικές είναι οι εξής: μεταλλικός σίδηρος (F. hydrogenio reductum), κιτρικός σίδηρος (F. Citricum - 20% Fe), εκχύλισμα μηλικού σιδήρου (Extractum ferri pomatum ), αλβουμινικό σίδηρο ( Liquor ferri albuminatum), φερατίνη - μια πρωτεϊνική ένωση με 6% σίδηρο. φερρατόζη - διάλυμα φερρατίνης, καρνιφερρίνης - ένωση σιδήρου με νουκλεΐνη (30% Fe). φερατογόνο από νουκλεΐνη ζυμομύκητα (1% Fe), αιματογόνο - διάλυμα αιμοσφαιρίνης 70% σε γλυκερίνη, αιμοσφαιρίνη - αιμοσφαιρίνη μειωμένη με σκόνη ψευδαργύρου.
Φυσικές ιδιότητες του σιδήρου
Τα αριθμητικά δεδομένα που είναι διαθέσιμα στη βιβλιογραφία που χαρακτηρίζουν τις διάφορες φυσικές ιδιότητες του σιδήρου κυμαίνονται λόγω της δυσκολίας απόκτησης σιδήρου σε χημικά καθαρή κατάσταση. Ως εκ τούτου, τα πιο αξιόπιστα δεδομένα είναι αυτά που λαμβάνονται για τον ηλεκτρολυτικό σίδηρο, στον οποίο η συνολική περιεκτικότητα σε προσμίξεις (C, Si, Mn, S, P) δεν υπερβαίνει το 0,01-0,03%. Τα παρακάτω δεδομένα αναφέρονται στις περισσότερες περιπτώσεις σε τέτοιο υλικό. Για αυτό, το σημείο τήξης είναι 1528°C ± 3°C (Ruer and Klesper, 1914) και το σημείο βρασμού είναι ≈ 2450°C. Στη στερεά κατάσταση, ο σίδηρος υπάρχει σε τέσσερις διαφορετικές τροποποιήσεις - α, β, γ και δ, για τις οποίες έχουν καθοριστεί με ακρίβεια τα ακόλουθα όρια θερμοκρασίας:

Η μετάβαση του σιδήρου από τη μια τροποποίηση στην άλλη ανιχνεύεται στις καμπύλες ψύξης και θέρμανσης από κρίσιμα σημεία, για τα οποία υιοθετούνται οι ακόλουθες ονομασίες:

 Αυτά τα κρίσιμα σημεία φαίνονται στο Σχ. 1 σχηματικές καμπύλες θέρμανσης και ψύξης. Η ύπαρξη τροποποιήσεων δ-, γ- και α-Fe θεωρείται επί του παρόντος αδιαμφισβήτητη, αλλά η ανεξάρτητη ύπαρξη του β-Fe αμφισβητείται λόγω της ανεπαρκώς έντονης διαφοράς μεταξύ των ιδιοτήτων του και των ιδιοτήτων του α-Fe. Όλες οι τροποποιήσεις του σιδήρου κρυσταλλώνονται με τη μορφή κύβου, με τα α, β και δ να έχουν χωρικό πλέγμα κεντραρισμένου κύβου και το γ-Fe να έχει κύβο με κεντρικές επιφάνειες. Τα πιο ευδιάκριτα κρυσταλλογραφικά χαρακτηριστικά των τροποποιήσεων σιδήρου λαμβάνονται στα φάσματα ακτίνων Χ, όπως φαίνεται στο Σχ. 2 (Westgreen, 1929).
Αυτά τα κρίσιμα σημεία φαίνονται στο Σχ. 1 σχηματικές καμπύλες θέρμανσης και ψύξης. Η ύπαρξη τροποποιήσεων δ-, γ- και α-Fe θεωρείται επί του παρόντος αδιαμφισβήτητη, αλλά η ανεξάρτητη ύπαρξη του β-Fe αμφισβητείται λόγω της ανεπαρκώς έντονης διαφοράς μεταξύ των ιδιοτήτων του και των ιδιοτήτων του α-Fe. Όλες οι τροποποιήσεις του σιδήρου κρυσταλλώνονται με τη μορφή κύβου, με τα α, β και δ να έχουν χωρικό πλέγμα κεντραρισμένου κύβου και το γ-Fe να έχει κύβο με κεντρικές επιφάνειες. Τα πιο ευδιάκριτα κρυσταλλογραφικά χαρακτηριστικά των τροποποιήσεων σιδήρου λαμβάνονται στα φάσματα ακτίνων Χ, όπως φαίνεται στο Σχ. 2 (Westgreen, 1929).  Από τα δεδομένα μοτίβα ακτίνων Χ προκύπτει ότι για τα α-, β- και δ-Fe οι γραμμές του φάσματος των ακτίνων Χ είναι ίδιες. αντιστοιχούν σε ένα πλέγμα ενός κεντρικού κύβου με παραμέτρους 2,87, 2,90 και 2,93 A, και για το γ-Fe το φάσμα αντιστοιχεί σε ένα πλέγμα ενός κύβου με κεντρικές επιφάνειες και παραμέτρους 3,63-3,68 A.
Από τα δεδομένα μοτίβα ακτίνων Χ προκύπτει ότι για τα α-, β- και δ-Fe οι γραμμές του φάσματος των ακτίνων Χ είναι ίδιες. αντιστοιχούν σε ένα πλέγμα ενός κεντρικού κύβου με παραμέτρους 2,87, 2,90 και 2,93 A, και για το γ-Fe το φάσμα αντιστοιχεί σε ένα πλέγμα ενός κύβου με κεντρικές επιφάνειες και παραμέτρους 3,63-3,68 A.
Το ειδικό βάρος του σιδήρου κυμαίνεται από 7.855 έως 7.864 (Cross and Gill, 1927). Όταν θερμαίνεται, το ειδικό βάρος του σιδήρου μειώνεται λόγω της θερμικής διαστολής, για την οποία οι συντελεστές αυξάνονται με τη θερμοκρασία, όπως δείχνουν τα δεδομένα του Πίνακα 1. 1 (Driesen, 1914).

Η μείωση των συντελεστών διαστολής στις περιοχές 20-800°C, 20-900°C, 700-800°C και 800-900°C εξηγείται από ανωμαλίες στη διαστολή κατά τη διέλευση από τα κρίσιμα σημεία A C2 και A C3. Αυτή η μετάβαση συνοδεύεται από συμπίεση, ιδιαίτερα έντονη στο σημείο A C3, όπως φαίνεται από τις καμπύλες συμπίεσης και διαστολής στο Σχ. 3. Η τήξη του σιδήρου συνοδεύεται από διαστολή του κατά 4,4% (Gonda and Enda, 1926). Η θερμοχωρητικότητα του σιδήρου είναι αρκετά σημαντική σε σύγκριση με άλλα μέταλλα και εκφράζεται για διαφορετικά εύρη θερμοκρασίας σε τιμές από 0,11 έως 0,20 Cal, όπως φαίνεται στον Πίνακα. 2 (Obergoffer and Grosse, 1927) και η καμπύλη που κατασκευάστηκε στη βάση τους (Εικ. 4).

 Στα δεδομένα που δίνονται, οι μετασχηματισμοί A 2 , A 3 , A 4 και η τήξη του σιδήρου ανιχνεύονται τόσο καθαρά που υπολογίζονται εύκολα τα θερμικά φαινόμενα: A 3 ... + 6,765 Cal, A 4 ... + 2,531 Cal , τήξη σιδήρου ... - 64,38 Cal (κατά S. Umino, 1926, - 69,20 Cal).
Στα δεδομένα που δίνονται, οι μετασχηματισμοί A 2 , A 3 , A 4 και η τήξη του σιδήρου ανιχνεύονται τόσο καθαρά που υπολογίζονται εύκολα τα θερμικά φαινόμενα: A 3 ... + 6,765 Cal, A 4 ... + 2,531 Cal , τήξη σιδήρου ... - 64,38 Cal (κατά S. Umino, 1926, - 69,20 Cal).
Ο σίδηρος χαρακτηρίζεται από περίπου 6-7 φορές μικρότερη θερμική αγωγιμότητα από το ασήμι και 2 φορές μικρότερη από το αλουμίνιο. Δηλαδή, η θερμική αγωγιμότητα του σιδήρου είναι ίση στους 0°C - 0,2070, στους 100°C - 0,1567, στους 200°C - 0,1357 και στους 275°C - 0,1120 Cal/cm·sec·°C. Πλέον χαρακτηριστικές ιδιότητεςΟ σίδηρος είναι μαγνητικός και εκφράζεται από έναν αριθμό μαγνητικών σταθερών που λαμβάνονται κατά τη διάρκεια του πλήρους κύκλου μαγνήτισης του σιδήρου. Αυτές οι σταθερές για τον ηλεκτρολυτικό σίδηρο εκφράζονται με τις ακόλουθες τιμές στο Gauss (Gumlich, 1909 και 1918):

Όταν διέρχεται από το σημείο A c2, οι σιδηρομαγνητικές ιδιότητες του σιδήρου σχεδόν εξαφανίζονται και μπορεί. ανακαλύφθηκε μόνο με πολύ ακριβείς μαγνητικές μετρήσεις. Στην πράξη, οι β-, γ- και δ-τροποποιήσεις θεωρούνται μη μαγνητικές. Η ηλεκτρική αγωγιμότητα του σιδήρου στους 20°C είναι ίση με R -1 m m/mm 2 (όπου R είναι η ηλεκτρική αντίσταση του σιδήρου, ίση με 0,099 Ω mm 2 /m). Ο συντελεστής θερμοκρασίας της ηλεκτρικής αντίστασης a0-100° x10 5 κυμαίνεται από 560 έως 660, όπου
![]()
 Η ψυχρή επεξεργασία (έλαση, σφυρηλάτηση, διάνοιξη, σφράγιση) έχει πολύ αισθητή επίδραση φυσικές ιδιότητεςαχ σίδερο. Έτσι, η % μεταβολή τους κατά την ψυχρή έλαση εκφράζεται με τα ακόλουθα σχήματα (Gerens, 1911): τάση καταναγκασμού +323%, μαγνητική υστέρηση +222%, ηλεκτρική αντίσταση + 2%, ειδικό βάρος - 1%, μαγνητική διαπερατότητα - 65%. Η τελευταία περίσταση καθιστά σαφείς τις σημαντικές διακυμάνσεις στις φυσικές ιδιότητες που παρατηρούνται μεταξύ διαφορετικών ερευνητών: η επίδραση των ακαθαρσιών συχνά συνοδεύεται από την επίδραση της ψυχρής μηχανικής επεξεργασίας.
Η ψυχρή επεξεργασία (έλαση, σφυρηλάτηση, διάνοιξη, σφράγιση) έχει πολύ αισθητή επίδραση φυσικές ιδιότητεςαχ σίδερο. Έτσι, η % μεταβολή τους κατά την ψυχρή έλαση εκφράζεται με τα ακόλουθα σχήματα (Gerens, 1911): τάση καταναγκασμού +323%, μαγνητική υστέρηση +222%, ηλεκτρική αντίσταση + 2%, ειδικό βάρος - 1%, μαγνητική διαπερατότητα - 65%. Η τελευταία περίσταση καθιστά σαφείς τις σημαντικές διακυμάνσεις στις φυσικές ιδιότητες που παρατηρούνται μεταξύ διαφορετικών ερευνητών: η επίδραση των ακαθαρσιών συχνά συνοδεύεται από την επίδραση της ψυχρής μηχανικής επεξεργασίας.
ΣΧΕΤΙΚΑ ΜΕ μηχανικές ιδιότητεςΠολύ λίγος καθαρός σίδηρος είναι γνωστός. Ο ηλεκτρολυτικός σίδηρος, κράμα σε κενό, έδειξε: αντοχή εφελκυσμού 25 kg/mm 2, επιμήκυνση - 60%, συμπίεση διατομής - 85%, σκληρότητα Brinell - από 60 έως 70.
Η δομή του σιδήρου εξαρτάται από την περιεκτικότητα σε ακαθαρσίες σε αυτόν (ακόμη και σε μικρές ποσότητες) και την προεπεξεργασία του υλικού. Η μικροδομή του σιδήρου, όπως και άλλα καθαρά μέταλλα, αποτελείται από περισσότερο ή λιγότερο μεγάλους κόκκους (κρυσταλλίτες), που εδώ ονομάζονται φερρίτης


Το μέγεθος και η ευκρίνεια των περιγραμμάτων τους εξαρτώνται από το κεφ. αρ. σχετικά με το ρυθμό ψύξης του σιδήρου: όσο χαμηλότερος είναι ο τελευταίος, τόσο πιο ανεπτυγμένοι είναι οι κόκκοι και τόσο πιο έντονο το περίγραμμά τους. Επιφανειακά, οι κόκκοι έχουν τις περισσότερες φορές διαφορετικό χρώμα λόγω της διαφορετικής κρυσταλλογραφίας, του προσανατολισμού τους και των διαφορετικών επιδράσεων χάραξης των αντιδραστηρίων σε διαφορετικές κατευθύνσεις στον κρύσταλλο. Συχνά οι κόκκοι επιμηκύνονται προς μία κατεύθυνση ως αποτέλεσμα μηχανικής επεξεργασίας. Εάν η επεξεργασία έγινε σε χαμηλές θερμοκρασίες, τότε εμφανίζονται γραμμές διάτμησης (γραμμές Neumann) στην επιφάνεια των κόκκων ως αποτέλεσμα της ολίσθησης. μεμονωμένα μέρηκρυσταλλίτες κατά μήκος των επιπέδων διάσπασής τους. Αυτές οι γραμμές είναι ένα από τα σημάδια της σκλήρυνσης και εκείνων των αλλαγών στις ιδιότητες που αναφέρθηκαν παραπάνω.
Ο σίδηρος στη μεταλλουργία
Ο όρος σίδηρος στη σύγχρονη μεταλλουργία αποδίδεται μόνο στον σφυρήλατο σίδηρο, δηλαδή ένα προϊόν χαμηλής περιεκτικότητας σε άνθρακα που λαμβάνεται σε κατάσταση ζύμης σε θερμοκρασία που δεν αρκεί για την τήξη του σιδήρου, αλλά τόσο υψηλή ώστε τα μεμονωμένα σωματίδια του να είναι καλά συγκολλημένα μεταξύ τους. , δίνοντας ένα ομοιογενές μαλακό προϊόν μετά τη σφυρηλάτηση, δεν δέχεται σκλήρυνση. Ο σίδηρος (με την υποδεικνυόμενη έννοια της λέξης) λαμβάνεται: 1) απευθείας από μετάλλευμα σε κατάσταση ζύμης με τη διαδικασία εμφύσησης τυριού. 2) με τον ίδιο τρόπο, αλλά σε χαμηλότερη θερμοκρασία, ανεπαρκής για τη συγκόλληση σωματιδίων σιδήρου. 3) ανακατανομή του χυτοσιδήρου με μια κρίσιμη διαδικασία. 4) ανακατανομή του χυτοσιδήρου με λακκούβες.
1) Διαδικασία παραγωγής τυριού επί του παρόντος. Ο χρόνος χρησιμοποιείται μόνο από ακαλλιέργητους λαούς και σε περιοχές από όπου λαμβάνεται αμερικανικός ή ευρωπαϊκός σίδηρος με σύγχρονους τρόπους. Η διαδικασία πραγματοποιείται σε ανοιχτούς φούρνους τυριών και φούρνους. Πρώτες ύλεςεξυπηρετούν για αυτόν σιδηρομετάλλευμα(συνήθως καφέ σιδηρομετάλλευμα) και κάρβουνο. Το κάρβουνο χύνεται στο σφυρηλάτηση στο μισό του όπου τροφοδοτείται η έκρηξη, ενώ το μετάλλευμα χύνεται σε ένα σωρό στην αντίθετη πλευρά. Το μονοξείδιο του άνθρακα που σχηματίζεται σε ένα παχύ στρώμα καιόμενου άνθρακα διέρχεται από όλο το πάχος του μεταλλεύματος και, σε υψηλή θερμοκρασία, μειώνει το σίδηρο. Η μείωση του μεταλλεύματος γίνεται σταδιακά - από την επιφάνεια των μεμονωμένων τεμαχίων στον πυρήνα. Ξεκινώντας με άνω μέρησωρό, επιταχύνεται καθώς το μετάλλευμα μετακινείται σε μια περιοχή μεγαλύτερη υψηλή θερμοκρασία; Σε αυτή την περίπτωση, το οξείδιο του σιδήρου μετατρέπεται πρώτα σε μαγνητικό οξείδιο, μετά σε οξείδιο και, τέλος, εμφανίζεται μεταλλικός σίδηρος στην επιφάνεια των τεμαχίων μεταλλεύματος. Ταυτόχρονα, οι γήινες ακαθαρσίες του μεταλλεύματος (άχρηστα πετρώματα) συνδυάζονται με το μη ανηγμένο ακόμη οξείδιο του σιδήρου και σχηματίζουν μια εύτηκτη σκωρία σιδήρου, η οποία λιώνει μέσα από τις ρωγμές του μεταλλικού κελύφους, το οποίο σχηματίζει ένα είδος κελύφους σε κάθε κομμάτι. του μεταλλεύματος. Αυτά τα κοχύλια θερμαίνονται σε άσπρη-καυτή θερμότητα, συγκολλούνται μεταξύ τους, σχηματίζοντας μια σπογγώδη μάζα σιδήρου στο κάτω μέρος του φούρνου - κρίτσα, διαποτισμένη από σκωρία. Για να διαχωριστεί από το τελευταίο, η κρίτσα που βγαίνει από το σφυρήλατο κόβεται σε πολλά μέρη, καθένα από τα οποία σφυρηλατείται, βράζεται, αφού κρυώσει στο ίδιο σφυρήλατο σε λωρίδες ή απευθείας σε προϊόντα (οικιακά είδη, όπλα). Στην Ινδία, η διαδικασία εμφύσησης τυριού εξακολουθεί να πραγματοποιείται σε φούρνους τυριού, οι οποίοι διαφέρουν από τους σφυρηλατητές μόνο στο ελαφρώς υψηλότερο ύψος τους - περίπου 1,5 m. Οι τοίχοι των κλιβάνων είναι κατασκευασμένοι από πηλό (όχι τούβλο) και εξυπηρετούν μόνο ένα λιώσει. Η έκρηξη τροφοδοτείται στον κλίβανο μέσω ενός σωλήνα από φυσούνες που οδηγούνται από τα πόδια ή τα χέρια. Μια ορισμένη ποσότητα ξυλάνθρακα («αδρανές κέλυφος») φορτώνεται σε έναν άδειο κλίβανο και, στη συνέχεια, εναλλάξ, σε ξεχωριστά στρώματα, μετάλλευμα και άνθρακα, με την ποσότητα του πρώτου να αυξάνεται σταδιακά μέχρι να φτάσει σε μια αναλογία προς τον άνθρακα που καθορίζεται από την εμπειρία. το βάρος όλου του γεμισμένου μεταλλεύματος καθορίζεται από το επιθυμητό βάρος της κρίτσας, το οποίο, γενικά, είναι ασήμαντο. Η διαδικασία αποκατάστασης είναι η ίδια όπως στο σφυρηλάτηση. Ο σίδηρος επίσης δεν μειώνεται εντελώς, και η κρίτσα που προκύπτει στο πλευρό περιέχει πολλή σιδηρούχα σκωρία. Η κρίτσα αφαιρείται σπάζοντας τη σόμπα και κόβεται σε κομμάτια βάρους 2-3 κιλών. Κάθε ένα από αυτά θερμαίνεται σε σφυρηλάτηση και επεξεργάζεται κάτω από ένα σφυρί. Το αποτέλεσμα είναι ο εξαιρετικός μαλακός σίδηρος, ο οποίος, μεταξύ άλλων, χρησιμεύει ως υλικό για την κατασκευή ινδικών χαλύβδινων «woots» (χάλυβας Damask). Η σύνθεσή του έχει ως εξής (σε%):
Η ασήμαντη περιεκτικότητα σε στοιχεία - ακαθαρσίες σιδήρου - ή η πλήρης απουσία τους εξηγείται από την καθαρότητα του μεταλλεύματος, την ατελή αναγωγή του σιδήρου και τη χαμηλή θερμοκρασία στον κλίβανο. Λόγω του μικρού μεγέθους των σφυρήλατων και των κλιβάνων και της συχνότητας λειτουργίας τους, η κατανάλωση κάρβουνου είναι πολύ υψηλή. Στη Φινλανδία, τη Σουηδία και τα Ουράλια, ο σίδηρος τήχθηκε στον κλίβανο τυριού Husgavel, στον οποίο ήταν δυνατό να ρυθμιστεί η διαδικασία αναγωγής και κορεσμού του σιδήρου με άνθρακα. η κατανάλωση άνθρακα σε αυτό ήταν έως και 1,1 ανά μονάδα σιδήρου, η απόδοση του οποίου άγγιζε το 90% της περιεκτικότητάς του στο μετάλλευμα.
2) Στο μέλλον, θα πρέπει να περιμένουμε την ανάπτυξη της παραγωγής σιδήρου απευθείας από μετάλλευμα, όχι με τη χρήση της διαδικασίας εμφύσησης τυριού, αλλά με τη μείωση του σιδήρου σε θερμοκρασία ανεπαρκή για το σχηματισμό σκωρίας και ακόμη και για τη σύντηξη των απορριμμάτων μεταλλεύματος (1000 ° C). Τα πλεονεκτήματα αυτής της διαδικασίας είναι η δυνατότητα χρήσης καυσίμων χαμηλής ποιότητας, εξαλείφοντας τη ροή και την κατανάλωση θερμότητας για την τήξη της σκωρίας.
3) Η παραγωγή σφυρήλατος σιδήρου με την ανακατανομή του χυτοσιδήρου με τη διαδικασία του κλιβάνου πραγματοποιείται στους φούρνους του Χρ. αρ. στη Σουηδία (στη χώρα μας - στα Ουράλια). Για την επεξεργασία λιώνεται ειδικός χυτοσίδηρος, το λεγόμενο. Lancashire, δίνοντας τα λιγότερα απόβλητα. Περιέχει: 0,3-0,45% Si, 0,5-0,6% Mn, 0,02 P,<0,01% S. Такой чугун в изломе кажется белым или половинчатым. Горючим в кричных горнах может служить только древесный уголь.
Η διαδικασία είναι σε εξέλιξη. αρρ.: ο σφυρηλάτης, απαλλαγμένος από το χωνευτήριο, αλλά με την ώριμη σκωρία του τέλους της διαδικασίας να παραμένει στην κάτω σανίδα, γεμίζει με κάρβουνο, κεφ. αρ. πεύκο, πάνω στο οποίο τοποθετείται χυτοσίδηρος που θερμαίνεται με προϊόντα καύσης σε ποσότητα 165-175 kg (για 3/8 m 2 της διατομής της εστίας υπάρχουν 100 kg χυτοσίδηρου). Περιστρέφοντας τη βαλβίδα στον αγωγό αέρα, η έκρηξη κατευθύνεται μέσω σωλήνων που βρίσκονται στον χώρο κάτω από το τόξο του κλιβάνου και θερμαίνεται εδώ σε θερμοκρασία 150-200 ° C, επιταχύνοντας έτσι. λιώσιμο χυτοσιδήρου. Ο χυτοσίδηρος τήξης στηρίζεται συνεχώς (με τη βοήθεια λοστών) στο κάρβουνο πάνω από τις τούγιες. Κατά τη διάρκεια μιας τέτοιας εργασίας, ολόκληρη η μάζα του χυτοσιδήρου υπόκειται στην οξειδωτική δράση του οξυγόνου του αέρα και του διοξειδίου του άνθρακα, περνώντας από τη ζώνη καύσης με τη μορφή σταγόνων. Η μεγάλη τους επιφάνεια συμβάλλει στην ταχεία οξείδωση του σιδήρου και των ακαθαρσιών του - πυριτίου, μαγγανίου και άνθρακα. Ανάλογα με την περιεκτικότητα σε αυτές τις ακαθαρσίες, ο χυτοσίδηρος τις χάνει σε μεγαλύτερο ή μικρότερο βαθμό πριν μαζευτεί στο κάτω μέρος της εστίας. Δεδομένου ότι ο χυτοσίδηρος χαμηλής περιεκτικότητας σε πυρίτιο και χαμηλή περιεκτικότητα σε μαγγάνιο επεξεργάζεται σε σουηδικό σφυρηλάτηση, όταν διέρχεται από τον ορίζοντα tuyere, χάνει όλο του το Si και το Mn (τα οξείδια των οποίων αποτελούν την κύρια σκωρία με οξείδιο του σιδήρου) και ένα σημαντικό μέρος του άνθρακας. Η τήξη του χυτοσιδήρου διαρκεί 20-25 λεπτά. Στο τέλος αυτής της διαδικασίας, η ψυχρή έκρηξη απελευθερώνεται στο σφυρηλάτηση. Το μέταλλο που έχει κατακαθίσει στον πυθμένα της εστίας αρχίζει να αντιδρά με τις ώριμες σκωρίες που βρίσκονται εκεί, οι οποίες περιέχουν μεγάλη περίσσεια (σε σύγκριση με την ποσότητα του πυριτίου) οξειδίων του σιδήρου - Fe 3 O 4 και FeO, τα οποία οξειδώνουν τον άνθρακα με απελευθέρωση μονοξειδίου του άνθρακα, που προκαλεί βρασμό ολόκληρου του μετάλλου. Όταν το μέταλλο παχύνει (από απώλεια άνθρακα) και «κάθεται σαν εμπόρευμα», το τελευταίο ανυψώνεται με λοστούς πάνω από τους σωλήνες, απελευθερώνεται ξανά θερμή έκρηξη και το «εμπόρευμα» λιώνει.
Κατά τη δευτερογενή τήξη, το μέταλλο οξειδώνεται με οξυγόνο τόσο από την έκρηξη όσο και από τη σκωρία που τήκεται από αυτό. Μετά την πρώτη άνοδο, το μέταλλο πέφτει στον πάτο του σφυρηλάτησης, αρκετά μαλακό για να μαζέψει την κρίτσα από μερικά από τα πιο ώριμα μέρη του. Αλλά πριν, όταν χρησιμοποιούσαμε ποιότητες πυριτίου από χυτοσίδηρο, ήταν απαραίτητο να καταφύγουμε σε μια δεύτερη και ακόμη και τρίτη ανύψωση των εμπορευμάτων, η οποία, φυσικά, μείωσε την παραγωγικότητα του σφυρηλάτησης, αύξησε την κατανάλωση καυσίμου και τα απόβλητα σιδήρου. Τα αποτελέσματα της εργασίας επηρεάστηκαν από την απόσταση των tuyeres από την κάτω σανίδα (το βάθος της εστίας) και την κλίση των tuyere: όσο πιο απότομο είναι το tuyere και όσο πιο ρηχό είναι το βάθος της εστίας, τόσο μεγαλύτερη είναι η επίδραση του οξειδωτική ατμόσφαιρα στο μέταλλο. Μια πιο ήπια κλίση των σωλήνων, καθώς και ένα μεγαλύτερο βάθος της εστίας, μειώνει την άμεση επίδραση του οξυγόνου στην έκρηξη, δίνοντας έτσι μεγαλύτερο ρόλο στη δράση της σκωρίας στις ακαθαρσίες σιδήρου. η οξείδωση από αυτά είναι πιο αργή, αλλά χωρίς απόβλητα σιδήρου. Υπό οποιεσδήποτε δεδομένες συνθήκες, η πιο πλεονεκτική θέση των tuyeres σε σχέση με την κάτω σανίδα καθορίζεται από την εμπειρία. σε ένα σύγχρονο σουηδικό σφυρηλάτηση, το μάτι tuyere εγκαθίσταται σε απόσταση 220 mm από την κάτω σανίδα και η κλίση των tuyere ποικίλλει εντός στενών ορίων - από 11 έως 12 °.
Η κρίτσα που προκύπτει στο κάτω μέρος του κλιβάνου, σε αντίθεση με τον κλίβανο φουσκώματος τυριού, περιέχει πολύ λίγη μηχανικά παρασυρόμενη σκωρία. Όσον αφορά τις χημικές ακαθαρσίες του σιδήρου, τότε μπορεί να είναι Si, Mn και C. αφαιρείται πλήρως (η αμελητέα περιεκτικότητα σε Si και Mn που υποδεικνύεται από την ανάλυση είναι μέρος της μηχανικής ακαθαρσίας - σκωρίας), και το θείο απομακρύνεται μόνο εν μέρει, οξειδώνεται από την έκρηξη κατά την τήξη. Ταυτόχρονα, ο φώσφορος οξειδώνεται επίσης, πηγαίνοντας στη σκωρία με τη μορφή άλατος φωσφόρου-σιδήρου, αλλά ο τελευταίος στη συνέχεια ανάγεται με άνθρακα και το τελικό μέταλλο μπορεί να περιέχει ακόμη και σχετικά περισσότερο φώσφορο (από απόβλητα σιδήρου) από το αρχικό χυτοσίδηρος. Αυτός είναι ο λόγος για τον οποίο, για να αποκτήσει μέταλλο πρώτης κατηγορίας για εξαγωγή, η Σουηδία χρησιμοποιεί μόνο χυτοσίδηρο που είναι καθαρός από την άποψη του P. Η έτοιμη κρίτσα που βγάζουμε από το σφυρήλατο κόβεται σε τρία μέρη (50-55 κιλά το καθένα) και συμπιέζεται κάτω από ένα σφυρί δίνοντας την όψη παραλληλεπίπεδου.
Η διάρκεια της διαδικασίας αναδιανομής στο σουηδικό σφυρηλάτηση είναι από 65 έως 80 λεπτά. ανά ημέρα αποδεικνύεται από 2,5 έως 3,5 τόνους συμπιεσμένων τεμαχίων "για φωτιά", με κατανάλωση ξυλάνθρακα μόνο 0,32-0,40 ανά μονάδα τελικού υλικού και η απόδοσή του είναι από 89 έως 93,5% του χυτοσιδήρου που προδιαγράφεται για επεξεργασία. Πιο πρόσφατα, στη Σουηδία, πραγματοποιήθηκαν επιτυχημένα πειράματα στην ανακατανομή υγρού χυτοσιδήρου που λαμβάνεται από υψικάμινους και στην επιτάχυνση της διαδικασίας βρασμού με ανάδευση του μετάλλου χρησιμοποιώντας μηχανικές τσουγκράνες. Ταυτόχρονα, η απώλεια αποβλήτων μειώθηκε στο 7%, και η κατανάλωση άνθρακα - στο 0,25.
Τα ακόλουθα δεδομένα (σε%) δίνουν μια ιδέα για τη χημική σύνθεση του σιδήρου της Σουηδίας και του Νοτίου Ουραλίου:
Από όλους τους τύπους σιδήρου που παράγονται βιομηχανικά, ο σουηδικός σίδηρος είναι πιο κοντά στον χημικά καθαρό και, αντί του τελευταίου, χρησιμοποιείται στην εργαστηριακή πρακτική και στις ερευνητικές εργασίες. Διαφέρει από τον ακατέργαστο σίδηρο ως προς την ομοιομορφία του και από το πιο μαλακό μέταλλο ανοιχτής εστίας (χυτοσίδηρος) απουσία μαγγανίου. Χαρακτηρίζεται από τον υψηλότερο βαθμό συγκολλητικότητας, ολκιμότητας και ελατότητας. Ο σουηδικός χυτοσίδηρος παρουσιάζει χαμηλή αντοχή σε εφελκυσμό - μόνο περίπου 30 kg/mm 2, με επιμήκυνση 40% και μείωση της διατομής κατά 75%. Επί του παρόντος, η ετήσια παραγωγή κρυογονικού σιδήρου στη Σουηδία έχει πέσει στους 50.000 τόνους, μετά τον πόλεμο του 1914-18. Το εύρος των βιομηχανικών εφαρμογών αυτού του σιδήρου μειώθηκε σημαντικά. Η μεγαλύτερη ποσότητα χρησιμοποιείται για την παραγωγή (στην Αγγλία και τη Γερμανία) των υψηλότερων ποιοτήτων εργαλείων και ειδικών χάλυβων. Στην ίδια τη Σουηδία, χρησιμοποιείται για την κατασκευή ειδικού σύρματος («σύρμα λουλουδιών»), καρφιά πετάλου, τα οποία σφυρηλατούνται εύκολα σε ψυχρή κατάσταση, αλυσίδες και κενά λωρίδων για συγκολλημένους σωλήνες. Για τους δύο τελευταίους σκοπούς, οι ιδιότητες του χυτοσιδήρου είναι ιδιαίτερα σημαντικές: αξιόπιστη συγκολλησιμότητα και για σωλήνες, επιπλέον, η υψηλότερη αντοχή στη σκουριά.
4) Η ανάπτυξη της παραγωγής σιδήρου ως κρίσιμης διαδικασίας συνεπαγόταν την καταστροφή των δασών. αφού οι τελευταίες σε διάφορες χώρες τέθηκαν υπό την προστασία ενός νόμου που περιόριζε την υλοτόμησή τους στην ετήσια ανάπτυξη, η Σουηδία και στη συνέχεια η Ρωσία -δασώδεις χώρες με αφθονία μεταλλευμάτων υψηλής ποιότητας- έγιναν οι κύριοι προμηθευτές σιδήρου στη διεθνή αγορά καθ' όλη τη διάρκεια του 18ου αιώνα. . Το 1784, ο Άγγλος Cort εφηύρε το puddling - τη διαδικασία της αναδιανομής του χυτοσιδήρου στην εστία ενός πύρινου φούρνου, στην εστία του οποίου καίγονταν άνθρακας. Μετά το θάνατο του Cort, οι Rogers και Gall εισήγαγαν σημαντικές βελτιώσεις στο σχεδιασμό του φούρνου λακκούβων, οι οποίες συνέβαλαν στην ταχεία εξάπλωση της λακκούβας σε όλες τις βιομηχανικές χώρες και άλλαξαν εντελώς τη φύση και την έκταση της παραγωγής σιδήρου κατά το πρώτο μισό του 19ου αιώνα. Αυτή η διαδικασία παρήγαγε τη μάζα του μετάλλου που χρειαζόταν για την κατασκευή σιδερένιων πλοίων, σιδηροδρόμων, ατμομηχανών, ατμολεβήτων και αυτοκινήτων.
Το καύσιμο για λακκούβες είναι ο άνθρακας με μεγάλη φλόγα, αλλά όπου δεν είναι διαθέσιμος, έπρεπε να καταφύγουμε στον καφέ άνθρακα και εδώ στα Ουράλια - σε καυσόξυλα. Τα καυσόξυλα πεύκου παράγουν μεγαλύτερη φλόγα από τον άνθρακα. θερμαίνεται καλά, αλλά η περιεκτικότητα σε υγρασία στο ξύλο δεν πρέπει να υπερβαίνει το 12%. Στη συνέχεια, ένας αναγεννητικός φούρνος Siemens χρησιμοποιήθηκε για λακκούβες στα Ουράλια. Τέλος, στις ΗΠΑ και εδώ (στις λεκάνες του Βόλγα και του Κάμα) οι φούρνοι λακκούβων λειτουργούσαν με λάδι που ψεκάζεται απευθείας στον χώρο εργασίας του κλιβάνου.
Για να επιταχύνετε την επεξεργασία και να μειώσετε την κατανάλωση καυσίμου, συνιστάται να έχετε κρύο χυτοσίδηρο. Κατά την τήξη του όμως σε οπτάνθρακα, το προϊόν παράγει πολύ θείο (0,2 έως και 0,3%) και με υψηλή περιεκτικότητα σε φώσφορο στο μετάλλευμα, φώσφορο επίσης. Για τις συνήθεις εμπορικές ποιότητες σιδήρου, τέτοιος χυτοσίδηρος με χαμηλή περιεκτικότητα σε πυρίτιο (λιγότερο από 1%), που ονομάζεται χυτοσίδηρος, τήκονταν προηγουμένως σε μεγάλες ποσότητες. Ο χυτοσίδηρος από άνθρακα, ο οποίος επεξεργαζόταν στα Ουράλια και την κεντρική Ρωσία, δεν περιείχε θείο και παρήγαγε ένα προϊόν που χρησιμοποιήθηκε επίσης για την κατασκευή σιδήρου στέγης. Επί του παρόντος, το puddling χρησιμεύει για την παραγωγή μετάλλων υψηλής ποιότητας σύμφωνα με ειδικές προδιαγραφές, και επομένως δεν παρέχεται συνηθισμένος χυτοσίδηρος σε φούρνους λακκούβων, αλλά υψηλής ποιότητας χυτοσίδηρος, για παράδειγμα, μαγγάνιο ή «αιματίτης» (χαμηλός φώσφορος) ή, αντίθετα , υψηλή περιεκτικότητα σε φώσφορο για την παραγωγή σιδήρου ξηρών καρπών. Ακολουθεί η περιεκτικότητα (σε %) των κύριων στοιχείων σε ορισμένους τύπους χυτοσιδήρου που χρησιμοποιούνται για λακκούβες:

Ένας φούρνος λακκούβας, στο τέλος της προηγούμενης λειτουργίας, έχει συνήθως μια κανονική ποσότητα σκωρίας στην εστία για να λειτουργήσει με την επόμενη φόρτιση. Κατά την επεξεργασία χυτοσιδήρου με υψηλή περιεκτικότητα σε πυριτικό, μένει πολλή σκωρία στον κλίβανο και πρέπει να αποστραγγιστεί. Αντίθετα, ο λευκός χυτοσίδηρος αφήνει «στεγνούς» κάτω από τον κλίβανο και η εργασία πρέπει να ξεκινήσει ρίχνοντας την απαιτούμενη ποσότητα σκωρίας στο κάτω μέρος, η οποία λαμβάνεται από κάτω από το σφυρί («ώριμο», το πιο πλούσιο σε μαγνητικό οξείδιο). Ένα φορτίο χυτοσιδήρου, που θερμαίνεται σε ένα δοχείο από χυτοσίδηρο, ρίχνεται στη σκωρία (250-300 kg σε συνηθισμένους φούρνους και 500-600 kg σε διπλούς φούρνους). Στη συνέχεια, μια νέα ποσότητα καυσίμου ρίχνεται στην εστία, οι σχάρες καθαρίζονται και δημιουργείται πλήρες ρεύμα στον κλίβανο. Μέσα σε 25-35 λεπτά. χυτοσίδηρος λιώνει, υφίσταται β. ή μ. σημαντική αλλαγή στη σύνθεσή του. Ο στερεός χυτοσίδηρος οξειδώνεται από το οξυγόνο της φλόγας και ο σίδηρος, το μαγγάνιο και το πυρίτιο παράγουν διπλό πυριτικό άλας, το οποίο ρέει προς τα κάτω στον κλίβανο. Η τήξη του χυτοσιδήρου εκθέτει όλο και περισσότερα στρώματα στερεού χυτοσιδήρου, ο οποίος επίσης οξειδώνεται και λιώνει. Στο τέλος της περιόδου τήξης, λαμβάνονται δύο υγρά στρώματα στην εστία - χυτοσίδηρος και σκωρία, στην επιφάνεια επαφής των οποίων συμβαίνει η διαδικασία οξείδωσης του άνθρακα από μαγνητικό οξείδιο του σιδήρου, αν και σε ασθενή βαθμό, όπως αποδεικνύεται από φυσαλίδες μονοξειδίου του άνθρακα που απελευθερώνεται από το λουτρό. Ανάλογα με την περιεκτικότητα σε πυρίτιο και μαγγάνιο στον χυτοσίδηρο, άνιση ποσότητα από αυτά παραμένει στο λιωμένο μέταλλο: σε χυτοσίδηρο με χαμηλή περιεκτικότητα σε πυρίτιο άνθρακα ή λευκό χυτοσίδηρο - τήξη οπτάνθρακα - το πυρίτιο στις περισσότερες περιπτώσεις καίγεται εντελώς κατά την τήξη. μερικές φορές μια ορισμένη ποσότητα του παραμένει στο μέταλλο (0,3-0,25%), καθώς και στο μαγγάνιο. Ο φώσφορος οξειδώνεται επίσης αυτή τη στιγμή, μετατρέποντας σε άλας φωσφόρου σιδήρου. Λόγω της μείωσης του βάρους του μετάλλου καθώς καίγονται οι προαναφερθείσες ακαθαρσίες, η ποσοστιαία περιεκτικότητα σε άνθρακα μπορεί ακόμη και να αυξηθεί, αν και μέρος του αναμφίβολα καίγεται από το οξυγόνο της φλόγας και τη σκωρία που καλύπτει τα πρώτα μέρη του τηγμένου μέταλλο.
Για να επιταχύνουν την εξάντληση των υπόλοιπων ποσοτήτων πυριτίου, μαγγανίου και άνθρακα, καταφεύγουν σε λακκούβες, δηλαδή στην ανάμειξη χυτοσιδήρου με σκωρία χρησιμοποιώντας ένα ραβδί με το άκρο λυγισμένο σε ορθή γωνία. Εάν το μέταλλο είναι υγρό (γκρίζος χυτοσίδηρος, πολύ ανθρακούχο), τότε η ανάδευση δεν επιτυγχάνει τον στόχο και το λουτρό γίνεται πρώτα παχύρρευστο ρίχνοντας μέσα κρύα ώριμη σκωρία ή μειώνοντας το βύθισμα, δημιουργείται ατελής καύση στον κλίβανο , συνοδευόμενη από φλόγα με πολύ καπνό (σιγοβράζει). Μετά από λίγα λεπτά, κατά τη διάρκεια της οποίας διεξάγεται συνεχής ανάδευση, εμφανίζονται άφθονες φυσαλίδες καμένου μονοξειδίου του άνθρακα στην επιφάνεια του λουτρού - προϊόν της οξείδωσης του άνθρακα από χυτοσίδηρο από το οξυγόνο του μαγνητικού οξειδίου που διαλύεται στην κύρια σκωρία σιδήρου. Καθώς η διαδικασία εξελίσσεται, η οξείδωση του C εντείνεται και μετατρέπεται σε βίαιο «βρασμό» ολόκληρης της μάζας του μετάλλου, το οποίο συνοδεύεται από διόγκωση και τόσο σημαντική αύξηση όγκου που μέρος της σκωρίας ξεχειλίζει το κατώφλι των οπών εργασίας. Καθώς το C καίγεται, το σημείο τήξης του μετάλλου αυξάνεται και για να συνεχιστεί ο βρασμός, η θερμοκρασία στον κλίβανο αυξάνεται συνεχώς. Ο βρασμός που ολοκληρώνεται σε χαμηλή θερμοκρασία παράγει ένα ακατέργαστο προϊόν, δηλαδή μια σπογγώδη μάζα σιδήρου με υψηλή περιεκτικότητα σε άνθρακα, που δεν μπορεί να συγκολληθεί. ώριμα προϊόντα «κάθονται» σε ζεστό φούρνο. Η διαδικασία οξείδωσης των ακαθαρσιών σιδήρου σε έναν κλίβανο λακκούβας ξεκινά λόγω του οξυγόνου της σκωρίας, η οποία είναι ένα κράμα πυριτίου σιδήρου (Fe 2 SiO 4) με μαγνητικό οξείδιο και οξείδιο σιδήρου μεταβλητής σύστασης. Σε αγγλικούς φούρνους, η σύνθεση του μίγματος οξειδίων εκφράζεται με τον τύπο 5Fe 3 O 4 5 FeO. στο τέλος του βρασμού, η αναλογία των οξειδίων στην εξαντλημένη σκωρία εκφράζεται με τον τύπο Fe 3 O 4 5FeO, δηλαδή, το 80% του συνολικού μαγνητικού οξειδίου της σκωρίας συμμετέχει στη διαδικασία οξείδωσης. Οι αντιδράσεις οξείδωσης μπορεί να. αντιπροσωπεύεται από τις ακόλουθες θερμοχημικές εξισώσεις:

Όπως φαίνεται από αυτές τις εξισώσεις, η οξείδωση των Si, P και Mn συνοδεύεται από απελευθέρωση θερμότητας και ως εκ τούτου θερμαίνει το λουτρό, ενώ η οξείδωση του C κατά την αναγωγή του Fe 3 O 4 σε FeO απορροφά θερμότητα και επομένως απαιτεί υψηλή θερμοκρασία. Αυτό εξηγεί τη διαδικασία απομάκρυνσης των ακαθαρσιών σιδήρου και το γεγονός ότι η καύση άνθρακα τελειώνει πιο γρήγορα σε έναν καυτό κλίβανο. Η αναγωγή του Fe 3 O 4 σε μέταλλο δεν συμβαίνει, καθώς αυτό απαιτεί υψηλότερη θερμοκρασία από αυτή στην οποία συμβαίνει το «βρασμός».
Το συρρικνωμένο «προϊόν», για να γίνει καλά συγκολλημένο σίδερο, χρειάζεται ακόμα ατμό: το προϊόν αφήνεται για αρκετά λεπτά στο φούρνο και από καιρό σε καιρό αναποδογυρίζεται με λοστούς και τα κάτω μέρη του τοποθετούνται από πάνω. Υπό τη συνδυασμένη δράση του οξυγόνου της φλόγας και των σκωριών που διαπερνούν ολόκληρη τη μάζα του σιδήρου, ο άνθρακας συνεχίζει να καίγεται αυτή τη στιγμή. Μόλις ληφθεί μια ορισμένη ποσότητα καλά συγκολλημένου μετάλλου, αρχίζουν να ξετυλίγονται κρίσεις από αυτό, αποφεύγοντας την περιττή οξείδωση. Συνολικά, καθώς τα εμπορεύματα ωριμάζουν, κυλούν από 5 έως 10 κριτς (όχι περισσότερα από 50 κιλά το καθένα). Οι κόκκοι διατηρούνται (αχνίζονται) στο κατώφλι στην περιοχή της υψηλότερης θερμοκρασίας και τροφοδοτούνται κάτω από το σφυρί για συμπίεση, η οποία επιτυγχάνει την απελευθέρωση της σκωρίας και τους δίνει το σχήμα ενός κομματιού (τμήμα από 10x10 έως 15x15 cm ), βολικό για κύλιση σε ρολά. Όσοι τους ακολουθούν προχωρούν στον τόπο των εκδοθέντων κριτς, μέχρι το τελευταίο. Η διάρκεια της διαδικασίας για την παραγωγή μετάλλου υψηλής ποιότητας (ινώδης σίδηρος) από ώριμο (υψηλής περιεκτικότητας σε άνθρακα) χυτοσίδηρο άνθρακα στα Ουράλια ήταν η εξής: 1) φύτευση χυτοσιδήρου - 5 λεπτά, 2) τήξη - 35 λεπτά, 3) σιγοβράζοντας - 25 λεπτά, 4) λακκούβες (ανάμιξη) - 20 λεπτά, 5) μαγείρεμα στον ατμό - 20 λεπτά, 6) ψήσιμο και βράσιμο στον ατμό - 40 λεπτά, 7) τσιπς διανομής (10-11 τεμ.) - 20 λεπτά; σύνολο - 165 λεπτά. Όταν εργάζεστε σε λευκό χυτοσίδηρο, χρησιμοποιώντας συνηθισμένο σίδερο του εμπορίου, η διάρκεια της διαδικασίας μειώθηκε (στη Δυτική Ευρώπη) στα 100 και ακόμη και στα 75 λεπτά.
Όσον αφορά τα αποτελέσματα της εργασίας, διέφεραν σε διαφορετικές μεταλλουργικές περιοχές ανάλογα με τον τύπο του καυσίμου, την ποιότητα του χυτοσιδήρου και τον τύπο του παραγόμενου σιδήρου. Οι φούρνοι Ural που λειτουργούσαν σε ξύλο έδωσαν την απόδοση χρησιμοποιήσιμου σιδήρου ανά 1 m 3 ξύλου από 0,25 έως 0,3 τόνους. Η κατανάλωση λαδιού μας ανά μονάδα σιδήρου είναι 0,33, ο άνθρακας στους ευρωπαϊκούς φούρνους είναι από 0,75 έως 1,1. Η ημερήσια παραγωγικότητα των μεγάλων κλιβάνων μας (600 κιλά χυτοσίδηρου) όταν εργαζόμασταν σε αποξηραμένα καυσόξυλα ήταν 4-5 τόνοι. η απόδοση υλικού κατάλληλου για την παραγωγή σιδήρου στέγης ήταν 95-93% της ποσότητας χυτοσιδήρου που ελήφθη για επεξεργασία. Στην Ευρώπη, η ημερήσια παραγωγικότητα των συνηθισμένων κλιβάνων (φόρτιση 250-300 kg) είναι περίπου 3,5 τόνοι με απόβλητα 9%, και για σίδηρο υψηλής ποιότητας - 2,5 τόνοι με απόβλητα 11%.
Όσον αφορά τη χημική σύνθεση και τις φυσικές ιδιότητες, ο σίδηρος λακκούβας είναι πολύ χειρότερο προϊόν από τον χυτοσίδηρο, αφενός, και τον χυτοσίδηρο, αφετέρου. Οι συνηθισμένοι τύποι σιδήρου που παρήχθησαν προηγουμένως στη Δυτική Ευρώπη περιείχαν πολύ θείο και φώσφορο, καθώς παράγονταν από ακάθαρτο σίδηρο οπτάνθρακα, και οι δύο αυτές επιβλαβείς ακαθαρσίες μετατρέπονται μόνο εν μέρει σε σκωρία. η ποσότητα της σκωρίας στο σίδερο είναι 3-6% σε μέταλλο υψηλής ποιότητας δεν υπερβαίνει το 2%. Η παρουσία σκωρίας μειώνει σημαντικά τα αποτελέσματα των μηχανικών δοκιμών του σιδήρου λακκούβας. Ακολουθούν ορισμένα δεδομένα σε % που χαρακτηρίζουν το σίδερο λακκούβων - συνηθισμένο δυτικοευρωπαϊκό και καλό Ural:

Η πολύτιμη ιδιότητα για την οποία υποστηρίζεται πλέον η παραγωγή λακκούβας είναι η εξαιρετική συγκολλητότητά του, η οποία μερικές φορές έχει ιδιαίτερη σημασία από άποψη ασφάλειας. Προδιαγραφές σιδηροδρόμων Οι κοινωνίες απαιτούν την κατασκευή συσκευών ζεύξης, ράβδων για διακόπτες και μπουλονιών από λακκούβες. Λόγω της καλύτερης αντοχής του στις διαβρωτικές επιδράσεις του νερού, ο σίδηρος λακκούβας χρησιμοποιείται επίσης για την παραγωγή σωλήνων νερού. Χρησιμοποιείται επίσης για την κατασκευή ξηρών καρπών (ένα χονδρόκοκκο φωσφορώδες μέταλλο) και υψηλής ποιότητας ινώδη σίδηρο για πριτσίνια και αλυσίδες.
Η δομή του σφυρήλατος σιδήρου, ανιχνεύσιμη στο μικροσκόπιο ακόμη και σε χαμηλή μεγέθυνση, χαρακτηρίζεται από την παρουσία μαύρων και ανοιχτόχρωμων συστατικών στη φωτογραφική εικόνα. Τα πρώτα ανήκουν στη σκωρία και τα δεύτερα σε κόκκους ή ίνες σιδήρου που λαμβάνονται με το τράβηγμα του μετάλλου.
Εμπορία σιδήρου
Τα μεταλλουργικά εργοστάσια παράγουν δύο βασικούς τύπους σιδήρου για βιομηχανικές ανάγκες: 1) λαμαρίνα και 2) σίδηρο τομής.
Η λαμαρίνα αυτή τη στιγμή τυλίγεται σε πλάτος έως 3 m. με πάχος 1-3 χιλιοστά το λέμε λεπτό-ρολό? από 3 mm και άνω (συνήθως έως 40 mm) - λέβητας, δεξαμενή, πλοίο, ανάλογα με το σκοπό στον οποίο αντιστοιχούν η σύνθεση και οι μηχανικές ιδιότητες του υλικού. Το σίδερο του λέβητα είναι το πιο μαλακό. Συνήθως περιέχει 0,10-0,12% C, 0,4-0,5% Mn, P και S - το καθένα όχι περισσότερο από 0,05%. η προσωρινή αντοχή του σε εφελκυσμό δεν ισχύει. περισσότερο από 41 kg/mm 2 (αλλά όχι λιγότερο από 34 kg/mm 2), επιμήκυνση στο σπάσιμο - περίπου 28%. Το σίδερο της δεξαμενής γίνεται πιο σκληρό και πιο ανθεκτικό. περιέχει 0,12-0,15% C. 0,5-0,7% Mn και όχι περισσότερο από 0,06% τόσο του P όσο και του S. αντοχή σε εφελκυσμό 41-49 kg/mm 2, επιμήκυνση 25-28%. Το μήκος των φύλλων του λέβητα και του σιδήρου ρεζερβουάρ ρυθμίζεται κατά παραγγελία σύμφωνα με τις διαστάσεις του προϊόντος που καρφώνεται από τα φύλλα (αποφεύγοντας τις περιττές ραφές και γαρνιτούρες), αλλά συνήθως δεν υπερβαίνει τα 8 m, αφού για τα λεπτά φύλλα είναι περιορισμένο από την ταχεία ψύξη τους κατά τη διαδικασία έλασης και για χοντρά φύλλα - με το βάρος του πλινθώματος.
Η λαμαρίνα με πάχος μικρότερο από 1 mm ονομάζεται μαύρος κασσίτερος. χρησιμοποιείται για την κατασκευή λευκοσιδήρου και ως υλικό στέγης. Για τον τελευταίο σκοπό, στην ΕΣΣΔ κυλούν φύλλα διαστάσεων 1422x711 mm, βάρους 4-5 kg, με πάχος 0,5-0,625 mm. Το σίδερο στέγης παράγεται από τα εργοστάσια σε συσκευασίες βάρους 82 κιλών. Στο εξωτερικό, ο μαύρος κασσίτερος ταξινομείται στο εμπόριο σύμφωνα με ειδικούς αριθμούς διαμετρήματος - από 20 έως 30 (το κανονικό πάχος του γερμανικού κασσίτερου είναι από 0,875 έως 0,22 mm και του αγγλικού κασσίτερου είναι από 1,0 έως 0,31 mm). Ο κασσίτερος είναι κατασκευασμένος από τον πιο μαλακό χυτοσίδηρο που περιέχει 0,08-0,10% C, 0,3-0,35% Mn εάν είναι κατασκευασμένο από ανθρακικό χυτοσίδηρο (το δικό μας) και 0,4-0,5% Mn, εάν η πρώτη ύλη είναι οπτανθρακοσίδηρος. αντοχή σε εφελκυσμό - από 31 έως 34 kg/mm 2, επιμήκυνση - 28-30%. Ένα είδος λαμαρίνας είναι το κυματοειδές σίδερο. Χωρίζεται ανάλογα με τη φύση των κυμάτων σε σίδηρο με χαμηλά και υψηλά κύματα. στην πρώτη, η αναλογία του πλάτους του κύματος προς το βάθος κυμαίνεται από 3 έως 4, στη δεύτερη, 1-2. Το κυματοειδές σίδερο κατασκευάζεται με πάχος 0,75-2,0 mm και πλάτος φύλλου 0,72-0,81 m (με χαμηλά κύματα) και 0,4-0,6 m (με υψηλά κύματα). Το κυματοειδές σίδερο χρησιμοποιείται για στέγες, τοίχους ελαφρών κατασκευών, περσίδες και με υψηλά κύματα, επιπλέον, χρησιμοποιείται για την κατασκευή δαπέδων χωρίς δοκούς.
Ο διαβαθμισμένος σίδηρος χωρίζεται σε δύο κατηγορίες ανάλογα με το σχήμα της διατομής του: τον κοινό διαβαθμισμένο σίδηρο και τον μορφοποιημένο σίδηρο.
Η πρώτη κατηγορία περιλαμβάνει στρογγυλό σίδερο (με διάμετρο μικρότερη από 10 mm που ονομάζεται σύρμα), τετράγωνο, επίπεδο ή λωρίδα. Το τελευταίο, με τη σειρά του, χωρίζεται σε: ίδια λωρίδα - πλάτος από 10 έως 200 mm και πάχος άνω των 5 mm. στεφάνι - το ίδιο πλάτος, αλλά πάχος από 5 έως 1 mm, που υποδεικνύεται από τον αριθμό διαμετρήματος (από 3 έως 19 κανονικά γερμανικά και από 6 έως 20 νέο αγγλικό διαμέτρημα). ελαστικό - από 38 έως 51 mm πλάτος και έως 22 mm πάχος. καθολική - από 200 έως 1000 mm πλάτος και τουλάχιστον 6 mm πάχος (τυλιγμένα σε ειδικά ρολά - καθολική). Τόσο το ελαστικό όσο και ο σίδηρος στεφάνης παράγονται από τα εργοστάσια σε ρολά, έλασης σύρματος - σε ρόλους. άλλες ποικιλίες έχουν τη μορφή ίσιων (ισιωμένων) λωρίδων, συνήθως μήκους όχι περισσότερο από 8 m (κανονικά - από 4,5 έως 6 m), αλλά με ειδική παραγγελία για κατασκευές από σκυρόδεμα, οι λωρίδες κόβονται μήκους έως 18 mm και μερικές φορές περισσότερο .
Οι κύριοι τύποι διαμορφωμένου σιδήρου: γωνιακό (ίσο και άνισο), κουτί (κανάλι), σχήματος Τ, δοκός Ι (δοκοί), στήλη (τετράγωνο) και σίδηρος ζήτα. Υπάρχουν επίσης κάποιοι άλλοι λιγότερο συνηθισμένοι τύποι μορφοποιημένου σιδήρου. Σύμφωνα με την κανονική μας μετρική συλλογή, οι διαστάσεις του διαμορφωμένου σιδήρου υποδεικνύονται από τον αριθμό προφίλ (Ο αριθμός είναι ο αριθμός, δείτε το πλάτος του ραφιού ή το υψηλότερο ύψος προφίλ). Το γωνιακό άνισο και το T-σίδερο έχουν διπλό Αρ. Για παράδειγμα, το Νο 16/8 σημαίνει γωνία με ράφια 16 και 8 cm ή μπλουζάκι με ράφι 16 cm και ύψος μπλουζάκι 8 cm Τα πιο βαριά προφίλ διαμορφωμένου σιδήρου έλασης από εμάς: Νο 15 - γωνία, Αρ 30 - γούρνα, Νο. 40 - δοκός Ι.
Η σύνθεση του συνηθισμένου συγκολλήσιμου σιδήρου: 0,12% C, 0,4% Mn, λιγότερο από 0,05% P και S - το καθένα. η αντοχή του σε εφελκυσμό είναι 34-40 kg/mm 2. αλλά ο στρογγυλός σίδηρος για πριτσίνια είναι κατασκευασμένος από πιο μαλακό υλικό της σύνθεσης: λιγότερο από 0,10% C, 0,25-0,35% Mn, περίπου 0,03% P και S το καθένα. Η αντοχή σε εφελκυσμό είναι 32-35 kg/mm 2 και η επιμήκυνση είναι 28-32%. Ο διαμορφωμένος, μη συγκολλημένος, αλλά καρφωτός σίδηρος ("χάλυβας κατασκευής") περιέχει: 0,15 - 0,20% C, 0,5% Mn, έως 0,06% P και S - το καθένα. Η αντοχή του σε εφελκυσμό είναι 40-50 kg/mm 2, η επιμήκυνση 25-20%. Για την παραγωγή ξηρών καρπών, παρασκευάζεται σίδηρος (σίδηρος Thomas), που περιέχει περίπου 0,1% C, αλλά από 0,3 έως 0,5% P (όσο μεγαλύτεροι είναι οι ξηροί καρποί, τόσο περισσότερο P). Στο εξωτερικό, για την κάλυψη των αναγκών των ειδικών ελασματουργείων, χρησιμοποιείται στο εμπόριο ένα ημιπροϊόν - ένα τετράγωνο billet, συνήθως διατομής 50 x 50 mm.
Γνωστό στους ανθρώπους από την αρχαιότητα: οι επιστήμονες αποδίδουν αρχαία είδη οικιακής χρήσης από αυτό το υλικό στην 4η χιλιετία π.Χ.
Είναι αδύνατο να φανταστεί κανείς την ανθρώπινη ζωή χωρίς σίδηρο. Πιστεύεται ότι ο σίδηρος χρησιμοποιείται για βιομηχανικούς σκοπούς πιο συχνά από άλλα μέταλλα. Οι πιο σημαντικές δομές κατασκευάζονται από αυτό. Ο σίδηρος βρίσκεται επίσης σε μικρές ποσότητες στο αίμα. Είναι το περιεχόμενο του εικοστού έκτου στοιχείου που χρωματίζει το αίμα κόκκινο.
Φυσικές ιδιότητες του σιδήρου
Ο σίδηρος καίγεται σε οξυγόνο, σχηματίζοντας ένα οξείδιο:
3Fe + 2O2 = Fe3O4.
Όταν θερμαίνεται, ο σίδηρος μπορεί να αντιδράσει με αμέταλλα:
Επίσης σε θερμοκρασία 700-900 °C αντιδρά με υδρατμούς:
3Fe + 4H2O = Fe3O4 + 4H2.
Ενώσεις σιδήρου
Όπως είναι γνωστό, τα οξείδια του σιδήρου έχουν ιόντα με δύο καταστάσεις οξείδωσης: +2 και + 3. Η γνώση αυτού είναι εξαιρετικά σημαντική, γιατί θα πραγματοποιηθούν εντελώς διαφορετικές ποιοτικές αντιδράσεις για διαφορετικά στοιχεία.
Ποιοτικές αντιδράσεις στο σίδηρο
Χρειάζεται μια ποιοτική αντίδραση ώστε να μπορεί κανείς να προσδιορίσει εύκολα την παρουσία ιόντων μιας ουσίας σε διαλύματα ή ακαθαρσίες μιας άλλης. Ας εξετάσουμε τις ποιοτικές αντιδράσεις του δισθενούς και του τρισθενούς σιδήρου.
Ποιοτικές αντιδράσεις στο σίδηρο (III)
Η περιεκτικότητα σε ιόντα σιδήρου σε ένα διάλυμα μπορεί να προσδιοριστεί χρησιμοποιώντας αλκάλια. Εάν το αποτέλεσμα είναι θετικό, σχηματίζεται μια βάση - υδροξείδιο σιδήρου (III) Fe(OH)3.
 Υδροξείδιο σιδήρου (III) Fe(OH)3
Υδροξείδιο σιδήρου (III) Fe(OH)3
Η ουσία που προκύπτει είναι αδιάλυτη στο νερό και έχει καφέ χρώμα. Είναι το καφέ ίζημα που μπορεί να υποδεικνύει την παρουσία ιόντων σιδήρου στο διάλυμα:
FeCl3 + 3NaOH = Fe(OH)36+ 3NaCl.
Τα ιόντα Fe(III) μπορούν επίσης να προσδιοριστούν χρησιμοποιώντας K3.
Ένα διάλυμα χλωριούχου σιδήρου αναμιγνύεται με κιτρινωπό διάλυμα άλατος αίματος. Ως αποτέλεσμα, μπορείτε να δείτε ένα όμορφο γαλαζωπό ίζημα, το οποίο θα υποδεικνύει ότι υπάρχουν ιόντα σιδήρου στο διάλυμα. Θα βρείτε θεαματικά πειράματα για να μελετήσετε τις ιδιότητες του σιδήρου.
Ποιοτικές αντιδράσεις στο σίδηρο (II)
Τα ιόντα Fe2+ αντιδρούν με κόκκινο άλας αίματος Κ4. Εάν σχηματιστεί ένα γαλαζωπό ίζημα όταν προστεθεί αλάτι, τότε αυτά τα ιόντα υπάρχουν στο διάλυμα.

Σίδερο(Λατινικό ferrum), fe, χημικό στοιχείο της ομάδας VIII του περιοδικού συστήματος του Mendeleev. ατομικός αριθμός 26, ατομική μάζα 55,847; γυαλιστερό ασημί-λευκό μέταλλο. Το στοιχείο στη φύση αποτελείται από τέσσερα σταθερά ισότοπα: 54 fe (5,84%), 56 fe (91,68%), 57 fe (2,17%) και 58 fe (0,31%).
Ιστορική αναφορά. Ο σίδηρος ήταν γνωστός στην προϊστορική εποχή, αλλά βρήκε ευρεία χρήση πολύ αργότερα, καθώς είναι εξαιρετικά σπάνιος στη φύση σε ελεύθερη κατάσταση και η εξόρυξή του από μεταλλεύματα κατέστη δυνατή μόνο σε ένα ορισμένο επίπεδο τεχνολογικής ανάπτυξης. Ήταν πιθανώς η πρώτη φορά που ο άνθρωπος γνώρισε τον σίδηρο μετεωρίτη, όπως μαρτυρούν τα ονόματά του στις γλώσσες των αρχαίων λαών: το αρχαίο αιγυπτιακό «beni-pet» σημαίνει «ουράνιο σίδερο». Το αρχαίο ελληνικό sideros συνδέεται με το λατινικό sidus (γενική περίπτωση sideris) - αστέρι, ουράνιο σώμα. Σε χεττιτικά κείμενα του 14ου αι. προ ΧΡΙΣΤΟΥ μι. Ως μέταλλο που έπεσε από τον ουρανό αναφέρεται ο J.. Οι ρομανικές γλώσσες διατηρούν τη ρίζα του ονόματος που έδωσαν οι Ρωμαίοι (για παράδειγμα, γαλλικά fer, ιταλικά ferro).
Η μέθοδος λήψης σιδήρου από μεταλλεύματα επινοήθηκε στη δυτική Ασία τη 2η χιλιετία π.Χ. μι.; Μετά από αυτό, η χρήση του σιδήρου εξαπλώθηκε στη Βαβυλώνα, την Αίγυπτο και την Ελλάδα. για αλλαγή Η εποχή του Χαλκούήρθε Εποχή του σιδήρου.Ο Όμηρος (στο 23ο τραγούδι της Ιλιάδας) λέει ότι ο Αχιλλέας απένειμε έναν δίσκο από σίδηρο στον νικητή σε έναν αγώνα δισκοβολίας. Στην Ευρώπη και στην Αρχαία Ρωσία, για πολλούς αιώνες, οι γυναίκες έλαβαν διαδικασία παρασκευής τυριού.Το σιδηρομετάλλευμα μειώθηκε με κάρβουνο σε σφυρηλάτηση χτισμένη σε λάκκο. Με φυσούνες διοχετεύονταν αέρας στο σφυρηλάτηση, το προϊόν αναγωγής - η κρίτσα - διαχωρίστηκε από τη σκωρία με χτυπήματα σφυριού και σφυρηλατήθηκαν από αυτό διάφορα προϊόντα. Καθώς οι μέθοδοι εμφύσησης βελτιώθηκαν και το ύψος της εστίας αυξανόταν, η θερμοκρασία της διαδικασίας αυξήθηκε και μέρος του σιδήρου ενανθράκωσε, δηλ. αποκτήθηκε χυτοσίδηρος; αυτό το σχετικά εύθραυστο προϊόν θεωρήθηκε απόβλητο παραγωγής. Εξ ου και το όνομα του χυτοσιδήρου "χουράνιος", "χυτοσίδηρος" - αγγλικό χυτοσίδηρο. Αργότερα παρατηρήθηκε ότι κατά τη φόρτωση χυτοσιδήρου αντί σιδηρομεταλλεύματος στο σφυρηλάτηση, ελήφθη επίσης μια κρούστα σιδήρου χαμηλής περιεκτικότητας σε άνθρακα και μια τέτοια διαδικασία δύο σταδίων αποδείχθηκε πιο επικερδής από τη διαδικασία εμφύσησης τυριού. Τον 12ο-13ο αι. η μέθοδος της κραυγής ήταν ήδη ευρέως διαδεδομένη. Τον 14ο αιώνα Ο χυτοσίδηρος άρχισε να τήκεται όχι μόνο ως ημιπροϊόν για περαιτέρω επεξεργασία, αλλά και ως υλικό για τη χύτευση διαφόρων προϊόντων. Την ίδια εποχή χρονολογείται και η ανακατασκευή της εστίας σε φρεάτιο φούρνο («δόμνιτσα») και στη συνέχεια σε υψικάμινο. Στα μέσα του 18ου αιώνα. Στην Ευρώπη, η διαδικασία του χωνευτηρίου άρχισε να χρησιμοποιείται για την απόκτηση γίνομαι, που ήταν γνωστό στη Συρία τον πρώιμο Μεσαίωνα, αλλά αργότερα αποδείχτηκε ξεχασμένο. Σε αυτή τη μέθοδο, ο χάλυβας παρήχθη με τήξη μεταλλικών φορτίων σε μικρά δοχεία (χωνευτήρια) από μια εξαιρετικά πυρίμαχη μάζα. Στο τελευταίο τέταρτο του 18ου αιώνα. Η διαδικασία μετατροπής του χυτοσιδήρου σε σίδηρο στον πυθμένα ενός φλογερού κλιβάνου αντήχησης άρχισε να αναπτύσσεται. Η βιομηχανική επανάσταση του 18ου και των αρχών του 19ου αιώνα, η εφεύρεση της ατμομηχανής και η κατασκευή σιδηροδρομικών γραμμών, μεγάλων γεφυρών και στόλου ατμού δημιούργησαν τεράστια ζήτηση για σίδηρο και τα κράματά του. Ωστόσο, όλες οι υπάρχουσες μέθοδοι παραγωγής σιδήρου δεν μπορούσαν να ικανοποιήσουν τις ανάγκες της αγοράς. Η μαζική παραγωγή χάλυβα ξεκίνησε μόλις στα μέσα του 19ου αιώνα, όταν αναπτύχθηκαν οι διαδικασίες Bessemer, Thomas και ανοιχτής εστίας. Τον 20ο αιώνα Η διαδικασία τήξης σε ηλεκτρικό φούρνο προέκυψε και έγινε ευρέως διαδεδομένη, παράγοντας χάλυβας υψηλής ποιότητας.
Επικράτηση στη φύση. Όσον αφορά την περιεκτικότητα στη λιθόσφαιρα (4,65% κατά μάζα), ο σίδηρος κατέχει τη δεύτερη θέση μεταξύ των μετάλλων (το αλουμίνιο κατέχει την πρώτη θέση). Μεταναστεύει δυναμικά στον φλοιό της γης, σχηματίζοντας περίπου 300 ορυκτά (οξείδια, σουλφίδια, πυριτικά, ανθρακικά, τιτανικά, φωσφορικά κ.λπ.). Ο σίδηρος συμμετέχει ενεργά σε μαγματικές, υδροθερμικές και υπεργονιδιακές διεργασίες, οι οποίες σχετίζονται με το σχηματισμό διαφόρων τύπων αποθεμάτων του. Ο σίδηρος είναι μέταλλο στα βάθη της γης, συσσωρεύεται στα πρώτα στάδια της κρυστάλλωσης του μάγματος, σε υπερβασικά (9,85%) και βασικά (8,56%) πετρώματα (στους γρανίτες είναι μόνο 2,7%). Στη βιόσφαιρα, ο σίδηρος συσσωρεύεται σε πολλά θαλάσσια και ηπειρωτικά ιζήματα, σχηματίζοντας ιζηματογενή μεταλλεύματα.
Σημαντικό ρόλο στη γεωχημεία του σιδήρου παίζουν οι οξειδοαναγωγικές αντιδράσεις - η μετάβαση του σιδήρου 2 σθένους σε σίδηρο τρισθενών και αντίστροφα. Στη βιόσφαιρα, παρουσία οργανικών ουσιών, το fe 3+ μειώνεται σε fe 2+ και μεταναστεύει εύκολα, και όταν συναντά ατμοσφαιρικό οξυγόνο, το fe 2+ οξειδώνεται, σχηματίζοντας συσσωρεύσεις υδροξειδίων του τρισθενούς σιδήρου Ο τρισθενής σίδηρος έχει χρώμα κόκκινο, κίτρινο, καφέ. Αυτό καθορίζει το χρώμα πολλών ιζηματογενών πετρωμάτων και το όνομά τους - "ερυθρόχρωμος σχηματισμός" (κόκκινοι και καφέ άργιλοι και άργιλοι, κίτρινες άμμοι κ.λπ.).
ΦΥΣΙΚΕΣ ΚΑΙ ΧΗΜΙΚΕΣ ΙΔΙΟΤΗΤΕΣ. Η σημασία του σιδήρου στη σύγχρονη τεχνολογία καθορίζεται όχι μόνο από την ευρεία κατανομή του στη φύση, αλλά και από έναν συνδυασμό πολύτιμων ιδιοτήτων. Είναι πλαστικό, σφυρηλατείται εύκολα τόσο σε ψυχρή όσο και σε θερμαινόμενη κατάσταση και μπορεί να τυλιχτεί, να σφραγιστεί και να τραβηχτεί. Η ικανότητα διάλυσης άνθρακα και άλλων στοιχείων χρησιμεύει ως βάση για την παραγωγή διαφόρων κραμάτων σιδήρου.
Το υγρό μπορεί να υπάρχει με τη μορφή δύο κρυσταλλικών δικτυωμάτων: a - και g - κυβικό με κέντρο το σώμα (bcc) και κυβικό με επίκεντρο πρόσωπο (fcc). Κάτω από τους 910 °C, το a - fe με ένα πλέγμα bcc είναι σταθερό (a = 2,86645 å στους 20 °C). Μεταξύ 910°C και 1400°C, η g-τροποποίηση με ένα πλέγμα fcc είναι σταθερή (a = 3,64 å). Πάνω από τους 1400°C, το πλέγμα bcc d-fe (a = 2,94 å) σχηματίζεται ξανά, σταθερό μέχρι τη θερμοκρασία τήξης (1539°C). Το a - fe είναι σιδηρομαγνητικό μέχρι τους 769°C (σημείο Curie). Η τροποποίηση g -fe και d -fe είναι παραμαγνητικές.
Οι πολυμορφικοί μετασχηματισμοί του σιδήρου και του χάλυβα κατά τη θέρμανση και την ψύξη ανακαλύφθηκαν το 1868 από τον D.K. Τσερνόφ. Ο άνθρακας σχηματίζεται με το J. στερεά διαλύματαεμφυτεύματα στις οποίες άτομα C, με μικρή ατομική ακτίνα (0,77 å), βρίσκονται στα διάκενα του μεταλλικού κρυσταλλικού πλέγματος, που αποτελείται από μεγαλύτερα άτομα (ατομική ακτίνα fe 1,26 å). Ένα στερεό διάλυμα άνθρακα σε g-fe ονομάζεται. ωστενίτης, και σε (a -fe- φερρίτης. Κορεσμένο στερεό διάλυμα άνθρακα σε g - Το fe περιέχει 2,0% C κατά βάρος στους 1130°C. Το a -fe διαλύει μόνο 0,02-0,04% C στους 723°C και λιγότερο από 0,01% σε θερμοκρασία δωματίου. Επομένως, όταν βαφή μέταλλουσχηματίζεται ωστενίτης μαρτενσίτης -ένα υπερκορεσμένο στερεό διάλυμα άνθρακα σε a - fe, πολύ σκληρό και εύθραυστο. Συνδυασμός σκλήρυνσης με διακοπές(με θέρμανση σε σχετικά χαμηλές θερμοκρασίες για τη μείωση των εσωτερικών τάσεων) καθιστά δυνατή την απόδοση του απαιτούμενου συνδυασμού σκληρότητας και ολκιμότητας στον χάλυβα.
Οι φυσικές ιδιότητες του σιδήρου εξαρτώνται από την καθαρότητά του. Τα βιομηχανικά υλικά σιδήρου περιέχουν συνήθως ακαθαρσίες άνθρακα, αζώτου, οξυγόνου, υδρογόνου, θείου και φωσφόρου. Ακόμη και σε πολύ χαμηλές συγκεντρώσεις, αυτές οι ακαθαρσίες αλλάζουν πολύ τις ιδιότητες του μετάλλου. Άρα, το θείο προκαλεί τα λεγόμενα. κόκκινη ευθραυστότητα, φώσφορος (ακόμη και 10 -20% P) - ψυχρότητα; ο άνθρακας και το άζωτο μειώνονται πλαστική ύληκαι το υδρογόνο αυξάνεται εύθραυστοΖ. (το λεγόμενο υδρογόνο ευθραυστότητα). Μείωση της περιεκτικότητας σε ακαθαρσίες σε 10 -7 - 10 -9% οδηγεί σε σημαντικές αλλαγές στις ιδιότητες του μετάλλου, ιδιαίτερα σε αύξηση της ολκιμότητας.
Οι ακόλουθες είναι οι φυσικές ιδιότητες του σιδήρου, που σχετίζονται κυρίως με μέταλλο με συνολική περιεκτικότητα σε ακαθαρσίες μικρότερη από 0,01% κατά βάρος:
Ατομική ακτίνα 1,26 å
Ιονικές ακτίνες fe 2+ ο.80 å, fe 3+ ο.67 å
Πυκνότητα (20 o c) 7.874 g/cm 3
t pl 1539°C
t kipπερίπου 3200 o C
Συντελεστής θερμοκρασίας γραμμικής διαστολής (20°C) 11,7·10 -6
Θερμική αγωγιμότητα (25°C) 74.04 Τρ/(μ Κ)
Η θερμοχωρητικότητα του υγρού εξαρτάται από τη δομή του και αλλάζει με πολύπλοκο τρόπο με τη θερμοκρασία. μέση ειδική θερμοχωρητικότητα (0-1000 o γ) 640,57 j/(κιλό·ΠΡΟΣ ΤΗΝ) .
Ηλεκτρική αντίσταση (20°C)
9,7·10 -8 ωμ μ
Συντελεστής θερμοκρασίας ηλεκτρικής αντίστασης
(0-100°C) 6,51·10-3
Συντελεστής Young 190-210 10 3 Mn/m. 2
(19-21 10 3 kgf/mm 2)
Συντελεστής θερμοκρασίας συντελεστή Young
Συντελεστής διάτμησης 84,0 10 3 Mn/m 2
Βραχυπρόθεσμη αντοχή σε εφελκυσμό
170-210 Mn/m 2
Επιμήκυνση 45-55%
Σκληρότητα Brinell 350-450 Mn/m 2
Αντοχή διαρροής 100 Mn/m 2
Αντοχή κρούσης 300 Mn/m 2
Διαμόρφωση του εξωτερικού κελύφους ηλεκτρονίων του ατόμου fe 3 ρε 6 4s 2 . Ο σίδηρος παρουσιάζει μεταβλητό σθένος (οι ενώσεις του σιδήρου 2 και 3 σθένους είναι οι πιο σταθερές). Με το οξυγόνο, ο σίδηρος σχηματίζει οξείδιο feo, οξείδιο fe 2 o 3 και οξείδιο fe 3 o 4 (ένωση του feo με fe 2 o 3, που έχει τη δομή σπινελών) . Σε υγρό αέρα σε κανονικές θερμοκρασίες, ο σίδηρος καλύπτεται με χαλαρή σκουριά (fe 2 o 3 nη 2 ο). Λόγω του πορώδους της, η σκουριά δεν εμποδίζει την πρόσβαση οξυγόνου και υγρασίας στο μέταλλο και επομένως δεν το προστατεύει από περαιτέρω οξείδωση. Ως αποτέλεσμα διάφορων τύπων διάβρωσης, εκατομμύρια τόνοι σιδήρου χάνονται ετησίως Όταν ο σίδηρος θερμαίνεται σε ξηρό αέρα πάνω από 200°C, καλύπτεται με ένα λεπτό φιλμ οξειδίου, το οποίο προστατεύει το μέταλλο από τη διάβρωση σε κανονικές θερμοκρασίες. αυτή είναι η βάση της τεχνικής μεθόδου προστασίας του Zh. λουλάκι.Όταν θερμαίνεται σε υδρατμούς, ο σίδηρος οξειδώνεται για να σχηματίσει fe 3 o 4 (κάτω από 570°C) ή feo (πάνω από 570°C) και απελευθερώνει υδρογόνο.
Το υδροξείδιο του Fe(oh)2 σχηματίζεται με τη μορφή λευκού ιζήματος όταν δρουν καυστικά αλκάλια ή αμμωνία σε υδατικά διαλύματα αλάτων fe2+ σε ατμόσφαιρα υδρογόνου ή αζώτου. Όταν έρχεται σε επαφή με τον αέρα, το fe(oh)2 πρώτα γίνεται πράσινο, μετά γίνεται μαύρο και τελικά γρήγορα μετατρέπεται στο κόκκινο-καφέ υδροξείδιο fe(oh)3. Το οξείδιο Feo παρουσιάζει βασικές ιδιότητες. Το οξείδιο Fe 2 o 3 είναι επαμφοτερίζον και έχει ασθενώς εκφρασμένη όξινη λειτουργία. αντιδρώντας με περισσότερα βασικά οξείδια (για παράδειγμα, mgo), σχηματίζει φερρίτες - ενώσεις του τύπου fe 2 o 3 n meo, που έχουν σιδηρομαγνητικές ιδιότητες και χρησιμοποιούνται ευρέως στα ραδιοηλεκτρονικά. Οι όξινες ιδιότητες εκφράζονται επίσης στον εξασθενή σίδηρο, ο οποίος υπάρχει με τη μορφή φερρατικών, για παράδειγμα k 2 feo 4, άλατα τρισθενούς οξέος που δεν έχουν απομονωθεί σε ελεύθερη κατάσταση.
Το F. αντιδρά εύκολα με αλογόνα και υδραλογονίδια, δίνοντας άλατα, για παράδειγμα, τα χλωρίδια fecl 2 και fecl 3. Όταν το υγρό θερμαίνεται με θείο, σχηματίζονται τα σουλφίδια fes και fes 2. Καρβίδια Zh - fe 3 c ( τσιμεντίτης) και fe 2 c (e-καρβίδιο) - ίζημα από στερεά διαλύματα άνθρακα σε υγρό κατά την ψύξη. Το fe 3 c απελευθερώνεται επίσης από διαλύματα άνθρακα σε υγρό υγρό σε υψηλές συγκεντρώσεις αζώτου Το άζωτο, όπως ο άνθρακας, δίνει ενδιάμεσα στερεά διαλύματα από υγρό. Από αυτά, απελευθερώνονται νιτρίδια fe 4 n και fe 2 n. Με το υδρογόνο, ο σίδηρος παράγει μόνο ασταθή υδρίδια, η σύνθεση των οποίων δεν έχει εξακριβωθεί με ακρίβεια. Όταν θερμαίνεται, ο σίδηρος αντιδρά έντονα με το πυρίτιο και τον φώσφορο, σχηματίζοντας πυριτικά (για παράδειγμα, fe 3 si) και φωσφίδια (για παράδειγμα, fe 3 p).
Οι υγρές ενώσεις με πολλά στοιχεία (O, s, κ.λπ.) που σχηματίζουν κρυσταλλική δομή έχουν μεταβλητή σύνθεση (για παράδειγμα, η περιεκτικότητα σε θείο στο μονοσουλφίδιο μπορεί να κυμαίνεται από 50 έως 53,3 στο %). Αυτό οφείλεται σε ελαττώματα στην κρυσταλλική δομή. Για παράδειγμα, στο οξείδιο του σιδήρου, μερικά από τα ιόντα fe 2+ στις θέσεις πλέγματος αντικαθίστανται από ιόντα fe 3+. για να διατηρηθεί η ηλεκτρική ουδετερότητα, ορισμένες θέσεις πλέγματος που ανήκαν σε ιόντα fe 2+ παραμένουν κενές και η φάση (wüstite) υπό κανονικές συνθήκες έχει τον τύπο fe 0,947 o.
η αλληλεπίδραση του J. με νιτρικό οξύ.Συμπυκνωμένο hno 3 (πυκνότητα 1,45 g/cm 3) Παθητικοποιεί το σίδερο λόγω της εμφάνισης προστατευτικής μεμβράνης οξειδίου στην επιφάνειά του. ένα πιο αραιό hno 3 διαλύει το υγρό με το σχηματισμό ιόντων fe 2+ ή fe 3+, που μειώνονται σε mh 3 ή n 2 o και n 2.
Τα διαλύματα αλάτων δισθενούς σιδήρου στον αέρα είναι ασταθή - το fe 2+ οξειδώνεται σταδιακά σε fe 3+. Υδατικά διαλύματα υγρών αλάτων λόγω υδρόλυσηέχουν όξινη αντίδραση. Η προσθήκη fe 3+ θειοκυανικών ιόντων scn - σε διαλύματα αλάτων δίνει ένα λαμπερό κόκκινο χρώμα λόγω της εμφάνισης του fe (scn) 3, το οποίο καθιστά δυνατή την ανακάλυψη της παρουσίας 1 μέρους fe 3+ σε περίπου 10 6 μέρη του νερού. Η J. χαρακτηρίζεται από μόρφωση σύνθετες ενώσεις.
Παραλαβή και αίτηση. Ο καθαρός σίδηρος λαμβάνεται σε σχετικά μικρές ποσότητες με ηλεκτρόλυση υδατικών διαλυμάτων των αλάτων του ή με αναγωγή των οξειδίων του με υδρογόνο. Αναπτύσσεται μέθοδος για την άμεση παραγωγή σιδήρου από μεταλλεύματα με ηλεκτρόλυση τήγματος. Η παραγωγή επαρκώς καθαρού σιδήρου αυξάνεται σταδιακά μέσω της άμεσης αναγωγής του από συμπυκνώματα μεταλλεύματος με υδρογόνο, φυσικό αέριο ή άνθρακα σε σχετικά χαμηλές θερμοκρασίες.
Ο σίδηρος είναι το πιο σημαντικό μέταλλο της σύγχρονης τεχνολογίας. Στην καθαρή του μορφή, ο σίδηρος πρακτικά δεν χρησιμοποιείται λόγω της χαμηλής αντοχής του, αν και στην καθημερινή ζωή τα προϊόντα χάλυβα ή χυτοσίδηρου ονομάζονται συχνά «σίδερο». Ο κύριος όγκος του σιδήρου χρησιμοποιείται με τη μορφή κραμάτων με πολύ διαφορετικές συνθέσεις και ιδιότητες. Τα κράματα σιδήρου αντιπροσωπεύουν περίπου το 95% όλων των μεταλλικών προϊόντων. Κράματα πλούσια σε άνθρακα (πάνω από 2% κατά βάρος) - χυτοσίδηροι - τήκονται σε υψικάμινους από εμπλουτισμένα μεταλλεύματα σιδήρου. Χάλυβας διαφόρων ποιοτήτων (περιεκτικότητα σε άνθρακα μικρότερη από 2% κατά βάρος) τήκεται από χυτοσίδηρο σε ανοιχτές εστίες και ηλεκτρικούς φούρνους και μετατροπείς οξειδώνοντας (καίγοντας) την περίσσεια άνθρακα, αφαιρώντας επιβλαβείς ακαθαρσίες (κυρίως s, P, O) και προσθέτοντας κραματικά στοιχεία. Χάλυβες υψηλής κραματοποίησης (με υψηλή περιεκτικότητα σε νικέλιο, χρώμιο, βολφράμιο και άλλα στοιχεία) τήκονται σε ηλεκτρικό τόξο και επαγωγικούς κλιβάνους. Για την παραγωγή χάλυβα και κραμάτων σιδήρου για ιδιαίτερα κρίσιμους σκοπούς, χρησιμοποιούνται νέες διεργασίες - κενό, επανατήξη ηλεκτροσκωρίας, τήξη πλάσματος και δέσμης ηλεκτρονίων κ.λπ. Αναπτύσσονται μέθοδοι για την τήξη χάλυβα σε μονάδες συνεχούς λειτουργίας που εξασφαλίζουν υψηλής ποιότητας μέταλλο και αυτοματισμό η διαδικασία.
Με βάση το σίδηρο δημιουργούνται υλικά που αντέχουν τις επιπτώσεις υψηλών και χαμηλών θερμοκρασιών, κενού και υψηλών πιέσεων, επιθετικών περιβαλλόντων, υψηλών εναλλασσόμενων τάσεων, πυρηνικής ακτινοβολίας κ.λπ. Η παραγωγή σιδήρου και των κραμάτων του αυξάνεται συνεχώς. Το 1971, 89,3 εκατομμύρια λιώθηκαν στην ΕΣΣΔ. Τχυτοσίδηρος και 121 εκατ Τγίνομαι.
L. A. Shvartsman, L. V. Vanyukova.
Ο σίδηρος ως καλλιτεχνικό υλικό χρησιμοποιείται από την αρχαιότητα στην Αίγυπτο (κεφαλοστάσιο από τον τάφο του Τουταγχαμών κοντά στη Θήβα, μέσα 14ου αιώνα π.Χ., Μουσείο Ashmolean, Οξφόρδη), Μεσοποταμία (στιλέτα που βρέθηκαν κοντά στο Carchemish, 500 π.Χ., Βρετανικό Μουσείο, Λονδίνο) , Ινδία (σιδερένια στήλη στο Δελχί, 415). Από τον Μεσαίωνα, πολυάριθμα προϊόντα υψηλής τέχνης από σίδηρο και χάλυβα έχουν διατηρηθεί στις ευρωπαϊκές χώρες (Αγγλία, Γαλλία, Ιταλία, Ρωσία, κ.λπ.) - σφυρηλατημένοι φράχτες, μεντεσέδες πόρτας, βραχίονες τοίχου, ανεμοδείκτες, πλαίσια θώρακα και φώτα. Τα σφυρήλατα προϊόντα από ράβδους και τα προϊόντα από διογκωμένα μεταλλικά φύλλα (συχνά με επένδυση μαρμαρυγίας) διακρίνονται από τα επίπεδα σχήματά τους, μια σαφή γραμμική γραφική σιλουέτα και είναι αποτελεσματικά ορατά σε ένα ανοιχτόχρωμο φόντο. Τον 20ο αιώνα Ο σίδηρος χρησιμοποιείται για την κατασκευή σχαρών, περιφράξεων, εσωτερικών χωρισμάτων διάτρητων, κηροπήγια και μνημείων.
T.L.
Σίδηρος στο σώμα. Ο σίδηρος υπάρχει στους οργανισμούς όλων των ζώων και των φυτών (κατά μέσο όρο περίπου 0,02%). είναι απαραίτητο κυρίως για το μεταβολισμό του οξυγόνου και τις οξειδωτικές διεργασίες. Υπάρχουν οργανισμοί (οι λεγόμενοι συγκεντρωτές) ικανοί να το συσσωρεύσουν σε μεγάλες ποσότητες (για παράδειγμα, βακτήρια σιδήρου -έως 17-20% F.). Σχεδόν όλα τα λίπη σε ζωικούς και φυτικούς οργανισμούς συνδέονται με πρωτεΐνες. Η έλλειψη λίπους προκαλεί καθυστέρηση ανάπτυξης και συμπτώματα χλώρωση των φυτών,σχετίζεται με μειωμένη εκπαίδευση χλωροφύλλη.Η περίσσεια σιδήρου έχει επίσης επιβλαβή επίδραση στην ανάπτυξη των φυτών, προκαλώντας, για παράδειγμα, στειρότητα των ανθέων του ρυζιού και χλώρωση. Σε αλκαλικά εδάφη, σχηματίζονται ενώσεις σιδήρου που είναι απρόσιτες για απορρόφηση από τις ρίζες των φυτών και τα φυτά δεν τον λαμβάνουν σε επαρκείς ποσότητες. σε όξινα εδάφη, ο σίδηρος περνά σε διαλυτές ενώσεις σε περίσσεια. Όταν υπάρχει ανεπάρκεια ή περίσσεια αφομοιώσιμων ενώσεων σιδήρου στο έδαφος, οι ασθένειες των φυτών μπορεί να εμφανιστούν σε μεγάλες εκτάσεις.
Οι φυτικές ίνες εισέρχονται στο σώμα των ζώων και των ανθρώπων με την τροφή (οι πιο πλούσιες πηγές σε αυτές είναι το συκώτι, το κρέας, τα αυγά, τα όσπρια, το ψωμί, τα δημητριακά, το σπανάκι και τα παντζάρια). Κανονικά, ένα άτομο λαμβάνει 60-110 με δίαιτα mg J., που ξεπερνά σημαντικά την καθημερινή του απαίτηση. Η απορρόφηση της γονιμοποίησης που λαμβάνεται από την τροφή γίνεται στο άνω μέρος του λεπτού εντέρου, από όπου εισέρχεται στο αίμα σε μορφή δεσμευμένη με πρωτεΐνες και μεταφέρεται με το αίμα σε διάφορα όργανα και ιστούς, όπου εναποτίθεται με τη μορφή λίπανσης. σύμπλεγμα πρωτεϊνών - φερριτίνη. Η κύρια αποθήκη λίπους στο σώμα είναι το συκώτι και ο σπλήνας. Λόγω της φερριτίνης σιδήρου, συντίθενται όλες οι ενώσεις του σώματος που περιέχουν σίδηρο: η αναπνευστική χρωστική συντίθεται στο μυελό των οστών αιμοσφαιρίνη,στους μυς - μυοσφαιρίνη,σε διάφορους ιστούς κυτοχρώματακαι άλλα ένζυμα που περιέχουν σίδηρο. Το λίπος αποβάλλεται από το σώμα κυρίως μέσω του τοιχώματος του παχέος εντέρου (στον άνθρωπο υπάρχουν περίπου 6-10 mgημερησίως) και σε μικρό βαθμό από τα νεφρά. Η ανάγκη του σώματος για λίπος αλλάζει με την ηλικία και τη φυσική κατάσταση. Για 1 κιλό βάρους, τα παιδιά χρειάζονται - 0,6, οι ενήλικες - 0,1 και οι έγκυες γυναίκες - 0,3 mg J. ανά ημέρα. Στα ζώα, η ανάγκη για λίπος είναι περίπου (ανά 1 κιλόξηρή ουσία της διατροφής): για αγελάδες γαλακτοπαραγωγής - τουλάχιστον 50 mg,για νεαρά ζώα - 30-50 mg,για χοιρίδια - έως 200 mg,για έγκυους χοίρους - 60 mg.
V. V. Kovalsky.
Στην ιατρική, φαρμακευτικά σκευάσματα σιδήρου (ανηγμένο σίδηρο, γαλακτικό σίδηρο, γλυκεροφωσφορικό σίδηρο, δισθενές θειικό σίδηρο, δισκία Blo, μηλικό διάλυμα, φεραμίδιο, αιμοδιουλίνη κ.λπ.) χρησιμοποιούνται στη θεραπεία ασθενειών που συνοδεύονται από ανεπάρκεια σιδήρου. σιδηροπενική αναιμία), καθώς και ως γενικό τονωτικό (μετά από μολυσματικές ασθένειες κ.λπ.). Τα ισότοπα του σιδήρου (52 fe, 55 fe και 59 fe) χρησιμοποιούνται ως δείκτες στη βιοϊατρική έρευνα και διάγνωση ασθενειών του αίματος (αναιμία, λευχαιμία, πολυκυτταραιμία κ.λπ.).
Λιτ.:Γενική μεταλλουργία, Μ., 1967; Nekrasov B.V., Fundamentals of General Chemistry, τόμος 3, Μ., 1970; Remi G., Μάθημα ανόργανης χημείας, μτφρ. from German, vol. 2, M., 1966; Σύντομη χημική εγκυκλοπαίδεια, τόμος 2, Μ., 1963; Levinson N. R., [Προϊόντα από μη σιδηρούχα και σιδηρούχα μέταλλα], στο βιβλίο: Ρωσική διακοσμητική τέχνη, τομ., 1962-65; Vernadsky V.I., Βιογεωχημικά δοκίμια. 1922-1932, M. - L., 1940; Granik S., Iron metabolism in animals and plants, στη συλλογή: Microelements, trans. from English, Μ., 1962; Dixon Μ., Webb F., enzymes, trans. from English, Μ., 1966; neogi π., σίδηρος στην αρχαία Ινδία, Καλκούτα, 1914; φίλος j. σημ., σιδερένιο στην αρχαιότητα, λ., 1926; ειλικρινής ε. β., παλιά γαλλική σιδηρουργία, καμπ. (μαζ.), 1950; Lister R., διακοσμητικό σφυρήλατο σίδηρο στη Μεγάλη Βρετανία, l., 1960.
κατεβάστε την περίληψη
Σίδερο
ΣΙΔΕΡΟ-ΕΝΑ; Νυμφεύομαι
1. Χημικό στοιχείο (Fe), ένα εύπλαστο μέταλλο σε ασημί χρώμα που συνδυάζεται με άνθρακα για να σχηματίσει χάλυβα και χυτοσίδηρο.
2. Η κοινή ονομασία για τον χάλυβα χαμηλών εκπομπών άνθρακα, ένα μέταλλο σε ασημί χρώμα. Σιδηρουργείο Ο αέρας κροταλίζει τη σιδερένια οροφή.
3. Σχετικά με το τι είναι ισχυρό, συμπαγές, δυνατό (σχετικά με τις εξωτερικές φυσικές ιδιότητες). Τα χέρια σου είναι καλά! // Για το τι είναι σκληρό, ανυποχώρητο (για τις εσωτερικές ηθικές ιδιότητες). Ο χαρακτήρας του είναι...
4. Razg.Σχετικά με ένα φάρμακο που περιέχει αδενικές ουσίες. Το σώμα στερείται σιδήρου. Πίνετε καλά. Τα μήλα περιέχουν w.
5. Razg. τεχν.Υλικό υπολογιστή (σε αντίθεση με το λογισμικό). Αγοράστε το σίδερο που λείπει.
◊ Κάψτε με ζεστό σίδερο. Να εξαλείψει, να καταστρέψει κάτι, να καταφύγει σε ακραία, έκτακτα μέτρα. Χτυπήστε όσο το σίδερο είναι ζεστό (βλ. Σφυρηλάτηση).
◁ Σίδερο; Αδενώδης; Σίδερο; Σίδερο (βλ.).
σίδερο(λατ. Ferrum), χημικό στοιχείο της ομάδας VIII του περιοδικού συστήματος. Γυαλιστερό ασημί-λευκό μέταλλο. Σχηματίζει πολυμορφικές τροποποιήσεις. σε συνηθισμένες θερμοκρασίες ο α-Fe είναι σταθερός (κρυσταλλικό πλέγμα - κυβικό με κέντρο) με πυκνότητα 7,874 g/cm 3 . Το α-Fe μέχρι τους 769°C (σημείο Curie) είναι σιδηρομαγνητικό. t pl 1535°C. Στον αέρα οξειδώνεται και καλύπτεται με χαλαρή σκουριά. Όσον αφορά την επικράτηση των στοιχείων στη φύση, ο σίδηρος βρίσκεται στην 4η θέση. σχηματίζει περίπου 300 ορυκτά. Τα κράματα σιδήρου με άνθρακα και άλλα στοιχεία αντιπροσωπεύουν περίπου το 95% όλων των μεταλλικών προϊόντων (χυτοσίδηρος, χάλυβας, σιδηροκράματα). Στην καθαρή του μορφή πρακτικά δεν χρησιμοποιείται (στην καθημερινή ζωή τα προϊόντα χάλυβα ή χυτοσίδηρου ονομάζονται συχνά σίδηρος). Απαραίτητο για τη ζωή των ζωικών οργανισμών. είναι μέρος της αιμοσφαιρίνης.
ΣΙΔΕΡΟΣΙΔΗΡΟΣ (λατ. Ferrum), Fe (διαβάστε «ferrum»), χημικό στοιχείο, ατομικός αριθμός 26, ατομική μάζα 55,847. Η προέλευση τόσο της λατινικής όσο και της ρωσικής ονομασίας του στοιχείου δεν έχει εξακριβωθεί με σαφήνεια. Ο φυσικός σίδηρος είναι ένα μείγμα τεσσάρων νουκλεϊδίων (εκ. NUCLIDE)με μαζικούς αριθμούς 54 (περιεκτικότητα σε φυσικό μείγμα 5,82% κατά βάρος), 56 (91,66%), 57 (2,19%) και 58 (0,33%). Διαμόρφωση δύο εξωτερικών ηλεκτρονικών στρωμάτων 3 μικρό 2
Π 6
ρε 6
4s 2
. Τυπικά σχηματίζει ενώσεις σε καταστάσεις οξείδωσης +3 (σθένος III) και +2 (σθένος II). Είναι επίσης γνωστές ενώσεις με άτομα σιδήρου σε καταστάσεις οξείδωσης +4, +6 και μερικές άλλες.
Στο περιοδικό σύστημα του Mendeleev, ο σίδηρος περιλαμβάνεται στην ομάδα VIII. Στην τέταρτη περίοδο, στην οποία ανήκει ο σίδηρος, στην ομάδα αυτή ανήκει και το κοβάλτιο (εκ.ΚΟΒΑΛΤΙΟ)και νικέλιο (εκ.ΝΙΚΕΛΙΟ). Αυτά τα τρία στοιχεία σχηματίζουν μια τριάδα και έχουν παρόμοιες ιδιότητες.
Η ακτίνα του ουδέτερου ατόμου σιδήρου είναι 0,126 nm, η ακτίνα του ιόντος Fe 2+ είναι 0,080 nm και του ιόντος Fe 3+ είναι 0,067 nm. Οι ενέργειες του διαδοχικού ιονισμού του ατόμου του σιδήρου είναι 7.893, 16.18, 30.65, 57, 79 eV. Συγγένεια ηλεκτρονίων 0,58 eV. Σύμφωνα με την κλίμακα Pauling, η ηλεκτραρνητικότητα του σιδήρου είναι περίπου 1,8.
Ο σίδηρος υψηλής καθαρότητας είναι ένα γυαλιστερό ασημί-γκρι, όλκιμο μέταλλο που μπορεί εύκολα να κατεργαστεί με διάφορους τρόπους.
Όντας στη φύση
Ο σίδηρος είναι αρκετά διαδεδομένος στον φλοιό της γης - αντιπροσωπεύει περίπου το 4,1% της μάζας του φλοιού της γης (4η θέση μεταξύ όλων των στοιχείων, 2η μεταξύ των μετάλλων). Είναι γνωστός ένας μεγάλος αριθμός μεταλλευμάτων και ορυκτών που περιέχουν σίδηρο. Τα ερυθρά σιδηρομεταλλεύματα (μετάλλευμα αιματίτη) έχουν τη μεγαλύτερη πρακτική σημασία (εκ.ΑΙΜΑΤΙΤΗΣ), Fe 2 O 3 ; περιέχει έως και 70% Fe), μαγνητικά μεταλλεύματα σιδήρου (μεταλλεύματος μαγνητίτη (εκ.ΜΑΓΝΗΤΗΣ), Fe 3 O 4 ; περιέχει 72,4% Fe), μεταλλεύματα καφέ σιδήρου (υδρογοαιθίτης НFeO 2 μετάλλευμα n H 2 O), καθώς και τα μεταλλεύματα σιδήρου (σιδερίτη (εκ.ΣΙΔΗΡΙΤΗΣ ΛΙΘΟΣ), ανθρακικός σίδηρος, FeCO 3 ; περιέχει περίπου 48% Fe). Μεγάλα κοιτάσματα πυρίτη βρίσκονται επίσης στη φύση. (εκ.ΣΙΔΗΡΟΠΥΡΙΤΗΣ) FeS 2 (άλλα ονόματα είναι πυρίτης θείου, σιδηροπυρίτης, δισουλφίδιο του σιδήρου και άλλα), αλλά τα μεταλλεύματα με υψηλή περιεκτικότητα σε θείο δεν έχουν ακόμη πρακτική σημασία. Η Ρωσία κατέχει την πρώτη θέση στον κόσμο όσον αφορά τα αποθέματα σιδηρομεταλλεύματος. Το θαλασσινό νερό περιέχει 1·10 -5 -1·10 -8% σίδηρο.
Ιστορία παραγωγής σιδήρου
Ο σίδηρος έπαιξε και συνεχίζει να παίζει εξαιρετικό ρόλο στην υλική ιστορία της ανθρωπότητας. Ο πρώτος μεταλλικός σίδηρος που έπεσε σε ανθρώπινα χέρια ήταν πιθανότατα μετεωριτικής προέλευσης. Τα μεταλλεύματα σιδήρου είναι ευρέως διαδεδομένα και συχνά βρίσκονται ακόμη και στην επιφάνεια της Γης, αλλά ο εγγενής σίδηρος στην επιφάνεια είναι εξαιρετικά σπάνιος. Πιθανώς, πριν από αρκετές χιλιάδες χρόνια, κάποιος παρατήρησε ότι μετά το κάψιμο μιας φωτιάς, σε ορισμένες περιπτώσεις παρατηρήθηκε σχηματισμός σιδήρου από εκείνα τα κομμάτια μεταλλεύματος που κατά λάθος κατέληξαν στη φωτιά. Όταν καίγεται μια φωτιά, η αναγωγή του σιδήρου από το μετάλλευμα συμβαίνει λόγω της αντίδρασης του μεταλλεύματος τόσο απευθείας με τον άνθρακα όσο και με το μονοξείδιο του άνθρακα (II) CO που σχηματίζεται κατά την καύση. Η δυνατότητα λήψης σιδήρου από μεταλλεύματα διευκολύνθηκε πολύ από την ανακάλυψη του γεγονότος ότι όταν το μετάλλευμα θερμαίνεται με άνθρακα, εμφανίζεται ένα μέταλλο, το οποίο μπορεί στη συνέχεια να καθαριστεί περαιτέρω κατά τη σφυρηλάτηση. Η εξόρυξη σιδήρου από μετάλλευμα με τη μέθοδο της εμφύσησης τυριού επινοήθηκε στη Δυτική Ασία τη 2η χιλιετία π.Χ. μι. Περίοδος από τον 9ο έως τον 7ο αιώνα. προ ΧΡΙΣΤΟΥ ε., όταν αναπτύχθηκε η μεταλλουργία του σιδήρου μεταξύ πολλών φυλών της Ευρώπης και της Ασίας, ονομάστηκε Εποχή του Σιδήρου, (εκ.ΕΠΟΧΗ ΤΟΥ ΣΙΔΗΡΟΥ)που αντικατέστησε την Εποχή του Χαλκού (εκ.Η ΕΠΟΧΗ ΤΟΥ ΧΑΛΚΟΥ). Οι βελτιώσεις στις μεθόδους εμφύσησης (το φυσικό βύθισμα αντικαταστάθηκε από φυσούνες) και η αύξηση του ύψους της σφυρηλάτησης (εμφανίστηκαν φούρνοι χαμηλού άξονα) οδήγησαν στην παραγωγή χυτοσιδήρου, ο οποίος άρχισε να τήκεται ευρέως στη Δυτική Ευρώπη από τον 14ο αιώνα. Ο χυτοσίδηρος που προέκυψε μετατράπηκε σε χάλυβα. Από τα μέσα του 18ου αιώνα, ο οπτάνθρακας άρχισε να χρησιμοποιείται στη διαδικασία της υψικαμίνου αντί του άνθρακα. (εκ.ΚΟΚ). Στη συνέχεια, οι μέθοδοι λήψης σιδήρου από μεταλλεύματα βελτιώθηκαν σημαντικά και επί του παρόντος χρησιμοποιούνται ειδικές συσκευές για αυτό - υψικάμινοι, μετατροπείς οξυγόνου, κλίβανοι ηλεκτρικού τόξου.
ΦΥΣΙΚΕΣ ΚΑΙ ΧΗΜΙΚΕΣ ΙΔΙΟΤΗΤΕΣ
Σε θερμοκρασίες από δωμάτιο έως 917 °C, καθώς και στο εύρος θερμοκρασίας 1394-1535 °C, υπάρχει a-Fe με κυβικό πλέγμα με κέντρο σε θερμοκρασία δωματίου η παράμετρος του πλέγματος α = 0,286645 nm. Σε θερμοκρασίες 917-1394 °C, το b-Fe με κυβικό πλέγμα T (a = 0,36468 nm) είναι σταθερό. Σε θερμοκρασίες από θερμοκρασία δωματίου έως 769 °C (το λεγόμενο σημείο Κιουρί (εκ.ΣΗΜΕΙΟ ΚΙΟΥΡΙ)) ο σίδηρος έχει ισχυρές μαγνητικές ιδιότητες (λέγεται ότι είναι σιδηρομαγνητικός), σε υψηλότερες θερμοκρασίες ο σίδηρος συμπεριφέρεται ως παραμαγνητικός. Μερικές φορές το παραμαγνητικό a-Fe με κυβικό πλέγμα με κέντρο το σώμα, σταθερό σε θερμοκρασίες από 769 έως 917 °C, θεωρείται ως g-τροποποίηση του σιδήρου και το b-Fe, σταθερό σε υψηλές θερμοκρασίες (1394-1535 °C), ονομάζεται παραδοσιακά d-Fe (η ιδέα της ύπαρξης τεσσάρων τροποποιήσεων του σιδήρου - a, b, g και d - προέκυψε όταν η ανάλυση περίθλασης ακτίνων Χ δεν υπήρχε ακόμη και δεν υπήρχαν αντικειμενικές πληροφορίες για την εσωτερική δομή του σίδερο). Σημείο τήξεως 1535 °C, σημείο βρασμού 2750 °C, πυκνότητα 7,87 g/cm3. Το τυπικό δυναμικό του ζεύγους Fe 2+ /Fe 0 είναι –0,447V, το ζεύγος Fe 3+ /Fe 2+ είναι +0,771V.
Όταν αποθηκεύεται στον αέρα σε θερμοκρασίες έως 200 °C, ο σίδηρος καλύπτεται σταδιακά με ένα πυκνό φιλμ οξειδίου, το οποίο εμποδίζει την περαιτέρω οξείδωση του μετάλλου. Στον υγρό αέρα, ο σίδηρος καλύπτεται με ένα χαλαρό στρώμα σκουριάς, το οποίο δεν εμποδίζει την πρόσβαση οξυγόνου και υγρασίας στο μέταλλο και την καταστροφή του. Η σκουριά δεν έχει σταθερή χημική σύνθεση περίπου ο χημικός τύπος της μπορεί να γραφτεί ως Fe 2 O 3 xH 2 O.
Ο σίδηρος αντιδρά με το οξυγόνο όταν θερμαίνεται. Όταν ο σίδηρος καίγεται στον αέρα, σχηματίζεται οξείδιο Fe 2 O 3, όταν καίγεται σε καθαρό οξυγόνο, σχηματίζεται οξείδιο Fe 3 O 4. Εάν το οξυγόνο ή ο αέρας περάσει μέσα από τηγμένο σίδηρο, σχηματίζεται οξείδιο FeO. Όταν θερμαίνονται το θείο και η σκόνη σιδήρου, σχηματίζεται θειούχο, ο κατά προσέγγιση τύπος του οποίου μπορεί να γραφτεί ως FeS.
Ο σίδηρος αντιδρά με αλογόνα όταν θερμαίνεται (εκ.ΑΛΑΓΟΝΟ). Δεδομένου ότι το FeF 3 είναι μη πτητικό, ο σίδηρος είναι ανθεκτικός στο φθόριο μέχρι θερμοκρασίες 200-300°C. Όταν ο σίδηρος χλωριωθεί (σε θερμοκρασία περίπου 200°C), σχηματίζεται πτητικό FeCl 3. Εάν η αλληλεπίδραση σιδήρου και βρωμίου συμβεί σε θερμοκρασία δωματίου ή με θέρμανση και αυξημένη πίεση ατμών βρωμίου, σχηματίζεται FeBr 3. Όταν θερμαίνεται, το FeCl 3 και, ιδιαίτερα, το FeBr 3 διασπούν το αλογόνο και μετατρέπονται σε αλογονίδια σιδήρου (II). Όταν ο σίδηρος και το ιώδιο αλληλεπιδρούν, σχηματίζεται ιωδίδιο Fe 3 I 8.
Όταν θερμαίνεται, ο σίδηρος αντιδρά με το άζωτο, σχηματίζοντας νιτρίδιο σιδήρου Fe 3 N, με φώσφορο, σχηματίζοντας φωσφίδια FeP, Fe 2 P και Fe 3 P, με άνθρακα, σχηματίζοντας καρβίδιο Fe 3 C, με πυρίτιο, σχηματίζοντας πολλά πυριτικά, για παράδειγμα, FeSi .
Σε αυξημένη πίεση, ο μεταλλικός σίδηρος αντιδρά με το μονοξείδιο του άνθρακα CO και σχηματίζεται υγρό, υπό κανονικές συνθήκες, εξαιρετικά πτητικός σίδηρος πεντακαρβονυλ Fe(CO) 5. Τα καρβονύλια σιδήρου των συνθέσεων Fe 2 (CO) 9 και Fe 3 (CO) 12 είναι επίσης γνωστά. Τα καρβονύλια του σιδήρου χρησιμεύουν ως πρώτες ύλες στη σύνθεση οργανικών ενώσεων σιδήρου, συμπεριλαμβανομένου του σιδηροκενίου (εκ. FERROCENE)σύνθεση
Ο καθαρός μεταλλικός σίδηρος είναι σταθερός στο νερό και σε αραιά αλκαλικά διαλύματα. Ο σίδηρος δεν διαλύεται σε πυκνά θειικά και νιτρικά οξέα, καθώς ένα ισχυρό φιλμ οξειδίου παθητικοποιεί την επιφάνειά του.
Ο σίδηρος αντιδρά με υδροχλωρικά και αραιά (περίπου 20%) θειικά οξέα για να σχηματίσει άλατα σιδήρου (II):
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
Όταν ο σίδηρος αντιδρά με περίπου 70% θειικό οξύ, η αντίδραση προχωρά για να σχηματίσει θειικό σίδηρο (III):
2Fe + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
Το οξείδιο του σιδήρου (II) FeO έχει βασικές ιδιότητες η βάση Fe(OH) 2 του αντιστοιχεί. Το οξείδιο του σιδήρου (III) Fe 2 O 3 είναι ασθενώς επαμφοτερίζον και ταιριάζει με μια ακόμη πιο αδύναμη βάση από το Fe(OH) 2, Fe(OH) 3, το οποίο αντιδρά με οξέα:
2Fe(OH) 3 + 3H 2 SO 4 = Fe 2 (SO 4) 3 + 6H 2 O
Το υδροξείδιο του σιδήρου (III) Fe(OH) 3 παρουσιάζει ασθενώς αμφοτερικές ιδιότητες. είναι ικανό να αντιδρά μόνο με συμπυκνωμένα διαλύματα αλκαλίων:
Fe(OH) 3 + ΚΟΗ = Κ
Τα προκύπτοντα υδροξοσύμπλοκα σιδήρου (III) είναι σταθερά σε έντονα αλκαλικά διαλύματα. Όταν τα διαλύματα αραιώνονται με νερό, καταστρέφονται και καθιζάνει το υδροξείδιο του σιδήρου (III) Fe(OH) 3.
Οι ενώσεις σιδήρου (III) σε διαλύματα ανάγεται με μεταλλικό σίδηρο:
Fe + 2FeCl 3 = 3 FeCl 2
Κατά την αποθήκευση υδατικών διαλυμάτων αλάτων σιδήρου (II), παρατηρείται οξείδωση του σιδήρου (II) σε σίδηρο (III):
4FeCl 2 + O 2 + 2H 2 O = 4Fe(OH)Cl 2
Από τα άλατα σιδήρου (II) σε υδατικά διαλύματα, το πιο σταθερό είναι το άλας Mohr - διπλό αμμώνιο και θειικός σίδηρος (II) (NH 4) 2 Fe (SO 4) 2 6H 2 O.
Ο σίδηρος (III) είναι ικανός να σχηματίζει διπλά θειικά άλατα με μεμονωμένα φορτισμένα κατιόντα όπως στυπτηρία, για παράδειγμα, KFe(SO 4) 2 - στυπτηρία σιδήρου-καλίου, (NH 4)Fe(SO 4) 2 - στυπτηρία σιδήρου-αμμωνίου κ.λπ. .
Όταν το αέριο χλώριο ή το όζον δρα σε αλκαλικά διαλύματα ενώσεων σιδήρου (III), σχηματίζονται ενώσεις σιδήρου (VI) - φερρικά, για παράδειγμα, φερριικό κάλιο (VI) K 2 FeO 4. Υπάρχουν αναφορές για παραγωγή ενώσεων σιδήρου (VIII) υπό την επίδραση ισχυρών οξειδωτικών παραγόντων.
Για την ανίχνευση ενώσεων σιδήρου (III) σε διάλυμα, χρησιμοποιείται μια ποιοτική αντίδραση ιόντων Fe 3+ με θειοκυανικά ιόντα CNS -. Όταν τα ιόντα Fe 3+ αλληλεπιδρούν με τα ανιόντα του ΚΝΣ, σχηματίζεται έντονο κόκκινο θειοκυανικό σίδηρο Fe(CNS) 3. Ένα άλλο αντιδραστήριο για τα ιόντα Fe 3+ είναι το εξακυανοφερρικό κάλιο (II) K 4 (προηγουμένως αυτή η ουσία ονομαζόταν κίτρινο άλας αίματος). Όταν τα ιόντα Fe 3+ και 4- αλληλεπιδρούν, σχηματίζεται ένα έντονο μπλε ίζημα.
Το αντιδραστήριο για τα ιόντα Fe 2+ σε διάλυμα μπορεί να είναι ένα διάλυμα εξακυανοφερρικού καλίου (III) K3, που προηγουμένως ονομαζόταν κόκκινο άλας αίματος. Όταν τα ιόντα Fe 3+ και 3- αλληλεπιδρούν, σχηματίζεται ένα φωτεινό μπλε ίζημα της ίδιας σύνθεσης όπως στην περίπτωση της αλληλεπίδρασης των ιόντων Fe 3+ και 4-.
Κράματα σιδήρου-άνθρακα
Ο σίδηρος χρησιμοποιείται κυρίως σε κράματα, κυρίως σε κράματα με άνθρακα - διάφορους χυτοσίδηρους και χάλυβες. Στον χυτοσίδηρο, η περιεκτικότητα σε άνθρακα είναι υψηλότερη από 2,14% κατά βάρος (συνήθως σε επίπεδο 3,5-4%), στον χάλυβα η περιεκτικότητα σε άνθρακα είναι χαμηλότερη (συνήθως σε επίπεδο 0,8-1%).
Ο χυτοσίδηρος παράγεται σε υψικάμινους. Ο υψικάμινος είναι ένας γιγάντιος κόλουρος κώνος (ύψους έως 30-40 m), κοίλος εσωτερικά. Τα εσωτερικά τοιχώματα της υψικάμινου είναι επενδεδυμένα με πυρίμαχα τούβλα το πάχος της τοιχοποιίας είναι αρκετά μέτρα. Από πάνω, εμπλουτισμένο (απαλλαγμένο από πετρώματα) σιδηρομετάλλευμα, αναγωγικό οπτάνθρακα (ειδικές ποιότητες άνθρακα που υποβάλλεται σε οπτανθρακοποίηση - θερμαίνεται σε θερμοκρασία περίπου 1000 °C χωρίς πρόσβαση αέρα), καθώς και υλικά τήξης (ασβεστόλιθος και άλλα) που προάγουν διαχωρισμός φορτώνονται στην υψικάμινο με καρότσια από το λιωμένο μέταλλο υπάρχουν ακαθαρσίες - σκωρίες. Το υψικάμινο (καθαρό οξυγόνο ή αέρας εμπλουτισμένος με οξυγόνο) τροφοδοτείται στον υψικάμινο από κάτω. Καθώς τα υλικά που φορτώνονται στην υψικάμινο χαμηλώνουν, η θερμοκρασία τους αυξάνεται στους 1200-1300 °C. Ως αποτέλεσμα των αντιδράσεων αναγωγής που συμβαίνουν κυρίως με τη συμμετοχή οπτάνθρακα C και CO:
Fe 2 O 3 + 3C = 2Fe + 3CO;
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
Εμφανίζεται μεταλλικός σίδηρος, ο οποίος είναι κορεσμένος με άνθρακα και ρέει προς τα κάτω.
Αυτό το τήγμα απελευθερώνεται περιοδικά από την υψικάμινο μέσω μιας ειδικής οπής - μιας οπής βρύσης - και το τήγμα αφήνεται να σκληρύνει σε ειδικές μορφές. Ο χυτοσίδηρος μπορεί να είναι λευκός, ο λεγόμενος χυτοσίδηρος (χρησιμοποιείται για την παραγωγή χάλυβα) και γκρίζος ή χυτοσίδηρος. Ο λευκός χυτοσίδηρος είναι ένα στερεό διάλυμα άνθρακα σε σίδηρο. Στη μικροδομή του γκρίζου χυτοσιδήρου διακρίνονται μικροκρυστάλλοι γραφίτη. Λόγω της παρουσίας γραφίτη, ο γκρίζος χυτοσίδηρος αφήνει σημάδι στο λευκό χαρτί.
Ο χυτοσίδηρος είναι εύθραυστος και σπάει όταν κρούεται, επομένως δεν μπορούν να κατασκευαστούν από αυτό ελατήρια, φυλλοειδή ελατήρια ή οποιαδήποτε προϊόντα που πρέπει να λυγίσουν.
Ο στερεός χυτοσίδηρος είναι ελαφρύτερος από τον λιωμένο χυτοσίδηρο, επομένως όταν στερεοποιείται, δεν συστέλλεται (όπως συνήθως όταν στερεοποιούνται μέταλλα και κράματα), αλλά διαστέλλεται. Αυτή η δυνατότητα σάς επιτρέπει να κάνετε διάφορα χυτά από χυτοσίδηρο, συμπεριλαμβανομένης της χρήσης του ως υλικού για καλλιτεχνική χύτευση.
Εάν η περιεκτικότητα σε άνθρακα στο χυτοσίδηρο μειωθεί στο 1,0-1,5%, τότε σχηματίζεται χάλυβας. Οι χάλυβες μπορεί να είναι άνθρακας (τέτοιοι χάλυβες δεν έχουν άλλα συστατικά εκτός από Fe και C) και κραματοποιημένοι (τέτοιοι χάλυβες περιέχουν πρόσθετα χρωμίου, νικελίου, μολυβδαινίου, κοβαλτίου και άλλων μετάλλων που βελτιώνουν τις μηχανικές και άλλες ιδιότητες του χάλυβα).
Οι χάλυβες παράγονται με επεξεργασία χυτοσιδήρου και απορριμμάτων μετάλλου σε μετατροπέα οξυγόνου, ηλεκτρικό τόξο ή φούρνους ανοιχτής εστίας. Με μια τέτοια επεξεργασία, η περιεκτικότητα σε άνθρακα στο κράμα μειώνεται στο απαιτούμενο επίπεδο, όπως λένε, η περίσσεια άνθρακα καίγεται.
Οι φυσικές ιδιότητες του χάλυβα διαφέρουν σημαντικά από τις ιδιότητες του χυτοσιδήρου: ο χάλυβας είναι ελαστικός, μπορεί να σφυρηλατηθεί και να τυλιχθεί. Δεδομένου ότι ο χάλυβας, σε αντίθεση με το χυτοσίδηρο, συστέλλεται κατά τη στερεοποίηση, τα προκύπτοντα χυτά χάλυβα υποβάλλονται σε συμπίεση σε ελασματουργεία. Μετά την έλαση, τα κενά και οι κοιλότητες που εμφανίστηκαν κατά τη στερεοποίηση των λιωμάτων εξαφανίζονται στον όγκο του μετάλλου.
Η παραγωγή χάλυβα έχει μακρά, βαθιά παράδοση στη Ρωσία και ο χάλυβας που παράγεται από τους μεταλλουργούς μας είναι υψηλής ποιότητας.
Εφαρμογή του σιδήρου, των κραμάτων και των ενώσεων του
Ο καθαρός σίδηρος έχει μάλλον περιορισμένες χρήσεις. Χρησιμοποιείται στην κατασκευή πυρήνων ηλεκτρομαγνητών, ως καταλύτης για χημικές διεργασίες και για ορισμένους άλλους σκοπούς. Αλλά τα κράματα σιδήρου - χυτοσίδηρος και χάλυβας - αποτελούν τη βάση της σύγχρονης τεχνολογίας. Πολλές ενώσεις σιδήρου χρησιμοποιούνται επίσης ευρέως. Έτσι, ο θειικός σίδηρος (III) χρησιμοποιείται στην επεξεργασία του νερού, τα οξείδια του σιδήρου και το κυάνιο χρησιμεύουν ως χρωστικές στην κατασκευή βαφών κ.λπ.
Σίδηρος στο σώμα
Ο σίδηρος υπάρχει στο σώμα όλων των φυτών και των ζώων ως ιχνοστοιχείο. (εκ.ΜΙΚΡΟΣΤΟΙΧΕΙΑ)δηλαδή σε πολύ μικρές ποσότητες (κατά μέσο όρο περίπου 0,02%). Ωστόσο, βακτήρια σιδήρου (εκ.ΒΑΚΤΗΡΙΑ ΣΙΔΗΡΟΥ), χρησιμοποιώντας την ενέργεια οξείδωσης του σιδήρου (II) σε σίδηρο (III) για τη χημειοσύνθεση (εκ.ΧΗΜΟΣΥΝΘΕΣΗ), μπορούν να συσσωρεύσουν έως και 17-20% σίδηρο στα κύτταρά τους. Η κύρια βιολογική λειτουργία του σιδήρου είναι η συμμετοχή στη μεταφορά οξυγόνου και στις οξειδωτικές διεργασίες. Ο σίδηρος εκτελεί αυτή τη λειτουργία ως μέρος σύνθετων πρωτεϊνών - αιμοπρωτεϊνών (εκ.ΑΙΜΟΠΡΩΤΕΕΙΔΗ), η προσθετική ομάδα της οποίας είναι το σύμπλεγμα πορφυρίνης σιδήρου - αίμη (εκ.ΚΟΣΜΗΜΑ). Μεταξύ των πιο σημαντικών αιμοπρωτεϊνών είναι οι αναπνευστικές χρωστικές αιμοσφαιρίνη (εκ.ΑΙΜΟΣΦΑΙΡΙΝΗ)και μυοσφαιρίνη, (εκ.ΜΥΟΓΛΟΒΙΝΗ)καθολικοί φορείς ηλεκτρονίων στις αντιδράσεις κυτταρικής αναπνοής, οξείδωσης και φωτοσύνθεσης, κυτοχρώματα, (εκ.ΚΥΤΟΧΡΩΜΑΤΑ)ένζυμα καταλόζης και υπεροξειδίου και άλλα. Σε ορισμένα ασπόνδυλα, οι αναπνευστικές χρωστικές που περιέχουν σίδηρο heloerythrin και chlorocruorin έχουν δομή διαφορετική από τις αιμοσφαιρίνες. Κατά τη βιοσύνθεση των αιμοπρωτεϊνών, ο σίδηρος μεταφέρεται σε αυτές από την πρωτεΐνη φερριτίνη (εκ.ΦΕΡΡΙΤΙΝΗ), που αποθηκεύει και μεταφέρει σίδηρο. Αυτή η πρωτεΐνη, ένα μόριο της οποίας περιέχει περίπου 4.500 άτομα σιδήρου, συγκεντρώνεται στο ήπαρ, τον σπλήνα, τον μυελό των οστών και τον εντερικό βλεννογόνο των θηλαστικών και των ανθρώπων. Οι ημερήσιες ανάγκες ενός ατόμου σε σίδηρο (6-20 mg) καλύπτονται άφθονα από τρόφιμα (κρέας, συκώτι, αυγά, ψωμί, σπανάκι, παντζάρια και άλλα είναι πλούσια σε σίδηρο). Το σώμα ενός μέσου ανθρώπου (σωματικό βάρος 70 κιλά) περιέχει 4,2 g σιδήρου, 1 λίτρο αίματος περιέχει περίπου 450 mg. Όταν υπάρχει έλλειψη σιδήρου στον οργανισμό, αναπτύσσεται αδενική αναιμία, η οποία αντιμετωπίζεται με φάρμακα που περιέχουν σίδηρο. Τα συμπληρώματα σιδήρου χρησιμοποιούνται επίσης ως γενικοί ενισχυτικοί παράγοντες. Μια υπερβολική δόση σιδήρου (200 mg ή περισσότερο) μπορεί να έχει τοξική επίδραση. Ο σίδηρος είναι επίσης απαραίτητος για τη φυσιολογική ανάπτυξη των φυτών, γι' αυτό και υπάρχουν μικρολιπάσματα με βάση τα σκευάσματα σιδήρου.
εγκυκλοπαιδικό λεξικό. 2009 .
Συνώνυμα:Δείτε τι είναι το "hardware" σε άλλα λεξικά:
Νυμφεύομαι. αίθουσα(ες) νότια, δυτικά μέταλλο, ψίχα, λιωμένο από μετάλλευμα σε μορφή χυτοσιδήρου και σφυρηλατημένο από αυτό το τελευταίο κάτω από ένα σφυρί που ουρλιάζει. Όταν συνδυάζεται με άνθρακα, σχηματίζει χάλυβα. Ο σίδηρος πωλείται με τη μορφή: λωρίδας ή τεμαχισμένου. το πρώτο είναι ίσιο... Επεξηγηματικό Λεξικό Dahl
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0