Το Sulphur βρίσκεται στην ομάδα VIa Περιοδικός Πίνακας χημικά στοιχεία DI. Μεντελέεφ.
Το εξωτερικό ενεργειακό επίπεδο του θείου περιέχει 6 ηλεκτρόνια, τα οποία έχουν 3s 2 3p 4. Σε ενώσεις με μέταλλα και υδρογόνο, το θείο εμφανίζει αρνητική κατάσταση οξείδωσης των στοιχείων -2, σε ενώσεις με οξυγόνο και άλλα ενεργά αμέταλλα - θετική +2, +4, +6. Το θείο είναι ένα τυπικό μη μέταλλο, ανάλογα με τον τύπο του μετασχηματισμού, μπορεί να είναι ένας οξειδωτικός και ένας αναγωγικός παράγοντας.
 Εύρεση θείου στη φύση
Εύρεση θείου στη φύση
Το θείο βρίσκεται σε ελεύθερη (φυσική) κατάσταση και δεσμευμένη μορφή.
Οι πιο σημαντικές φυσικές ενώσεις θείου:
FeS 2 - σιδηροπυρίτης ή πυρίτης,
ZnS - μείγμα ψευδαργύρου ή φαλερίτης (βουρτζίτης),
PbS - λάμψη μολύβδου ή γαλένα,
HgS - κιννάβαρη,
Sb 2 S 3 - στιβνίτης.
Επιπλέον, το θείο υπάρχει στο πετρέλαιο, τον φυσικό άνθρακα, τα φυσικά αέρια και τα φυσικά νερά (με τη μορφή θειικών ιόντων και καθορίζει τη «μόνιμη» σκληρότητα γλυκό νερό). Ένα ζωτικό στοιχείο για ανώτερους οργανισμούς, συστατικόπολλές πρωτεΐνες συγκεντρώνονται στα μαλλιά.
Αλλοτροπικές τροποποιήσεις του θείου
Αλλοτροπία- αυτή είναι η ικανότητα του ίδιου στοιχείου να υπάρχει σε διαφορετικές μοριακές μορφές (τα μόρια περιέχουν διαφορετικούς αριθμούς ατόμων του ίδιου στοιχείου, για παράδειγμα, O 2 και O 3, S 2 και S 8, P 2 και P 4, κ.λπ. ). 
Το θείο διακρίνεται από την ικανότητά του να σχηματίζει σταθερές αλυσίδες και κύκλους ατόμων. Τα πιο σταθερά είναι τα S8, τα οποία σχηματίζουν ορθορομβικό και μονοκλινικό θείο. Αυτό είναι κρυσταλλικό θείο - μια εύθραυστη κίτρινη ουσία.
Οι ανοιχτές αλυσίδες έχουν πλαστικό θείο, μια καφέ ουσία, η οποία λαμβάνεται με απότομη ψύξη λιωμένου θείου (το πλαστικό θείο γίνεται εύθραυστο μετά από λίγες ώρες, αποκτά κίτρινο χρώμα και σταδιακά μετατρέπεται σε ρομβικό). 
1) ρομβικό - S 8
t°pl. = 113°C; r = 2,07 g/cm 3
Η πιο σταθερή τροποποίηση.
2) μονοκλινικές - σκούρες κίτρινες βελόνες
t°pl. = 119°C; r = 1,96 g/cm 3
Σταθερό σε θερμοκρασίες άνω των 96°C. υπό κανονικές συνθήκες μετατρέπεται σε ρομβικό.
3) πλαστική - καφέ λαστιχένια (άμορφη) μάζα
Ασταθής, όταν σκληραίνει μετατρέπεται σε ρομβικό
Λήψη θείου
- Η βιομηχανική μέθοδος είναι η τήξη του μεταλλεύματος με ατμό.
- Ατελής οξείδωση του υδρόθειου (με έλλειψη οξυγόνου):
2H 2 S + O 2 → 2S + 2H 2 O
- Η αντίδραση του Wackenroeder:
2H 2 S + SO 2 → 3S + 2H 2 O
Χημικές ιδιότητεςθείο
Οξειδωτικές ιδιότητες του θείου
(μικρό 0
+ 2ē→ μικρό -2
)
1) Το θείο αντιδρά με αλκαλικές ουσίες χωρίς θέρμανση:
S + O 2 – t° → S +4 O 2
2S + 3O 2 – t °; pt → 2S +6 O 3
4) (εκτός από ιώδιο):
S+Cl2 → S +2 Cl 2
S + 3F 2 → SF 6
Με σύνθετες ουσίες:
5) με οξέα - οξειδωτικά μέσα:
S + 2H 2 SO 4 (συμπ.) → 3S +4 O 2 + 2H 2 O
S + 6HNO 3 (συμπ.) → H 2 S + 6 O 4 + 6NO 2 + 2H 2 O
Αντιδράσεις δυσαναλογίας:
6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
7) Το θείο διαλύεται σε συμπυκνωμένο διάλυμα θειώδους νατρίου:
S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 θειοθειικό νάτριο


Το οξείδιο του θείου (IV) έχει όξινες ιδιότητες, οι οποίες εκδηλώνονται σε αντιδράσεις με ουσίες που παρουσιάζουν βασικές ιδιότητες. Οι όξινες ιδιότητες εμφανίζονται όταν αλληλεπιδρούν με το νερό. Αυτό παράγει ένα διάλυμα θειικού οξέος:
Ο βαθμός οξείδωσης του θείου στο αέριο διοξείδιο του θείου (+4) καθορίζει τις αναγωγικές και οξειδωτικές ιδιότητες του αερίου διοξειδίου του θείου:
vo-tel: S+4 – 2e => S+6
οκ-τηλ: S+4 + 4e => S0
Οι αναγωγικές ιδιότητες εκδηλώνονται σε αντιδράσεις με ισχυρούς οξειδωτικούς παράγοντες: οξυγόνο, αλογόνα, νιτρικό οξύ, υπερμαγγανικό κάλιο και άλλα. Για παράδειγμα:
2SO2 + O2 = 2SO3
S+4 – 2e => S+6 2
O20 + 4e => 2O-2 1
Με ισχυρούς αναγωγικούς παράγοντες, το αέριο παρουσιάζει οξειδωτικές ιδιότητες. Για παράδειγμα, εάν αναμίξετε διοξείδιο του θείου και υδρόθειο, αυτά αλληλεπιδρούν υπό κανονικές συνθήκες:
2H2S + SO2 = 3S + 2H2O
S-2 – 2e => S0 2
S+4 + 4e => S0 1
Το θειικό οξύ υπάρχει μόνο σε διάλυμα. Είναι ασταθές και αποσυντίθεται σε διοξείδιο του θείου και νερό. Το θειικό οξύ δεν ταξινομείται ως ισχυρά οξέα. Είναι οξύ μέτριας ισχύος και διασπάται σταδιακά. Όταν προστίθεται αλκάλιο στο θειικό οξύ, σχηματίζονται άλατα. Το θειικό οξύ παράγει δύο σειρές αλάτων: μέτρια - θειώδη και όξινα - υδροθειώδη.
Οξείδιο του θείου (VI).
Το τριοξείδιο του θείου παρουσιάζει όξινες ιδιότητες. Αντιδρά βίαια με το νερό, απελευθερώνοντας μεγάλη ποσότητα θερμότητας. Αυτή η αντίδραση χρησιμοποιείται για να ληφθεί το πιο σημαντικό προϊόν χημική βιομηχανία- θειικό οξύ.
SO3 + H2O = H2SO4
Δεδομένου ότι το θείο στο τριοξείδιο του θείου έχει υψηλοτερος ΒΑΘΜΟΣοξείδωση, τότε το οξείδιο του θείου (VI) παρουσιάζει οξειδωτικές ιδιότητες. Για παράδειγμα, οξειδώνει αλογονίδια, αμέταλλα με χαμηλή ηλεκτραρνητικότητα:
2SO3 + C = 2SO2 + CO2
S+6 + 2e => S+4 2
C0 – 4e => C+4 2
Το θειικό οξύ αντιδρά τρία είδη: οξεο-βάση, ανταλλαγή ιόντων, οξειδοαναγωγή. Επίσης, αλληλεπιδρά ενεργά με οργανικές ουσίες.
Αντιδράσεις οξέος-βάσης
Το θειικό οξύ εμφανίζει όξινες ιδιότητες σε αντιδράσεις με βάσεις και βασικά οξείδια. Αυτές οι αντιδράσεις γίνονται καλύτερα με αραιό θειικό οξύ. Δεδομένου ότι το θειικό οξύ είναι διβασικό, μπορεί να σχηματίσει τόσο ενδιάμεσα άλατα (θειικά) όσο και όξινα (υδροθειικά).
Αντιδράσεις ανταλλαγής ιόντων
Το θειικό οξύ χαρακτηρίζεται από αντιδράσεις ανταλλαγής ιόντων. Ταυτόχρονα, αλληλεπιδρά με διαλύματα αλάτων, σχηματίζοντας ένα ίζημα, ένα ασθενές οξύ ή απελευθερώνοντας αέριο. Αυτές οι αντιδράσεις συμβαίνουν με ταχύτερο ρυθμό εάν πάρετε 45% ή ακόμα περισσότερο αραιωμένο θειικό οξύ. Η έκλυση αερίου συμβαίνει σε αντιδράσεις με άλατα ασταθών οξέων, τα οποία αποσυντίθενται για να σχηματίσουν αέρια (ανθρακικό, διοξείδιο του θείου, υδρόθειο) ή για να σχηματίσουν πτητικά οξέα όπως το υδροχλωρικό οξύ.
Αντιδράσεις οξειδοαναγωγής
Το θειικό οξύ εκδηλώνει τις ιδιότητές του πιο καθαρά στις αντιδράσεις οξειδοαναγωγής, αφού στη σύνθεσή του το θείο έχει την υψηλότερη κατάσταση οξείδωσης +6. Οι οξειδωτικές ιδιότητες του θειικού οξέος μπορούν να ανιχνευθούν σε μια αντίδραση, για παράδειγμα, με χαλκό.
Υπάρχουν δύο οξειδωτικά στοιχεία σε ένα μόριο θειικού οξέος: ένα άτομο θείου με CO. +6 και ιόντα υδρογόνου Η+. Ο χαλκός δεν μπορεί να οξειδωθεί με το υδρογόνο στην κατάσταση οξείδωσης +1, αλλά το θείο μπορεί. Αυτός είναι ο λόγος για την οξείδωση ενός τόσο αδρανούς μετάλλου όπως ο χαλκός από το θειικό οξύ.
Η κατάσταση οξείδωσης +4 για το θείο είναι αρκετά σταθερή και εκδηλώνεται σε τετρααλογονίδια SHal 4, οξοδιαλογονίδια SOHal 2, διοξείδιο SO 2 και τα αντίστοιχα ανιόντα τους. Θα εξοικειωθούμε με τις ιδιότητες του διοξειδίου του θείου και του θειούχου οξέος.
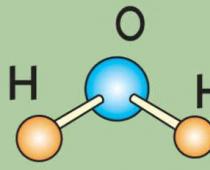
1.11.1. Οξείδιο του θείου (IV) Δομή του μορίου so2
Η δομή του μορίου SO 2 είναι παρόμοια με τη δομή του μορίου του όζοντος. Το άτομο θείου βρίσκεται σε κατάσταση υβριδισμού sp 2, το σχήμα των τροχιακών είναι ένα κανονικό τρίγωνο και το σχήμα του μορίου είναι γωνιακό. Το άτομο θείου έχει ένα μοναχικό ζεύγος ηλεκτρονίων. Το μήκος του δεσμού S–O είναι 0,143 nm και η γωνία δεσμού είναι 119,5°.
Η δομή αντιστοιχεί στις ακόλουθες δομές συντονισμού:
Σε αντίθεση με το όζον, η πολλαπλότητα του δεσμού S–O είναι 2, δηλαδή η κύρια συνεισφορά γίνεται από την πρώτη δομή συντονισμού. Το μόριο χαρακτηρίζεται από υψηλή θερμική σταθερότητα.
Φυσικές ιδιότητες
Υπό κανονικές συνθήκες, το διοξείδιο του θείου ή το διοξείδιο του θείου είναι ένα άχρωμο αέριο με έντονη αποπνικτική οσμή, σημείο τήξης -75 °C, σημείο βρασμού -10 °C. Είναι πολύ διαλυτό στο νερό στους 20 °C, 40 όγκοι διοξειδίου του θείου διαλύονται σε 1 όγκο νερού. Τοξικό αέριο.
Χημικές ιδιότητες του οξειδίου του θείου (IV).
Το διοξείδιο του θείου είναι εξαιρετικά δραστικό. Το διοξείδιο του θείου είναι ένα όξινο οξείδιο. Είναι αρκετά διαλυτό στο νερό για να σχηματίσει υδρίτες. Επίσης αντιδρά εν μέρει με το νερό, σχηματίζοντας ασθενές θειικό οξύ, το οποίο δεν απομονώνεται σε μεμονωμένη μορφή:
SO 2 + H 2 O = H 2 SO 3 = H + + HSO 3 - = 2H + + SO 3 2- .
Ως αποτέλεσμα της διάστασης, σχηματίζονται πρωτόνια, άρα το διάλυμα έχει όξινο περιβάλλον.
Όταν το αέριο διοξείδιο του θείου διέρχεται μέσω ενός διαλύματος υδροξειδίου του νατρίου, σχηματίζεται θειώδες νάτριο. Το θειώδες νάτριο αντιδρά με περίσσεια διοξειδίου του θείου για να σχηματίσει υδροθειώδες νάτριο:
2NaOH + SO 2 = Na 2 SO 3 + H 2 O;
Na 2 SO 3 + SO 2 = 2 NaHSO 3.
Το διοξείδιο του θείου χαρακτηρίζεται από δυαδικότητα οξειδοαναγωγής, για παράδειγμα, εμφανίζει αναγωγικές ιδιότητες και αποχρωματίζει το βρώμιο:
SO 2 + Br 2 + 2H 2 O = H 2 SO 4 + 2HBr
και διάλυμα υπερμαγγανικού καλίου:
5SO 2 + 2KMnO 4 + 2H 2 O = 2KНSO 4 + 2MnSO 4 + H 2 SO 4.
οξειδώνεται με οξυγόνο σε θειικό ανυδρίτη:
2SO 2 + O 2 = 2SO 3.
Παρουσιάζει οξειδωτικές ιδιότητες όταν αλληλεπιδρά με ισχυρούς αναγωγικούς παράγοντες, για παράδειγμα:
SO 2 + 2CO = S + 2CO 2 (στους 500 °C, παρουσία Al 2 O 3).
SO 2 + 2H 2 = S + 2H 2 O.
Παρασκευή οξειδίου του θείου (IV)
Καύση θείου στον αέρα
S + O 2 = SO 2.
Οξείδωση σουλφιδίου
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Επίδραση ισχυρών οξέων στα θειούχα μέταλλα
Na 2 SO 3 + 2H 2 SO 4 = 2NaHSO 4 + H 2 O + SO 2.
1.11.2. Θειικό οξύ και τα άλατά του
Όταν το διοξείδιο του θείου διαλύεται στο νερό, σχηματίζεται ασθενές θειικό οξύ, ο κύριος όγκος του διαλυμένου SO 2 έχει τη μορφή της ενυδατωμένης μορφής SO 2 ·H 2 O κατά την ψύξη, απελευθερώνεται επίσης κρυσταλλικό ένυδρο, αλλά όχι τα περισσότερα απόμόρια θειικού οξέος διασπώνται σε θειώδη και υδροθειώδη ιόντα. Στην ελεύθερη κατάσταση, το οξύ δεν απελευθερώνεται.
Όντας διβασικό, σχηματίζει δύο είδη αλάτων: μέτρια - θειώδη και όξινα - υδροθειώδη. Μόνο θειώδη άλατα αλκαλιμετάλλων και υδροθειώδη άλατα αλκαλίων και μετάλλων αλκαλικών γαιών διαλύονται στο νερό.
Στις διεργασίες οξειδοαναγωγής, το διοξείδιο του θείου μπορεί να είναι τόσο οξειδωτικός όσο και αναγωγικός παράγοντας επειδή το άτομο αυτής της ένωσης έχει μια ενδιάμεση κατάσταση οξείδωσης +4.
Πώς αντιδρά το SO 2 με ισχυρότερους αναγωγικούς παράγοντες, όπως:
SO 2 + 2H 2 S = 3S↓ + 2H 2 O
Πώς αντιδρά ο αναγωγικός παράγοντας SO 2 με ισχυρότερα οξειδωτικά μέσα, για παράδειγμα με παρουσία καταλύτη, με κ.λπ.:
2SO2 + O2 = 2SO3
SO 2 + Cl 2 + 2H 2 O = H 2 SO 3 + 2HCl
Παραλαβή
1) Το διοξείδιο του θείου σχηματίζεται όταν καίγεται το θείο:
2) Στη βιομηχανία λαμβάνεται με ψήσιμο πυρίτη:
3) Στο εργαστήριο, το διοξείδιο του θείου μπορεί να ληφθεί:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
Εφαρμογή
Το διοξείδιο του θείου χρησιμοποιείται ευρέως στην κλωστοϋφαντουργία για τη λεύκανση διαφόρων προϊόντων. Επιπλέον, χρησιμοποιείται στη γεωργία για την καταστροφή επιβλαβών μικροοργανισμών σε θερμοκήπια και κελάρια. Μεγάλες ποσότητες SO 2 χρησιμοποιούνται για την παραγωγή θειικού οξέος.
Οξείδιο του θείου (VI) – ΕΤΣΙ 3 (θειικός ανυδρίτης)
Ο θειικός ανυδρίτης SO 3 είναι ένα άχρωμο υγρό, το οποίο σε θερμοκρασίες κάτω των 17 o C μετατρέπεται σε λευκή κρυσταλλική μάζα. Απορροφά την υγρασία πολύ καλά (υγροσκοπικό).
Χημικές ιδιότητες
Οξεοβασικές ιδιότητες
Πώς αντιδρά ένα τυπικό οξείδιο οξέος, ο θειικός ανυδρίτης:
SO 3 + CaO = CaSO 4
γ) με νερό:
SO 3 + H 2 O = H 2 SO 4
Μια ιδιαίτερη ιδιότητα του SO 3 είναι η ικανότητά του να διαλύεται καλά στο θειικό οξύ. Ένα διάλυμα SO 3 σε θειικό οξύ ονομάζεται ελαϊκό.
Σχηματισμός ελαίου: H 2 SO 4 + n SO 3 = H 2 SO 4 ∙ nΛΟΙΠΟΝ 3
Ιδιότητες οξειδοαναγωγής
Το οξείδιο του θείου (VI) χαρακτηρίζεται από ισχυρές οξειδωτικές ιδιότητες (συνήθως ανάγεται σε SO 2):
3SO 3 + H 2 S = 4SO 2 + H 2 O
Παραλαβή και χρήση
Ο θειικός ανυδρίτης σχηματίζεται από την οξείδωση του διοξειδίου του θείου:
2SO2 + O2 = 2SO3
Καθαρός θειικός ανυδρίτης πρακτική σημασίαδεν έχει. Λαμβάνεται ως ενδιάμεσο προϊόν στην παραγωγή θειικού οξέος.
H2SO4
Η αναφορά του θειικού οξέος βρίσκεται για πρώτη φορά μεταξύ Άραβων και Ευρωπαίων αλχημιστών. Λήφθηκε με φρύξη θειικού σιδήρου (FeSO 4 ∙ 7H 2 O) στον αέρα: 2FeSO 4 = Fe 2 O 3 + SO 3 + SO 2 ή μείγμα με: 6KNO 3 + 5S = 3K 2 SO 4 + 2SO 3 + 3N 2, και οι απελευθερωμένοι ατμοί θειικού ανυδρίτη συμπυκνώθηκαν. Απορροφώντας την υγρασία, μετατράπηκαν σε ελαιόλαδο. Ανάλογα με τη μέθοδο παρασκευής, το H 2 SO 4 ονομαζόταν λάδι βιτριόλης ή θειούχο λάδι. Το 1595, ο αλχημιστής Andreas Liebavius καθιέρωσε την ταυτότητα και των δύο ουσιών.
Για πολύ καιρό, το λάδι βιτριόλης δεν χρησιμοποιήθηκε ευρέως. Το ενδιαφέρον γι' αυτό αυξήθηκε πολύ μετά τον 18ο αιώνα. Ανακαλύφθηκε η διαδικασία λήψης της καρμίνης indigo, μιας σταθερής μπλε χρωστικής, από το indigo. Το πρώτο εργοστάσιο παραγωγής θειικού οξέος ιδρύθηκε κοντά στο Λονδίνο το 1736. Η διαδικασία γινόταν σε θαλάμους μολύβδου, στον πυθμένα των οποίων χυνόταν νερό. Ένα λιωμένο μείγμα άλατος και θείου κάηκε στο πάνω μέρος του θαλάμου και στη συνέχεια εισήχθη αέρας σε αυτό. Η διαδικασία επαναλήφθηκε μέχρις ότου σχηματίστηκε ένα οξύ της απαιτούμενης συγκέντρωσης στον πυθμένα του δοχείου.
Τον 19ο αιώνα η μέθοδος βελτιώθηκε: αντί για αλάτι, άρχισαν να χρησιμοποιούν νιτρικό οξύ (δίνει όταν αποσυντίθεται στον θάλαμο). Για την επιστροφή των νιτρωδών αερίων στο σύστημα, κατασκευάστηκαν ειδικοί πύργοι, που έδωσαν το όνομα στην όλη διαδικασία - διαδικασία πύργου. Τα εργοστάσια που λειτουργούν με τη μέθοδο του πύργου εξακολουθούν να υπάρχουν σήμερα.

Το θειικό οξύ είναι ένα βαρύ ελαιώδες υγρό, άχρωμο και άοσμο, υγροσκοπικό. διαλύεται καλά στο νερό. Όταν το πυκνό θειικό οξύ διαλύεται στο νερό, απελευθερώνεται μεγάλη ποσότητα θερμότητας, οπότε πρέπει να χυθεί προσεκτικά στο νερό (και όχι το αντίστροφο!) και να αναμειχθεί το διάλυμα.
Ένα διάλυμα θειικού οξέος σε νερό με περιεκτικότητα σε H 2 SO 4 μικρότερη από 70% ονομάζεται συνήθως αραιό θειικό οξύ και ένα διάλυμα άνω του 70% είναι πυκνό θειικό οξύ.
Χημικές ιδιότητες
Οξεοβασικές ιδιότητες
Το αραιό θειικό οξύ αποκαλύπτει τα πάντα χαρακτηριστικές ιδιότητεςισχυρά οξέα. Εκείνη αντιδρά:
H 2 SO 4 + NaOH = Na 2 SO 4 + 2H 2 O
H 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2HCl
Η διαδικασία αλληλεπίδρασης ιόντων Ba 2+ με θειικά ιόντα SO 4 2+ οδηγεί στο σχηματισμό ενός λευκού αδιάλυτου ιζήματος BaSO 4 . Αυτό ποιοτική αντίδρασησε θειικό ιόν.
Ιδιότητες οξειδοαναγωγής
Στο αραιό H 2 SO 4 οι οξειδωτικοί παράγοντες είναι ιόντα H + και στο συμπυκνωμένο H 2 SO 4 οι οξειδωτικοί παράγοντες είναι θειικά ιόντα SO 4 2 +. Τα ιόντα SO 4 2+ είναι ισχυρότεροι οξειδωτικοί παράγοντες από τα ιόντα H + (βλ. διάγραμμα). 
ΣΕ αραιό θειικό οξύμέταλλα που βρίσκονται στην ηλεκτροχημική σειρά τάσης διαλύονται στο υδρογόνο. Σε αυτή την περίπτωση, σχηματίζονται θειικά άλατα μετάλλων και απελευθερώνονται τα ακόλουθα:
Zn + H 2 SO 4 = ZnSO 4 + H 2
Μέταλλα που βρίσκονται μετά το υδρογόνο στην ηλεκτροχημική σειρά τάσης δεν αντιδρούν με αραιό θειικό οξύ:
Cu + H 2 SO 4 ≠
Συμπυκνωμένο θειικό οξύείναι ένας ισχυρός οξειδωτικός παράγοντας, ειδικά όταν θερμαίνεται. Οξειδώνει πολλές και κάποιες οργανικές ουσίες.
Όταν το πυκνό θειικό οξύ αλληλεπιδρά με μέταλλα που βρίσκονται μετά το υδρογόνο στην ηλεκτροχημική σειρά τάσης (Cu, Ag, Hg), σχηματίζονται θειικά άλατα μετάλλων, καθώς και το προϊόν αναγωγής του θειικού οξέος - SO 2.
 Αντίδραση θειικού οξέος με ψευδάργυρο
Αντίδραση θειικού οξέος με ψευδάργυρο Με πιο ενεργά μέταλλα (Zn, Al, Mg), το πυκνό θειικό οξύ μπορεί να αναχθεί σε ελεύθερο θειικό οξύ. Για παράδειγμα, όταν το θειικό οξύ αντιδρά με, ανάλογα με τη συγκέντρωση του οξέος, διάφορα προϊόντα αναγωγής του θειικού οξέος - SO 2, S, H 2 S - μπορούν να σχηματιστούν ταυτόχρονα:
Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O
3Zn + 4H 2 SO 4 = 3ZnSO 4 + S↓ + 4H 2 O
4Zn + 5H 2 SO 4 = 4ZnSO 4 + H 2 S + 4H 2 O
Στο κρύο, το συμπυκνωμένο θειικό οξύ παθητικοποιεί ορισμένα μέταλλα, για παράδειγμα και έτσι μεταφέρεται σε σιδερένιες δεξαμενές:
Fe + H 2 SO 4 ≠
Το πυκνό θειικό οξύ οξειδώνει ορισμένα αμέταλλα (, κ.λπ.), ανάγεται σε οξείδιο του θείου (IV) SO 2:
S + 2H 2 SO 4 = 3SO 2 + 2H 2 O
C + 2H 2 SO 4 = 2SO 2 + CO 2 + 2H 2 O
Παραλαβή και χρήση

Στη βιομηχανία, το θειικό οξύ παράγεται με τη μέθοδο επαφής. Η διαδικασία λήψης γίνεται σε τρία στάδια:
- Λήψη SO 2 με ψήσιμο πυρίτη:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
- Οξείδωση SO 2 σε SO 3 παρουσία καταλύτη – οξειδίου βαναδίου (V):
2SO2 + O2 = 2SO3
- Διάλυση SO 3 σε θειικό οξύ:
H2SO4+ n SO 3 = H 2 SO 4 ∙ nΛΟΙΠΟΝ 3
Το ελαιόλαδο που προκύπτει μεταφέρεται σε σιδερένιες δεξαμενές. Το θειικό οξύ της απαιτούμενης συγκέντρωσης λαμβάνεται από το ελαιόλαδο προσθέτοντάς το σε νερό. Αυτό μπορεί να εκφραστεί με ένα διάγραμμα:
H2SO4∙ n SO 3 + H 2 O = H 2 SO 4
Το θειικό οξύ έχει ποικίλες χρήσεις σε ένα ευρύ φάσμα εφαρμογών Εθνική οικονομία. Χρησιμοποιείται για την ξήρανση αερίων, στην παραγωγή άλλων οξέων, για την παραγωγή λιπασμάτων, διαφόρων βαφών και φαρμάκων.
Άλατα θειικού οξέος

Τα περισσότερα θειικά άλατα είναι πολύ διαλυτά στο νερό (το CaSO 4 είναι ελαφρώς διαλυτό, το PbSO 4 είναι ακόμη λιγότερο διαλυτό και το BaSO 4 είναι πρακτικά αδιάλυτο). Ορισμένα θειικά άλατα που περιέχουν νερό κρυστάλλωσης ονομάζονται βιτριόλια:
CuSO 4 ∙ 5H 2 O θειικός χαλκός
FeSO 4 ∙ 7H 2 O θειικός σίδηρος
Όλοι έχουν άλατα θειικού οξέος. Η σχέση τους με τη θερμότητα είναι ιδιαίτερη.
Θειικά ενεργά μέταλλα( , ) δεν αποσυντίθενται ακόμη και στους 1000 o C, ενώ άλλα (Cu, Al, Fe) αποσυντίθενται μετά από ελαφρά θέρμανση σε οξείδιο μετάλλου και SO 3:
CuSO 4 = CuO + SO 3
Κατεβάστε:
Κατεβάστε δωρεάν μια περίληψη για το θέμα: «Παραγωγή θειικού οξέος με μέθοδο επαφής»
Μπορείτε να κατεβάσετε περιλήψεις για άλλα θέματα
*στην εικόνα εγγραφής υπάρχει φωτογραφία θειικού χαλκού
Το οξείδιο του θείου (IV) έχει όξινες ιδιότητες, οι οποίες εκδηλώνονται σε αντιδράσεις με ουσίες που παρουσιάζουν βασικές ιδιότητες. Οι όξινες ιδιότητες εμφανίζονται όταν αλληλεπιδρούν με το νερό. Αυτό παράγει ένα διάλυμα θειικού οξέος:
Ο βαθμός οξείδωσης του θείου στο αέριο διοξείδιο του θείου (+4) καθορίζει τις αναγωγικές και οξειδωτικές ιδιότητες του αερίου διοξειδίου του θείου:
Αυτά τα ένζυμα μπορεί να μην απενεργοποιηθούν πλήρως κατά την επεξεργασία του χυμού επειδή η υψηλή περιεκτικότητα σε κυτταρίνη που γενικά βρίσκεται στους χυμούς τροπικών φρούτων καθιστά δύσκολη τη θερμική αδρανοποίηση αυτών των ενζύμων. Η προσθήκη θειώδους άλατος αποτρέπει την καταστροφή του ασκορβικού οξέος κατά την επεξεργασία και αποθήκευση του προϊόντος, αποφεύγοντας την οξείδωση που προκαλείται από τα ένζυμα της οξειδάσης του ασκορβικού οξέος 13.
Έλεγχος της μη ενζυματικής αμαύρωσης. Οι χυμοί φρούτων έχουν συγκεκριμένα χαρακτηριστικά χρώματος, γεύσης και αρώματος. Αυτά τα χαρακτηριστικά τείνουν να τροποποιούνται κατά την επεξεργασία και την αποθήκευση, οδηγώντας σε συνολική υποβάθμιση του προϊόντος. Οι τρεις πιο σημαντικοί μη ενζυματικοί μηχανισμοί σκουρότητας στους χυμούς φρούτων είναι: 1 - η αντίδραση Maillard, η οποία συμβαίνει μεταξύ των αναγωγικών σακχάρων και των γ-αμινο ομάδων αμινοξέων, πεπτιδίων και πρωτεϊνών, με αποτέλεσμα το σχηματισμό μελανοιδινών. 2 - οξείδωση ασκορβικού οξέος σε φουρφουράλη και άλφα-κετογουλονικό οξύ, τα οποία σχηματίζουν σκούρες καφέ χρωστικές παρουσία ενώσεων αζώτου. εκτός από τη δημιουργία απλού πολυμερισμού σχηματίζονται φουρφουροειδή ανοιχτό καφέ χρωστικές? 3 - καραμελοποίηση των σακχάρων, η οποία συμβαίνει υπό τη δράση οξέων στα σάκχαρα, η οποία οδηγεί στον σχηματισμό υδροξυμεθυλοφουρφουράλης, η οποία πολυμερίζει το σχηματισμό μελανοειδινών, καφέ χρωστικές 47.
vo-tel: S+4 – 2e => S+6
οκ-τηλ: S+4 + 4e => S0
Οι αναγωγικές ιδιότητες εκδηλώνονται σε αντιδράσεις με ισχυρούς οξειδωτικούς παράγοντες: οξυγόνο, αλογόνα, νιτρικό οξύ, υπερμαγγανικό κάλιο και άλλα. Για παράδειγμα:
2SO2 + O2 = 2SO3
S+4 – 2e => S+6 2
O20 + 4e => 2O-2 1
Με ισχυρούς αναγωγικούς παράγοντες, το αέριο παρουσιάζει οξειδωτικές ιδιότητες. Για παράδειγμα, εάν αναμίξετε διοξείδιο του θείου και υδρόθειο, αυτά αλληλεπιδρούν υπό κανονικές συνθήκες:
Οι μη ενζυματικές αντιδράσεις σκουρότητας οδηγούν στην καταστροφή θρεπτικών συστατικών όπως απαραίτητα αμινοξέα και ασκορβικό οξύ, μειώνουν την πεπτικότητα των πρωτεϊνών, αναστέλλουν τη δράση των πεπτικών ενζύμων και παρεμβαίνουν στην απορρόφηση μετάλλων προάγοντας τη συμπλοκοποίηση των μεταλλικών ιόντων. Μπορούν να σχηματιστούν δυνητικά τοξικά μεταλλαξιογόνα προϊόντα λόγω της αντίδρασης Maillard 19.
Γενικά, η μη ενζυματική αμαύρωση μπορεί να ανασταλεί ή να ελεγχθεί διαφορετικοί τρόποιχρησιμοποιώντας χαμηλές θερμοκρασίεςαποθήκευση με αφαίρεση οξυγόνου από τη συσκευασία και χρήση χημικών αναστολέων όπως τα θειώδη 47. Το διοξείδιο του θείου είναι ίσως το πιο αποτελεσματικό μη ενζυματικό μαύρισμα στα τρόφιμα 10.
2H2S + SO2 = 3S + 2H2O
S-2 – 2e => S0 2
S+4 + 4e => S0 1
Το θειικό οξύ υπάρχει μόνο σε διάλυμα. Είναι ασταθές και αποσυντίθεται σε διοξείδιο του θείου και νερό. Το θειικό οξύ δεν είναι ισχυρό οξύ. Είναι οξύ μέτριας ισχύος και διασπάται σταδιακά. Όταν προστίθεται αλκάλιο στο θειικό οξύ, σχηματίζονται άλατα. Το θειικό οξύ παράγει δύο σειρές αλάτων: μέτρια - θειώδη και όξινα - υδροθειώδη.
Ο χημικός μηχανισμός με τον οποίο το διοξείδιο του θείου αναστέλλει το μη ενζυματικό μαύρισμα δεν είναι πλήρως κατανοητός και πιστεύεται ότι είναι μια αντίδραση του διθειώδους με τις ενεργές καρβονυλικές ομάδες των μορίων σακχάρου και της βιταμίνης C 10. Το θειώδες άλας αλληλεπιδρά με διάφορα συστατικά που υπάρχουν στα τρόφιμα, όπως: σάκχαρα, αλδεΰδες, κετόνες, πρωτεΐνες και ανθοκυανίνες 53 και τα θειώδη στη δεσμευμένη μορφή τους μειώνονται στα όξινα τρόφιμα. Η έκταση της αντίδρασης εξαρτάται από το pH, τη θερμοκρασία, τη συγκέντρωση θειώδους και τα δραστικά συστατικά που υπάρχουν στο προϊόν.
Οξείδιο του θείου (VI).
Το τριοξείδιο του θείου παρουσιάζει όξινες ιδιότητες. Αντιδρά βίαια με το νερό, απελευθερώνοντας μεγάλη ποσότητα θερμότητας. Αυτή η αντίδραση χρησιμοποιείται για την παραγωγή του πιο σημαντικού προϊόντος της χημικής βιομηχανίας - θειικού οξέος.
SO3 + H2O = H2SO4
Δεδομένου ότι το θείο στο τριοξείδιο του θείου έχει την υψηλότερη κατάσταση οξείδωσης, το οξείδιο του θείου (VI) παρουσιάζει οξειδωτικές ιδιότητες. Για παράδειγμα, οξειδώνει αλογονίδια, αμέταλλα με χαμηλή ηλεκτραρνητικότητα:
Μία από τις αρχές που διέπουν τη χρήση πρόσθετα τροφίμων, είναι η ασφάλειά τους, αλλά είναι αδύνατο να προσδιοριστεί απόλυτη απόδειξη της τοξικότητάς τους για όλους τους ανθρώπους. Οι τοξικολογικές δοκιμές αναφέρονται σε φυσιολογικές επιδράσεις σε πειραματόζωα σε σχέση με έναν ορισμένο ρυθμό κατάποσης.
Αυτή η ομάδα κατέληξε στο συμπέρασμα ότι τα θειώδη δεν είναι τερατογόνα, μεταλλαξιογόνα ή καρκινογόνα σε πειραματόζωα. Επίσης, δεν βρήκαν σημαντικά τοξικολογικά ή μεταβολικά δεδομένα 54. Τα θειώδη ήταν δημοφιλή στους ιδιοκτήτες εστιατορίων για χρήση σε σαλάτες επειδή περιείχαν φρέσκα φρέσκα φρούτα και λαχανικά, αλλά η χρήση τους απαγορεύτηκε μετά από επικίνδυνες αλλεργικές αντιδράσεις σε μερικούς ανθρώπους. Κατά συνέπεια, σε πολλά προϊόντα μόνο ένα μικρό ποσοστό του προστιθέμενου θειώδους παραμένει σε ελεύθερη μορφή στο τελικό προϊόν 18.
2SO3 + C = 2SO2 + CO2
S+6 + 2e => S+4 2
C0 – 4e => C+4 2
Το θειικό οξύ υφίσταται τρεις τύπους αντιδράσεων: οξέος-βάσης, ανταλλαγής ιόντων και οξειδοαναγωγής. Επίσης, αλληλεπιδρά ενεργά με οργανικές ουσίες.
Αντιδράσεις οξέος-βάσης
Το θειικό οξύ εμφανίζει όξινες ιδιότητες σε αντιδράσεις με βάσεις και βασικά οξείδια. Αυτές οι αντιδράσεις γίνονται καλύτερα με αραιό θειικό οξύ. Δεδομένου ότι το θειικό οξύ είναι διβασικό, μπορεί να σχηματίσει τόσο ενδιάμεσα άλατα (θειικά) όσο και όξινα (υδροθειικά).
Ο βιομετασχηματισμός του θειώδους συνίσταται στην οξείδωσή του σε θειικό με τη δράση του ενζύμου θειώδη οξειδάση που βρίσκεται στα μιτοχόνδρια που υπάρχουν στους ιστούς, κυρίως στην καρδιά, το ήπαρ και τα νεφρά. Στο ανθρώπινο σώμα, αυτό το ένζυμο μετατρέπει επίσης τα αμινοξέα του θείου σε θειώδη. Αυτή η φυσιολογική μεταβολική διαδικασία ελέγχει την περίσσεια αυτών των αμινοξέων οξειδώνοντάς τα σε θειικά άλατα, τα οποία αποβάλλονται εύκολα. Σε όλα τα είδη που μελετήθηκαν, το μεγαλύτερο μέρος του θειώδους άλατος που καταναλώνεται απεκκρίνεται ταχέως ως θειικό, το οποίο μπορεί να αντιδράσει με πρωτεΐνες για να σχηματίσει ένα σύμπλεγμα πρωτεΐνης-θειοσουλφονικού που μπορεί να συγκρατηθεί στο σώμα.
Αντιδράσεις ανταλλαγής ιόντων
Το θειικό οξύ χαρακτηρίζεται από αντιδράσεις ανταλλαγής ιόντων. Ταυτόχρονα, αλληλεπιδρά με διαλύματα αλάτων, σχηματίζοντας ένα ίζημα, ένα ασθενές οξύ ή απελευθερώνοντας αέριο. Αυτές οι αντιδράσεις συμβαίνουν με ταχύτερο ρυθμό εάν λάβετε 45% ή ακόμα περισσότερο αραιό θειικό οξύ. Η έκλυση αερίου συμβαίνει σε αντιδράσεις με άλατα ασταθών οξέων, τα οποία αποσυντίθενται για να σχηματίσουν αέρια (ανθρακικό, διοξείδιο του θείου, υδρόθειο) ή για να σχηματίσουν πτητικά οξέα όπως το υδροχλωρικό οξύ.
Τα ασθματικά άτομα και τα άτομα με ανεπάρκεια θειώδους οξειδάσης ανέχονται έως και μια ορισμένη ποσότητα θειώδους άλατος χωρίς να είναι ευαίσθητα. Υπάρχει ένα άλλο μη ειδικό ένζυμο που οξειδώνει επίσης θειώδες σε θειικό, την οξειδάση της ξανθίνης 21. Σύμφωνα με τον Taylor 19, η μόνη αρνητική επίδραση που σχετίζεται με την ευαισθησία στα θειώδη είναι το άσθμα, αν και μόνο ένα μικρό ποσοστό ασθματικών είναι ευαίσθητα στα θειώδη.
Πρόσθετο τροφίμων είναι κάθε πρόσθετο που προστίθεται σκόπιμα σε ένα τρόφιμο, χωρίς διατροφικό σκοπό, με σκοπό την αλλαγή των φυσικών, χημικών, βιολογικών ή αισθητηριακών χαρακτηριστικών κατά την παραγωγή, επεξεργασία, προετοιμασία, χειρισμό, συσκευασία, αποθήκευση, μεταφορά ή χειρισμό των τροφίμων 59 Ωστόσο, η έννοια του συμπληρώματος διατροφής ποικίλλει πολύ από χώρα σε χώρα. Μια μεμονωμένη ουσία μπορεί να χρησιμοποιηθεί ως πρόσθετο σε μια χώρα και να απαγορευτεί σε μια άλλη 60.
Αντιδράσεις οξειδοαναγωγής
Το θειικό οξύ εκδηλώνει τις ιδιότητές του πιο καθαρά στις αντιδράσεις οξειδοαναγωγής, αφού στη σύνθεσή του το θείο έχει την υψηλότερη κατάσταση οξείδωσης +6. Οι οξειδωτικές ιδιότητες του θειικού οξέος μπορούν να ανιχνευθούν σε μια αντίδραση, για παράδειγμα, με χαλκό.
Υπάρχουν δύο οξειδωτικά στοιχεία σε ένα μόριο θειικού οξέος: ένα άτομο θείου με CO. +6 και ιόντα υδρογόνου Η+. Ο χαλκός δεν μπορεί να οξειδωθεί με το υδρογόνο στην κατάσταση οξείδωσης +1, αλλά το θείο μπορεί. Αυτός είναι ο λόγος για την οξείδωση ενός τόσο αδρανούς μετάλλου όπως ο χαλκός από το θειικό οξύ.
Στη Βραζιλία, τα πρόσθετα ταξινομούνται σε 23 λειτουργικές κατηγορίες, μεταξύ των οποίων είναι τα συντηρητικά, τα οποία ορίζονται ως ουσίες που εμποδίζουν ή καθυστερούν τις αλλαγές στα τρόφιμα που προκαλούνται από μικροοργανισμούς ή ένζυμα. Το διοξείδιο του θείου και τα παράγωγά του ταξινομούνται ως συντηρητικά 59.
Ωστόσο, στη συγκεκριμένη περίπτωση του χυμού κάσιους, είναι απαραίτητο να χρησιμοποιήσετε περισσότερο υψηλά επίπεδαδιοξείδιο του θείου σε σχέση με άλλους χυμούς φρούτων για να αποφευχθεί το σκουρόχρωμο και η απώλεια αρώματος, γεύσης και θρεπτικής αξίας. Η συντήρηση των χυμών τροπικών φρούτων με προσθήκη διοξειδίου του θείου ακολουθούμενη από θερμική επεξεργασία είναι η μέθοδος που χρησιμοποιείται περισσότερο στις βιομηχανίες επεξεργασίας, καθώς αυτό το πρόσθετο έχει αποδειχθεί αποτελεσματικό στον έλεγχο των μικροοργανισμών και στην ενζυματική και μη ενζυματική αμαύρωση, η οποία έχει συμβάλει σημαντικά στη διατήρηση της ποιότητας των επεξεργασμένων χυμών για μεγαλύτερο χρονικό διάστημα.
Σε αραιά διαλύματα θειικού οξέος, ο οξειδωτικός παράγοντας είναι κυρίως το ιόν υδρογόνου H+. Στα συμπυκνωμένα διαλύματα, ιδιαίτερα στα θερμά, οι οξειδωτικές ιδιότητες του θείου κυριαρχούν στην κατάσταση οξείδωσης +6.
Χρειάζεστε βοήθεια με τις σπουδές σας;
Προηγούμενο θέμα: Χημικές ιδιότητες οξυγόνου και θείου: αντιδράσεις με μέταλλα και αμέταλλαΕπόμενο θέμα: Ιδιότητες σύνθετες ουσίεςπου περιέχει άζωτο: οξείδια του αζώτου
Είναι γνωστές αρκετές αλλοτροπικές τροποποιήσεις του θείου - ρομβικό, μονοκλινικό και πλαστικό θείο. Η πιο σταθερή τροποποίηση είναι το ρομβικό θείο, όλες οι άλλες τροποποιήσεις μετατρέπονται αυθόρμητα σε αυτό μετά από κάποιο χρονικό διάστημα.
Επιπλέον, αυτό το πρόσθετο θεωρείται τοξικολογικά ασφαλές, υπό την προϋπόθεση ότι δεν υπερβαίνει τα όρια που επιτρέπονται από τη νομοθεσία της Βραζιλίας. Νικητές ποτών: η χρήση αμινοξέων και πεπτιδίων στην αθλητική διατροφή. Λειτουργικά τρόφιμα: η ιαπωνική προσέγγιση.
Σύγχρονη διατροφή σε υγεία και ασθένειες. 8η έκδ. Ένωση Επεξεργασίας Τροπικών Φρούτων. Έκθεση εξαγωγής χυμού φρούτων. Επετηρίδα του Βραζιλιάνου Γεωργία. Θειώδη πρόσθετα τροφίμων: να απαγορευτούν ή όχι; Ανασκόπηση των θειωδών στα τρόφιμα: αναλυτική μεθοδολογία και δημοσιευμένα αποτελέσματα.
Το θείο μπορεί να δώσει τα ηλεκτρόνια του όταν αλληλεπιδρά με ισχυρότερους οξειδωτικούς παράγοντες:
Σε αυτές τις αντιδράσεις, το θείο είναι ο αναγωγικός παράγοντας.
Πρέπει να τονιστεί ότι το οξείδιο του θείου (VI) μπορεί να σχηματιστεί μόνο παρουσία ή σε υψηλή πίεση (βλ. παρακάτω).
Όταν αλληλεπιδρά με μέταλλα, το θείο παρουσιάζει οξειδωτικές ιδιότητες:
Μικροβιολογία χυμών, κυτταρίνης και όξινων προϊόντων. Αλληλεπιδράσεις προσθέτων τροφίμων και πρόσθετων που περιλαμβάνουν διοξείδιο του θείου, ασκορβικό και νιτρώδες οξέα - μια ανασκόπηση. Αντιμικροβιακά πρόσθετα τροφίμων: Χαρακτηριστικά αποτελέσματα χρήσης. 2η έκδ. Μαύρισμα προϊόντων: έλεγχος με θειώδη, αντιοξειδωτικά και άλλα μέσα.
Χημική συντήρηση των τροφίμων. Παράγοντες που επηρεάζουν το θάνατο της ζύμης από το διοξείδιο του θείου. Χημικά συντηρητικά σε προϊόντα διατροφής. Χημεία Τροφίμων: Μηχανισμοί και Θεωρία. Πρόσθετα για τρόφιμα από τοξικολογική άποψη. 2η έκδ. Απολύμανση, αποστείρωση και συντήρηση.
Το θείο αντιδρά με τα περισσότερα μέταλλα όταν θερμαίνεται, αλλά στην αντίδραση με τον υδράργυρο η αλληλεπίδραση συμβαίνει ήδη σε θερμοκρασία δωματίου.
Αυτή η περίσταση χρησιμοποιείται σε εργαστήρια για την απομάκρυνση του χυμένου υδραργύρου, οι ατμοί του οποίου είναι ισχυρό δηλητήριο.
Βενζοϊκό νάτριο και βενζοϊκό οξύ. Νέα Υόρκη: Marcel Dekker; Με. 11. Συντηρητικό βενζοϊκό οξύ και σορβικό οξύ. Τρέχουσα και μελλοντική χρήση παραδοσιακών αντιμικροβιακών. Βρωματολογικές και τοξικολογικές πτυχές της βενζοΐνης και των σορβικών συντηρητικών.
Ένζυμα και χρωστικές: επιρροή και αλλαγές κατά την επεξεργασία. Οδηγός εκβιομηχάνισης φρούτων. Βιοχημεία τροπικών φρούτων. Μερικές τεχνολογικές πτυχές των τροπικών φρούτων και των προϊόντων τους. Συμπεριφορά πολυφαινολοοξειδασών σε προϊόντα διατροφής. Φαινολικές ενώσεις και οξειδάση πολυφαινόλης σε σχέση με το ψήσιμο σε σταφύλια και κρασιά.
Υδρόθειο, υδροσουλφιδικό οξύ, σουλφίδια.
Όταν το θείο θερμαίνεται με υδρογόνο, εμφανίζεται μια αναστρέψιμη αντίδραση
με πολύ χαμηλή απόδοση υδρόθειου. Συνήθως παρασκευάζεται με τη δράση αραιών οξέων στα σουλφίδια:
Το υδρόθειο είναι ένα άχρωμο αέριο με τη μυρωδιά σάπιων αυγών και είναι δηλητηριώδες. Ένας όγκος νερού σε κανονικές συνθήκες διαλύει 3 όγκους υδρόθειου.
Φυσική και χημικές μεθόδους, χρησιμοποιείται για τον έλεγχο του ενζυματικού μαυρίσματος των λαχανικών. Ενζυματικές αντιδράσεις φρυγανίσματος σε μήλα και προϊόντα μήλου. Πολυφαινολοοξειδάση και υπεροξειδάση σε φρούτα και λαχανικά. Μηχανισμός αναστολής θειώδους μαύρισμα που προκαλείται από οξειδάση πολυφαινόλης.
Η επίδραση του διοξειδίου του θείου στα οξειδωτικά ενζυμικά συστήματα στους φυτικούς ιστούς. Πολυφαινολοοξειδάσες στα φυτά. Κινητική μελέτη της μη αναστρέψιμης αναστολής ενός ενζύμου από έναν αναστολέα που καθίσταται ασταθής από την ενζυμική κατάλυση. Βιοχημεία των φρούτων και η επίδραση τους στην επεξεργασία. Επεξεργασία φρούτων: διατροφή, προϊόντα και διαχείριση ποιότητας. 2η έκδ.
Το υδρόθειο είναι ένας τυπικός αναγωγικός παράγοντας. Καίγεται σε οξυγόνο (βλ. παραπάνω). Ένα διάλυμα υδρόθειου σε νερό είναι πολύ αδύναμο υδροσουλφιδικό οξύ, το οποίο διαχωρίζει σταδιακά και κυρίως σύμφωνα με το πρώτο βήμα:

Το υδρόθειο οξύ, όπως και το υδρόθειο, είναι ένας τυπικός αναγωγικός παράγοντας.
Υγειονομικός έλεγχος προϊόντων διατροφής. 2η έκδ. Συντηρητικά: εναλλακτικές μέθοδοι καταπολέμησης βακτηρίων. Οι τοξικοί παράγοντες εισέρχονται απευθείας στα τρόφιμα. Σάο Πάολο: Βαρέλα; R. 61. Χημεία τροφίμων: θεωρία και πράξη. 1η έκδ. Ομοσπονδία Αμερικανικών Εταιρειών Πειραματικής Βιολογίας.
Ασφάλεια τροφίμων και τεχνολογία τροφίμων. Διατροφή: Έννοιες και αντιπαραθέσεις. 8η έκδ. Σήμανση τροφίμων: δήλωση σουλφονωτικών παραγόντων. Εκτίμηση περιεκτικότητας σε διοξείδιο του θείου και μικροβιολογικής ποιότητας κονσερβοποιημένων μανιταριών. Χημεία σουλφονωτικών παραγόντων στα τρόφιμα.
Το υδρόθειο οξειδώνεται όχι μόνο από ισχυρούς οξειδωτικούς παράγοντες, όπως το χλώριο,
αλλά και πιο αδύναμα, για παράδειγμα θειικό οξύ
ή ιόντα σιδήρου:
Το υδρόθειο οξύ μπορεί να αντιδράσει με βάσεις, βασικά οξείδια ή άλατα, σχηματίζοντας δύο σειρές αλάτων: μέτρια - σουλφίδια, όξινα - υδροσουλφίδια.
Το υπ’ αριθμ. 540 διάταγμα του Υπουργείου Υγείας. Εγκρίνει Τεχνικό Κανονισμό: Πρόσθετα τροφίμων - ορισμοί, ταξινόμηση και απασχόληση. Νομοθεσία για τα πρόσθετα τροφίμων. Ψήφισμα αρ. 04 Εθνικό Συμβούλιοφροντίδα υγείας. Ψήφισμα 12 της Εθνικής Υπηρεσίας Υγειονομικής Επιτήρησης.
Επίσης, ο Πέρσης αλχημιστής Al-Razi πιστώνεται με τις πρώτες περιγραφές αυτής της ουσίας. Περαιτέρω βελτιώσεις σε αυτή τη διαδικασία από τον Γάλλο χημικό Gay-Lussac και τον Βρετανό χημικό John Glover βελτίωσαν τη συγκέντρωση του προκύπτοντος οξέος. Η ιστορία του θειικού οξέος συζητείται λεπτομερέστερα στο άρθρο μας.
Τα περισσότερα σουλφίδια (εκτός από αλκάλια και μέταλλα αλκαλικών γαιών, καθώς και το θειούχο αμμώνιο) είναι ελάχιστα διαλυτό στο νερό. Τα σουλφίδια, ως άλατα ενός πολύ ασθενούς οξέος, υφίστανται υδρόλυση.
Οξείδιο του θείου(IV). Θειώδες οξύ.
Το SO2 σχηματίζεται όταν το θείο καίγεται σε οξυγόνο ή όταν τα σουλφίδια καβουρδίζονται. είναι ένα άχρωμο αέριο με έντονη οσμή, εξαιρετικά διαλυτό στο νερό (40 όγκοι σε 1 όγκο νερού στους 20 ° C).
Γεωλογία, κλιματολογία και αστροφυσική
Το ιστορικό της απόκτησης των πιο χρήσιμων χημικών ουσιών. Το θειικό οξύ σχηματίζεται φυσικά λόγω των εκπομπών από ηφαίστεια, τα οποία παράγουν διοξείδιο του θείου, το οποίο οξειδώνεται στην ατμόσφαιρα και στη συνέχεια αντιδρά με την υγρασία του αέρα. Σχηματίζεται επίσης σε φυσαλίδες σε υδάτινα σώματα κοντά σε ηφαιστειακή δραστηριότητα και λίμνες που σχηματίζονται μέσα σε ηφαιστειακούς κρατήρες.
Σχηματίζεται επίσης μαζί με υδροχλώριο και επομένως υδροχλωρικό οξύ όταν η ηφαιστειακή λάβα έρχεται σε επαφή με θαλασσινό νερό. Σύννεφα ατμών που περιέχουν θειικό οξύ. Αυτοί οι υδρίτες είναι πιθανό να εμφανίζονται στη στρατόσφαιρα της Γης και μπορεί να παρέχουν τοποθεσίες για τη συμπύκνωση των νεφών πάγου σε μεγάλο υψόμετρο που μπορούν να επηρεάσουν σημαντικά το κλίμα της Γης, ειδικά μετά από ηφαιστειακές εκρήξεις όταν μεγάλες ποσότητες θείου εναποτίθενται στην παραπάνω ατμόσφαιρα. Ειδικότερα, η περιοχή που μελετήθηκε καθαρός πάγοςημι-εξαένυδρο θειικό οξύ, συμπεριλαμβανομένων λεπτομερών μελετών οκταένυδρου θειικού οξέος.
Το οξείδιο του θείου (IV) είναι ένας ανυδρίτης θειούχου οξέος, επομένως, όταν διαλύεται στο νερό, εμφανίζεται μια μερική αντίδραση με το νερό και σχηματίζεται ένα ασθενές θειικό οξύ:
που είναι ασταθής, εύκολα διασπάται ξανά σε. Σε ένα υδατικό διάλυμα διοξειδίου του θείου, υπάρχουν ταυτόχρονα οι ακόλουθες ισορροπίες.
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0