ΔΙΑΦΟΡΕΤΙΚΟΙ ΤΥΠΟΙ. Σε χημικές αντιδράσεις μπορούν να αποσυντεθούν για να σχηματίσουν πολλές άλλες ουσίες και μπορούν να σχηματιστούν από αρκετές λιγότερο πολύπλοκες ουσίες. Για παράδειγμα, το νερό αποτελείται από άτομα οξυγόνου και υδρογόνου, το θειούχο σίδηρο αποτελείται από άτομα σιδήρου και θείου.
Σημειώσεις
δείτε επίσης
Συνδέσεις
Ίδρυμα Wikimedia. 2010.
Δείτε τι είναι οι "Σύνθετες ουσίες" σε άλλα λεξικά:
Χημικές αντιδράσεις κατά τις οποίες λαμβάνονται τελικά προϊόντα από αρχικά προϊόντα μέσω ενδιάμεσων ουσιών. Ο σχηματισμός καθεμιάς από τις ενδιάμεσες ουσίες ονομάζεται στοιχειώδες στάδιο μιας σύνθετης αντίδρασης. Οι σύνθετες αντιδράσεις περιλαμβάνουν, για παράδειγμα, αλυσιδωτές αντιδράσεις... Μεγάλο Εγκυκλοπαιδικό Λεξικό
Εστέρας ανθρακικού οξέος. Τα R και R υποδηλώνουν οποιαδήποτε ομάδα αλκυλίου ή αρυλίου που προέρχονται από οξοξέα (και καρβοξυλικά και ορυκτά) Rk ... Wikipedia
Γενική δομή των θειοεστέρων Οι θειοεστέρες είναι οργανικές ενώσεις που περιέχουν τη λειτουργική ομάδα C S CO C και είναι εστέρες θειόλων και υδατανθράκων ... Wikipedia
Χημικές αντιδράσεις κατά τις οποίες λαμβάνονται τελικά προϊόντα από αρχικά προϊόντα μέσω ενδιάμεσων ουσιών. Ο σχηματισμός καθεμιάς από τις ενδιάμεσες ουσίες ονομάζεται στοιχειώδες στάδιο σύνθετων αντιδράσεων. Οι σύνθετες αντιδράσεις περιλαμβάνουν, για παράδειγμα, την αλυσίδα... ... εγκυκλοπαιδικό λεξικό
Τέτοιες αντιδράσεις είναι χημικές, οι στοιχειώδεις δράσεις των οποίων είναι διαφορετικές. Σε αντίθεση με τον S. r. Οι στοιχειώδεις πράξεις των απλών αντιδράσεων δεν διαφέρουν μεταξύ τους από τη φύση των ουσιών που εμπλέκονται σε αυτές, αλλά μόνο, ίσως, από την κατεύθυνση του μετασχηματισμού, εάν... ... Μεγάλη Σοβιετική Εγκυκλοπαίδεια
- (πρωτεΐνες, ολοπρωτεΐνες) πρωτεΐνες δύο συστατικών, οι οποίες, εκτός από πεπτιδικές αλυσίδες (απλή πρωτεΐνη), περιέχουν ένα μη αμινοξικό συστατικό, μια προσθετική ομάδα. Κατά την υδρόλυση συμπλόκων πρωτεϊνών, εκτός από τα ελεύθερα αμινοξέα, ... ... Wikipedia
Αλλοτροπική τροποποίηση ανθρακικού διαμαντιού (στο μητρικό βράχο) Απλές ουσίες ουσίες που αποτελούνται αποκλειστικά από άτομα ενός χημικού στοιχείου (από ομοπύρηνες ... Wikipedia
Οι ανόργανες ουσίες είναι χημικές ουσίες που δεν είναι οργανικές, δηλαδή δεν περιέχουν άνθρακα (εκτός από καρβίδια, κυανιούχα, ανθρακικά, οξείδια του άνθρακα και κάποιες άλλες ενώσεις που παραδοσιακά ταξινομούνται ως ... ... Wikipedia
ουσίες υψηλής καθαρότητας- απλές (χημικά στοιχεία) και σύνθετες ουσίες, περιέχουν προσμίξεις από 10 6 έως 10 8 wt. %, αλλά ≤10 3 wt. %. Τέτοιες ουσίες παίζουν σημαντικό ρόλο στη βιομηχανία ημιαγωγών, την πυρηνική ενέργεια, τις οπτικές ίνες... Εγκυκλοπαιδικό Λεξικό Μεταλλουργίας
ΕΣΤΕΡΕΣ, ουσίες από μια κατηγορία οργανικών ενώσεων που σχηματίζονται ως αποτέλεσμα της αντίδρασης μεταξύ ΑΛΚΟΟΛΩΝ και ΟΞΕΩΝ... Επιστημονικό και τεχνικό εγκυκλοπαιδικό λεξικό
Βιβλία
- Μοντελοποίηση διαδικασιών μεταφοράς και μετασχηματισμού ύλης στη θάλασσα. Η μονογραφία συνεχίζει τη σειρά βιβλίων «Μαθηματική μοντελοποίηση θαλάσσιων οικολογικών συστημάτων», που εκδόθηκε από τον Εκδοτικό Οίκο του Πανεπιστημίου του Λένινγκραντ. Τα δύο πρώτα βιβλία καλύπτουν...
- Δοκιμές χημείας, βαθμός 8 Αλλαγές που συμβαίνουν σε ουσίες Διαλύματα διάλυσης Αντιδράσεις ανταλλαγής ιόντων και αντιδράσεις οξειδοαναγωγής Στο σχολικό βιβλίο O. S. Gabrielyan Chemistry, τάξη 8, Ryabov M.. Το εγχειρίδιο περιλαμβάνει τεστ που καλύπτουν θέματα στο σχολικό βιβλίο του O. S. Gabrielyan "Chemistry. Grade 8" : "Αλλαγές που συμβαίνουν με ουσίες", "Διάλυση. Λύσεις. Αντιδράσεις ανταλλαγής ιόντων και...
Η ταξινόμηση των ανόργανων ουσιών και η ονοματολογία τους βασίζεται στο απλούστερο και πιο σταθερό χαρακτηριστικό στο χρόνο - χημική σύνθεση, που δείχνει τα άτομα των στοιχείων που σχηματίζουν μια δεδομένη ουσία στην αριθμητική τους αναλογία. Αν μια ουσία αποτελείται από άτομα ενός χημικού στοιχείου, δηλ. είναι η μορφή ύπαρξης αυτού του στοιχείου σε ελεύθερη μορφή, τότε ονομάζεται απλό ουσία; αν η ουσία αποτελείται από άτομα δύο ή περισσότερων στοιχείων, τότε ονομάζεται σύνθετη ουσία. Όλες οι απλές ουσίες (εκτός από τις μονατομικές) και όλες οι σύνθετες ουσίες συνήθως ονομάζονται χημικές ενώσεις, αφού σε αυτά άτομα ενός ή διαφορετικών στοιχείων συνδέονται μεταξύ τους με χημικούς δεσμούς.
Η ονοματολογία των ανόργανων ουσιών αποτελείται από τύπους και ονόματα. Χημική φόρμουλα - απεικόνιση της σύνθεσης μιας ουσίας χρησιμοποιώντας σύμβολα χημικών στοιχείων, αριθμητικούς δείκτες και ορισμένα άλλα σημάδια. Χημική ονομασία - εικόνα της σύνθεσης μιας ουσίας χρησιμοποιώντας μια λέξη ή μια ομάδα λέξεων. Η κατασκευή των χημικών τύπων και ονομάτων καθορίζεται από το σύστημα κανόνες ονοματολογίας.
Τα σύμβολα και τα ονόματα των χημικών στοιχείων δίνονται στον Περιοδικό Πίνακα Στοιχείων από τον D.I. Μεντελέεφ. Τα στοιχεία χωρίζονται συμβατικά σε μέταλλα Και αμέταλλα . Τα μη μέταλλα περιλαμβάνουν όλα τα στοιχεία της ομάδας VIIIA (ευγενή αέρια) και της ομάδας VIIA (αλογόνα), στοιχεία της ομάδας VIA (εκτός από το πολώνιο), στοιχεία άζωτο, φώσφορο, αρσενικό (ομάδα VA). άνθρακας, πυρίτιο (ομάδα IVA); βόριο (ομάδα IIIA), καθώς και υδρογόνο. Τα υπόλοιπα στοιχεία ταξινομούνται ως μέταλλα.
Κατά τη σύνταξη των ονομάτων των ουσιών, συνήθως χρησιμοποιούνται ρωσικά ονόματα στοιχείων, για παράδειγμα, διοοξυγόνο, διφθοριούχο ξένο, σεληνικό κάλιο. Παραδοσιακά, για ορισμένα στοιχεία, οι ρίζες των λατινικών ονομάτων τους εισάγονται σε παράγωγους όρους:
Για παράδειγμα: ανθρακικό, μαγγανικό, οξείδιο, σουλφίδιο, πυριτικό άλας.
Τίτλοι απλές ουσίεςαποτελούνται από μία λέξη - το όνομα ενός χημικού στοιχείου με αριθμητικό πρόθεμα, για παράδειγμα:
Χρησιμοποιούνται τα ακόλουθα αριθμητικά προθέματα:
Ένας αόριστος αριθμός υποδεικνύεται με ένα αριθμητικό πρόθεμα n- πολυ.
Για μερικές απλές ουσίες χρησιμοποιούν επίσης ειδικόςονόματα όπως O 3 - όζον, P 4 - λευκός φώσφορος.
Χημικοί τύποι σύνθετες ουσίεςαποτελείται από τον προσδιορισμό ηλεκτρισμένος θετικά(συνθηκών και πραγματικών κατιόντων) και ηλεκτροαρνητικός(συνθήκη και πραγματικά ανιόντα), για παράδειγμα, CuSO 4 (εδώ το Cu 2+ είναι ένα πραγματικό κατιόν, το SO 4 2 - είναι ένα πραγματικό ανιόν) και PCl 3 (εδώ το P +III είναι ένα κατιόν υπό όρους, το Cl-I είναι ένα υπό όρους ανιόν).
Τίτλοι σύνθετες ουσίεςαποτελείται σύμφωνα με χημικούς τύπους από δεξιά προς τα αριστερά. Αποτελούνται από δύο λέξεις - τα ονόματα των ηλεκτραρνητικών συστατικών (στην ονομαστική περίπτωση) και των ηλεκτροθετικών συστατικών (στη γενική περίπτωση), για παράδειγμα:
CuSO 4 - θειικός χαλκός(II).
PCl 3 - τριχλωριούχος φώσφορος
LaCl3 - χλωριούχο λανθάνιο (III).
CO - μονοξείδιο του άνθρακα
Ο αριθμός των ηλεκτροθετικών και ηλεκτραρνητικών συστατικών στα ονόματα υποδεικνύεται με τα αριθμητικά προθέματα που δίνονται παραπάνω (καθολική μέθοδος) ή με καταστάσεις οξείδωσης (αν μπορούν να προσδιοριστούν από τον τύπο) χρησιμοποιώντας λατινικούς αριθμούς σε παρένθεση (το σύμβολο συν παραλείπεται). Σε ορισμένες περιπτώσεις δίνεται το φορτίο ιόντων (για κατιόντα και ανιόντα σύνθετης σύστασης), χρησιμοποιώντας αραβικούς αριθμούς με το κατάλληλο πρόσημο.
Οι ακόλουθες ειδικές ονομασίες χρησιμοποιούνται για κοινά πολυστοιχειακά κατιόντα και ανιόντα:
|
H 2 F + - φθορόνιο |
C22--ακετυλενίδιο |
|
H 3 O + - οξώνιο |
CN - - κυάνιο |
|
H 3 S + - σουλφόνιο |
CNO - - κεραυνοβόλος |
|
NH 4 + - αμμώνιο |
HF 2 - - υδροδιφθορίδιο |
|
N 2 H 5 + - υδραζίνιο (1+) |
HO 2 - - υδροϋπεροξείδιο |
|
N 2 H 6 + - υδραζίνιο (2+) |
HS - - υδροσουλφίδιο |
|
NH 3 OH + - υδροξυλαμίνη |
Ν 3 - αζίδιο |
|
ΝΟ+ - νιτροζύλιο |
NCS - - θειοκυανικό |
|
ΝΟ 2 + - νιτροϋλ |
O 2 2 - - υπεροξείδιο |
|
O 2 + - διοξυγονύλιο |
O 2 - - υπεροξείδιο |
|
PH 4 + - φωσφόνιο |
O 3 - - οζονίδιο |
|
VO 2+ - βαναδύλιο |
OCN - - κυανικό |
|
UO 2+ - ουρανύλιο |
OH - - υδροξείδιο |
Χρησιμοποιείται επίσης για μικρό αριθμό γνωστών ουσιών ειδικόςτίτλοι:
1. Όξινα και βασικά υδροξείδια. Άλατα
Τα υδροξείδια είναι ένας τύπος πολύπλοκων ουσιών που περιέχουν άτομα κάποιου στοιχείου Ε (εκτός από φθόριο και οξυγόνο) και υδροξυλομάδες ΟΗ. γενικός τύπος υδροξειδίων E(OH) n, Οπου n= 1÷6. Μορφή υδροξειδίων Ε(ΟΗ) nπου ονομάζεται ορθο-σχήμα; στο n> 2 υδροξείδιο μπορεί επίσης να βρεθεί σε μετα-μορφή, η οποία περιλαμβάνει, εκτός από τα άτομα Ε και τις ομάδες ΟΗ, άτομα οξυγόνου Ο, για παράδειγμα Ε(ΟΗ) 3 και ΕΟ(ΟΗ), Ε(ΟΗ) 4 και Ε(ΟΗ) 6 και ΕΟ 2 (ΟΗ) 2 .
Τα υδροξείδια χωρίζονται σε δύο ομάδες με αντίθετες χημικές ιδιότητες: τα όξινα και τα βασικά υδροξείδια.
Όξινα υδροξείδιαπεριέχουν άτομα υδρογόνου, τα οποία μπορούν να αντικατασταθούν από άτομα μετάλλου που υπόκεινται στον κανόνα του στοιχειομετρικού σθένους. Τα περισσότερα υδροξείδια οξέος βρίσκονται σε μετα-η μορφή και τα άτομα υδρογόνου στους τύπους των όξινων υδροξειδίων δίνονται στην πρώτη θέση, για παράδειγμα, H 2 SO 4, HNO 3 και H 2 CO 3, και όχι SO 2 (OH) 2, NO 2 (OH) και CO ( Ω) 2. Ο γενικός τύπος των υδροξειδίων οξέος είναι Η ΧΕΟ στο, όπου η ηλεκτραρνητική συνιστώσα ΕΟ y x - που ονομάζεται υπόλειμμα οξέος. Εάν δεν αντικατασταθούν όλα τα άτομα υδρογόνου από ένα μέταλλο, τότε παραμένουν ως μέρος του υπολείμματος οξέος.
Τα ονόματα των κοινών υδροξειδίων οξέος αποτελούνται από δύο λέξεις: το κατάλληλο όνομα με την κατάληξη «aya» και την ομαδική λέξη «οξύ». Ακολουθούν οι τύποι και τα σωστά ονόματα των κοινών υδροξειδίων οξέος και των όξινων υπολειμμάτων τους (μια παύλα σημαίνει ότι το υδροξείδιο δεν είναι γνωστό σε ελεύθερη μορφή ή σε όξινο υδατικό διάλυμα):
|
υδροξείδιο οξέος |
υπόλειμμα οξέος |
|
HAsO 2 - μετααρσενικό |
AsO 2 - - μετααρσενίτης |
|
H 3 AsO 3 - ορθοαρσενικό |
AsO 3 3 - - ορθοαρσενίτης |
|
H 3 AsO 4 - αρσενικό |
AsO 4 3 - - αρσενικό |
|
B 4 O 7 2 - - τετραβορικό |
|
|
ВiО 3 - - βισμουθικό |
|
|
HBrO - βρωμίδιο |
BrO - - υποβρωμίτης |
|
HBrO 3 - βρωμιωμένο |
BrO 3 - - βρωμικό |
|
H 2 CO 3 - άνθρακας |
CO 3 2 - - ανθρακικό |
|
HClO - υποχλωριώδες |
ClO- - υποχλωριώδες |
|
HClO 2 - χλωριούχο |
ClO2 - - χλωρίτης |
|
HClO 3 - χλωρικό |
ClO3 - - χλωρικό άλας |
|
HClO 4 - χλώριο |
ClO4 - - υπερχλωρικό |
|
H 2 CrO 4 - χρώμιο |
CrO 4 2 - - χρωμικό άλας |
|
НCrO 4 - - υδροχρωμικό |
|
|
H 2 Cr 2 O 7 - διχρωμία |
Cr 2 O 7 2 - - διχρωμικό |
|
FeO 4 2 - - φερρατέ |
|
|
HIO 3 - ιώδιο |
IO 3 - - ιωδικό |
|
HIO 4 - μεταϊώδιο |
IO 4 - - μεταπεριοδικά |
|
H 5 IO 6 - ορθοϊώδιο |
IO 6 5 - - ορθοπεριοδικά |
|
HMnO 4 - μαγγάνιο |
MnO4- - υπερμαγγανικό |
|
MnO 4 2 - - μαγγανικό |
|
|
MoO 4 2 - - μολυβδαινικό |
|
|
HNO 2 - αζωτούχο |
ΟΧΙ 2 - - νιτρώδες αλάτι |
|
HNO 3 - άζωτο |
ΟΧΙ 3 - - νιτρικό άλας |
|
HPO 3 - μεταφωσφορικό |
PO 3 - - μεταφωσφορικό |
|
H 3 PO 4 - ορθοφωσφορικό |
PO 4 3 - - ορθοφωσφορικό |
|
НPO 4 2 - - υδρορθοφωσφορικό |
|
|
H 2 PO 4 - - διυδροθειοφωσφορικό |
|
|
H 4 P 2 O 7 - διφωσφορικό |
P 2 O 7 4 - - διφωσφορικό |
|
ReO 4 - - διατρυπώνω |
|
|
SO 3 2 - - θειώδες άλας |
|
|
HSO 3 - - υδροθειώδες |
|
|
H 2 SO 4 - θειικό |
SO 4 2 - - θειικό άλας |
|
HSO 4 - - υδροθειικό |
|
|
H 2 S 2 O 7 - διθείο |
S 2 O 7 2 - - διθειικό |
|
H 2 S 2 O 6 (O 2) - υπεροξοδιθείο |
S 2 O 6 (O 2) 2 - - υπεροξοδιθειικό |
|
H 2 SO 3 S - θειοθείο |
SO 3 S 2 - - θειοθειικό |
|
H 2 SeO 3 - σελήνιο |
SeO 3 2 - - σεληνίτης |
|
H 2 SeO 4 - σελήνιο |
SeO 4 2 - - σεληνός |
|
H 2 SiO 3 - μεταπυρίτιο |
SiO 3 2 - - μεταπυριτικό |
|
H 4 SiO 4 - ορθοπυρίτιο |
SiO 4 4 - - ορθοπυριτικό |
|
H 2 TeO 3 - τελλουρικό |
TeO 3 2 - - τελουρίτης |
|
H 2 TeO 4 - μετατελλουρικό |
TeO 4 2 - - μετατελιούχος |
|
H 6 TeO 6 - ορθοτελουρικό |
TeO 6 6 - - ορθοτελούρης |
|
VO 3 - - μεταβαναδάτη |
|
|
VO 4 3 - - ορθοβαναδάτη |
|
|
WO 4 3 - - βολφραμίου |
Τα λιγότερο κοινά υδροξείδια οξέος ονομάζονται σύμφωνα με τους κανόνες της ονοματολογίας για σύνθετες ενώσεις, για παράδειγμα:
Τα ονόματα των υπολειμμάτων οξέος χρησιμοποιούνται για την κατασκευή των ονομάτων των αλάτων.
Βασικά υδροξείδιαπεριέχουν ιόντα υδροξειδίου, τα οποία μπορούν να αντικατασταθούν από υπολείμματα οξέος με την επιφύλαξη του κανόνα του στοιχειομετρικού σθένους. Όλα τα βασικά υδροξείδια βρίσκονται σε ορθο-μορφή; ο γενικός τους τύπος είναι M(OH) n, Οπου n= 1,2 (λιγότερο συχνά 3,4) και M n+ είναι ένα κατιόν μετάλλου. Παραδείγματα τύπων και ονομασίες βασικών υδροξειδίων:
Η πιο σημαντική χημική ιδιότητα των βασικών και όξινων υδροξειδίων είναι η αλληλεπίδρασή τους μεταξύ τους για να σχηματίσουν άλατα. αντίδραση σχηματισμού άλατος), Για παράδειγμα:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Τα άλατα είναι ένας τύπος πολύπλοκων ουσιών που περιέχουν κατιόντα Μ n+ και όξινα υπολείμματα*.
Άλατα με γενικό τύπο Μ Χ(ΕΟ στο)nπου ονομάζεται μέση τιμή άλατα και άλατα με μη υποκατεστημένα άτομα υδρογόνου - θυμώνωάλατα. Μερικές φορές τα άλατα περιέχουν επίσης ιόντα υδροξειδίου και/ή οξειδίων. τέτοια άλατα λέγονται κύριοςάλατα. Ακολουθούν παραδείγματα και ονόματα αλάτων:
|
Ορθοφωσφορικό ασβέστιο |
|
|
Διόξινο ορθοφωσφορικό ασβέστιο |
|
|
όξινο φωσφορικό ασβέστιο |
|
|
Ανθρακικός χαλκός (II). |
|
|
Cu 2 CO 3 (OH) 2 |
Ανθρακικό διυδροξείδιο του διχαλκού |
|
Νιτρικό λανθάνιο (III). |
|
|
Δινιτρικό οξείδιο του τιτανίου |
Τα όξινα και βασικά άλατα μπορούν να μετατραπούν σε μεσαία άλατα με αντίδραση με το κατάλληλο βασικό και όξινο υδροξείδιο, για παράδειγμα:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
Υπάρχουν επίσης άλατα που περιέχουν δύο διαφορετικά κατιόντα: συχνά ονομάζονται διπλά άλατα, Για παράδειγμα:
2. Όξινα και βασικά οξείδια
Οξείδια Ε ΧΣΧΕΤΙΚΑ ΜΕ στο- προϊόντα πλήρους αφυδάτωσης υδροξειδίων:
Υδροξείδια οξέος (H 2 SO 4, H 2 CO 3) απαντούν οξείδια οξέος(SO 3, CO 2) και βασικά υδροξείδια (NaOH, Ca(OH) 2) - βασικόςοξείδια(Na 2 O, CaO) και η κατάσταση οξείδωσης του στοιχείου Ε δεν αλλάζει όταν μετακινείται από υδροξείδιο σε οξείδιο. Παράδειγμα τύπων και ονομασιών οξειδίων:
Τα όξινα και βασικά οξείδια διατηρούν τις ιδιότητες σχηματισμού άλατος των αντίστοιχων υδροξειδίων όταν αλληλεπιδρούν με υδροξείδια αντίθετων ιδιοτήτων ή μεταξύ τους:
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
3. Αμφοτερικά οξείδια και υδροξείδια
Αμφοτερικότηταυδροξείδια και οξείδια - μια χημική ιδιότητα που συνίσταται στο σχηματισμό δύο σειρών αλάτων από αυτά, για παράδειγμα, για το υδροξείδιο του αργιλίου και το οξείδιο του αργιλίου:
(α) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(β) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Έτσι, το υδροξείδιο του αργιλίου και το οξείδιο στις αντιδράσεις (α) παρουσιάζουν τις ιδιότητες κύριοςυδροξείδια και οξείδια, δηλ. αντιδρούν με όξινα υδροξείδια και οξείδιο, σχηματίζοντας το αντίστοιχο άλας - θειικό αργίλιο Al 2 (SO 4) 3, ενώ στις αντιδράσεις (β) παρουσιάζουν και τις ιδιότητες όξινοςυδροξείδια και οξείδια, δηλ. αντιδρούν με βασικό υδροξείδιο και οξείδιο, σχηματίζοντας άλας - διοξοαργιλικό νάτριο (III) NaAlO 2. Στην πρώτη περίπτωση, το στοιχείο αλουμίνιο παρουσιάζει την ιδιότητα ενός μετάλλου και αποτελεί μέρος του ηλεκτροθετικού συστατικού (Al 3+), στη δεύτερη - την ιδιότητα ενός μη μετάλλου και αποτελεί μέρος του ηλεκτραρνητικού συστατικού του τύπου αλατιού ( AlO 2 -).
Εάν αυτές οι αντιδράσεις συμβαίνουν σε ένα υδατικό διάλυμα, τότε η σύνθεση των αλάτων που προκύπτουν αλλάζει, αλλά η παρουσία αργιλίου στο κατιόν και το ανιόν παραμένει:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
Εδώ, τα σύμπλοκα ιόντα 3+ - κατιόν εξααργιλίου (III), - - τετραϋδροξοαργιλικό (III) ιόν επισημαίνονται σε αγκύλες.
Τα στοιχεία που παρουσιάζουν μεταλλικές και μη μεταλλικές ιδιότητες σε ενώσεις ονομάζονται αμφοτερικά, σε αυτά περιλαμβάνονται στοιχεία των ομάδων Α του Περιοδικού Πίνακα - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po κ.λπ., όπως καθώς και τα περισσότερα στοιχεία των ομάδων Β - Cr, Mn, Fe, Zn, Cd, Au κ.λπ. Τα αμφοτερικά οξείδια ονομάζονται το ίδιο με τα βασικά, για παράδειγμα:
Αμφοτερικά υδροξείδια (αν η κατάσταση οξείδωσης του στοιχείου υπερβαίνει το + II) μπορούν να βρεθούν σε ορθο- ή (και) μετα- φόρμα. Ακολουθούν παραδείγματα αμφοτερικών υδροξειδίων:
Τα αμφοτερικά οξείδια δεν αντιστοιχούν πάντα σε αμφοτερικά υδροξείδια, καθώς όταν προσπαθούμε να λάβουμε τα τελευταία, σχηματίζονται ένυδρα οξείδια, για παράδειγμα:
Εάν ένα αμφοτερικό στοιχείο σε μια ένωση έχει πολλές καταστάσεις οξείδωσης, τότε η αμφοτερικότητα των αντίστοιχων οξειδίων και υδροξειδίων (και, κατά συνέπεια, η αμφοτερικότητα του ίδιου του στοιχείου) θα εκφραστεί διαφορετικά. Για καταστάσεις χαμηλής οξείδωσης, τα υδροξείδια και τα οξείδια υπερισχύουν των βασικών ιδιοτήτων και το ίδιο το στοιχείο έχει μεταλλικές ιδιότητες, επομένως περιλαμβάνεται σχεδόν πάντα στη σύνθεση των κατιόντων. Για καταστάσεις υψηλής οξείδωσης, αντίθετα, τα υδροξείδια και τα οξείδια υπερισχύουν όξινων ιδιοτήτων και το ίδιο το στοιχείο έχει μη μεταλλικές ιδιότητες, επομένως περιλαμβάνεται σχεδόν πάντα στη σύνθεση των ανιόντων. Έτσι, το οξείδιο και το υδροξείδιο του μαγγανίου (II) έχουν κυρίαρχες βασικές ιδιότητες και το ίδιο το μαγγάνιο είναι μέρος κατιόντων του τύπου 2+, ενώ το οξείδιο και το υδροξείδιο του μαγγανίου (VII) έχουν κυρίαρχες όξινες ιδιότητες και το ίδιο το μαγγάνιο είναι μέρος του MnO 4 - τύπου ανιόν. Στα αμφοτερικά υδροξείδια με υψηλή κυριαρχία όξινων ιδιοτήτων αποδίδονται τύποι και ονομασίες που διαμορφώνονται σύμφωνα με όξινα υδροξείδια, για παράδειγμα HMn VII O 4 - οξύ μαγγανίου.
Έτσι, η διαίρεση των στοιχείων σε μέταλλα και μη μέταλλα είναι υπό όρους. Μεταξύ των στοιχείων (Na, K, Ca, Ba κ.λπ.) με αμιγώς μεταλλικές ιδιότητες και των στοιχείων (F, O, N, Cl, S, C κ.λπ.) με αμιγώς μη μεταλλικές ιδιότητες, υπάρχει μια μεγάλη ομάδα. στοιχείων με αμφοτερικές ιδιότητες.
4. Δυαδικές ενώσεις
Ένας ευρύς τύπος ανόργανων σύνθετων ουσιών είναι δυαδικές ενώσεις. Αυτές περιλαμβάνουν, πρώτα απ 'όλα, όλες τις ενώσεις δύο στοιχείων (εκτός από βασικά, όξινα και αμφοτερικά οξείδια), για παράδειγμα H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC2, SiH4. Τα ηλεκτροθετικά και ηλεκτραρνητικά συστατικά των τύπων αυτών των ενώσεων περιλαμβάνουν μεμονωμένα άτομα ή συνδεδεμένες ομάδες ατόμων του ίδιου στοιχείου.
Οι πολυστοιχειακές ουσίες, στους τύπους των οποίων ένα από τα συστατικά περιέχει άσχετα άτομα πολλών στοιχείων, καθώς και ομάδες ατόμων ενός στοιχείου ή πολλών στοιχείων (εκτός από υδροξείδια και άλατα), θεωρούνται ως δυαδικές ενώσεις, για παράδειγμα CSO, IO 2 F 3, SBrO 2 F, CrO (O 2) 2, PSI 3, (CaTi)O 3, (FeCu)S 2, Hg(CN) 2, (PF 3) 2 O, VCl 2 (NH 2). Έτσι, το CSO μπορεί να αναπαρασταθεί ως ένωση CS 2 στην οποία ένα άτομο θείου αντικαθίσταται από ένα άτομο οξυγόνου.
Τα ονόματα των δυαδικών ενώσεων κατασκευάζονται σύμφωνα με τους συνήθεις κανόνες ονοματολογίας, για παράδειγμα:
|
OF 2 - διφθοριούχο οξυγόνο |
K 2 O 2 - υπεροξείδιο του καλίου |
|
HgCl2 - χλωριούχος υδράργυρος(II). |
Na 2S - θειούχο νάτριο |
|
Hg 2 Cl 2 - διχλωριούχος διυδράργυρος |
Mg 3 N 2 - νιτρίδιο μαγνησίου |
|
SBr 2 O - οξείδιο του θείου-διβρωμίδιο |
NH 4 Br - βρωμιούχο αμμώνιο |
|
N 2 O - οξείδιο του αζώτου |
Pb(N 3) 2 - αζίδιο μολύβδου(II). |
|
NO 2 - διοξείδιο του αζώτου |
CaC 2 - ακετυλενίδιο ασβεστίου |
Για ορισμένες δυαδικές ενώσεις, χρησιμοποιούνται ειδικές ονομασίες, μια λίστα των οποίων δόθηκε νωρίτερα.
Οι χημικές ιδιότητες των δυαδικών ενώσεων είναι αρκετά διαφορετικές, επομένως συχνά χωρίζονται σε ομάδες με το όνομα ανιόντα, δηλ. Τα αλογονίδια, τα χαλκογονίδια, τα νιτρίδια, τα καρβίδια, τα υδρίδια κ.λπ. θεωρούνται χωριστά Μεταξύ των δυαδικών ενώσεων υπάρχουν και εκείνες που έχουν κάποια χαρακτηριστικά άλλων τύπων ανόργανων ουσιών. Έτσι, οι ενώσεις CO, NO, NO 2 και (Fe II Fe 2 III) O 4, τα ονόματα των οποίων κατασκευάζονται με τη λέξη οξείδιο, δεν μπορούν να ταξινομηθούν ως οξείδια (όξινα, βασικά, αμφοτερικά). Το μονοξείδιο του άνθρακα CO, το μονοξείδιο του αζώτου NO και το διοξείδιο του αζώτου NO 2 δεν έχουν αντίστοιχα υδροξείδια οξέος (αν και αυτά τα οξείδια σχηματίζονται από αμέταλλα C και N), ούτε σχηματίζουν άλατα των οποίων τα ανιόντα θα περιλαμβάνουν άτομα C II, N II και N IV. Διπλό οξείδιο (Fe II Fe 2 III) O 4 - δισιδήρου(III)-οξείδιο σιδήρου(II), αν και περιέχει άτομα του αμφοτερικού στοιχείου - σίδηρο στο ηλεκτροθετικό συστατικό, αλλά σε δύο διαφορετικές καταστάσεις οξείδωσης, με αποτέλεσμα , όταν αλληλεπιδρά με υδροξείδια οξέος, σχηματίζει όχι ένα, αλλά δύο διαφορετικά άλατα.
Οι δυαδικές ενώσεις όπως AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl, και Pb(N 3) 2 κατασκευάζονται, όπως τα άλατα, από πραγματικά κατιόντα και ανιόντα, γι' αυτό ονομάζονται σαν αλάτι δυαδικές ενώσεις (ή απλά άλατα). Μπορούν να θεωρηθούν ως προϊόντα της υποκατάστασης ατόμων υδρογόνου στις ενώσεις HF, HCl, HBr, H 2 S, HCN και HN 3. Τα τελευταία σε ένα υδατικό διάλυμα έχουν όξινη λειτουργία και επομένως τα διαλύματά τους ονομάζονται οξέα, για παράδειγμα HF (aqua) - υδροφθορικό οξύ, H 2 S (aqua) - υδροσουλφιδικό οξύ. Ωστόσο, δεν ανήκουν στον τύπο των υδροξειδίων οξέος και τα παράγωγά τους δεν ανήκουν στα άλατα της ταξινόμησης των ανόργανων ουσιών.
Μια διεθνής ομάδα επιστημόνων συνέθεσε και μελέτησε το seaborgium hexacarbonyl, Sg(CO)6, μια ένωση του ασταθούς στοιχείου με ατομικό αριθμό 106 με μονοξείδιο του άνθρακα, και το συνέκρινε επίσης με παρόμοιες ενώσεις των ασταθών ισοτόπων του μολυβδαινίου και του βολφραμίου, ομόλογα του seaborgium . Αυτή είναι η πιο περίπλοκη πειραματικά ληφθείσα χημική ένωση, η οποία περιλαμβάνει ένα τρανσακτινοειδές, δηλαδή ένα στοιχείο με ατομικό αριθμό πάνω από 103. Στις χημικές ιδιότητες των τρανσακτινοειδών, τα αποτελέσματα της θεωρίας της σχετικότητας για τα εσωτερικά ηλεκτρόνια είναι πιο έντονα, επομένως το Η μελέτη της χημείας των τρανσακτινοειδών καθιστά δυνατή την αποσαφήνιση ολόκληρης της θεωρίας υπολογισμού της ηλεκτρονικής δομής των βαρέων ατόμων.
Ο περιοδικός πίνακας των χημικών στοιχείων έχει ήδη συμπληρωθεί μέχρι τον αριθμό 118 (Εικ. 1). Ολόκληρη η δομή του αντανακλά την περιοδικότητα των χημικών ιδιοτήτων των στοιχείων με αυξανόμενο ατομικό αριθμό, η οποία προκύπτει με το σταδιακό γέμισμα των ηλεκτρονικών κελυφών. Εάν δύο χημικά στοιχεία διαφέρουν ως προς τον αριθμό των πλήρως γεμισμένων εσωτερικών φλοιών ηλεκτρονίων, αλλά έχουν παρόμοια εξωτερικά ηλεκτρόνια - τα οποία είναι υπεύθυνα για τους χημικούς δεσμούς - τότε τα δύο στοιχεία θα πρέπει να έχουν παρόμοιες χημικές ιδιότητες. Αυτές οι σειρές στοιχείων ονομάζονται ομόλογα μεταξύ τους και στον περιοδικό πίνακα βρίσκονται στην ίδια ομάδα, το ένα πάνω από το άλλο. Για παράδειγμα, τα μέταλλα μετάπτωσης που σχηματίζουν την ομάδα έξι - χρώμιο, μολυβδαίνιο, βολφράμιο και το υπερβαρύ στοιχείο με αριθμό 106 seaborgium - είναι ομόλογα μεταξύ τους. Ενώ οι χημικές ιδιότητες των τριών πρώτων από αυτά είναι γνωστές εδώ και πολύ καιρό, η χημεία του seaborgium μόλις αρχίζει να μελετάται. Ωστόσο, με βάση τον περιοδικό πίνακα, οι χημικές τους ιδιότητες αναμένεται να είναι παρόμοιες.
Όταν συγκρίνουμε τις χημικές ιδιότητες των ομόλογων στοιχείων, υπάρχει μια σημαντική παγίδα. Στα βαριά άτομα, τα εσωτερικά ηλεκτρόνια κινούνται με ταχύτητες σχεδόν του φωτός, και εξαιτίας αυτού, τα αποτελέσματα της θεωρίας της σχετικότητας λειτουργούν στο έπακρο. Οδηγούν σε πρόσθετη συμπίεση των τροχιακών s και p και, κατά συνέπεια, σε κάποια επέκταση των εξωτερικών νεφών ηλεκτρονίων. Ένα μεγάλο πυρηνικό φορτίο ενισχύει επίσης τις επιδράσεις των ηλεκτρονίων που αλληλεπιδρούν μεταξύ τους, όπως η διάσπαση τροχιάς σπιν. Όλα αυτά επηρεάζουν τον χημικό δεσμό ενός βαριού ατόμου με ορισμένους γείτονες. Και η σύγχρονη θεωρητική χημεία θα πρέπει να είναι σε θέση να υπολογίσει σωστά όλα αυτά τα αποτελέσματα.
Όσο πιο βαρύ είναι το άτομο, τόσο ισχυρότερα είναι τα σχετικιστικά φαινόμενα. Φαίνεται φυσικό να χρησιμοποιούμε τα βαρύτερα γνωστά στοιχεία, τα τρανσακτινοειδή, στοιχεία με ατομικό αριθμό πάνω από 103, για να δοκιμάσουμε τους θεωρητικούς υπολογισμούς (Εικόνα 1). Ωστόσο, προκύπτουν αρκετές σημαντικές δυσκολίες στον δρόμο προς την πειραματική τους μελέτη.
Πρώτον, οι ατομικοί πυρήνες των τρανσακτινοειδών στοιχείων είναι πολύ ασταθείς. Η τυπική διάρκεια ζωής τους είναι λεπτά, δευτερόλεπτα ή ακόμα και κλάσματα του δευτερολέπτου. Επομένως, δεν γίνεται λόγος για συσσώρευση μακροσκοπικής ποσότητας ύλης, πρέπει να εργαστούμε με μεμονωμένα άτομα αμέσως μετά τη γέννησή τους.
Αυτό δεν θα ήταν μεγάλο πρόβλημα αν όχι για τη δεύτερη δυσκολία: αυτά τα άτομα μπορούν να ληφθούν μόνο σε ποσότητες τεμαχίων. Τα υπερβαριά άτομα συντίθενται σε πυρηνικές αντιδράσεις, στη διαδικασία συγχώνευσης δύο άλλων αρκετά βαρέων ατόμων με μεγάλη περιεκτικότητα σε νετρόνια. Για να γίνει αυτό, μια δέσμη βαρέων ιόντων ενός τύπου κατευθύνεται σε έναν στόχο που περιέχει βαρέα άτομα άλλου τύπου και όταν αυτά συγκρούονται, συμβαίνουν πυρηνικές αντιδράσεις. Στη συντριπτική πλειονότητα των περιπτώσεων, δημιουργούν μόνο μικρότερα θραύσματα και μόνο περιστασιακά συμβαίνει ότι ο επιθυμητός υπερβαρύς πυρήνας γεννιέται στη συγχώνευση δύο πυρήνων. Ως αποτέλεσμα, ο ρυθμός παραγωγής υπερβαρέων πυρήνων κατά τη συνεχή ακτινοβόληση ενός στόχου αποδεικνύεται γελοία χαμηλός: της τάξης του ενός ανά λεπτό, ανά ώρα, ανά ημέρα ή ακόμη και ανά εβδομάδα.
Αυτή η τεχνολογία γέννησης οδηγεί σε ένα τρίτο πρόβλημα. Η σύνθεση υπερβαρέων ατόμων λαμβάνει χώρα υπό συνθήκες συνεχούς σκληρής ακτινοβολίας από μια δέσμη που χτυπά τον στόχο και, κατά συνέπεια, παρουσία μιας τεράστιας ροής εξωτερικών πυρηνικών συντριμμιών. Ακόμα κι αν ο επιθυμητός πυρήνας γεννηθεί, λάβει ηλεκτρόνια από το περιβάλλον, γίνει πραγματικό άτομο και, τελικά, αμέσως πίσω από τον στόχο εισέλθει σε μια χημική αντίδραση με το σχηματισμό μιας νέας ένωσης - αυτή η ένωση θα βρίσκεται σε σκληρές συνθήκες ακτινοβολίας, σε συνεχής επαφή με το πλάσμα που προκαλείται από σκληρό ιονισμό Το γεγονός ότι κάτω από αυτές τις συνθήκες είναι γενικά δυνατό να μελετηθεί κάποιο είδος χημείας των τρανσακτινοειδών μέχρι το φλερόβιο (στοιχείο 114) είναι από μόνο του ένα μεγάλο επίτευγμα. Ωστόσο, μέχρι τώρα όλες οι χημικές ενώσεις που περιλαμβάνουν τρανσακτινοειδή ήταν πολύ απλές από χημική άποψη - αλογονίδια, οξείδια και άλλες παρόμοιες ενώσεις με βαρύ άτομο στη μέγιστη κατάσταση οξείδωσης. Πιο εύθραυστες χημικές ενώσεις με μη ασήμαντους χημικούς δεσμούς καταστρέφονται γρήγορα παρουσία σκληρής ακτινοβολίας. Και όλα αυτά, δυστυχώς, δυσκολεύουν τον έλεγχο των χημικών ιδιοτήτων των τρανσακτινοειδών.
Τις προάλλες σε ένα περιοδικό Επιστήμηδημοσιεύτηκε, σηματοδοτώντας την αρχή της «μη τετριμμένης» τρανσακτινοειδούς χημείας. Αναφέρει τη σύνθεση και την πειραματική μελέτη της ένωσης Sg(CO) 6, seaborgium hexacarbonyl (Εικ. 2). Επιπλέον, στην ίδια διάταξη και με τις ίδιες μεθόδους, μελετήθηκαν επίσης εξακαρβονυλικά σύμπλοκα των ομόλογων στοιχείων seaborgium, Mo(CO) 6 και W(CO) 6 και βραχύβια ισότοπα μολυβδαινίου και βολφραμίου με χρόνο ημιζωής αρκετά δευτερόλεπτα ή λεπτά.
Το κύριο χαρακτηριστικό αυτής της εργασίας είναι μια συνδυασμένη πειραματική διάταξη που συγκεντρώνει αρκετές τεχνικές προόδους της τελευταίας δεκαετίας. Αυτή η εγκατάσταση ξεπερνά το τρίτο από τα προβλήματα που αναφέρθηκαν παραπάνω - χωρίζει χωρικά την περιοχή σύνθεσης υπερβαρέων πυρήνων και την περιοχή φυσικοχημικής έρευνας της προκύπτουσας ένωσης. Η γενική του εμφάνιση φαίνεται στο Σχ. 3. Στην είσοδο της εγκατάστασης (από δεξιά προς τα αριστερά στο φόντο του σχήματος), μια δέσμη πυρήνων αλληλεπιδρά με τον στόχο και δημιουργεί ένα «κοκτέιλ» δευτερευόντων πυρήνων. Τα προϊόντα της αντίδρασης εκτρέπονται από ένα διπολικό μαγνητικό πεδίο (στοιχείο D στο σχήμα) και με διαφορετικούς τρόπους για διαφορετικούς λόγους φορτίου και μάζας πυρήνων. Το μέγεθος του μαγνητικού πεδίου υπολογίζεται με τέτοιο τρόπο ώστε μόνο οι υπό μελέτη πυρήνες περνούν από το σύστημα των μαγνητικών φακών (Q), ενώ οι πυρήνες του φόντου και η αρχική δέσμη εκτρέπονται μακριά. Στην ουσία, αυτή η τεχνική αντιγράφει τη γνωστή φασματομετρία μάζας που εφαρμόζεται στους πυρήνες.
Στο επόμενο βήμα, οι διαχωρισμένοι πυρήνες (Sg, Mo ή W) εισέρχονται στον θάλαμο RTC, μέσω του οποίου διοχετεύεται ένα μείγμα αερίου ηλίου και μονοξειδίου του άνθρακα. Ένα σημαντικό σημείο: στη διαδρομή προς τον θάλαμο, οι πυρήνες περνούν από ένα παράθυρο αυστηρά καθορισμένου πάχους, κατασκευασμένο από mylar. Μειώνει την κινητική ενέργεια των θερμών πυρήνων και τους επιτρέπει να θερμοποιηθούν (επιβραδύνουν μέχρι την ενέργεια της θερμικής κίνησης των μορίων) μέσα στο θάλαμο αερίων. Εκεί, οι πυρήνες «ντύνονται με ηλεκτρόνια» και, μπαίνοντας σε μια χημική αντίδραση με μονοξείδιο του άνθρακα, σχηματίζουν μια ένωση - ένα σύμπλοκο καρβονυλίου. Δεδομένου ότι η ένωση είναι πτητική, μεταφέρεται με ολόκληρη τη ροή αερίου μέσω ενός τριχοειδούς τεφλόν μήκους 10 μέτρων στο δεύτερο μέρος της εγκατάστασης - έναν ειδικό αναλυτή COMPACT.
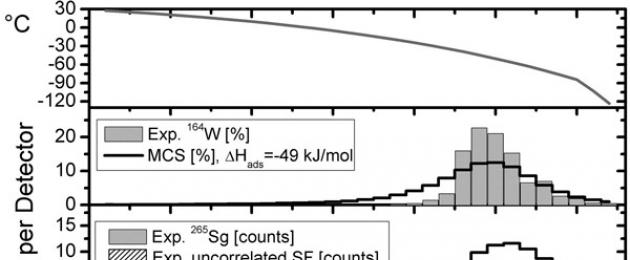
Το όνομα COMPACT σημαίνει Cryo-Online Πολυανιχνευτής για τη Φυσική και τη Χημεία των Τρανσακτινοειδών. Αυτή η εγκατάσταση είναι μια ολόκληρη σειρά 32 ζευγών ανιχνευτών ημιαγωγών για αέρια θερμοχρωματογραφία ενώσεων ασταθών στοιχείων. Δημιουργείται μια ισχυρή διαβάθμιση θερμοκρασίας κατά μήκος της γραμμής: κάθε ζεύγος ανιχνευτών βρίσκεται στη δική του θερμοκρασία, από +30°C στην αρχή της γραμμής έως -120°C στο τέλος του. Κάθε ανιχνευτής είναι ικανός να καταγράφει τα σωματίδια α και β που εκπέμπονται από τους πυρήνες κατά τη διάσπασή τους και να μετράει την ενέργεια και τον χρόνο αναχώρησής τους με υψηλή ακρίβεια. Αυτό είναι απαραίτητο προκειμένου να αναγνωριστούν οι πυρήνες του seaborgium με τη χαρακτηριστική τους αλυσίδα διασπάσεων, στην οποία τα σωματίδια άλφα ορισμένων ενεργειών εκπέμπονται το ένα μετά το άλλο, και για να μην συγχέουμε αυτά τα σπάνια συμβάντα με διαδικασίες υποβάθρου.
Ο αναλυτής COMPACT λειτουργεί έτσι. Όταν το μείγμα αερίων διοχετεύεται μέσω του χάρακα, μόρια του συμπλόκου καρβονυλίου του βαρέος μετάλλου εναποτίθενται στην επιφάνεια ενός συγκεκριμένου ανιχνευτή, όπου καταγράφονται μετά από ραδιενεργό διάσπαση. Ο αριθμός του ανιχνευτή στον οποίο καταγράφεται η διάσπαση δείχνει τη θερμοκρασία στην οποία η απορρόφηση του μορίου γίνεται ενεργειακά ευνοϊκή. Αυτή η θερμοκρασία καθορίζεται από τα φυσικοχημικά χαρακτηριστικά του συμπλόκου καρβονυλίου που μελετάται - την ενθαλπία της προσρόφησης. Λοιπόν, αυτό ακριβώς το χαρακτηριστικό της ύλης, με τη σειρά του, προβλέπεται από χημικούς υπολογισμούς, στους οποίους τα σχετικιστικά φαινόμενα παίζουν σημαντικό ρόλο. Έτσι, μετρώντας τον τρόπο με τον οποίο τα Sg(CO) 6 , W(CO) 6 και Mo(CO) 6 εναποτίθενται στον αναλυτή COMPACT, μπορούν να επαληθευτούν χημικοί θεωρητικοί υπολογισμοί και να μετρηθεί η ενθαλπία της προσρόφησης αυτών των ειδών.

Τα αποτελέσματα αυτής της μελέτης φαίνονται στο Σχ. 4. Εδώ είναι αρκετά χαρακτηριστικά σε καθένα από τα 32 ζεύγη ανιχνευτών. Το επάνω γράφημα είναι απλώς η κατανομή της θερμοκρασίας κατά μήκος ενός χάρακα. Τα μεσαία και κάτω γραφήματα δείχνουν, στην πραγματικότητα, τα ίδια τα πειραματικά δεδομένα - την κατανομή των καταγεγραμμένων διασπάσεων των πυρήνων βολφραμίου-164 (στο κέντρο) και seaborgium-265 (κάτω) στους ανιχνευτές. Εδώ φυσικά δεν υπάρχουν αρκετά συμβάντα με seaborgium - σε δύο εβδομάδες συνεχούς ακτινοβόλησης του στόχου με έντονη δέσμη, καταγράφηκαν συνολικά 18 από αυτά. Ωστόσο, είναι ξεκάθαρα ορατό ότι δεν κατανέμονται ομοιόμορφα κατά μήκος της γραμμής, αλλά πιο κοντά στο τέλος της, σε ανιχνευτές με αριθμούς πάνω από 20. Περίπου η ίδια εικόνα λήφθηκε κατά τη μοντελοποίηση αυτής της διαδικασίας με την ενθαλπία της προσρόφησης, που υπολογίστηκε πολύ πρόσφατα στο μια θεωρητική εργασία μόνο για αυτές τις ουσίες. Παρόμοια εικόνα παρατηρείται για ενώσεις με ασταθές ισότοπο βολφραμίου και με ισότοπα μολυβδαινίου (δεν φαίνονται στο σχήμα): το μέγιστο των κατανομών πέφτει ακριβώς εκεί που προβλέπουν οι θεωρητικοί υπολογισμοί. Αυτή η σύμπτωση δίνει πρόσθετη σιγουριά ότι οι σύγχρονες μέθοδοι πλήρως σχετικιστικού υπολογισμού της δομής των βαρέων ατόμων περιγράφουν επαρκώς τα πειραματικά δεδομένα.
Τέλος, είναι χρήσιμο να ρίξουμε μια ματιά σε αυτή την έρευνα. Τυπικά, τα ασταθή υπερβαριά στοιχεία ενδιαφέρουν τους φυσικούς για χάρη της νέας γνώσης στην πυρηνική φυσική. Ωστόσο, δεδομένου ότι η φύση μας το επιτρέπει, αυτά τα στοιχεία μπορούν να χρησιμοποιηθούν για έναν άλλο σκοπό - για να ελέγξουμε πόσο καλά μπορούμε να προβλέψουμε χημική ουσίαιδιότητες τέτοιων ατόμων. Αυτή η γνώση, με τη σειρά της, δεν χρειαζόμαστε από μόνη της, αλλά ως πρόσθετο τεστ ολόκληρης της σύγχρονης θεωρίας υπολογισμού των ηλεκτρονικών δομών των βαρέων ατόμων, λαμβάνοντας υπόψη τις σχετικιστικές επιδράσεις. Και από εδώ ακολουθούν πολλές εφαρμογές, από την καθαρά εφαρμοσμένη έρευνα μέχρι την πραγματική θεμελιώδη επιστήμη. Η χημεία των τρανσακτινοειδών υπογραμμίζει για άλλη μια φορά πόσο έντονα συνδέονται μεταξύ τους οι πιο διαφορετικοί τομείς της φυσικής και οι σχετικοί κλάδοι.
Ο κόσμος γύρω μας είναι υλικός. Υπάρχουν δύο είδη ύλης: ουσία και πεδίο. Το αντικείμενο της χημείας είναι μια ουσία (συμπεριλαμβανομένης της επίδρασης διαφόρων πεδίων στην ουσία - ήχος, μαγνητικό, ηλεκτρομαγνητικό κ.λπ.)
Ύλη είναι οτιδήποτε έχει μάζα ηρεμίας (δηλαδή χαρακτηρίζεται από την παρουσία μάζας όταν δεν κινείται). Έτσι, αν και η μάζα ηρεμίας ενός ηλεκτρονίου (η μάζα ενός μη κινούμενου ηλεκτρονίου) είναι πολύ μικρή - περίπου 10 -27 g, αλλά ακόμη και ένα ηλεκτρόνιο είναι ύλη.
Η ουσία υπάρχει σε τρεις καταστάσεις συσσωμάτωσης - αέρια, υγρή και στερεή. Υπάρχει μια άλλη κατάσταση της ύλης - το πλάσμα (για παράδειγμα, οι κεραυνοί και οι κεραυνοί της μπάλας περιέχουν πλάσμα), αλλά στα σχολικά μαθήματα η χημεία του πλάσματος σχεδόν δεν λαμβάνεται υπόψη. 
Οι ουσίες μπορεί να είναι καθαρές, πολύ καθαρές (απαραίτητες, για παράδειγμα, για τη δημιουργία οπτικών ινών), μπορεί να περιέχουν αξιοσημείωτες ποσότητες ακαθαρσιών ή μπορεί να είναι μείγματα.
Όλες οι ουσίες αποτελούνται από μικροσκοπικά σωματίδια που ονομάζονται άτομα. Ουσίες που αποτελούνται από άτομα του ίδιου τύπου(από άτομα ενός στοιχείου), ονομάζονται απλές(για παράδειγμα, κάρβουνο, οξυγόνο, άζωτο, ασήμι κ.λπ.). Οι ουσίες που περιέχουν άτομα διαφορετικών στοιχείων διασυνδεδεμένα ονομάζονται σύνθετες.
Εάν μια ουσία (για παράδειγμα, ο αέρας) περιέχει δύο ή περισσότερες απλές ουσίες, και τα άτομα τους δεν είναι συνδεδεμένα μεταξύ τους, τότε δεν ονομάζεται σύνθετη ουσία, αλλά μείγμα απλών ουσιών. Ο αριθμός των απλών ουσιών είναι σχετικά μικρός (περίπου πεντακόσιες), αλλά ο αριθμός των πολύπλοκων ουσιών είναι τεράστιος. Μέχρι σήμερα, είναι γνωστές δεκάδες εκατομμύρια διαφορετικές πολύπλοκες ουσίες. 
Χημικοί μετασχηματισμοί
Οι ουσίες μπορούν να αλληλεπιδρούν μεταξύ τους και προκύπτουν νέες ουσίες. Τέτοιοι μετασχηματισμοί ονομάζονται χημική ουσία. Για παράδειγμα, μια απλή ουσία, ο άνθρακας, αλληλεπιδρά (οι χημικοί λένε ότι αντιδρά) με μια άλλη απλή ουσία, το οξυγόνο, με αποτέλεσμα να σχηματιστεί μια πολύπλοκη ουσία, το διοξείδιο του άνθρακα, στην οποία τα άτομα άνθρακα και οξυγόνου αλληλοσυνδέονται. Τέτοιοι μετασχηματισμοί μιας ουσίας σε μια άλλη ονομάζονται χημικές. Οι χημικοί μετασχηματισμοί είναι χημικές αντιδράσεις.Έτσι, όταν η ζάχαρη θερμαίνεται στον αέρα, μια σύνθετη γλυκιά ουσία - η σακχαρόζη (από την οποία αποτελείται η ζάχαρη) - μετατρέπεται σε μια απλή ουσία - άνθρακα και μια σύνθετη ουσία - νερό.
Η Χημεία μελετά τη μετατροπή μιας ουσίας σε μια άλλη. Το καθήκον της χημείας είναι να ανακαλύψει με ποιες ουσίες μια συγκεκριμένη ουσία μπορεί να αλληλεπιδράσει (αντιδράσει) υπό δεδομένες συνθήκες και τι σχηματίζεται. Επιπλέον, είναι σημαντικό να μάθετε υπό ποιες συνθήκες μπορεί να συμβεί ένας συγκεκριμένος μετασχηματισμός και να ληφθεί η επιθυμητή ουσία.
Φυσικές ιδιότητες ουσιών
Κάθε ουσία χαρακτηρίζεται από ένα σύνολο φυσικών και χημικών ιδιοτήτων. Οι φυσικές ιδιότητες είναι ιδιότητες που μπορούν να χαρακτηριστούν χρησιμοποιώντας φυσικά όργανα. Για παράδειγμα, χρησιμοποιώντας ένα θερμόμετρο μπορείτε να προσδιορίσετε τα σημεία τήξης και βρασμού του νερού. Μπορούν να χρησιμοποιηθούν φυσικές μέθοδοι για τον χαρακτηρισμό της ικανότητας μιας ουσίας να άγει ηλεκτρικό ρεύμα, να προσδιορίζει την πυκνότητα της ουσίας, τη σκληρότητά της κ.λπ. Κατά τη διάρκεια των φυσικών διεργασιών, οι ουσίες παραμένουν αμετάβλητες στη σύνθεση.
Οι φυσικές ιδιότητες των ουσιών χωρίζονται σε μετρήσιμες (αυτές που μπορούν να χαρακτηριστούν με χρήση ορισμένων φυσικών οργάνων με αριθμό, για παράδειγμα, υποδεικνύοντας πυκνότητα, σημεία τήξης και βρασμού, διαλυτότητα στο νερό κ.λπ.) και αμέτρητες (αυτές που δεν μπορούν να χαρακτηριστούν από αριθμός ή είναι πολύ δύσκολο - όπως χρώμα, οσμή, γεύση κ.λπ.).
Χημικές ιδιότητες ουσιών
Οι χημικές ιδιότητες μιας ουσίας είναι ένα σύνολο πληροφοριών σχετικά με το ποιες άλλες ουσίες και υπό ποιες συνθήκες μια δεδομένη ουσία εισέρχεται σε χημικές αλληλεπιδράσεις. Το πιο σημαντικό καθήκον της χημείας είναι να αναγνωρίζει τις χημικές ιδιότητες των ουσιών.
Οι χημικοί μετασχηματισμοί περιλαμβάνουν τα μικρότερα σωματίδια ουσιών - άτομα. Κατά τη διάρκεια των χημικών μετασχηματισμών, άλλες ουσίες σχηματίζονται από ορισμένες ουσίες και οι αρχικές ουσίες εξαφανίζονται και στη θέση τους σχηματίζονται νέες ουσίες (προϊόντα αντίδρασης). ΕΝΑ άτομα σεΟλοι διατηρούνται οι χημικοί μετασχηματισμοί. Η αναδιάταξή τους συμβαίνει κατά τη διάρκεια χημικών μετασχηματισμών, οι παλιοί δεσμοί μεταξύ των ατόμων καταστρέφονται και δημιουργούνται νέοι δεσμοί.
Χημικό στοιχείο
Ο αριθμός των διαφορετικών ουσιών είναι τεράστιος (και καθεμία από αυτές έχει το δικό της σύνολο φυσικών και χημικών ιδιοτήτων). Υπάρχουν σχετικά λίγα άτομα στον υλικό κόσμο γύρω μας που διαφέρουν μεταξύ τους ως προς τα πιο σημαντικά χαρακτηριστικά τους - περίπου εκατό. Κάθε τύπος ατόμου έχει το δικό του χημικό στοιχείο. Ένα χημικό στοιχείο είναι μια συλλογή ατόμων με τα ίδια ή παρόμοια χαρακτηριστικά. Περίπου 90 διαφορετικά χημικά στοιχεία βρίσκονται στη φύση. Μέχρι σήμερα, οι φυσικοί έχουν μάθει να δημιουργούν νέους τύπους ατόμων που δεν βρίσκονται στη Γη. Τέτοια άτομα (και, κατά συνέπεια, τέτοια χημικά στοιχεία) ονομάζονται τεχνητά (στα αγγλικά - ανθρωπογενή στοιχεία). Περισσότερα από δύο δωδεκάδες τεχνητά ληφθέντα στοιχεία έχουν συντεθεί μέχρι σήμερα.
Κάθε στοιχείο έχει ένα λατινικό όνομα και ένα σύμβολο ενός ή δύο γραμμάτων. Στη ρωσική χημική βιβλιογραφία δεν υπάρχουν σαφείς κανόνες για την προφορά των συμβόλων των χημικών στοιχείων. Μερικοί το προφέρουν ως εξής: αποκαλούν το στοιχείο στα ρωσικά (σύμβολα νατρίου, μαγνησίου κ.λπ.), άλλοι - με λατινικά γράμματα (σύμβολα άνθρακα, φωσφόρου, θείου), άλλοι - πώς ακούγεται το όνομα του στοιχείου στα λατινικά (σίδηρος, ασήμι, χρυσός, υδράργυρος). Συνήθως προφέρουμε το σύμβολο του στοιχείου υδρογόνο H με τον τρόπο που προφέρεται αυτό το γράμμα στα γαλλικά.
Μια σύγκριση των πιο σημαντικών χαρακτηριστικών των χημικών στοιχείων και των απλών ουσιών δίνεται στον παρακάτω πίνακα. Ένα στοιχείο μπορεί να αντιστοιχεί σε πολλές απλές ουσίες (το φαινόμενο της αλλοτροπίας: άνθρακας, οξυγόνο κ.λπ.), ή ίσως μόνο σε μία (αργό και άλλα αδρανή αέρια).

- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0