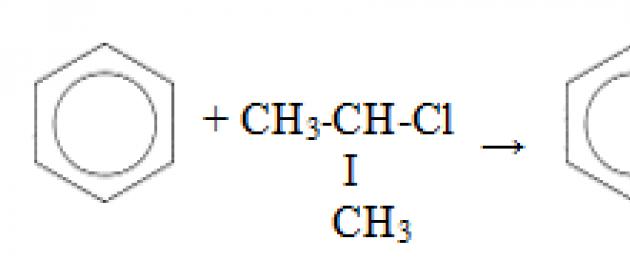ΟΡΙΣΜΟΣ
Βενζόλιο(κυκλοεξατριένιο – 1,3,5) – οργανική ύλη, ο πιο απλός εκπρόσωπος της σειράς αρωματικούς υδρογονάνθρακες.
Τύπος – C 6 H 6 (δομικός τύπος – Εικ. 1). Μοριακή μάζα – 78, 11.
Ρύζι. 1. Δομικοί και χωρικοί τύποι βενζολίου.
Και τα έξι άτομα άνθρακα στο μόριο του βενζολίου βρίσκονται στην υβριδική κατάσταση sp 2. Κάθε άτομο άνθρακα σχηματίζει δεσμούς 3 σ με δύο άλλα άτομα άνθρακα και ένα άτομο υδρογόνου, που βρίσκονται στο ίδιο επίπεδο. Έξι άτομα άνθρακα σχηματίζουν ένα κανονικό εξάγωνο (σ-σκελετός του μορίου του βενζολίου). Κάθε άτομο άνθρακα έχει ένα μη υβριδοποιημένο τροχιακό p που περιέχει ένα ηλεκτρόνιο. Έξι p-ηλεκτρόνια σχηματίζουν ένα ενιαίο νέφος π-ηλεκτρονίων (αρωματικό σύστημα), το οποίο απεικονίζεται ως κύκλος μέσα σε έναν εξαμελή δακτύλιο. Η ρίζα υδρογονάνθρακα που λαμβάνεται από το βενζόλιο ονομάζεται C 6 H 5 - - φαινύλιο (Ph-).
Χημικές ιδιότητες του βενζολίου
Το βενζόλιο χαρακτηρίζεται από αντιδράσεις υποκατάστασης που συμβαίνουν μέσω ενός ηλεκτροφιλικού μηχανισμού:
- αλογόνωση (το βενζόλιο αντιδρά με χλώριο και βρώμιο παρουσία καταλυτών - άνυδρο AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 = C6H5-Cl + HCl;
- νίτρωση (το βενζόλιο αντιδρά εύκολα με το μείγμα νιτροποίησης - μείγμα συμπυκνωμένων νιτρικών και θειικών οξέων)

- αλκυλίωση με αλκένια
C6H6 + CH2 = CH-CH3 → C6H5-CH(CH3)2;
Οι αντιδράσεις προσθήκης στο βενζόλιο οδηγούν σε καταστροφή αρωματικό σύστημακαι εμφανίζονται μόνο σε σκληρές συνθήκες:
— υδρογόνωση (η αντίδραση λαμβάνει χώρα όταν θερμαίνεται, ο καταλύτης είναι Pt)

- προσθήκη χλωρίου (συμβαίνει υπό την επίδραση της υπεριώδους ακτινοβολίας με το σχηματισμό στερεού προϊόντος - εξαχλωροκυκλοεξάνιο (εξαχλωράνιο) - C 6 H 6 Cl 6)

Όπως κάθε οργανική ένωσηΤο βενζόλιο υφίσταται μια αντίδραση καύσης για να σχηματίσει προϊόντα αντίδρασης διοξείδιο του άνθρακακαι νερό (καίγεται με καπνιστή φλόγα):
2C 6 H 6 +15O 2 → 12CO 2 + 6H 2 O.
Φυσικές ιδιότητες του βενζολίου
Το βενζόλιο είναι ένα άχρωμο υγρό, αλλά έχει μια συγκεκριμένη πικάντικη οσμή. Σχηματίζει αζεοτροπικό μείγμα με νερό, αναμιγνύεται καλά με αιθέρες, βενζίνη και διάφορους οργανικούς διαλύτες. Σημείο βρασμού – 80,1 C, σημείο τήξης – 5,5 C. Τοξικό, καρκινογόνο (δηλαδή προάγει την ανάπτυξη καρκίνου).
Παρασκευή και χρήση βενζολίου
Οι κύριες μέθοδοι λήψης βενζολίου:
— αφυδροκυκλοποίηση εξανίου (καταλύτες – Pt, Cr 3 O 2)
CH 3 –(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2;
— αφυδρογόνωση του κυκλοεξανίου (η αντίδραση λαμβάνει χώρα όταν θερμαίνεται, ο καταλύτης είναι Pt)
C6H12 → C6H6 + 4H2;
— τριμερισμός ακετυλενίου (η αντίδραση λαμβάνει χώρα όταν θερμαίνεται στους 600 C, ο καταλύτης είναι ενεργός άνθρακας)
3HC≡CH → C 6 H 6 .
Το βενζόλιο χρησιμεύει ως πρώτη ύλη για την παραγωγή ομολόγων (αιθυλοβενζόλιο, κουμένιο), κυκλοεξάνιο, νιτροβενζόλιο, χλωροβενζόλιο και άλλες ουσίες. Παλαιότερα, το βενζόλιο χρησιμοποιήθηκε ως πρόσθετο στη βενζίνη για την αύξηση του αριθμού οκτανίων της, ωστόσο, τώρα, λόγω της υψηλής τοξικότητάς του, η περιεκτικότητα σε βενζόλιο στο καύσιμο ρυθμίζεται αυστηρά. Το βενζόλιο χρησιμοποιείται μερικές φορές ως διαλύτης.
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
| Ασκηση | Γράψτε τις εξισώσεις που μπορούν να χρησιμοποιηθούν για να πραγματοποιηθούν οι παρακάτω μετασχηματισμοί: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Λύση | Για την παραγωγή ακετυλενίου από μεθάνιο, χρησιμοποιείται η ακόλουθη αντίδραση: 2CH 4 → C 2 H 2 + 3H 2 (t = 1400C). Η παραγωγή βενζολίου από ακετυλένιο είναι δυνατή με την αντίδραση τριμερισμού του ακετυλενίου, η οποία συμβαίνει όταν θερμαίνεται (t = 600 C) και παρουσία ενεργού άνθρακα: 3C 2 H 2 → C 6 H 6 . Η αντίδραση χλωρίωσης του βενζολίου για την παραγωγή χλωροβενζολίου ως προϊόντος πραγματοποιείται παρουσία χλωριούχου σιδήρου (III): C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
ΠΑΡΑΔΕΙΓΜΑ 2
| Ασκηση | Σε 39 g βενζολίου παρουσία χλωριούχου σιδήρου (III), προστέθηκε 1 mol βρωμιούχου νερού. Τι ποσότητα ουσίας και πόσα γραμμάρια από ποια προϊόντα παρήχθη; |
| Λύση | Ας γράψουμε την εξίσωση για την αντίδραση της βρωμίωσης του βενζολίου παρουσία χλωριούχου σιδήρου (III): C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Τα προϊόντα της αντίδρασης είναι βρωμοβενζόλιο και υδροβρώμιο. Μοριακή μάζα βενζολίου υπολογισμένη χρησιμοποιώντας τον πίνακα χημικά στοιχεία DI. Mendeleev – 78 g/mol. Ας βρούμε την ποσότητα του βενζολίου: n(C6H6) = m(C6H6) / M(C6H6); n(C6H6) = 39 / 78 = 0,5 mol. Σύμφωνα με τις συνθήκες του προβλήματος, το βενζόλιο αντέδρασε με 1 mole βρωμίου. Κατά συνέπεια, το βενζόλιο είναι σε έλλειψη και περαιτέρω υπολογισμοί θα γίνουν με χρήση βενζολίου. Σύμφωνα με την εξίσωση αντίδρασης n(C 6 H 6): n(C 6 H 5 Br) : n (HBr) = 1: 1: 1, επομένως n(C 6 H 6) = n (C 6 H 5 Br) =: n(HBr) = 0,5 mol. Τότε, οι μάζες του βρωμοβενζολίου και του υδροβρωμίου θα είναι ίσες: m(C6H5Br) = n(C6H5Br)×M(C6H5Br); m(HBr) = n(HBr)×M(HBr). Μοριακές μάζες βρωμοβενζολίου και υδροβρωμιδίου, υπολογιζόμενες χρησιμοποιώντας τον πίνακα χημικών στοιχείων του D.I. Mendeleev – 157 και 81 g/mol, αντίστοιχα. m(C6H5Br) = 0,5 × 157 = 78,5 g; m(HBr) = 0,5×81 = 40,5 g. |
| Απάντηση | Τα προϊόντα της αντίδρασης είναι βρωμοβενζόλιο και υδροβρώμιο. Οι μάζες του βρωμοβενζολίου και του υδροβρωμίου είναι 78,5 και 40,5 g, αντίστοιχα. |
Οι αρένες είναι αρωματικοί υδρογονάνθρακες που περιέχουν έναν ή περισσότερους δακτυλίους βενζολίου. Ο δακτύλιος βενζολίου αποτελείται από 6 άτομα άνθρακα, μεταξύ των οποίων εναλλάσσονται διπλοί και απλοί δεσμοί.
Είναι σημαντικό να σημειωθεί ότι οι διπλοί δεσμοί στο μόριο του βενζολίου δεν είναι σταθεροί, αλλά κινούνται συνεχώς σε κύκλο.
Οι αρένες ονομάζονται και αρωματικοί υδρογονάνθρακες. Πρώτο μέλος ομόλογες σειρές- βενζόλιο - C 6 H 6. Ο γενικός τύπος της ομόλογης σειράς τους είναι CnH2n-6.
Για πολύ καιρό, η δομική φόρμουλα του βενζολίου παρέμενε μυστήριο. Ο τύπος που πρότεινε ο Kekule με δύο τριπλούς δεσμούς δεν μπορούσε να εξηγήσει το γεγονός ότι το βενζόλιο δεν εισέρχεται σε αντιδράσεις προσθήκης. Όπως αναφέρθηκε παραπάνω, σύμφωνα με τις σύγχρονες έννοιες, οι διπλοί δεσμοί σε ένα μόριο κινούνται συνεχώς, επομένως είναι πιο σωστό να τους σχεδιάσουμε με τη μορφή δακτυλίου.
Λόγω των διπλών δεσμών στο μόριο του βενζολίου, σχηματίζεται σύζευξη. Όλα τα άτομα άνθρακα βρίσκονται σε κατάσταση υβριδισμού sp 2. Γωνία συγκόλλησης - 120°.
Ονοματολογία και ισομέρεια αρένων
Τα ονόματα των αρένων σχηματίζονται προσθέτοντας τα ονόματα των υποκαταστατών στην κύρια αλυσίδα - τον δακτύλιο βενζολίου: βενζόλιο, μεθυλοβενζόλιο (τολουόλιο), αιθυλοβενζόλιο, προπυλοβενζόλιο κ.λπ. Τα υποκατάστατα, ως συνήθως, παρατίθενται με αλφαβητική σειρά. Εάν υπάρχουν αρκετοί υποκαταστάτες στον δακτύλιο βενζολίου, τότε επιλέγεται η συντομότερη διαδρομή μεταξύ τους.

Τα αρένα χαρακτηρίζονται από δομικό ισομερισμό που σχετίζεται με τη θέση των υποκαταστατών. Για παράδειγμα, δύο υποκαταστάτες σε έναν δακτύλιο βενζολίου μπορούν να βρίσκονται σε διαφορετικές θέσεις.
Η θέση των υποκαταστατών στον δακτύλιο βενζολίου ονομάζεται με βάση τη θέση τους μεταξύ τους. Συμβολίζεται με τα προθέματα ορθο-, μετα- και παρά. Παρακάτω θα βρείτε μνημονικές συμβουλές για την επιτυχή απομνημόνευσή τους;)

Λήψη αρένων
Οι αρένες αποκτώνται με διάφορους τρόπους:

Χημικές ιδιότητεςαρένες
Οι αρένες είναι αρωματικοί υδρογονάνθρακες που περιέχουν ένα δακτύλιο βενζολίου με συζευγμένους διπλούς δεσμούς. Αυτό το χαρακτηριστικό καθιστά τις αντιδράσεις προσθήκης δύσκολες (και όμως πιθανές!)
Να θυμάστε ότι, σε αντίθεση με άλλες ακόρεστες ενώσεις, το βενζόλιο και τα ομόλογά του δεν αποχρωματίζονται βρωμιούχο νερόκαι διάλυμα υπερμαγγανικού καλίου.

© Bellevich Yuri Sergeevich 2018-2020
Αυτό το άρθρο γράφτηκε από τον Yuri Sergeevich Bellevich και αποτελεί πνευματική του ιδιοκτησία. Η αντιγραφή, διανομή (συμπεριλαμβανομένης της αντιγραφής σε άλλους ιστότοπους και πόρους στο Διαδίκτυο) ή οποιαδήποτε άλλη χρήση πληροφοριών και αντικειμένων χωρίς την προηγούμενη συγκατάθεση του κατόχου των πνευματικών δικαιωμάτων τιμωρείται από το νόμο. Για να λάβετε υλικό του άρθρου και άδεια χρήσης τους, επικοινωνήστε
Αρωματικά HC (αρένες)– πρόκειται για υδρογονάνθρακες των οποίων τα μόρια περιέχουν έναν ή περισσότερους δακτυλίους βενζολίου.
Παραδείγματα αρωματικών υδρογονανθράκων:

Αρένες της σειράς βενζολίου (μονοκυκλικές αρένες)
Γενικός τύπος:CnH 2n-6, n≥6
Ο απλούστερος εκπρόσωπος των αρωματικών υδρογονανθράκων είναι το βενζόλιο, ο εμπειρικός τύπος του είναι C 6 H 6.
Ηλεκτρονική δομή του μορίου του βενζολίου
Ο γενικός τύπος των μονοκυκλικών αρενών C n H 2 n -6 δείχνει ότι είναι ακόρεστες ενώσεις.
Το 1856, ο Γερμανός χημικός A.F. Ο Kekule πρότεινε έναν κυκλικό τύπο για το βενζόλιο με συζευγμένους δεσμούς (εναλλασσόμενοι απλοί και διπλοί δεσμοί) - κυκλοεξατριένιο-1,3,5: 
Αυτή η δομή του μορίου του βενζολίου δεν εξηγεί πολλές από τις ιδιότητες του βενζολίου:
- Το βενζόλιο χαρακτηρίζεται από αντιδράσεις υποκατάστασης και όχι από αντιδράσεις προσθήκης χαρακτηριστικές των ακόρεστων ενώσεων. Οι αντιδράσεις προσθήκης είναι δυνατές, αλλά είναι πιο δύσκολες από ό,τι για ?
- Το βενζόλιο δεν εισέρχεται σε αντιδράσεις που είναι ποιοτικές αντιδράσειςγια ακόρεστους υδρογονάνθρακες (με βρωμιούχο νερό και διάλυμα KMnO 4).
Μεταγενέστερες μελέτες περίθλασης ηλεκτρονίων έδειξαν ότι όλοι οι δεσμοί μεταξύ των ατόμων άνθρακα στο μόριο του βενζολίου έχουν το ίδιο μήκος 0,140 nm (η μέση τιμή μεταξύ του μήκους ενός απλού Συνδέσεις S-S 0,154 nm και διπλός δεσμός C=C 0,134 nm). Η γωνία μεταξύ των δεσμών σε κάθε άτομο άνθρακα είναι 120°. Το μόριο είναι ένα κανονικό επίπεδο εξάγωνο.
Η σύγχρονη θεωρία για να εξηγήσει τη δομή του μορίου C 6 H 6 χρησιμοποιεί την ιδέα του υβριδισμού των ατομικών τροχιακών.
Τα άτομα άνθρακα στο βενζόλιο βρίσκονται σε κατάσταση υβριδισμού sp 2. Κάθε άτομο «C» σχηματίζει τρεις δεσμούς σ (δύο με άτομα άνθρακα και έναν με άτομο υδρογόνου). Όλοι οι δεσμοί σ βρίσκονται στο ίδιο επίπεδο:
Κάθε άτομο άνθρακα έχει ένα p-ηλεκτρόνιο, το οποίο δεν συμμετέχει στον υβριδισμό. Τα μη υβριδισμένα ρ-τροχιακά των ατόμων άνθρακα βρίσκονται σε επίπεδο κάθετο στο επίπεδο των δεσμών σ. Κάθε p-σύννεφο επικαλύπτεται με δύο γειτονικά p-σύννεφα και ως αποτέλεσμα σχηματίζεται ένα ενιαίο συζευγμένο π-σύστημα (θυμηθείτε την επίδραση της σύζευξης των p-ηλεκτρονίων στο μόριο 1,3-βουταδιενίου, που συζητήθηκε στο θέμα «Υδρογονάνθρακες Diene ”):
Ο συνδυασμός έξι σ-δεσμών με ένα μόνο π-σύστημα ονομάζεται αρωματική σύνδεση.
Ένας δακτύλιος έξι ατόμων άνθρακα που συνδέονται με έναν αρωματικό δεσμό ονομάζεται δακτύλιος βενζολίουή δακτύλιος βενζολίου.
Σύμφωνα με τις σύγχρονες ιδέες για ηλεκτρονική δομήτο μόριο βενζολίου C 6 H 6 απεικονίζεται ως εξής:

Φυσικές ιδιότητες του βενζολίου
Το βενζόλιο υπό κανονικές συνθήκες είναι ένα άχρωμο υγρό. t o pl = 5,5 o C; t o kip. = 80 o C; έχει μια χαρακτηριστική μυρωδιά. δεν αναμιγνύεται με νερό, καλός διαλύτης, πολύ τοξικός.
Χημικές ιδιότητες του βενζολίου
Ο αρωματικός δεσμός καθορίζει τις χημικές ιδιότητες του βενζολίου και άλλων αρωματικών υδρογονανθράκων.
Το σύστημα των 6π ηλεκτρονίων είναι πιο σταθερό από τους συνηθισμένους π-δεσμούς δύο ηλεκτρονίων. Επομένως, οι αντιδράσεις προσθήκης είναι λιγότερο χαρακτηριστικές για τους αρωματικούς υδρογονάνθρακες παρά για τους ακόρεστους υδρογονάνθρακες. Οι πιο χαρακτηριστικές αντιδράσεις για τις αρένες είναι οι αντιδράσεις υποκατάστασης.
Εγώ. Αντιδράσεις υποκατάστασης
1.Αλογόνωση

2. Περιέχων άζωτον
Η αντίδραση πραγματοποιείται με ένα μείγμα οξέων (μίγμα νιτροποίησης): 
3.Σουλφονίωση

4.Αλκυλίωση (αντικατάσταση του ατόμου «Η» με μια ομάδα αλκυλίου) – Αντιδράσεις Friedel-Crafts, σχηματίζονται ομόλογα βενζολίου:

Αντί για αλογονοαλκάνια, μπορούν να χρησιμοποιηθούν αλκένια (παρουσία καταλύτη - AlCl 3 ή ανόργανου οξέος):

II. Αντιδράσεις προσθήκης
1.Υδρογόνωση

2.Προσθήκη χλωρίου

III.Αντιδράσεις οξείδωσης
1. Καύση
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Όχι πλήρης οξείδωση (KMnO 4 ή K 2 Cr 2 O 7 σε όξινο περιβάλλον). Ο δακτύλιος βενζολίου είναι ανθεκτικός σε οξειδωτικά μέσα. Δεν εμφανίζεται καμία αντίδραση.
Λήψη βενζολίου
Στη βιομηχανία:
1) επεξεργασία πετρελαίου και άνθρακα.
2) αφυδρογόνωση κυκλοεξανίου:

3) αφυδροκυκλοποίηση (αρωματοποίηση) εξανίου:

Στο εργαστήριο:
Σύντηξη αλάτων βενζοϊκού οξέος με:

Ισομερισμός και ονοματολογία ομολόγων βενζολίου
Οποιοδήποτε ομόλογο βενζολίου έχει πλευρική αλυσίδα, δηλ. ρίζες αλκυλίου δεσμευμένες σε δακτύλιο βενζολίου. Το πρώτο ομόλογο βενζολίου είναι ένας δακτύλιος βενζολίου συνδεδεμένος με μια ρίζα μεθυλίου: 
Το τολουόλιο δεν έχει ισομερή, αφού όλες οι θέσεις στον δακτύλιο βενζολίου είναι ισοδύναμες.
Για τα επόμενα ομόλογα του βενζολίου, είναι δυνατός ένας τύπος ισομέρειας - ισομερισμός πλευρικής αλυσίδας, ο οποίος μπορεί να είναι δύο τύπων:
1) ισομέρεια του αριθμού και της δομής των υποκαταστατών.
2) ισομέρεια της θέσης των υποκαταστατών.



Φυσικές ιδιότητες τολουολίου
Τολουΐνη- άχρωμο υγρό με χαρακτηριστική οσμή, αδιάλυτο στο νερό, διαλυτό σε οργανικούς διαλύτες. Το τολουόλιο είναι λιγότερο τοξικό από το βενζόλιο.
Χημικές ιδιότητες του τολουολίου
Εγώ. Αντιδράσεις υποκατάστασης
1.Αντιδράσεις που αφορούν τον δακτύλιο βενζολίου
Το μεθυλοβενζόλιο εισέρχεται σε όλες τις αντιδράσεις υποκατάστασης στις οποίες εμπλέκεται το βενζόλιο, και ταυτόχρονα παρουσιάζει υψηλότερη αντιδραστικότητα, οι αντιδράσεις προχωρούν με ταχύτερο ρυθμό.
Η ρίζα μεθυλίου που περιέχεται στο μόριο τολουολίου είναι υποκαταστάτης του είδους, επομένως, ως αποτέλεσμα αντιδράσεων υποκατάστασης στον δακτύλιο βενζολίου, λαμβάνονται ορθο- και παρα-παράγωγα τολουολίου ή, σε περίπτωση περίσσειας του αντιδραστηρίου, τριπαράγωγα του γενικού τύπου:

α) αλογόνωση


Με περαιτέρω χλωρίωση, μπορούν να ληφθούν διχλωρομεθυλοβενζόλιο και τριχλωρομεθυλοβενζόλιο:

II. Αντιδράσεις προσθήκης
Υδρογόνωση

III.Αντιδράσεις οξείδωσης
1.Καύση
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Ατελής οξείδωση
Σε αντίθεση με το βενζόλιο, τα ομόλογά του οξειδώνονται από ορισμένους οξειδωτικούς παράγοντες. Στην περίπτωση αυτή, η πλευρική αλυσίδα υπόκειται σε οξείδωση, στην περίπτωση του τολουολίου, η μεθυλ ομάδα. Ήπιοι οξειδωτικοί παράγοντες όπως το MnO 2 το οξειδώνουν σε μια ομάδα αλδεΰδης, οι ισχυρότεροι οξειδωτικοί παράγοντες (KMnO 4) προκαλούν περαιτέρω οξείδωση σε ένα οξύ: 
Οποιοδήποτε ομόλογο βενζολίου με μία πλευρική αλυσίδα οξειδώνεται από έναν ισχυρό οξειδωτικό παράγοντα όπως το KMnO4 σε βενζοϊκό οξύ, δηλ. η πλευρική αλυσίδα σπάει με την οξείδωση του αποσπώμενου τμήματος σε CO 2. Για παράδειγμα: 
Εάν υπάρχουν πολλές πλευρικές αλυσίδες, καθεμία από αυτές οξειδώνεται καρβοξυλική ομάδακαι ως αποτέλεσμα, σχηματίζονται πολυβασικά οξέα, για παράδειγμα:

Λήψη τολουολίου:
Στη βιομηχανία:
1) επεξεργασία πετρελαίου και άνθρακα.
2) αφυδρογόνωση μεθυλοκυκλοεξανίου:

3) αφυδροκυκλοποίηση επτανίου:
Στο εργαστήριο:
1) Αλκυλίωση Friedel-Crafts.
2) Αντίδραση Wurtz-Fittig(αντίδραση νατρίου με μίγμα αλογονοβενζολίου και αλογονοαλκανίου).
Η πρώτη ομάδα αντιδράσεων είναι οι αντιδράσεις υποκατάστασης. Είπαμε ότι οι αρένες δεν έχουν πολλαπλούς δεσμούς στη δομή του μορίου, αλλά περιέχουν ένα συζευγμένο σύστημα έξι ηλεκτρονίων, το οποίο είναι πολύ σταθερό και δίνει επιπλέον αντοχή στον δακτύλιο βενζολίου. Επομένως, στις χημικές αντιδράσεις, πρώτα συμβαίνει η αντικατάσταση των ατόμων υδρογόνου και όχι η καταστροφή του δακτυλίου του βενζολίου.
Έχουμε ήδη συναντήσει αντιδράσεις υποκατάστασης όταν μιλάμε για αλκάνια, αλλά γι' αυτά αυτές οι αντιδράσεις ακολούθησαν έναν ριζικό μηχανισμό, ενώ οι αρένες χαρακτηρίζονται από έναν ιοντικό μηχανισμό αντιδράσεων υποκατάστασης.
Πρώτααλογόνωση χημικών ιδιοτήτων. Αντικατάσταση ατόμου υδρογόνου με άτομο αλογόνου, χλώριο ή βρώμιο.
Η αντίδραση γίνεται όταν θερμαίνεται και πάντα με τη συμμετοχή καταλύτη. Στην περίπτωση του χλωρίου, θα μπορούσε να είναι χλωριούχο αλουμίνιο ή χλωριούχος σίδηρος τρία. Ο καταλύτης πολώνει το μόριο αλογόνου, προκαλώντας διάσπαση ετερολυτικού δεσμού και παράγοντας ιόντα.
Το χλώριο είναι ένα θετικά φορτισμένο ιόν και αντιδρά με το βενζόλιο.
Εάν η αντίδραση συμβεί με βρώμιο, τότε ο καταλύτης είναι βρωμιούχος σίδηρος ή βρωμιούχο αργίλιο.

Είναι σημαντικό να σημειωθεί ότι η αντίδραση λαμβάνει χώρα με μοριακό βρώμιο και όχι με βρωμιούχο νερό. Το βενζόλιο δεν αντιδρά με βρωμιούχο νερό.
Η αλογόνωση των ομολόγων βενζολίου έχει τα δικά της χαρακτηριστικά. Στο μόριο τολουολίου, η ομάδα μεθυλίου διευκολύνει την υποκατάσταση στον δακτύλιο, η αντιδραστικότητα αυξάνεται και η αντίδραση λαμβάνει χώρα υπό ηπιότερες συνθήκες, δηλαδή σε θερμοκρασία δωματίου.

Είναι σημαντικό να σημειωθεί ότι η υποκατάσταση λαμβάνει χώρα πάντα στις θέσεις ορθο και παρά, έτσι λαμβάνεται ένα μείγμα ισομερών.
Δεύτεροςιδιότητα νίτρωση του βενζολίου, εισαγωγή μιας νιτροομάδας στον δακτύλιο βενζολίου.

Ένα βαρύ κιτρινωπό υγρό με τη μυρωδιά πικραμύγδαλου σχηματίζεται νιτροβενζόλιο, οπότε η αντίδραση μπορεί να είναι ποιοτική προς το βενζόλιο. Για τη νίτρωση χρησιμοποιείται ένα μίγμα νιτροποίησης συμπυκνωμένου νιτρικού και θειικού οξέος. Η αντίδραση πραγματοποιείται με θέρμανση.
Να υπενθυμίσω ότι για τη νίτρωση των αλκανίων στην αντίδραση Konovalov, αραιωμένο Νιτρικό οξύχωρίς προσθήκη θείου.
Κατά τη νίτρωση του τολουολίου, καθώς και κατά την αλογόνωση, σχηματίζεται ένα μείγμα ορθο- και παρα-ισομερών.

Τρίτοςιδιότητα αλκυλίωση του βενζολίου με αλογονοαλκάνια.

Αυτή η αντίδραση επιτρέπει την εισαγωγή μιας ρίζας υδρογονάνθρακα στον δακτύλιο βενζολίου και μπορεί να θεωρηθεί μέθοδος για την παραγωγή ομολόγων βενζολίου. Το χλωριούχο αλουμίνιο χρησιμοποιείται ως καταλύτης, ο οποίος προάγει την αποσύνθεση του μορίου του αλογονοαλκανίου σε ιόντα. Η θέρμανση είναι επίσης απαραίτητη.
Τέταρτοςιδιότητα αλκυλίωση του βενζολίου με αλκένια.

Με αυτόν τον τρόπο μπορείτε να λάβετε, για παράδειγμα, κουμένιο ή αιθυλοβενζόλιο. Καταλύτης χλωριούχο αλουμίνιο.
2. Αντιδράσεις προσθήκης στο βενζόλιο
Η δεύτερη ομάδα αντιδράσεων είναι οι αντιδράσεις προσθήκης. Είπαμε ότι αυτές οι αντιδράσεις δεν είναι τυπικές, αλλά είναι δυνατές κάτω από αρκετά αυστηρές συνθήκες με την καταστροφή του νέφους πι-ηλεκτρονίων και το σχηματισμό δεσμών έξι σίγμα.
Πέμπτοςιδιότητα στον γενικό κατάλογο υδρογόνωση, προσθήκη υδρογόνου.

Θερμοκρασία, πίεση, νικέλιο ή πλατίνα καταλύτη. Το τολουόλιο μπορεί να αντιδράσει με τον ίδιο τρόπο.
Εκτοςχλωρίωση ιδιοκτησίας. σημειώστε ότι μιλάμε γιαειδικά για την αλληλεπίδραση με το χλώριο, αφού το βρώμιο δεν εισέρχεται σε αυτή την αντίδραση.
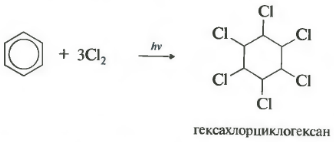
Η αντίδραση λαμβάνει χώρα υπό σκληρή υπεριώδη ακτινοβολία. Σχηματίζεται εξαχλωροκυκλοεξάνιο, ένα άλλο όνομα για το εξαχλωράνιο, ένα στερεό.
Είναι σημαντικό να το θυμάστε αυτό για το βενζόλιο αδύνατοναντιδράσεις προσθήκης υδραλογονιδίων (υδροαλογόνωση) και προσθήκη νερού (ενυδάτωση).
3. Αντικατάσταση στην πλευρική αλυσίδα των ομολόγων βενζολίου
Η τρίτη ομάδα αντιδράσεων αφορά μόνο ομόλογα βενζολίου - πρόκειται για αντικατάσταση στην πλευρική αλυσίδα.
Εβδομοςιδιότητα στη γενική λίστα αλογόνωση στο άτομο άνθρακα άλφα στην πλευρική αλυσίδα.

Η αντίδραση συμβαίνει όταν θερμαίνεται ή ακτινοβολείται και πάντα μόνο στον άλφα άνθρακα. Καθώς η αλογόνωση συνεχίζεται, το δεύτερο άτομο αλογόνου θα επιστρέψει στη θέση άλφα.
4. Οξείδωση ομολόγων βενζολίου
Η τέταρτη ομάδα αντιδράσεων είναι η οξείδωση.
Ο δακτύλιος βενζολίου είναι πολύ δυνατός, άρα βενζίνη δεν οξειδώνεταιτο υπερμαγγανικό κάλιο δεν αποχρωματίζει το διάλυμά του. Αυτό είναι πολύ σημαντικό να το θυμάστε.
Αλλά τα ομόλογα βενζολίου οξειδώνονται από ένα οξινισμένο διάλυμα υπερμαγγανικού καλίου όταν θερμαίνονται. Και αυτή είναι η όγδοη χημική ιδιότητα.

Αυτό παράγει βενζοϊκό οξύ. Παρατηρείται αποχρωματισμός του διαλύματος. Σε αυτή την περίπτωση, ανεξάρτητα από το πόσο μακριά είναι η ανθρακική αλυσίδα του υποκαταστάτη, σπάει πάντα μετά το πρώτο άτομο άνθρακα και το άτομο άλφα οξειδώνεται σε μια καρβοξυλομάδα με το σχηματισμό βενζοϊκού οξέος. Το υπόλοιπο του μορίου οξειδώνεται στο αντίστοιχο οξύ ή, αν είναι μόνο ένα άτομο άνθρακα, σε διοξείδιο του άνθρακα.
Εάν ένα ομόλογο βενζολίου έχει περισσότερους από έναν υποκαταστάτες υδρογονάνθρακα στον αρωματικό δακτύλιο, τότε η οξείδωση λαμβάνει χώρα σύμφωνα με τους ίδιους κανόνες - ο άνθρακας που βρίσκεται στη θέση άλφα οξειδώνεται.

Αυτό το παράδειγμα παράγει ένα διβασικό αρωματικό οξύ που ονομάζεται φθαλικό οξύ.
Θα ήθελα ιδιαίτερα να σημειώσω την οξείδωση του κουμένιου, του ισοπροπυλοβενζολίου, από το ατμοσφαιρικό οξυγόνο παρουσία θειικού οξέος.

Αυτή είναι η λεγόμενη μέθοδος κουμένιου για την παραγωγή φαινόλης. Κατά κανόνα, αυτή την αντίδραση συναντά κανείς σε θέματα που σχετίζονται με την παραγωγή φαινόλης. Αυτή είναι μια βιομηχανική μέθοδος.
Ενατοςιδιότητα καύση, πλήρης οξείδωση με οξυγόνο. Το βενζόλιο και τα ομόλογά του καίγονται σε διοξείδιο του άνθρακα και νερό.
Ας γράψουμε την εξίσωση καύσης του βενζολίου σε γενική μορφή.
Σύμφωνα με το νόμο της διατήρησης της μάζας, πρέπει να υπάρχουν τόσα άτομα στα αριστερά όσα άτομα στα δεξιά. Γιατί στις χημικές αντιδράσεις τα άτομα δεν εξαφανίζονται, αλλά απλώς αλλάζει η σειρά των δεσμών μεταξύ τους. Άρα θα υπάρχουν τόσα μόρια διοξειδίου του άνθρακα όσα άτομα άνθρακα στο μόριο αρενίου, αφού το μόριο περιέχει ένα άτομο άνθρακα. Δηλαδή, n μόρια CO 2. Θα υπάρχουν δύο φορές λιγότερα μόρια νερού από τα άτομα υδρογόνου, δηλαδή (2n-6)/2, που σημαίνει n-3.
Υπάρχει ο ίδιος αριθμός ατόμων οξυγόνου αριστερά και δεξιά. Στα δεξιά υπάρχουν 2n από το διοξείδιο του άνθρακα, επειδή κάθε μόριο έχει δύο άτομα οξυγόνου, συν n-3 από το νερό, για ένα σύνολο 3n-3. Στα αριστερά υπάρχει ο ίδιος αριθμός ατόμων οξυγόνου 3n-3, που σημαίνει ότι υπάρχουν δύο φορές λιγότερα μόρια, επειδή το μόριο περιέχει δύο άτομα. Δηλαδή (3n-3)/2 μόρια οξυγόνου.
Έτσι, έχουμε συντάξει μια εξίσωση για την καύση ομολόγων βενζολίου σε γενική μορφή.
PRTSVSh (F) Ομοσπονδιακό κρατικό προϋπολογισμό Εκπαιδευτικό Ίδρυμα Ανώτατης Επαγγελματικής Εκπαίδευσης
Τμήμα Πυρασφάλειας
Δοκιμή
στο γνωστικό αντικείμενο "Θεωρία Καύσης και Εκρήξεων"
Εργασία Νο. 1
Προσδιορίστε τις συγκεκριμένες θεωρητικές ποσότητες και όγκο αέρα που απαιτείται για την πλήρη καύση ατμών βενζολίου. Οι συνθήκες στις οποίες βρίσκεται ο αέρας χαρακτηρίζονται από θερμοκρασία Tb και πίεση Pb, και ατμούς βενζολίου από θερμοκρασία Tg και πίεση Pg. Εκφράστε τα αποτελέσματα του υπολογισμού στις ακόλουθες μονάδες: ; ;;;
Αρχικά δεδομένα (N - αριθμός ομάδας, n - αριθμός σύμφωνα με τη λίστα μαθητών:
TV=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 K
Рв=?10 3 =95900 Pa;
Tg=300;(δ1) Ν δ2?Ν;(α1) n δ0,2?n= 321,6 Κ;
Рr=?10 3 =79400 Pa.
С6Н6+7,5О2+7,5?3,76N2=6CO2+3pO+7,5?3,76N2+Qp (1),
όπου Qr είναι θερμότητα χημική αντίδραση. Από δεδομένη εξίσωσηείναι δυνατός ο προσδιορισμός των στοιχειομετρικών συντελεστών του βενζολίου και του μοριακού οξυγόνου: Vg = 1, V0 = 7,5
2. Συγκεκριμένη θεωρητική ποσότητα αέρα - ο αριθμός των χιλιογραμμομορίων αέρα που είναι απαραίτητα για την πλήρη καύση ενός κιλομορίου βενζολίου, που υπολογίζεται με τον τύπο:
όπου 4,76 είναι η ποσότητα αέρα που περιέχει μοναδιαία ποσότητα οξυγόνου, = είναι η αναλογία των στοιχειομετρικών συντελεστών του μοριακού οξυγόνου (Vo) και του βενζολίου (Vg)
Αντικαθιστώντας τις τιμές των Vo και Vg σε (d), παίρνουμε:
3. Ο όγκος του αέρα που απαιτείται για την πλήρη καύση ενός kilomole βενζολίου προσδιορίζεται ως εξής:
όπου είναι ο όγκος ενός kilomole αέρα σε θερμοκρασία Тв και πίεση Рв. Η τιμή υπολογίζεται χρησιμοποιώντας τον τύπο
όπου 22,4 είναι ο μοριακός όγκος του αερίου υπό κανονικές συνθήκες, Po = 101325 Pa είναι κανονική πίεση, To = 273 K είναι η κανονική θερμοκρασία.
Αντικαθιστώντας τα TV, To, Pv, Po σε (5), παίρνουμε
Ο συγκεκριμένος θεωρητικός όγκος αέρα υπολογίζεται με τον τύπο (4):
4. Ο όγκος του αέρα που απαιτείται για την πλήρη καύση μιας μονάδας όγκου αερίου καυσίμου προσδιορίζεται ως εξής:
όπου είναι ο όγκος ενός κιλομορίου καυσίμου - ατμού βενζολίου σε θερμοκρασία Tg και πίεση Pg. Λαμβάνοντας υπ 'όψιν ότι
και αντικαθιστώντας τα (8) και (5) στο (7), λαμβάνουμε την ακόλουθη έκφραση για τον συγκεκριμένο θεωρητικό όγκο αέρα:
Υπολογίζουμε την τιμή αυτής της παραμέτρου της διαδικασίας καύσης:
Ο όγκος του αέρα που απαιτείται για την πλήρη καύση ενός κιλού βενζολίου προσδιορίζεται ως εξής:
πού είναι η μοριακή μάζα του καυσίμου - η μάζα ενός χιλιογραμμομέτρου βενζολίου, εκφρασμένη σε κιλά. Η μοριακή μάζα του βενζολίου είναι αριθμητικά ίση με αυτήν μοριακό βάροςβρίσκεται με τον τύπο:
Ac?nc+An?nn, УiAi?ni (11)
όπου As και An - ατομικά βάρηάνθρακα και υδρογόνο, nc και nn - ο αριθμός των ατόμων άνθρακα σε ένα μόριο βενζολίου. Αντικαθιστώντας τις τιμές Ac = 12, nc = 6, An = 1, nn = 6, παίρνουμε:
Βρίσκουμε τον συγκεκριμένο θεωρητικό όγκο αέρα αντικαθιστώντας τις τιμές του n μέσα και στον τύπο (10):
Αποτέλεσμα υπολογισμού:
Εργασία Νο. 2
Προσδιορίστε τη συγκεκριμένη θεωρητική ποσότητα, όγκο και σύσταση των προϊόντων καύσης βενζολίου, εάν είναι γνωστοί ο συντελεστής περίσσειας αέρα b, η θερμοκρασία Tp και η πίεση Pp των προϊόντων καύσης, η θερμοκρασία Tg και η πίεση Pg των ατμών βενζολίου. Εκφράστε τα αποτελέσματα του υπολογισμού σε μοριακά κλάσματα (ποσοστό) και στις ακόλουθες μονάδες: ; ;;
Αρχικά δεδομένα:
v=1,5+(?1) N δ0,1?Ν;(?1) n δ0,01?n = 0,2;
Рп=?10 3 = 68400 Pa;
Тп=1600?(?1) N?20?N?(?1) n?2?n = 1816 K;
Tg=273;(δ1) Ν δ2?Ν+(δ1) η δ0,2;n = 295,4 Κ;
Рг=?10 3 = 111600 Pa;
διάλυμα (N=11, n=2).
1. Ας γράψουμε τη στοιχειομετρική εξίσωση για την αντίδραση καύσης του βενζολίου στον αέρα:
C6H6 +7,5O 2 +7,5?3,76N 2 =6CO 2 +3H 2 O + 7,5?3,76N 2 +Qp, (1)
όπου Qp είναι η θερμότητα της χημικής αντίδρασης. Από αυτή την εξίσωση προσδιορίζουμε τους ακόλουθους στοιχειομετρικούς συντελεστές:
V CO2 =6, V pO =3, V C6H6 =1, V O2 =7,5, V N2 =7,5;3,76
2. Προσδιορίστε την εκτιμώμενη ποσότητα προϊόντων καύσης για ένα χιλιογραμμάριο καυσίμου:
Αντικαθιστώντας σε (2) τις τιμές των στοιχειομετρικών συντελεστών των προϊόντων καύσης και του καυσίμου, λαμβάνουμε:
3. Η συγκεκριμένη θεωρητική ποσότητα αέρα - ο αριθμός των χιλιογραμμομέτρων αέρα που απαιτούνται για την πλήρη καύση ενός χιλιογραμμομέτρου καυσίμου, προσδιορίζεται χρησιμοποιώντας τον τύπο:
Όπου 4,76 είναι η ποσότητα αέρα που περιέχει μια μονάδα ποσότητας οξυγόνου,
Λόγος στοιχειομετρικών συντελεστών μοριακού οξυγόνου και βενζολίου.
Αντικαθιστώντας σε (4) τις τιμές V O2 =7,5 και V C6H6 =1, λαμβάνουμε:
4. Η περίσσεια ποσότητα αέρα ανά 1 Kmol καυσίμου προσδιορίζεται από την έκφραση:
αέρας καύσης ατμού βενζολίου
Αντικατάσταση τιμών σε αυτήν την έκφραση
37,7(0,2-1)=30,16(7)
5. Η συνολική ποσότητα προϊόντων καύσης ανά μονάδα ποσότητας καυσίμου ουσίας προσδιορίζεται από το άθροισμα:
Αφού αντικαταστήσουμε τις τιμές και παίρνουμε:
6. Τα μοριακά κλάσματα των προϊόντων καύσης, εκφρασμένα σε ποσοστό, προσδιορίζονται ως εξής:
Στους τύπους (9) για τα μοριακά κλάσματα αζώτου και οξυγόνου στα προϊόντα καύσης, 0,79 και 0,21 είναι τα μοριακά κλάσματα αυτών των ουσιών στον αέρα, η περίσσεια των οποίων οδηγεί σε αύξηση της αναλογίας αζώτου και στην εμφάνιση οξυγόνου στα προϊόντα καύσης.
7. Για τον προσδιορισμό των συγκεκριμένων όγκων και προϊόντων καύσης, είναι απαραίτητο να υπολογιστεί ο μοριακός όγκος τους - ο όγκος ενός χιλιογραμμομέτρου αερίου υπό τις συνθήκες στις οποίες βρίσκονται τα προϊόντα:
όπου 22,4 είναι ο όγκος ενός kilomol αερίου υπό κανονικές συνθήκες, T 0 = 273 K είναι η κανονική θερμοκρασία, Po = 101325 Pa είναι η κανονική πίεση.
Αντικαθιστώντας τις τιμές Po, To σε (10), λαμβάνουμε:
Ο όγκος των προϊόντων που σχηματίζονται κατά την καύση ενός κιλού καυσίμου, χωρίς να λαμβάνεται υπόψη η περίσσεια αέρα, υπολογίζεται ως εξής:
πού είναι η μοριακή μάζα του καυσίμου - η μάζα ενός χιλιογραμμομέτρου βενζολίου, εκφρασμένη σε κιλά. Η μοριακή μάζα του βενζολίου βρίσκεται με τον τύπο:
όπου Ac και An είναι τα ατομικά βάρη του άνθρακα (12) και του υδρογόνου (1), n ·c και n n είναι οι αριθμοί των ατόμων άνθρακα (6) και υδρογόνου (6) στα μόρια βενζολίου (C 6 H 6).
Αντικαθιστώντας τις τιμές και στο (12) παίρνουμε
Ο πλεονάζων όγκος αέρα ανά 1 κιλό καυσίμου προσδιορίζεται ως εξής:
όπου είναι ο όγκος ενός χιλιογραμμομέτρου περίσσειας αέρα, που αποτελεί μέρος των προϊόντων καύσης. Εφόσον η θερμοκρασία και η πίεση της περίσσειας αέρα αντιστοιχούν στη θερμοκρασία και την πίεση των προϊόντων καύσης, τότε = =220,7.
Αντικαθιστώντας αυτήν την τιμή, όπως και στην (14), λαμβάνουμε:
Για να υπολογίσουμε τον ειδικό όγκο των προϊόντων πλήρους καύσης καυσίμου, θα υποθέσουμε ότι οι ατμοί βενζολίου έχουν θερμοκρασία Tg σε πίεση:
όπου είναι ο όγκος ενός κιλομορίου ατμού βενζολίου σε θερμοκρασία Tg και πίεση Pg. Ο μοριακός όγκος του καυσίμου υπολογίζεται με τον τύπο:
Αντικαθιστώντας την τιμή που προκύπτει και τέτοιες τιμές στο (17), παίρνουμε:
Ο πλεονάζων όγκος αέρα ανά κυβικό μέτρο ατμών βενζολίου προσδιορίζεται ως εξής:
Αντικατάσταση σε (20) τιμές =30,16 , =και
δίνει το εξής αποτέλεσμα:
Ο συνολικός ειδικός όγκος των προϊόντων καύσης, λαμβάνοντας υπόψη την περίσσεια αέρα, προσδιορίζεται από το άθροισμα
Αποτέλεσμα υπολογισμού:
X CO2 = %; X H2O = 4,4%; X N2 =%; X O2 =11,7%
Παρόμοια έγγραφα
Υπολογισμός του συντελεστή ευφλεκτότητας του νιτροβενζολίου C6H5NO2 και του δισουλφιδίου του άνθρακα CS2. Εξίσωση για την αντίδραση καύσης οξικού προπυλεστέρα στον αέρα. Υπολογισμός του όγκου του αέρα και των προϊόντων καύσης κατά την καύση εύφλεκτου αερίου. Προσδιορισμός του σημείου ανάφλεξης του τολουολίου χρησιμοποιώντας τον τύπο του V. Blinov.
δοκιμή, προστέθηκε 04/08/2017
Υπολογισμός του όγκου του αέρα και των προϊόντων καύσης που σχηματίζονται κατά την καύση μιας ουσίας. Εξίσωση για την αντίδραση καύσης αιθυλενογλυκόλης στον αέρα. Καύση μείγματος εύφλεκτων αερίων. Υπολογισμός της θερμοκρασίας αδιαβατικής καύσης για ένα στοιχειομετρικό μείγμα. Καύση προπανόλης.
δοκιμή, προστέθηκε στις 17/10/2012
Τύπος καύσης και οι κύριες παράμετροί της. Χημική μετατροπή καυσίμου και οξειδωτικού σε προϊόντα καύσης. Εξισώσεις υλικού και θερμικής ισορροπίας της αντίδρασης καύσης. Η επίδραση του συντελεστή περίσσειας αέρα στη σύνθεση των προϊόντων καύσης και στη θερμοκρασία καύσης.
δοκιμή, προστέθηκε 17/01/2013
Προσδιορισμός του όγκου του αέρα που απαιτείται για την πλήρη καύση μιας μονάδας μάζας μιας εύφλεκτης ουσίας. Σύνθεση προϊόντων καύσης ανά μονάδα μάζας καύσιμης ουσίας. Όρια διάδοσης φλόγας μιγμάτων αερίου, ατμού, σκόνης-αέρα. Εκρηκτική πίεση αποσύνθεσης.
εργασία μαθήματος, προστέθηκε 23/12/2013
Ανάπτυξη μέτρων για την πρόληψη εκδήλωσης πυρκαγιών και εκρήξεων, εκτίμηση των συνθηκών ανάπτυξης και καταστολής τους. Η έννοια του ποσοστού εξουθένωσης, η μέθοδος προσδιορισμού του. Η διαδικασία σύνθεσης της εξίσωσης αντίδρασης καύσης. Υπολογισμός του όγκου του αέρα που απαιτείται για την καύση.
εργασία μαθήματος, προστέθηκε 07/10/2014
Προσδιορισμός της σύστασης των προϊόντων πλήρους καύσης αερίου. Υπολογισμός της αδιαβατικής θερμοκρασίας καύσης ενός μείγματος αερίων σε σταθερό όγκο και σταθερή πίεση. Κινητικές σταθερές της αυθόρμητης αντίδρασης καύσης φυσικού αερίου. Όριο ευφλεκτότητας του μείγματος αερίων.
εργασία μαθήματος, προστέθηκε 19/02/2014
Χαρακτηριστικό γνώρισμα βιομηχανικές μεθόδουςαλκυλίωση βενζολίου με προπυλένιο. Αρχές αλκυλίωσης βενζολίου με ολεφίνες σε χημική τεχνολογία. Προβλήματα σχεδιασμού μονάδων διεργασίας αλκυλίωσης βενζολίου. Περιγραφή της τεχνολογίας της παραγωγικής διαδικασίας.
διατριβή, προστέθηκε 15/11/2010
Η καύση ως ισχυρή διαδικασία οξείδωσης. Είδη καύσης: σιγοκαίει και καύση με φλόγα. Έκρηξη σαν ειδική περίπτωσηκαύση. Ηλεκτρικές ιδιότητες της φλόγας. Μια ποικιλία προϊόντων καύσης ως συνέπεια της ατελούς καύσης του καυσίμου. Διήθηση καπνού μέσω του νερού.
επιστημονική εργασία, προστέθηκε 29/07/2009
Προσδιορισμός του όγκου του αέρα που απαιτείται για την πλήρη καύση δεδομένης ποσότητας προπανίου. Υπολογισμός μεταβολών της ενθαλπίας, της εντροπίας και της ενέργειας Gibbs, χρησιμοποιώντας συνέπειες του νόμου του Hess. Ορισμός μοριακές μάζεςισοδύναμα οξειδωτικού και αναγωγικού παράγοντα.
δοκιμή, προστέθηκε 02/08/2012
Μέθοδοι για τον προσδιορισμό της κατανάλωσης λαδιού απορρόφησης, της συγκέντρωσης βενζολίου στο λάδι απορρόφησης που εξέρχεται από τον απορροφητή. Υπολογισμός της διαμέτρου και του ύψους του συσκευασμένου απορροφητή. Προσδιορισμός της απαιτούμενης επιφάνειας θέρμανσης στον κύβο στήλης και της ροής του θερμαντικού ατμού.
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0