Όταν θερμαίνεται, το θείο αντιδρά με το υδρογόνο. Σχηματίζεται ένα δηλητηριώδες αέριο με έντονη οσμή - υδρόθειο. Διαφορετικά ονομάζεται υδρόθειο, υδρόθειο, διϋδροσουλφίδιο.
Δομή
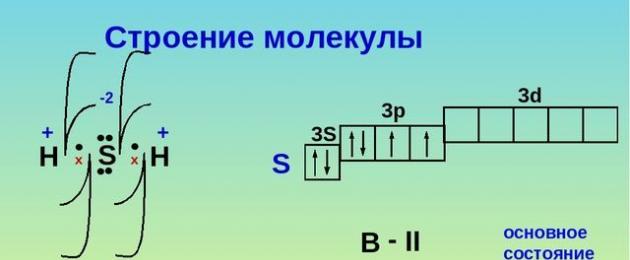
Το υδρόθειο είναι μια δυαδική ένωση θείου και υδρογόνου. Ο τύπος του υδρόθειου είναι H 2 S. Η δομή του μορίου είναι παρόμοια με τη δομή του μορίου του νερού. Ωστόσο, το θείο σχηματίζεται με το υδρογόνο όχι υδρογόνο, αλλά ομοιοπολικό πολική σύνδεση. Αυτό οφείλεται στο γεγονός ότι, σε αντίθεση με το άτομο οξυγόνου, το άτομο θείου είναι μεγαλύτερο σε όγκο, έχει χαμηλότερη ηλεκτραρνητικότητα και χαμηλότερη πυκνότητα φορτίου.

Ρύζι. 1. Η δομή του υδρόθειου.
Παραλαβή
Το υδρόθειο είναι σπάνιο στη φύση. Σε μικρές συγκεντρώσεις είναι μέρος συναφών, φυσικών, ηφαιστειακών αερίων. Οι θάλασσες και οι ωκεανοί περιέχουν υδρόθειο σε μεγάλα βάθη. Για παράδειγμα, το υδρόθειο βρίσκεται σε βάθος 200 μέτρων στη Μαύρη Θάλασσα. Επιπλέον, το υδρόθειο απελευθερώνεται όταν οι πρωτεΐνες που περιέχουν θείο σαπίζουν.
Στη βιομηχανία λαμβάνεται με διάφορους τρόπους:
- αντίδραση οξέων με σουλφίδια:
FeS + 2HCl → FeCl 2 + H 2 S;
- η επίδραση του νερού στο θειούχο αλουμίνιο:
Al2S3 + 6H2O → 2Al(OH) 3 + 3H2S;
- με σύντηξη θείου με παραφίνη:
C 18 H 38 + 18S → 18H 2 S + 18C.
Το πιο καθαρό αέριο λαμβάνεται με άμεση αλληλεπίδραση υδρογόνου και θείου. Η αντίδραση λαμβάνει χώρα στους 600°C.
Φυσικές ιδιότητες
Το διυδροσουλφίδιο είναι ένα άχρωμο αέριο με οσμή σάπιων αυγών και γλυκιά γεύση. Πρόκειται για μια τοξική ουσία, επικίνδυνη σε υψηλές συγκεντρώσεις. Λόγω της μοριακής του δομής, το υδρόθειο δεν υγροποιείται υπό κανονικές συνθήκες.
Είναι κοινά φυσικές ιδιότητεςυδρόθειο:
- ελάχιστα διαλυτό στο νερό.
- παρουσιάζει ιδιότητες υπεραγωγού σε θερμοκρασία -70°C και πίεση 150 GPa.
- εύφλεκτος;
- διαλυτό σε αιθανόλη.
- υγροποιείται στους -60,3°C.
- μετατρέπεται σε στερεόςστους -85,6°C.
- τήκεται στους -86°C.
- βράζει στους -60°C.
- αποσυντίθεται σε απλές ουσίες(θείο και υδρογόνο) στους 400°C.
Υπό κανονικές συνθήκες, μπορείτε να παρασκευάσετε ένα διάλυμα υδρόθειου (υδρόθειο νερό). Ωστόσο, το υδρόθειο δεν αντιδρά με το νερό. Στον αέρα, το διάλυμα οξειδώνεται γρήγορα και γίνεται θολό λόγω της απελευθέρωσης θείου. Το υδρόθειο νερό παρουσιάζει ιδιότητες ασθενούς οξέος.

Ρύζι. 2. Υδρόθειο νερό.
Χημικές ιδιότητες
Το υδρόθειο είναι ένας ισχυρός αναγωγικός παράγοντας. Βασικός Χημικές ιδιότητεςουσίες περιγράφονται στον πίνακα.
|
Αντίδραση |
Περιγραφή |
Η εξίσωση |
|
Με οξυγόνο |
Καίγεται στον αέρα με μπλε φλόγα που παράγει διοξείδιο του θείου. Όταν υπάρχει έλλειψη οξυγόνου, σχηματίζεται θείο και νερό |
2H 2 S + 4O 2 → 2H 2 O + 2SO 2; 2H 2 S + O 2 → 2S + 2H 2 O |
|
Με οξειδωτικά μέσα |
Οξειδώνεται σε διοξείδιο του θείου ή θείο |
3H2S + 4HClO3 → 3H2SO4 + 4HCl; 2H2S + SO2 → 2H2O + 3S; 2H 2 S + H 2 SO 3 → 3S + 3H 2 O |
|
Με αλκάλια |
Με περίσσεια αλκαλίων, σχηματίζονται μέτρια άλατα, με αναλογία 1:1 - όξινα |
H2S + 2NaOH → Na2S + 2H2O; H 2 S + NaOH → NaHS + H 2 O |
|
Διασπάσεις |
Διαχωρίζεται σταδιακά σε διάλυμα |
H 2 S ⇆ H + + HS – ; HS – ⇆H + + S 2- |
|
Υψηλή ποιότητα |
Σχηματισμός μαύρου ιζήματος - θειούχου μολύβδου |
H 2 S + Pb(NO 3) 2 → PbS↓ + 2HNO 3 |

Ρύζι. 3. Καύση υδρόθειου.
Το υδρόθειο είναι τοξικό αέριο, επομένως η χρήση του είναι περιορισμένη. Τα περισσότερα απόΤο παραγόμενο υδρόθειο χρησιμοποιείται στη βιομηχανική χημεία για την παραγωγή θείου, σουλφιδίου και θειικού οξέος.
Τι μάθαμε;
Από το θέμα του μαθήματος μάθαμε για τη δομή, την παραγωγή και τις ιδιότητες του υδρόθειου ή υδρόθειου. Είναι ένα άχρωμο αέριο με δυσάρεστη οσμή. Είναι τοξική ουσία. Σχηματίζει υδρόθειο νερό χωρίς να αλληλεπιδρά με το νερό. Στις αντιδράσεις εμφανίζει τις ιδιότητες ενός αναγωγικού παράγοντα. Αντιδρά με ατμοσφαιρικό οξυγόνο, ισχυρούς οξειδωτικούς παράγοντες (οξείδια, οξέα οξυγόνου) και αλκάλια. Διασπάται σε διάλυμα σε δύο στάδια. Το υδρόθειο χρησιμοποιείται σε χημική βιομηχανίαγια την παραγωγή παραγώγων.
Δοκιμή για το θέμα
Αξιολόγηση της έκθεσης
Μέση βαθμολογία: 4.4. Συνολικές βαθμολογίες που ελήφθησαν: 66.
- (υδρόθειο) H2S, ένα άχρωμο αέριο με τη μυρωδιά σάπιων αυγών. Σημείο τήξεως;85.54.C, σημείο βρασμού;60.35.C; στους 0.C υγροποιείται υπό πίεση 1 MPa. Αναγωγικό μέσο. Υποπροϊόν κατά τη διύλιση προϊόντων πετρελαίου, οπτάνθρακα κ.λπ. σχηματίζεται κατά την αποσύνθεση... ... Μεγάλο εγκυκλοπαιδικό λεξικό
- (H2S), ένα άχρωμο, δηλητηριώδες αέριο με τη μυρωδιά των σάπιων αυγών. Σχηματίζεται κατά τις διαδικασίες αποσύνθεσης και βρίσκεται στο αργό πετρέλαιο. Λαμβάνεται από τη δράση του θειικού οξέος σε θειούχα μετάλλων. Χρησιμοποιείται στην παραδοσιακή ΠΟΙΟΤΙΚΗ ΑΝΑΛΥΣΗ. Ιδιότητες: θερμοκρασία…… Επιστημονικό και τεχνικό εγκυκλοπαιδικό λεξικό
ΥΔΡΟΓΟΝΟ Θειούχο, υδρόθειο, πολλά άλλα. όχι, σύζυγος (χημ.). Αέριο που παράγεται από τη σήψη πρωτεϊνικών ουσιών, αναδίδοντας τη μυρωδιά των σάπιων αυγών. ΛεξικόΟυσακόβα. D.N. Ο Ουσάκοφ. 1935 1940... Επεξηγηματικό Λεξικό του Ουσάκοφ
ΘΕΙΟ ΥΔΡΟΓΟΝΟΥ, ρε σύζυγο. Άχρωμο αέριο με έντονη, δυσάρεστη οσμή, που σχηματίζεται κατά την αποσύνθεση πρωτεϊνικών ουσιών. | επίθ. υδρόθειο, ω, ω. Επεξηγηματικό λεξικό Ozhegov. ΣΙ. Ozhegov, N.Yu. Σβέντοβα. 1949 1992… Επεξηγηματικό λεξικό Ozhegov
Ουσιαστικό, αριθμός συνωνύμων: 1 αέριο (55) ASIS Λεξικό Συνωνύμων. V.N. Τρίσιν. 2013… Συνώνυμο λεξικό
Άχρωμο δηλητηριώδες αέριο H2S με δυσάρεστη ειδική οσμή. Έχει ελαφρώς όξινες ιδιότητες. 1 λίτρο C. σε t 0 °C και πίεση 760 mm είναι 1,539 g Βρίσκεται σε λάδια, φυσικά νερά και αέρια βιοχημικής προέλευσης, όπως... ... Γεωλογική εγκυκλοπαίδεια
Θειούχο ΥΔΡΟΓΟΝΟ- Θειούχο ΥΔΡΟΓΟΝΟ, H2S ( μοριακό βάρος 34.07), ένα άχρωμο αέριο με χαρακτηριστική οσμή σάπιων αυγών. Ένα λίτρο αερίου υπό κανονικές συνθήκες (0°, 760 mm) ζυγίζει 1,5392 g Θερμοκρασία βρασμού 62°, τήξη 83°. Το S. είναι μέρος των αερίων εκπομπών... ... Μεγάλη Ιατρική Εγκυκλοπαίδεια
υδρόθειο- - Θέματα βιοτεχνολογίας EN υδρόθειο ... Οδηγός Τεχνικού Μεταφραστή
υδρόθειο- ΘΕΙΟ ΥΔΡΟΓΟΝΟΥ, α, m Άχρωμο αέριο με έντονη, δυσάρεστη οσμή, που σχηματίζεται κατά την αποσύνθεση πρωτεϊνικών ουσιών και αντιπροσωπεύει ένωση θείου με υδρογόνο. Το υδρόθειο βρίσκεται σε ορισμένα μεταλλικά νερά και σε φαρμακευτικές λάσπες και χρησιμοποιείται... ... Επεξηγηματικό λεξικό ρωσικών ουσιαστικών
Βιβλία
- Πώς να κόψετε το κάπνισμα! (DVD), Pelinsky Igor. «Τίποτα δεν είναι πιο εύκολο από το να κόψεις το κάπνισμα - το έχω ήδη κόψει τριάντα φορές» (Μαρκ Τουέιν). Γιατί οι άνθρωποι αρχίζουν να καπνίζουν; Για να χαλαρώσετε, να αποσπαστείτε, να μαζέψετε τις σκέψεις σας, να απαλλαγείτε από το άγχος ή...
- Οι Vestimentiferans είναι εντερικά ασπόνδυλα της βαθιάς θάλασσας, V.V. Η μονογραφία είναι αφιερωμένη σε μια νέα ομάδα γιγάντιων (μέχρι 2,5 m) ζώων βαθέων υδάτων που ζουν σε περιοχές υδροθερμικής δραστηριότητας βαθέων υδάτων και κρύων διαρροών υδρογονανθράκων. Πλέον… eBook
- Σκέψεις ενός ασκούμενου ιατρού για την υγεία των εργαζομένων στη βιομηχανία αερίου, I. V. Fomichev. Svetlana Vladimirovna Fomicheva – Ph.D. μέλι. Επιστημών, ανώτερος ερευνητής Ινστιτούτο Κυτταρικής και Ενδοκυτταρικής Συμβίωσης, Παράρτημα Ουραλίων της Ρωσικής Ακαδημίας Επιστημών. Fomichev Ilya Vladimirovich – γαστρεντερολόγος, επικεφαλής της Ιατρικής...
ΟΡΙΣΜΟΣ
Υδρόθειοείναι ένα άχρωμο αέριο με χαρακτηριστική οσμή πρωτεΐνης που σαπίζει.
Είναι ελαφρώς βαρύτερο από τον αέρα, υγροποιείται σε θερμοκρασία -60,3 o C και στερεοποιείται στους -85,6 o C. Στον αέρα, το υδρόθειο καίγεται με μπλε φλόγα, σχηματίζοντας διοξείδιο του θείου και νερό:
2H 2 S + 3O 2 = 2H 2 O + 2SO 2.
Εάν εισάγετε κάποιο κρύο αντικείμενο, όπως ένα κύπελλο πορσελάνης, στη φλόγα υδρόθειου, η θερμοκρασία της φλόγας πέφτει σημαντικά και το υδρόθειο οξειδώνεται μόνο σε ελεύθερο θείο, το οποίο κατακάθεται στο κύπελλο με τη μορφή κίτρινης επικάλυψης:
2H 2 S + O 2 = 2H 2 O + 2S.
Το υδρόθειο είναι πολύ εύφλεκτο. το μείγμα του με τον αέρα εκρήγνυται. Το υδρόθειο είναι πολύ δηλητηριώδες. Παρατεταμένη εισπνοή αέρα που περιέχει αυτό το αέριο, ακόμη και μέσα μικρές ποσότητες, προκαλεί σοβαρή δηλητηρίαση.
Στους 20 o C, ένας όγκος νερού διαλύει 2,5 όγκους υδρόθειου. Ένα διάλυμα υδρόθειου σε νερό ονομάζεται υδρόθειο νερό. Όταν στέκεται στον αέρα, ειδικά στο φως, το υδρόθειο νερό σύντομα γίνεται θολό από το θείο που απελευθερώνεται. Αυτό συμβαίνει ως αποτέλεσμα της οξείδωσης του υδρόθειου από το ατμοσφαιρικό οξυγόνο.
Παραγωγή υδρόθειου
Στο υψηλή θερμοκρασίαΤο θείο αντιδρά με το υδρογόνο για να σχηματίσει αέριο υδρόθειο.
Στην πράξη, το υδρόθειο παράγεται συνήθως από τη δράση αραιών οξέων σε μέταλλα θείου, για παράδειγμα θειούχο σίδηρο:
FeS + 2HCl = FeCl 2 + H 2 S.
Περισσότερο καθαρό υδρόθειο μπορεί να ληφθεί με υδρόλυση CaS, BaS ή A1 2 S 3. Το πιο καθαρό αέριο λαμβάνεται με την άμεση αντίδραση υδρογόνου και θείου στους 600 °C.
Χημικές ιδιότητες του υδρόθειου
Ένα διάλυμα υδρόθειου σε νερό έχει τις ιδιότητες ενός οξέος. Το υδρόθειο είναι ένα ασθενές διβασικό οξύ. Διαχωρίζεται βήμα προς βήμα και κυρίως σύμφωνα με το πρώτο βήμα:
H 2 S↔H + + HS - (K 1 = 6 × 10 -8).
Διάσπαση δεύτερου σταδίου
HS - ↔H + + S 2- (K 2 = 10 -14)
εμφανίζεται σε αμελητέα έκταση.
Το υδρόθειο είναι ένας ισχυρός αναγωγικός παράγοντας. Όταν εκτίθεται σε ισχυρά οξειδωτικά μέσα, οξειδώνεται σε διοξείδιο του θείου ή θειικό οξύ. το βάθος της οξείδωσης εξαρτάται από τις συνθήκες: θερμοκρασία, pH του διαλύματος, συγκέντρωση του οξειδωτικού παράγοντα. Για παράδειγμα, η αντίδραση με το χλώριο συνήθως προχωρά σε σχηματισμό θειικού οξέος:
H 2S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Τα μεσαία άλατα του υδρόθειου ονομάζονται σουλφίδια.
Εφαρμογή υδρόθειου
Η χρήση του υδρόθειου είναι αρκετά περιορισμένη, γεγονός που οφείλεται κυρίως στην υψηλή τοξικότητά του. Έχει βρει εφαρμογή στην εργαστηριακή πρακτική ως κατακρημνιστικό βαριά μέταλλα. Το υδρόθειο χρησιμεύει ως πρώτη ύλη για την παραγωγή θειικού οξέος, θείου σε στοιχειακή μορφή και θειούχων
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
| Ασκηση | Προσδιορίστε πόσες φορές βαρύτερο από τον αέρα είναι το υδρόθειο H 2 S. |
| Λύση | Ο λόγος της μάζας ενός δεδομένου αερίου προς τη μάζα ενός άλλου αερίου που λαμβάνεται στον ίδιο όγκο, στην ίδια θερμοκρασία και την ίδια πίεση ονομάζεται σχετική πυκνότητα του πρώτου αερίου προς το δεύτερο. Αυτή η τιμή δείχνει πόσες φορές το πρώτο αέριο είναι βαρύτερο ή ελαφρύτερο από το δεύτερο αέριο. Το σχετικό μοριακό βάρος του αέρα λαμβάνεται ως 29 (λαμβάνοντας υπόψη την περιεκτικότητα του αέρα σε άζωτο, οξυγόνο και άλλα αέρια). Πρέπει να σημειωθεί ότι η έννοια του «συγγενή μοριακή μάζααέρας» χρησιμοποιείται υπό όρους, αφού ο αέρας είναι ένα μείγμα αερίων. D αέρας (H 2 S) = M r (H 2 S) / M r (αέρας); D αέρας (H 2 S) = 34 / 29 = 1,17. M r (H 2 S) = 2 × A r (H) + A r (S) = 2 × 1 + 32 = 2 + 32 = 34. |
| Απάντηση | Το υδρόθειο H 2 S είναι 1,17 φορές βαρύτερο από τον αέρα. |
ΠΑΡΑΔΕΙΓΜΑ 2
| Ασκηση | Βρείτε την πυκνότητα του υδρογόνου ενός μείγματος αερίων στο οποίο το κλάσμα όγκου του οξυγόνου είναι 20%, του υδρογόνου είναι 40% και το υπόλοιπο είναι υδρόθειο H 2 S. |
| Λύση | Τα κλάσματα όγκου των αερίων θα συμπίπτουν με τα μοριακά, δηλ. με κλάσματα ποσοτήτων ουσιών, αυτό είναι συνέπεια του νόμου του Avogadro. Ας βρούμε το υπό όρους μοριακό βάρος του μείγματος: M r υπό όρους (μίγμα) = φ (O 2) × M r (O 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
Το υδρόθειο - H2S - είναι ένα άχρωμο αέριο με έντονη οσμή σάπιων αυγών. Ελάχιστα διαλυτό στο νερό. Το μόριο υδρόθειου έχει γωνιακό σχήμα. Το μόριο είναι πολικό. Λόγω του γεγονότος ότι το υδρόθειο δεν σχηματίζει ισχυρούς δεσμούς υδρογόνου, υπό κανονικές συνθήκες το υδρόθειο είναι αέριο. υδατικό διάλυμαΤο υδρόθειο σχηματίζει ασθενές υδρόθειο οξύ.
Παραλαβή
Μετατόπιση αλάτων από ισχυρά οξέα:
FeS + 2HCl = FeCl2 + H2S (συσκευή Kipp)
Αντιδράσεις υδρόθειου: οξειδώνεται από το ατμοσφαιρικό οξυγόνο σε θείο ή διοξείδιο του θείου
2H2S + O2 = 2S(SO2) + 2H2O
Υδρόθειο οξύ– αδύναμος, διβασικός
Υδρόθειο οξύ
Τα αδιάλυτα άλατα του υδροσουλφιδικού οξέος (σουλφίδια) παράγονται με αντίδραση θείου με μέταλλα ή σε αντιδράσεις ανταλλαγής μεταξύ διαλυμάτων αλάτων:
Na2S + CuSO4 = CuS↓ + Na2SO4
K2S + FeCl2 = FeS↓ + 2KCl
Τα διαλυτά σουλφίδια σχηματίζονται από μέταλλα αλκαλίων και αλκαλικών γαιών. Μπορούν να ληφθούν με αντίδραση διαλυμάτων οξέος με μέταλλα ή αλκάλια. Σε αυτή την περίπτωση, ανάλογα με τη μοριακή αναλογία μεταξύ των αρχικών ουσιών, μπορούν να σχηματιστούν τόσο όξινα (υδροσουλφίδια) όσο και μέτρια άλατα.
H2S + NaOH = NaHS + H2O (με έλλειψη αλκαλίων)
H2S + 2NaOH = Na2S + 2H2O (σε περίσσεια αλκαλίου)
Ορισμένα σουλφίδια (CuS, HgS, Ag2S, PbS) δεν αποσυντίθενται από διαλύματα ισχυρών οξέων. Επομένως, το υδρόθειο μπορεί να εκτοπίσει ισχυρά οξέααπό υδατικά διαλύματα των αλάτων τους που σχηματίζονται από αυτά τα μέταλλα:
CuSO4 + H2S = CuS↓ + H2SO4
HgCl2 + H2S = HgS↓ +2HCl
Το υδρόθειο οξύ στον αέρα οξειδώνεται αργά από το οξυγόνο, απελευθερώνοντας θείο:
2H2S + O2 = 2S↓ + 2H2O
Επομένως, με την πάροδο του χρόνου, τα διαλύματα H2S γίνονται θολά κατά την αποθήκευση.
Σουλφίδια μέταλλα αλκαλικών γαιώνσε υδατικό διάλυμα στο πρώτο στάδιο υδρολύονται σχεδόν 100% και υπάρχουν με τη μορφή διαλυτών αλάτων οξέος:
2CaS + 2HOH = Ca(HS)2 + Ca(OH)2
Τα σουλφίδια ορισμένων μετάλλων (Al2S3, Fe2S3, Cr2S3) υδρολύονται πλήρως σε H2O:
Al2S3 + 6 H2O = 2Al(OH)3 + 3 H2S
Τα περισσότερα σουλφίδια βαρέων μετάλλων είναι πολύ ελάχιστα διαλυτά στο H2O.
50) Φώσφορος. Αλλοτροπικές τροποποιήσεις του φωσφόρου……
Φώσφορος - συστατικόφυτικές και ζωικές πρωτεΐνες. Στα φυτά, ο φώσφορος συγκεντρώνεται στους σπόρους, στα ζώα - μέσα νευρικό ιστό, μύες, σκελετός. Το ανθρώπινο σώμα περιέχει περίπου 1,5 kg φωσφόρου: 1,4 kg στα οστά,
130 g - στους μύες και 13 g στον νευρικό ιστό. Στη φύση, ο φώσφορος βρίσκεται σε δεσμευμένη μορφή.
Απαραίτητα μέταλλα:
απατίτης Ca5(PO4)3F και φωσφορίτης Ca3(PO4)2.
Ο φώσφορος μπορεί να ληφθεί με θέρμανση ενός μείγματος φωσφορίτη,
άνθρακας και άμμος σε ειδικό φούρνο:
Ca3(PO4)2 + 5C + 3SiO2 2P + 3CaSiO3 + 5CO
Η φωσφίνη είναι ένα δηλητηριώδες αέριο με οσμή σκόρδου, μπορεί να ληφθεί από το φωσφίδιο ψευδάργυρου με τη δράση οξέων ή νερού:
Zn3P2 + 6HCl → 2PH3 + 3ZnCl2
Οι κύριες ιδιότητες της φωσφίνης είναι πιο αδύναμες από αυτές της αμμωνίας:
PH3 + HCl → PH4Cl
Τα άλατα φωσφονίου σε υδατικά διαλύματα είναι ασταθή:
PH4 + H2O → PH3 + H3O
Η φωσφίνη έχει αναγωγική κατάσταση (η χαμηλότερη κατάσταση οξείδωσης του φωσφόρου), καίει στον αέρα:
2PH3 + 4O2 → P2O5 + 3H2O
Η φωσφίνη είναι ένα άχρωμο δηλητηριώδες αέριο με τη μυρωδιά του σάπιου ψαριού. Αυτοαναφλέγεται στον αέρα
2РН3 + 4О2 → P2O5 + 2Н2О
Είναι ελαφρώς διαλυτό στο νερό και, σε αντίθεση με το NH3, δεν αντιδρά με αυτό.
Σχηματίζει άλατα φωσφονίου παρόμοια με την αμμωνία με πολύ ισχυρό οξυγόνο και οξέα.
PH3 + HI= PH4I
ιωδιούχο φωσφόνιο
Διφωσφίνη (ανάλογο υδραζίνης) (P2H4) – είναι ένα υγρό,
αυτοαναφλέγεται στον αέρα.
Παρασκευή: Από φωσφορικό πέτρωμα με σύντηξη με άνθρακα και οξείδιο του πυριτίου
Ca3(PO4)2 + C +SiO2 → P4 + CaSiO3 + CO
Από φωσφορικό Ca, σε θερμοκρασίες άνω των 1500°C: Ca3(PO4)2 + C → CaO + P4 + CO
Χημικές ιδιότητες: P + O2 = P2O3; P + O2 = P2O5; P + S = P2S3; P + Cl2 = PCl3; Το P+H2 δεν λειτουργεί
Αλλοτροπικές τροποποιήσεις:Ο λευκός φώσφορος είναι ισχυρό δηλητήριο, ακόμη και σε μικρές δόσεις είναι θανατηφόρος. Λαμβάνεται σε στερεή κατάσταση με ταχεία ψύξη ατμών φωσφόρου. Στην καθαρή του μορφή είναι εντελώς άχρωμο, διαφανές, εμφάνισηπαρόμοιο με το κερί: εύθραυστο στο κρύο, μαλακό σε θερμοκρασίες άνω των 15 °C, κόβεται εύκολα με μαχαίρι.
Ο κόκκινος φώσφορος είναι μια κοκκινοκαφέ σκόνη, μη τοξική, μη πτητική, αδιάλυτη στο νερό και σε πολλούς οργανικούς διαλύτες και σε δισουλφίδιο του άνθρακα. δεν αναφλέγεται στον αέρα και δεν λάμπει στο σκοτάδι. Μόνο όταν θερμανθεί στους 260 °C αναφλέγεται. Με ισχυρή θέρμανση, χωρίς πρόσβαση αέρα, χωρίς λιώσιμο (παράκαμψη υγρή κατάσταση) εξατμίζεται – εξαχνώνεται. Όταν κρυώσει, μετατρέπεται σε λευκό φώσφορο.
Ο μαύρος φώσφορος παράγεται από υψηλή θερμότητα και υψηλή πίεση λευκού φωσφόρου. Ο μαύρος φώσφορος είναι βαρύτερος από άλλες τροποποιήσεις. Χρησιμοποιείται πολύ σπάνια - ως ημιαγωγός στη σύνθεση φωσφορικού γαλλίου και ινδίου στη μεταλλουργία.
Αντιδρά με οξέα P + HNO3 = HPO4 + NO + H2O; P + H2SO4 = H3PO4 + SO2 + H2O
Αντιδρά με αλκάλια P + KOH + H2O = KH 2PO2 + PH3
ΟΡΙΣΜΟΣ
Υδρόθειο οξύ(υδρόθειο, μονοσουλφάνιο) υπό κανονικές συνθήκες είναι ένα άχρωμο αέριο.
Θερμικά ασταθής. Δυσδιάλυτο σε κρύο νερό. Ένα κορεσμένο διάλυμα (0,1 M) ονομάζεται «υδρόθειο νερό», το οποίο γίνεται θολό όταν εκτίθεται στον αέρα. Παρουσιάζει ασθενείς όξινες ιδιότητες. Το OVR είναι ένας ισχυρός αναγωγικός παράγοντας.
Χημικός τύπος υδροσουλφιδικού οξέος
Χημική φόρμουλαυδροσουλφιδικό οξύ H 2 S. Δείχνει ότι αυτό το μόριο περιέχει δύο άτομα υδρογόνου (Ar = 1 amu) και ένα άτομο θείου (Ar = 32 amu). Χρησιμοποιώντας τον χημικό τύπο, μπορείτε να υπολογίσετε το μοριακό βάρος του οξέος υδρόθειου:
Mr(H2S) = 2×Ar(H) + Ar(S);
Mr(H 2 S) = 2×1 + 32 = 2 +32 = 34.
Γραφικός (δομικός) τύπος υδρόθειου οξέος
Ο δομικός (γραφικός) τύπος του υδρόθειου οξέος είναι πιο σαφής. Δείχνει πώς συνδέονται τα άτομα μεταξύ τους μέσα σε ένα μόριο (Εικ. 1).
Ρύζι. 1. Η δομή του μορίου του υδρόθειου, που δείχνει τη γωνία δεσμού μεταξύ των δεσμών και το μήκος των χημικών δεσμών.
Ιονικός τύπος
Το υδρόθειο οξύ είναι ηλεκτρολύτης, δηλ. σε ένα υδατικό διάλυμα είναι ικανό να διασπαστεί σε ιόντα σύμφωνα με την ακόλουθη εξίσωση:
H 2 S ↔ 2H + + S 2- .
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
| Ασκηση | Προσδιορίστε τον μοριακό τύπο μιας ένωσης που περιέχει 49,4% κάλιο, 20,2% θείο, 30,4% οξυγόνο, εάν η σχετική μοριακή μάζα αυτής της ένωσης είναι 3,95 φορές τη σχετική ατομική μάζα του ασβεστίου. |
| Λύση |
Ας υποδηλώσουμε τον αριθμό των γραμμομορίων στοιχείων που περιλαμβάνονται στην ένωση ως «x» (κάλιο), «y» (θείο) και «z» (οξυγόνο). Στη συνέχεια, η μοριακή αναλογία θα μοιάζει με αυτό (τιμές σχετικών ατομικών μαζών που λαμβάνονται από Περιοδικός Πίνακας DI. Mendeleev, στρογγυλοποίηση σε ακέραιους αριθμούς): x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 49,4/39: 20,2/32: 30,4/16; x:y:z= 1,3: 0,63:1,9 = 2: 1: 3. Αυτό σημαίνει ότι ο απλούστερος τύπος για μια ένωση καλίου, θείου και οξυγόνου θα είναι το K 2 SO 3 και μοριακή μάζα 158 g/mol. Ας βρούμε την πραγματική μοριακή μάζα αυτής της ένωσης: M ουσία = Ar(Ca) × 3,95 = 40 × 3,95 = 158 g/mol. Για να βρείτε την αληθινή φόρμουλα οργανική ένωσηΑς βρούμε την αναλογία των μοριακών μαζών που προκύπτουν: M ουσία / M(K 2 SO 3) = 158 / 158 = 1. Αυτό σημαίνει ότι ο τύπος για την ένωση καλίου, θείου και οξυγόνου είναι K 2 SO 3 . |
| Απάντηση | K2SO3 |
ΠΑΡΑΔΕΙΓΜΑ 2
| Ασκηση | Η ουσία περιέχει 32,5% νάτριο, 22,5% θείο και 45% οξυγόνο. Να εξάγετε τον χημικό τύπο της ουσίας. |
| Λύση | Το κλάσμα μάζας του στοιχείου Χ σε ένα μόριο της σύνθεσης ΝΧ υπολογίζεται χρησιμοποιώντας τον ακόλουθο τύπο: ω (X) = n × Ar (X) / M (HX) × 100%. Ας υποδηλώσουμε τον αριθμό των γραμμομορίων στοιχείων που περιλαμβάνονται στην ένωση ως «x» (νάτριο), «y» (θείο) και «z» (οξυγόνο). Στη συνέχεια, η μοριακή αναλογία θα μοιάζει με αυτό (οι τιμές των σχετικών ατομικών μαζών που λαμβάνονται από τον Περιοδικό Πίνακα του D.I. Mendeleev στρογγυλοποιούνται σε ακέραιους αριθμούς): x:y:z = ω(Na)/Ar(Na) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 32,5/23: 22,5/32: 45/16; x:y:z= 1,4: 0,7: 2,8 = 2: 1: 4. Αυτό σημαίνει ότι ο τύπος για την ένωση νατρίου, θείου και οξυγόνου θα είναι Na 2 SO 4. Αυτό είναι θειικό νάτριο. |
| Απάντηση | Na2SO4 |
- Σε επαφή με 0
- Google+ 0
- Εντάξει 0
- Facebook 0