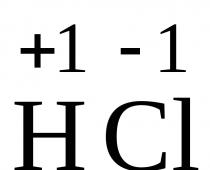Ley periódica de los elementos químicos.(formulación moderna): las propiedades de los elementos químicos, así como de las sustancias simples y complejas formadas por ellos, dependen periódicamente del valor de la carga de los núcleos atómicos.
Tabla periódica - Expresión gráfica de la ley periódica.
Elemento químico - se trata de un conjunto de átomos con la misma carga que el núcleo del átomo Z i.
Isótopos – estos son átomos con la misma carga nuclear, pero con diferentes números másicos A r.
Carga del núcleo de un átomo, igual al número de serie de un elemento N en la tabla periódica, aumenta continuamente y las propiedades de los elementos químicos, las formas y propiedades de los compuestos de los elementos cambian periódicamente.
Período- una fila horizontal de elementos químicos dispuestos en orden creciente de carga nuclear y número de electrones en el átomo.
Grupo– una fila vertical de elementos químicos cuyos átomos tienen el mismo número de electrones de valencia, pero un número diferente de niveles de energía. Los números de grupo se indican en números romanos. Hay 8 grupos en la tabla.
Cambios en las propiedades metálicas por grupo y período.
Las propiedades metálicas de los elementos de un grupo de arriba a abajo se mejoran porque el número de niveles de energía aumenta, por lo tanto aumenta el radio del átomo, la atracción de los electrones del último nivel de energía se debilita, la electronegatividad disminuye y, por lo tanto, aumentan las propiedades metálicas.
En el período comprendido entre el principio y el final del período, las propiedades metálicas se debilitan. aumenta la carga del núcleo del átomo de un elemento, aumenta la atracción de los electrones del último nivel de energía, aumenta la electronegatividad y se debilitan las propiedades metálicas.
Rieles están ubicados en la Tabla Periódica a la izquierda de una línea diagonal escalonada que comienza con Boro (B) y termina con polonio (Po) (las excepciones son el germanio (Ge) y el antimonio (Sb). Es fácil ver que los metales ocupan la mayor parte de la tabla periódica. Propiedades básicas de los metales: duros (excepto mercurio); brillantes; buenos conductores eléctricos y térmicos; plásticos; maleables; ceden electrones fácilmente.
No metales
Los elementos ubicados a la derecha de la diagonal del paso B-Po se denominan no metales. Las propiedades de los no metales son exactamente opuestas a las de los metales: malos conductores del calor y la electricidad; frágil; no maleable; no plástico; normalmente acepta electrones.
metaloides
Entre los metales y los no metales se encuentran los semimetales (metaloides). Se caracterizan por las propiedades tanto de los metales como de los no metales. Los semimetales han encontrado su principal aplicación en la industria en la producción de semiconductores, sin los cuales no es concebible ni un solo microcircuito o microprocesador moderno.
Muchos científicos han intentado sistematizar los elementos químicos. Pero solo en 1869 D.I. Mendeleev logró crear una clasificación de elementos que estableció la conexión y dependencia de las sustancias químicas y la carga del núcleo atómico.
Historia
La formulación moderna de la ley periódica es la siguiente: las propiedades de los elementos químicos, así como las formas y propiedades de los compuestos de los elementos, dependen periódicamente de la carga del núcleo de los átomos del elemento.
Cuando se descubrió la ley, se conocían 63 elementos químicos. Sin embargo, las masas atómicas de muchos de estos elementos se determinaron erróneamente.
El propio D.I. Mendeleev formuló en 1869 su ley como una dependencia periódica de los pesos atómicos de los elementos, ya que en el siglo XIX la ciencia aún no tenía información sobre la estructura del átomo. Sin embargo, la ingeniosa previsión del científico le permitió comprender más profundamente que todos sus contemporáneos los patrones que determinan la periodicidad de las propiedades de los elementos y sustancias. Tomó en cuenta no solo el aumento de la masa atómica, sino también las propiedades ya conocidas de sustancias y elementos y, tomando como base la idea de periodicidad, pudo predecir con precisión la existencia y propiedades de elementos y sustancias desconocidas. para la ciencia en ese momento, corregir las masas atómicas de una serie de elementos y ordenar correctamente los elementos en el sistema, dejando espacios vacíos y realizando reordenamientos.

Arroz. 1. D. I. Mendeleev.
Existe el mito de que Mendeleev soñó con la tabla periódica. Sin embargo, esto es sólo una hermosa historia, que no es un hecho probado.
Estructura de la tabla periódica.
La tabla periódica de elementos químicos de D.I. Mendeleev es un reflejo gráfico de su propia ley. Los elementos están ordenados en la tabla según un significado químico y físico específico. Por la ubicación de un elemento, se puede determinar su valencia, número de electrones y muchas otras características. La tabla se divide horizontalmente en períodos grandes y pequeños y verticalmente en grupos.

Arroz. 2. Tabla periódica.
Hay 7 periodos que comienzan con un metal alcalino y terminan con sustancias que tienen propiedades no metálicas. Los grupos, a su vez, formados por 8 columnas, se dividen en subgrupos principales y secundarios.
Un mayor desarrollo de la ciencia ha demostrado que la repetición periódica de las propiedades de los elementos en ciertos intervalos, que se manifiesta especialmente claramente en el segundo y tercer período pequeño, se explica por la repetición de la estructura electrónica de los niveles de energía externos, donde se encuentran los electrones de valencia. , por lo que en las reacciones se produce la formación de enlaces químicos y nuevas sustancias. Por lo tanto, en cada grupo de columnas verticales hay elementos con rasgos característicos que se repiten. Esto se manifiesta claramente en grupos que contienen familias de metales alcalinos muy activos (grupo I, subgrupo principal) y metales no halógenos (grupo VII, subgrupo principal). De izquierda a derecha a lo largo del período, el número de electrones aumenta de 1 a 8, mientras que las propiedades metálicas de los elementos disminuyen. Por tanto, las propiedades metálicas son más pronunciadas cuanto menos electrones hay en el nivel exterior.

Arroz. 3. Períodos pequeños y grandes de la tabla periódica.
Las propiedades atómicas como la energía de ionización, la energía de afinidad electrónica y la electronegatividad también se repiten periódicamente. Estas cantidades están asociadas con la capacidad de un átomo de ceder un electrón de un nivel externo (ionización) o de retener el electrón de otra persona en su nivel externo (afinidad electrónica). Calificaciones totales recibidas: 147.
La casa de apuestas Melbet acepta apuestas deportivas online desde 2012. En la casa de apuestas Melbet no sólo apuestan en eventos deportivos, sino también en política, Eurovisión y el mundo del espectáculo. Esto atrae incluso a aquellos jugadores que no son especialmente aficionados a los deportes. Debido a la falta de acceso directo al sitio de Internet de la casa de apuestas Melbet, es necesario recurrir al uso del llamado espejo.
ir al espejo
¿Qué es hoy el espejo Melbet?
Cuando sea imposible acceder al sitio web oficial de la oficina de Melbet, entonces es muy posible implementar otro acceso a través del sitio web del host Melbethgf. Este espejo es funcional: en Melbet recibirás acceso completo al recurso oficial. Mirror es una copia del sitio web oficial. Cuando accedas al sitio de copia, podrás ver que se guardan las apuestas, cotizaciones, la probabilidad de retirar o depositar dinero, como en la versión oficial de la casa de apuestas Melbet. Por lo tanto, siempre puedes utilizar un sitio espejo.
¿Por qué se bloqueó el principal sitio web actual de BC Melbet?
Melbet está bloqueado siempre que la empresa no tenga la autoridad para realizar actividades oficiales de apuestas. En particular, en la Federación de Rusia todos los fondos empresariales están prohibidos a nivel municipal.
El recurso de la casa de apuestas Melbet fue incluido en el registro por las razones previstas en el artículo 15.1 de la Ley Federal de 27 de julio de 2006 No. 149-FZ. Este decreto es un documento sobre desarrollo de la información y protección de la información. Las autoridades rusas aplican este decreto a todos los recursos de las casas de apuestas.
El motivo de la elaboración del decreto es sencillo. Las oficinas se negaron categóricamente a obtener una licencia para operar en la red y, por lo tanto, se negaron a cancelar una parte importante del volumen de negocios de la empresa en el presupuesto gubernamental de la Federación de Rusia. Según el mismo decreto, está prohibido crear sitios espejo o copias del sitio web oficial. Estos recursos están incluidos en el registro estatal de sitios prohibidos de Roskomnadzor. Por lo tanto, existe un problema al iniciar sesión en el sitio web oficial y al cambio constante de direcciones de los espejos de las casas de apuestas. Una dirección válida se bloquea muy rápidamente.
La situación cambiará sólo después de que la casa de apuestas pueda aceptar los términos del decreto y emitir una licencia. En determinados casos, la transición al recurso de la casa de apuestas está cerrada, pero aún puedes visitar los espejos desarrollados por la casa de apuestas. Esto se hace bajo circunstancias apropiadas:
- el sitio está congelado debido a ataques de piratas informáticos;
- Actualmente se están realizando trabajos técnicos sobre el recurso;
- la transición se realiza desde el territorio del estado con cuyos residentes Melbet no trabaja.
Cómo registrarse
El proceso de registro, al igual que en el sitio web oficial, no lleva mucho tiempo. El registro en el espejo Melbet es una circunstancia necesaria cuando se desean realizar apuestas deportivas. Pero después del registro podrás obtener acceso completo al clon del sitio web oficial. Sólo necesitas completar la información básica:
- Nombre completo;
- tipo de unidad monetaria para realizar transacciones financieras;
- información básica del pasaporte;
- correo electrónico;
- Datos de contacto para comunicación.
Después de ingresar la información completa, se le enviará un código, que luego deberá ingresar en el campo correspondiente. El proceso de registro está completo. Puedes empezar a apostar.
El siglo XIX en la historia de la humanidad es un siglo en el que se reformaron muchas ciencias, incluida la química. Fue en esta época cuando apareció el sistema periódico de Mendeleev y con él la ley periódica. Fue él quien se convirtió en la base de la química moderna. El sistema periódico de D.I. Mendeleev es una sistematización de elementos que establece la dependencia de las propiedades químicas y físicas de la estructura y carga del átomo de una sustancia.
Historia
El comienzo del período periódico lo marcó el libro "La correlación de las propiedades con el peso atómico de los elementos", escrito en el tercer cuarto del siglo XVII. En él se mostraban los conceptos básicos de los elementos químicos conocidos (en aquella época sólo había 63). Además, las masas atómicas de muchos de ellos se determinaron incorrectamente. Esto interfirió en gran medida con el descubrimiento de D.I. Mendeleev.
Dmitry Ivanovich comenzó su trabajo comparando las propiedades de los elementos. En primer lugar, trabajó con cloro y potasio, y solo luego pasó a trabajar con metales alcalinos. Armado con tarjetas especiales en las que estaban representados los elementos químicos, intentó repetidamente montar este “mosaico”: colocándolo sobre su mesa en busca de las combinaciones y coincidencias necesarias.
Después de mucho esfuerzo, Dmitry Ivanovich finalmente encontró el patrón que buscaba y dispuso los elementos en filas periódicas. Habiendo recibido como resultado celdas vacías entre los elementos, el científico se dio cuenta de que no todos los elementos químicos eran conocidos por los investigadores rusos, y que era él quien debía dar a este mundo el conocimiento en el campo de la química que aún no había sido dado por su antecesores.

Todo el mundo conoce el mito de que la tabla periódica se le apareció a Mendeleev en un sueño y reunió los elementos de memoria en un solo sistema. Esto es, en términos generales, una mentira. El hecho es que Dmitry Ivanovich trabajó bastante tiempo y se concentró en su trabajo, lo que lo agotó enormemente. Mientras trabajaba en el sistema de elementos, Mendeleev una vez se quedó dormido. Cuando despertó se dio cuenta que no había terminado la tabla y más bien continuó llenando las celdas vacías. Su conocido, un tal Inostrantsev, profesor universitario, decidió que Mendeleev había soñado con la tabla periódica y difundió este rumor entre sus alumnos. Así surgió esta hipótesis.
Fama
Los elementos químicos de Mendeleev son un reflejo de la ley periódica creada por Dmitry Ivanovich allá por el tercer cuarto del siglo XIX (1869). Fue en 1869 cuando en una reunión de la comunidad química rusa se leyó la notificación de Mendeleev sobre la creación de una determinada estructura. Y ese mismo año se publicó el libro "Fundamentos de la química", en el que se publicó por primera vez el sistema periódico de elementos químicos de Mendeleev. Y en el libro "El sistema natural de elementos y su uso para indicar las cualidades de elementos no descubiertos", D. I. Mendeleev mencionó por primera vez el concepto de "ley periódica".

Estructura y reglas para colocar elementos.
Los primeros pasos en la creación de la ley periódica los dio Dmitry Ivanovich en 1869-1871, en ese momento trabajó duro para establecer la dependencia de las propiedades de estos elementos de la masa de su átomo. La versión moderna consta de elementos resumidos en una tabla bidimensional.
La posición de un elemento en la tabla tiene un cierto significado químico y físico. Por la ubicación de un elemento en la tabla, se puede averiguar cuál es su valencia y determinar otras características químicas. Dmitry Ivanovich intentó establecer una conexión entre elementos, tanto similares en propiedades como diferentes.

Basó la clasificación de los elementos químicos conocidos en aquella época en la valencia y la masa atómica. Al comparar las propiedades relativas de los elementos, Mendeleev intentó encontrar un patrón que uniera todos los elementos químicos conocidos en un solo sistema. Al ordenarlos en función de masas atómicas crecientes, aún logró la periodicidad en cada una de las filas.
Mayor desarrollo del sistema.
La tabla periódica, que apareció en 1969, ha sido refinada más de una vez. Con la aparición de los gases nobles en la década de 1930, fue posible revelar una nueva dependencia de los elementos, no de la masa, sino del número atómico. Posteriormente se logró establecer el número de protones en los núcleos atómicos y resultó que coincide con el número atómico del elemento. Los científicos del siglo XX estudiaron la energía electrónica y descubrieron que también afecta la periodicidad. Esto cambió enormemente las ideas sobre las propiedades de los elementos. Este punto quedó reflejado en ediciones posteriores de la tabla periódica de Mendeleev. Cada nuevo descubrimiento de las propiedades y características de los elementos encaja orgánicamente en la tabla.
Características del sistema periódico de Mendeleev.
La tabla periódica se divide en períodos (7 filas dispuestas horizontalmente), que, a su vez, se dividen en grandes y pequeños. El período comienza con un metal alcalino y termina con un elemento con propiedades no metálicas.
La tabla de Dmitry Ivanovich está dividida verticalmente en grupos (8 columnas). Cada uno de ellos en la tabla periódica consta de dos subgrupos, a saber, el principal y el secundario. Después de muchas discusiones, por sugerencia de D.I. Mendeleev y su colega U. Ramsay, se decidió introducir el llamado grupo cero. Incluye gases inertes (neón, helio, argón, radón, xenón, criptón). En 1911, se pidió a los científicos F. Soddy que colocaran elementos indistinguibles, los llamados isótopos, en la tabla periódica; se les asignaron celdas separadas.

A pesar de la exactitud y precisión del sistema periódico, la comunidad científica durante mucho tiempo no quiso reconocer este descubrimiento. Muchos grandes científicos ridiculizaron el trabajo de D.I. Mendeleev y creyeron que era imposible predecir las propiedades de un elemento que aún no había sido descubierto. Pero después de que se descubrieron los supuestos elementos químicos (que eran, por ejemplo, escandio, galio y germanio), el sistema de Mendeleev y su ley periódica se convirtieron en la ciencia de la química.
Mesa en los tiempos modernos
La tabla periódica de elementos de Mendeleev es la base de la mayoría de los descubrimientos químicos y físicos relacionados con la ciencia atómico-molecular. El concepto moderno de elemento se formó precisamente gracias al gran científico. La llegada del sistema periódico de Mendeleev introdujo cambios fundamentales en la comprensión de diversos compuestos y sustancias simples. La creación de la tabla periódica por parte de los científicos tuvo un gran impacto en el desarrollo de la química y todas las ciencias relacionadas con ella.
Si los elementos químicos están ordenados en orden creciente de números atómicos, entonces sus propiedades químicas encajan en un esquema determinado.
A Dmitry Ivanovich Mendeleev le gustaba decir que la idea de la tabla periódica se le ocurrió en un sueño. Como muchos químicos de mediados del siglo XIX, intentó de alguna manera sistematizar la enorme cantidad de elementos químicos descubiertos. Mendeleev estaba entonces trabajando en el libro "Fundamentos de la química" y siempre le pareció que, para las sustancias que describía, ciertamente debía haber alguna forma de ordenarlas que las convirtiera en algo más que un simple conjunto aleatorio de elementos. Fue precisamente este método de ordenamiento, tal ley, lo que vio en su sueño.
En su tabla (hoy la llamamos tabla periódica o sistema de elementos), Mendeleev dispuso los elementos químicos en filas en orden de masa creciente, eligiendo la longitud de las filas de modo que los elementos químicos de una columna tuvieran propiedades químicas similares. Por ejemplo, la columna más a la derecha de la tabla contiene helio, neón, argón, criptón, xenón y radón. Este Gases nobles- sustancias que reaccionan a regañadientes con otros elementos y presentan una baja actividad química. Por el contrario, los elementos de la columna de la izquierda (litio, sodio, potasio, etc.) reaccionan violentamente con otras sustancias, el proceso es explosivo. Se pueden hacer afirmaciones similares sobre las propiedades químicas de los elementos en otras columnas de la tabla; dentro de una columna, estas propiedades son similares, pero varían de una columna a otra.
No podemos dejar de rendir homenaje a la valentía del pensamiento de Mendeleev, quien decidió publicar sus resultados. Por un lado, la tabla en su forma original contenía muchas celdas vacías. Los elementos que ahora sabemos que existen aún estaban por descubrir. (De hecho, el descubrimiento de estos elementos, incluidos el escandio y el germanio, fue uno de los mayores triunfos de la tabla periódica). Por otro lado, Mendeleev tuvo que admitir que los pesos atómicos de algunos elementos se midieron incorrectamente, ya que de lo contrario se no encaja en el sistema. Y nuevamente resultó que tenía razón.
La tabla periódica en su primera versión simplemente reflejaba el estado de cosas existente en la naturaleza. Al igual que con las leyes del movimiento planetario de Kepler, la tabla no explicaba de ninguna manera por qué debería ser así. Y sólo con la llegada de la mecánica cuántica y, en particular, el principio de exclusión de Pauli, quedó claro el verdadero significado de la disposición de los elementos en la tabla periódica.
Hoy miramos la tabla periódica desde la perspectiva de cómo los electrones llenan las capas de electrones en un átomo ( cm. Principio de Aufbau). Las propiedades químicas de un átomo (es decir, qué tipo de enlaces se formarán con otros átomos) están determinadas por la cantidad de electrones en la capa externa. Por tanto, el hidrógeno y el litio tienen cada uno sólo un electrón externo, por lo que se comportan de manera similar en reacciones químicas. A su vez, el helio y el neón tienen capas externas llenas y también se comportan de manera similar, pero completamente diferente, que el hidrógeno y el litio.
En la naturaleza se encuentran elementos químicos hasta el uranio (que contiene 92 protones y 92 electrones). A partir del número 93 hay elementos artificiales creados en el laboratorio. Hasta ahora, la cifra más alta anunciada por los científicos es 118.
Estas sustancias se llaman gases nobles. , pero el nombre se cambió en 1962 cuando se descubrió que el xenón aún podía reaccionar con el flúor. — Aprox. autor
Ver también:
Dmitri Ivanovich MENDELEEV1834-1907
químico ruso. Nacido en Siberia, en la ciudad de Tobolsk, era el menor de 17 hermanos de la familia. La infancia de Mendeleev no fue fácil. Su padre, maestro de escuela, quedó ciego y su madre tuvo que administrar una fábrica de vidrio para mantener a la familia. Su padre murió cuando Mendeleev tenía 13 años, luego la planta se quemó y luego murió su madre. El niño adquirió sus conocimientos científicos del marido de su hermana.
Antes de su muerte, su madre envió a Dmitry al Instituto Pedagógico de San Petersburgo. Allí Mendeleev se licenció en química y continuó sus estudios en Francia y Alemania. En Karlsruhe conoció al químico italiano Stanislao Cannizaro (1826-1910), cuya idea de distinguir los conceptos de peso atómico y molecular causó una gran impresión en el científico ruso. Al regresar a San Petersburgo, Mendeleev se convirtió en profesor de química en el Instituto Tecnológico en 1864.
La tabla periódica, que Mendeleev compiló a finales de la década de 1860, no obtuvo reconocimiento inmediato, pero más tarde lo convirtió en el científico ruso más famoso. En 1890 se pronunció en apoyo de los estudiantes que abogaban por la reforma social, por lo que fue despedido de la universidad. Pero el destino fue muy injusto para Mendeleev cuando en 1906 le faltaba sólo un voto para ganar el Premio Nobel de Química. El premio fue para Henri Moissan (1852-1907), quien logró aislar el flúor, solo un elemento químico, mientras que Mendeleev creó la clasificación de todos ellos.
Mostrar comentarios (9)
Contraer comentarios (9)
Mendeleev no lo sabía, pero sus seguidores aprendieron, pero olvidaron por completo o ignoraron de manera poco científica el hecho de que los átomos son pares complementarios de esencias fundamentales de materia mutuamente complementarias, incrustadas entre sí: los núcleos atómicos como entidad interna y las nubes de electrones como entidad externa. . En otras palabras, los átomos son fractales anidados, muñecos anidados.
De ello se deduce que, en realidad, la serie natural de elementos no es una serie de elementos, sino dos series complementarias de esencias fundamentales de la materia: ¡núcleos atómicos y nubes de electrones!
El siguiente gran error científico de Mendeleev y sus seguidores: el comienzo de cada período con un metal alcalino y el final con un gas noble. De hecho, en el primer período de la Tabla Periódica de Elementos modificada por Mendeleev hasta 1902, el primero no era un metal alcalino, sino un gas biatómico, no metálico y químicamente activo, hidrógeno, que tiene un punto de ebullición extremadamente bajo. Mientras que en todos los períodos posteriores el primer elemento fue el grupo de metales alcalinotérreos. ¡La brecha en la Tabla Periódica de Elementos es terrible! Y en la tabla periódica de elementos modificada por Mendeleev en 1902 y 1906, el primer elemento de los períodos fue un elemento del grupo de los gases nobles.
El final correcto y natural de absolutamente cada período del mundo atómico de la materia no es un gas noble, sino un metal alcalinotérreo, según Yu.L. Meyer. (prioridad desde 1862 para la correcta finalización de los períodos en un elemento del grupo de los metales alcalinotérreos), Mendeleev D.I. (prioridad de 1869 y 1870 sobre la predicción correcta de las propiedades de varios elementos entonces desconocidos y la corrección de las masas atómicas de varios elementos conocidos, así como sobre la formulación de la fórmula para un fenómeno periódico, erróneamente llamado y todavía considerado erróneamente la ley periódica y prioridad desde 1902 sobre la hipótesis sobre dos elementos del éter material: newtonio y coronio, anteriores al hidrógeno), A. Weber (prioridad desde 1905 sobre la idea de mostrar cada uno de todos los períodos en una fila ), Zhanet Ch. (prioridad desde 1928 en la visualización de cada uno de los períodos correctos en una fila), Rutherford E. (prioridad desde 1911 en la explicación correcta de la estructura de los átomos a partir de un núcleo compacto cargado electrostáticamente positivamente y un extenso electrostáticamente negativo nube de electrones cargada), Moseley G. (prioridad desde 1913 en el espectro experimental de rayos X, prueba de que el número de elemento es igual al número de protones en el núcleo de un átomo o al número de electrones en la nube de electrones de un no -átomo ionizado), N. Bohr (prioridad de 1913 sobre la idea de órbitas estacionarias de electrones no excitados en las capas de las capas de la nube de electrones de un átomo) y A.K. Makeev. (prioridad de 2000, 2010, 2013 para un paquete de más de 20 leyes periódicas reales y disposiciones científicas fundamentales que describen la estructura y el orden de formación de la nube de electrones de un átomo a medida que aumenta la carga electrostática de los núcleos atómicos; para la expansión de la periódica sistema de elementos frente al hidrógeno por 10 elementos de niveles de materia de vacío; creación de un modelo de la estructura de la materia de fotones y vacío, prueba teórica de que los cuantos de campos electrostáticos y magnéticos en la composición de la materia de fotones en sus vectores de movimiento tienen una velocidad de la raíz cuadrada dos veces más rápida que el movimiento de todo el sistema de materia fotónica en su vector de movimiento)!
Entonces la ciencia mundial debería aceptar oficialmente que el primer período correcto (natural) de niveles atómicos de materia contiene 4 elementos que difieren radicalmente entre sí en propiedades físicas y químicas: hidrógeno (un gas biatómico químicamente activo), helio (un gas químicamente inerte gas unatómico), litio (un metal alcalino reactivo) y berilio (un metaloide alcalinotérreo reactivo). Por lo tanto, los últimos 4 elementos de cada período correcto (natural) posterior son posicionalmente análogos al gas diatómico similar al halógeno, no metálico químicamente activo, al gas monoatómico químicamente inerte no metálico helio, al metal alcalino químicamente activo litio y al reactivo ¡Berilio, metal alcalinotérreo!
En la Matriz del Automatismo de la Materia - la tabla periódica de elementos del vacío y niveles atómicos de la materia de Meyer, Zhanet y Makeev, aparece una prohibición muy importante - la ley de Makeev, no notada por Pauli - la prohibición para cada capa del electrón Nube de un átomo para llenar más de una de sus capas dentro de cada período natural, en el que esta capa se llena de electrones.
Ver detalles aquí:
1. Makeyev A.K. Julius Lothar Meyer fue el primero en construir la tabla periódica de elementos // Ciencias aplicadas europeas, abril de 2013, 4 (2) - pp. 49-61. ISSN 2195-2183
2. Makeev A.K. Un sistema de ciclos naturales de automatismos de la materia. Materiales del 1er congreso científico y práctico internacional “Perspectivas para el desarrollo de las ciencias naturales en el siglo XXI” // Aprobación. Revista científica y práctica mensual, nº 2, 2012. 110 págs., págs. 88-100. ISSN 2305-4484
3. Makeev A.K. Las partículas del campo electrostático y magnético en el sistema de materia del fotón se mueven mucho más rápido que el propio fotón. // Discusión científica: materiales del IV congreso científico y práctico internacional por correspondencia. Parte I. (20 de agosto de 2012) - Moscú: Editorial. “Centro Internacional para la Ciencia y la Educación”, 2012. 142 págs., págs. 47-65. ISBN 978-5-905945-37-3 UDC 08. BBK 94. N 34. http://www.internauka.org/node/479
4. Makeev A.K. Matriz de automatismos de materia y matriz de articulaciones elementales en el marco de un holograma de omnisciencia // Biblioteca Científica y Técnica. 27 de marzo de 2013. 84 p. http://www.sciteclibrary.ru/rus/catalog/pages/12751.html
Por cierto, la autoridad y prioridad de Rusia, como lugar de nacimiento de la verdad elemental fundamental de la química física: el Sistema Natural de Elementos, ¡no se ha visto afectada en absoluto! Después de todo, el autor de esta "tabla periódica" de elementos dentro de los límites correctos de todos los períodos y un paquete de más de veinte leyes periódicas reales y disposiciones científicas fundamentales es un ciudadano de Rusia, el moscovita Alexander Konstantinovich Makeev, médico e investigador multidisciplinario. e inventor, con prioridad desde el año 2000! En coautoría con el médico, físico y químico alemán Meyer Julius Lothar, con prioridad desde 1862. Y en coautoría con la industrial y científica francesa, empresaria Jeanette Charles, con prioridad desde 1928.
Mendeleev, con razón, no recibió el Premio Nobel en 1906. Después de todo, ¡su Tabla Periódica de Elementos Químicos es tremendamente incorrecta al final de todos los períodos! ¡Ni siquiera podía formular una sola ley periódica real!
Ahora el Comité de concesión del Premio. Alfred Nobel puede, con el alma pura, sin temor a que aparezca un truco con el tiempo, otorgar su gran Premio al verdadero creador del Sistema Natural de Elementos y descubridor de todo un paquete de leyes periódicas reales, el ruso Alexander Konstantinovich. ¡Makeev! ¡Hola, actuales premios Nobel que tienen derecho a hacerlo, hablen con el Comité Nobel, por favor!
Respuesta
Límites complicados de períodos
El gran químico Mendeleev
Pidió medir todo en las ciencias.
¡Sin medida, toda ciencia es un desastre!
- Así habló nuestra luminaria.
Habiendo llamado a otros, él mismo cometió un error.
En la Tabla de Períodos de repente hubo un error.
Construyó los elementos en filas,
Y en grupos agregué columnas:
Al comienzo de las líneas - gas noble,
¡El fin de los halógenos! - Se dio una orden.
Después de pensar seriamente, el disidente
Él dirá: ¡muy mal documento!
¡Cada período termina con un error!
¡Hay un error en tres elementos!
Después de todo, un metal alcalinotérreo
¡Que se acaben los períodos!
La “Ley” entró en conflicto con la ciencia.
- ¡No se dejó incluir en los números!
Y como la fórmula no está en los números,
¡Él no es la Ley, como “basura en el apartamento”!
Resumimos todo el asunto,
¿Por qué Svetoch-Khimik es “rey” y “dios”?
La periodicidad es sólo un fenómeno
¡Dmitry abrió, sin duda!
Pero el mundo de los científicos es inquebrantable,
El innovador no aceptó el argumento.
Como antes, la Mesa reza,
Y lucha contra los disidentes...
Meyer advirtió por ocho años,
Acabo de acumular los períodos,
Charles Janet añadió a la mesa:
Pero pocas personas recuerdan esto ahora...
Makeev luego construyó la mesa,
Puse todos los elementos en su lugar.
Según Janet y Meyer, a quienes no conocía,
¡Pero definitivamente cayó dentro de los límites de los períodos!
No sólo desde los niveles atómicos,
Pero incluso desde niveles de vacío
Elementos de materia construidos.
Todo como uno, ¡no perdido!
(Makeev A.K., región de Moscú, pueblo de Belozerskaya, pueblo de Bykovo 24-28/05/2006. Nueva edición: Moscú, 3 de junio de 2013, 11 horas 02 minutos. URL: http://www.stihi.ru/ 2013/06 /03/1207)
Respuesta
La distribución de elementos químicos en la Tabla Periódica - IUPAC no tiene una expresión matemática (fórmula, ecuación, código) debido a que los elementos químicos son un subconjunto (parte) de un conjunto más general de elementos naturales del Universo. Y el enfoque para la búsqueda de una expresión matemática debe ser deductivo (científico general, teórico, matemático, cosmovisión, ecuménico) y no inductivo (empírico). El enfoque deductivo reveló una expresión matemática en forma de una ecuación breve y sencilla, un código de una letra.
Como resultado, todos los elementos químicos, que, por supuesto, también son elementos naturales, están completamente descritos por el "código radical" del Sistema y Círculo de elementos naturales del Universo (http://www.decoder.ru/media /file/0/2494.docx o http://e-science.ru//content/Chemical-elements-in-the-Code-System-and-Circle-of-natural-elements-of-the-Universe) .Respuesta
Escribir un comentario
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0