La desintegración radiactiva es un evento aleatorio en la “vida” de un átomo, se podría decir un accidente. Intentemos, basándonos en esta consideración tan general, derivar una ley según la cual la concentración de átomos radiactivos debería cambiar con el tiempo.
Deja que en algún momento t la concentración del isótopo radiactivo era igual a PAG(t), y después de un corto tiempo D t se volvió igual PAG(t+D t). Es claro que durante el tiempo D t se vino abajo PAG(t) – PAG(t+D t) átomos.
Si la desintegración radiactiva es un proceso aleatorio, entonces es bastante lógico suponer que el número de desintegraciones en el tiempo D t será mayor cuanto mayor sea la concentración de átomos PAG(t) y cuanto más largo sea el período de tiempo D t:
PAG(t) – PAG(t+D t) ~ PAG(t) ×D t
PAG(t) – PAG(t+D t) = l PAG(t)D t, (1)
donde l es el coeficiente de proporcionalidad. Está claro que cada isótopo tiene su propio coeficiente: si el isótopo se desintegra rápidamente, entonces el coeficiente l es grande, si se desintegra lentamente, entonces es pequeño.
Reescribamos la igualdad (1) en la forma:
PAG(t+D t) – PAG(t) = –l PAG(t)D t. (2)
Ahora dirijamos D t a cero y tenga en cuenta que PAG(t+D t) – PAG(t) - Este incremento de función sustantivo, masculino—(t) en el tiempo D t, obtenemos:
Tenemos una ecuación diferencial. Está claro que si en el momento inicial la concentración de isótopos era igual a PAG 0, entonces PAG(0) = = PAG 0. "Adivinemos" la solución de la ecuación (3):
PAG(t) = PAG 0 mi– yo t. (4)
Comprobemos sustituyendo la expresión (4) en la ecuación (3):
izquierda: ( PAG 0 mi– yo t)¢ = PAG 0 mi– yo t(–l);
p.f.: –l PAG 0 mi– yo t.
Es obvio que el lado izquierdo es idénticamente igual al derecho, además, también se cumple la condición inicial:
PAG(0) = PAG 0 mi– l × 0 = PAG 0 mi 0 = PAG 0×1 = PAG 0 .
Entonces, hemos obtenido la ley de desintegración de las ondas de radio:
PAG(t) = PAG 0 mi– yo t. (25.1)
La cantidad l se llama constante de desintegración radiactiva.
Media vida
Al estudiar la desintegración radiactiva, en lugar de la constante de desintegración como característica de la velocidad del proceso, a menudo se usa otro valor: media vida.
Media vida t es el tiempo durante el cual se desintegra la mitad de la cantidad original de un isótopo radiactivo determinado. Encontremos una conexión entre t y yo.
Usemos el hecho matemático de que para cualquier número A la igualdad es cierta.
En efecto,
en e un = a en mi = a×1 = a Y ![]() .
.
Luego reescribimos la fórmula (25.1) en la forma
![]() .
.
Introduzcamos la notación
Si sustituimos el valor en la fórmula (25.3) t = T, obtenemos
![]() .
.
Por tanto, es la vida media de un isótopo determinado.
Hay que decir que las vidas medias de diferentes isótopos pueden adoptar valores muy diferentes. Por ejemplo:
92 U 238 (desintegración a): t= 4,5×10 9 años;
94 Pu 239 (desintegración a): t= 24400 años;
89 Ra 236 (desintegración a): t= 1600 años;
91 Ac 233 (b – -decaimiento): t= 27 días;
90 Th 233 (b – -decaimiento): t= 22 min.
Hay isótopos con una vida media de diez milésimas de segundo (algunos isótopos de polonio 84 Po).
Problema 25.2. El isótopo radiactivo del carbono en un viejo trozo de madera es 0,0416 veces la masa de ese isótopo en las plantas vivas. ¿Qué edad tiene este trozo de madera? La vida media del isótopo es de 5570 años.
entonces la masa cambia según la misma ley que la concentración
metro(t) = metro 0 . (1)
Expresemos a partir de la ecuación (1) la incógnita t.
MOSCÚ, 3 de junio - RIA Novosti. Los niveles elevados de carbono-14 radiactivo en los anillos de crecimiento de dos cedros japoneses pueden indicar que la Tierra fue bombardeada por rayos cósmicos en el año 774-775 d.C., dicen los físicos en un artículo publicado en la revista Nature.
Los árboles y otros tipos de vegetación reaccionan de manera muy sensible a los más mínimos cambios en las condiciones de vida: aumento o disminución de la temperatura, energía de la radiación solar y otros factores. Todos estos eventos se reflejan en la forma y el grosor de los anillos anuales: capas de madera en el tronco que se forman durante la temporada de crecimiento. Se cree que los anillos oscuros corresponden a condiciones ambientales desfavorables y los anillos claros a condiciones ambientales favorables.
Un grupo de físicos liderados por Fusa Miyake de la Universidad de Nagoya (Japón) examinó los anillos de crecimiento de dos antiguos cedros japoneses para determinar la fecha exacta del “incursión” de rayos cósmicos en la Tierra, que supuestamente ocurrió entre el 750 y el 820 d.C.
Como explican los físicos, los episodios de “bombardeo” prolongado con partículas de origen extraterrestre suelen ir acompañados de un aumento de la proporción del isótopo pesado y radiactivo carbono-14 en la madera y los tejidos blandos de las plantas.
Guiados por esta idea, los físicos dividieron finos cortes de dos cedros japoneses que crecieron en la Tierra del Sol Naciente durante la Edad Media en anillos de crecimiento separados.
En un caso, utilizaron trozos de madera para calcular las variaciones anuales del carbono-14 entre el 770 y el 779 d.C., y en el segundo, los utilizaron para observar cambios en la concentración media de un isótopo pesado de carbono cada dos años entre el 750 y el 779 d.C. y 820 d.C.
En ambos casos, los científicos registraron un fuerte aumento en la proporción de carbono radiogénico en los anillos que datan del 774 y 775 d.C. Según ellos, este pico de concentración no puede explicarse por variaciones estacionales en la intensidad de la radiación solar, ya que el carbono 14 en los anillos de 774 y 775 era aproximadamente 20 veces mayor que en las capas de madera formadas durante el aumento de la actividad solar.
Según los investigadores, esta conclusión concuerda bastante con los resultados de los estudios antárticos. Así, en las muestras de nieve 774 y 775, obtenidas de la estación antártica Fuji Dome, se registró un pico similar en la concentración de otro elemento "cósmico": el berilio-10.
Los científicos creen que la fuente de los rayos cósmicos podría haber sido una poderosa supernova que explotó a una distancia relativamente cercana (6,5 mil años luz) del sistema solar. Otra posible razón para esto podría ser una “súper llamarada” en el Sol con una potencia varias decenas de veces mayor que la potencia típica de las erupciones solares.
Cree un campo magnético perpendicular a la placa con potencial Ux = 2,8 V. Determine la concentración por inducción B = 0,100 T, luego surge una diferencia transversal de portadores de corriente. potencial U2=55 nV. Determine la concentración de cobre 119. La diferencia de potencial transversal que surge de los electrones libres n y la movilidad Un. al pasar corriente a través de una placa de aluminio de espesor 112. La movilidad de los electrones en germanio tipo n con un espesor de 0,1 mm es 2,7⋅10-6 V. ¿Qué corriente pasa a través de 3,7⋅10 cm2/(V⋅s)? Determine la constante de Hall si la tercera placa se coloca en un campo magnético con una resistividad del semiconductor de 1,6⋅10-2 Ohm⋅m. producción B=0,5 T. La concentración de electrones de conducción es 113. Perpendicular al campo magnético homogéneo es igual a la concentración de átomos. lu, cuya inducción es de 0,1 T, se coloca una placa delgada Física nuclear de germanio, ancho de placa b = 4 cm. Determine la densidad 120. Durante la desintegración de 94 Pu → 92 U + 2 He se libera la corriente j. en el cual la diferencia de potencial de Hall alcanza un valor de 0,5 V. A la constante de Hall para el germanio se le da energía, la mayor parte de la cual es cinética: tome 0,3 m3/C. energía física de las partículas α. 0,09 meV son transportados por los rayos γ, is- 114. Determine la movilidad de los electrones en un semiconductor si la constante de Hall es 0,8 m3/C, la transmisión específica de los núcleos de uranio. Determine la velocidad de las partículas α, su resistencia es 1,56 Ohm⋅m. mPu=239,05122 uma, mU=235,04299 uma, mAl=4,00260 115. Energía necesaria para la formación de uma eléctrica. Trones de conducción en germanio y silicio, respectivamente - 121. Durante el proceso de fisión, el núcleo de uranio se desintegra en pero son iguales a 1,12⋅10-19 J y 1,76⋅10-19 J. ¿En cuál de estas dos partes, la masa total de cual La concentración del co-núcleo es aproximadamente 0,2 veces la masa en reposo de un protón menos que la masa inicial de los semiconductores a una temperatura determinada. ¿Hay más electrones reales? Indique ¿cuál de estos elementos es más adecuado para fabricar un fotorresistor? nia. 123. Determine el número de átomos de uranio 92U238, que se desintegran 116. Al calentar silicio de T=273 K a T=283 K durante el año, si la masa inicial de uranio 1 su conductividad específica aumentó 2,3 veces. Determinar kg. Calcula la constante de desintegración del uranio. banda prohibida de un cristal de silicio. 124. Calcula el número de átomos de radón que se desintegraron en 117. Conductividad específica del silicio con impurezas durante el primer día, si la masa inicial del radón es 1.112 Ohm/m. Determinar la movilidad de los huecos y su concentración. Calcular la constante de desintegración del uranio. 125. En el cuerpo humano hay 0,36 masa de prichotio, si la constante de Hall es 3,66⋅10-4 m3/C. Semiconductos al potasio. El isótopo radiactivo de potasio 19K40 solo tiene conductividad hueca. es 0,012% de la masa total de potasio. ¿Cuál es la actividad del calcio 118. Una placa delgada de silicio de 2 cm de ancho poli- si la masa de la persona es de 75 kg? ¿Su vida media es perpendicular a las líneas de inducción de un campo magnético uniforme igual a 0,5 Tesla? En densidad actual j=2 1,42⋅108 años. µA/mm2 dirigido a lo largo de la placa, el Hall muestra 126. En la balanza se encuentran 100 g de sustancia radiactiva. ¿Después de cuántos días una balanza con una sensibilidad de 0,01 g mostrará la ausencia de una sustancia radiactiva? La vida media del 137. ¿Cuánto tiempo tarda el 80% de los átomos de una sustancia en desintegrarse es de 2 días? isótopo radiactivo del cromo 24Cr51, si su vida media es 127. ¿En dos días, la radiactividad del preparado de radón desciende en 27,8 días? disminuyó en 1,45 veces. Determinar la vida media. 138. La masa del isótopo radiactivo del sodio 11Na25 128. Determine el número de núcleos radiactivos en los recién formados: igual a 0,248⋅10-8 kg. Vida media 62 s. ¿Cuál es el valor del fármaco preparado 53J131, si se sabe que a través de la actividad inicial del fármaco y su actividad después de 10 días su actividad llegó a ser 0,20 Curie? ¿Vida media mínima? Yodo 8 días. 139. ¿Cuánta sustancia radiactiva queda después de 129. ¿La proporción relativa de carbono radiactivo después de uno o dos días, si al principio había 0,1 kg? 14 6C en un trozo de madera viejo es 0,0416 de su proporción en un líquido. La vida media de la sustancia es de 2 días. plantas de hiedra. ¿Qué edad tiene este trozo de madera? Período 140. La actividad de una preparación de uranio con una vida media masiva de 6C14 es de 5570 años. 238 es igual a 2,5⋅104 desintegración/s, la masa del fármaco es 1 g Encuentre el período de 130. Se encontró que en prepa- vida media. A este ritmo, se producen 6,4⋅108 desintegraciones nucleares por minuto. Determine 141. ¿Qué fracción de átomos del isótopo radiactivo 234 determina la actividad de este fármaco? 90Th, que tiene una vida media de 24,1 días, se desintegra - 131. ¿Qué fracción del número inicial de núcleos se destruye en 1 s, por día, por mes? 90 38Sr permanece después de 10 y 100 años, se desintegra en un día, 142. ¿Qué fracción de los átomos del isótopo radiactivo cabra- 15 años? Vida media 28 años. Balta se desintegra en 20 días si su vida media es 132. Hay 26⋅106 átomos de radio. ¿Cuántos de ellos son 72 días? Sufrirán desintegración radiactiva en un día si 143. ¿Cuánto tiempo tarda una preparación con una vida media activa constante: la vida media del radio es de 1620 años? ¿Con una velocidad de 8,3⋅106 desintegraciones/s, se desintegran 25⋅108 núcleos? 133. La cápsula contiene 0,16 moles del isótopo 94Pu238. 144. Encuentre la actividad de 1 µg de tungsteno 74W185, peri- Su vida media es 2,44⋅104 años. Determinar el activo cuya vida media es de 73 días. contenido de plutonio. 145. ¿Cuántas desintegraciones nucleares ocurren por minuto en 134. ¿Existe una preparación de uranio con una actividad de una preparación cuya actividad sea 1,04⋅108 desintegraciones/s? 20,7⋅106 dispersión/s. Determine la masa del isótopo 146 en la preparación. ¿Qué proporción de la cantidad inicial de radiactivo es 235 92U con una vida media de 7,1⋅108 años? de la sustancia permanece sin desintegrarse después de 1,5 períodos 135. ¿Cómo cambiará la actividad del fármaco de cobalto durante su vida media? dentro de 3 años? Vida media 5,2 años. 147. ¿Qué fracción de la cantidad inicial de radio- 136. En una cápsula de plomo hay 4,5⋅1018 átomos del isótopo activo se desintegra durante la vida útil de este isotorio. ¿Determinar la actividad del radio si su vida media es? decadencia 1620 años. 148. ¿Cuál es la actividad del radón formado a partir de 1 g de radio en una hora? La vida media del radio es de 1620 años, la del radón es de 3,8 días. 149. Cierto fármaco radiactivo tiene cuántas transformaciones α y β se produjeron en cada estación de desintegración de 1,44⋅10-3 h-1. ¿Cuánto tiempo tardará la familia en separarse? ¿Cae el 70% del número original de átomos? 159. Encuentre la energía de enlace por 150. Encuentre la actividad específica de un medio nucleón artificial en el núcleo del átomo de oxígeno 8O16. precioso isótopo radiactivo del estroncio 38Sr90. Período 160. Encuentre la energía liberada durante la vida media nuclear de sus 28 años. acciones: 151. ¿Puede un núcleo de silicio convertirse en un núcleo de aluminio H 2 + 1H 2 →1 H1 + 1H 3 1, emitiendo así un protón? ¿Por qué? 161. ¿Qué energía se liberará durante la formación de 1 g 152. Durante el bombardeo de aluminio 13Al27 α-helio 2He4 a partir de protones y neutrones? El fósforo 15P30 está formado por partículas. Escribe esta reacción y 162. ¿En qué se convierte el isótopo de torio 90Th234? Calcula la energía liberada por el núcleo. ¿Cuál sufre tres desintegraciones α sucesivas? 153. Cuando un protón choca con un núcleo de berilio, se produce la pro- 163. Completa las reacciones nucleares: se produce la reacción nuclear 4 Be + 1 P → 3 Li + α. Encuentre 9 1 6 3 Li 6 + 1 P 1 → ?+ 2 He 4 ; energía de reacción. 154. Encuentre la energía de enlace promedio por 1 nucleón en núcleos 3Li6, 7N14. 164. El núcleo de uranio 92U235, habiendo capturado un neutrón, dis- 155. Cuando los núcleos de flúor fueron bombardeados con protones, el 9F19 se formó en dos fragmentos y se liberaron dos trozos de oxígeno, 8O16. Cuánta energía se libera durante el trono. Uno de los fragmentos resultó ser un núcleo de xenón 54Xe140. esta reaccion y que nucleos se forman? ¿Cuál es el segundo fragmento? Escribe la ecuación de reacción. 156. Encuentre la energía liberada durante lo siguiente: 165. Calcule la energía de enlace del núcleo de helio 2He3. reacción nuclear general 4 Be + 1 H → 5 B + o n. 9 2 10 1 166. Encuentre la energía liberada durante la reacción nuclear: 157. Un isótopo de radio con número másico 226 se transforma en un isótopo de plomo con número másico 206. ¿Cuánto α y 20 Ca 44 + 1 P 1 → 19 K 41 + α β: ¿se produjo alguna descomposición durante esto? 167. Escriba las notaciones que faltan en lo siguiente - 158. Se dan los elementos iniciales y finales de cuatro reacciones nucleares: familias radiactivas: ....+ 1 P 1 → α + 11 Na 22 U 238 → 82 Pb 206, 92 13 Al 27 + o n 1 → α + ... 90 Th 232 → 82 Pb 202, 168. Determine la energía de enlace específica de la tritina. U 235 → 82 Pb 207 169. El cambio de masa durante la formación del núcleo 7N15 92 es igual a 0,12396 a.m. Determinar la masa de un átomo. 95 Am 241 → 83 Bi 209 170. Encuentre la energía de enlace de los núcleos 1H3 y 2He4. ¿Cuál de estos núcleos es el más estable? 171. Cuando se bombardea el litio 3Li7 con protones, el resultado es 183. En un año, el 64,46% de sus núcleos primarios de helio se desintegraron. Escribe esta reacción. ¿Cuánta energía es la cantidad liberada de fármaco radiactivo? ¿Está determinado por tal reacción? Vierta la vida media y la vida media. 172. Encuentre la energía absorbida durante la reacción: 184. Vida útil promedio de la sustancia radiactiva N 14 + 2 He 4 → 1 P 1 + ? τ=8266,6 años. Determine el tiempo durante el cual se desintegran 7 51,32% de los núcleos de su número inicial, período 173. Calcule la energía de enlace del núcleo de helio 2He4. ludecay, constante de decaimiento. 174. Encuentre la energía liberada durante la siguiente 185. En una sustancia radiactiva con una reacción nuclear de desintegración constante: sí λ = 0,025 años-1, 52,76% de los núcleos de su original 3 Li 7 + 2 He 4 → 5 B10 + o n 1 cantidades descompuestas. ¿Cuánto duró la ruptura? ¿Cuál es la vida media de los núcleos? 175. Completa las reacciones nucleares: 186. Determina la actividad de 222 Rn con una masa de 0,15 μg con 86 ?+ 1 P → 11 Na 22 + 2 He 4, 1 25 Mn 55 + ? 27 Co 58 + en 1 mitad -vida 3,8 días en dos días. Analice 176. Encuentre la energía liberada durante la siguiente dependencia A=f(t) de la reacción nuclear: 187. La vida media del bismuto (83 Bi 210) es igual a 5 3 Li 6 + 1 H 2 → 2α días. ¿Cuál es la actividad de este fármaco que pesa 0,25 μg 177. Los núcleos del isótopo 90Th232 sufren una desintegración α, dos en 24 horas? Supongamos que todos los átomos del isótopo son radiactivos: desintegración β y una desintegración α más. ¿Qué núcleos quedan vacíos después de esto? ¿están radiantes? 188. El isótopo 82 Ru 210 tiene una vida media de 22 178. Determine la energía de enlace del núcleo de deuterio. Sí. Determine la actividad de este isótopo con una masa de 0,25 μg 179. ¿El núcleo del isótopo 83Bi211 se obtuvo de otro núcleo después de 24 horas? después de una desintegración α y una desintegración β. ¿Qué tipo de veneno es este? 189. ¿El flujo de neutrones térmicos que pasa a través del aluminio ro? distancia d=79,4 cm, debilitado tres veces. Determine 180. ¿Qué isótopo se forma a partir de una sección transversal radiactiva a efectiva de la reacción de captura de neutrones por un núcleo atómico 90Th232 como resultado de 4 desintegraciones α y 2 desintegraciones β? mamá aluminio. Densidad del aluminio ρ=2699 kg/m3. 181. En una droga radiactiva con una desintegración constante- 190. El flujo de neutrones se debilita 50 veces, habiendo pasado y λ = 0,0546 años-1 desintegrado a = 36,36% de los núcleos de su distancia inicial d en plutonio, la densidad de que es ρ = 19860 cantidades. Determinar la vida media, promedio kg/m3. Determine d si la sección transversal de captura efectiva es la vida útil. ¿Cuánto tiempo tardaron los núcleos en desintegrarse? núcleo de plutonio σ = 1025 bares. 182. vida media de una sustancia radiactiva 191. ¿Cuántas veces se debilita el flujo de neu- 86 años térmicos? ¿Cuánto tiempo tardará en desintegrarse el 43,12% de los núcleos de sus primeros natrones después de recorrer una distancia d=6 cm en circonio, si la cantidad es densa? Determine la constante de desintegración λ y la densidad del circonio ρ = 6510 kg/m3, y la sección transversal efectiva y la vida útil promedio del núcleo radiactivo. captura de acciones σ = 0,18 granero. 192. Determine la actividad de 85 Ra 228 con el período de actividad de una muestra de plantas frescas. El período de vida media es de 6,7 años después de 5 años, si la masa del fármaco es m = 0,4 y 14C T = 5730 años. 6 mcg y todos los átomos del isótopo son radiactivos. 201. Determine el espesor de la capa de mercurio si el flujo 193. ¿Cuánto tiempo tardó el 44,62% de los núcleos en desintegrarse de los primeros neutrones después de atravesarlo se debilita en 50 veces la cantidad inicial efectiva, si la vida media t = 17,6 sección transversal de la reacción de captura de neutrones por el núcleo σ = 38 graneros, años. Determine la constante de desintegración λ, el tiempo de vida promedio del mercurio ρ=13546 kg/m3. sin núcleo radiactivo. 202. El isótopo 81Тλ207 tiene una vida media T=4,8 194. Determine la edad de un hallazgo arqueológico en millones ¿Cuál es la actividad de este isótopo que pesa 0,16 μg a través de la madera, si la actividad de la muestra para el isótopo 14C es 6? tiempo t=5 millones. Suponga que todos los átomos del isótopo Tλ207 son radiactivos en el 80% de la muestra de plantas frescas. Vida media activa. 14 6 C es igual a 5730 años. 203. ¿Cuántos núcleos de su número original son 195? El potasio líquido ρ = 800 kg / m 3 debilita el flujo de materia que se desintegra en 5 años si se duplica la constante de desintegración de neutrones. Determine la sección transversal efectiva re- λ = 0.1318 años-1. Determine la vida media, el promedio de la captura de un neutrón por el núcleo de un átomo de potasio, si el flujo de neutrones es la vida útil de los núcleos. tronos pasa en potasio líquido una distancia d = 28,56 cm 204. Determine la actividad de 87 Fr 221 con una masa de 0,16 μg 196. Determine la edad del tejido antiguo si el activo tiene una vida media T = 4,8 millones después de un. tiempo t = 5 min. El contenido de isótopo 14C de la muestra es el 72% de la actividad. 6 Analice la dependencia de la actividad con la masa (A=f(m)). muestra de plantas frescas. La vida media del 14C es 6205. La vida media del isótopo de carbono 6C es 14 T = 5730 años. 197. Escriba en forma completa la ecuación de re- T = 5730 años, actividad de la madera según la composición del isótopo 6 C 14 - acciones (ρ, α) 22 Na. Determine la energía liberada en una actividad del 0,01% de muestras de plantas frescas. Como resultado de una reacción nuclear. dividir la edad de la madera. 198. El uranio, cuya densidad es ρ = 18950 kg/m3, se debilita - 206. El flujo de neutrones, al pasar a través del azufre (ρ = 2000 kg/m3), reduce el flujo de neutrones térmicos 2 veces con un espesor de capa de la distancia d = 37,67 cm se debilita 2 veces. Determine d=1,88 cm. Determine la sección transversal efectiva de la reacción de captura: la sección transversal efectiva de la reacción de captura de un neutrón por un núcleo de átomo, un neutrón por un núcleo de uranio. ma azufre. 199. Determinar la actividad del isótopo 89 Ac 225 con un período de 207. Comparación de la actividad de los fármacos 89 Ac 227 y la vida media de la casa T = 10 días después de un tiempo t = 30 días, si 82Pb 210, si el masa de los fármacos m = 0,16 μg, después de 25 años. masa inicial del fármaco m = 0,05 μg. Las vidas medias de los isótopos son iguales e iguales a 21,8 200. Determine la edad del hallazgo arqueológico a partir de años. madera, si la actividad de la muestra para 6 C 14 es del 10% 208. En una sustancia radiactiva, el 49,66% de los núcleos de su cantidad original se desintegraron en t = 300 días. Determine la constante de desintegración, la vida media, la vida media promedio 22. 52 82 112 142 172 202 del núcleo isotópico. 23. 53 83 113 143 173 203 209. Analice la dependencia de la actividad del isótopo radiactivo 89 Ac 225 con la masa después de t = 30 días, 25. 55 85 115 145 175 205 si la vida media T = 10 días. Tome la masa inicial del isótopo 26. 56 86 116 146 176 206 m1 = 0,05 μg, m2 = 0,1 μg, 27. 57 87 117 147 177 207 m3 = 0,15 µg. 28. 58 88 118 148 178 208 210. El iridio debilita el flujo de neutrones térmicos en 2 28. 59 89 119 149 179 209 veces. Determine el espesor de la capa de iridio si su densidad es 30. 60 90 120 150 180 210 ρ = 22400 kg/m3, y la sección transversal efectiva para la reacción de captura de neutrones por un núcleo de iridio es σ = 430 barn. Literatura recomendada n/n Problema número 1. Savelyev I.V. Curso de física. M, - 1987. T3. 2. Trofimova T.I. Curso de física. M, -1989. 1. 31 61 91 121 151 181 3. Vetrov V.T. Colección de problemas de física. Minsk, - 2. 32 62 92 122 152 182 1991. 3. 33 63 93 123 153 183 4. Tsedrik M.S. Colección de problemas para el curso de física general 4. 34 64 94 124 154 184. M, - 1989. 5. 35 65 95 125 155 185 6. 36 66 96 126 156 186 7. 37 67 97 127 157 187 8. 38 68 98 128 158 188 9. 39 69 99 129 59 189 10. 40 70 100 130 160 190 11. 41 71 101 131 161 191 12. 42 72 102 132 162 192 13. 43 73 103 133 163 193 14. 44 74 104 134 164 194 75 105 135 165 195 16. 46 76 106 136 166. 196 17. 47 77 107 137 167 197 18. 48 78 108 138 168 198 19. 49 79 109 139 169 199 20. 50 80 110 140 170 200 21. 51 81 111 141 171 201
La Tierra y su atmósfera están constantemente expuestas al bombardeo radiactivo de corrientes de partículas elementales procedentes del espacio interestelar. Al penetrar en la atmósfera superior, las partículas dividen los átomos allí, liberando protones y neutrones, así como estructuras atómicas más grandes. Los átomos de nitrógeno en el aire absorben neutrones y liberan protones. Estos átomos tienen, como antes, una masa de 14, pero tienen menos carga positiva; ahora su carga es de seis. Así, el átomo de nitrógeno original se convierte en un isótopo radiactivo de carbono:
donde n, N, C y p representan neutrones, nitrógeno, carbono y protones, respectivamente.
La formación de nucleidos de carbono radiactivos a partir del nitrógeno atmosférico bajo la influencia de los rayos cósmicos se produce a un ritmo medio de aprox. 2,4 at./s por cada centímetro cuadrado de la superficie terrestre. Los cambios en la actividad solar pueden provocar algunas fluctuaciones en este valor.
Debido a que el carbono-14 es radiactivo, es inestable y gradualmente se convierte en los átomos de nitrógeno-14 a partir del cual se formó; En el proceso de tal transformación, libera un electrón, una partícula negativa, lo que permite registrar este proceso en sí.
La formación de átomos de radiocarbono bajo la influencia de los rayos cósmicos suele ocurrir en las capas superiores de la atmósfera, a altitudes de 8 a 18 km. Al igual que el carbono normal, el radiocarbono se oxida en el aire para formar dióxido radiactivo (dióxido de carbono). Bajo la influencia del viento, la atmósfera se mezcla constantemente y, en última instancia, el dióxido de carbono radiactivo, formado bajo la influencia de los rayos cósmicos, se distribuye uniformemente en el dióxido de carbono atmosférico. Sin embargo, el contenido relativo de radiocarbono 14 C en la atmósfera sigue siendo extremadamente bajo: aprox. 1,2´10 –12 g por gramo de carbono ordinario 12 C.
Radiocarbono en organismos vivos.
Todos los tejidos vegetales y animales contienen carbono. Las plantas lo obtienen de la atmósfera y, dado que los animales comen plantas, el dióxido de carbono también ingresa indirectamente a sus cuerpos. Por tanto, los rayos cósmicos son la fuente de radiactividad de todos los organismos vivos.
La muerte priva a la materia viva de la capacidad de absorber radiocarbono. En los tejidos orgánicos muertos se producen cambios internos, incluida la desintegración de los átomos de radiocarbono. Durante este proceso, a lo largo de 5730 años, la mitad del número original de nucleidos de 14 C se convierte en átomos de 14 N. Este intervalo de tiempo se denomina vida media del 14 C. Después de otra vida media, el contenido de nucleidos de 14 C es sólo. 1/4 de su número original, después de la vida media del siguiente período – 1/8, etc. Como resultado, el contenido del isótopo 14 C en la muestra se puede comparar con la curva de desintegración radiactiva y así establecer el período de tiempo transcurrido desde la muerte del organismo (su exclusión del ciclo del carbono). Sin embargo, para tal determinación de la edad absoluta de una muestra, es necesario suponer que el contenido inicial de 14 C en los organismos durante los últimos 50.000 años (recurso de datación por radiocarbono) no ha sufrido cambios. De hecho, la formación de 14 C bajo la influencia de los rayos cósmicos y su absorción por los organismos cambió algo. Como resultado, medir el contenido de isótopos 14 C de una muestra proporciona sólo una fecha aproximada. Para tener en cuenta los efectos de los cambios en el contenido inicial de 14 C, se pueden utilizar datos dendrocronológicos sobre el contenido de 14 C en los anillos de los árboles.
El método de datación por radiocarbono fue propuesto por W. Libby (1950). En 1960, la datación por radiocarbono había ganado una amplia aceptación, se habían establecido laboratorios de radiocarbono en todo el mundo y Libby había recibido el Premio Nobel de Química.
Método.
La muestra destinada a la datación por radiocarbono debe recogerse utilizando instrumentos absolutamente limpios y almacenarse seca en una bolsa de plástico esterilizada. Es necesaria información precisa sobre la ubicación y las condiciones de selección.
Una muestra ideal de madera, carbón o tela debería pesar aproximadamente 30 g. Para las conchas, es deseable un peso de 50 g, y para los huesos, 500 g (las últimas técnicas, sin embargo, permiten determinar la edad a partir de muestras mucho más pequeñas). . Cada muestra debe limpiarse a fondo de contaminantes viejos y jóvenes que contienen carbono, por ejemplo, de las raíces de plantas de crecimiento posterior o de fragmentos de rocas carbonatadas antiguas. A la limpieza previa de la muestra le sigue un procesamiento químico en el laboratorio. Se utiliza una solución ácida o alcalina para eliminar minerales extraños que contienen carbono y materia orgánica soluble que puedan haber penetrado en la muestra. Después de esto, las muestras orgánicas se queman y las cáscaras se disuelven en ácido. Ambos procedimientos dan como resultado la liberación de gas dióxido de carbono. Contiene todo el carbono de la muestra purificada y, en ocasiones, se convierte en otra sustancia adecuada para la datación por radiocarbono.
El método tradicional requiere equipos mucho menos voluminosos. En primer lugar se utilizó un contador que determinaba la composición del gas y que en principio era similar a un contador Geiger. El contador se llenó con dióxido de carbono u otro gas (metano o acetileno) obtenido de la muestra. Cualquier desintegración radiactiva que se produzca dentro del dispositivo produce un impulso eléctrico débil. La energía de la radiación ambiental de fondo suele variar mucho, a diferencia de la radiación causada por la desintegración del 14 C, cuya energía suele estar cerca del límite inferior del espectro de fondo. La relación muy indeseable entre los valores de fondo y los datos de 14 C se puede mejorar aislando el contador de la radiación externa. Para ello, el mostrador se cubre con pantallas de hierro o plomo de alta pureza de varios centímetros de espesor. Además, las paredes del propio contador están protegidas por contadores Geiger situados uno cerca del otro que, al retrasar toda la radiación cósmica, desactivan el propio contador que contiene la muestra durante aproximadamente 0,0001 segundos. El método de detección reduce la señal de fondo a unas pocas desintegraciones por minuto (una muestra de madera de 3 g que data del siglo XVIII arroja ~40 desintegraciones de 14 C por minuto), lo que permite datar muestras bastante antiguas.
Aproximadamente desde 1965, el método de centelleo líquido se ha generalizado en la datación. Convierte el gas carbonoso producido a partir de la muestra en un líquido que puede almacenarse y examinarse en un pequeño recipiente de vidrio. Al líquido se le añade una sustancia especial, un centelleador, que se carga con la energía de los electrones liberados durante la desintegración de los radionucleidos de 14 C. El centelleador emite casi inmediatamente la energía acumulada en forma de destellos de ondas de luz. La luz se puede capturar utilizando un tubo fotomultiplicador. Un contador de centelleo contiene dos de estos tubos. Una señal falsa se puede identificar y eliminar ya que la envía un solo teléfono. Los contadores de centelleo modernos tienen una radiación de fondo muy baja, casi nula, lo que permite datar con gran precisión muestras de hasta 50.000 años de antigüedad.
El método de centelleo requiere una preparación cuidadosa de la muestra porque el carbono debe convertirse en benceno. El proceso comienza con una reacción entre el dióxido de carbono y el litio fundido para formar carburo de litio. Al carburo se le añade agua poco a poco y este se disuelve liberando acetileno. Este gas, que contiene todo el carbono de la muestra, se convierte, bajo la influencia de un catalizador, en un líquido transparente: el benceno. La siguiente cadena de fórmulas químicas muestra cómo se transfiere el carbono de un compuesto a otro en este proceso:
Todas las determinaciones de edad obtenidas a partir de mediciones de laboratorio de 14 C se denominan fechas de radiocarbono. Se dan en el número de años anteriores al presente (BP), y se toma como punto de partida la fecha moderna redonda (1950 o 2000). Las fechas de radiocarbono siempre se dan con una indicación de posible error estadístico (por ejemplo, 1760 ± 40 BP).
Solicitud.
Normalmente, se utilizan varios métodos para determinar la edad de un evento, especialmente si es relativamente reciente. La edad de una muestra grande y bien conservada se puede determinar con una precisión de diez años, pero el análisis repetido de la muestra requiere varios días. Normalmente el resultado se obtiene con una precisión del 1% de la edad determinada.
La importancia de la datación por radiocarbono aumenta especialmente en ausencia de datos históricos. En Europa, África y Asia, los primeros vestigios del hombre primitivo se extienden más allá de los límites temporales de la datación por radiocarbono, es decir, resultan tener más de 50.000 años. Sin embargo, las etapas iniciales de la organización de la sociedad y los primeros asentamientos permanentes, así como el surgimiento de ciudades y estados antiguos, entran dentro del alcance de la datación por radiocarbono.
La datación por radiocarbono ha sido particularmente exitosa en el desarrollo de una línea de tiempo para muchas culturas antiguas. Gracias a esto, ahora es posible comparar el curso del desarrollo de culturas y sociedades y establecer qué grupos de personas fueron los primeros en dominar ciertas herramientas, crear un nuevo tipo de asentamiento o allanar una nueva ruta comercial.
La determinación de la edad mediante radiocarbono se ha vuelto universal. Después de formarse en las capas superiores de la atmósfera, los radionucleidos de 14 C penetran en diferentes ambientes. Las corrientes de aire y las turbulencias en la atmósfera inferior aseguran la distribución global del radiocarbono. Al pasar en las corrientes de aire sobre el océano, el 14 C ingresa primero a la capa superficial de agua y luego penetra en las capas profundas. En los continentes, la lluvia y la nieve aportan 14 C a la superficie terrestre, donde se acumulan gradualmente en ríos y lagos, así como en los glaciares, donde pueden persistir durante miles de años. El estudio de las concentraciones de radiocarbono en estos entornos aumenta nuestro conocimiento sobre el ciclo del agua en los océanos del mundo y el clima de épocas pasadas, incluida la última edad de hielo. La datación por radiocarbono de los restos de árboles talados por el avance del glaciar mostró que el período frío más reciente en la Tierra terminó hace aproximadamente 11.000 años.
Las plantas absorben anualmente dióxido de carbono de la atmósfera durante la temporada de crecimiento, y los isótopos 12 C, 13 C y 14 C están presentes en las células vegetales en aproximadamente la misma proporción que en la atmósfera. Los átomos de 12 C y 13 C están contenidos en la atmósfera en proporciones casi constantes, pero la cantidad del isótopo 14 C fluctúa según la intensidad de su formación. Las capas de crecimiento anual, llamadas anillos de árboles, reflejan estas diferencias. La secuencia continua de anillos anuales de un solo árbol puede abarcar 500 años en el roble y más de 2000 años en la secuoya y el pino erizo. En las áridas regiones montañosas del noroeste de Estados Unidos y en las turberas de Irlanda y Alemania se descubrieron horizontes con troncos de árboles muertos de diferentes edades. Estos hallazgos nos permiten combinar información sobre las fluctuaciones en la concentración de 14 C en la atmósfera durante casi 10.000 años. La correcta determinación de la edad de las muestras durante la investigación de laboratorio depende del conocimiento de la concentración de 14 C durante la vida del organismo. Durante los últimos 10.000 años, estos datos se han recopilado y generalmente se presentan en forma de una curva de calibración que muestra la diferencia entre el nivel de 14 C atmosférico en 1950 y en el pasado. La discrepancia entre las fechas de radiocarbono y calibradas no excede ±150 años para el intervalo entre 1950 d.C. y 500 a.C. Para épocas más antiguas, esta discrepancia aumenta y, con una edad de radiocarbono de 6.000 años, alcanza los 800 años. ver también ARQUEOLOGÍA

Naturaleza, 1992, núm. 12, págs. 59-65.
Carbono radiactivo
I.Ya.Vasilenko, V.A.Osipov, V.P.Rublevsky
© Vasilenko I.Ya., Osipov V.A., Rublevsky V.P. Carbono radiactivo.
Ivan Yakovlevich Vasilenko, Doctor en Ciencias Médicas, profesor, premio estatal de la URSS, investigador destacado del Instituto de Biofísica del Ministerio de Salud de la Federación de Rusia. Área de intereses científicos: toxicología de productos de fisión nuclear, higiene radiológica.
Vyacheslav Aleksandrovich Osipov, candidato de ciencias médicas, investigador principal del mismo instituto, especialista en toxicología. Estudia la cinética del metabolismo y la eficacia biológica de los radionucleidos en el cuerpo de los mamíferos.
Vladimir Petrovich Rublevsky, candidato de ciencias técnicas, investigador principal del mismo instituto. Los principales intereses científicos están relacionados con la ecología, la protección del medio ambiente y la seguridad radiológica de la energía nuclear.
DE TODOS los elementos naturales de la tabla periódica, el carbono desempeña un papel especial: forma la base estructural de los compuestos orgánicos, incluidos los que forman parte de los organismos vivos.
El carbono natural es una mezcla de dos isótopos estables: 12 C (98,892%) y 13 C (1,108%). De los cuatro isótopos radiactivos (10 C, 11 C, 14 C y 15 C), sólo el carbono 14 de larga vida (vida media 5730 años) tiene interés práctico, ya que participa en el ciclo del carbono de la biosfera. Este emisor beta limpio y de baja energía con una energía máxima de partícula de 156 keV está clasificado como un radionucleido global. Se forma tanto en condiciones naturales como artificiales como resultado de varias reacciones nucleares. El aumento de la concentración de 14 C antropogénico en el medio ambiente (y sus fuentes son las explosiones nucleares y las emisiones de las centrales nucleares) representa un importante problema higiénico y medioambiental.
FUENTES DE RADIOCARBONO
El nucleido natural se forma principalmente por la interacción de neutrones secundarios de la radiación cósmica con núcleos de nitrógeno en las capas superiores de la atmósfera según la reacción 14 N (n, p) 14 C. El papel de otras reacciones es 15 N (n, a) 14ºC; 16O(p,Zr)14C; 17O (n,a) 14C; 13 C (n.у) 14 C - en la formación del carbono-14 natural es insignificante debido a las pequeñas secciones transversales de interacción y al bajo contenido de los núcleos de estos isótopos en la mezcla natural de elementos.
La tasa media de formación de este nucleido en la atmósfera (principalmente en la estratosfera) es de 2,28 átomos/s por 1 cm2 de la superficie terrestre, lo que equivale a 9,7 x 10\23 átomos/día. En masa es de aproximadamente 22,5 g/día y en actividad es de aproximadamente 2,8 TBq/día o 1 PBq/año. El contenido medio de nucleidos naturales en la atmósfera y la biosfera se mantiene constante: 227 ± 1 Bq/kg de carbono.
El carbono 14 antrohigeo se forma principalmente como el carbono natural, es decir, Los neutrones (producidos en grandes cantidades durante la explosión de bombas nucleares) son absorbidos por los núcleos de nitrógeno-14. La cantidad de nucleido depende del tipo de bomba (atómica o termonuclear), su diseño (materiales utilizados) y su potencia (densidad de flujo de neutrones). El rendimiento de 14 C durante las explosiones para la reacción de síntesis se considera de 0,65 PBq/Mt, para la reacción de fisión es casi cinco veces menor (0,12 PBq/Mt). Se estima que se produjeron 249,2 PBq de carbono-14 entre la explosión de la primera bomba atómica en 1945 y 1980 (Tabla 1).
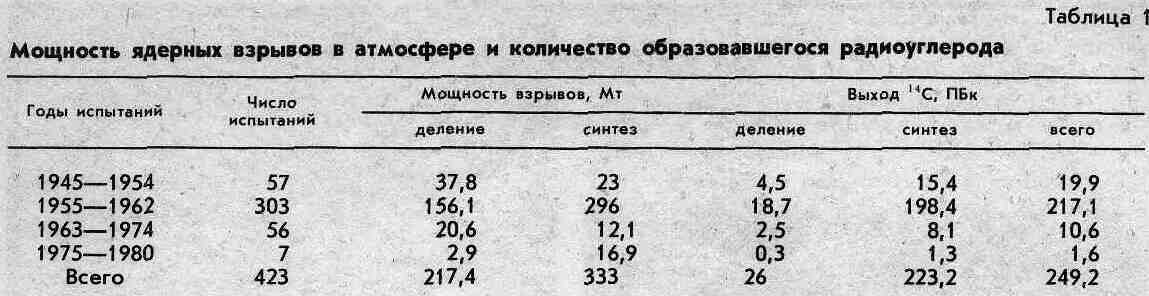
Desde 1981, cesaron los ensayos de armas nucleares en la atmósfera y las empresas del ciclo del combustible nuclear resultaron ser la única fuente poderosa de nucleidos antropogénicos que puede influir significativamente en el aumento de su concentración en la atmósfera y la biosfera de la Tierra. Este nucleido se forma en el núcleo de reactores nucleares de cualquier tipo, donde se producen potentes flujos de neutrones que interactúan con los materiales de las estructuras del reactor, con la sustancia refrigerante, el moderador, el combustible y las impurezas presentes en ellos: 14 N (p, p) 14C; 17 O (n.a) 14 C; 13 C (n.y) 14 C; 235 U (n.f) 14 C (fisión ternaria del uranio-235 en combustible).
Dependiendo del tipo y de las características de diseño del reactor, la contribución de cada una de estas reacciones a la formación del nucleido puede variar de forma muy significativa. Según los cálculos, su rendimiento específico cuando se irradia con neutrones térmicos de determinadas sustancias utilizadas como moderador o refrigerante para la reacción (n,p) en nitrógeno gaseoso y aire es aproximadamente cuatro órdenes de magnitud mayor que para la reacción (n,a). en agua, dióxido de carbono o oxígeno del aire debido a la gran sección transversal para la interacción de los neutrones térmicos con los núcleos de nitrógeno (a = 1750 mbarn) y su alto contenido en el aire (78%). El rendimiento de 14C mediante la reacción (n,y) en grafito, detolilmetano, gasóleo y terfenilo es todavía un orden de magnitud menor que mediante la reacción (n,a).
La tasa de formación de carbono-14 en el combustible depende principalmente de la concentración de impurezas de nitrógeno: en su contenido habitual (0,001-0,002%), la tasa es de aproximadamente 0,4-2,5 TBq/(GW/año), y el agua del El refrigerante moderador contiene entre 0,2 y 0,5 TBq/(GWe/año).
En las centrales nucleares en funcionamiento de la antigua URSS se utilizan principalmente reactores de agua a presión (VVER-440 y VVER-1000), reactores de agua y grafito (RBMK-1000 y RBMK-1500) y reactores de neutrones rápidos (BN-350 y BN-600). . El primer y tercer reactor son similares a los tipos correspondientes de reactores extraños (PWR y PBR) en cuanto a la tasa de generación de 14 C y su liberación al medio ambiente.
Los reactores RBMK con agua hirviendo a presión como refrigerante y grafito como moderador no tienen análogos en la práctica de construcción de reactores en el extranjero. Su característica principal es la presencia de una gran cantidad de nitrógeno en el núcleo, utilizado en mezcla con helio para enfriar el moderador, y una gran masa de carbono en el propio moderador. Esto conduce a una mayor tasa de generación de 14 C hasta un valor de 2-3 TBq/ (GWe/año), que es aproximadamente un orden de magnitud mayor que en los reactores de tipo VVER.
El carbono-14, formado en el refrigerante y el moderador, se libera parcial o totalmente al medio ambiente en forma de aerosoles de gas y a partir del combustible del reactor, con desechos radiactivos de las plantas de procesamiento (regeneración).
MIGRACIÓN EN EL ENTORNO EXTERIOR
El radiocarbono es muy móvil. Desde los lugares de emisión como resultado de procesos atmosféricos, el nucleido se transporta a largas distancias y, al oxidarse a 14 CO2, ingresa al ciclo natural del carbono.
Se sabe que todo el carbono terrestre se concentra en dos cuencas: la "sedimentaria" y la "de intercambio". El carbono de la primera cuenca (carbono orgánico e inorgánico de rocas sedimentarias, carbón, petróleo y otros fósiles) prácticamente no participa en los procesos metabólicos naturales; entra en el ciclo sólo después de la combustión del combustible orgánico; El carbono de la segunda cuenca, que contiene alrededor del 0,17% del total de carbono terrestre, y más del 90% se encuentra en las aguas profundas del Océano Mundial, participa en el ciclo a través de sus reservorios individuales: la atmósfera, la biosfera. , hidrosfera, etc.

Modelo global circulación carbono-14 que ingresa a la atmósfera con emisiones de empresas del ciclo del combustible nuclear (1) y vertidos (2). Los coeficientes de cambio se dan en rel. unidades/año
El ciclo del carbono en la naturaleza consta de dos ciclos que discurren paralelos en las partes terrestre y marina de la biosfera y conectados por la atmósfera. De los muchos modelos que describen el comportamiento del carbono en la cuenca de “intercambio”, SCEAR utiliza para los cálculos el modelo de 8 reservorios, que tiene en cuenta todos los procesos principales que tienen lugar en el ciclo natural del carbono de la Tierra.
La tasa de intercambio de carbono entre los reservorios de la cuenca de "intercambio" es diferente: el tiempo promedio de permanencia de una molécula de CO2 en la atmósfera antes de pasar al agua del océano es de varios años, desde sus profundidades hasta la atmósfera, hasta varios cientos de años. , y desde las rocas sedimentarias hasta la atmósfera incluso varios millones de años. Así, las rocas sedimentarias son como un “cementerio” del radiocarbono (natural y artificial), en el que prácticamente se desintegra y abandona el ciclo natural.
CINÉTICA DE INTERCAMBIO
El carbono-14, oxidado en el ambiente externo a 14 CO2, se acumula en las plantas mediante la fotosíntesis (en pequeñas cantidades también se absorbe del suelo) y luego pasa a través de la cadena alimentaria a los animales y a los humanos. El coeficiente de transición en la cadena "carbono atmosférico - carbono vegetal" es igual a uno y el equilibrio se establece en dos o tres meses. Durante los ensayos intensivos de armas nucleares (1963-1964), el contenido de 14 C en los productos vegetales, la leche y el agua. La carne aumentó aproximadamente dos veces en comparación con el entorno natural. Tenga en cuenta que el período de media purificación de los productos alimenticios es de unos seis años.
El radiocarbono ingresa al cuerpo humano en forma de diversos compuestos orgánicos e inorgánicos, principalmente como parte de carbohidratos, proteínas y grasas. La ingesta aerogénica es insignificante: sólo el 1% de la ingesta de alimentos. Para entender qué efecto tiene en el cuerpo. 14 C, que se presenta en forma de compuestos orgánicos e inorgánicos, estudiamos la cinética del metabolismo en experimentos con ratas. Resultó que el intercambio de compuestos inorgánicos (Ha2 14 CO3, NaH 14 CO3, K2 14 CO3) se caracteriza por una alta intensidad; El radiocarbono se detecta en la sangre de los animales desde los primeros minutos de entrada al organismo, después de 15 minutos. su contenido alcanza un máximo de varios por ciento de la cantidad administrada. Al formar compuestos frágiles de bicarbonato en la sangre, el radiocarbono se elimina rápidamente. Sólo una pequeña parte de la cantidad administrada de nucleido se acumula en órganos y tejidos y se distribuye de manera bastante uniforme: primero en el hígado, los riñones, el bazo y luego en el tejido esquelético y adiposo. Con la ingesta prolongada, la actividad del nucleido se acumula lentamente: del 1,7% el segundo día al 7,7 el día 32 de la cantidad diaria administrada de Na2 14 CO3. Se puede suponer que al final del mes de experimentos se habrá establecido un estado de equilibrio entre la ingesta del nucleido y su contenido en el cuerpo de las ratas, con una relación de acumulación aproximadamente igual a 0,07.
En experimentos que estudiaron el intercambio de 14 C en forma de compuestos orgánicos, utilizamos glucosa, ácido succínico, glicina, valina, triptófano, glicerina, ácidos palmítico y esteárico, alcoholes metílicos y etílicos que contienen nucleidos, es decir, compuestos incluidos en la mayoría. clases importantes: carbohidratos, proteínas, grasas y alcoholes. Al ingresar al cuerpo, los compuestos de alto peso molecular se descomponen en compuestos de bajo peso molecular, cuyo carbono finalmente se oxida a dióxido de carbono. Al mismo tiempo, se sintetizan aminoácidos, ácidos grasos, hexosas y otros metabolitos importantes, que el organismo utiliza como energía y material plástico. Así, el radionúclido penetra en todas las estructuras y tejidos de los organismos vivos.
La dinámica de su acumulación durante la ingesta crónica en forma de compuestos orgánicos depende de la forma del compuesto. El contenido de equilibrio de 14 C-glucosa se produce al final del tercer mes (el factor de acumulación es tres), 14 C-glicina y 14 C-ácido palmítico, al final del cuarto (el factor de acumulación es 12 y 13, respectivamente).
La tasa de eliminación de nucleidos de compuestos orgánicos del cuerpo depende en cierta medida también de su clase: los nucleidos de carbohidratos se eliminan con mayor intensidad que los recibidos en forma de aminoácidos y ácidos grasos, y los introducidos como parte de alcoholes se retienen. más largo que los “carbohidratos”. Con el tiempo, la tasa de eliminación disminuye gradualmente, aparentemente debido al hecho de que el nucleido que ingresa al cuerpo se utiliza como material plástico. El radiocarbono se excreta principalmente a través del sistema respiratorio, y mucho menos a través de los riñones y los intestinos, y la proporción también depende de la forma del compuesto.
Se sabe que los metabolitos finales de los carbohidratos, grasas y alcoholes son dióxido de carbono y agua, y las proteínas también son urea, ácido úrico y creatinina (estas últimas se excretan del organismo a través de los riñones y los intestinos). Parte del nucleido alcohólico se exhala sin cambios.
Utilizamos los resultados de estudios en ratas para evaluar el metabolismo del carbono 14 que ingresa al cuerpo humano con los alimentos. Dado que la dieta estándar de un adulto incluye alrededor de 500 g de carbohidratos, 100 g de grasas y proteínas, y la proporción de carbono en ellos es del 50, 75 y 54%, respectivamente, entonces obtenemos alrededor del 70, 20 y 10% de carbono. por día de los alimentos.

Si tenemos en cuenta que la multiplicidad de acumulación del nucleido suministrado como parte de estos compuestos es igual a 15, 65 y 60, entonces en una dieta estándar será aproximadamente 31. Este valor se acerca a la multiplicidad de acumulación de estable. carbono y nucleidos de origen natural en el hombre. El inicio de un estado de equilibrio estará determinado por el radiocarbono suministrado con grasas y proteínas y, teniendo en cuenta las diferencias en la intensidad del metabolismo en ratas y humanos, podemos esperar que en estos últimos ocurra aproximadamente 1,5 años después de la inicio de la entrada del nucleido al cuerpo.
Así, el intercambio de radiocarbono depende de la forma de su compuesto, lo que incide en los valores de las dosis de radiación interna generada (Tabla 2). Las dosis absorbidas de las sustancias orgánicas que lo contienen desde el momento de su entrada al organismo hasta la formación de los metabolitos finales no son las mismas: debido a diferencias en su metabolismo, pero en promedio son de decenas a cientos de veces mayores que las inorgánicas. Las características metabólicas de varios compuestos de radiocarbono también afectan su toxicidad.
ACCIÓN BIOLÓGICA
El efecto de la radiación, como se sabe, depende de la magnitud de la dosis absorbida, su potencia, el volumen de tejidos y órganos irradiados y el tipo de radiación. El efecto dañino se basa en un complejo de procesos interrelacionados e interdependientes: la ionización y excitación de átomos y moléculas dan lugar a la formación de radicales altamente activos que interactúan con diversas estructuras biológicas de las células. Es importante la transferencia intra e intermolecular de energía de excitación, así como la posible ruptura de enlaces en las moléculas debido a la acción directa de la radiación. Los procesos fisicoquímicos que ocurren en la etapa inicial se consideran primarios y iniciales. Posteriormente, el desarrollo de una lesión por radiación se manifiesta en una disfunción de los órganos y sus sistemas.
De particular peligro son los radionucleidos que, al acumularse en órganos y tejidos, se convierten en una fuente de radiación interna a largo plazo. Su naturaleza depende de las propiedades fisicoquímicas de los radionucleidos, entre ellos, como se señaló, el carbono-14 ocupa un lugar especial, ya que es un isótopo del principal elemento biogénico. Su efecto biológico está asociado no sólo con la radiación, sino también con los efectos de transmutación que surgen cuando 14 átomos de C se convierten en 14 átomos de N como resultado de la desintegración beta. Estos procesos pueden volverse particularmente peligrosos cuando el radiocarbono se incluye en el ADN y el ARN. células germinales, ya que incluso los actos individuales de su descomposición conducen a mutaciones puntuales que el cuerpo no puede eliminar.
Muchos expertos creen que la eficacia biológica del nucleido debería aumentar significativamente debido al efecto de transmutación. Pero los resultados de los experimentos resultaron contradictorios. El valor de la eficacia biológica relativa del 14 C, establecido por diversos investigadores7 en términos de mutaciones genéticas (fagos, levaduras, Drosophila), aberraciones cromosómicas (raíces de cebolla y brotes de soja) y muerte de células reproductivas (cultivos de tejidos y bacterias), oscila entre 1 a 20. Aparentemente, esto se debe a diferentes condiciones experimentales, una variedad de pruebas y condiciones de irradiación. No conocemos ningún material de investigación sobre animales de sangre caliente.
Estudiamos los efectos biológicos de dosis agudas de radiocarbono en ratones utilizando compuestos orgánicos que pueden simular la ingesta del nucleido en proteínas (14 C-glicina), grasas (14 C-ácido esteárico) y ácido 14 C-succínico. un compuesto formado en el cuerpo como resultado de la oxidación de carbohidratos, proteínas y grasas (es decir, todos los alimentos básicos) y sus transformaciones mutuas en las células. El estado de los animales fue evaluado mediante parámetros clínicos, hematológicos, fisiológicos, bioquímicos, inmunológicos y patológicos.
La irradiación de los animales fue prolongada y relativamente uniforme. La diferencia en las dosis absorbidas (se evaluaron mediante estudios radiométricos especiales) en órganos y tejidos, con excepción de la grasa, cuyas dosis de radiación eran aproximadamente dos o tres veces mayores que las del tejido promedio, no superó 1,5. Al final del primer mes, las dosis estaban aproximadamente completas en un 50%, y dentro de tres a seis meses (dependiendo del compuesto), en un 90%. Las características observadas de la irradiación son de fundamental importancia para evaluar la eficacia biológica del radiocarbono, que se caracteriza por una radiotoxicidad relativamente baja, determinada por la forma del compuesto. Para la glicina, la dosis que provoca la muerte del 50% de los animales en 30 días (DE 50/30) es de 6,3 MBq/g de peso corporal. Cuando murió el 50% de los ratones (esperanza de vida promedio de 17,5 ± ± 1,5 días), la dosis tisular promedio era de 8 a 1 Gy a una velocidad de 0,08 a 0,02 cGy/min. Las lesiones graves por radiación en ratones con desenlace fatal durante el primer mes con la introducción de ácido 14 C-esteárico (2,2 MBq/g) se deben al hecho de que se forman dosis más altas de radiación interna por unidad de actividad administrada.
Con base en los resultados de los estudios del efecto biológico de la 14 C-glicina, teniendo en cuenta las características del metabolismo y los valores generados de las dosis absorbidas por unidad de actividad administrada, evaluamos la toxicidad de otros compuestos de radiocarbono. Resultó que la toxicidad del 14 C-carbonato y del bicarbonato de sodio es 130 veces menor que la del 14 C-glicina, el 14 C-potasio y los carbonatos de calcio: 85 y 30 veces, respectivamente, 14 C-glucosa, 14 C-glucosamina y 14 Ácido C-succínico - aproximadamente cuatro veces, 14 C-valina, 14 C-alcohol etílico y 14 C-metílico - casi igual a la toxicidad de 14 C-glicina, 14 C-triptófano y 14 C-ácido palmítico - alrededor de cuatro a cinco veces mayor. Teniendo en cuenta el contenido de hidratos de carbono, proteínas y grasas en la dieta diaria de los ratones, calculamos que la dosis de nucleido que provoca la muerte del 50% de los animales en 30 días es aproximadamente igual a 15 MBq/g de peso corporal.

Contenido de radiocarbono en el cuerpo de ratas después de una sola administración en forma de: 14 C-bicarbonato de sodio (1), 14 C-carbonato de sodio (2), potasio (3); y calcio (4); 14 C-ácido succínico (5), 14 C-glucosamina (6), 14 C-glucosa (7), 14 C-alcoholes etílicos (8) y metílicos (9), 14 C-valina (10), 14 C- glicerol (11), 14 C-ácido esteárico (12), 14 C-glicina (13), 14 C-triptófano (14) y 14 C-ácido palmítico (15).
En el curso clínico de las lesiones agudas por nucleidos suministrados con los alimentos, no hubo diferencias significativas con la enfermedad por radiación causada por irradiación gamma externa. También se distinguieron períodos bien conocidos: manifestaciones latentes y pronunciadas de la enfermedad y recuperación (recuperación o transición de la enfermedad); enfermedad a una forma crónica). Los cambios en los parámetros sanguíneos, por los cuales generalmente se juzga la gravedad de la enfermedad, eran típicos, los trastornos metabólicos se manifestaban en la obesidad de los animales y se registraba claramente el efecto blastomogénico (productor de tumores) del nucleido. Con daño agudo, perdieron peso drásticamente y murieron en un contexto de leucopenia profunda (bajo contenido de leucocitos en la sangre periférica). Las lesiones graves y moderadas se volvieron crónicas y los recuentos sanguíneos se recuperaron lentamente. La recuperación llevó muchísimo tiempo. La esperanza de vida (dependiendo de la gravedad de la lesión) fue significativamente menor que la de los ratones de control.
El concepto de acción sin umbral de las radiaciones ionizantes planteó el problema de las dosis bajas. El peligro de las dosis al nivel de la radiación natural se asocia principalmente con la inducción de mutaciones (su número está determinado por la magnitud de la dosis absorbida) en somáticos: » células sexuales. Las mutaciones en las células somáticas conducen al crecimiento de neoplasias malignas y otros trastornos, en las células reproductivas, a una disminución de la función reproductiva, una desviación del desarrollo normal y enfermedades hereditarias. Cuando se exponen a pequeñas dosis, es posible que se produzcan trastornos de desarrollo lento con una amplia variación individual, dependiendo del estado inicial del cuerpo y sus características hereditarias.
Estudiamos el efecto biológico de pequeñas dosis de carbono-14 en condiciones de ingesta crónica en experimentos con ratas. Los animales de ocho grupos lo recibieron diariamente con agua de bebida en forma de 14C-glucosa durante toda su vida en una cantidad de 92,5; 18,3; 13; 1,9; 1.3; 0,2; 0,1 y 0,01 kBq/g de peso corporal. Las dosis promedio absorbidas por el tejido fueron respectivamente 233; 47; 11,5; 1; 0,5; 0,1 y 0,01 mGy por año. El estado de las ratas se evaluó mediante parámetros clínicos, hematológicos, fisiológicos, bioquímicos, inmunológicos y morfológicos.
En el período inicial, el estado de los animales de experimentación y de control no difirió significativamente, pero posteriormente se revelaron cambios funcionales que pueden evaluarse como una reacción a la irradiación. Y al final de los experimentos (principalmente en los primeros tres grupos), se descubrió patología morfológica en los pulmones, riñones e hígado y disminuyó la función reproductiva. Aparentemente, en el período inicial el cuerpo logra compensar las violaciones, pero luego, a medida que se acumula el daño por radiación, lo afecta la insuficiencia de los mecanismos de reparación y las reacciones adaptativas. Como resultado, se reduce la resistencia del cuerpo a otros factores ambientales adversos y la esperanza de vida.
El estado de las ratas irradiadas con dosis más bajas (grupos cuatro a ocho) se mantuvo sin cambios significativos durante todo el experimento, aunque hubo una tendencia a la aparición más temprana de tumores de glándula mamaria en comparación con los animales de control. Sin embargo, las diferencias cuantitativas resultaron ser estadísticamente insignificantes.

Estudiamos los efectos genéticos del radiocarbono (junto con empleados del Instituto de Genética General de la Academia de Ciencias de Rusia V.A. Shevchenko, M.D. Pomerantseva y L.K. Ramaya) en diferentes etapas de la espermatogénesis en ratones con administración única, prolongada y crónica de 14 C-glucosa para los machos. Tres meses después de una única inyección del nucleido, la dosis de radiación fue de 0,22; 0,5; y 1,01 Gy, a largo plazo - 0,74 y 1,47 (al final del experimento) y crónico - 0,066 y 0,013 Gy/año.
Comparamos la frecuencia de mutaciones letales dominantes en las células germinales post y premeióticas, la frecuencia de translocaciones recíprocas (intercambio de dos secciones entre cromosomas homólogos) en las espermatogonias y la frecuencia de cabezas de esperma anormales con los mismos indicadores bajo la influencia de factores externos. radiación gamma. Resultó que la eficiencia genética relativa del radiocarbono es de aproximadamente 1-2 y no se detectan las consecuencias de la transmutación; aparentemente, la 14 C-glucosa no penetra en el ADN de las células germinales. Nuestras conclusiones difícilmente deben considerarse definitivas; el efecto de la radiación en un organismo vivo requiere muchos estudios especiales.
Así, tenemos algunos resultados experimentales sobre los efectos de diferentes dosis de radiocarbono en animales. ¿Es posible con base en esto estimar las consecuencias somáticas y genéticas en la población humana a medida que aumenta la concentración del nucleido? Intentamos hacer esto (Tabla 3), teniendo en cuenta que con la actual contaminación global del medio ambiente por radiocarbono, se establece un equilibrio en la cadena “atmósfera - alimentos - personas” con un coeficiente de discriminación en toda la cadena igual a 1;
se han detenido los ensayos nucleares en la atmósfera;
existe una relación dosis/efecto lineal sin umbral.
Con una eficiencia genética del nucleido igual a 1 (sin transmutaciones), podemos esperar que el número de enfermedades oncogénicas mortales en una población de 10 6 personas y entre 10 6 recién nacidos con irradiación a una dosis de 10 6 Gy-persona sea 124 y 40 casos, respectivamente. A modo de comparación, observamos: la mortalidad por neoplasias de diversas etiologías y localizaciones (sin tener en cuenta los efectos de las radiaciones ionizantes) alcanza entre 1.500 y 2.000 casos por año en la misma población de personas, y la frecuencia natural de trastornos genéticos es de 60.000 casos. por cada 10 millones de niños, con 16 mil - defectos graves.
Entonces, todos los representantes del mundo vegetal y animal están expuestos a los efectos del radionucleido global: el carbono-14. Es posible que en los ecosistemas haya objetos menos estables que los humanos, por lo que un aumento en la concentración de radiocarbono en el ambiente externo representa no solo un problema higiénico, sino también ambiental... La ausencia de una carga genética obvia como resultado La irradiación con radiocarbono natural aparentemente está asociada con la producción durante la evolución de mecanismos protectores que eliminan el daño mutacional en diferentes etapas de desarrollo de los organismos. Pero con dosis de radiación cada vez mayores, estos mecanismos pueden no ser lo suficientemente eficaces.
1. Bylkin B.K., Rublevsky V.P., Khrulev A.A., Tishchenko V.A. // Átomo. equipos en el extranjero. 1988. No. 1. P. 17-20. 2. Rublevsky V. P., Golenetsky S. P., K i r d i n G. S. Carbono radiactivo en la biosfera. M., 1979.
3. Bolin B. Ciclo del carbono // Biosfera. M., 1982. S. 91--104.
4. Broeker W. S., WaHon A.//Ciencia. 1959. V. 130. N 3371. P. 309-314.
5. Vasilenko I. Ya., Bugryshee P. F., Istomina A. G., Turova V. I. // Diario. higiene, epidemiología, microbiología e inmunología (Praga). 1982. Edición. 26. No. 1. P. 18-27.
6. Vasilenko I. Ya., O s i 11 o in V. A., L i g i n s k a ya A. M. et al. Cinética metabólica y efectos biológicos del carbono radiactivo (^ C). Preimpresión TsNIIatominform-ON-4-88. M., 1988. págs. 28-29.
7. Ver, por ejemplo; Kuzin A. M., Isaev B. M., Khvostov B. M. et al. Eficiencia de la acción biológica de IgC cuando se incluye en estructuras vivas // Radiation Genetics. M., 1962. P.267-273; Kuzin A. M., Glembotsky Ya., L v p k i n Yu.//Radiobiología. 1964. T. 4. No. 6. P. 804-809; Aleksandrov S.N., P sobre p sobre en D.K., Strelnikova N.K.//Higiene y saneamiento. 1971. No. 3. P. 63-66; Apelgot S. Efecto lеtal de la dеsintеgration d "átomos radioacfivs [ "H, "C, "Pi incorpora dons Lactous//Efectos biológicos de la transmutación y desintegración de los radioiiotops incorporados. Viena, 1968. P. 147-163.
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0