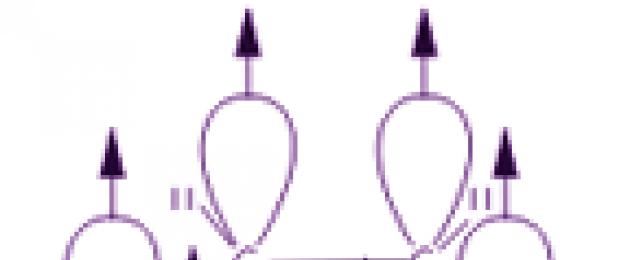
El concepto de "anillo de benceno" requiere decodificación inmediata. Para hacer esto, es necesario considerar al menos brevemente la estructura de la molécula de benceno. La primera estructura del benceno fue propuesta en 1865 por el científico alemán A. Kekule:
Los hidrocarburos aromáticos más importantes incluyen el benceno C 6 H 6 y sus homólogos: tolueno C 6 H 5 CH 3, xileno C 6 H 4 (CH 3) 2, etc.; naftaleno C 10 H 8, antraceno C 14 H 10 y sus derivados.
Los átomos de carbono de la molécula de benceno forman un hexágono plano regular, aunque normalmente se dibuja como uno alargado.
La estructura de la molécula de benceno fue finalmente confirmada por la reacción de su formación a partir de acetileno. La fórmula estructural representa tres enlaces carbono-carbono alternos simples y tres dobles. Pero tal imagen no transmite la verdadera estructura de la molécula. En realidad, los enlaces carbono-carbono del benceno son equivalentes y tienen propiedades diferentes a las de los enlaces simples o dobles. Estas características se explican por la estructura electrónica de la molécula de benceno.
Estructura electrónica del benceno.
Cada átomo de carbono de una molécula de benceno se encuentra en un estado de hibridación sp 2. Está conectado a dos átomos de carbono vecinos y a un átomo de hidrógeno mediante tres enlaces σ. El resultado es un hexágono plano: los seis átomos de carbono y todos los enlaces σ C-C y C-H se encuentran en el mismo plano. La nube de electrones del cuarto electrón (electrón p), que no participa en la hibridación, tiene forma de mancuerna y está orientada perpendicular al plano del anillo de benceno. Estas nubes de electrones p de átomos de carbono vecinos se superponen por encima y por debajo del plano del anillo.

Como resultado, seis electrones p forman una nube de electrones común y un enlace químico único para todos los átomos de carbono. Dos regiones del plano grande de los electrones están ubicadas a cada lado del plano del enlace σ.

La nube de electrones p provoca una reducción en la distancia entre los átomos de carbono. En una molécula de benceno son iguales e iguales a 0,14 nm. En el caso de un enlace simple y doble, estas distancias serían de 0,154 y 0,134 nm, respectivamente. Esto significa que no hay enlaces simples ni dobles en la molécula de benceno. La molécula de benceno es un ciclo estable de seis miembros de grupos CH idénticos que se encuentran en el mismo plano. Todos los enlaces entre los átomos de carbono del benceno son equivalentes, lo que determina las propiedades características del anillo de benceno. Esto se refleja con mayor precisión en la fórmula estructural del benceno en forma de un hexágono regular con un círculo en su interior (I). (El círculo simboliza la equivalencia de enlaces entre átomos de carbono). Sin embargo, también se utiliza a menudo la fórmula de Kekulé que indica dobles enlaces (II):

El anillo de benceno tiene un cierto conjunto de propiedades, que comúnmente se denomina aromaticidad.
Series homólogas, isomería, nomenclatura.
Convencionalmente, las arenas se pueden dividir en dos filas. El primero incluye derivados del benceno (por ejemplo, tolueno o bifenilo), el segundo incluye arenos condensados (polinucleares) (el más simple de ellos es el naftaleno):

La serie homóloga del benceno tiene la fórmula general C n H 2 n -6. Los homólogos pueden considerarse derivados del benceno en los que uno o más átomos de hidrógeno son reemplazados por varios radicales hidrocarbonados. Por ejemplo, C 6 H 5 -CH 3 - metilbenceno o tolueno, C 6 H 4 (CH 3) 2 - dimetilbenceno o xileno, C 6 H 5 -C 2 H 5 - etilbenceno, etc.

Como todos los átomos de carbono del benceno son equivalentes, su primer homólogo, el tolueno, no tiene isómeros. El segundo homólogo, el dimetilbenceno, tiene tres isómeros que se diferencian en la disposición relativa de los grupos metilo (sustituyentes). Se trata de un isómero orto (abreviado o-) o 1,2, en el que los sustituyentes se encuentran en átomos de carbono vecinos. Si los sustituyentes están separados por un átomo de carbono, entonces es un meta- (abreviado m-) o 1,3-isómero, y si están separados por dos átomos de carbono, entonces es un para- (abreviado p-) o 1,4-isómero. En los nombres, los sustituyentes se designan con letras (o-, m-, p-) o números.

Propiedades físicas
Los primeros miembros de la serie homóloga del benceno son líquidos incoloros con un olor específico. Su densidad es inferior a 1 (más ligera que el agua). Insoluble en agua. El benceno y sus homólogos son en sí mismos buenos disolventes para muchas sustancias orgánicas. Las arenas arden con una llama humeante debido al alto contenido de carbono en sus moléculas.
Propiedades químicas
La aromaticidad determina las propiedades químicas del benceno y sus homólogos. El sistema π de seis electrones es más estable que los enlaces π ordinarios de dos electrones. Por tanto, las reacciones de adición son menos comunes para los hidrocarburos aromáticos que para los hidrocarburos insaturados. Las reacciones más características de los arenos son las reacciones de sustitución. Así, los hidrocarburos aromáticos, en sus propiedades químicas, ocupan una posición intermedia entre los hidrocarburos saturados e insaturados.
I. Reacciones de sustitución
1. Halogenación (con Cl 2, Br 2)

2. Nitración

3. Sulfonación

4. Alquilación (se forman homólogos de benceno) - Reacciones de Friedel-Crafts

La alquilación del benceno también ocurre cuando reacciona con alquenos:

El estireno (vinilbenceno) se obtiene por deshidrogenación del etilbenceno:

II. Reacciones de suma
1. Hidrogenación

2. cloración

III. Reacciones de oxidación
1. Combustión
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Oxidación bajo la influencia de KMnO 4, K 2 Cr 2 O 7, HNO 3, etc.
No se produce ninguna reacción química (similar a los alcanos).
Propiedades de los homólogos de benceno.
En los homólogos del benceno, se distinguen un núcleo y una cadena lateral (radicales alquilo). Las propiedades químicas de los radicales alquilo son similares a las de los alcanos; la influencia del anillo de benceno sobre ellos se manifiesta en el hecho de que las reacciones de sustitución siempre involucran átomos de hidrógeno en el átomo de carbono directamente unido al anillo de benceno, así como en la oxidación más fácil de los enlaces C-H.

El efecto de un radical alquilo donador de electrones (por ejemplo, -CH 3) sobre el anillo de benceno se manifiesta en un aumento de las cargas negativas efectivas de los átomos de carbono en las posiciones orto y para; como resultado, se facilita la sustitución de los átomos de hidrógeno asociados. Por tanto, los homólogos del benceno pueden formar productos trisustituidos (y el benceno suele formar derivados monosustituidos).
TEMA 20. Hidrocarburos aromáticos de la serie del benceno.
Series homólogas. Formula general. Nomenclatura. Isomería.
Fuentes naturales y métodos de producción: a partir de compuestos alifáticos, alicíclicos y aromáticos. Reacciones de Wurtz-Fittig y Friedel-Crafts.
Propiedades físicas del benceno y sus homólogos.
Propiedades químicas. Reacciones de sustitución electrófila: halogenación, nitración, sulfonación, alquilación y acilación. Reacciones de adición de hidrógeno, halógenos, ozono. Oxidación del benceno. Reacciones de homólogos de benceno que involucran la cadena lateral: halogenación, nitración, oxidación, deshidrogenación.
Series homólogas. Formula general.
El primer y más importante representante de los hidrocarburos aromáticos monocíclicos (arenos) es benceno C6H6.
De ahí el nombre común de la serie homóloga de hidrocarburos aromáticos: Serie del benceno.
Formula general Serie homóloga del benceno: S p N 2p-6.
Nomenclatura de arenas.
A menudo se utilizan nombres triviales para nombrar arenas: benceno, tolueno, estireno, cumeno, etc.
Según la nomenclatura internacional de sustitución Los arenos se consideran derivados del benceno, en los que la posición de los sustituyentes se indica mediante números, mientras que el número de átomos de carbono en los que se encuentran los sustituyentes debe ser el más pequeño:
metilbenceno etilbenceno isopropilbenceno
(tolueno)(cumeno)

vinilbenceno etinilbenceno
(estireno) (fenilacetileno)
En el caso de dos sustituyentes idénticos, en lugar de números, se pueden utilizar prefijos: 1,2- (orto-), 1,3- (meta-), 1,4- (para-):

1,2-dimetilbenceno 1,3-dimetilbenceno 1,4-dimetilbenceno
(orto-xileno) (meta-xileno) (para-xileno)
Benceno como representante de arenos. La estructura de la molécula de benceno. Conjugación del enlace pi. Isomería y nomenclatura de arenos. Homólogos del benceno. Preparación de arenos, sus propiedades físicas.
A RENES (hidrocarburos aromáticos)
- Los arenos o hidrocarburos aromáticos son compuestos cuyas moléculas contienen grupos de átomos cíclicos estables (núcleos de benceno) con un sistema cerrado de enlaces conjugados.
Los representantes más simples (arenas de un solo núcleo):
Arenas multinúcleo: naftaleno C10H8, antraceno C 14 N 10 y etc.El término "compuestos aromáticos" surgió hace mucho tiempo debido a que algunos representantes de esta serie de sustancias tienen un olor agradable. Sin embargo, hoy en día el concepto de “aromaticidad” tiene un significado completamente diferente.La aromaticidad de una molécula significa su mayor estabilidad, debido a la deslocalización de los electrones π en el sistema cíclico.Criterios de aromaticidad del areno:
- Los átomos de carbono en el estado hibridado sp 2 forman un sistema cíclico.
- Los átomos de carbono están situados en el mismo plano (el ciclo tiene una estructura plana).
- Un sistema cerrado de conexiones conjugadas contiene
- 4n+2 electrones π ( norte– número entero).
La molécula de benceno cumple plenamente estos criterios. C6H6.
1. Estructura del benceno
Benceno C6H6– el antepasado de los hidrocarburos aromáticos.
Cada uno de los seis átomos de carbono de su molécula se encuentra en un estado de hibridación sp 2 y está conectado a dos átomos de carbono vecinos y a un átomo de hidrógeno mediante tres enlaces σ. Los ángulos de enlace entre cada par de enlaces π son 120°. Por tanto, el esqueleto de los enlaces σ es un hexágono regular en el que todos los átomos de carbono y todos los enlaces σ C – C y C – H se encuentran en el mismo plano:
Los electrones p de todos los átomos de carbono interactúan entre sí mediante la superposición lateral de los 2p-AO vecinos ubicados perpendiculares al plano del esqueleto σ del anillo de benceno. Forman una única nube cíclica de electrones π concentrada por encima y por debajo del plano del anillo.
Todos los enlaces C-C del benceno son equivalentes, su longitud es de 0,140 nm, lo que corresponde a un valor intermedio entre la longitud de un enlace simple (0,154 nm) y un doble enlace (0,134 nm). Esto significa que en la molécula de benceno no existen enlaces puramente simples y dobles entre los átomos de carbono (como en la fórmula propuesta en 1865 por el químico alemán F. Kekule), y todos están alineados (deslocalizados, ver animación). Por lo tanto, la fórmula estructural del benceno se representa como un hexágono regular (σ-esqueleto) y un círculo dentro de él, que indica enlaces π deslocalizados:
La fórmula de Kekule también se utiliza a menudo, pero se tiene en cuenta que sólo transmite condicionalmente la estructura de la molécula.
2. Homólogos del benceno. Nomenclatura e isomería
Los homólogos de benceno son compuestos formados al reemplazar uno o más átomos de hidrógeno en una molécula de benceno con radicales hidrocarbonados (R):
Fórmula general de la serie homóloga del benceno.CnH2n-6(n ≥ 6).
Nomenclatura. Se utilizan mucho nombres triviales (tolueno, xileno, cumeno, etc.). Los nombres sistemáticos se construyen a partir del nombre del radical hidrocarbonado (prefijo) y la palabra benceno(raíz):
C6H5-CH3 C6H5-C2H5C6H5-C3H7
Metilbenceno (tolueno) etilbencina propilbenceno
Si hay dos o más radicales, su posición está indicada por el número de átomos de carbono en el anillo al que están unidos. La numeración del anillo se realiza de forma que el número de radicales sea el menor. Por ejemplo:
Para bencenos disustituidos RC 6 H 4 -R También se utiliza otro método para construir nombres, en el que la posición de los sustituyentes se indica antes del nombre trivial del compuesto con prefijos:
orto- (oh-) sustituyentes en los átomos de carbono vecinos del anillo, es decir 1,2-;
meta- (metro-) sustituyentes a través de un átomo de carbono (1,3-);
par- (PAG-) sustituyentes en lados opuestos del anillo (1,4-).
Los radicales monovalentes aromáticos tienen el nombre común " arilo". De ellos, dos son los más habituales en la nomenclatura de compuestos orgánicos: C6H5- (fenilo) Y C6H5CH2- (bencilo).
Isomería(estructural):
1) cargos de diputados Para di-, tres- Y tetra-bencenos sustituidos (por ejemplo, oh-, metro- Y PAG-xilenos);
2) esqueleto de carbono en la cadena lateral que contiene al menos 3 átomos de carbono:
3) isomería de sustituyentes R, comenzando con R - C 2 H 5.
Por ejemplo, la fórmula molecular C8H10 Corresponden 4 isómeros:
tres xilenos CH3-C6H4-CH3 (o-, m-, p-) y etilbenceno C6H5-C2H5.
No existe isomería espacial con respecto al anillo de benceno en los alquilbencenos.
Preparación de hidrocarburos aromáticos.
Las principales fuentes naturales de hidrocarburos aromáticos son carbón y petróleo.
Las reacciones para la producción de arenos indican la relación entre diferentes grupos de hidrocarburos y la posibilidad de su conversión entre sí.
Arenos o aromáticos Los hidrocarburos (bencenoides) son compuestos cuyas moléculas contienen grupos cíclicos estables de átomos (anillos de benceno) con un sistema cerrado de enlaces conjugados.
El carácter aromático de los arenos se explica por la estructura electrónica del anillo de benceno.
Criterios de aromaticidad. A partir del estudio de sistemas conjugados cíclicos, se ha establecido que un compuesto es aromático si obedece La regla de Hückel: La mayor estabilidad termodinámica (aromaticidad) la poseen solo los sistemas conjugados monocíclicos (polienos) que tienen una estructura plana y contienen 4n + 2 electrones en una cadena de conjugación cerrada (donde n es un número entero: 0, 1, 2, 3, etc.) d). Los anillos que contienen electrones 4n son antiaromáticos (desestabilizados).
Condiciones de aromaticidad La molécula de benceno C 6 H 6 corresponde completamente, en cuyo sistema de conjugación están involucrados 6 electrones , un sexteto aromático (según la fórmula 4n + 2 con n = 1). Los anillos aromáticos son mucho más estables que sus análogos acíclicos conjugados con el mismo número de electrones π, es decir el benceno es más estable que CH 2 =CH–CH=CH–CH=CH 2 (hexatrieno-1,3,5).
Nomenclatura. Se utilizan mucho nombres triviales (tolueno, xileno, cumeno, etc.). Los nombres sistemáticos de los homólogos del benceno se construyen a partir del nombre del radical hidrocarbonado (prefijo) y la palabra benceno (raíz): C 6 H 5 - CH 3 - metilbenceno (tolueno), C 6 H 5 - C 2 H 5 - etilbenceno, C 6 H 5 - CH (CH 3) 2 – isopropilbenceno (cumeno). Si hay dos o más radicales, su posición está indicada por el número de átomos de carbono en el anillo al que están asociados. La numeración del anillo se realiza de forma que el número de radicales sea el menor.
Para los bencenos disustituidos RC 6 H 4 R, también se utiliza otro método para construir nombres, en el que la posición de los sustituyentes se indica antes del nombre trivial del compuesto con prefijos: sustituyentes orto-(o-) en el carbono vecino átomos del anillo, es decir en la posición 1,2-; sustituyentes meta-(m-) a través de un átomo de carbono (1,3-); sustituyentes para- (p-) en lados opuestos (1,4-).
Isomería. En la serie de homólogos de benceno, aparece la isomería estructural: 1) posiciones de sustituyentes de bencenos di-, tri- y tetra-sustituidos (por ejemplo, o-, m- y p-xilenos); 2) un esqueleto de carbono en una cadena lateral que contiene al menos 3 átomos de carbono (C 6 H 5 -CH 2 CH 2 CH 3 - n-propilbenceno y C 6 H 5 -CH(CH 3) 2 - isopropilbenceno o cumeno); 3) isomería de los sustituyentes R, comenzando con R = C 2 H 5 (por ejemplo, la fórmula molecular C 8 H 10 corresponde a 4 isómeros: o-, m-, p-xilenos CH 3 -C 6 H 4 -CH 3 y etilbenceno C 6 H 5 -C 2 H 5); 4) isomería entre clases con compuestos insaturados (por ejemplo, la fórmula C 6 H 6 excepto el benceno
tienen compuestos CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2, etc., así como ciclos insaturados). No hay isomería espacial con respecto al anillo de benceno en arenos sustituidos.
Regla de Hückel:
Las moléculas que obedecen la regla de Hückel son aromáticas: un sistema conjugado monocíclico plano que contiene (4n + 2) electrones π (donde n = 0,1,2...) es aromático.
Mecanismo de sustitución electrófila.:
1Etapa 1: formación del complejo p. En este caso, se forma un enlace débil entre la nube de electrones p del anillo de benceno y el reactivo electrófilo con una deficiencia de densidad electrónica mientras se mantiene el sexteto aromático. El reactivo electrófilo suele estar situado perpendicular al plano del anillo a lo largo de su eje de simetría. Esta etapa ocurre rápidamente y no afecta la velocidad de reacción. La existencia del complejo p está demostrada mediante espectroscopia UV...
Etapa 2: formación del complejo b. Esta etapa es lenta y prácticamente irreversible. Se forma un enlace b covalente entre el electrófilo y el átomo de carbono del anillo de benceno, y el átomo de carbono pasa del estado spI al estado spI-valente con la ruptura del sexteto aromático y la formación de un catión ciclohexadienilo (ion bencenio). El catión benceno junto con el contraión forman un compuesto iónico que conduce bien la corriente eléctrica. En el ion benceno, todos los átomos de carbono están ubicados en el mismo plano y los sustituyentes del átomo de carbono hibridado con ysp son perpendiculares a él.
3.ª y 4.ª etapas: formación del segundo complejo p y aromatización. El complejo b se puede convertir en un nuevo complejo p ligeramente estable, que se desprotona bajo la influencia de una base, normalmente un contraión.
Hidrocarburos aromáticos (arenos)- hidrocarburos cuyas moléculas contienen uno o más anillos de benceno. La composición de los arenos con un anillo de benceno corresponde a la fórmula general C. norte h 2n-6 .
En la molécula del areno más simple, el benceno (C 6 H 6), los enlaces forman un único sistema conjugado (aromático) deslocalizado de enlaces.
La estructura de la molécula del areno más simple, el benceno, se puede expresar mediante fórmulas estructurales de varios tipos:
Isómeros y homólogos.
| GRAMO | benceno |
|||||
metilbenceno (tolueno) |
||||||
etilbencina |
1,2-dimetilbenceno ( orto-xileno) |
1,3-dimetilbenceno ( meta-xileno) |
1,4-dimetilbenceno ( par-xileno) |
|||
propilbenceno |
isopropilbenceno |
1,2,4-trimetilbenceno |
1-metil-2-etilbenceno |
1-metil-3-etilbenceno |
1-metil-4-etilbenceno |
|
| isómeros | ||||||
El nombre del derivado de benceno sustituido se basa en la palabra "benceno". Los átomos del anillo de benceno están numerados del sustituyente más alto al más bajo. Ejemplo: 1-metil-2-etilbenceno, no 1-etil-2-metilbenceno. Si los sustituyentes son iguales, la numeración se realiza por el camino más corto. Ejemplo: 1,3-dimetilbenceno, no 1,5-dimetilbenceno.
Consolas orto-, meta-, par-(del griego orthos - recto, meta - después, a través, entre, para - contra, cerca, pasado) en los nombres de sustancias orgánicas (abreviado: O-, metro-, PAG-) se utilizan para indicar las posiciones relativas de dos sustituyentes en un anillo de benceno.
Propiedades físicas del benceno: líquido incoloro, insoluble en agua y de olor peculiar, punto de fusión 5,4 o C, punto de ebullición 80,1 o C, densidad 0,88 g/cm 3 . Los vapores de benceno son venenosos.
Propiedades químicas
El benceno no decolora el agua de bromo ni la solución de permanganato de potasio en condiciones normales.
Conseguir arenas
Problemas y pruebas sobre el tema "Tema 3. "Hidrocarburos aromáticos"."
- Hidrocarburos. Polímeros - Sustancias orgánicas grado 8–9
Lecciones: 7 Asignaciones: 9 Pruebas: 1
- - El hombre en el mundo de las sustancias, los materiales y las reacciones químicas, grados 8-9.
Lecciones: 2 Asignaciones: 6 Pruebas: 1
- Clasificación de sustancias - Clases de sustancias inorgánicas de grado 8-9.
Lecciones: 2 Asignaciones: 9 Pruebas: 1
- Redes cristalinas - Estructura de la materia grado 8–9
Lecciones: 1 Asignaciones: 9 Pruebas: 1
- Composición de soluciones - Soluciones 8–9 grado
Lecciones: 3 Asignaciones: 8 Pruebas: 1
Habiendo estudiado el tema, es necesario: comprender los conceptos de hidrocarburos aromáticos, enlaces aromáticos, conocer la fórmula general de los arenos, reglas de nomenclatura, tipos de reacciones de sustitución (halogenación en presencia de un catalizador, nitración), adición (halogenación a la luz). , hidrogenación).
Compruebe si puede realizar cálculos utilizando ecuaciones de reacción y derivar fórmulas moleculares de sustancias basadas en fracciones de masa de elementos, encontrar el rendimiento del producto de reacción y resolver problemas teniendo en cuenta la fracción de masa de impurezas.
Ejemplo 1. Un hidrocarburo cuya densidad de vapor para el hidrógeno es 15 contiene 80% de carbono. Encuentra su fórmula molecular.
Respuesta: C2H6
Ejemplo 2. A partir de 7,8 g de benceno se obtuvieron 8,61 g de nitrobenceno. Determine el rendimiento del producto de reacción.
Respuesta: 70%
Ejemplo 3. Se trató carburo de calcio técnico que pesaba 20 g con un exceso de agua. ¿Qué volumen de acetileno se obtuvo si la fracción masiva de impurezas en el carburo técnico fue del 20%?
Respuesta: 5,6 litros
Después de asegurarse de dominar todo lo que necesita, proceda a completar las tareas del tema. Le deseamos éxito.
Lectura recomendada:
- O. S. Gabrielyan y otros Química décimo grado. M., Avutarda, 2002;
- L. S. Guzey, R. P. Surovtseva, G. G. Lysova. Química 11º grado. Avutarda, 1999.
- G. G. Lisova. Apuntes y ensayos básicos en química orgánica. M., LLC Glik Plus, 1999.
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0