ANÁLISIS ESPECTRAL(utilizando espectros de emisión) se utiliza en casi todos los sectores de la economía. Ampliamente utilizado en la industria del metal para el análisis rápido de hierro, acero, hierro fundido, así como diversos aceros especiales y productos metálicos acabados, para determinar la pureza de metales ligeros, no ferrosos y preciosos. El análisis espectral se utiliza ampliamente en geoquímica al estudiar la composición de minerales. En la industria química y afines, el análisis espectral se utiliza para determinar la pureza de productos fabricados y usados, para analizar catalizadores, residuos diversos, sedimentos, turbiedades y aguas de lavado; en medicina, por el descubrimiento de metales en diversos tejidos orgánicos. Una serie de problemas especiales que son difíciles de resolver o que no pueden resolverse de ninguna otra manera se resuelven mediante análisis espectral de forma rápida y precisa. Esto incluye, por ejemplo, la distribución de metales en aleaciones, el estudio de sulfuros y otras inclusiones en aleaciones y minerales; A este tipo de investigación a veces se le llama análisis local.
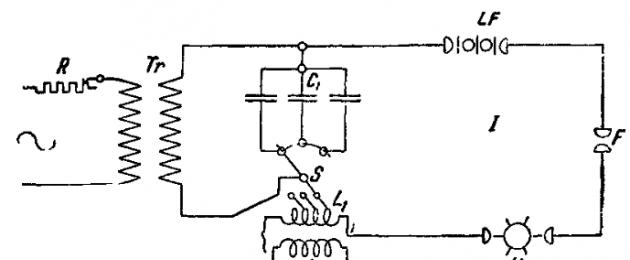
La elección de uno u otro tipo de aparato espectral desde el punto de vista de la suficiencia de su dispersión se realiza en función de la finalidad y objetivos del análisis espectral. Espectrógrafos de cuarzo con mayor dispersión, que dan para longitudes de onda 4000-2200 ɐ una franja de espectro de al menos 22 cm de largo, para otros elementos puede ser Se utilizan aparatos que producen espectros de 7 a 15 cm de longitud, siendo generalmente menos importantes los espectrógrafos con óptica de vidrio. De estos, son convenientes los instrumentos combinados (por ejemplo, de las empresas Hilger y Fuss), que, si se desea, pueden utilizarse como espectroscopio y espectrógrafo. Las siguientes fuentes de energía se utilizan para obtener espectros. 1) Llama de mezcla ardiente- hidrógeno y oxígeno, una mezcla de oxígeno y gas de iluminación, una mezcla de oxígeno y acetileno, o finalmente aire y acetileno. En este último caso, la temperatura de la fuente de luz alcanza los 2500-3000°C. La llama es más adecuada para obtener espectros de metales alcalinos y alcalinotérreos, así como para elementos como Cu, Hg y Tl. 2) Arco voltaico. a) Ordinario, cap. Arr. corriente continua, potencia 5-20 A. Se utiliza con gran éxito para el análisis cualitativo de minerales difíciles de fusionar, que se introducen en el arco en forma de trozos o polvos finamente molidos. Para el análisis cuantitativo de metales, el uso de un arco voltaico convencional tiene un inconveniente muy importante, a saber, que la superficie de los metales analizados se cubre con una película de óxido y la combustión del arco finalmente se vuelve desigual. La temperatura del arco voltaico alcanza los 5000-6000°C. b) Arco intermitente (Abreissbogen) de corriente continua con una potencia de 2-5 A a un voltaje de aproximadamente 80 V. Con la ayuda de un dispositivo especial, el arco se interrumpe de 4 a 10 veces por segundo. Este método de excitación reduce la oxidación de la superficie de los metales analizados. A voltajes más altos (hasta 220 V y una corriente de 1-2 A), también se puede utilizar un arco intermitente para analizar soluciones. 3) Descargas de chispas, obtenido mediante una bobina de inducción o, más frecuentemente, un transformador de corriente continua o (preferiblemente) alterna con una potencia de hasta 1 kW, que proporciona entre 10.000 y 30.000 V en el circuito secundario. Se utilizan tres tipos de descargas: a) Descargas por chispa sin capacitancia ni inductancia en el circuito secundario, llamado a veces con arco de alto voltaje (Hochspannungsbogen). El análisis de líquidos y sales fundidas utilizando este tipo de vertidos es muy sensible. b) Descargas de chispas con capacitancia e inductancia en el circuito secundario, a menudo también llamadas chispas condensadas, representan una fuente de energía más universal, adecuada para excitar los espectros de casi todos los elementos (excepto los metales alcalinos), así como los gases. El diagrama de conexión se muestra en la Fig. 1,

donde R es el reóstato en el circuito primario, Tr es el transformador de corriente alterna, C 1 es la capacitancia en el circuito secundario I, S es el interruptor para cambiar la inductancia L 1, U es el disyuntor síncrono, LF es el parachispas , F es la distancia entre chispas de trabajo. El circuito secundario II se sintoniza en resonancia con el circuito secundario I mediante inductancia y capacitancia variable C 2; un signo de la presencia de resonancia es la intensidad de corriente más alta que muestra el miliamperímetro A. El propósito del circuito secundario II del disyuntor síncrono U y del parachispas LF es hacer que las descargas eléctricas sean lo más uniformes posible tanto en carácter como en número durante un cierto período de tiempo; durante el trabajo normal no se introducen tales dispositivos adicionales.
Al estudiar metales en el circuito secundario, se utiliza una capacitancia de 6000-15000 cm3 y una inductancia de hasta 0,05-0,01 N. Para analizar líquidos, a veces se introduce en el circuito secundario un reóstato de agua con una resistencia de hasta 40000 ohmios. . Los gases se estudian sin inductancia con pequeña capacitancia. c) Descargas de corriente Tesla, que se realizan mediante el circuito que se muestra en la Fig. 2,

donde V es un voltímetro, A es un amperímetro, T es un transformador, C es una capacitancia, T-T es un transformador Tesla, F es la vía de chispas donde se introduce la sustancia analizada. Las corrientes de Tesla se utilizan para estudiar sustancias que tienen un punto de fusión bajo: diversas preparaciones vegetales y orgánicas, depósitos en filtros, etc. En el análisis espectral de metales, en el caso de un gran número de ellos, suelen ser ellos mismos electrodos, y se les da alguna forma, por ejemplo, de las mostradas en las Figs. 3,

donde a es un electrodo hecho del alambre grueso que se analiza, b es de estaño, c es un alambre delgado doblado, d es un disco cortado de una varilla cilíndrica gruesa, e es una forma cortada de grandes piezas de fundición. En el análisis cuantitativo, siempre es necesario tener la misma forma y tamaño de la superficie del electrodo expuesta a las chispas. Si la cantidad de metal que se analiza es pequeña, se puede utilizar un marco hecho de algún metal puro, por ejemplo, oro y platino, en el que se fija el metal analizado, como se muestra en la Fig. 4.
Se han propuesto bastantes métodos para introducir soluciones en una fuente de luz. Cuando se trabaja con llama, se utiliza un atomizador Lundegaard, que se muestra esquemáticamente en la Fig. 5 junto con un quemador especial.

El aire que pasa a través del pulverizador BC captura el líquido de prueba, se vierte en una cantidad de 3 a 10 cm 3 en el hueco C y lo transporta en forma de polvo fino al quemador A, donde se mezcla con el gas. Para introducir soluciones en el arco, así como en la chispa, se utilizan electrodos limpios de carbono o grafito, en uno de los cuales se hace un hueco. Cabe señalar, sin embargo, que es muy difícil cocinar brasas completamente limpias. Los métodos utilizados para la limpieza (hervido alternativo en ácido clorhídrico y fluorhídrico, así como calcinación en atmósfera de hidrógeno a 2500-3000 ° C) no producen carbones libres de impurezas; Ca, Mg, V, Ti, Al permanecen (aunque quedan trazas). ), Fe, Si, B. También se obtienen carbones de pureza satisfactoria calcinándolos al aire mediante corriente eléctrica: se hace pasar una corriente de unos 400 A a través de una varilla de carbón de 5 mm de diámetro y se consigue la fuerte incandescencia en de esta manera (hasta 3.000 °C) es suficiente para que en unos segundos se evapore la mayor parte de las impurezas que contaminan las brasas. También existen métodos para introducir soluciones en una chispa, donde la solución en sí es el electrodo inferior y la chispa salta a su superficie; otro electrodo puede ser cualquier metal puro. Un ejemplo de tal dispositivo se muestra en la Fig. 6 Electrodo líquido Gerlyach.

El hueco en el que se vierte la solución problema se recubre con una lámina de platino o se cubre con una gruesa capa de oro. En la Fig. La figura 7 muestra un aparato de Hitchen, que también sirve para introducir soluciones en una chispa.

Desde el recipiente A, la solución de prueba fluye en una corriente débil a través del tubo B y la boquilla de cuarzo C hacia la esfera de acción de las descargas de chispas. El electrodo inferior, soldado a un tubo de vidrio, se fija al aparato mediante un tubo de goma E. El accesorio C, que se muestra en la Fig. 7 por separado, tiene un corte en un lado para realizar paredes con mortero. D - un recipiente de seguridad de vidrio en el que se hace un orificio redondo para la salida de los rayos ultravioleta. Es más conveniente hacer este recipiente de cuarzo sin agujero. El electrodo superior F, de grafito, carbono o metal, también está equipado con una placa resistente a salpicaduras. Para un "arco de alto voltaje", que calienta fuertemente las sustancias analizadas, Gerlach utiliza electrodos enfriados cuando trabaja con soluciones, como se muestra esquemáticamente en la figura. 8.

Se fija un embudo de vidrio G a un alambre grueso (6 mm de diámetro) mediante un tapón K, en el que se colocan trozos de hielo. En el extremo superior del alambre se fija un electrodo de hierro redondo E con un diámetro de 4 cm y una altura de 4 cm, sobre el cual se coloca una copa de platino P; este último debe poder retirarse fácilmente para su limpieza. También se debe utilizar el electrodo superior. espesa para evitar que se derrita. Al analizar pequeñas cantidades de sustancias (sedimentos en filtros, polvos diversos, etc.), puede utilizar el dispositivo que se muestra en la Fig. 9.
Se hace un bulto con la sustancia de prueba y papel de filtro, humedecido para una mejor conductividad con una solución, por ejemplo, NaCl, colocada en el electrodo inferior, que a veces consiste en cadmio puro, encerrado en un tubo de cuarzo (peor vidrio); El electrodo superior también es de metal puro. Para los mismos análisis cuando se trabaja con corrientes de Tesla, se utiliza un diseño especial de vía de chispa, como se muestra en la Fig. 10 a y b.

En la bisagra redonda K se fija en la posición deseada una placa de aluminio E, sobre la cual se coloca una placa de vidrio G, y sobre esta última, la preparación P sobre papel de filtro F. La preparación se humedece con una solución ácida o salina. Todo este sistema es un pequeño condensador. Para estudiar gases se utilizan recipientes cerrados de vidrio o cuarzo (Fig. 11).

Para el análisis cuantitativo de gases, es conveniente utilizar electrodos de oro o platino, cuyas líneas se pueden utilizar para comparar. Casi todos los dispositivos mencionados anteriormente para introducir sustancias en una chispa y un arco se montan en soportes especiales durante el funcionamiento. Un ejemplo es el trípode Gramont que se muestra en la Fig. 12:

usando el tornillo D, los electrodos se separan y separan simultáneamente; el tornillo E se utiliza para mover el electrodo superior paralelo al banco óptico, y el tornillo C es para la rotación lateral del electrodo inferior; el tornillo B se utiliza para la rotación lateral de toda la parte superior del trípode; finalmente, utilizando el tornillo A, podrás subir o bajar toda la parte superior del trípode; N - soporte para quemadores, vasos, etc. La elección de la fuente de energía para un propósito de investigación particular se puede realizar utilizando la siguiente tabla aproximada.

Analisis cualitativo. En el análisis espectral cualitativo, el descubrimiento de un elemento depende de muchos factores: la naturaleza del elemento que se determina, la fuente de energía, la resolución del aparato espectral y la sensibilidad de las placas fotográficas. En cuanto a la sensibilidad del ensayo, se pueden realizar las siguientes pautas. Cuando se trabaja con descargas de chispas en soluciones, se puede abrir el 10 -9 -10 -3%, y en metales el 10 -2 -10 -4% del elemento en estudio; cuando se trabaja con arco voltaico, los límites de apertura son de aproximadamente 10 -3%. La cantidad absoluta que puede ser abierto cuando se trabaja con llama, es de 10 -4 -10 -7 gy con descargas de chispa 10 -6 -10 -8 g del elemento en estudio. La mayor sensibilidad de descubrimiento se aplica a los metales y metaloides: B, P, C; menor sensibilidad a los metaloides As, Se y Te; Los halógenos, así como S, O, N en sus compuestos, no se pueden utilizar en absoluto. abierto y m.b. descubierto sólo en algunos casos en mezclas de gases.
Para el análisis cualitativo, las "últimas líneas" son de gran importancia, y en el análisis la tarea es determinar con mayor precisión las longitudes de onda de las líneas espectrales. En los estudios visuales, las longitudes de onda se miden a lo largo del tambor del espectrómetro; estas mediciones pueden considerarse sólo aproximadas, ya que la precisión suele ser ±(2-З)ɐ y en las tablas de Kaiser este intervalo de error puede corresponder a unas 10 líneas espectrales pertenecientes a diferentes elementos para λ 6000 y 5000ɐ y a unas 20 líneas espectrales para λ ≈ 4000 . La longitud de onda se determina con mucha más precisión mediante análisis espectrográfico. En este caso, en los espectrogramas, utilizando un microscopio de medición, se mide la distancia entre líneas con una longitud de onda conocida y una determinada; Para encontrar la longitud de onda de este último se utiliza la fórmula de Hartmann. La precisión de tales mediciones cuando se trabaja con un instrumento que produce una franja espectral de unos 20 cm de largo es de ± 0,5 ɐ para λ ≈ 4000 ɐ, ± 0,2 ɐ para λ ≈ 3000 ɐ y ± 0,1 ɐ para λ ≈ 2500 ɐ. El elemento correspondiente se encuentra en las tablas según la longitud de onda. La distancia entre líneas durante el trabajo normal se mide con una precisión de 0,05-0,01 mm. Esta técnica a veces se combina convenientemente con la captura de espectros con los llamados obturadores Hartmann, dos tipos de los cuales se muestran en la Fig. 13, ayb; Con su ayuda, la rendija del espectrógrafo se puede fabricar a diferentes alturas. Higo. 13c representa esquemáticamente el caso del análisis cualitativo de la sustancia X: la identificación de los elementos A y B en ella. Los espectros de la FIG. 13, d muestran que en la sustancia Y, además del elemento A, cuyas líneas se designan con la letra G, hay una impureza, cuyas líneas se designan con z. Con esta técnica, en casos sencillos, se puede realizar un análisis cualitativo sin recurrir a la medición de distancias entre líneas.

Análisis cuantitativo. Para el análisis espectral cuantitativo, las líneas que tienen la mayor sensibilidad posible a la concentración dI/dK son de gran importancia, donde I es la intensidad de la línea y K es la concentración del elemento que la proporciona. Cuanto mayor sea la sensibilidad a la concentración, más preciso será el análisis. Con el tiempo, se han desarrollado varios métodos para el análisis espectral cuantitativo. Estos métodos son los siguientes.
I. Métodos espectroscópicos(sin fotografía) casi todos son métodos fotométricos. Estos incluyen: 1) Método Barratt. Al mismo tiempo, se excitan los espectros de dos sustancias, la de prueba y la de estándar, visibles en el campo de visión del espectroscopio, una al lado de la otra, una encima de la otra. La trayectoria de los rayos se muestra en la Fig. 14,

donde F 1 y F 2 son dos explosores, cuya luz pasa a través de los prismas de Nicolas N 1 y N 2, polarizando los rayos en planos mutuamente perpendiculares. Usando el prisma D, los rayos entran en la rendija S del espectroscopio. En su telescopio se coloca un tercer prisma de Nicolás, un analizador, que al girar consigue la misma intensidad de las dos líneas que se comparan. Anteriormente, al estudiar estándares, es decir, sustancias con contenidos conocidos de elementos, se establece la relación entre el ángulo de rotación del analizador y la concentración, y a partir de estos datos se elabora un diagrama. Al analizar por el ángulo de rotación del analizador, el porcentaje deseado se encuentra en este diagrama. La precisión del método es ±10%. 2). El principio del método es que los rayos de luz después del prisma del espectroscopio pasan a través de un prisma de Wollaston, donde divergen en dos haces y se polarizan en planos mutuamente perpendiculares. El diagrama de trayectoria del rayo se muestra en la Fig. 15,

donde S es la rendija, P es el prisma del espectroscopio, W es el prisma de Wollaston. En el campo de visión se obtienen dos espectros B 1 y B 2, uno al lado del otro; L - lupa, N - analizador. Si gira el prisma de Wollaston, los espectros se moverán entre sí, lo que le permitirá combinar dos de sus líneas. Por ejemplo, si se analiza hierro que contiene vanadio, entonces la línea de vanadio se combina con alguna línea de hierro monocolor cercana; luego, girando el analizador, consiguen el mismo brillo de estas líneas. El ángulo de rotación del analizador, como en el método anterior, es una medida de la concentración del elemento deseado. El método es especialmente adecuado para el análisis del hierro, cuyo espectro tiene muchas líneas, lo que permite encontrar siempre líneas adecuadas para la investigación. La precisión del método es ± (3-7)%. 3) Método Occhialini. Si los electrodos (por ejemplo, los metales que se analizan) se colocan horizontalmente y la imagen se proyecta desde una fuente de luz sobre la rendija vertical del espectroscopio, tanto durante las descargas de chispa como de arco, pueden aparecer líneas de impurezas. abiertos en función de la concentración a mayor o menor distancia de los electrodos. La fuente de luz se proyecta sobre la rendija mediante una lente especial equipada con un tornillo micrométrico. Durante el análisis, esta lente se mueve y la imagen de la fuente de luz se mueve con ella hasta que desaparece cualquier línea de impureza en el espectro. La medida de la concentración de impurezas es la lectura en la escala de la lente. Actualmente, este método también se ha desarrollado para trabajar con la parte ultravioleta del espectro. Cabe señalar que Lockyer utilizó el mismo método para iluminar la rendija de un aparato espectral y desarrolló un método de análisis espectral cuantitativo, el llamado. Método de "líneas largas y cortas". 4) Fotometría directa de espectros.. Los métodos descritos anteriormente se denominan visuales. En lugar de estudios visuales, Lundegaard utilizó una fotocélula para medir la intensidad de las líneas espectrales. La precisión de la determinación de metales alcalinos cuando se trabaja con llama alcanzó ± 5%. Para descargas de chispas, este método no es aplicable, ya que son menos constantes que las llamas. También existen métodos basados en cambiar la inductancia en el circuito secundario, así como utilizar la atenuación artificial de la luz que ingresa al espectroscopio hasta que las líneas espectrales en estudio desaparezcan del campo de visión.
II. Métodos espectrográficos. Con estos métodos se examinan fotografías de espectros, y la medida de la intensidad de las líneas espectrales es el ennegrecimiento que producen en la placa fotográfica. La intensidad se evalúa visualmente o fotométricamente.
A. Métodos sin fotometría.. 1) Método de las últimas líneas. Cuando cambia la concentración de cualquier elemento en el espectro, cambia el número de sus líneas, lo que permite, en condiciones de funcionamiento constantes, juzgar la concentración del elemento que se está determinando. Se fotografían una serie de espectros de sustancias con un contenido conocido del componente de interés, se determina el número de sus líneas en los espectrogramas y se compilan tablas que indican qué líneas son visibles en concentraciones determinadas. Estas tablas sirven además para definiciones analíticas. Al analizar el espectrograma, se determina el número de líneas del elemento de interés y el contenido porcentual se encuentra en las tablas, y el método no da una cifra inequívoca, sino límites de concentración, es decir, "de-a". Lo más fiable es distinguir concentraciones que difieren entre sí en un factor de 10, por ejemplo, del 0,001 al 0,01%, del 0,01 al 0,1%, etc. Las tablas analíticas son importantes sólo para condiciones de funcionamiento muy específicas, que pueden variar en gran medida entre laboratorios; Además, se requiere un cuidadoso cumplimiento de condiciones de trabajo constantes. 2) Método de espectros comparativos. Se fotografían varios espectros de la sustancia analizada A + x% B, en los que se determina el contenido de x elemento B, y en los intervalos entre ellos en la misma placa fotográfica - espectros de sustancias estándar A + a% B, A + b % B, A + c% B , donde a, b, c son el porcentaje conocido de B. En los espectrogramas, la intensidad de las líneas B determina entre qué concentraciones se encuentra el valor de x. El criterio para la constancia de las condiciones de operación es la igualdad de intensidad en todos los espectrogramas de cualquier línea A cercana. Al analizar soluciones, se les agrega la misma cantidad de algún elemento, dando una línea cercana a las líneas B, y luego la constancia de Las condiciones de funcionamiento se juzgan por la igualdad de intensidad de estas líneas. Cuanto menor sea la diferencia entre las concentraciones de a, b, c, ... y cuanto más exactamente se logre la igualdad de intensidad de las líneas A, más preciso será el análisis. A. Rice, por ejemplo, utilizó concentraciones de a, b, c,..., relacionadas entre sí, como 1:1,5. Junto al método de espectros comparativos está el método de “selección de concentraciones” (Testverfahren) según Güttig y Thurnwald, que sólo es aplicable al análisis de soluciones. Consiste en el hecho de que si en dos soluciones que contienen a% A y x% A (x es mayor o menor que a), que ahora se pueden determinar a partir de sus espectros, entonces se agrega tal cantidad n del elemento A a cualquier de estas soluciones para que la intensidad de sus líneas en ambos espectros sea la misma. Esto determinará la concentración x, que será igual a (a ± n)%. También se puede agregar algún otro elemento B a la solución analizada hasta que las intensidades de ciertas líneas A y B sean iguales y, en base a la cantidad de B, estimar el contenido de A. 3) Método de pares homólogos. En el espectro de una sustancia A + a% B, las líneas de los elementos A y B no son igualmente intensas y, si hay un número suficiente de estas líneas, se pueden encontrar dos de esas líneas A y B, cuya intensidad será ser el mismo. Para otra composición A + b% B, otras líneas A y B serán iguales en intensidad, etc. Estas dos líneas idénticas se llaman pares homólogos. Las concentraciones de B en las que se produce uno u otro par homólogo se denominan puntos de fijación esta pareja. Para trabajar con este método, se requiere una compilación preliminar de tablas de pares homólogos utilizando sustancias de composición conocida. Cuanto más completas sean las tablas, es decir, cuantos más pares homólogos contengan con puntos de fijación que difieran lo menos posible entre sí, más preciso será el análisis. Se han elaborado un número bastante grande de estas tablas y se pueden utilizar en cualquier laboratorio, ya que se conocen con precisión las condiciones de las descargas durante su elaboración y se pueden utilizar estas condiciones. reproducido con absoluta precisión. Esto se logra utilizando la siguiente técnica simple. En el espectro de la sustancia A + a% B, se seleccionan dos líneas del elemento A, cuya intensidad varía mucho según el valor de la autoinducción en el circuito secundario, es decir, una línea de arco (perteneciente al átomo neutro) y una línea de chispa (perteneciente al ion). Estas dos líneas se llaman par de fijación. Seleccionando el valor de la autoinductancia, las líneas de este par se vuelven idénticas y la compilación se realiza precisamente en estas condiciones, siempre indicadas en las tablas. En las mismas condiciones se realiza el análisis y se determina el porcentaje en función de la implementación de uno u otro par de homólogos. Existen varias modificaciones del método de pares homólogos. De estos, el más importante es el método. espectro auxiliar, utilizado cuando los elementos A y B no tienen un número suficiente de líneas. En este caso, las líneas espectrales del elemento A están conectadas de cierta manera con las líneas de otro elemento G más adecuado, y el elemento G comienza a desempeñar el papel de A. El método de pares homológicos fue desarrollado por Gerlyach y Schweitzer. Es aplicable tanto a aleaciones como a soluciones. Su precisión es en promedio de aproximadamente ±10%.
EN. Métodos que utilizan fotometría.. 1) Método Barratt. Higo. 16 da una idea del método.

F 1 y F 2 son dos explosores, con la ayuda de los cuales se excitan simultáneamente los espectros del estándar y la sustancia analizada. La luz pasa a través de 2 sectores giratorios S 1 y S 2 y, con la ayuda de un prisma D, forma espectros que se encuentran uno encima del otro. Al seleccionar cortes sectoriales se le da la misma intensidad a las líneas del elemento en estudio; la concentración del elemento que se determina se calcula a partir de la relación de los valores de los recortes. 2) es similar, pero con un explosor (Fig. 17).

La luz de F se divide en dos haces y pasa por los sectores S 1 y S 2, utilizando el rombo de Hüfner R se obtienen dos franjas del espectro una encima de la otra; Sp - rendija del espectrógrafo. Los cortes del sector se cambian hasta que la intensidad de la línea de impureza y cualquier línea cercana de la sustancia principal sean iguales, y el contenido porcentual del elemento que se determina se calcula a partir de la relación de los valores de corte. 3) Cuando se utiliza como fotómetro sector logarítmico giratorio las líneas adquieren una apariencia en forma de cuña en los espectrogramas. Uno de estos sectores y su posición relativa al espectrógrafo durante la operación se muestra en la Fig. 18, a y b.

El recorte del sector obedece a la ecuación
- log Ɵ = 0,3 + 0,2l
donde Ɵ es la longitud del arco en partes de un círculo completo, ubicado a una distancia I, medida en mm a lo largo del radio desde su extremo. Una medida de la intensidad de las líneas es su longitud, ya que con un cambio en la concentración de un elemento, también cambia la longitud de sus líneas en forma de cuña. En primer lugar, utilizando muestras con contenido conocido, se construye un diagrama de la dependencia de la longitud de una línea con respecto al % de contenido; Cuando se analiza en un espectrograma, se mide la longitud de la misma línea y el porcentaje se encuentra en el diagrama. Hay varias modificaciones diferentes de este método. Cabe destacar la modificación de Scheibe, quien utilizó el llamado. sector doble logarítmico. Una vista de este sector se muestra en la Fig. 19.

Luego, las líneas se examinan utilizando un aparato especial. Precisión alcanzable utilizando sectores logarítmicos, ±(10-15)%; La modificación de Scheibe da una precisión de ±(5-7)%. 4) Muy a menudo, la fotometría de líneas espectrales se utiliza mediante espectrofotómetros luminosos y termoeléctricos de varios diseños. Los fotómetros termoeléctricos, diseñados específicamente para realizar análisis cuantitativos, son convenientes. Por ejemplo en la FIG. La figura 20 muestra un diagrama del fotómetro según Sheibe:

L es una fuente de luz constante con un condensador K, M es una placa fotográfica con el espectro que se está estudiando, Sp es una rendija, O 1 y O 2 son lentes, V es un obturador, Th es un termoelemento que está conectado al galvanómetro. . Una medida de la intensidad de las líneas es la desviación de la aguja del galvanómetro. Menos utilizados son los galvanómetros autorregistrables, que registran la intensidad de las líneas en forma de curva. La precisión del análisis cuando se utiliza este tipo de fotometría es de ±(5-10)%. Cuando se combina con otros métodos de análisis cuantitativo, la precisión puede ser aumentó; Por ejemplo, método de tres líneas Scheibe y Schnettler, que es una combinación del método de pares homólogos y mediciones fotométricas, en casos favorables puede dar una precisión de ±(1-2)%.
Los métodos de análisis espectral se basan en el estudio de los espectros ópticos de emisión o absorción. Se distingue entre análisis espectral de absorción atómica (análisis basado en espectros de absorción) y análisis espectral de emisión (análisis basado en espectros de emisión). El análisis espectral se utiliza ampliamente para el análisis cualitativo y cuantitativo de diversas sustancias. A partir de las líneas características del espectro se puede determinar la composición elemental de una sustancia y la intensidad de la línea espectral es una medida de la concentración de la sustancia en la muestra.
espectroscopia de emisión
Los átomos de elementos en estado excitado emiten radiación con una longitud de onda estrictamente definida. Los espectros de emisión (espectros de emisión) de cada elemento son individuales, constan de un determinado conjunto de líneas características, a partir de las cuales se puede determinar la composición elemental de la sustancia y su concentración.
En el análisis espectral de emisión, la muestra en estudio se evapora o quema si es líquida o sólida, luego se somete a alta temperatura o una carga eléctrica para transferir los átomos a un estado excitado y se registra el espectro. El análisis cualitativo de emisiones se reduce a descifrar las líneas del espectro de la muestra analizada. El análisis cuantitativo se basa en comparar la intensidad de las líneas espectrales de la muestra con la intensidad de las líneas en el espectro de una muestra estándar, determinando el contenido del elemento en el que se conoce.
Las fuentes de excitación pueden ser llamas, arcos eléctricos, chispas, impulsos o descargas eléctricas de vacío. Una descarga de arco produce una temperatura de 5000-7000 °C, a la cual los átomos de la mayoría de los elementos entran en un estado excitado. En una chispa de alto voltaje con una temperatura de 7000-15000 °C, se excitan átomos de elementos con un alto potencial de excitación. Para excitar gases inertes se utilizan descargas de vacío eléctricas y pulsadas.
Según el método de registro del espectro, se distinguen varios tipos de análisis espectral de emisión. En el análisis visual, la composición cualitativa se determina mediante la observación directa del espectro visible. Más preciso es el análisis fotográfico, según el cual el espectro se fotografía en una placa fotográfica, que luego se examina en un espectroproyector para determinaciones cualitativas o se fotomedida con un microfotómetro para determinaciones cuantitativas. Sobre una placa fotográfica se obtiene una serie fija de líneas correspondientes a las líneas espectrales de la muestra en estudio, cuyo grado de ennegrecimiento es proporcional a la intensidad de estas líneas.
Los espectroproyectores se utilizan para descifrar espectrogramas. La industria nacional produce el espectroproyector PS-18, que permite obtener en la pantalla pequeñas secciones del espectro ampliadas 20 veces, lo que facilita su descifrado durante el análisis exprés cualitativo o semicuantitativo.
La densidad de ennegrecimiento de las líneas en una placa fotográfica se mide utilizando microfotómetros. El flujo de luz pasa a través de la parte no ennegrecida de la placa fotográfica y luego se dirige a una fotocélula con un galvanómetro. Se anota la desviación de la aguja del galvanómetro en la escala. Luego, el flujo de luz pasa a través de la parte ennegrecida de la placa y se observa nuevamente la desviación de la aguja del galvanómetro. La densidad de ennegrecimiento está determinada por la ecuación:
donde I0 es la intensidad de la luz que atraviesa la parte no ennegrecida de la placa fotográfica; I es la intensidad de la luz que atraviesa la parte ennegrecida de la placa fotográfica.
Dado que la densidad del ennegrecimiento es proporcional a la concentración del elemento, se construye un gráfico de calibración de la dependencia del ennegrecimiento de la concentración basándose en las lecturas del galvanómetro. A partir de este gráfico se determina el contenido del elemento. Para determinar la densidad de ennegrecimiento de las líneas en un espectrograma, se utilizan un microfotómetro MF-2 (o MF-4) y un microfotómetro de dos haces IFO-451.
En el análisis de emisiones fotoeléctricas, las líneas analíticas se registran mediante fotocélulas. El resultado del análisis se indica en la escala del dispositivo de medición o se registra en la cinta de un dispositivo de autorregistro.
Espectrógrafo de cuarzo ISP-28. El espectrógrafo ISP-28 se utiliza para obtener espectros en el rango de longitud de onda de 200 a 600 nm. Realiza análisis cualitativos y cuantitativos de metales, aleaciones, menas, minerales y otros materiales. En la Fig. 126 muestra el diagrama óptico del dispositivo. La luz de la fuente 1 (arco o chispa) a través de un condensador de tres lentes 3-5, protegido de salpicaduras de metal por una placa de cuarzo 2, se dirige a una rendija 6 ubicada en el foco de una lente de espejo 8. Un haz de luz paralelo reflejada por esta lente se dirige a un prisma de cuarzo 9. La luz de dispersión expuesta se enfoca mediante una lente de cuarzo 10 sobre la emulsión de la placa fotográfica 11.

Otros espectrógrafos. El espectrógrafo de laboratorio de cuarzo de mesa ISP-30 se utiliza para análisis cualitativos de metales, aleaciones y minerales; El espectrógrafo de vidrio de tres prismas ISP-51 se utiliza para el análisis de sustancias que contienen elementos con un pequeño número de líneas espectrales. Para analizar sustancias que contienen elementos con espectros especialmente complejos se utiliza el espectrógrafo STE-1. Para el análisis cualitativo y cuantitativo de metales, menas, minerales, etc., se utiliza un espectrógrafo de foco largo DFS-8 (tres modificaciones) con rejillas de difracción y un espectrógrafo de difracción DFS-452.
Fotometría de llama
La fotometría de llama es uno de los métodos más precisos de análisis espectral de emisión. Este método se utiliza ampliamente para la determinación de metales alcalinos y alcalinotérreos. La esencia del método de fotometría de llama es la siguiente.
La solución de la sustancia analizada se rocía con aire comprimido en la zona de llama de un quemador de gas, en el que se quema acetileno, hidrógeno, iluminación o algún otro gas. La llama del quemador también sirve como fuente de energía para excitar los átomos. Un dispositivo óptico selecciona la línea espectral del elemento que se está determinando y mide su intensidad mediante una fotocélula. La intensidad de la línea espectral es proporcional a la concentración de sal en la solución (dentro de ciertos límites). La concentración del elemento se determina mediante una curva de calibración. A continuación se muestra la composición de algunas mezclas de gases inflamables y la temperatura media que se obtiene al quemarlas (en °C):

Fotómetro de llama portátil PPF-UNIZ. El diagrama esquemático del fotómetro PPF-UNIZ se muestra en la Fig. 127. El gas combustible de un cilindro (o red urbana) pasa a través del manostato 2, la botella tampón 3, el filtro 4 y entra a través del microgrifo 5 al mezclador 7, que al mismo tiempo realiza la función de eliminador de gotas. La presión del gas después del manostato se mantiene constante mediante un microgrifo 5 y se mide mediante un manómetro de líquido 6 en forma de U. El exceso de gas sale al quemador de laboratorio 1 y se quema.

El aire comprimido de un compresor (sin el uso de lubricación con aceite) o de un cilindro ingresa a una botella amortiguadora de 3" y luego a un filtro 13. La presión del aire se mantiene constante usando un microgrifo 12 y se mide con un manómetro 11. El aire ingresa al pulverizador 8, donde la solución analizada se aspira del vidrio 10. La solución en forma de aerosol finamente atomizado ingresa al mezclador 7, donde se mezcla con gas inflamable. La mezcla de gas y aire que sale del mezclador contiene el elemento en estudio en estado pulverizado, ingresa al quemador 20 a través de un eliminador de gotas 14.
La longitud de onda de la línea de llama amarilla del sodio es 589 ± 5 µm, la línea roja del calcio es 615 ± 5 µm y la línea infrarroja del potasio es 766 ± 5 µm. La intensidad de estas líneas se registra mediante una fotocélula 16, equipada con filtros de interferencia reemplazables 17 y diafragmas 18. Para determinar el sodio y el calcio, se utilizan fotocélulas de selenio del tipo AFI-5 con una sensibilidad de 460-500 μA/lm, para para la determinación del potasio - una fotocélula de azufre de plata del tipo FESS-UZ con una sensibilidad de 6000-9000 µA/lm. Las fotocélulas y los filtros de luz están protegidos de la radiación térmica directa de la llama mediante una pantalla de vidrio 19. Las fotocorrientes resultantes se registran mediante un microamperímetro magnetoeléctrico 21 tipo M-95, al que se conectan dos de las tres fotocélulas según un circuito de compensación a través de un interruptor eléctrico 15.
Antes de comenzar a trabajar con el dispositivo, abra la puerta 10 (Fig. 128) y asegúrela con un pestillo. Se conecta un tubo de goma al tubo de drenaje 14 del pulverizador 12 y se baja a un recipiente con un líquido barrera de 20-25 cm de altura. Se coloca un vaso con una capacidad de 25-30 ml de agua destilada debajo del tubo de succión 13 de el pulverizador. Se instala un dispositivo de protección (visera) 11 en la puerta y el dispositivo se conecta a una red de corriente alterna de 220 V (50 Hz). Encienda el compresor para suministrar aire y, girando lentamente la manija del microgrifo “aire” 4 en sentido antihorario, consiga una buena atomización del agua destilada, es decir. Formación de aerosoles altamente dispersos. La presión de aire óptima (4-8) * 10000 Pa (0,4-0,8 atm) no debe cambiar durante todo el tiempo de medición.

Girando lentamente la manija del microgrifo “gas” 5, suministre gas al quemador y después de 10-20 s enciéndalo en la entrada del quemador y en la salida del manostato. El suministro de gas se ajusta de modo que el cono interior de la llama esté pintado de verde y el exterior de un azul azulado. Usando la manija 9, coloque el quemador en una posición en la que el cono interior de la llama descienda 5-6 cm por debajo del borde de la entrada del diafragma.
Las mediciones comienzan después de 20 minutos de calentar la celda fotométrica. Durante el período de calentamiento, el diafragma de la celda debe estar completamente abierto, el microamperímetro se enciende a baja sensibilidad (1,0 μA) y se introduce agua destilada en la llama del quemador. Después de calentar la celda fotoeléctrica, se cierra el diafragma, el mango del microamperímetro 6 se cambia a la sensibilidad más alta (0,1 μA) y el puntero del microamperímetro se pone a cero girando el cabezal corrector ubicado en el lado derecho del dispositivo.
Para construir una curva de calibración, se prepara una serie de soluciones estándar. Para preparar la solución madre, se disuelven 2,385 g de cloruro de potasio KCl (grado reactivo) en un matraz volumétrico de 500 ml y se diluye con agua hasta la marca. Pipetear 5,00 ml de esta solución en un matraz aforado de 500 ml y diluir con agua destilada hasta la marca (dilución 100 veces). La solución resultante contiene 25 mg de potasio en 1 ml, a partir de ella se preparan soluciones que contienen 5, 10, 15 y 20 mg de potasio en 1 ml. Para ello, pipetear 20, 40, 60 y 80 ml de una solución que contenga 25 mg/ml de potasio en matraces aforados de 100 ml y diluir el volumen con agua hasta la marca.
Estas soluciones se introducen secuencialmente en la llama del quemador y se registran las lecturas del microamperímetro. Al pasar de una solución a otra, el pulverizador se lava con agua destilada hasta que la aguja del microamperímetro vuelve a cero. A partir de los datos obtenidos, se construye un gráfico de calibración: lecturas del microamperímetro (en el eje de abscisas) - concentración del elemento que se está determinando (en el eje de ordenadas) (en mg/ml).
Para determinar la concentración de un elemento en la solución de prueba, se introduce en la llama del quemador y se registran las lecturas del microamperímetro, a partir de las cuales, mediante un gráfico de calibración, se encuentra la concentración del elemento que se está determinando. Durante todo el proceso de análisis, es necesario mantener constante la presión del aire y del gas.
Además del método para determinar la concentración mediante una curva de calibración, se utiliza el método de soluciones limitantes, es decir tomar lecturas de un microamperímetro al analizar la solución en estudio y, en paralelo, lecturas del dispositivo al analizar soluciones estándar: soluciones con concentraciones más bajas y más altas. El contenido de potasio (en mg/l) se calcula mediante la fórmula
![]()
donde c1 es el contenido de potasio en una solución estándar más concentrada; c2 - contenido de potasio en una solución estándar menos concentrada; I1: lecturas de microamperímetro al analizar una solución estándar con mayor concentración; I2: lecturas de microamperímetro al analizar una solución estándar con una concentración más baja; Ix: lecturas del microamperímetro al analizar la solución de prueba.
Fotómetro de llama Flapho-4. Dispositivo de dos canales para determinación seriada de sodio, potasio, calcio, litio y plomo con alta sensibilidad. Producido en la RDA.
La solución de prueba de la muestra se absorbe mediante flujo; Se pulveriza con aire comprimido y se convierte en aerosol. El aerosol ingresa a un tanque especial, donde se mezcla con un gas inflamable (acetileno o propano) y la mezcla resultante se suministra a un quemador rodeado de aire purificado. En una llama de gas, la sustancia en estudio se evapora y sus átomos se excitan. Un filtro de interferencia metalizado separa un componente de radiación monocromático del espectro general de la llama, que incide en la fotocélula de selenio. La fotocorriente intermitente resultante se amplifica y se suministra a un dispositivo de medición o registro. El diagrama del dispositivo se muestra en la Fig. 129.

Otros fotómetros de llama: fotómetro de llama de tres canales FP-101 para determinar la concentración de Na, K, Ca y Li; fotómetro de llama PFM para la determinación cuantitativa de concentraciones de elementos alcalinos y alcalinotérreos, así como de magnesio, boro, cromo y manganeso; analizadores fotométricos de líquidos de llama PAZH-1 y BIAN-140 para determinar microcantidades de K, Na, Ca y Li en soluciones, fotómetro de llama para determinar Na y K en fluidos biológicos.
Espectrofotometría de absorción atómica.
Los átomos libres en estado no excitado ubicados en la zona de la llama de baja temperatura tienen la capacidad de absorber luz selectivamente. La longitud de onda de la luz absorbida por los átomos de un elemento es la misma que la longitud de onda de la luz emitida por los átomos de ese elemento. En consecuencia, utilizando las líneas características del espectro de absorción y su intensidad, es posible analizar sustancias, determinando su composición y la concentración de sus elementos constituyentes.
Para realizar el análisis de absorción atómica, la sustancia en estudio se evapora alimentándola en una zona de llama de baja temperatura. Las moléculas de la sustancia evaporada se disocian en átomos. El flujo de luz, en cuyo espectro hay una línea de luz absorbida por la sustancia que pasa a través de esta llama, se debilita y cuanto mayor es la concentración de la sustancia analizada, mayor.
En la Fig. 130 muestra un diagrama esquemático de la instalación para análisis de absorción atómica. La luz del tubo de descarga 1 (cátodo hueco) pasa a través de la llama del quemador 2 y se enfoca en la rendija del monocromador 3. Luego, la radiación incide en el tubo fotomultiplicador o fotocélula 4. El monocromador selecciona radiación con una longitud de onda absorbida por el elemento en estudio del flujo luminoso total. La corriente se amplifica en el bloque 5 y se registra mediante el dispositivo de medición 6.

La determinación consiste en medir la relación de las intensidades de la luz que atraviesa la llama con y sin el analito introducido en ella. Dado que la intensidad de la línea espectral del elemento en estudio en la llama del quemador resulta ser mayor que su intensidad de radiación del cátodo hueco, la radiación de este último está modulada. La modulación de la radiación (cambiando la amplitud y frecuencia de las oscilaciones) se realiza mediante un disco giratorio con orificios (modulador 7) ubicado entre el cátodo hueco y la llama. El amplificador 5 debe tener una ganancia máxima para la misma frecuencia con la que se modula la radiación del cátodo hueco.
Espectrofotómetro de absorción atómica AAS-1. Destinado al análisis espectral de absorción y emisión. Le permite definir 65 elementos.
Principio de operación. La muestra líquida se atomiza utilizando un gas oxidante, se mezcla con un gas inflamable (acetileno o propano) y se quema en la llama de un quemador. La radiación de una lámpara de cátodo hueco atraviesa la llama del quemador. Después de seleccionar una línea adecuada mediante un monocromador de difracción, la radiación se dirige a un fotomultiplicador. Se suprime el componente de corriente continua causado por la autoradiación. La señal del fotomultiplicador se amplifica, se rectifica mediante un rectificador sensible y se registra. El dispositivo se ajusta y controla mediante soluciones estándar.
En la Fig. 131 muestra un diagrama del espectrofotómetro de absorción atómica AAS-1.

Diseño de dispositivos. El dispositivo tiene un conjunto de accesorios para el suministro de gases, un sistema de pulverización y combustión, un dispositivo reemplazable para lámparas con cátodos huecos, un sistema óptico y un dispositivo receptor con amplificador e indicador.
La llama del quemador funciona con una mezcla de acetileno o propano y aire comprimido. Los gases ingresan al sistema de combustión desde cilindros convencionales con reductores de presión ajustados (primarios). El suministro de aire libre de aceite se realiza mediante un compresor de membrana (16 l/min a una presión de 3*100.000 Pa (3 atm)). El complejo de válvulas del dispositivo tiene cajas de cambios ajustables (secundarias) y medidores de flujo para controlar el caudal de cada gas, así como filtros cerámicos de polvo sinterizado y una botella para enjuague adicional con acetileno. La válvula de seguridad detiene automáticamente el acceso de gas inflamable cuando la presión de funcionamiento del aire comprimido disminuye (por ejemplo, debido a un retorcimiento o rotura de la manguera de suministro); la válvula elimina el orden incorrecto de suministro de gas al encender la llama.
El sistema de atomización y combustión está ubicado detrás de una ventana de vidrio laminado removible que permite observar el sistema. El atomizador de boquilla anular tiene una alta relación de atomización y se caracteriza por un flujo de líquido bajo (3,4 ml/min, o 0,5 ml durante todo el análisis). El quemador está equipado con cabezales de boquilla reemplazables: uno ranurado para el análisis de absorción (Fig. 132, a) y dos de orificios múltiples (quemadores Mecker con malla) para el análisis de emisiones (Fig. 132,6).

Los soportes ajustables para cuatro lámparas de cátodo hueco están ubicados en un dispositivo que permite cambios rápidos de lámpara. Después de reemplazar una de las lámparas, no es necesario ajustar los soportes.
El sistema óptico dirige la radiación de la lámpara en forma de un haz estrecho hacia la llama. Debido al desplazamiento lateral del tubo con el sistema de imágenes, la radiación pasa a través de la llama una o tres veces para aumentar la sensibilidad del análisis. Un monocromador de difracción de alta apertura selecciona la línea de resonancia deseada del espectro de líneas de una lámpara de cátodo hueco determinada. El ancho de la ranura del monocromador se ajusta de 0 a 2 mm.
Una rejilla de difracción de precisión con 1300 líneas por 1 mm y una dispersión angular de 1,5 nm/mm tiene una alta resolución. El rango espectral de la rejilla es de 190 a 820 nm.
El receptor de radiación es un fotomultiplicador de 12 etapas. El amplificador de instrumentación, la fuente de alimentación de la lámpara de cátodo hueco y los fotomultiplicadores funcionan con transistores y son capaces de compensar las fluctuaciones de la tensión de red de +10 a -15%.
Las lecturas del dispositivo se miden mediante un comparador que tiene tres escalas: una escala logarítmica del coeficiente de extinción de 0 a 1,5; escala lineal de 0 a 100 y escala de tensión de funcionamiento de 0 a 16 mV. Al dispositivo se le puede conectar un dispositivo de grabación o de computación para determinar la concentración o procesar los datos. La sensibilidad de las determinaciones (en mg/l) es:
![]()
El dispositivo funciona desde una red de corriente alterna de 220 V, 50 Hz. Producido en la RDA.
Otros espectrofotómetros de absorción atómica domésticos: espectrofotómetro de absorción atómica S-302 para determinar trazas de hierro, cobre, zinc, cobalto, níquel, bismuto, calcio y otros elementos; espectrofotómetro de absorción atómica automatizado AA-A para la determinación de calcio y cobre con mayor sensibilidad; "Saturno" - espectrofotómetro de grabación semiautomático de absorción atómica de llama para la determinación de 32 elementos; "Spectrum-1" es un espectrofotómetro de absorción atómica para la determinación rápida de más de 40 elementos con una sensibilidad de aproximadamente 0,2 μg/ml.
En Inglaterra se fabrica el espectrofotómetro de absorción atómica Perkin-Elmer modelo 603. El aparato está construido según un esquema de dos haces y combinado con un microordenador. Proporciona alta precisión y rapidez de determinación. Se utiliza una mezcla inflamable de oxígeno y acetileno para encender la llama.
Espectros, métodos de obtención de los mismos, características, clasificación y utilización con fines analíticos. Elementos básicos de los instrumentos espectrales y su finalidad.
Los métodos de análisis espectral son métodos basados en la determinación de la composición química y la estructura de sustancias de su espectro.
El espectro de una sustancia es la radiación electromagnética ordenada por longitud de onda, emitida, absorbida, dispersada o refractada por la sustancia. Los métodos basados en la obtención y estudio de los espectros de emisión (emisión) de radiación electromagnética (energía) se denominan métodos de emisión, absorción (absorción) - absorción, dispersión - dispersión, refracción - refracción.
El espectro de una sustancia se obtiene influyéndolo con la temperatura, el flujo de electrones, el flujo de luz (energía electromagnética) con una determinada longitud de onda (frecuencia de radiación) y otros métodos. Con una cierta cantidad de energía de impacto, una sustancia puede entrar en un estado excitado. En este caso, se producen procesos que conducen a la aparición de radiación con una determinada longitud de onda en el espectro (Tabla 2.2.1).
La emisión, absorción, dispersión o refracción de la radiación electromagnética puede considerarse como una señal analítica que transporta información sobre la composición cualitativa y cuantitativa de una sustancia o su estructura. La frecuencia (longitud de onda) de la radiación está determinada por la composición de la sustancia en estudio, y la intensidad de la radiación es proporcional al número de partículas que provocaron su aparición, es decir, Cantidad de una sustancia o componente de una mezcla.
Cada uno de los métodos analíticos no suele utilizar todo el espectro de una sustancia, cubriendo el rango de longitudes de onda desde los rayos X hasta las ondas de radio, sino sólo una determinada parte del mismo. Los métodos espectrales generalmente se distinguen por el rango de longitudes de onda espectrales que funcionan para un método determinado: ultravioleta (UV), rayos X, infrarrojos (IR), microondas, etc.
Los métodos que operan en los rangos UV, visible e IR se denominan ópticos. Se utilizan más en métodos espectrales debido a la relativa simplicidad del equipo para obtener y registrar el espectro.
Los espectros en el rango óptico son el resultado de cambios en la energía de los átomos o moléculas.
Tabla 2.2.1
| Tipo de radiación | Procesos atómicos y moleculares. | Fuentes de excitación | Detectores de radiación | |
| , nm | Nombre | |||
| 10-3 | -radiación | Nuclear | Ciclotrones | contadores Geiger, |
| 10-2 | radiografía | reacciones | contadores de centelleo, placas fotográficas | |
| 10-1 | Transiciones de externo | tubos de rayos x | ||
| 100 | electrones | |||
| 101 | vacío ultravioleta | |||
| 2·102 | UV lejos | Transiciones de electrones externos | Tubos de rayos X, chispas, llamas, arco. | Fotocélulas, materiales fotográficos. |
| 3·102 | UV cerca | |||
| 375-750 | Visible | Ojo, fotocélula | ||
| 104 | IR cerca | Vibraciones de moléculas. | Hilos metálicos calentados. | Termopares de vacío, |
| 105 | Más | Rotación de moléculas | bolómetros | |
Como resultado de un cambio en la energía de un átomo o molécula, pasan del estado fundamental con la mínima energía interna posible E0 a un estado excitado con energía E1. La energía interna es una cantidad discreta (cuántica), por lo que la transición de un átomo o molécula del estado fundamental a otro siempre va acompañada de un cambio brusco de energía, es decir. recibir o emitir una porción (cuanto) de energía.
Los cuantos de radiación electromagnética son fotones cuya energía está relacionada con la frecuencia y la longitud de onda de la radiación mediante una relación conocida.
E = h · =
,donde E = E1 - E2, E1 es la energía del estado inicial y E2 es la energía del estado final del átomo o molécula entre los cuales ocurre la transición; h - constante de Planck; c es la velocidad de la luz; - frecuencia; - longitud de onda de la radiación electromagnética.
Cuando un átomo se excita, los electrones se mueven desde los niveles externos llenos a niveles de energía superiores vacíos.
Un átomo no puede permanecer en estado excitado por mucho tiempo. Se esfuerza por desprenderse del exceso de energía recibido y volver a un estado de tranquilidad. Después de un tiempo muy corto (10-8 - 10-7 s), el átomo regresa espontáneamente del estado excitado al estado fundamental o intermedio.
Cuando un electrón pasa de un nivel superior a uno inferior, se libera un fotón, un cuanto de radiación con ciertos y .
Esquemáticamente, las transiciones electrónicas en átomos entre diferentes estados, acompañadas de la emisión y absorción de cuantos de radiación electromagnética, se pueden representar en forma de diagrama (Fig. 2.2.1).

Líneas horizontales en la Fig. 2.2.1. Se representan los niveles de energía de varios estados del átomo. El nivel E0 es el nivel del estado fundamental; E1, E2, E3: niveles de estados excitados en orden creciente de energía. Las flechas verticales corresponden a la emisión (flecha hacia abajo) o absorción () de un fotón. Es obvio que
01 = 10, 13 = 31, etc.
El conjunto de fotones emitidos o absorbidos durante cualquier transición electrónica de un átomo, creando radiación con una longitud de onda, se llama línea espectral. La longitud de onda de la línea espectral se puede determinar a partir de la relación =
. El conjunto de líneas espectrales relacionadas con un átomo (molécula) específico forma el espectro de ese átomo (molécula).El espectro causado por la transición en E1 E2 se llama espectro de emisión, y en E1 E2, espectro de absorción. Las transiciones y las correspondientes líneas espectrales que pasan desde o hacia el nivel de energía principal se denominan resonantes.
Para excitar una línea espectral se requiere cierta energía, llamada potencial de excitación. Si se imparte demasiada energía a un átomo, puede producirse una eliminación completa de un electrón, es decir. ionización del átomo. La energía necesaria para ello se llama potencial de ionización. Las líneas de resonancia son las más brillantes y se caracterizan por el menor potencial de excitación.
Un cambio en la energía de una molécula va acompañado de un cambio tanto en la energía de las vibraciones como de las rotaciones, es decir, la molécula no tiene transiciones puramente electrónicas, sino que sólo son posibles transiciones electrónicas-vibratorias-rotacionales (EV). El número de posibles transiciones ECV en una molécula es mucho mayor que en los átomos, por lo que, por regla general, los espectros de las moléculas son más complejos y constan de un mayor número de líneas espectrales en el rango de longitudes de onda ópticas. Se puede presentar un diagrama esquemático de los niveles de energía de una molécula de la siguiente manera (Fig. 2.2.2).

Fig.2.2.2. Diagrama de niveles de energía molecular.
Tanto para las moléculas como para los átomos no se producen todas las transiciones imaginables. Las transiciones están reguladas por las llamadas reglas de selección: se permiten transiciones en las que el número cuántico cambia en uno (por ejemplo, Sp, pd, etc.).
Para fines analíticos, se pueden utilizar tanto el espectro de emisión como el de absorción, ya que están interrelacionados. Por ejemplo, la luz emitida por vapor de sodio metálico incandescente que pasa a través de un prisma produce dos líneas amarillas muy cercanas con longitudes de onda de 589,0 y 589,6 micrones. Estas son las llamadas líneas D - sodio. Por otro lado, si se pasa luz blanca policromática (es decir, un conjunto de haces de luz con todas las longitudes de onda) a través de vapor de sodio y luego se descompone en los colores que la componen en un prisma de vidrio, entonces, en el contexto de un espectro continuo, dos Las líneas negras se detectarán exactamente en el lugar de las líneas D. En consecuencia, el vapor de sodio absorbe radiación precisamente en las longitudes de onda que emiten cuando se excitan.
Este es un patrón general, por lo que el análisis espectral se puede realizar utilizando tanto el espectro de emisión como el espectro de absorción. El primer método es conveniente para analizar materiales en los que el espectro de emisión de sustancias constituyentes, como metales y gases, se excita fácilmente, y el segundo método es más conveniente para analizar materiales en los que es difícil excitar sustancias constituyentes (por ejemplo, soluciones).
Los espectros de emisión se dividen en continuo, rayado y lineal (Fig. 2.2.3). Los espectros continuos (o continuos) contienen todas las longitudes de onda en un intervalo determinado.
Son emitidas por objetos calientes que se encuentran a distancias tales entre sí que su radiación puede considerarse independiente. Los gases y vapores metálicos tienen espectros lineales.
Las líneas en los espectros de los átomos no están ubicadas al azar, sino que se combinan en grupos llamados series. Las distancias entre las líneas de la serie disminuyen naturalmente a medida que pasamos de ondas más largas a más cortas.
Balmeer, para el espectro lineal más simple del hidrógeno, descubrió que las frecuencias de las líneas espectrales en serie ubicadas en diferentes regiones de radiación electromagnética están en una cierta relación regular entre sí, que en términos generales para todos los elementos se expresaba por la dependencia

o en ciertos casos
El análisis espectral se divide en varios métodos independientes. Entre ellos se encuentran: espectroscopia infrarroja y ultravioleta, absorción atómica, análisis de luminiscencia y fluorescencia, espectroscopia de reflexión y Raman, espectrofotometría, espectroscopia de rayos X, así como muchos otros métodos.
El análisis espectral de absorción se basa en el estudio de los espectros de absorción de la radiación electromagnética. El análisis espectral de emisión se lleva a cabo utilizando los espectros de emisión de átomos, moléculas o iones excitados de diversas formas.
Análisis espectral de emisión atómica.
El análisis espectral a menudo se denomina únicamente análisis espectral de emisión atómica, que se basa en el estudio de los espectros de emisión de átomos e iones libres en la fase gaseosa. Se realiza en el rango de longitudes de onda de 150 a 800 nm. Se introduce una muestra de la sustancia en estudio en la fuente de radiación, después de lo cual se produce en ella la evaporación y disociación de las moléculas, así como la excitación de los iones resultantes. Emiten radiación, que es registrada por el dispositivo registrador del instrumento espectral.
Trabajar con espectros
Los espectros de las muestras se comparan con los espectros de elementos conocidos, que se pueden encontrar en las correspondientes tablas de líneas espectrales. Así se determina la composición de la sustancia analizada. El análisis cuantitativo implica la concentración de un elemento determinado en el analito. Se reconoce por la magnitud de la señal, por ejemplo, por el grado de ennegrecimiento o la densidad óptica de las líneas en una placa fotográfica, o por la intensidad del flujo luminoso en un receptor fotoeléctrico.
Tipos de espectros
Las sustancias en estado sólido o líquido, así como los gases densos, proporcionan un espectro continuo de radiación. En dicho espectro no hay interrupciones, en él están representadas ondas de todas las longitudes. Su carácter depende no sólo de las propiedades de los átomos individuales, sino también de su interacción entre sí.
Un espectro de emisión lineal es característico de las sustancias en estado gaseoso, mientras que los átomos casi no interactúan entre sí. El hecho es que los átomos aislados de un elemento químico emiten ondas de una longitud de onda estrictamente definida.
A medida que aumenta la densidad del gas, las líneas espectrales comienzan a ampliarse. Para observar dicho espectro, se utiliza el brillo de una descarga de gas en un tubo o el vapor de una sustancia en una llama. Si la luz blanca pasa a través de un gas que no emite, aparecerán líneas oscuras en el espectro de absorción en el contexto del espectro continuo de la fuente. El gas absorbe más intensamente la luz de aquellas longitudes de onda que emite cuando se calienta.
Uno de los principales métodos para analizar la composición química de una sustancia es el análisis espectral. Se realiza un análisis de su composición a partir del estudio de su espectro. Análisis espectral: utilizado en varios estudios. Con su ayuda se descubrió un complejo de elementos químicos: He, Ga, Cs. en la atmósfera del Sol. Además de Rb, In y XI, se determina la composición del Sol y de la mayoría de los demás cuerpos celestes.
Aplicaciones
Experiencia espectral, común en:
- Metalurgia;
- Geología;
- Química;
- Mineralogía;
- Astrofísica;
- Biología;
- medicina, etc
Le permite encontrar las cantidades más pequeñas de una sustancia determinada en los objetos en estudio (hasta 10 - MS). El análisis espectral se divide en cualitativo y cuantitativo.
Métodos
El método para establecer la composición química de una sustancia basándose en el espectro es la base del análisis espectral. Los espectros lineales tienen una personalidad única, al igual que las huellas dactilares humanas o el patrón de los copos de nieve. La singularidad de los patrones en la piel de un dedo es una gran ventaja a la hora de buscar a un criminal. Por tanto, gracias a las peculiaridades de cada espectro, es posible establecer el contenido químico del organismo analizando la composición química de la sustancia. Incluso si la masa de un elemento no supera los 10 - 10 g, mediante análisis espectral se puede detectar en la composición de una sustancia compleja. Este es un método bastante sensible.
Análisis espectral de emisión
El análisis espectral de emisión es una serie de métodos para determinar la composición química de una sustancia a partir de su espectro de emisión. La base del método para establecer la composición química de una sustancia (examen espectral) se basa en los patrones en los espectros de emisión y absorción. Este método le permite identificar millonésimas de miligramo de una sustancia.
Existen métodos de examen cualitativo y cuantitativo, de acuerdo con el establecimiento de la química analítica como materia, cuyo propósito es formular métodos para establecer la composición química de una sustancia. Los métodos para identificar una sustancia se vuelven extremadamente importantes dentro del análisis orgánico cualitativo.
Con base en el espectro lineal de vapores de cualquier sustancia, es posible determinar qué elementos químicos están contenidos en su composición, porque cualquier elemento químico tiene su propio espectro de emisión específico. Este método para establecer la composición química de una sustancia se llama análisis espectral cualitativo.
Análisis espectral de rayos X.
Existe otro método para identificar una sustancia química llamado análisis espectral de rayos X. El análisis espectral de rayos X se basa en la activación de los átomos de una sustancia cuando ésta es irradiada con rayos X, proceso llamado secundario o fluorescente. La activación también es posible cuando se irradian con electrones de alta energía; en este caso, el proceso se llama excitación directa. Como resultado del movimiento de los electrones en las capas electrónicas internas más profundas, aparecen líneas de rayos X.
La fórmula de Wulff-Bragg permite establecer las longitudes de onda en la composición de la radiación de rayos X cuando se utiliza un cristal de estructura popular con una distancia d conocida. Ésta es la base del método de determinación. La sustancia en estudio se bombardea con electrones de alta velocidad. Se coloca, por ejemplo, sobre el ánodo de un tubo de rayos X desmontable, tras lo cual emite rayos X característicos que inciden sobre un cristal de estructura conocida. Se miden los ángulos y se calculan las longitudes de onda correspondientes utilizando la fórmula, después de fotografiar el patrón de difracción resultante.
Técnicas
Actualmente, todos los métodos de análisis químico se basan en dos técnicas. Ya sea en la prueba física, o en la prueba química, comparando la concentración establecida con su unidad de medida:
Físico
La técnica física se basa en el método de correlacionar una unidad de cantidad de un componente con un estándar midiendo su propiedad física, que depende de su contenido en una muestra de la sustancia. La relación funcional “Saturación de propiedades – contenido de componentes en la muestra” se determina mediante prueba calibrando los medios para medir una propiedad física determinada de acuerdo con el componente que se está instalando. Del gráfico de calibración se obtienen relaciones cuantitativas, construidas en las coordenadas: “saturación de una propiedad física - concentración del componente instalado”.
Químico
Se utiliza una técnica química en el método de correlacionar una unidad de cantidad de un componente con un estándar. Aquí se utilizan las leyes de conservación de la cantidad o masa de un componente durante las interacciones químicas. Las interacciones químicas se basan en las propiedades químicas de los compuestos químicos. En una muestra de una sustancia se lleva a cabo una reacción química que cumple con los requisitos especificados para determinar el componente deseado y se mide el volumen o masa involucrado en la reacción química específica de los componentes. Se obtienen relaciones cuantitativas, luego se anota el número de equivalentes de un componente para una determinada reacción química o la ley de conservación de la masa.
Dispositivos
Los instrumentos para analizar la composición física y química de una sustancia son:
- analizadores de gases;
- Alarmas de concentraciones máximas permisibles y explosivas de vapores y gases;
- Concentradores para soluciones líquidas;
- Medidores de densidad;
- Medidores de sal;
- Medidores de humedad y otros dispositivos similares en finalidad e integridad.
Con el tiempo, la variedad de objetos analizados aumenta y la velocidad y precisión del análisis aumentan. Uno de los métodos instrumentales más importantes para establecer la composición química atómica de una sustancia es el análisis espectral.
NOTA:
El precio del examen químico incluye impuestos. Los gastos de transporte se pagan por separado.
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0