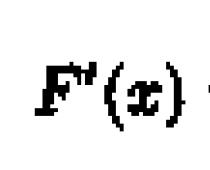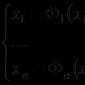Mis on vajalik töövedeliku, antud juhul õhu, temperatuuri muutmiseks ühe kraadi võrra. Õhu soojusmahtuvus sõltub otseselt temperatuurist ja rõhust. Samas saab eri tüüpi soojusmahtuvuse uurimiseks kasutada erinevaid meetodeid.
Matemaatiliselt väljendatakse õhu soojusmahtuvust soojushulga ja selle temperatuuri tõusu suhtena. 1 kg massiga keha soojusmahtuvust nimetatakse erisoojuseks. Õhu molaarne soojusmahtuvus on ühe mooli aine soojusmahtuvus. Näidatud on soojusmahtuvus - J / K. Molaarne soojusmahtuvus vastavalt J / (mol * K).
Soojusmahtuvust võib pidada aine, antud juhul õhu füüsikaliseks omaduseks, kui mõõtmine toimub konstantsetes tingimustes. Enamasti tehakse sellised mõõtmised konstantsel rõhul. Nii määratakse õhu isobaarne soojusmahtuvus. See suureneb temperatuuri ja rõhu tõustes ning on ka nende suuruste lineaarne funktsioon. Sellisel juhul toimub temperatuurimuutus konstantsel rõhul. Isobaarse soojusmahtuvuse arvutamiseks on vaja määrata pseudokriitiline temperatuur ja rõhk. See määratakse võrdlusandmete põhjal.
Õhu soojusmahtuvus. Iseärasused
Õhk on gaasisegu. Neid termodünaamikas vaadeldes tehti järgmised eeldused. Iga segu gaas peab olema kogu mahus ühtlaselt jaotunud. Seega on gaasi maht võrdne kogu segu mahuga. Igal segus oleval gaasil on oma osarõhk, mida see avaldab anuma seintele. Iga gaasisegu komponendi temperatuur peab olema võrdne kogu segu temperatuuriga. Sel juhul on kõigi komponentide osarõhkude summa võrdne segu rõhuga. Õhu soojusmahtuvuse arvutamine toimub gaasisegu koostise ja üksikute komponentide soojusmahtuvuse andmete põhjal.
Soojusmahtuvus iseloomustab ainet mitmetähenduslikult. Termodünaamika esimesest seadusest võime järeldada, et keha siseenergia ei muutu ainult sõltuvalt vastuvõetud soojushulgast, vaid ka keha tehtud tööst. Soojusülekande protsessi erinevates tingimustes võib keha töö varieeruda. Seega võib sama kogus kehale edastatud soojust põhjustada erineva väärtusega temperatuuri ja keha siseenergia muutusi. See omadus on iseloomulik ainult gaasilistele ainetele. Erinevalt tahketest ja vedelikest võivad gaasilised ained oluliselt muuta mahtu ja teha tööd. Seetõttu määrab õhu soojusmahtuvus termodünaamilise protsessi enda olemuse.
Konstantse mahu juures õhk aga ei tööta. Seetõttu on siseenergia muutus võrdeline selle temperatuuri muutusega. Konstantse rõhuga protsessi soojusmahtuvuse suhe konstantse mahuga protsessi soojusmahtuvusse on osa adiabaatilise protsessi valemist. Seda tähistatakse kreeka tähega gamma.
Ajaloost
Mõisted "soojusmaht" ja "soojuse hulk" ei kirjelda nende olemust kuigi hästi. See on tingitud asjaolust, et nad jõudsid kaasaegsesse teadusesse XVIII sajandil populaarsest kaloriteooriast. Selle teooria järgijad pidasid soojust mingiks kehades sisalduvaks mõõtmatuks aineks. Seda ainet ei saa hävitada ega luua. Kehade jahtumist ja soojendamist seletati vastavalt kalorisisalduse vähenemise või tõusuga. Aja jooksul tunnistati see teooria vastuvõetamatuks. Ta ei osanud seletada, miks tekib kehale erineva soojushulga ülekandmisel sama siseenergia muutus ja see sõltub ka keha tööst.
Under erisoojus ained mõistavad soojushulka, mis tuleb teatada või lahutada aine ühikust (1 kg, 1 m 3, 1 mol), et muuta selle temperatuuri ühe kraadi võrra.
Sõltuvalt antud aine ühikust eristatakse järgmisi spetsiifilisi soojusmahtuvusi:
Massi soojusmahtuvus FROM, 1 kg gaasi kohta, J/(kg∙K);
molaarne soojusmahtuvus µC, viitab 1 kmoolile gaasile, J/(kmol∙K);
Mahuline soojusmaht FROM', viitab 1 m 3 gaasile, J / (m 3 ∙K).
Erisoojusvõimsused on omavahel seotud seosega:
kus υ n- gaasi erimaht normaaltingimustes (n.o.), m 3 /kg; µ - gaasi molaarmass, kg/kmol.
Ideaalse gaasi soojusmahtuvus sõltub soojuse etteandmise (või eemaldamise) protsessi iseloomust, gaasi aatomilisusest ja temperatuurist (reaalsete gaaside soojusmahtuvus sõltub ka rõhust).
Massi isobaari seos C P ja isohooriline C V Soojusvõimsused määratakse Mayeri võrrandiga:
C P - C V = R, (1.2)
kus R- gaasikonstant, J/(kg∙K).
Ideaalse gaasi kuumutamisel konstantse mahuga suletud anumas kulub soojust ainult selle molekulide liikumisenergia muutmisele ja konstantsel rõhul kuumutamisel toimub gaasi paisumise tõttu samaaegselt ka välisjõudude vastu töö. .
Molaarsete soojusvõimsuste jaoks on Mayeri võrrand järgmine:
µС р - µС v = µR, (1.3)
kus uR\u003d 8314J / (kmol∙K) - universaalne gaasikonstant.
Ideaalne gaasi maht V n, taandatuna tavatingimustele, määratakse järgmisest seosest:
![]() (1.4)
(1.4)
kus R n- rõhk normaalsetes tingimustes, R n= 101325 Pa = 760 mm Hg; T n- temperatuur normaalsetes tingimustes, T n= 273,15K; P t, V t, T t– gaasi töörõhk, maht ja temperatuur.
Tähistatakse isobaari soojusmahtuvuse ja isohoorilise soojusmahtuvuse suhet k ja helistada adiabaatiline eksponent:
![]() (1.5)
(1.5)
Alates (1.2) ja võttes arvesse (1.5) saame:
Täpsete arvutuste jaoks määratakse keskmine soojusmahtuvus järgmise valemiga:
![]() (1.7)
(1.7)
Erinevate seadmete soojusarvutustes määratakse sageli gaaside soojendamiseks või jahutamiseks vajalik soojushulk:
Q = cm∙(t 2 - t 1), (1.8)
Q = C′∙V n∙(t 2 - t 1), (1.9)
kus V n on gaasi maht n.c. juures, m 3 .
Q = µC∙ν∙(t 2 - t 1), (1.10)
kus ν on gaasi kogus, kmol.
Soojusmahtuvus. Soojusvõimsuse kasutamine protsesside kirjeldamiseks suletud süsteemides
Vastavalt võrrandile (4.56) saab soojust määrata, kui on teada süsteemi entroopia S muutus. Kuid tõsiasi, et entroopiat ei saa otseselt mõõta, tekitab mõningaid komplikatsioone, eriti isohooriliste ja isobaariliste protsesside kirjeldamisel. Katseliselt mõõdetud koguse abil on vaja määrata soojushulk.
Süsteemi soojusmahtuvus võib olla selline suurus. Kõige üldisem soojusmahtuvuse definitsioon tuleneb termodünaamika esimese seaduse avaldisest (5.2), (5.3). Selle põhjal määratakse võrrandiga süsteemi C mis tahes suutlikkus vormi m töö suhtes
C m = dA m / dP m = P m d e g m / dP m, (5.42)
kus C m on süsteemi võimsus;
P m ja g m on vastavalt üldistatud potentsiaal ja vormi m oleku koordinaat.
Väärtus C m näitab, kui palju m-tüüpi tööd tuleb etteantud tingimustes teha, et muuta süsteemi m-ndat üldistatud potentsiaali selle mõõtühiku kohta.
Süsteemi võimsuse kontseptsiooni seoses konkreetse tööga termodünaamikas kasutatakse laialdaselt ainult siis, kui kirjeldatakse süsteemi ja keskkonna vahelist soojuslikku vastasmõju.
Süsteemi võimsust soojuse suhtes nimetatakse soojusmahtuvuseks ja see saadakse võrdsusega
C \u003d d e Q / dT \u003d Td e S soe / dT. (5.43)
Sellel viisil, soojusmahtuvust saab määratleda kui soojushulka, mis tuleb süsteemi edastada, et muuta selle temperatuuri ühe kelvini võrra.
Soojusmahtuvus, nagu siseenergia ja entalpia, on aine hulgaga võrdeline ulatuslik suurus. Praktikas kasutatakse aine massiühiku soojusmahtuvust - erisoojus ja soojusmahtuvus aine mooli kohta, molaarne soojusmahtuvus. Erisoojusmahtuvust SI-s väljendatakse J/(kg·K) ja molaarset soojusmahtuvust J/(mol·K).
Eri- ja molaarsed soojusvõimsused on seotud seosega:
C mol \u003d C võita M, (5,44)
kus M on aine molekulmass.
Eristama tegelik (diferentsiaalne) soojusmahtuvus, mis on määratud võrrandist (5.43) ja kujutab soojuse elementaarset suurenemist lõpmata väikese temperatuurimuutusega, ja keskmine soojusmahtuvus mis on soojuse koguhulga ja kogu temperatuurimuutuse suhe selles protsessis:
Q/DT . (5.45)
Tõelise ja keskmise erisoojusvõimsuse vaheline seos määratakse seosega
Konstantsel rõhul või mahul omandab soojus ja vastavalt ka soojusmahtuvus olekufunktsiooni omadused, s.t. muutuvad süsteemi tunnusteks. Just neid soojusmahtuvusi – isobaarilist C P (konstantsel rõhul) ja isohoorset C V (konstantsel ruumalal) kasutatakse termodünaamikas enim.
Kui süsteemi köetakse konstantsel mahul, siis vastavalt avaldisele (5.27) kirjutatakse isohooriline soojusmahtuvus C V järgmiselt.
C V = ![]() . (5.48)
. (5.48)
Kui süsteemi kuumutatakse konstantsel rõhul, siis vastavalt võrrandile (5.32) kuvatakse isobaariline soojusmahtuvus C P
C P = ![]() . (5.49)
. (5.49)
Et leida seost С Р ja С V vahel, on vaja eristada avaldist (5.31) temperatuuri suhtes. Ideaalse gaasi ühe mooli kohta võib seda avaldist, võttes arvesse võrrandit (5.18), esitada järgmiselt
H=U+pV=U+RT. (5.50)
dH/dT = dU/dT + R, (5,51)
ning isobaarilise ja isohoorilise soojusmahtuvuse erinevus ühe mooli ideaalse gaasi kohta on arvuliselt võrdne universaalse gaasikonstandiga R:
C P - C V \u003d R. (5,52)
Soojusmaht konstantsel rõhul on alati suurem kui soojusmahtuvus konstantsel ruumalal, kuna aine kuumutamisega konstantsel rõhul kaasneb gaasi paisumine.
Kasutades ideaalse üheaatomilise gaasi siseenergia avaldist (5.21), saame selle soojusmahtuvuse väärtuse ideaalse üheaatomilise gaasi ühe mooli kohta:
C V \u003d dU / dT \u003d d (3/2 RT) dT \u003d 3/2 R "12,5 J / (mol K); (5,53)
C Р \u003d 3 / 2R + R \u003d 5/2 R \u003e 20,8 J / (mol K). (5,54)
Seega ei sõltu üheaatomiliste ideaalgaaside puhul C V ja C p temperatuurist, kuna kogu tarnitud soojusenergia kulutatakse ainult translatsioonilise liikumise kiirendamiseks. Polüaatomiliste molekulide puhul võib koos translatsioonilise liikumise muutumisega toimuda ka muutus pöörlevas ja vibratsioonilises molekulisiseses liikumises. Kaheaatomiliste molekulide puhul võetakse tavaliselt arvesse pöörlevat liikumist, mille tulemusena on nende soojusmahtuvuse arvväärtused:
C V \u003d 5/2 R "20,8 J / (mol K); (5,55)
C p \u003d 5/2 R + R = 7/2 R = 29,1 J / (mol K). (5,56)
Möödaminnes puudutame teistes (v.a gaasilistes) agregaatides olevate ainete soojusmahtuvusi. Tahkete keemiliste ühendite soojusmahtuvuse hindamiseks kasutatakse sageli ligikaudset Neumanni ja Koppi liitereeglit, mille kohaselt on tahkes olekus keemiliste ühendite molaarne soojusmahtuvus võrdne selles sisalduvate elementide aatomsoojusvõimsuste summaga. see ühend. Seega saab keerulise keemilise ühendi soojusmahtuvust, võttes arvesse Dulongi ja Petiti reegleid, hinnata järgmiselt:
C V \u003d 25n J / (mol K), (5,57)
kus n on aatomite arv ühendite molekulides.
Vedelike ja tahkete ainete soojusmahtuvus sulamistemperatuuri (kristalliseerumise) temperatuuril on peaaegu võrdne. Normaalse keemistemperatuuri lähedal on enamiku orgaaniliste vedelike erisoojusmaht 1700 - 2100 J/kg·K. Nende faasisiirdetemperatuuride vaheaegadel võib vedeliku soojusmahtuvus oluliselt erineda (olenevalt temperatuurist). Üldiselt on tahkete ainete soojusmahtuvuse sõltuvus temperatuurist vahemikus 0–290K enamikul juhtudel hästi esindatud poolempiirilise Debye võrrandiga (kristallvõre jaoks) madala temperatuuriga piirkonnas.
C P » C V = eT 3 , (5,58)
milles proportsionaalsuskoefitsient (e) sõltub aine olemusest (empiiriline konstant).
Gaaside, vedelike ja tahkete ainete soojusmahtuvuse sõltuvust temperatuurist tavalistel ja kõrgetel temperatuuridel väljendatakse tavaliselt empiiriliste võrranditega, mis on astmeridade kujul:
C P \u003d a + bT + cT 2 (5,59)
C P \u003d a + bT + c "T -2, (5,60)
kus a, b, c ja c" on empiirilised temperatuurikoefitsiendid.
Tulles tagasi suletud süsteemides toimuvate protsesside kirjeldamise juurde soojusmahtuvuste meetodil, paneme kirja mõned punktis 5.1 toodud võrrandid veidi teistsugusel kujul.
Isokooriline protsess. Väljendades siseenergia (5.27) soojusmahtuvusena, saame
dU V \u003d dQ V \u003d U 2 - U 1 \u003d C V dT = C V dT. (5,61)
Arvestades, et ideaalse gaasi soojusmahtuvus ei sõltu temperatuurist, saab võrrandi (5.61) kirjutada järgmiselt:
DU V \u003d Q V \u003d U 2 - U 1 \u003d C V DT. (5,62)
Reaalsete ühe- ja mitmeaatomiliste gaaside integraali (5.61) väärtuse arvutamiseks on vaja teada tüübi (5.59) või (5.60) funktsionaalse sõltuvuse C V = f(T) spetsiifilist vormi.
isobaarne protsess. Aine gaasilise oleku jaoks kirjutatakse selle protsessi termodünaamika esimene seadus (5.29), võttes arvesse paisumistööd (5.35) ja kasutades soojusmahtuvuste meetodit, järgmiselt:
Q P \u003d C V DT + RDT \u003d C P DT \u003d DH (5,63)
Q P = DH P = H 2 - H 1 \u003d C P dT. (5,64)
Kui süsteem on ideaalne gaas ja soojusmahtuvus C P ei sõltu temperatuurist, muutub seos (5.64) väärtuseks (5.63). Reaalset gaasi kirjeldava võrrandi (5.64) lahendamiseks on vaja teada sõltuvuse C p = f(T) spetsiifilist kuju.
isotermiline protsess. Ideaalse gaasi siseenergia muutus konstantsel temperatuuril toimuvas protsessis
dU T = C V dT = 0. (5,65)
adiabaatiline protsess. Kuna dU \u003d C V dT, siis ühe mooli ideaalse gaasi korral on siseenergia muutus ja tehtud töö vastavalt võrdsed:
DU = C V dT = C V (T 2 - T 1); (5,66)
Ja karusnahk \u003d -DU \u003d C V (T 1 - T 2). (5,67)
Erinevaid termodünaamilisi protsesse iseloomustavate võrrandite analüüs järgmistel tingimustel: 1) p = const; 2) V = konst; 3) T = const ja 4) dQ = 0 näitab, et neid kõiki saab esitada üldvõrrandiga:
pV n = konst. (5,68)
Selles võrrandis võib eksponent "n" võtta erinevate protsesside jaoks väärtusi vahemikus 0 kuni ¥:
1. isobaarne (n = 0);
2. isotermiline (n = 1);
3. isohooriline (n = ¥);
4. adiabaatiline (n = g; kus g = C Р /C V on adiabaatiline koefitsient).
Saadud seosed kehtivad ideaalse gaasi jaoks ja on selle olekuvõrrandi tagajärg ning vaadeldavad protsessid on reaalsete protsesside erilised ja piiravad ilmingud. Reaalsed protsessid on reeglina vahepealsed, kulgevad suvaliste väärtustega "n" ja neid nimetatakse polütroopseteks protsessideks.
Kui võrrelda vaadeldavates termodünaamilistes protsessides tekkiva ideaalse gaasi paisumistööd ruumala muutusega V 1-lt V 2-le, siis, nagu on näha jooniselt fig. 5.2, suurim paisutustöö tehakse isobaarses protsessis, väikseim - isotermilises ja veelgi väiksem - adiabaatilises protsessis. Isohoorilise protsessi puhul on töö null.
Riis. 5.2. P = f (V) - sõltuvus erinevatest termodünaamilistest protsessidest (varjutatud alad iseloomustavad paisumistööd vastavas protsessis)
Vaadeldakse õhu peamisi füüsikalisi omadusi: õhu tihedus, selle dünaamiline ja kinemaatiline viskoossus, erisoojusmahtuvus, soojusjuhtivus, soojusdifuusioon, Prandtli arv ja entroopia. Õhu omadused on toodud tabelites sõltuvalt temperatuurist normaalsel atmosfäärirõhul.
Õhu tihedus versus temperatuur
Esitatakse üksikasjalik tabel kuiva õhu tiheduse väärtuste kohta erinevatel temperatuuridel ja normaalsel atmosfäärirõhul. Mis on õhu tihedus? Õhu tihedust saab analüütiliselt määrata, jagades selle massi mahuga, mida see hõivab. etteantud tingimustel (rõhk, temperatuur ja niiskus). Selle tihedust on võimalik arvutada ka ideaalse gaasi olekuvalemi võrrandi abil. Selleks peate teadma õhu absoluutset rõhku ja temperatuuri, samuti selle gaasikonstanti ja molaarmahtu. See võrrand võimaldab teil arvutada õhu tihedust kuivas olekus.
Praktikas, et teada saada, milline on õhu tihedus erinevatel temperatuuridel, on mugav kasutada valmis tabeleid. Näiteks antud õhuõhu tiheduse väärtuste tabel sõltuvalt selle temperatuurist. Tabelis olevat õhutihedust väljendatakse kilogrammides kuupmeetri kohta ja see on antud temperatuurivahemikus miinus 50 kuni 1200 kraadi Celsiuse järgi normaalsel atmosfäärirõhul (101325 Pa).
| t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 | t, °С | ρ, kg/m3 |
|---|---|---|---|---|---|---|---|
| -50 | 1,584 | 20 | 1,205 | 150 | 0,835 | 600 | 0,404 |
| -45 | 1,549 | 30 | 1,165 | 160 | 0,815 | 650 | 0,383 |
| -40 | 1,515 | 40 | 1,128 | 170 | 0,797 | 700 | 0,362 |
| -35 | 1,484 | 50 | 1,093 | 180 | 0,779 | 750 | 0,346 |
| -30 | 1,453 | 60 | 1,06 | 190 | 0,763 | 800 | 0,329 |
| -25 | 1,424 | 70 | 1,029 | 200 | 0,746 | 850 | 0,315 |
| -20 | 1,395 | 80 | 1 | 250 | 0,674 | 900 | 0,301 |
| -15 | 1,369 | 90 | 0,972 | 300 | 0,615 | 950 | 0,289 |
| -10 | 1,342 | 100 | 0,946 | 350 | 0,566 | 1000 | 0,277 |
| -5 | 1,318 | 110 | 0,922 | 400 | 0,524 | 1050 | 0,267 |
| 0 | 1,293 | 120 | 0,898 | 450 | 0,49 | 1100 | 0,257 |
| 10 | 1,247 | 130 | 0,876 | 500 | 0,456 | 1150 | 0,248 |
| 15 | 1,226 | 140 | 0,854 | 550 | 0,43 | 1200 | 0,239 |
25°C juures on õhu tihedus 1,185 kg/m 3 . Kuumutamisel õhu tihedus väheneb - õhk paisub (selle erimaht suureneb). Temperatuuri tõusuga, näiteks kuni 1200°C, saavutatakse väga madal õhutihedus, mis võrdub 0,239 kg/m 3 , mis on 5 korda väiksem kui selle väärtus toatemperatuuril. Üldjuhul võimaldab kuumutamise vähenemine sellisel protsessil nagu loomulik konvektsioon toimuda ja seda kasutatakse näiteks lennunduses.
Kui võrrelda õhu tihedust suhtega, siis on õhk kolme suurusjärgu võrra kergem - temperatuuril 4 ° C on vee tihedus 1000 kg / m 3 ja õhu tihedus 1,27 kg / m 3. Samuti on vaja märkida õhutiheduse väärtus tavatingimustes. Gaaside normaalsed tingimused on need, mille korral nende temperatuur on 0 ° C ja rõhk on võrdne normaalse atmosfäärirõhuga. Seega vastavalt tabelile õhutihedus normaalsetes tingimustes (NU juures) on 1,293 kg / m 3.
Õhu dünaamiline ja kinemaatiline viskoossus erinevatel temperatuuridel
Soojusarvutuste tegemisel on vaja teada õhu viskoossuse väärtust (viskoossustegur) erinevatel temperatuuridel. See väärtus on vajalik Reynoldsi, Grashofi, Rayleighi arvude arvutamiseks, mille väärtused määravad selle gaasi voolurežiimi. Tabelis on näidatud dünaamiliste koefitsientide väärtused μ ja kinemaatiline ν õhu viskoossus temperatuurivahemikus -50 kuni 1200°C atmosfäärirõhul.
Õhu viskoossus suureneb oluliselt temperatuuri tõustes. Näiteks õhu kinemaatiline viskoossus on võrdne 15,06 10 -6 m 2 / s temperatuuril 20 ° C ja temperatuuri tõusuga 1200 ° C-ni muutub õhu viskoossus 233,7 10 -6 m 2 / s, see tähendab, et see suureneb 15,5 korda! Õhu dünaamiline viskoossus temperatuuril 20°C on 18,1·10 -6 Pa·s.
Õhu kuumutamisel suurenevad nii kinemaatilise kui ka dünaamilise viskoossuse väärtused. Need kaks suurust on omavahel seotud õhutiheduse väärtuse kaudu, mille väärtus selle gaasi kuumutamisel väheneb. Õhu (ja ka teiste gaaside) kinemaatilise ja dünaamilise viskoossuse suurenemine kuumutamisel on seotud õhumolekulide intensiivsema vibratsiooniga nende tasakaaluoleku ümber (vastavalt MKT-le).
| t, °С | μ 10 6, Pa s | ν 10 6, m 2 / s | t, °С | μ 10 6, Pa s | ν 10 6, m 2 / s | t, °С | μ 10 6, Pa s | ν 10 6, m 2 / s |
|---|---|---|---|---|---|---|---|---|
| -50 | 14,6 | 9,23 | 70 | 20,6 | 20,02 | 350 | 31,4 | 55,46 |
| -45 | 14,9 | 9,64 | 80 | 21,1 | 21,09 | 400 | 33 | 63,09 |
| -40 | 15,2 | 10,04 | 90 | 21,5 | 22,1 | 450 | 34,6 | 69,28 |
| -35 | 15,5 | 10,42 | 100 | 21,9 | 23,13 | 500 | 36,2 | 79,38 |
| -30 | 15,7 | 10,8 | 110 | 22,4 | 24,3 | 550 | 37,7 | 88,14 |
| -25 | 16 | 11,21 | 120 | 22,8 | 25,45 | 600 | 39,1 | 96,89 |
| -20 | 16,2 | 11,61 | 130 | 23,3 | 26,63 | 650 | 40,5 | 106,15 |
| -15 | 16,5 | 12,02 | 140 | 23,7 | 27,8 | 700 | 41,8 | 115,4 |
| -10 | 16,7 | 12,43 | 150 | 24,1 | 28,95 | 750 | 43,1 | 125,1 |
| -5 | 17 | 12,86 | 160 | 24,5 | 30,09 | 800 | 44,3 | 134,8 |
| 0 | 17,2 | 13,28 | 170 | 24,9 | 31,29 | 850 | 45,5 | 145 |
| 10 | 17,6 | 14,16 | 180 | 25,3 | 32,49 | 900 | 46,7 | 155,1 |
| 15 | 17,9 | 14,61 | 190 | 25,7 | 33,67 | 950 | 47,9 | 166,1 |
| 20 | 18,1 | 15,06 | 200 | 26 | 34,85 | 1000 | 49 | 177,1 |
| 30 | 18,6 | 16 | 225 | 26,7 | 37,73 | 1050 | 50,1 | 188,2 |
| 40 | 19,1 | 16,96 | 250 | 27,4 | 40,61 | 1100 | 51,2 | 199,3 |
| 50 | 19,6 | 17,95 | 300 | 29,7 | 48,33 | 1150 | 52,4 | 216,5 |
| 60 | 20,1 | 18,97 | 325 | 30,6 | 51,9 | 1200 | 53,5 | 233,7 |
Märkus: ole ettevaatlik! Õhu viskoossus on antud astmega 10 6 .
Õhu erisoojusmahtuvus temperatuuridel -50 kuni 1200°С
Esitatakse õhu erisoojusmahtuvuse tabel erinevatel temperatuuridel. Tabelis toodud soojusmahtuvus on antud konstantsel rõhul (õhu isobaariline soojusmahtuvus) temperatuurivahemikus miinus 50 kuni 1200°C kuiva õhu puhul. Mis on õhu erisoojusmahtuvus? Erisoojusvõimsuse väärtus määrab soojushulga, mis tuleb anda ühele kilogrammile konstantsel rõhul olevale õhule, et selle temperatuur tõuseks 1 kraadi võrra. Näiteks 20 °C juures on 1 kg selle gaasi soojendamiseks 1 °C võrra isobaarses protsessis vaja 1005 J soojust.
Õhu erisoojusmahtuvus suureneb selle temperatuuri tõustes.Õhu massi soojusmahtuvuse sõltuvus temperatuurist ei ole aga lineaarne. Vahemikus -50 kuni 120°C selle väärtus praktiliselt ei muutu – nendes tingimustes on õhu keskmine soojusmahtuvus 1010 J/(kg deg). Tabeli järgi on näha, et temperatuur hakkab oluliselt mõjutama alates väärtusest 130°C. Kuid õhutemperatuur mõjutab selle erisoojusmahtu palju nõrgemini kui viskoossus. Nii et 0 kuni 1200°C kuumutamisel suureneb õhu soojusmahtuvus vaid 1,2 korda – 1005 kuni 1210 J/(kg deg).
Tuleb märkida, et niiske õhu soojusmahtuvus on suurem kui kuiva õhu oma. Kui võrrelda õhku, siis on ilmne, et vee väärtus on suurem ja veesisaldus õhus toob kaasa erisoojuse tõusu.
| t, °С | C p , J/(kg kraadi) | t, °С | C p , J/(kg kraadi) | t, °С | C p , J/(kg kraadi) | t, °С | C p , J/(kg kraadi) |
|---|---|---|---|---|---|---|---|
| -50 | 1013 | 20 | 1005 | 150 | 1015 | 600 | 1114 |
| -45 | 1013 | 30 | 1005 | 160 | 1017 | 650 | 1125 |
| -40 | 1013 | 40 | 1005 | 170 | 1020 | 700 | 1135 |
| -35 | 1013 | 50 | 1005 | 180 | 1022 | 750 | 1146 |
| -30 | 1013 | 60 | 1005 | 190 | 1024 | 800 | 1156 |
| -25 | 1011 | 70 | 1009 | 200 | 1026 | 850 | 1164 |
| -20 | 1009 | 80 | 1009 | 250 | 1037 | 900 | 1172 |
| -15 | 1009 | 90 | 1009 | 300 | 1047 | 950 | 1179 |
| -10 | 1009 | 100 | 1009 | 350 | 1058 | 1000 | 1185 |
| -5 | 1007 | 110 | 1009 | 400 | 1068 | 1050 | 1191 |
| 0 | 1005 | 120 | 1009 | 450 | 1081 | 1100 | 1197 |
| 10 | 1005 | 130 | 1011 | 500 | 1093 | 1150 | 1204 |
| 15 | 1005 | 140 | 1013 | 550 | 1104 | 1200 | 1210 |
Soojusjuhtivus, soojusdifuusioon, õhu Prandtl arv
Tabelis on toodud sellised atmosfääriõhu füüsikalised omadused nagu soojusjuhtivus, termiline difusioon ja selle Prandtli arv sõltuvalt temperatuurist. Kuiva õhu termofüüsikalised omadused on antud vahemikus -50 kuni 1200°C. Tabeli järgi on näha, et õhu näidatud omadused sõltuvad oluliselt temperatuurist ja selle gaasi vaadeldavate omaduste temperatuurisõltuvus on erinev.
Transpordienergia (külmtransport) Õhuniiskus. Õhu soojusmahtuvus ja entalpiaÕhuniiskus. Õhu soojusmahtuvus ja entalpia
Atmosfääriõhk on kuiva õhu ja veeauru segu (0,2% kuni 2,6%). Seega võib õhku peaaegu alati pidada niiskeks.
Kuiva õhu ja veeauru mehaanilist segu nimetatakse niiske õhk või õhu/auru segu. Maksimaalne võimalik auruniiskuse sisaldus õhus m a.s. temperatuurist sõltuv t ja survet P segud. Kui see muutub t ja Põhk võib minna algselt küllastumata veeauruga küllastunud olekusse ja seejärel hakkab gaasimahus ja ümbritsevatel pindadel udu, härmatise või lumena välja langema liigne niiskus.
Peamised niiske õhu olekut iseloomustavad parameetrid on: temperatuur, rõhk, erimaht, niiskusesisaldus, absoluutne ja suhteline niiskus, molekulmass, gaasikonstant, soojusmahtuvus ja entalpia.
Vastavalt Daltoni seadusele gaasisegude kohta märja õhu üldrõhk (P) on kuiva õhu P c ja veeauru P p osarõhkude summa: P \u003d P c + P p.
Samamoodi määratakse niiske õhu maht V ja mass m suhetega:
V \u003d V c + V p, m \u003d m c + m p.
Tihedus ja niiske õhu erimaht (v) määratletud:
![]()
Niiske õhu molekulmass:
![]()
kus B on õhurõhk.
Kuna õhuniiskus kuivamise ajal pidevalt suureneb ja kuiva õhu hulk auru-õhu segus jääb muutumatuks, hinnatakse kuivatusprotsessi selle järgi, kuidas muutub veeauru kogus 1 kg kuiva õhu kohta ja kõik näitajad. auru-õhu segu (soojusmaht, niiskusesisaldus, entalpia jne) viitab 1 kg kuivale õhule niiskes õhus.
d \u003d m p / m c, g / kg või X \u003d m p / m c.
Absoluutne õhuniiskus- auru mass 1 m 3 niiskes õhus. See väärtus on arvuliselt võrdne .
Suhteline niiskus - on küllastumata õhu absoluutse niiskuse ja küllastunud õhu absoluutse niiskuse suhe antud tingimustes:
siin , kuid sagedamini on suhteline õhuniiskus antud protsentides.
Niiske õhu tiheduse puhul on seos tõene:
Erisoojus niiske õhk:
c \u003d c c + c p × d / 1000 \u003d c c + c p × X, kJ / (kg × ° С),
kus c c on kuiva õhu erisoojusmahtuvus, c c = 1,0;
c p - auru erisoojusmahtuvus; n = 1,8.
Kuiva õhu soojusmahtuvust konstantsel rõhul ja väikestes temperatuurivahemikes (kuni 100 ° C) võib ligikaudsete arvutuste jaoks pidada konstantseks, mis võrdub 1,0048 kJ / (kg × ° C). Ülekuumendatud auru puhul võib eeldada, et keskmine isobaarne soojusmahtuvus atmosfäärirõhul ja madalal ülekuumenemisastmel on konstantne ja võrdne 1,96 kJ/(kg×K).
Niiske õhu entalpia (i).- see on üks selle peamisi parameetreid, mida kasutatakse laialdaselt kuivatusseadmete arvutustes, peamiselt kuivatatud materjalide niiskuse aurustamiseks kulutatud soojuse määramiseks. Niiske õhu entalpia on seotud ühe kilogrammi kuiva õhuga auru-õhu segus ja seda defineeritakse kui kuiva õhu ja veeauru entalpiate summat, st.
i \u003d i c + i p × X, kJ / kg.
Segude entalpia arvutamisel peab iga komponendi entalpia lähtepunkt olema sama. Niiske õhu arvutamiseks võib eeldada, et vee entalpia on 0 o C juures null, siis arvestatakse ka kuiva õhu entalpia alates 0 o C, see tähendab, et i in \u003d c in * t \u003d 1,0048 t.
Labor nr 1
Massi isobaari määratlus
õhu soojusmahtuvus
Soojusmahtuvus on soojus, mis tuleb varustada aine ühikukogusega, et seda kuumutada 1 K võrra. Aine ühikukogust saab mõõta kilogrammides, kuupmeetrites tavalistes füüsikalistes tingimustes ja kilomoolides. Kilomool gaasi on gaasi mass kilogrammides, arvuliselt võrdne selle molekulmassiga. Seega on soojusmahtuvusi kolme tüüpi: mass c, J/(kg⋅K); maht c', J/(m3⋅K) ja molaarne, J/(kmol⋅K). Kuna kilomooli gaasi mass on μ korda suurem kui üks kilogramm, ei ole molaarse soojusmahtuvuse jaoks eraldi tähistust kasutusele võetud. Soojusvõimsuste vahelised seosed:
kus = 22,4 m3/kmol on ideaalse gaasi kilomooli maht normaalsetes füüsikalistes tingimustes; on gaasi tihedus normaalsetes füüsikalistes tingimustes, kg/m3.
Gaasi tegelik soojusmahtuvus on soojuse tuletis temperatuuri suhtes:
Gaasi tarnitav soojus sõltub termodünaamilisest protsessist. Seda saab määrata isohooriliste ja isobaarsete protsesside termodünaamika esimese seaduse alusel:
Siin on soojus, mis antakse isobaarses protsessis 1 kg gaasile; on gaasi siseenergia muutus; on gaaside töö välisjõudude vastu.
Sisuliselt formuleerib valem (4) termodünaamika 1. seaduse, millest järeldub Mayeri võrrand:
Kui panna = 1 K, siis see tähendab, et gaasikonstandi füüsikaline tähendus on 1 kg gaasi töö isobaarises protsessis, kui selle temperatuur muutub 1 K võrra.
Mayeri võrrand 1 kilomooli gaasi kohta on
kus = 8314 J/(kmol⋅K) on universaalne gaasikonstant.
Lisaks Mayeri võrrandile on gaaside isobaarilised ja isohoorsed massisoojusvõimsused omavahel seotud adiabaatilise indeksi k kaudu (tabel 1):
Tabel 1.1
Ideaalsete gaaside adiabaatiliste eksponentide väärtused
Gaaside aatomilisus | |
Monatoomilised gaasid | |
Kaheaatomilised gaasid | |
Kolme- ja mitmeaatomilised gaasid |
TÖÖ EESMÄRK
Teoreetiliste teadmiste kinnistamine termodünaamika põhiseadustest. Õhu soojusmahtuvuse määramise meetodi praktiline väljatöötamine energiabilansi alusel.
Õhu erimassi soojusmahtuvuse katseline määramine ja saadud tulemuse võrdlemine kontrollväärtusega.
1.1. Labori seadistuse kirjeldus
Paigaldus (joonis 1.1) koosneb messingist torust 1 siseläbimõõduga d =
= 0,022 m, mille otsas on soojusisolatsiooniga elektrikeris 10. Toru sees liigub õhuvool, mida toidetakse 3. Õhuvoolu saab juhtida ventilaatori kiirust muutes. Torusse 1 on paigaldatud täisrõhuga toru 4 ja staatilise ülerõhuga 5, mis on ühendatud manomeetritega 6 ja 7. Lisaks on torusse 1 paigaldatud termopaar 8, mis saab liikuda mööda ristlõiget samaaegselt täissurve toru. Termopaari EMF väärtus määratakse potentsiomeetriga 9. Läbi toru liikuva õhu soojenemist reguleeritakse laboratoorse autotransformaatori 12 abil, muutes küttekeha võimsust, mis määratakse ampermeetri 14 ja voltmeetri 13 näitude järgi. temperatuur küttekeha väljalaskeava juures määratakse termomeetriga 15.
1.2. EKSPERIMENTAALNE TEHNIKA
Küttekeha soojusvoog, W:
kus I on praegune, A; U – pinge, V; = 0,96; =
= 0,94 - soojuskao koefitsient.

Joon.1.1. Eksperimentaalse seadistuse skeem:
1 - toru; 2 - segaja; 3 – ventilaator; 4 - toru dünaamilise pea mõõtmiseks;
5 - haru toru; 6, 7 – diferentsiaalrõhumõõturid; 8 - termopaar; 9 - potentsiomeeter; 10 - isolatsioon;
11 - elektrikeris; 12 – labori autotransformaator; 13 - voltmeeter;
14 - ampermeeter; 15 - termomeeter
Õhuga tajutav soojusvoog, W:
kus m on õhu mass, kg/s; – katseline, õhu massiline isobaarne soojusmahtuvus, J/(kg K); – õhutemperatuur küttesektsiooni väljapääsu juures ja selle sissepääsu juures, °C.
Õhu mass, kg/s:
![]() . (1.10)
. (1.10)
Siin on keskmine õhu kiirus torus, m/s; d on toru siseläbimõõt, m; - õhu tihedus temperatuuril , mis leitakse valemiga, kg/m3:
![]() , (1.11)
, (1.11)
kus = 1,293 kg/m3 on õhu tihedus tavalistes füüsikalistes tingimustes; B – rõhk, mm. rt. st; - liigne staatiline õhurõhk torus, mm. vesi. Art.
Õhukiirused määratakse dünaamilise pea abil neljas võrdses osas, m/s:
kus on dünaamiline pea, mm. vesi. Art. (kgf/m2); g = 9,81 m/s2 on vaba langemise kiirendus.
Keskmine õhukiirus toruosas, m/s:
Õhu keskmine isobaarmassi soojusmahtuvus määratakse valemiga (1.9), millesse soojusvoog asendatakse võrrandiga (1.8). Õhu soojusmahtuvuse täpne väärtus keskmise õhutemperatuuri juures leitakse keskmiste soojusmahtude tabeli või empiirilise valemi järgi J / (kg⋅K):
![]() . (1.14)
. (1.14)
Katse suhteline viga, %:
![]() . (1.15)
. (1.15)
1.3. Eksperimendi läbiviimine ja töötlemine
mõõtmistulemused
Katse viiakse läbi järgmises järjestuses.
1. Laboristatiiv lülitatakse sisse ja pärast statsionaarse režiimi loomist võetakse järgmised näidud:
Dünaamiline õhurõhk toru võrdsete osade neljas punktis;
Liigne staatiline õhurõhk torus;
Vool I, A ja pinge U, V;
Sisendõhu temperatuur, °С (termopaar 8);
Väljalasketemperatuur, °С (termomeeter 15);
Õhurõhk B, mm. rt. Art.
Katset korratakse järgmise režiimi jaoks. Mõõtmistulemused on kantud tabelisse 1.2. Arvutused tehakse tabelis. 1.3.
Tabel 1.2
Mõõtmistabel
Väärtuse nimi | |||
Sisendõhu temperatuur, °C | |||
Väljuva õhu temperatuur, °C |
|||
Dünaamiline õhurõhk, mm. vesi. Art. | |||
Liigne staatiline õhurõhk, mm. vesi. Art. |
|||
Õhurõhk B, mm. rt. Art. |
|||
Pinge U, V |
Tabel 1.3
Arvutustabel
Koguste nimetus |
|
|||
Dünaamiline pea, N/m2 | ||||
Keskmine sisendvoolu temperatuur, °C |
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0