Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин , лизоцим .
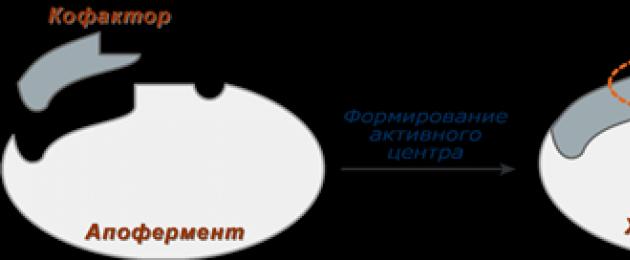
Сложные ферменты (холоферменты ) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент , и небелковую часть – кофактор . Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), различные пероксидазы (содержат гем), лактатдегидрогеназа (содержит Zn 2+), амилаза (содержит Ca2+ ).
Кофактор , в свою очередь, может называться коферментом (НАД+ , НАДФ+ , ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+ , Mg2+ , Ca2+ , Zn2+ ).
Деление на коферменты и простетические группы не всегда однозначно:
если связь кофактора с белком прочная, то в этом случае говорят о наличии простетической группы
,
но если в качестве кофактора выступает производное витамина – то его называют коферментом
, независимо от прочности связи.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами , т.е. состоять из одной субъединицы, и полимерами , состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.

Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.

Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см "Регуляция активности ферментов ").
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию . Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет .
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н 4) и 2 (H 3 M 1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H 1 M 3) и ЛДГ-5 (М 4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H 2 M 2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение .
Еще одним примером изоферментов является группа гексокиназ , которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа ), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
Ферменты (энзимы) - это высокоспецифичные белки, выполняющие функции биологических катализаторов. Катализатор - это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Условия необходимые для химического взаимодействия молекул, чтобы произошла химическая реакция:
- молекулы должны сблизиться (столкнуться). Но не всякое столкновение приводит к взаимодействию;
- необходимо, чтобы это столкновение стало эффективным - завершилось бы химическим превращением. Обязательное условие для эффективности столкновения - чтобы запас энергии молекул в момент столкновения был не ниже энергетического уровня реакции.
Энергетический уровень реакции - это запас энергии, которым должны обладать молекулы, чтобы их столкновение стало эффективным (чтобы произошла химическая реакция). Этот запас энергии является постоянной характеристикой (константой) для каждой данной реакции.
Средний энергетический уроовень молекул - это энергия, которой обладает большинство молекул системы в данный момент времени. Эта средняя величина энергетического запаса, которая характеризует совокупность данных молекул в данных конкретных условиях (температура, давление и другие). Энергетический запас молекул - это понятие статистическое (вероятностное). Молекулы постоянно находятся в тепловом движении. Поэтому энергетический запас каждой из них все время изменяется, колеблется около величины, которая и представляет собой средний энергетический уровень молекул.
В каждый момент времени наибольшая доля молекул данной совокупности обладает именно таким средним запасом энергии. И чем больше отличается энергия определенной группы молекул от среднего энергетического уровня (в любую сторону), тем малочисленнее эта группа. В любой совокупности молекул ее определенная доля обладает такой энергией, которая выше среднего энергетического уровня и достаточна для протекания химической реакции.
Разность между средним энергетическим уровнем молекул и энергетическим уровнем реакции называется энергетическим барьером или энергией активациии. Чем больше эта энергия активации, тем медленнее идет химическая реакция.
Как ускорить химическую реакцию? Повышение среднего энергетического уровня молекул (повышение температуры, давления и других параметров среды, которое используют на химических заводах и фабриках) невозможно для живых организмов, которые нормально функционируют только при постоянных значениях температуры, давления и других параметров. Невозможен и другой путь - уменьшение энергии активации путем снижения энергетического уровня реакции, поскольку эта величина является постоянной характеристикой данной реакции.
Поэтому, только явление катализа (применение катализаторов) может обеспечить ускорение химических реакций в живых организмах. Рассмотрим две реакции.
В общем случае энергии активации реакций 1, 2а и 2б не совпадают между собой, и все разнообразие возможных вариантов можно разделить на две группы:
- Еакт2а и/или Еакт2б больше, чем Еакт1.
- Во всех таких случаях реакция образования вещества "АВ" с участием вещества "К" пойдет медленнее. Значит, вещество "К" является ингибитором (замедлителем) этой реакции;
- Еакт2а и/или Еакт2б меньше, чем Еакт1.
В этих случаях реакция с участием вещества "К" пойдет быстрее, чем без него. Значит, вещество "К" является катализатором (ускорителем) данной химической реакции.
Катализатор - это вещество, которое направляет реакцию по такому обходному пути, на котором энергетические барьеры ниже.
Энергия, которую надо затратить для "подъема" молекулы от среднего энергетического уровня реакции, полностью компенсируется при самостоятельном "скатывании" молекулы по склону "вулкана". При дальнейшем самопроизвольном "скатывании" до подошвы "вулкана" (т. е., до среднего энергетического уровня молекул, которые являются продуктами данной реакции). Энергия, которая при этом выделяется, называется "энергетический итог реакции".
Энергетический итог реакции - это разность между энергетическим уровнем исходных веществ (субстратов) и энергетическим уровнем продуктов реакции.
Энергетический итог реакции не зависит от пути, по которому идет реакция (он одинаков и для реакции с участием катализатора, и для реакции без его участия). Он не зависит и от величины энергии активации - от нее зависит только скорость протекания каждого из путей этой реакции.
Вывод из уравнения Аррениуса: так как энергия активации в этом уравнении входит в показатель степени, то даже маленькое изменение энергии активации приводит к большим изменениям скорости реакции.
Общие свойства катализаторов
- Катализаторы сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает и без них.
- Не влияют на энергетический итог реакции.
- В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени, из чего следует, что катализаторы:
- не влияют на направленность обратимой реакции, которая определяется только соотношением концентраций исходных веществ (субстратов) и конечных продуктов;
- не влияют на положение равновесия обратимой реакции, а только ускоряют его достижение.
Особенности ферментов как биологических катализаторов
Ферменты обладают всеми общими свойствами обычных катализаторов. Но, по сравнению с обычными катализаторами, все ферменты являются белками. Поэтому они обладают особенностями, отличающими их от обычных катализаторов.
Эти особенности ферментов, как биологических катализаторов, иногда называют общими свойствами ферментов. К ним относится следующее.
- Высокая эффективность действия. Ферменты могут ускорять реакцию в 10 8 -10 12 раз.
- Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия).
- Высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды - температуре, рН, ионной силе раствора и т.д.
- Высокая чувствительность к химическим реагентам.
- Высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу.
Строение ферментов
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента.
Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
В его пределах различают Адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр.
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K.
Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории индуцированного соответствия (или наведенного соответствия), которая преодолела ограниченность существовавшей ранее теории ключа и замка (жесткого соответствия структуры субстрата структуре адсорбционного центра).
Очевидно, что именно структура адсорбционного центра определяет субстратную специфичность фермента, т. е. требования фермента к молекуле химического вещества, чтобы она могла стать для него подходящим субстратом.
Некоторые вещества, обладающие подходящими характеристиками (т. е. похожие на субстрат), могут тоже связываться с адсорбционным центром фермента. Но если в их молекуле нет такой химической связи, на которую может воздействовать каталитический центр данного фермента, то химических превращений этого вещества не произойдет. Занимая активный центр фермента, такие молекулы блокируют его работу, т. е. являются обратимыми ингибиторами данного фермента (обратимыми, потому что связаны с ферментом слабыми типами связей). Повышая концентрацию субстрата, их можно вытеснить из адсорбционного центра. Поэтому такие ингибиторы называют конкурентными. Они конкурируют с истинным субстратом данного фермента за обладание его адсорбционным центром.
Аллостерическими центрами называют такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит - обратимо) с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами или аллостерическими ингибаторами данного фермента.
Термин "аллостерический" (т. е. "имеющий иную пространственную структуру") появился в связи с тем, что эти эффекторы по своей пространственной конфигурации совсем не похожи на молекулу субстрата данного фермента (и потому не могут связываться с активным центром фермента). Было сделано заключение, что и аллостерический центр не похож по своей структуре на активный центр фермента.
Аллостерические центры найдены не у всех ферментов. Они есть у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ. Некоторые искусственно синтезированные лекарства обладают биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.
Специфичность ферментов
Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия.
Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
- абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата;
- относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов;
- стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
Классификация ферментов
I класс - оксидоредуктазы
К данному классу относятся ферменты, катализирующие окислительно-восстановительные реакции. При окислении может происходить либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу. В зависимости от способа окисления различают следующие подклассы оксидоредуктаз:
- дегидрогеназы. Катализируют реакции, при которых происходит отнятие водорода от окисляемого вещества;
- оксигеназы. Ферменты этого подкласса катализируют включение кислорода в окисляемое вещество:
- монооксигеназы - включают один атом кислорода в окисляемое вещество;
- диоксигеназы - включают 2 атома кислорода в окисляемое вещество. Часто это сопровождается разрывом циклической структуры. По месту разрыва связи присоединяются атомы кислорода.
II класс - трансферазы
Катализируют реакции переноса химических групп с молекулы одного вещества на молекулу другого вещества.
III класс - гидролазы
Катализируют реакции разрушения химических связей с участием воды.
IV класс - лиазы
Катализируют реакции разрушения химических связей без участия воды.
V класс - изомеразы
Катализируют реакции изомерных превращений.
VI класс - лигазы (сингазы, синтетазы)
Катализируют реакции синтеза.
Основные этапы ферментативного катализа
Любая ферментативная реакция протекает через ряд промежуточных стадий.
Различают три основных этапа ферментативного катализа.
1 этап. Ориентировочная сорбция субстрата на активном центре фермента с образованием обратимого E-S комплекса (фермент-субстратного). На этом этапе происходит взаимодействие адсорбционного центра фермента с молекулой субстрата. При этом и субстрат подвергается конформационной перестройке. Все это происходит за счет возникновения слабых типов связей между субстратом и адсорбционным центром фермента. В результате этого молекула субстрата подается на каталитический центр в наиболее удобном для него положении. Этот этап является легко обратимым, потому что здесь участвуют только слабые типы связей. Кинетическая характеристика 1-го этапа ферментативного катализа - константа Михаэлиса (Км).
2 этап. Химические превращения молекулы субстрата в составе фермент-субстратного комплекса с образованием комплекса фермента с химически преобразованным субстратом. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает значительно медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом. Значит, скорость ферментативного процесса в целом характеризуется величиной k+2, которая является почти всегда самой маленькой из всех частных констант скоростей. Кинетическая характеристика 2-го этапа - максимальная скорость (Vmax).
3 этап. Десорбция готового продукта из его комплекса с ферментом. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
Специфика ферментативного катализа
Любая химическая реакция характеризуется, кроме принципиальной возможности ее протекания (обусловленной законами термодинамики), скоростью процесса. Скорость ферментативной реакции - изменение [S] или [P] в единицу времени. Измерив ее скорость, т. е. скорость в присутствии фермента, мы должны измерить скорость реакции и в отсутствии фермента (спонтанно протекающая реакция). Именно эта разность и характеризует работу фермента.
Измеряя скорость реакции всегда надо измерять начальную скорость процесса, т. е. скорость ферментативной реакции, в достаточно короткий промежуток времени, когда концентрация субстрата меняется, не настолько значительно, чтобы это отразилось на скорости процесса. Единицы измерения скорости реакции могут быть разными. Лучше пользоваться молярными единицами, а время - это минуты или секунды, реже часы. Поэтому скорость реакции может выражаться, например, в мкмоль/мин или ммоль/час. Величина скорости определяется законом действующих масс. В общем случае скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. В случае ферментативной кинетики - одно из реагирующих веществ - фермент, концентрация которого на много порядков меньше, чем концентрация субстрата. Это определяет некоторые особенности кинетики ферментативного катализа.
V = k+2 [E] x [S].
Зависимость скорости ферментативной реакции от концентрации ([E]) при постоянной и довольно большой концентрации субстрата ([S]>>[E], [S]=const).
Отклонение от линейности графика при очень высокой концентрации фермента возникает из-за нехватки субстрата, поэтому снижается скорость поступления субстрата на активный центр фермента. Определять скорость ферментативной реакции надо только в том диапазоне концентраций фермента, в котором график линеен.
Линейность этого графика позволяет выразить его одной цифрой - тангенс угла наклона к оси абсцисс. Этот тангенс представляет собой величину активности фермента. Именно работа (эффективность) каждого фермента количественно характеризуется величиной его активности, т. е. величиной скорости ферментативной реакции в расчете на единицу количества фермента. Единицы активности могут быть различными: мкмоль S/мин.мг или мкмоль S/мин.мл сыворотки крови.
Молекулярная активность - это количество молекул субстрата, которые превращаются одной молекулой фермента за одну минуту при 30 °С и прочих оптимальных условиях. Преимущество этой единицы - в том, что можно сравнивать не только активность ферментов из разных источников, но и эффективность разных ферментов. Например, молекулярная активность фермента каталазы составляет 5 х 10 6 , а карбоангидразы - 36 х 10 6 .
Из линейности графика следует, что по скорости реакции можно судить о количестве фермента:
- катал - это количество фермента, которое обеспечивает превращение 1 моля субстрата за 1 с;
- юнит - это количество фермента, которое превращает 1 мкмоль субстрата за 1 мин. 1 юнит = 16,67 нкатал.
Зависимость скорости ферментативной реакции от концентрации субстрата при [E] = const и [S] >> [E]: чем выше концентрация субстрата, тем выше скорость реакции. Эта зависимость гиперболическая.
Предельное значение, к которому стремится гипербола - Vmax данной реакции - характеризует максимальную работоспособность фермента: Vmax=k+2 x [E].
Таким образом, Vmax - это предел, к которому стремится скорость реакции при бесконечном повышении концентрации субстрата.
kм - это константа Михаэлиса. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения.
Эта кривая описывается уравнением Михаэлиса-Ментен.
Физический смысл Км заключается в том, что она представляет собой константу равновесия между двумя реакциями, приводящими к распаду фермент-субстратного комплекса и той реакцией, которая ведет к образованию этого комплекса.
Ks - субстратная константа. Характеризует константу равновесия 1-го этапа ферментативной реакции. Следовательно, Км обычно тоже довольно близка к Кs. Следовательно, Км, как и Кs, характеризует сродство субстрата к данному ферменту. Но экспериментально определить k-1 и k+2 очень трудно, поэтому трудно определить и Кs. А вот Км можно просто определить, используя координаты Лайнуивера-Бэрка.
С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату, а значит тем больше равновесие первого этапа ферментативной реакции сдвинуто вправо - в сторону образования фермент-субстратного комплекса. Значит, будут созданы наилучшие условия для протекания и второго этапа ферментативного процесса. При таких условиях для достижения эффективного превращения субстрата требуется малая концентрация субстрата. Значит, и Vmax теоретически может быть достигнута при малых количествах субстрата.
Если Км высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно.
Км и Vmax - это две кинетические константы, с помощью которых можно характеризовать эффективность работы фермента, в том числе и in vivo.
Введение
На сегодняшний день остро стоит проблема совершенствования методов диагностики различных заболеваний человека. В медицине достаточно давно применяются в качестве диагностических инструментов анализы крови и анализы мочи. При этом чаще используется именно биохимический анализ крови. Однако, как свидетельствует практика, для выявления некоторых видов заболеваний, например патологий почек и мочевыводящих путей большей диагностической ценностью обладает не биохимический анализ сыворотки крови, а биохимический анализ мочи. Все это определяет актуальность выбора темы работы.
И если раньше лечащие врачи в основном обращали внимание на уровень глюкозы, общего белка, мочевины, креатинина в моче, а из ферментов - на уровень амилазы (диастазы), то за последнее десятилетие значительную популярность приобрели тесты на ферментный спектр мочи. Подобная методика очень востребована не только в диагностике нефропатологий, но и при раннем выявлении тяжёлых заболеваний у новорождённых, при комплексной диагностике заболеваний.
Энзимодиагностика - один из важнейших разделов клинической биохимии, который имеет свои задачи, направления и специфические исследовательские приёмы. В этой области достигнуты значительные успехи: открыт и выделен ряд новых ферментов; изучена их роль в разных звеньях метаболизма; создана концепция науки о ферментах, которая рассматривает заболевание как последовательные нарушения в структуре и функциях энзимов. Благодаря этим достижением стало возможным раскрытие патогенеза многих заболеваний на молекулярном уровне, создание не только эффективных методов диагностики, но профилактики, лечение больных. Поэтому в докладе мы рассмотрим биохимическую и физиологическую сущность ферментов и набор основных энзимов в моче человека.
Ферменты: биохимическое строение и физиологическая роль
Ферменты (энзимы) - это специфические белки, которые выполняют в организме роль биологических катализаторов.
Являясь белками, ферменты имеют первичную, вторичную, третичную и многие из них - четвертичную структуру.
При гидролизе ферментов образовывается смесь аминокислот. Известно свыше 20 различных аминокислот, входящих в состав белков.
Ферменты имеют общие с белками физико-химические свойства:
При гидролизе расщепляются на аминокислоты;
Имеют высокую молекулярную массу;
Создают коллоидные растворы;
Плохо кристаллизуются;
Очень неустойчивы к высоким температурам солей, тяжелых металлов, кислот, щелочей и т.п;
Имеют антигенные свойства.
Молекулярная масса ферментов характеризуется широкой вариацией - от нескольких десятков тысяч до несколько миллионов.
Ферменты отличаются по своей структуре. Их разделяют на 2 группы - простые и сложные. Простые, или однокомпонентные ферменты составляются только из аминокислот. К ним относятся небольшое количество ферментов (рибонуклеаза, амилаза, альдолаза, уреаза, пепсин и др.). Но большинство ферментов состоит из двух компонентов: небелковой части или простетической группы и белковой части - апофермента (рис. 1). Эти две части фермента отдельно не имеют силы, но только в комплексе друг с другом они проявляют каталитическую способность.
Небелковый компонент распада ферментов называется коферментом.
Многие коферменты являются витаминами или их производными. В данное время биохимии известно свыше 300 отдельных ферментов (а, возможно в ближайшее время их станет больше, так как наука не стоит на месте), в состав которых входят в качестве коферментов витамины или их производные. Как следствие, при авитаминозах в организме наблюдается нарушение деятельности всех ферментных систем.
Рисунок 1 Схема строения ферментов
Для определения механизма действия ферментов было предложено немало теорий. Оказалось, что катализаторы лишь сокращают время, необходимое для достижения равновесия химической реакции. Большинство химических реакций в живых организмах нуждается в «запуске», что и выполняют ферменты (рис. 2).
В основе жизнедеятельности организма лежат химические преобразования разных веществ, скорость которых определяют ферменты - биологические катализаторы. Пищеварение, использование всех полезных веществ, которые поступили в организм, рост, свертывание крови, мышечные сокращения и много других физиологических процессов - все это построено на четкой, последовательной работе ферментных систем.
Важнейшим признаком ферментов является не только их свойство ускорять протекание химических реакций, но выборочно катализировать лишь определенный путь преобразования данного субстрата. Это одна из основных функций ферментов по сравнению с небиологическими катализаторами.
Возвратность ферментативных реакций заключается в способности ферментов катализировать прямую и обратную реакцию. Так, например, липаза может при определенных условиях расцепить жир до глицерина и жирных кислот, а также катализировать его синтез из продуктов распада. Способность ферментов ускорять химические процессы, как в сторону синтеза, так и распада, имеет большое значение, так как создает возможность переключения этих процессов с одного на другой, чем обеспечивает тесную взаимосвязь катаболизма и анаболизма, гибкость и приспособленность обмена веществ к влиянию внешних и внутренних факторов.

Рисунок 2 Схема механизма действия ферментов
Ферменты очень чувствительные к изменению ph среды (то есть к степени кислотности и щёлочности), в которой они действуют. Каждый фермент имеет оптимум ph, при котором он наиболее активен.
Для большинства ферментов оптимальная среда близка к нейтральному уровню кислотно-щелочной среды (ph около 7,0), так как максимальная активность ферментов проявляется при физиологических значениях ph, а в кислой или щелочной среде их активность снижается. Но и из этого правила есть исключения, и их немало. Например, пепсин, который находится в желудочном соке, активируется лишь в очень кислой среде (ph 1,5 - 2,5). Ферменты очень чувствительные и к температуре, как мы убедились. При повышении температуры до 40-500 ?С повышается активность большинства ферментов, что отвечает общеизвестному закону ускорения химических реакций с повышением температуры. Установлено, что повышение температуры на каждых 100 ?С увеличивает скорость ферментативной реакции в 1,5 - 2 раза. И потому необходимо придерживаться температурного режима при проведении проб на ферменты.
Преобразование ферментов происходит подобно другим обменам белков организма. Ферменты постоянно обновляются, синтезируются и распадаются, что обеспечивает их надлежащий уровень в тканях.
В результате секреции или отмирании клеток ферменты попадают в кровь. Пути вывода ферментов из крови различны. В плазме крови проходит инактивация ферментов, потом они поглощаются клетками ретикулоэндотелиальной системы, где вследствие катаболизма, распадаются. Часть ферментов выводится через мочевыводящие пути и желудочно-кишечный тракт. Но, вывод ферментов с мочой и желчью занимает небольшой удельный вес в механизме вывода ферментов из организма. В основном, ферменты распадаются в плазме крови и тканях и выводятся их неиспользованные конечные продукты обычными для белков каналами. Тем не менее, анализ мочи на содержание ферментов является очень важным диагностическим инструментом, позволяющим выявить многие патологические процессы в организме.
В зависимости от типа катализируемых реакций, все ферменты делят на шесть классов и несколько подклассов. Согласно этой классификации каждый фермент обозначают шифром, который включает номера класса, подкласса и порядковый номер фермента в подподклассе (табл. 1).
Таблица 1 Классификация ферментов по А.Ш. Бишевскому и О.А. Терсенову
Биохимия
Ферменты
Ферменты
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов , так же как неорганических катализаторов, заключается:
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях. 
Ферменты Сходство ферментов и неорганических катализаторов заключается в следующем: 
Ферменты
Отличия ферментов от неорганических катализаторов позволяют им «работать» внутри живых тел и делают их изучение очень важным направлением в химии: 
Стадии ферментативного катализа
В ферментативной реакции можно выделить следующие этапы: 
Механизмы катализа
1. Кислотно-основной катализ
– в активном центре фермента находятся группы специфичных аминокислотных остатков , которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций. 2. Ковалентный катализ
– ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции. 
Типы ферментативных реакций В зависимости от последовательности взаимодействия между ферментом и реактивами выделяют следующие типы ферментативных реакций: 
Схема случайных реакций
В случайных реакциях последовательность взаимодействия между субстратом и реагентами не имеет значения: 
Схема последовательных реакций
В этом случае к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. 
Схема «пинг-понг» В этом случае фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. 
Строение ферментов Все ферменты являются белками, поэтому, они, как и остальные белки по составу делятся на простые и сложные.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Как многие белки, ферменты могут быть мономерами полимерами. 
Строение ферментов В составе фермента выделяют две области – активный центр и аллостерический центр. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. В активном центре выделяют два участка: 
Схема активного центра
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2005 г
Лекция № 1 Тема: Введение в биохимию. Ферменты: строение, свойства, локализация, номенклатура и классификация.
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
Биохимия – наука, изучающая вещества, входящих в состав живых организмов, их превращения, а также взаимосвязь этих превращений с деятельностью органов и тканей.Биохимия – наука, о химических основах процессов жизнедеятельности.
Биохимия сформировалась как самостоятельная наука в конце 19 в. На стыке биологии и химии, хотя истоки её относятся к далёкому прошлому. С 1-й половины 16 в. свой вклад в развитие химии и медицины внесли химики-врачи: немецкий врач и естествоиспытатель Ф. Парацельс, голландские учёные Я. Б. ван Гельмонт, Ф. Сильвий и др., занимавшиеся исследованием пищеварительных соков, жёлчи, а также процессов брожения.
Биохимия делиться на: 1) статическую (анализирует химический состав организмов); 2) динамическую (изучает обмен веществ и энергии в организме); 3) функциональную (исследует молекулярные основы различных проявлений жизнедеятельности).
По объектам исследования, биохимия делиться на: 1) биохимию человека и животных; 2) биохимию растений; 3) биохимию микроорганизмов.
Мы с вами будем заниматься медицинской биохимией, одним из разделов биохимии человека и животных. Предметом медицинской биохимии является человек.
Целью курса медицинской биохимии является изучение: 1) молекулярных основ физиологических функций человека; 2) молекулярные механизмы патогенеза болезней; 3) биохимические основы предупреждения и лечения болезней; 4) биохимические методы диагностики болезней и контроля эффективности лечения.
Задачи курса медицинской биохимии: 1) изучить теоретический материал; 2) получить практический навык биохимических исследований; 3) научиться интерпретировать результаты биохимических исследований.
Химическая природа, физико-химические свойства и биологическая роль ферментов .
Основу жизнедеятельности любого организма составляют химические процессы. Практически все реакции в живом организме протекают с участием природных биокатализаторов, называемых ферментами или энзимами.
Ферменты - это белки (установлено в 1922г), которые действуют как катализаторы в биологических системах.
Являясь веществами белкой природы, ферменты обладают всеми свойствами белков:
гидролизуются до аминокислот;
дают положительные цветные реакции на белки (биуретовую, ксантопротеиновую);
подобно белкам растворяются в воде с образованием коллоидных растворов;
являются амфотерными соединениями;
склонны к денатурации под влиянием тех же факторов: температуры, изменениях рН, действием солей тяжелых металлов, действием физических факторов (ультразвук, ионизирующее излучение и др.);
имеют несколько уровней организации макромолекул, что подтверждено данными рентгеноструктурного анализа, ЯМР, ЭПР.
Биологическая роль ферментов заключается в том, что они обеспечивают контролируемое протекание всех метаболических процессов в организме.