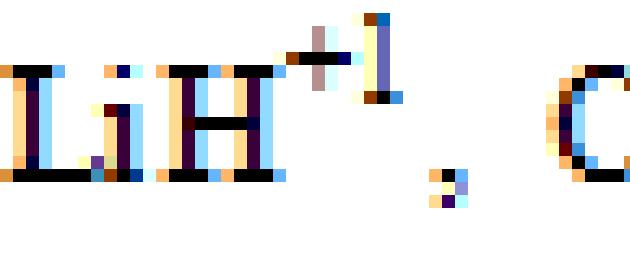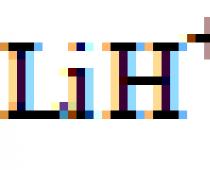U kemiji se pojmovi "oksidacija" i "redukcija" odnose na reakcije u kojima atom ili skupina atoma gubi odnosno dobiva elektrone. Oksidacijsko stanje je numerička vrijednost dodijeljena jednom ili više atoma koja karakterizira broj redistribuiranih elektrona i pokazuje kako su ti elektroni raspoređeni između atoma tijekom reakcije. Određivanje ove vrijednosti može biti jednostavan ili prilično složen postupak, ovisno o atomima i molekulama koje se od njih sastoje. Štoviše, atomi nekih elemenata mogu imati nekoliko oksidacijskih stanja. Srećom, postoje jednostavna, nedvosmislena pravila za određivanje oksidacijskog stanja; dovoljno je poznavati osnove kemije i algebre.
Koraci
dio 1
Određivanje oksidacijskog stanja prema zakonima kemije- Na primjer, Al(s) i Cl2 imaju oksidacijsko stanje 0 jer su oba u kemijski nevezanom elementarnom stanju.
- Imajte na umu da je alotropni oblik sumpora S8, ili oktasumpor, unatoč svojoj atipičnoj strukturi, također karakteriziran nultim oksidacijskim stanjem.
-
Odredite sastoji li se tvar u pitanju od iona. Oksidacijsko stanje iona jednako je njihovom naboju. To vrijedi i za slobodne ione i za one koji su dio kemijskih spojeva.
- Na primjer, oksidacijsko stanje Cl - iona je -1.
- Oksidacijsko stanje Cl iona u kemijskom spoju NaCl također je -1. Budući da ion Na po definiciji ima naboj +1, zaključujemo da ion Cl ima naboj -1, pa je stoga njegovo oksidacijsko stanje -1.
-
Imajte na umu da metalni ioni mogu imati nekoliko oksidacijskih stanja. Atomi mnogih metalnih elemenata mogu biti ionizirani u različitim stupnjevima. Na primjer, naboj iona metala kao što je željezo (Fe) je +2 ili +3. Naboj metalnih iona (i njihovo oksidacijsko stanje) može se odrediti nabojima iona drugih elemenata s kojima je metal dio kemijskog spoja; u tekstu je taj naboj označen rimskim brojevima: npr. željezo (III) ima oksidacijski stupanj +3.
- Kao primjer, razmotrite spoj koji sadrži aluminijev ion. Ukupni naboj spoja AlCl 3 je nula. Budući da znamo da Cl - ioni imaju naboj od -1, a postoje 3 takva iona u spoju, da bi tvar o kojoj je riječ bila ukupno neutralna, Al ion mora imati naboj od +3. Dakle, u ovom slučaju, stupanj oksidacije aluminija je +3.
-
Oksidacijsko stanje kisika je -2 (uz neke iznimke). U gotovo svim slučajevima atomi kisika imaju oksidacijsko stanje -2. Postoji nekoliko iznimaka od ovog pravila:
- Ako je kisik u svom elementarnom stanju (O2), njegovo oksidacijsko stanje je 0, kao i za ostale elementarne tvari.
- Ako je uključen kisik peroksid, njegovo oksidacijsko stanje je -1. Peroksidi su skupina spojeva koji sadrže jednostavnu vezu kisik-kisik (to jest, peroksidni anion O 2 -2). Primjerice, u sastavu molekule H 2 O 2 (vodikov peroksid) kisik ima naboj i oksidacijsko stanje -1.
- U kombinaciji s fluorom, kisik ima oksidacijsko stanje +2, pročitajte pravilo za fluor u nastavku.
-
Vodik ima oksidacijsko stanje +1, uz neke iznimke. Kao i kod kisika, i ovdje postoje iznimke. Tipično, oksidacijsko stanje vodika je +1 (osim ako nije u elementarnom stanju H2). Međutim, u spojevima koji se nazivaju hidridi, oksidacijsko stanje vodika je -1.
- Na primjer, u H2O oksidacijsko stanje vodika je +1 jer atom kisika ima naboj -2, a za ukupnu neutralnost potrebna su dva naboja +1. Međutim, u sastavu natrijevog hidrida, oksidacijsko stanje vodika je već -1, budući da Na ion nosi naboj od +1, a za ukupnu električnu neutralnost, naboj atoma vodika (a time i njegovo oksidacijsko stanje) mora biti jednak -1.
-
Fluor Uvijek ima oksidacijsko stanje -1. Kao što je već navedeno, oksidacijsko stanje nekih elemenata (metalni ioni, atomi kisika u peroksidima itd.) može varirati ovisno o nizu čimbenika. Međutim, stupanj oksidacije fluora uvijek je -1. To se objašnjava činjenicom da ovaj element ima najveću elektronegativnost - drugim riječima, atomi fluora su najmanje voljni odvojiti se od vlastitih elektrona i najaktivnije privlače strane elektrone. Dakle, njihov naboj ostaje nepromijenjen.
-
Zbroj oksidacijskih stanja u spoju jednak je njegovom naboju. Oksidacijski stupnjevi svih atoma u kemijskom spoju moraju zbrojiti naboj tog spoja. Na primjer, ako je spoj neutralan, zbroj oksidacijskih stanja svih njegovih atoma mora biti nula; ako je spoj poliatomski ion s nabojem -1, zbroj oksidacijskih stanja je -1, i tako dalje.
- Ovo je dobar način da provjerite - ako zbroj oksidacijskih stanja nije jednak ukupnom naboju spoja, onda ste negdje pogriješili.
dio 2
Određivanje oksidacijskog stanja bez korištenja kemijskih zakona-
Pronađite atome koji nemaju stroga pravila glede oksidacijskih brojeva. Za neke elemente ne postoje čvrsto utvrđena pravila za određivanje oksidacijskog stanja. Ako atom ne potpada ni pod jedno od gore navedenih pravila i ne znate njegov naboj (na primjer, atom je dio kompleksa i njegov naboj nije specificiran), možete odrediti oksidacijsko stanje takvog atoma pomoću eliminacija. Prvo odredite naboj svih ostalih atoma spoja, a zatim iz poznatog ukupnog naboja spoja izračunajte oksidacijsko stanje zadanog atoma.
- Na primjer, u spoju Na 2 SO 4 naboj atoma sumpora (S) je nepoznat - znamo samo da nije nula, jer sumpor nije u elementarnom stanju. Ovaj spoj služi kao dobar primjer za ilustraciju algebarske metode određivanja oksidacijskog stanja.
-
Odredite oksidacijska stanja preostalih elemenata u spoju. Pomoću gore opisanih pravila odredite oksidacijska stanja preostalih atoma spoja. Ne zaboravite na iznimke od pravila u slučaju O, H atoma i tako dalje.
- Za Na 2 SO 4, koristeći naša pravila, nalazimo da je naboj (a time i oksidacijsko stanje) iona Na +1, a za svaki od atoma kisika -2.
- U spojevima zbroj svih oksidacijskih stanja mora biti jednak naboju. Na primjer, ako je spoj dvoatomski ion, zbroj oksidacijskih stanja atoma mora biti jednak ukupnom ionskom naboju.
- Vrlo je korisno znati koristiti periodni sustav i znati gdje se u njemu nalaze metalni i nemetalni elementi.
- Oksidacijsko stanje atoma u elementarnom obliku uvijek je nula. Oksidacijsko stanje jednog iona jednako je njegovom naboju. Elementi skupine 1A periodnog sustava, poput vodika, litija, natrija, u svom elementarnom obliku imaju oksidacijski stupanj +1; Metali skupine 2A kao što su magnezij i kalcij imaju oksidacijsko stanje +2 u svom elementarnom obliku. Kisik i vodik, ovisno o vrsti kemijske veze, mogu imati 2 različita oksidacijska stanja.
Utvrdite je li dotična tvar elementarna. Oksidacijsko stanje atoma izvan kemijskog spoja je nula. Ovo pravilo vrijedi kako za tvari nastale od pojedinačnih slobodnih atoma, tako i za one koje se sastoje od dvije ili višeatomnih molekula jednog elementa.
Jedan od osnovnih pojmova u kemiji, naširoko korišten u sastavljanju jednadžbi redoks reakcija, je oksidacijsko stanje atomi.
U praktične svrhe (pri sastavljanju jednadžbi za redoks reakcije), prikladno je prikazati naboje na atomima u molekulama s polarnim vezama kao cijele brojeve jednake nabojima koji bi nastali na atomima kada bi se valentni elektroni potpuno prenijeli na više elektronegativnih atoma, tj. tj. ako su veze bile potpuno ionske. Ove vrijednosti naboja nazivaju se oksidacijskim stanjima. Oksidacijsko stanje bilo kojeg elementa u jednostavnoj tvari uvijek je 0.
U molekulama složenih tvari neki elementi uvijek imaju konstantno oksidacijsko stanje. Većinu elemenata karakteriziraju promjenjiva oksidacijska stanja, koja se razlikuju po predznaku i veličini, ovisno o sastavu molekule.
Često je oksidacijsko stanje jednako valenciji i razlikuje se od nje samo predznakom. Ali postoje spojevi u kojima oksidacijsko stanje elementa nije jednako njegovoj valenciji. Kao što je već navedeno, u jednostavnim tvarima oksidacijsko stanje elementa uvijek je nula, bez obzira na njegovu valenciju. U tablici se uspoređuju valencije i oksidacijska stanja pojedinih elemenata u različitim spojevima.
Oksidacijsko stanje atoma (elementa) u spoju je uvjetni naboj izračunat pod pretpostavkom da se spoj sastoji samo od iona. Pri određivanju oksidacijskog stanja konvencionalno se pretpostavlja da se valentni elektroni u spoju prenose na više elektronegativnih atoma, pa se stoga spojevi sastoje od pozitivno i negativno nabijenih iona. U stvarnosti, u većini slučajeva, ne postoji potpuna donacija elektrona, već samo premještanje elektronskog para iz jednog atoma u drugi. Tada možemo dati drugu definiciju: Oksidacijsko stanje je električni naboj koji bi se pojavio na atomu ako bi se elektronski parovi s kojima je on povezan s drugim atomima u spoju prenijeli na više elektronegativnih atoma, a elektronski parovi koji povezuju identične atome bili bi podijeljeno između njih.
Pri izračunavanju oksidacijskih stanja koristi se nekoliko jednostavnih pravila:
1 . Oksidacijsko stanje elemenata u jednostavnim tvarima, jednoatomskim i molekulskim, je nula (Fe 0, O 2 0).
2 . Oksidacijsko stanje elementa u obliku jednoatomnog iona jednako je naboju tog iona (Na +1, Ca +2, S –2).
3 . U spojevima s kovalentnom polarnom vezom negativan naboj odnosi se na elektronegativniji atom, a pozitivan naboj na manje elektronegativan atom, a oksidacijska stanja elemenata poprimaju sljedeće vrijednosti:
Oksidacijsko stanje fluora u spojevima je uvijek -1;
Oksidacijsko stanje kisika u spojevima je -2 (); s izuzetkom peroksida, gdje je formalno jednak -1 (), kisikovog fluorida, gdje je jednak +2 (), kao i superoksida i ozonida, u kojima je oksidacijsko stanje kisika -1/2;
Oksidacijsko stanje vodika u spojevima je +1 (), s izuzetkom metalnih hidrida, gdje je -1 ( ![]() );
);
Za alkalijske i zemnoalkalijske elemente oksidacijska stanja su +1, odnosno +2.
Većina elemenata može pokazivati promjenjiva oksidacijska stanja.
4 . Algebarski zbroj oksidacijskih stanja u neutralnoj molekuli jednak je nuli, u složenom ionu jednak je naboju iona.
Za elemente s promjenjivim oksidacijskim stanjem, njegovu je vrijednost lako izračunati, poznavajući formulu spoja i koristeći pravilo br. 4. Na primjer, potrebno je odrediti stupanj oksidacije fosfora u fosfornoj kiselini H 3 PO 4. Budući da kisik ima CO = –2, a vodik ima CO = +1, tada da bi fosfor imao zbroj nula, oksidacijsko stanje mora biti +5:
Na primjer, u NH 4 Cl zbroj oksidacijskih stanja svih vodikovih atoma je 4×(+1), a oksidacijsko stanje klora je -1, dakle, oksidacijsko stanje dušika mora biti jednako -3. U SO 4 2– sulfatnom ionu zbroj oksidacijskih stanja četiriju atoma kisika je -8, pa sumpor mora imati oksidacijsko stanje +6 da bi ukupni naboj iona bio -2.
Koncept oksidacijskog stanja za većinu spojeva je uvjetan, jer ne odražava stvarni efektivni naboj atoma, ali ovaj se koncept vrlo široko koristi u kemiji.
Maksimalno, a za nemetale minimalno oksidacijsko stanje ima periodičku ovisnost o rednom broju u D.I. Mendeljejeva, što je posljedica elektronske strukture atoma.
| Element | Vrijednosti oksidacijskog stanja i primjeri spojeva |
| F | –1 (HF, KF) |
| O | –2 (H2O, CaO, CO2); –1 (H2O2); +2 (OD 2) |
| N | –3 (NH3); –2(N2H4); –1 (NH2OH); +1 (N20); +2 (NE); |
| +3 (N203, HNO2); +4 (NO 2); +5 (N 2 O 5, HNO 3) | Cl |
| –1 (HCl, NaCl); +1 (NaClO); +3 (NaCl02); +5 (NaClO3); +7 (Cl 2 O 7, NaClO 4) | Br |
| –1 (KBr); +1 (BrF); +3 (BrF 3); +5 (KBrO 3) | ja |
| –1 (HI); +1 (ICl); +3 (IC13); +5 (I205); +7 (IO 3 F, K 5 IO 6) | C |
| –4 (CH4); +2 (CO); +4 (CO 2 , CCl 4) | Si |
| –4 (Ca 2 Si); +2 (SiO); +4 (SiO 2, H 2 SiO 3, SiF 4) | H |
| –1 (LiH); +1 (H2O, HCl) | S |
| –2 (H2S, FeS); +2 (Na2S203); +3 (Na2S204); | +4 (S02, Na2S03, SF4); +6 (SO 3, H 2 SO 4, SF 6) |
| Vidi, Te | –2 (H2Se, H2Te); +2 (SeCl2, TeCl2); +4 (SeO2, TeO2); +6 (H 2 SeO 4, H 2 TeO 4) |
| P | –3 (PH 3); +1 (H3P02); +3 (H3P03); +5 (P 2 O 5 , H 3 PO 4) |
| Kao, Sb | –3 (GaAs, Zn 3 Sb 2); +3 (AsCl3, Sb203); +5 (H 3 AsO 4, SbCl 5) |
| Li, Na, K | +1 (NaCl) |
| Budi, Mg, Ca | +2 (MgO, CaCO 3) |
| Al | +3 (Al 2 O 3, AlCl 3) |
| Kr | +2 (CrCl2); +3 (Cr203, Cr2(SO4)3); +4 (CrO2); +6 (K 2 CrO 4, K 2 Cr 2 O 7) |
| Mn | +2 (MnS04); +3 (Mn2(SO4)3); +4 (MnO2); +6 (K2MnO4); +7 (KMnO 4) |
| Fe | +2 (FeO, FeSO4); +3 (Fe2O3, FeCl3); +4 (Na 2 FeO 3) |
| Cu | +1 (Cu20); +2 (CuO, CuSO 4, Cu 2 (OH) 2 CO 3) |
| Ag | +1 (AgNO 3) |
| Au | +1 (AuCl); +3 (AuCl 3, KAuCl 4) |
| Zn | +2 (ZnO, ZnSO 4) |
| Hg | +1 (Hg2Cl2); +2 (HgO, HgCl 2) |
| Sn | +2 (SnO); +4 (SnO 2, SnCl 4) |
U kemijskim reakcijama mora biti ispunjeno pravilo očuvanja algebarskog zbroja oksidacijskih stanja svih atoma. U kompletnoj jednadžbi kemijske reakcije, procesi oksidacije i redukcije moraju se točno međusobno kompenzirati. Iako je stupanj oksidacije, kao što je gore navedeno, prilično formalan koncept, on se u kemiji koristi u sljedeće svrhe: prvo, za sastavljanje. jednadžbe redoks reakcija, drugo, za predviđanje redoks svojstava elemenata u spoju.
Mnoge elemente karakterizira nekoliko vrijednosti oksidacijskih stanja, a izračunavanjem njihovog oksidacijskog stanja mogu se predvidjeti redoks svojstva: element u najvišem negativnom oksidacijskom stanju može samo donirati elektrone (oksidirati) i biti redukcijski agens, u najvišem pozitivno oksidacijsko stanje može samo primati elektrone (reducirati) i biti oksidacijsko sredstvo, u srednjim oksidacijskim stanjima - i oksidirati i reducirati.
Oksidacija-redukcija je jedan, međusobno povezan proces. Oksidacija odgovara povećanju oksidacijskog stanja elementa, i oporavak - njegovo smanjenje.
Mnogi udžbenici tumače oksidaciju kao gubitak elektrona, a redukciju kao njihov dobitak. Ovaj pristup, koji je predložio ruski znanstvenik Pisarževski (1916.), primjenjiv je na elektrokemijske procese na elektrodama i odnosi se na pražnjenje (naelektrisanje) iona i molekula.
Međutim, objašnjenje promjena oksidacijskih stanja kao procesa apstrakcije i adicije elektrona općenito je netočno. Može se primijeniti na neke jednostavne ione poput
Cl - - ®Cl 0 .
Za promjenu oksidacijskog stanja atoma u složenim ionima poput
CrO 4 2 - ®Cr +3
smanjenje pozitivnog oksidacijskog stanja kroma od +6 do +3 odgovara manjem stvarnom porastu pozitivnog naboja (na Cr u CrO 4 2 - stvarni naboj "+0,2 naboja elektrona, a na Cr +3 - od +2 do +1,5 u različitim spojevima).
Prijenos naboja s redukcijskog sredstva na oksidacijsko sredstvo, jednako promjeni oksidacijskog stanja, događa se uz sudjelovanje drugih čestica, na primjer, H + iona:
CrO 4 2 - + 8H + + 3 ®Cr +3 + 4H 2 O.
Prikazani unos se zove polureakcije .
Povezane informacije.
Kemijski element u spoju, izračunat pod pretpostavkom da su sve veze ionske.
Oksidacijska stanja mogu imati pozitivnu, negativnu ili nultu vrijednost, stoga je algebarski zbroj oksidacijskih stanja elemenata u molekuli, uzimajući u obzir broj njihovih atoma, jednak 0, au ionu - naboj iona .
1. Oksidacijska stanja metala u spojevima su uvijek pozitivna.
2. Najviše oksidacijsko stanje odgovara broju skupine periodnog sustava u kojoj se element nalazi (iznimke su: Au +3(I grupa), Cu +2(II), iz skupine VIII oksidacijsko stanje +8 može se naći samo u osmiju os i rutenij Ru.
3. Oksidacijska stanja nemetala ovise o tome na koji je atom vezan:
- ako je s atomom metala, tada je oksidacijsko stanje negativno;
- ako je s atomom nemetala, tada oksidacijsko stanje može biti pozitivno ili negativno. Ovisi o elektronegativnosti atoma elemenata.
4. Najviše negativno oksidacijsko stanje nemetala može se odrediti tako da se od 8 oduzme broj skupine u kojoj se element nalazi, t.j. najviše pozitivno oksidacijsko stanje jednako je broju elektrona u vanjskom sloju, što odgovara broju skupine.
5. Oksidacijska stanja jednostavnih tvari su 0, bez obzira je li riječ o metalu ili nemetalu.
Elementi s konstantnim oksidacijskim stupnjem.
|
Element |
Karakteristično oksidacijsko stanje |
Iznimke |
|
Metalni hidridi: LIH -1 |
||
|
Oksidacijsko stanje naziva uvjetni naboj čestice pod pretpostavkom da je veza potpuno prekinuta (ima ionski karakter). H- Cl = H + + Cl - , Veza u klorovodičnoj kiselini je polarna kovalentna. Elektronski par je više pomaknut prema atomu Cl - , jer to je elektronegativniji element. Kako odrediti oksidacijsko stanje?Elektronegativnost je sposobnost atoma da privuku elektrone od drugih elemenata. Oksidacijski broj naveden je iznad elementa: Br 2 0 , Na 0 , O +2 F 2 -1 ,K + Cl - itd. Može biti negativan i pozitivan. Oksidacijsko stanje jednostavne tvari (nevezano, slobodno stanje) je nula. Oksidacijsko stanje kisika za većinu spojeva je -2 (izuzetak su peroksidi H2O2, gdje je jednak -1 i spojevi s fluorom - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Oksidacijsko stanje jednostavnog monoatomskog iona jednak je njegovom naboju: Na + , ca +2 . Vodik u svojim spojevima ima oksidacijsko stanje +1 (iznimke su hidridi - Na + H - i tipske veze C +4 H 4 -1 ). U vezama metal-nemetal negativno oksidacijsko stanje je atom koji ima veću elektronegativnost (podaci o elektronegativnosti dani su u Paulingovoj ljestvici): H + F - , Cu + Br - , ca +2 (NE 3 ) - itd. Pravila za određivanje stupnja oksidacije u kemijskim spojevima.Uzmimo vezu KMnO 4 , potrebno je odrediti oksidacijsko stanje atoma mangana. Rasuđivanje:
K+Mn X O 4 -2 Neka X- nama nepoznato oksidacijsko stanje mangana. Broj atoma kalija je 1, mangana - 1, kisika - 4. Dokazano je da je molekula kao cjelina električki neutralna, pa njezin ukupni naboj mora biti jednak nuli. 1*(+1) + 1*(X) + 4(-2) = 0, X = +7, To znači da je oksidacijsko stanje mangana u kalijevom permanganatu = +7. Uzmimo još jedan primjer oksida Fe2O3. Potrebno je odrediti oksidacijsko stanje atoma željeza. Rasuđivanje:
2*(X) + 3*(-2) = 0, Zaključak: stupanj oksidacije željeza u ovom oksidu je +3. Primjeri. Odredite oksidacijska stanja svih atoma u molekuli. 1. K2Cr2O7. Oksidacijsko stanje K +1, kisik O -2. Zadani indeksi: O=(-2)×7=(-14), K=(+1)×2=(+2). Jer algebarski zbroj oksidacijskih stanja elemenata u molekuli, uzimajući u obzir broj njihovih atoma, jednak je 0, tada je broj pozitivnih oksidacijskih stanja jednak broju negativnih. Oksidacijska stanja K+O=(-14)+(+2)=(-12). Iz ovoga slijedi da atom kroma ima 12 pozitivnih potencija, ali u molekuli postoje 2 atoma, što znači da ih ima (+12) po atomu: 2 = (+6). Odgovor: K 2 + Cr 2 + 6 O 7 -2. 2.(AsO4) 3-. U tom slučaju zbroj oksidacijskih stanja više neće biti jednak nuli, već naboju iona, tj. - 3. Napravimo jednadžbu: x+4×(- 2)= - 3 . Odgovor: (Kao +5 O 4 -2) 3- . |
Bilješke s predavanja
u općoj kemiji
Nastavak. Vidi početak u№ 8, 12, 13, 20, 23, 25-26, 40/2004
5. poglavlje.
Redox
reakcije
5.1. Određivanje oksidacijskog stanja
Redoks reakcije su reakcije praćene prijenosom elektrona s jednog atoma na drugi. Prijenos elektrona prosuđuje se prema promjenama oksidacijskih stanja atoma. Ako se oksidacijsko stanje atoma promijeni, mijenja se i njegovo elektroničko okruženje.– Postoje dva načina za određivanje oksidacijskog stanja atoma:
, prvi– po bruto formuli
.
drugi prema strukturnoj formuli
Pri određivanju oksidacijskih stanja atoma na prvi način koristi se sljedeće pravilo:
Ilustracije radi, odredimo oksidacijsko stanje atoma u natrijevom tiosulfatu Na 2 S 2 O 3 prvom metodom. Među elementima koji tvore česticu, kisik je najelektronegativniji – on će prihvatiti elektrone. Budući da je kisik u glavnoj podskupini skupine VI, nedostaju mu dva elektrona da dovrši elektronski sloj. Stoga će atom kisika preuzeti dva elektrona i postići oksidacijsko stanje –2.
2 (+1) + 2Najelektropozitivniji atom je natrij, koji ima samo jedan elektron na svojoj vanjskoj elektronskoj razini (natrij će ga dati). Ova razmatranja, uzimajući u obzir formulu natrijevog tiosulfata, omogućuju nam stvaranje jednadžbe: + 3 (–2) = 0,
X
čija će otopina dati vrijednost oksidacijskog stupnja atoma sumpora (+2).
2Najelektropozitivniji atom je natrij, koji ima samo jedan elektron na svojoj vanjskoj elektronskoj razini (natrij će ga dati). Ova razmatranja, uzimajući u obzir formulu natrijevog tiosulfata, omogućuju nam stvaranje jednadžbe: + 7 (–2) = –2
Možete odrediti oksidacijska stanja atoma u složenim ionima. Kao primjer, razmotrite anion. U njemu najelektronegativniji atom kisika prihvaća dva elektrona i ima oksidacijsko stanje –2. Oksidacijsko stanje atoma kroma određuje se iz jednadžbe:
i jednako je +6. oksidacijsko stanje
– Drugi način pronalaska oksidacijskih stanja atoma - pomoću strukturne formule - temelji se na definiciji: Ovo je konvencionalni cjelobrojni naboj koji bi bio na atomu kada bi sve njegove polarne kovalentne veze postale ionske.

Crtanje strukturne formule natrijeva tiosulfata
Odredimo oksidacijsko stanje njegovih atoma.
Atomi natrija povezani jednostrukim vezama s više elektronegativnih atoma kisika prirodno će im prepustiti svoje vanjske elektrone, pri čemu svaki poprima oksidacijsko stanje +1. Atomi kisika koji imaju dvije veze s više elektropozitivnih atoma uvjetno će prihvatiti dva elektrona i imat će oksidacijsko stanje –2. Iz strukturne formule jasno je da spoj sadrži dva atoma sumpora u različitim sredinama. Jedan od S atoma povezan je samo dvostrukom vezom s drugim S atomom, a njegovo oksidacijsko stanje je nula. Drugi atom sumpora ima četiri veze s još tri elektronegativna atoma kisika i stoga ima oksidacijsko stanje +4.
Atom kisika nema uvijek stupanj oksidacije –2. Na primjer, u kombinaciji s atomima fluora ima pozitivno oksidacijsko stanje. U peroksidima je oksidacijsko stanje svakog atoma kisika jednako , u superoksidima samo , a u ozonidima čak .
Također, oksidacijsko stanje atoma sumpora može biti –1, primjerice u disulfidima. U nekim oksidima, na primjer Fe 3 O 4 i Pb 3 O 4, oksidacijska stanja atoma određuju se na temelju činjenice da su ti oksidi miješani: Fe 2 O 3 FeO odnosno PbO 2 2PbO.
5.2. Zapisivanje jednadžbi
redoks reakcije
Odabir koeficijenata u jednadžbama redoks reakcija provodi se izradom elektroničke ravnoteže.
Metoda odabira, koja se svodi na brojanje broja atoma na desnoj i lijevoj strani jednadžbe, ne jamči uvijek ispravno određivanje koeficijenata. Dakle, tri donje jednadžbe za oksidaciju trietilamina dušičnom kiselinom sadrže jednak broj atoma ugljika, vodika, kisika i dušika na lijevoj i desnoj strani, ali samo je jedna od njih realizirana:
4(C2H5)3N + 36HNO3 = 24CO2 + 48H2O + 6NO2 + 17N2,
2(C2H5)3N + 78HNO3 = 12CO2 + 54H2O + 78NO2 + N2,
(C 2 H 5) 3 N + 11 HNO 3 = 6CO 2 + 13 H 2 O + 4NO 2 + 4N 2.

Teorija redoks procesa uključuje prijenos elektrona s atoma redukcijskog sredstva na atome oksidirajućeg sredstva.
12Najelektropozitivniji atom je natrij, koji ima samo jedan elektron na svojoj vanjskoj elektronskoj razini (natrij će ga dati). Ova razmatranja, uzimajući u obzir formulu natrijevog tiosulfata, omogućuju nam stvaranje jednadžbe: = 5Prema zakonu održanja materije, ukupan broj elektrona koje preda redukcijsko sredstvo jednak je ukupnom broju elektrona koje prihvati oksidacijsko sredstvo. Ova jednostavna ideja vodi sastavljanje jednadžbi za redoks reakcije. Zadatak je odabrati koeficijente proporcionalnosti pri kojima se postiže elektronska ravnoteža.,
čija su minimalna rješenja cijelih brojeva jednaka Najelektropozitivniji atom je natrij, koji ima samo jedan elektron na svojoj vanjskoj elektronskoj razini (natrij će ga dati). Ova razmatranja, uzimajući u obzir formulu natrijevog tiosulfata, omogućuju nam stvaranje jednadžbe: = 5, na = 12.
Odabir koeficijenata u jednadžbama reakcijom disproporcioniranja metodom elektronske vage mora se provesti na njihovoj desnoj strani. Kao primjer, pogledajmo disproporcioniranje Bertholletove soli (bez katalizatora):
![]()
Iz promjena u oksidacijskim stanjima atoma tijekom reakcije proizlazi da je prihvatio 6 elektrona, ali je navodno prepustio 2 elektrona.
Zatim
(KCl) = 3(KClO 4).
Stoga je potrebno staviti koeficijent 3 ispred kalijevog perklorata KClO 4:
4KClO 3 = KCl + 3KClO 4.
5.3. Elektroliza
Razgradnja elektrolita (u otopini ili talini) kada kroz njega prolazi električna struja naziva se elektroliza
.
Instrumentacija procesa elektrolize svodi se na činjenicu da se dvije elektrode spojene na izvor struje spuštaju u posudu s otopinom ili rastopljenim elektrolitom (slika 5.1).
Negativno nabijena elektroda naziva se katoda
(kationi se privlače), a pozitivno nabijena elektroda - anoda
(privlači anione). Električni krug je zatvoren zbog redoks procesa koji se odvijaju na elektrodama. Na katodi se događa redukcija kationa, a na anodi oksidacija aniona.
Počnimo razmatrati proces s najjednostavnijim slučajem - elektroliza talina. Tijekom elektrolize talina na katodi metalni kationi se reduciraju u čisti metal, i na anodi jednostavni anioni se oksidiraju u jednostavnu tvar, na primjer:
2Sl – – 2 e= Cl 2,
S 2– – 2 e= S.
Ako anion ima složenu strukturu, tada se u ovom slučaju odvija proces koji zahtijeva najmanje energije. Ako je sol otporna na toplinu i atom elementa u anionu je u najvišem oksidacijskom stanju, tada se kisik obično oksidira u jednostavnu tvar:
– 2e= SO3 + 1/2O2.
Ako je atom nekog elementa u srednjem oksidacijskom stanju, tada najvjerojatnije u tom slučaju neće biti oksidiran kisik, već atom nekog drugog elementa u anionu, na primjer:
– e= NE 2 .
Elektroliza u otopinama je složenija u smislu određivanja produkata. To je zbog pojave druge komponente - vode. Metali sa standardnim elektrodnim potencijalima od –1,67 V (Al) i niže (nalaze se lijevo od mangana u nizu metalnih napona) u pravilu se ne reduciraju iz vodenih otopina. U takvim sustavima vodik se oslobađa na katodi. To je prije svega zbog činjenice da ti metali (uključujući magnezij i aluminij bez zaštitnog oksidnog filma) reagiraju s vodom. Ali to ne znači da elektrodni procesi kao što su
Na++ e= Na
ne javljaju se u vodenim otopinama. Jedna od metoda dobivanja metalnog natrija je elektroliza vodene otopine NaCl (slana otopina). Tajna ovog procesa leži u korištenju živine katode. Reducirane atome natrija apsorbira sloj žive, koji ih štiti od kontakta s vodom. Naknadno razdvajanje na komponente dobivenog natrijevog amalgama (amalgam je legura čija je jedna od komponenti živa) postiže se rektifikacijom.
Oslobođena živa se zatim vraća u radni ciklus.
O nemogućnosti dobivanja metala koji međudjeluju s vodom elektrolizom vodenih otopina odgovarajućih elektrolita svjedoči i sljedeće razmišljanje. e Neka se kalcij reducira tijekom elektrolize vodene otopine na katodi:
Ca 2+ + 2
=Ca.
Metal će, nakon oporavka, reagirati s vodom:
Ca + 2H 2 O = Ca(OH) 2 + H 2.
Posljedično, umjesto metala, na katodi će se oslobađati vodik.
Metali sa standardnim elektrodnim potencijalima u rasponu od –1,05 V do 0 V (smješteni u elektrokemijskom nizu između aluminija i vodika) reduciraju se iz vodenih otopina paralelno s vodikom. e Omjer produkata (metala i vodika) određen je koncentracijom otopine, njezinom kiselošću i nekim drugim čimbenicima (prisutnost drugih, posebno složenih soli u otopini; materijal od kojeg je izrađena elektroda). Što je veća koncentracija soli, to je veći udio oslobođenog metala. Što je okolina kiselija, veća je vjerojatnost razvijanja vodika s pozitivnom standardnom elektrodom
potencijali (smješteni u nizu metalnih napona desno od vodika) oslobađaju se ponajprije tijekom elektrolize otopina.
Na primjer: e Ag + +
= Ag.
F2 + H2O = 2HF + 1/2O2.
Ako sol koja se podvrgava elektrolizi sadrži složeni anion u kojem je heteroatom (ne kisik) u najvišem oksidacijskom stanju, tada na anodi nastaje kisik, tj. dolazi do razgradnje vode:
H2O – 2 e= 2H++ 1/2O2.
Sam složeni anion također može poslužiti kao izvor kisika:
– 2e= SO3 + 1/2O2.
Nastali kiselinski anhidrid odmah će reagirati s vodom:
SO3 + H2O = H2SO4.
Kada je heteroatom u srednjem oksidacijskom stanju, oksidira se heteroatom, a ne atom kisika. Primjer takvog procesa je oksidacija sulfitnog iona pod utjecajem električne struje:
![]()
Nastali sumporni anhidrid SO 3 odmah reagira s vodom.
Anioni karboksilne kiseline dekarboksiliraju se kao rezultat elektrolize, tvoreći ugljikovodike:
2R–COO – – 2 e= R–R + 2CO 2 .
5.4. Smjer oksidacije-
procesi oporavka
te utjecaj kiselosti okoliša na to
Mjera redoks sposobnosti tvari u vodenim otopinama su redoks ili standardni elektrodni potencijali. Utvrdimo npr. može li kation željeza Fe 3+ oksidirati halogene anione u KCl, KBr i KI. Poznavajući standardne elektrodne potencijale ( 0), možemo izračunati elektromotornu silu (EMS) procesa. Definira se kao razlika između potencijala oksidirajućeg i redukcijskog sredstva, a reakcija se odvija pri pozitivnoj EMF vrijednosti:
![]()
Tablica 5.1
Utvrđivanje mogućnosti istjecanja
redoks procesi
na temelju standardnih elektrodnih potencijala
Stol 5.1 pokazuje da je moguć samo jedan od procesa koji se proučavaju. Doista, od svih gore navedenih kalijevih halogenida, samo KI reagira sa željeznim trikloridom:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl.
Postoji još jedan jednostavan način za određivanje smjera procesa. Ako napišemo dvije jednadžbe polureakcije procesa jednu ispod druge tako da je standardni elektrodni potencijal gornje polureakcije manji od potencijala donje, tada će slovo Z napisano između njih (sl. 5.2) označavati svojim krajevima smjerove faza dopuštenog procesa (pravilo Z).
Od istih tvari promjenom pH medija mogu se dobiti različiti produkti.
Na primjer, permanganatni anion u kiseloj okolini reducira se u spoj mangana(II):
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 5Na 2 SO 4 + 3H 2 O.
U neutralnom okruženju nastaje mangan dioksid MnO 2:
U alkalnoj sredini, permanganatni anion se reducira u manganatni anion:
2KMnO 4 + Na 2 SO 3 + 2KOH = 2K 2 MnO 4 + Na 2 SO 4 + H 2 O.
5.5. Vježbe
1. Odredite oksidacijska stanja atoma u sljedećim spojevima: BaO 2, CsO 2, RbO 3, F 2 O 2, LiH, F 2, C 2 H 5 OH, toluen, benzaldehid, octena kiselina.
- VKontakte 0
- Google+ 0
- U REDU 0
- Facebook 0