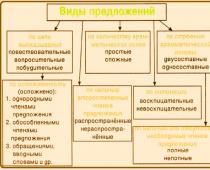
Karboksilna skupina (karboksil) -COOH je funkcionalna jednovalentna skupina koja ulazi u sastav karboksilnih kiselina i određuje njihova kiselinska svojstva.
Struktura karboksilne skupine
Karboksilna skupina spaja dvije funkcionalne skupine - karbonilnu (>C=O) i hidroksilnu (-OH), međusobno utječući jedna na drugu.
Kisela svojstva karboksilnih kiselina posljedica su pomaka u gustoći elektrona prema karbonilnom kisiku i rezultirajuće dodatne (u usporedbi s alkoholima) polarizacije O-H veze.
U vodenoj otopini karboksilne kiseline disociraju na ione:
R-COOH = R-COO − + H +
Topivost u vodi i visoka vrelišta kiselina posljedica su stvaranja međumolekulskih vodikovih veza.
S povećanjem molekulske mase smanjuje se topljivost kiselina u vodi.
| Benzen | Ovo je nacrt članka o organskoj kemiji. Možete pomoći projektu dodajući mu. |
Napišite recenziju o članku "Karboksilna skupina"
Odlomak koji karakterizira karboksilnu skupinu
– Svetodar, Sever... Što mu je bilo? Kako je sin Radomira i Magdalene proživio život na Zemlji?..Sjever je počeo razmišljati... Konačno, duboko udahnuvši, kao da je odbacio opsesiju prošlosti, započeo je svoju sljedeću uzbudljivu priču...
– Nakon Radomirova raspeća i smrti, Svetodara su vitezovi Hrama odveli u Španjolsku kako bi ga spasili iz krvavih kandži “svete” crkve koja ga je bez obzira na cijenu pokušavala pronaći i uništiti, budući da dječak je bio najopasniji živući svjedok, a ujedno i izravni nasljednik Radomirovog Drveta života koje je jednog dana trebalo promijeniti naš svijet.
Svetodar je živio i upoznavao svoju okolinu u obitelji španjolskog plemića, koji je bio vjeran sljedbenik učenja Radomira i Magdalene. Na njihovu veliku žalost, nisu imali svoju djecu, pa je “nova obitelj” dječaka primila vrlo srdačno, trudeći se da mu stvore što ugodnije i toplije kućno okruženje. Zvali su ga Amori (što je značilo dragi, voljeni), jer je za Svjatodara bilo opasno zvati se pravim imenom. Zvučalo je previše neobično za tuđe uši i bilo je više nego nerazumno zbog toga riskirati Svetodarov život. Tako je Svetodar postao Amoryjev dječak za sve ostale, a samo su ga prijatelji i obitelj zvali pravim imenom. A onda, tek kad u blizini nije bilo stranaca...
Karboksilne kiseline su spojevi koji sadrže karboksilnu skupinu:
Razlikuju se karboksilne kiseline:
- monobazične karboksilne kiseline;
- dibazične (dikarboksilne) kiseline (2 skupine UNS).
Ovisno o strukturi razlikuju se karboksilne kiseline:
- alifatski;
- aliciklički;
- aromatičan.
Primjeri karboksilnih kiselina.


Dobivanje karboksilnih kiselina.
1. Oksidacija primarnih alkohola kalijevim permanganatom i kalijevim dikromatom:

2. Hibroliza halogenom supstituiranih ugljikovodika koji sadrže 3 atoma halogena po atomu ugljika:
3. Dobivanje karboksilnih kiselina iz cijanida:
Kada se zagrije, nitril hidrolizira i formira amonijev acetat:
Kada se zakiseli, kiselina se taloži:
4. Upotreba Grignardovih reagensa:
5. Hidroliza estera:
6. Hidroliza kiselinskih anhidrida:
7. Specifične metode dobivanja karboksilnih kiselina:
Mravlja kiselina se proizvodi zagrijavanjem ugljikovog (II) monoksida s praškastim natrijevim hidroksidom pod tlakom:
Octena kiselina nastaje katalitičkom oksidacijom butana s atmosferskim kisikom:
Benzojeva kiselina se dobiva oksidacijom monosupstituiranih homologa s otopinom kalijevog permanganata:
Canniciarova reakcija. Benzaldehid se tretira sa 40-60% otopinom natrijevog hidroksida na sobnoj temperaturi.

Kemijska svojstva karboksilnih kiselina.
U vodenoj otopini karboksilne kiseline disociraju:

Ravnoteža je pomaknuta jako ulijevo, jer karboksilne kiseline su slabe.
Supstituenti utječu na kiselost zbog induktivnog učinka. Takvi supstituenti povlače elektronsku gustoću prema sebi i na njima se javlja negativni induktivni učinak (-I). Povlačenje elektronske gustoće dovodi do povećanja kiselosti kiseline. Supstituenti koji doniraju elektron stvaraju pozitivan induktivni naboj.

1. Stvaranje soli. Reakcije s bazičnim oksidima, solima slabih kiselina i aktivnim metalima:

Karboksilne kiseline su slabe, jer mineralne kiseline ih istiskuju iz odgovarajućih soli:
2. Stvaranje funkcionalnih derivata karboksilnih kiselina:
3. Esteri pri zagrijavanju kiseline s alkoholom u prisutnosti sumporne kiseline - reakcija esterifikacije:
4. Stvaranje amida, nitrila:
3. Svojstva kiselina određena su prisutnošću ugljikovodičnog radikala. Ako se reakcija odvija u prisutnosti crvenog fosfora, nastaje sljedeći produkt:
4. Reakcija adicije.

8. Dekarboksilacija. Reakcija se provodi spajanjem lužine sa soli alkalnog metala karboksilne kiseline:
9. Dvobazna kiselina se lako eliminira CO 2 kada se zagrije:
Dodatni materijali na temu: Karboksilne kiseline.
Kemijski kalkulatori |
|
| Kemija online na našoj web stranici za rješavanje problema i jednadžbi. | |
Elementi uključeni u karboksilnu skupinu imaju različite vrijednosti elektronegativnosti: C(sp 2) – 2,69; O – 3,5 i H – 2,2. Gustoća elektrona je pomaknuta prema kisiku, što dovodi do polarizacije veza. Karboksilna skupina je planarni konjugirani sustav u kojem se p, p-konjugacija događa kada p-orbitala atoma kisika hidroksilne skupine stupa u interakciju s p-vezom. Prisutnost p, p-konjugacije u karboksilnoj skupini karboksilnih kiselina doprinosi ravnomjernoj raspodjeli negativnog naboja u karboksilatnom ionu koji nastaje kada se proton ukloni.
Prisutnost p,p-konjugacije u karboksilnoj skupini karboksilnih kiselina značajno povećava kiselinska svojstva karboksilnih kiselina u usporedbi s alkoholima. Kisik OH skupine doživljava određeni nedostatak elektrona, pa uzrokuje pomak u gustoći elektrona s atoma vodika na sebe. Atom vodika postaje pokretan i može otići u obliku protona. Mobilnost protona potiče stvaranje soli karboksilnih kiselina (mehanizam S E reakcije).
Za karboksilne kiseline najtipičnije reakcije su nukleofilna supstitucija OH skupine u karboksilnoj (S N mehanizam). U reakcijama u kojima se atom (ili skupina atoma) zamijeni nukleofilom, dolazi do nukleofilne supstitucije S N. Nukleofili su donori elektrona: OH -, RO -, CN -, -NH 2, R-O-R, R-OH itd. U S N reakcijama, atom (ili skupina atoma) s negativnim nabojem uklanja se iz molekule i zamjenjuje nukleofilom:

Što je izlazni ion (:X) stabilniji, lakše se odvijaju reakcije nukleofilne supstitucije. S N reakcije s karboksilnim kiselinama odvijaju se u prisutnosti kiselog katalizatora. Reakcije nukleofilne supstitucije hidroksila na sp 2 -hibridiziranom ugljikovom atomu dovode do stvaranja funkcionalnih derivata karboksilnih kiselina:
1. Reakcija esterifikacije. Supstitucija hidroksila u karboksilu s alkoholnim ostatkom dovodi do stvaranja estera. Reakcija esterifikacije događa se kada se kiseline zagrijavaju s alkoholima u prisutnosti tvari koje uklanjaju vodu:

CH 3 COOH + C 2 H 5 OH ↔ CH 3 CO-OS 2 H 5 + H 2 O
etil acetat
Reakcija je reverzibilna i traje dok se ne uspostavi ravnoteža. Pomak ravnoteže udesno nastaje zbog uklanjanja jednog od konačnih produkata iz reakcijske smjese.
Hidroliza estera (za razliku od reakcije esterifikacije) može se provesti i u kiseloj i u alkalnoj sredini.
2. Kiselinski halogenidi- to su derivati u kojima je hidroksilna skupina karboksilne skupine zamijenjena halogenom. Kiselinski halogenidi nastaju djelovanjem fosfornih halogenida (PCl 5, PCl 3) ili tionil klorida (SOCl 2) na kiselinu:
Kiselinski halidi su vrlo aktivni nukleofili i koriste se u raznim sintezama kao aktivni acilirajući agensi za uvođenje kiselinskog ostatka u molekulu tvari.
3. Stvaranje kiselinskih anhidrida– zamjena hidroksila u karboksilu kiselinskim ostatkom.
Anhidridi monokarboksilnih kiselina najčešće se dobivaju reakcijom kiselinskih klorida i natrijevih soli tih kiselina.
4. Stvaranje kiselinskih amida- zamjena hidroksila u karboksilu s ostatkom amonijaka - amino skupina - NH 2

Reakcija se odvija bolje ako na kisele halide djelujete amonijakom.
5. Reakcije formiranja prilično su česte u ljudskom tijelu. tioeteri. Dakle, tkiva sadrže tiol HS–KoA (koenzim A - acilacijski koenzim), koji može reagirati s karboksilnim kiselinama prema jednadžbi:
CH 3 COOH + HS-KoA → H 2 O + CH 3 CO-S-CoA
Reakcije ove vrste kataliziraju složeni enzimski sustavi i rezultiraju stvaranjem tioestera, u ovom obliku karboksilne kiseline se koriste u metaboličkim reakcijama.
Dekarboksilacija je jedna od najvažnijih reakcija karboksilnih kiselina. Nesupstituirane monokarboksilne kiseline teško se dekarboksiliraju.
Dibazične karboksilne kiseline se lako dekarboksiliraju zagrijavanjem:
HOOC-COOH → HCOOH + CO2
HOOC–CH 2 –COOH → CH 3 COOH + CO 2
Enzimska dekarboksilacija α- i β-oksokiselina, kao i α-aminokiselina u tijelu je od velike važnosti.
U vodenim otopinama karboksilne kiseline disociraju:
CH 3 COOH ↔ CH 3 COO - + H +
Sve karboksilne kiseline su slabi elektroliti (HCOOH – srednje jakosti). Karboksilne kiseline stvaraju soli u reakcijama elektrofilne supstitucije:
CH 3 COOH + NaOH → CH 3 COONa + H 2 O
Soli oksalne kiseline (oksalati) su slabo topljivi i često stvaraju kamence u bubrezima i mokraćnom mjehuru (oksalatni kamenci). Ove soli uključuju kalcijev oksalat.
4. Ilustrativni materijal: prezentacija
5. Literatura:
Glavna literatura:
2. Seitembetov T.S. Kemija: udžbenik - Almaty: EVERO LLP, 2010. - 284 str.
3. Bolysbekova S. M. Kemija biogenih elemenata: udžbenik - Semej, 2012. - 219 str. : mulj
4. Verentsova L.G. Anorganska, fizikalna i koloidna kemija: udžbenik - Almaty: Evero, 2009. - 214 str. : ilustr.
5. Fizička i koloidna kemija / Pod uredništvom A. P. Belyaeva - M.: GEOTAR MEDIA, 2008.
6. Verentseva L.G. Anorganska, fizikalna i koloidna kemija, (kontrolni testovi) 2009
Dodatna literatura:
Test "Pyaterochka"
(Neka pitanja imaju više od jednog mogućeg odgovora.)
1. Koje su od navedenih kiselina organske?
A) Mrav; b) dušik;
B) sumpor; d) limun.
2. Zašto su ugrizi mrava bolni?
A) Spaliti mravljom kiselinom;
B) izlučuju otrov;
C) nagrizen mravljom lužinom;
D) oštri zubi probijaju.
3. Kako se nazivaju soli karboksilnih kiselina?
A) acetati; b) bustilati;
B) propilati; d) postulate.
4. Koji naziv za kiselinu ne postoji?
Limun; b) oksalin;
B) vino; d) grožđe.
5. Koje su kiseline vitamini?
A) Nikotin; b) askorbinska kiselina;
B) acetilsalicilna kiselina; d) jantar.
Predavanje br.5
1. Tema: Ugljikohidrati.
2. Namjena: Razviti znanja o klasifikaciji, strukturi i kemijskim svojstvima ugljikohidrata. Proučavanjem predmeta promiču se i formiraju znanja o građi i svojstvima ugljikohidrata, kao osnovi za razumijevanje njihovog metabolizma u živom organizmu.
3. Sažeci predavanja:
3.1. Sažetak predavanja
1. Ugljikohidrati, klasifikacija, karbonilne i projekcijske formule Fischera, Colley-Tollensove formule, Haworthove formule.
2. Monosaharidi - struktura, izomerija, tautomerija.
3. Kemijska svojstva monosaharida
4. Disaharidi: maltoza, celobioza, laktoza, saharoza.
5. Polisaharidi: homopolisaharidi i heteropolisaharidi.
6. Biološki značaj ugljikohidrata.
3.2. Sažeci predavanja
Ugljikohidrati su organski spojevi rasprostranjeni u živoj prirodi. Pojam "ugljikohidrati" predložio je 1844. kemičar K. Schmidt (Rusija) zbog činjenice da je većina predstavnika ove klase u sastavu odgovarala kombinaciji ugljika s vodom, na primjer: C 6 H 12 O 6 → 6 C + 6 H2O; Sn(H2O)n.
Klasa ugljikohidrata podijeljena je u dvije skupine:
- jednostavni ugljikohidrati (monosaharidi) ili monosaharidi
- složeni ugljikohidrati (homopolisećeri i heteropolisećeri)
Jednostavni ugljikohidrati se ne mogu hidrolizirati, ali složeni ugljikohidrati se hidroliziraju u jednostavne ugljikohidrate.
Monosaharidi- to su heterofunkcionalni spojevi. Oni su aldehidi i ketoni polihidričnih alkohola (ili njihovih cikličkih poluacetala). Ovisno o prisutnosti aldehidne ili ketonske skupine, razlikuju se aldoze i ketoze. Monosaharidi sadrže od 3 do 10 atoma ugljika po molekuli.
Izomerija monosaharida povezana je s prisutnošću: 1) aldehidnih i ketonskih skupina; 2) asimetrični atomi ugljika (optička izomerija). Pripadnost monosaharida D- ili L-seriji određena je pravilom M.A. Rozanova: prema konfiguraciji asimetričnog ugljikovog atoma najudaljenijeg od starije (karbonilne) skupine (pentoza C-4, heksoza C-5).
Karbonilne formule heksoza:
D-glukoza D-manoza D-galaktoza D-fruktoza
Monosaharidi postoje u obliku acikličkih (karbonilni oblici) i cikličkih poluacetalnih oblika. Aciklički i ciklički oblici monosaharida su izomeri jedni prema drugima. Ova vrsta izomerije naziva se ciklo-okso-tautomerizam.
Cikličke (Haworthove) formule heksoza:




a-D-glukoza b-D-glukoza a-D-galaktoza b-D-fruktoza
Za šećere u cikličkom obliku moguće je konformacijska izomerija, povezan s prostornim rasporedom ugljikovih atoma šesteročlanog ciklusa. Reakcije poluacetalnog hidroksila. Monosaharidi koji imaju strukturu cikličkih poluacetala, kada reagiraju s alkoholima u prisutnosti kiselog katalizatora u bezvodnim uvjetima, tvore potpune acetale.

a-D-galaktopiranoza Metil-a-D-galaktopiranozid
Hemiacetalni ili glikozidni hidroksil ne pokazuje svojstva alkohola, ali se ponaša specifično, tvoreći O- i N-glikozide. Glikozidi, kao i svi acetali, hidroliziraju u kiseloj sredini i otporni su na djelovanje razrijeđenih lužina. Hidroliza glikozida je obrnuta reakcija od stvaranja glikozida
Poput polihidričnih alkohola, monosaharidi otapaju bakrov(II) hidroksid, tvoreći plavi kelatni spoj. Ova reakcija se koristi za otkrivanje monosaharida i glikozida.
Eteri nastaju interakcijom s haloalkanima. Istodobno s alkoholnim hidroksilnim skupinama reagira i poluacetalni hidroksil, što rezultira stvaranjem glikozidnog etera.



Eterski esteri: α-glukoza i α-fruktoza fosfati
Esteri nastaju reakcijom esterifikacije OH skupina pod djelovanjem kiselina koje sadrže kisik (organskih i anorganskih) ili njihovih anhidrida. Biološki su važni esteri fosforne kiseline – fosfati.
Oporavak karbonilna skupina monosaharida s vodikom na niklu ili paladiju dovodi do stvaranja polihidričnih alkohola: glukoza - sorbitol (D-glucit), manoza - manitol, D-ksiloza - ksilitol, galaktoza - dulcit. Ksilitol i sorbitol su kristalne tvari slatkog okusa koje su visoko topljive u vodi i koriste se kao zamjena za šećer kod dijabetesa. Sorbitol je međuproizvod u industrijskoj proizvodnji askorbinske kiseline (vitamin C).
Oksidacija monosaharida.
Shema kemijske reakcije C x (H 2 O) y + xO 2 ® xCO 2 + yH 2 O + Q odgovara procesu potpune oksidacije (izgaranja) ugljikohidrata.
Ovisno o uvjetima oksidacije monosaharida nastaju glikanska, glikarska i glikuronska kiselina.
Neutralno okruženje. Samo se aldehidna skupina oksidira u karboksilnu skupinu u neutralnoj ili kiseloj sredini (blaga oksidacija). Oksidacija glukoze bromnom vodom u prisutnosti krede (koja se koristi za neutralizaciju rezultirajućeg HBr) na sobnoj temperaturi dovodi do stvaranja glukonske (glikonske) kiseline:


glukonska kiselina glucaric acid glukuronska kiselina
Glukonska kiselina u obliku kalcijevih soli (kalcijev glukanat) ima široku primjenu u praktičnoj medicini (za alergije, povećanu propusnost krvnih žila itd.).
Kisela sredina. Kada se monosaharidi zagrijavaju s razrijeđenom dušičnom kiselinom, istovremeno s aldehidnom skupinom dolazi do oksidacije primarne alkoholne skupine na drugom kraju monosaharidnog lanca, što dovodi do stvaranja dibazičnih hidroksi kiselina (glikarinske kiseline). Glukoza je glukarna kiselina.
Alkalna sredina. Kada se oksidiraju u alkalnoj sredini uz zagrijavanje, monosaharidi prolaze kroz duboke promjene s cijepanjem ugljikovog lanca. U ovom slučaju, oksidansi kao srebrov oksid Ag 2 O (reakcija srebrnog zrcala) i bakrov (II) hidroksid Cu (OH) 2 reduciraju se u metalno srebro i bakrov (I) oksid (Trommerov test).
U tkivima ljudskog tijela, tijekom oksidacije glukoze, može nastati glukuronska kiselina (aldehidna skupina je zaštićena i očuvana, oksidira se samo primarna alkoholna skupina). Oksidacijom galaktoze nastaje galakturonska kiselina. Uronske kiseline igraju zaštitnu ulogu u ljudskoj jetri, sudjeluju u neutralizaciji otrovnih tvari koje dolaze izvana ili nastaju kao rezultat vitalne aktivnosti. Dekarboksilacija uronskih kiselina dovodi do stvaranja pentoza (glukuronska kiselina → ksiloza + CO 2).
Derivati monosaharida
Dezoksišećeri su derivati monosaharida u kojima su jedna ili dvije HO skupine zamijenjene atomom vodika, npr. 2-deoksiriboza.
Amino šećer– nastaju na bazi monosaharida u čijim je molekulama OH skupina druge karike zamijenjena amino skupinom - NH 2, na primjer β,D-glukozamin.
Neuraminska kiselina . Dobiva se kao rezultat aldolne kondenzacije PVK (1) i D-manozamina (2):

Sijalne kiseline. Oni su N-acetil derivati neuraminske kiseline. Acilacija se događa s acetilnim ili hidroksiacetilnim ostatkom.
Složeni ugljikohidrati- to su spojevi čijom hidrolizom nastaju monosaharidi i njihovi derivati. Ovisno o građi i broju strukturnih komponenti, složeni ugljikohidrati se obično dijele na oligosaharidi(2-10 monoz) i polisaharidi.
Disaharidi nastaje od dva monosaharida. Njihova opća empirijska formula je C 12 H 22 O 11. Najvažniji disaharidi su maltoza, laktoza, saharoza, celobioza. Maltoza(sladni šećer) – redukcijski disaharid – sastoji se od ostataka 2 molekule D-glukopiranoze povezane alfa-1,4-glikozidnom vezom; hidrolizom se cijepa na dvije D-glukoze (D-glukopiranoze).
Laktoza(mliječni šećer) je redukcijski disaharid. Sadržano u mlijeku sisavaca. Hidrolizom stvara 2 monosaharida: β-D-galaktopiranozu (β-D-galaktozu) i D-glukozu.
Saharoza(šećer od šećerne trske, šećer od repe) je najpoznatiji i najrašireniji šećer. Tijekom hidrolize saharoza se razgrađuje na α-glukozu i β-fruktozu. α-1, β-2-glikozidnu vezu tvore poluacetalni hidroksili α-glukoze i β-fruktoze, tako da ne postoji mogućnost ciklooksoautomerizma. Saharoza je nereducirajući disaharid.
Celobioza– reducirajući disaharid, sastoji se od ostataka 2 molekule β-D-glukopiranoze povezane beta-1,4-glikozidnom vezom. Dobiva se hidrolizom celuloze (vlakna).
polisaharidi- To su visokomolekularni ugljikohidrati, kemijski srodni poliglikozidima, t.j. su produkti polikondenzacije monosaharida povezanih glikozidnim vezama.
Polisaharidni lanci mogu biti razgranati (amilopektin, glikogen) i nerazgranati, odnosno linearni (vlakna, amiloza).
Prema sastavu polisaharidi se dijele na
1. homopolisaharidi- biopolimeri nastali od ostataka jednog monosaharida;
2. heteropolisaharidi- biopolimeri nastali od ostataka raznih monosaharida.
Svi imaju zajedničko ime: glikani.
Škrob– rezervni je polisaharid u većini biljaka, u kojima nastaje reakcijom fotosinteze. Škrob nije homogene strukture – mješavina je dvaju polisaharida: amiloze i amilopektina u omjeru 10-20% do 80-90%. Amiloza sastoji se od a-D-glukopiranoznih ostataka povezanih a(1®4)-glikozidnim vezama. Makromolekula amiloze može sadržavati 200 do 1000 monomernih ostataka. amilopektin je homopolisaharid razgranate strukture, u kojem je linearni lanac a-D-glukopiranoznih ostataka izgrađen preko a(1®4) glikozidnih veza, a razgranati elementi nastaju preko a(1®6) glikozidnih veza. Između točaka grananja nalazi se 20 do 25 ostataka glukoze; molekularna težina amilopektina je 1-6 milijuna jedinica.
4. Ilustrativni materijal: prezentacija
5. Literatura:
Glavna literatura:
1. Bioorganska kemija: udžbenik. Tyukavkina N.A., Baukov Yu.I. 2014
- Seitembetov T.S. Kemija: udžbenik - Almaty: EVERO LLP, 2010. - 284 str.
- Bolysbekova S. M. Kemija biogenih elemenata: udžbenik - Semey, 2012. - 219 str. : mulj
- Verentsova L.G. Anorganska, fizikalna i koloidna kemija: udžbenik - Almaty: Evero, 2009. - 214 str. : ilustr.
- Fizička i koloidna kemija / Uredio A.P. Belyaev. - M.: GEOTAR MEDIA, 2008.
- Verentseva L.G. Anorganska, fizikalna i koloidna kemija, (kontrolni testovi) 2009
Dodatna literatura:
- Ravich-Scherbo M.I., Novikov V.V. Fizikalna i koloidna kemija. M. 2003. (monografija).
2. Slesarev V.I. Kemija. Osnove žive kemije. Sankt Peterburg: Khimizdat, 2001
3. Ershov Yu.A. Opća kemija. Biofizička kemija. Kemija biogenih elemenata. M.: VSh, 2003.
4. Asanbaeva R.D., Ilyasova M.I. Teorijske osnove strukture i reaktivnosti biološki važnih organskih spojeva. Almaty, 2003.
- Vodič za laboratorijsku nastavu iz bioorganske kemije, ur. NA. Tjukavkina. M., Droplja, 2003.
- Glinka N.L. Opća kemija. M., 2003. (monografija).
- Ponomarev V.D. Analitička kemija 1., 2. dio 2003
6. Pitanja za testiranje (povratna informacija):
- Koliki bi postotak dnevnog unosa u uravnoteženoj prehrani trebali činiti ugljikohidrati?
- Do čega dovodi nedostatak ugljikohidrata u hrani?
- Čemu dovodi višak ugljikohidrata u hrani?
Predavanje br.6
1. Tema:α-aminokiseline. Peptidi. Vjeverice.
2. Namjena: proučavati strukturu, svojstva, puteve stvaranja, α-aminokiseline u tijelu. Proučavanje teme doprinosi, formira znanja o sastavu, strukturi i biološkoj ulozi α-aminokiselina, peptida i proteina, proučavanju bioloških funkcija proteina na molekularnoj razini.
3. Sažeci predavanja:
3.1. Sažetak predavanja
1. Struktura aminokiselina, klasifikacija. Izomerija
2. Putovi nastanka aminokiselina u živom organizmu.
3. Fizikalna i kemijska svojstva aminokiselina.
4. Pojam peptida, njihov biološki značaj
5. Građa peptidne veze
6. Proteini, podjela, razine organizacije, biološka uloga
7. Hemoglobin je predstavnik hromoproteina
8. Kvalitativne reakcije na α-aminokiseline i proteine
Sažeci predavanja
Aminokiseline (AMA) su derivati karboksilnih kiselina, u radikalu kojih je jedan ili više vodikovih atoma zamijenjeno amino skupinama.
Opća formula AMK:
Ili alfa aminokiselina
Molekule aminokiselina mogu sadržavati nekoliko NH 2 i -COOH.
Na temelju položaja amino skupine u ugljikovom lancu u odnosu na karboksilnu skupinu razlikuju se α-, β-, γ-aminokiseline. α-aminokiseline (α-ama) su proteinski monomeri.
Klasifikacija alfa aminokiselina.
1. Na temelju broja amino i karboksilnih skupina razlikuju: monoaminomonokarboksilne kiseline (glicin, alanin, valin, leucin, izoleucin, serin, treonin, cistein, metionin, fenilalanin, tirozin, histidin, triptofan); monoaminodikarboksilne kiseline (glutaminska kiselina, asparaginska kiselina, cistin); diaminomonokarboksilne kiseline (lizin, arginin).
2. Po prisutnosti funkcionalnih skupina u radikalu: hidroksiaminokiseline (serin, treonin); aminokiseline koje sadrže sumpor (metionin, cistein, cistin).
3. Po prirodi radikala: alifatske aminokiseline (glicin, alanin, leucin i dr.); aromatske aminokiseline (fenilalanin, tirozin); heterocikličke aromatske aminokiseline (triptofan, histidin); heterocikličke imino kiseline (prolin, hidroksiprolin).
Izomerija aminokiselina povezana je s položajem funkcionalnih skupina i strukturom ugljikovog skeleta. Sve alfa aminokiseline koje čine proteine (osim GLI) su optički aktivne tvari, jer sadrže asimetrični atom ugljika i postoje u obliku enantiomera - D– i L- optički izomeri. Životinjski proteini sadrže L-ABA.
Karboksilna skupina objedinjuje dvije funkcionalne skupine - karbonilnu i hidroksilnu, koje međusobno utječu jedna na drugu. Taj se utjecaj prenosi preko sustava sučelja sp 2 atoma O–C–O.
Elektronska struktura skupine –COOH daje karboksilnim kiselinama karakteristična kemijska i fizikalna svojstva.
1. Pomak gustoće elektrona na karbonilni atom kisika uzrokuje dodatnu (u usporedbi s alkoholima i fenolima) polarizaciju O–H veze, koja određuje pokretljivost atoma vodika ( svojstva kiselina).
U vodenoj otopini karboksilne kiseline disociraju na ione:
Međutim, karboksilne kiseline općenito su slabe kiseline: u vodenim otopinama njihove su soli jako hidrolizirane.
Video eksperiment "Karboksilne kiseline su slabi elektroliti."
2. Smanjena gustoća elektrona (δ+) na ugljikovom atomu u karboksilnoj skupini omogućuje reakcije nukleofilna supstitucija grupe -OH.
3. Skupina -COOH, zbog pozitivnog naboja na atomu ugljika, smanjuje gustoću elektrona na radikalu ugljikovodika koji joj je pridružen, t.j. je u odnosu na njega privlačeći elektrone zamjenik U slučaju zasićenih kiselina, karboksilna skupina pokazuje -ja -Posljedica, i u nezasićenim (na primjer, CH 2 =CH-COOH) i aromatskim (C 6 H 5 -COOH) - -ja I -M - učinci.
4. Karboksilna skupina, kao akceptor elektrona, uzrokuje dodatnu polarizaciju C–H veze u susjednom (α-) položaju i povećava pokretljivost α-vodikovog atoma u reakcijama supstitucije na ugljikovodičnom radikalu.
Vidi također "Reakcijski centri u molekulama karboksilne kiseline".
Atomi vodika i kisika u karboksilnoj skupini -COOH sposobni su stvarati međumolekularne vodikove veze, što uvelike određuje fizička svojstva karboksilne kiseline.
Zbog povezanosti molekula, karboksilne kiseline imaju visoka vrelišta i tališta. U normalnim uvjetima postoje u tekućem ili krutom stanju.
Na primjer, najjednostavniji predstavnik je mravlja kiselina HCOOH – bezbojna tekućina s t.k. 101 °C, a čista bezvodna octena kiselina CH 3 COOH, kada se ohladi na 16,8 °C, pretvara se u prozirne kristale nalik ledu (otuda i naziv ledena kiselina).
Video pokus "Ledena octena kiselina".
Najjednostavnija aromatska kiselina - benzojeva kiselina C 6 H 5 COOH (tt 122,4 ° C) - lako sublimira, tj. prelazi u plinovito stanje, zaobilazeći tekuće stanje. Kada se ohladi, njegove pare sublimiraju u kristale. Ovo se svojstvo koristi za pročišćavanje tvari od nečistoća.
Video eksperiment "Sublimacija benzojeve kiseline."
Topivost karboksilnih kiselina u vodi rezultat je stvaranja međumolekulskih vodikovih veza s otapalom:
Niži homolozi C1-C3 se miješaju s vodom u bilo kojem omjeru. Kako se ugljikovodični radikal povećava, topljivost kiselina u vodi se smanjuje. Više kiseline, na primjer palmitinska C 15 H 31 COOH i stearinska C 17 H 35 COOH, bezbojne su krute tvari netopljive u vodi.
Karboksilna skupina spaja dvije funkcionalne skupine - karbonilnu i hidroksilnu, koje međusobno utječu jedna na drugu:
Kisela svojstva karboksilnih kiselina posljedica su pomaka u gustoći elektrona prema karbonilnom kisiku i rezultirajuće dodatne (u usporedbi s alkoholima) polarizacije O–H veze.
U vodenoj otopini karboksilne kiseline disociraju na ione:
Derivati karboksilnih kiselina: soli, esteri, kiselinski kloridi, anhidridi, amidi, nitrili, njihovo dobivanje.
Karboksilne kiseline pokazuju visoku reaktivnost. Reagiraju s različitim tvarima i tvore niz spojeva, među kojima su od velike važnosti funkcionalni derivati, tj. spojevi dobiveni kao rezultat reakcija na karboksilnoj skupini.
1. Stvaranje soli
a) u interakciji s metalima:
2RCOOH + Mg ® (RCOO) 2 Mg + H 2
b) u reakcijama s metalnim hidroksidima:
2RCOOH + NaOH ® RCOONa + H2O
2. Stvaranje estera R"–COOR":

Reakcija nastajanja estera iz kiseline i alkohola naziva se reakcija esterifikacije (od lat. eter- eter).
3. Stvaranje amida:

Umjesto karboksilnih kiselina češće se koriste njihovi kiseli halogenidi:

Amidi također nastaju interakcijom karboksilnih kiselina (njihovih kiselih halogenida ili anhidrida) s organskim derivatima amonijaka (aminima):

Amidi imaju važnu ulogu u prirodi. Molekule prirodnih peptida i proteina građene su od a-aminokiselina uz sudjelovanje amidnih skupina - peptidne veze
Nitrili su organski spojevi opće formule R-C≡N, koji se smatraju derivatima karboksilnih kiselina (produkti dehidratacije amida) i nazivaju se derivatima odgovarajućih karboksilnih kiselina, na primjer, CH 3 C≡N - acetonitril (nitril octene kiseline ), C6H5CN - benzonitril (nitril benzojeve kiseline).
Anhidridi karboksilnih kiselina mogu se smatrati produktom kondenzacije dviju -COOH skupina:
R 1 -COOH + HOOC-R 2 = R 1 -(CO)O(OC)-R 2 + H 2 O
- U kontaktu s 0
- Google+ 0
- u redu 0
- Facebook 0