Budući da su lipidi u osnovi hidrofobne molekule, transportiraju se u vodenoj fazi krvi u sklopu posebnih čestica – lipoproteina.
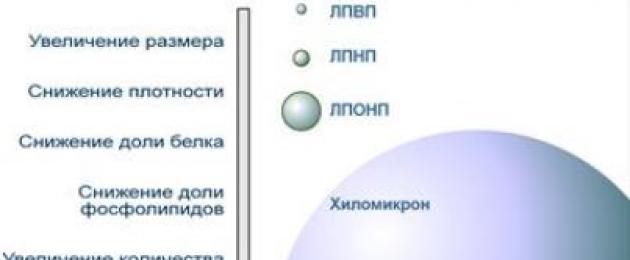
Struktura transportnih lipoproteina može se usporediti s orah koji imaju ljuska I jezgra. "Ljuska" lipoproteina je hidrofilna, jezgra je hidrofobna.
- nastaje površinski hidrofilni sloj fosfolipidi(njihov polarni dio), kolesterola(njegova OH grupa), vjeverice. Hidrofilnost lipida površinskog sloja dizajnirana je da osigura topljivost lipoproteinske čestice u krvnoj plazmi,
- "jezgru" čine nepolarni esteri kolesterola(HS) i triacilgliceroli(TAG), koji su transportirane masti. Njihov omjer varira u različitim vrstama lipoproteina. Središtu su okrenuti i ostaci masnih kiselina fosfolipida i ciklički dio kolesterola.
Shema strukture bilo kojeg transportnog lipoproteina
Postoje četiri glavne klase lipoproteina:
- lipoproteini visoke gustoće (HDL, α-lipoproteini, α-LP),
- lipoproteini niske gustoće (LDL, β-lipoproteini, β-LP),
- lipoproteini vrlo niske gustoće (VLDL, pre-β-lipoproteini, pre-β-LP),
- hilomikroni (CM).
Svojstva i funkcije lipoproteina različitih klasa ovise o njihovom sastavu, tj. o vrsti prisutnih proteina i o omjeru triacilglicerola, kolesterola i njegovih estera, fosfolipida.

Usporedba veličine i svojstava lipoproteina
Funkcije lipoproteina
Funkcije lipoproteina krvi su
1. Prijenos u stanice tkiva i organa
- zasićene i mononezasićene masne kiseline u sastavu triacilglicerola za naknadno skladištenje ili korištenje kao energetski supstrati,
- višestruko nezasićene masne kiseline u esterima kolesterola za korištenje stanicama u sintezi fosfolipida ili stvaranju eikosanoida,
- kolesterol kao membranski materijal,
- fosfolipidi kao membranski materijal,
Hilomikroni i VLDL prvenstveno su odgovorni za transport masne kiseline kao dio TAG-a. Lipoproteini visoke i niske gustoće - za transport slobodnih kolesterola I masne kiseline kao dio njegovih etera. HDL je također sposoban donirati dio svoje fosfolipidne membrane stanicama.
2. Uklanjanje viška kolesterola iz staničnih membrana.
3. Transport vitamina topivih u mastima.
4. Prijenos steroidnih hormona (uz specifične transportne proteine).
Lipoproteini apoproteini
Proteini u lipoproteinima obično se nazivaju apowhites, postoji nekoliko vrsta - A, B, C, D, E. U svakoj klasi lipoproteina postoje odgovarajući apoproteini koji obavljaju svoju funkciju:
1. Strukturalni funkcija(" stacionarni» proteini) – vežu lipide i stvaraju proteinsko-lipidne komplekse:
- apoB-48– dodaje triacilcerole,
- apoB-100– veže i triacilglicerole i estere kolesterola,
- apoA-I– prihvaća fosfolipide,
- apoA-IV– veže se za kolesterol.
2. Kofaktor funkcija(" dinamičan» proteini) – utječu na aktivnost metaboličkih enzima lipoproteina u krvi.
S biološkog gledišta, najvažnija fizikalno-kemijska svojstva lipida su po svojstvima suprotna ugljikohidratima. Njihove molekule su topljive u mastima, velike i imaju relativno nizak udio atoma kisika.
Lipidi su spori energetski supstrati. Zbog niske topivosti u vodi ne mogu postići visoke koncentracije u krvi, pa stoga ne mogu biti energetski supstrat za tkiva.
Ima dosta lipida. Prvo, zbog malog broja atoma kisika, slobodna energija lipida je prilično visoka. Drugo, zbog svoje hidrofobnosti mogu formirati velike kapljice koje ispunjavaju gotovo cijelu stanicu.
Lipidi su važni plastični materijali. Oni mogu formirati hidrofobnu ljusku koja ograničava stanicu od okolne vodene otopine. Iz tog razloga, oni su osnova za biološke membrane.
Potkožno masno tkivo je toplinski izolator. Taloženje lipida je važna mehanička funkcija.
Glavni lipidi ljudskog tijela su kolesterol, fosfolipidi i trigliceridi.
Masne kiseline i trigliceridi uglavnom funkcioniraju kao energetski supstrati. Kolesterol i fosfolipidi koriste se u druge svrhe - za stvaranje biološki aktivnih tvari i membrana.
Upotreba triglicerida:
Taloženje u masnom tkivu, katabolizam - izgradnja membrane.
Izvori triglicerida:
Dolaze s hranom i mobiliziraju se iz masnog tkiva.
Nastaju od ugljikohidrata i proteina. Povećanim unosom supstrata oni se u jetri pretvaraju u trigliceride i u krvi prenose u masno tkivo gdje i ostaju.
Glavni oblik taloženja lipida u masnom tkivu su trigliceridi.
Glavni energetski supstrat kojim se stanice opskrbljuju iz masnog tkiva su masne kiseline. To je zbog činjenice da masne kiseline bolje prodiru u stanične membrane.
Ketonska tijela su brži energetski supstrat. Ketonska tijela nastaju u jetri. Ketonska tijela mogu koristiti tkiva koja se brzo mijenjaju. Ali da bi se ketonska tijela potpuno oksidirala, potrebni su produkti oksidacije ugljikohidrata. Stoga, u prisutnosti poremećaja u katabolizmu ugljikohidrata, ketonska tijela se nakupljaju u krvi.
Stvaranje lipoproteina (LP) u tijelu je nužnost zbog hidrofobnosti (netopljivosti) lipida. Potonji su obavijeni proteinskom ljuskom koju čine posebni transportni proteini - apoproteini, koji osiguravaju topljivost lipoproteina. Osim hilomikrona (CM), u tijelu životinja i ljudi nastaju lipoproteini vrlo niske gustoće (VLDL), lipoproteini srednje gustoće (IDL), lipoproteini niske gustoće (LDL) i lipoproteini visoke gustoće (HDL). Fino razdvajanje na klase postiže se ultracentrifugiranjem u gradijentu gustoće i ovisi o omjeru količine proteina i lipida u česticama, jer lipoproteini su supramolekularne tvorevine koje se temelje na nekovalentnim vezama. U ovom slučaju, CM se nalaze na površini krvnog seruma zbog činjenice da sadrže do 85% masti, a lakši su od vode; na dnu epruvete za centrifugu nalaze se HDL, koji sadrže najveću količinu bjelančevine.
Druga klasifikacija LP-a temelji se na elektroforetskoj pokretljivosti. Tijekom elektroforeze u poliakrilamidnom gelu CM kao najveće čestice ostaje na startu, VLDL stvara pre-β - LP frakciju, LDPP i CPDL - β - LP frakciju, HDL - α - LP frakciju.
Svi lijekovi izgrađeni su od hidrofobne jezgre (masti, kolesteril esteri) i hidrofilne ovojnice koju predstavljaju proteini, te fosfolipidi i kolesterol. Njihove hidrofilne skupine okrenute su prema vodenoj fazi, a hidrofobni dijelovi prema središtu, jezgri. Svaka vrsta lipida nastaje u različitim tkivima i prenosi određene lipide. Dakle, CM transportiraju masti dobivene hranom iz crijeva u tkiva. CM se sastoje od 84-96% egzogenih triacilglicerida. Kao odgovor na masno opterećenje, kapilarne endotelne stanice oslobađaju enzim lipoprotein lipazu (LPL) u krv, koji hidrolizira molekule HM masti u glicerol i masne kiseline. Masne kiseline se transportiraju u različita tkiva, a topljivi glicerol transportira se u jetru, gdje se može koristiti za sintezu masti. LPL je najaktivniji u kapilarama masnog tkiva, srca i pluća, što je povezano s aktivnim taloženjem masti u adipocitima i posebnošću metabolizma u miokardu, koji koristi puno masnih kiselina u energetske svrhe. U plućima se masne kiseline koriste za sintezu surfaktanta i potporu aktivnosti makrofaga. Nije slučajno da se mast jazavca i medvjeda koristi u narodnoj medicini za plućne patologije, a sjeverni narodi koji žive u teškim klimatskim uvjetima rijetko obolijevaju od bronhitisa i upale pluća kada jedu masnu hranu.
S druge strane, visoka aktivnost LPL u kapilarama masnog tkiva potiče pretilost. Također postoje dokazi da se tijekom posta smanjuje, ali se povećava aktivnost mišićnog LPL-a.
Zaostale CM čestice hepatociti hvataju endocitozom, gdje ih enzimi lizosoma razgrađuju na aminokiseline, masne kiseline, glicerol i kolesterol. Jedan dio kolesterola i ostalih lipida izravno se izlučuje u žuč, drugi se pretvara u žučne kiseline, a treći se uključuje u VLDL. Potonji sadrže 50-60% endogenih triacilglicerida, stoga su nakon izlučivanja u krv, kao i CM, izloženi djelovanju lipoprotein lipaze. Kao rezultat, VLDL gubi TAG, koji zatim koriste masne i mišićne stanice. Tijekom katabolizma VLDL-a povećava se relativni postotak kolesterola i njegovih estera (EC) (osobito pri konzumiranju hrane bogate kolesterolom), te se VLDL pretvara u LDLP, koji kod mnogih sisavaca, osobito glodavaca, preuzima jetra i potpuno ga preuzima. razgrađuju se u hepatocitima. U ljudi, primata, ptica i svinja, veliki dio LDPP-a u krvi, koji nije zarobljen od strane hepatocita, pretvara se u LDL. Ova je frakcija najbogatija kolesterolom i kolesterolom, a budući da je povišeni kolesterol jedan od prvih čimbenika rizika za razvoj ateroskleroze, LDL se naziva najaterogenijom frakcijom LP. LDL kolesterol koriste nadbubrežne stanice i spolne žlijezde za sintezu steroidnih hormona. LDL opskrbljuje kolesterolom hepatocite, bubrežni epitel, limfocite i stanice vaskularne stijenke. Zbog činjenice da su same stanice sposobne sintetizirati kolesterol iz acetil koenzima A (AcoA), postoje fiziološki mehanizmi koji štite tkivo od viška kolesterola: inhibicija proizvodnje vlastitog internog kolesterola i receptora za lipidne apoproteine, budući da je svaka endocitoza posredovano receptorom. Sustav odvodnje HDL-a prepoznat je kao glavni stabilizator staničnog kolesterola.
HDL prekursori nastaju u jetri i crijevima. Sadrže visok postotak proteina i fosfolipida, vrlo su male veličine, slobodno prodiru kroz krvožilnu stijenku, vežu višak kolesterola i izbacuju ga iz tkiva, a same postaju zreli HDL. Dio EC prelazi izravno u plazmi iz HDL u VLDL i LDLP. U konačnici, sve LP-e razgrađuju lizosomi hepatocita. Dakle, gotovo sav "višak" kolesterola ulazi u jetru i izlučuje se iz nje kao dio žuči u crijeva, uklanjajući se s izmetom.
Lipidi su spojevi netopivi u vodi, pa su za njihov transport u krvi potrebni posebni nosači topljivi u vodi. Takvi transportni oblici su lipoproteini krvne plazme koji spadaju u slobodne lipoproteine (LP). Resintetizirana mast u crijevnim stanicama, odnosno sintetizirana mast u stanicama drugih organa i tkiva, može se prenositi krvlju tek nakon uključivanja u lijek, pri čemu proteini imaju ulogu stabilizatora.
LP micele imaju vanjski sloj i jezgru. Vanjski sloj se sastoji od proteina, PL i slobodnog kolesterola, koji imaju hidrofilne polarne skupine i pokazuju afinitet prema vodi. Jezgra se sastoji od TG i CS estera. Svi ti spojevi uključeni u jezgru nemaju hidrofilne skupine.
LP prijenos: PL, TG, kolesterol. Može prenositi neke vitamine topive u mastima (A, D, E, K). Postoje 4 klase transportnih lijekova, koji se međusobno razlikuju po kemijskom sastavu, veličini micela i transportiranim lipidima. Budući da imaju različite gustoće i brzine taloženja u otopini NaCl, dijele se u sljedeće skupine:
HM – hilomikroni. Nastaju u stijenci tankog crijeva;
VLDL – lipoproteini vrlo niske gustoće – stvaraju se u stijenci crijeva i jetri;
LDL – lipoproteini niske gustoće – nastaju u stijenci crijeva, jetri i endotelu kapilara iz VLDL pod djelovanjem lipoprotein lipaze;
HDL – lipoproteini visoke gustoće – stvaraju se u stijenci tankog crijeva i jetre.
Dakle, lipide u krvi stvaraju i izlučuju 2 vrste stanica – enterociti i hepatociti. Tijekom elektroforeze proteina krvnog seruma, LP se kreću u zoni a- i b-globulina, stoga se na temelju njihove elektroforetske pokretljivosti mogu označiti kao:
VLDL – pre-b-LP
LDL – b-LP
HDL – a-LP
XM - kao najveće čestice po veličini i najteže, ne miču se tijekom elektroforeze i ostaju na startu.
Opće je prihvaćeno da CM nema u krvi na prazan želudac, a posebno se aktivno sintetiziraju u stijenci tankog crijeva nakon uzimanja masnog obroka. Oni prenose uglavnom TG iz crijevnih stanica i masnih depoa u stanice organa i tkiva. Micele su velike i stoga ne prodiru kroz stijenke krvnih žila. Razgradnja CM je završena 10-12 sati nakon jela pod utjecajem lipoproteinske lipaze jetre, masnog tkiva i endotela kapilara. Produkti hidrolize sudjeluju u staničnom metabolizmu.
VLDL i LDL prenose pretežno kolesterol. Te ga frakcije unose u stanice organa i tkiva koje kolesterol koriste za izgradnju biomembrana, za stvaranje steroidnih hormona i vitamina D. Nazivaju se i aterogena razlomci (pre-b i b).
HDL prenosi kolesterol iz stanica i tkiva u jetru, gdje se oksidira, pretvarajući se u žučne kiseline. Ovaj antiaterogeno frakcija.
VLDL, LDL i HDL apsorbiraju se endocitozom u stanice jetre, crijeva, bubrega, nadbubrežnih žlijezda i masnog tkiva te se uništavaju u lizosomima ili mikrosomima.
Resintetizirana mast u stijenci crijeva spaja se s malom količinom proteina i tvori stabilne složene čestice zvane XM. Budući da su čestice velike, one ne mogu prodrijeti iz endotela crijevnih stanica u krvne kapilare. Difundiraju u intestinalni limfni sustav, a iz njega u torakalni kanal i u krvotok. Već nakon jela, nakon 1,5-2 sata, terminalni CM počinju rasti, koji dostižu maksimum 4-6 sati nakon jedenja masne hrane.
Aktivan ulaz CM u jetru i masno tkivo, gdje se pod utjecajem enzima lipoprotein lipaze (regulira heparin) razgrađuju uz stvaranje glicerola i IVH. Dio IVH koriste stanice, a dio transportni proteini u krvi. Raspad CM je završen 10-12 sati nakon jela.
Indeks aterogenosti– omjer kolesterola u VLDL, LDL i HDL.
DO ater= (HSlpnp + HSlpnp) / HSlppp. Normalno, indeks aterogenosti je 2-3, ali ako je iznad 4, tada je vjerojatnost razvoja ateroskleroze vrlo visoka.
SAVEZNA DRŽAVNA OBRAZOVNA USTANOVA VISOKOG STRUČNOG OBRAZOVANJA "MOSKVSKA DRŽAVNA AKADEMIJA ZA VETERINARSKU MEDICINU I BIOTEHNOLOGIJU NAZVANA PO K. I. SKRJABINU"
__________________________________________________________________
METABOLIZAM LIPIDA I NJEGOVI POREMEĆAJI U TIJELU ŽIVOTINJA
predavanje
Preporučeno od strane obrazovne i metodološke komisije Fakulteta veterinarske medicine Moskovske državne akademije za veterinarsku medicinu i biologiju nazvanu po. za studente specijalnosti 111201 – Veterinarska medicina
Moskva 2009
UDK 636: 612.015
Izvanredni profesor Zavoda za patološku fiziologiju nazvan. V. M. Koropova, kandidat bioloških znanosti Metabolizam lipida i njegovi poremećaji u životinja: Predavanje. – M.: FGOU VPO MGAVMiB, 2009, 19 str.
Prikazana je građa o osnovnim mehanizmima metabolizma lipida u životinja i nekim njihovim poremećajima.
Namijenjeno studentima Veterinarskog fakulteta.
Recenzenti: , doktor bioloških znanosti, profesor; , Doktor bioloških znanosti, prof.
Odobreno od strane Nastavno-metodološkog povjerenstva Veterinarskog fakulteta (zapisnik od 9. travnja 2009.).
Korištene kratice………………………..………………4
1. Važnost lipida u tijelu………………………….………. 5
2. Probava i apsorpcija lipida, njihovi poremećaji…………6
3. Transport lipida u tijelu…………………………………7
4. Hiperlipemija…………………………………………………… …..9
5. Neurohumoralna regulacija lipostata………………………..9
6. Povrede lipostata……………………………………………….11
7. Ketoza i steatoza jetre………………… ……………………….12
8. Uloga peroksidacije lipida u oštećenju stanica...15
9. Eikozanoidi………………………………………………………16
10. Ateroskleroza…………………………………………………………17
Bibliografija………………………………………………………… …18
Korištene kratice.
ACoA – acetil koenzim A
BAS – biološki aktivne tvari
SMC – glatke mišićne stanice
VFA – hlapljive masne kiseline
LP - lipoproteini
LPL – lipoproteinska lipaza
LDL – lipoproteini niske gustoće
VLDL – lipoproteini vrlo niske gustoće
DILP – Lipoproteini srednje gustoće
LPO – peroksidacija lipida
FFA - slobodne masne kiseline
TAG – triacilgliceridi (masti)
FLIP – fosfolipidi
HM – hilomikroni
CN - kolesterol
TCA ciklus - ciklus trikarboksilnih kiselina
EC - esteri kolesterola
Lipidi– skupina hidrofobnih tvari topljivih u organskim otapalima (eter, benzen, aceton), izgrađenih uz sudjelovanje alkohola i masnih kiselina.
1, Važnost lipida u tijelu
DO jednostavni lipidi uključuju masne kiseline i acilgliceride (na primjer, neutralne masti - triacilgliceridi), steroide (kolesterol i njegove estere s masnim kiselinama, žučne kiseline, kalciferole), voskove (lanolin, spermaceti).
Složeni lipidi uz alkohole i masne kiseline sadrže ostatke spojeva drugih klasa - fosfornu kiselinu, dušične baze, ugljikohidrate. Složeni lipidi uključuju fosfolipide, sfingolipide itd.
Triacilgliceridi (TAG) uglavnom se nalaze u potkožnom masnom tkivu, obavljajući funkcije rezervne energije, toplinske izolacije i amortizacije. Masni jastučić oko bubrega, srca i očne jabučice također ima važnu ulogu pri amortizaciji udara. Tijekom oksidacije TAG-a oslobađa se ne samo najveća količina energije, već i vode koja je važna za dobivanje endogene vlage od strane životinja u sušnim mjestima i pustinjama (deve, gerbili itd.). Za energetske potrebe djelomično skeletni mišići, a miokard uglavnom koristi masne kiseline, mozak koristi glukozu, ali je u mogućnosti iskoristiti i ketonska tijela.
Fosfolipidi i kolesterol imaju funkciju stvaranja membrane. Derivati kolesterola - steroidni hormoni kore nadbubrežne žlijezde i spolnih žlijezda - obavljaju regulatorne funkcije. Živčano tkivo sadrži lipide do 50% suhe tvari, uglavnom fosfolipide (FLIP) i sfingolipide.
Nedostatak prehrambenih lipida opasan je prvenstveno zbog nedostatka višestruko nezasićenih masnih kiselina. Linolna i linoleinska kiselina se ne sintetiziraju u ljudskom organizmu, zbog čega se nazivaju esencijalne, odnosno esencijalne. Zajedno s drugim polienskim kiselinama označeni su kao vitamin F (od engleskog fat - salo), iako je potreba za njima nekoliko grama dnevno, te ne spadaju u kriterije pravih vitamina. U pokusima na štakorima s nedostatkom vitamina F zabilježen je zastoj u rastu, dermatitis i ćelavost sa simptomima hiperkeratoze. Vitamini topljivi u mastima A, D, E i K ulaze u organizam s nedostatkom potonjih, uočavaju se poremećaji u rastu, razvoju, reproduktivnoj funkciji, smanjena otpornost itd. Treba napomenuti da će životinje preživača ne iskusite nedostatak višestruko nezasićenih masnih kiselina, što je povezano s prehrambenim navikama i probavom. Biljna hrana sadrži mnogo nezasićenih kiselina.
2. Probava i apsorpcija lipida, njihovi poremećaji
Probava lipida odvija se u tankom crijevu. Budući da su lipidi netopljivi u vodi, djelovanju lipolitičkih enzima prethodi emulgiranje lipida sa žučnim solima (taurokolna, glikokolna). Kao rezultat, velike kapljice lipida se raspršuju u mnogo malih, povećavajući područje utjecaja za enzime gušterače (lipaza, fosfolipaza A, kolesterol esteraza). Budući da je mlijeko jedini prirodni proizvod koji sadrži emulgirane masti, razgradnja njegovih komponenti u mladih sisavaca počinje u želucu pod djelovanjem želučane lipaze, koja je aktivna pri neutralnoj pH vrijednosti (kod odraslih je neaktivna, budući da pH njihove želučanog soka je 1,5 – 2,5). Nakon toga se razgradnja mliječnih masti nastavlja u crijevima pod djelovanjem lipaze pankreasa. Produkti hidrolize lipida su masne kiseline, 2-monoacilgliceridi, kolesterol i dr. Oni tvore miješane micele sa žučnim kiselinama, fosfolipidima i žučnim kolesterolom koji difundiraju kroz membrane u enterocite. Zajedno s njima apsorbiraju se i vitamini topivi u mastima.
U stanicama sluznice tankog crijeva dolazi do resinteze masti karakterističnih za ovaj organizam, te estera kolesterola i FLIP-a. Iz tih komponenti i proteina nastaju lipoproteinski kompleksi – hilomikroni (CM). Velike su veličine, pa se egzocitozom najprije otpuštaju u chyle formiran u limfnom sustavu crijevnih resica, te kroz torakalni limfni kanal ulaze u sustavnu cirkulaciju. Neki od njih se zatim talože u plućima.
Kratke masne kiseline (do 10 atoma ugljika, na primjer, octena, propionska, maslačna) apsorbiraju se bez micela, izravno u portalnu venu, vežu se za transport albumina i transportiraju u jetru.
Uzroci poremećene probave i apsorpcije lipida mogu biti različiti čimbenici.
2. Poremećeno izlučivanje pankreasnog soka s lipolitičkim enzimima.
3. Proljev i ubrzanje pokretljivosti crijeva
4. Oštećenje crijevnog epitela raznim otrovima (monidoacetat, soli teških metala), infektivnim agensima, antibioticima (neomicin).
5. Kršenje živčane i endokrine regulacije - smanjena vagalna aktivnost, višak adrenalina, nedostatak hormona nadbubrežne žlijezde, tiroksina, slabi apsorpciju masti. Uzrok tome je i nedostatak kolecistokinina i gastrina - hormona gastrointestinalnog trakta koji reguliraju kontrakciju žučnog mjehura, procese emulgiranja i razgradnju masti.
6. Višak dvovalentnih zemnoalkalijskih kationa (kalcij, magnezij) u hrani i vodi, što dovodi do stvaranja netopljivih soli masnih kiselina.
U svim slučajevima poremećene probave i apsorpcije lipida, oni se pojavljuju u velikim količinama u izmetu. To se zove steatoreja. Ako je steatoreja uzrokovana aholijom, tada stolica, osim što je glinastog izgleda, postaje i bjelkasta, diskolorirana zbog nedostatka žučnih pigmenata. Istovremeno, zbog gubitka vitamina topivih u mastima i polien masnih kiselina može doći do gubitka kose, krzna, dermatitisa, krvarenja i osteoporoze. U naprednim slučajevima razvija se iscrpljenost tijela.
3. Transport lipida u tijelu
Stvaranje lipoproteina (LP) u tijelu je nužnost zbog hidrofobnosti (netopljivosti) lipida. Potonji su obavijeni proteinskom ljuskom koju čine posebni transportni proteini - apoproteini, koji osiguravaju topljivost lipoproteina. Osim hilomikrona (CM), u tijelu životinja i ljudi nastaju lipoproteini vrlo niske gustoće (VLDL), lipoproteini srednje gustoće (IDL), lipoproteini niske gustoće (LDL) i lipoproteini visoke gustoće (HDL). Fino razdvajanje na klase postiže se ultracentrifugiranjem u gradijentu gustoće i ovisi o omjeru količine proteina i lipida u česticama, jer su lipoproteini supramolekularne tvorevine koje se temelje na nekovalentnim vezama. U ovom slučaju, CM se nalaze na površini krvnog seruma zbog činjenice da sadrže do 85% masti, a lakši su od vode; na dnu epruvete za centrifugu nalaze se HDL, koji sadrže najveću količinu bjelančevine.
Druga klasifikacija LP-a temelji se na elektroforetskoj pokretljivosti. Tijekom elektroforeze u poliakrilamidnom gelu CM kao najveće čestice ostaje na startu, VLDL stvara pre-β - LP frakciju, LDPP i CPDL - β - LP frakciju, HDL - α - LP frakciju.
Svi lijekovi izgrađeni su od hidrofobne jezgre (masti, kolesteril esteri) i hidrofilne ovojnice koju predstavljaju proteini, te fosfolipidi i kolesterol. Njihove hidrofilne skupine okrenute su prema vodenoj fazi, a hidrofobni dijelovi prema središtu, jezgri. Svaka vrsta lipida nastaje u različitim tkivima i prenosi određene lipide. Dakle, CM transportiraju masti dobivene hranom iz crijeva u tkiva. CM se sastoje od 84-96% egzogenih triacilglicerida. Kao odgovor na masno opterećenje, kapilarne endotelne stanice oslobađaju enzim lipoprotein lipazu (LPL) u krv, koji hidrolizira molekule HM masti u glicerol i masne kiseline. Masne kiseline se transportiraju u različita tkiva, a topljivi glicerol transportira se u jetru, gdje se može koristiti za sintezu masti. LPL je najaktivniji u kapilarama masnog tkiva, srca i pluća, što je povezano s aktivnim taloženjem masti u adipocitima i posebnošću metabolizma u miokardu, koji koristi puno masnih kiselina u energetske svrhe. U plućima se masne kiseline koriste za sintezu surfaktanta i potporu aktivnosti makrofaga. Nije slučajno da se mast jazavca i medvjeda koristi u narodnoj medicini za plućne patologije, a sjeverni narodi koji žive u teškim klimatskim uvjetima rijetko obolijevaju od bronhitisa i upale pluća kada jedu masnu hranu.
S druge strane, visoka aktivnost LPL u kapilarama masnog tkiva potiče pretilost. Također postoje dokazi da se tijekom posta smanjuje, ali se povećava aktivnost mišićnog LPL-a.
Zaostale CM čestice hepatociti hvataju endocitozom, gdje ih enzimi lizosoma razgrađuju na aminokiseline, masne kiseline, glicerol i kolesterol. Jedan dio kolesterola i ostalih lipida izravno se izlučuje u žuč, drugi se pretvara u žučne kiseline, a treći se uključuje u VLDL. Potonji sadrže 50-60% endogenih triacilglicerida, stoga su nakon izlučivanja u krv, kao i CM, izloženi djelovanju lipoprotein lipaze. Kao rezultat, VLDL gubi TAG, koji zatim koriste masne i mišićne stanice. Tijekom katabolizma VLDL-a povećava se relativni postotak kolesterola i njegovih estera (EC) (osobito pri konzumiranju hrane bogate kolesterolom), te se VLDL pretvara u LDLP, koji kod mnogih sisavaca, osobito glodavaca, preuzima jetra i potpuno ga preuzima. razgrađuju se u hepatocitima. U ljudi, primata, ptica i svinja, veliki dio LDPP-a u krvi, koji nije zarobljen od strane hepatocita, pretvara se u LDL. Ova je frakcija najbogatija kolesterolom i kolesterolom, a budući da je povišeni kolesterol jedan od prvih čimbenika rizika za razvoj ateroskleroze, LDL se naziva najaterogenijom frakcijom LP. LDL kolesterol koriste nadbubrežne stanice i spolne žlijezde za sintezu steroidnih hormona. LDL opskrbljuje kolesterolom hepatocite, bubrežni epitel, limfocite i stanice vaskularne stijenke. Zbog činjenice da su same stanice sposobne sintetizirati kolesterol iz acetil koenzima A (AcoA), postoje fiziološki mehanizmi koji štite tkivo od viška kolesterola: inhibicija proizvodnje vlastitog internog kolesterola i receptora za lipidne apoproteine, budući da je svaka endocitoza posredovano receptorom. Sustav odvodnje HDL-a prepoznat je kao glavni stabilizator staničnog kolesterola.
HDL prekursori nastaju u jetri i crijevima. Sadrže visok postotak proteina i fosfolipida, vrlo su male veličine, slobodno prodiru kroz krvožilnu stijenku, vežu višak kolesterola i izbacuju ga iz tkiva, a same postaju zreli HDL. Dio EC prelazi izravno u plazmi iz HDL u VLDL i LDLP. U konačnici, sve LP-e razgrađuju lizosomi hepatocita. Dakle, gotovo sav "višak" kolesterola ulazi u jetru i izlučuje se iz nje kao dio žuči u crijeva, uklanjajući se s izmetom.
4. Hiperlipemija
Hiperlipemija je povećanje sadržaja masti u krvi. Hiperlipemija može biti nutritivna, transportna i retencijska.
Nutritivna hiperlipemija se javlja nakon uzimanja masne hrane. Istodobno s povećanjem sadržaja masti u krvi može doći do povećanja sadržaja drugih tvari iz skupine lipida (fosfolipidi, kolesterol). Ukupno povećanje ovih tvari naziva se lipidemijom. Nutritivnu hiperlipemiju najčešće karakterizira privremeni porast hilomikrona u krvi.
Prijevoz hiperlipemija je povezana s povećanom razgradnjom masti i oslobađanjem slobodnih masnih kiselina (FFA) iz depoa tijekom gladovanja, stresa i dijabetesa. Lipolizu masnog tkiva i koštane srži pospješuju adrenalin, glukagon, tiroksin, somatotropin i adrenokortikotropni hormon. Kod dugotrajne hiperventilacije pluća dolazi do mobilizacije masti iz pluća, što dovodi do hiperlipemije (to djelomično objašnjava pretilost mnogih opernih pjevača).
Zadržavanje hiperlipemija (od latinskog retentio - odgoditi) razvija se zbog kašnjenja u prijelazu neutralnih masti iz krvi u tkiva. Može biti posljedica nedovoljne koncentracije albumina koji transportiraju FFA - u patologiji jetre (nedovoljna sinteza albumina), u nefrotskom sindromu (gubitak proteina urinom).
Retencijska hiperlipemija može biti povezana s nedovoljnom aktivnošću lipoprotein lipaze: zbog smanjenja heparina, koji ga aktivira u aterosklerozi, nefrozi; zbog nedostatka lipokaina, koji aktivira protok LPL u krv, kod dijabetes melitusa.
5. Neurohumoralna regulacija lipostata
Lipostat se konvencionalno naziva sustavom koji kontrolira postojanost tjelesne težine odraslog organizma. Središnja regulatorna jedinica lipostata je hipotalamus, gdje se nalaze jezgre autonomnog živčanog sustava. Indijski patofiziolog je 1961. godine ustanovio da se centar za glad nalazi u ventrolateralnim jezgrama hipotalamusa, a centar za sitost (sitost) u ventromedijalnim jezgrama. Centar za sitost povezan je s centrom za glad putem sinapsi koje prenose inhibitorne impulse. Procesi u tijelu lipogeneza(stvaranje masti) i lipoliza, odnosno mobilizacija masti (tj. njena razgradnja na glicerol i masne kiseline) aktivni su i konstantni, a najizraženiji su u masnom tkivu.
Masno tkivo nije inertno, kako se na prvi pogled čini, već metabolički vrlo aktivna tvorevina, u kojoj se neprestano odvijaju procesi sinteze i razgradnje masti, bjelančevina i ugljikohidrata. Od fibroblasta nastaju adipociti – stanice masnog tkiva. Adipociti imaju mnogo neurotransmiterskih i hormonskih receptora na svojoj površini (sjetimo se da je masno tkivo ovisno o inzulinu).
U "nahranjenom" stanju, adipociti luče peptidni hormon leptin, koji se veže na leptinske receptore u ventromedijalnim jezgrama (centar sitosti). Iz centra zasićenja šalju se inhibitorni signali u centar za glad i glad se povlači. Također, pod utjecajem leptina smanjuje se proizvodnja neuropeptida Y u centru za glad. Neuropeptid Y stimulira ponašanje životinja, traženje i konzumaciju hrane te proizvodnju inzulina. Dakle, u početku sama masna stanica normalno reagira na zasićenje i šalje leptinske signale o tome.
Lipogeneza aktivirati nakon jela. Povećava se koncentracija glukoze u krvi, što potiče lučenje inzulina. Pod utjecajem inzulina aktiviraju se proteini prijenosnici glukoze (GLUT-4) te ona ulazi u adipocite gdje se pretvara u glicerofosfat. Inzulin također aktivira sintezu lipoprotein lipaze u adipocitima i njezinu izloženost stjenkama površine kapilara. LPL hidrolizira hilomikron masti i VLDL u glicerol i masne kiseline. Glicerol se transportira u jetru, budući da za njega nema enzima u adipocitima, a masne kiseline prodiru u njih, vežu se za stvoreni glicerofosfat i pretvaraju u vlastite triacilgliceride. Dakle, ako u hrani postoji značajna količina glukoze, moguće je prekomjerno taloženje masti u masnom tkivu, jer tamo samo iz glukoze nastaje aktivirani glicerol.
Jetra također povećava sintezu masti i njihovo izlučivanje u krv kao VLDL. VLDL dostavlja masti u kapilare masnog i mišićnog tkiva, gdje se podvrgavaju hidrolizi pomoću LPL.
U razmacima između obroka, tijekom posta, koncentracija inzulina u krvi se smanjuje, ali se povećava sadržaj glukagona. Tijekom tjelesne aktivnosti povećava se lučenje adrenalina. Povećanje simpatoadrenalne aktivnosti i razine glukagona doprinosi povećanju lipoliza. Masne kiseline otpuštene u krv vežu se za albumin i postaju važan izvor energije za mišiće, srce, jetru i bubrege. No, apsolutna koncentracija FFA ni u ovom vremenskom intervalu nije visoka, jer je poluživot masnih kiselina vrlo kratak (manje od 5 minuta), brzo se metaboliziraju, noseći veliki protok energije. Lipoliza prestaje nakon uzimanja hrane i lučenja inzulina.
Glukokortikoidni hormoni povećavaju mobilizaciju masti iz masnog tkiva. Ali ovaj učinak može biti zasjenjen drugim učincima ovih hormona: sposobnošću da izazovu hiperglikemiju kroz glukoneogenezu i stimuliraju lučenje inzulina. A inzulin, kao što je već spomenuto, potiče lipogenezu.
Sudjelovanje živčanog sustava u regulaciji metabolizma masti potvrđuju podaci da dugotrajni emocionalni stres dovodi do mobilizacije masti iz masnih depoa i gubitka težine. Isti se učinak opaža kada su simpatički živci nadraženi. Desimpatizacija sprječava oslobađanje masti iz depoa. Iritacija parasimpatičkih živaca praćena je taloženjem masti.
6. Kršenje Lipostata
Povreda složenog sustava neurohumoralne regulacije leži u osnovi viška taloženja masti u masnom tkivu - pretilosti.
_Primarna pretilost razvija se kada kalorijski sadržaj prehrane premašuje energetske potrebe tijela. Nedavno se vjeruje da apsolutni ili relativni nedostatak leptina igra ključnu ulogu u razvoju primarne pretilosti.
Ljudi i životinje imaju "gen za pretilost" - gen za pretilost (ob), koji kodira leptin. Kao posljedica mutacije gena smanjuje se količina leptina u krvi (apsolutni nedostatak leptina). Niske razine leptina u krvi signaliziraju nedovoljne rezerve masti u tijelu. Centar za glad nastavlja lučiti neuropeptid Y, što dovodi do povećanja apetita i, kao rezultat toga, povećanja tjelesne težine.
U drugim slučajevima može postojati genetski defekt u receptorima za leptin u hipotalamusu. U tom se slučaju količina leptina povećava nekoliko puta, ali njegov relativni nedostatak djelovanja na hipotalamus održava centar za glad u stalnoj aktivnosti.
Vrijedno je naglasiti da je pretilost stvar ravnoteže. Debljanje je nemoguće bez viška unosa energije nad njezinom potrošnjom, stoga je tjelesna neaktivnost faktor rizika za razvoj pretilosti.
Sekundarna pretilost manifestira se kao sindrom s razvojem primarnih neuroendokrinih poremećaja, što dovodi do neravnoteže između lipogeneze i lipolize. Tako hipotireoza, hiperkortikosolizam, hiperinzulinizam i neki tumori mozga dovode do razvoja pretilosti.
Pretile krave imaju veću vjerojatnost da će razviti ketozu nego životinje prosječne debljine. Kod pretilih životinja poremećen je reproduktivni ciklus, a krave često ostaju neplodne. Telad, janjad, prasad i štenci od pretilih majki često se rađaju oslabljeni i skloni bolestima. Uz pretilost, funkcioniranje mišićno-koštanog sustava je poremećeno, povećava se opterećenje srca, pojavljuje se umor, povećava se rizik od razvoja ateroskleroze i tromboze.
Za razliku od pretilosti, moguće je da iscrpljenost, koju karakterizira značajan gubitak zaliha tjelesne masti. Iscrpljenost se opaža kod produljenog posta, jakih hiperpiretičkih vrućica, dijabetesa tipa 1 i emocionalnog stresa.
Lipolitičko djelovanje snažno je izraženo kod hipertireoze, s pojačanim otpuštanjem adrenalina i norepinefrina iz srži nadbubrežnih žlijezda, te kroničnih bolesti. Poznata je kaheksija raka, koja se javlja zbog intoksikacije. Osim toga, maligne stanice su "zamke" glukoze i drugih energetskih ekvivalenata. U dijabetes melitusu tipa 1 (hipoinzulinemija), anabolički učinci inzulina na lipide i proteine su izgubljeni. Stoga je iscrpljenost bitan dio kliničke slike dijabetesa ovisnog o inzulinu. Kaheksija se očituje u teškim dugotrajnim lezijama gastrointestinalnog trakta povezanih s poremećenom apsorpcijom tvari.
7. Ketoza i steatoza jetre
Središnje čvorište veza svih metabolizama je acetil koenzim A. Nastaje pri razgradnji glukoze, glicerola, nekih aminokiselina, te β-oksidaciji masnih kiselina. Većina ACoA se zatim oksidira u ciklusu trikarboksilne kiseline u vodu i ugljični dioksid, osiguravajući proizvodnju energije. Za uključivanje ACoA u TCA ciklus neophodna je dovoljna količina oksaloacetata. Drugi dio ACoA služi kao osnova za sintezu masnih kiselina, treći - kolesterola, četvrti se koristi za stvaranje ketonskih tijela. Ketonska tijela su molekule topljive u vodi - aceton, acetotoctena i β-hidroksimaslačna kiselina. U monostrijatnih životinja i ljudi, sinteza ketonskih tijela događa se samo u mitohondrijima jetre. U monostrijatnih životinja mogu nastati u sluznici proventrikulusa.
Ketonska tijela mogu se koristiti za energetske potrebe mozga, mišića, bubrega i pluća, posebno u uvjetima posta. Tijekom trudnoće iskorištavaju ih posteljica i fetus. Ketonska tijela su normalni metaboliti koji se brzo troše, pa je njihova koncentracija u krvi niska (kod čovjeka 3 - 10 mg/dl, kod krupne i sitne stoke do 6 ml/dl).
Tijekom dugotrajnog posta ketonska tijela postaju glavni izvor energije za skeletne mišiće, srce i bubrege, a glukozu troše mozak i crvena krvna zrnca. Tada se mozak adaptira na korištenje acetooctene kiseline. Ako se ketonska tijela nakupljaju u prekomjernoj količini u krvi (ketonemija), onda se pojavljuju u mokraći (ketonurija), a kod životinja u laktaciji u mlijeku (ketonolaktija) - mlijeko postaje gorko i neprikladno za upotrebu. Ovo stanje se naziva ketoza. Aceton se u pravilu uklanja znojem, urinom i mlijekom koje tkiva ne iskorištavaju. Aceton je taj koji stvara neobičan voćni miris životinje ili osobe.
Hiperketonemija je opasna za tijelo, jer dovodi do acidoze, prvo kompenzirane, sa smanjenjem alkalne rezerve, a zatim nekompenzirane, s pomakom pH. Nakupljanje protona u krvi remeti vezanje kisika hemoglobinom i funkciju drugih proteina, uključujući enzime. Javljaju se drugi metabolički poremećaji i znakovi kardiovaskularnog zatajenja. Životinjama se smanjuje ili poremećuje apetit, gubi na težini, pada produktivnost, a često dolazi do pobačaja. Uz acidozu, kosti gube kalcij; prvi znakovi toga su resorpcija kaudalnih kralježaka i zadnjih rebara te krhkost rogova. Hiperketonemija može dovesti do ketoacidotične kome.
Glavna veza u patogenezi ketoze smatra se ubrzanom razgradnjom masti uz stvaranje ACoA na pozadini nedostatka ugljikohidrata ili oksaloacetata za TCA ciklus.
Konvencionalno se razlikuju primarna i sekundarna ketoza. Primarna ketoza javlja se kod preživača kao posljedica neuravnotežene ili nekvalitetne hranidbe. Najčešće primarna ketoza pogađa visokoproduktivne krave u razdoblju najveće laktacije ili prije teljenja, pretile krave, ovce i koze s više gravidnosti. Niskoproduktivna goveda, svinje i konji otporni su na razvoj ketoze.
Do gladovanja ugljikohidratima može doći kada se omjer šećera i bjelančevina u prehrani smanji s optimalnih 1-1,5:1 na 0,2-0,6:1. Prilikom hranjenja koncentriranom hranom bogatom proteinima, pogačama i drugim komponentama s visokim udjelom masti, probava celuloze u mikroflori buraga je inhibirana, udio hlapivih masnih kiselina (VFA) se mijenja: maslačna kiselina (ketogena) se nakuplja na štetu propionske kiseline ( antiketogeni). Iz njega se glukoneogenezom sintetizira glukoza. Nemojte hraniti silažom s visokim sadržajem maslačne kiseline, pokvarenom ili pljesnivom hranom. Oni inhibiraju fermentaciju mliječne kiseline, izvor VFA i, u konačnici, glukoze. Tako dolazi do nedostatka ugljikohidrata. Kod visokoproduktivnih krava u laktaciji pogoršava se izlučivanjem ugljikohidrata u mlijeko: procjenjuje se da krava tijekom laktacije izluči do 2 kg mliječnog šećera!
U uvjetima intenzivnog metabolizma životinji su potrebne velike zalihe energije. Stoga se pojačava mobilizacija masti iz depoa, β-oksidacija masnih kiselina i stvaranje ACoA. “Masti izgaraju u plamenu ugljikohidrata.” Kako razumjeti ovu poznatu frazu? Kako bi se ACoA oksidirao u TCA ciklusu, treba se vezati s oksaloacetatom (oksalna kiselina), koja se sama sintetizira iz pirogrožđane kiseline, produkta razgradnje glukoze. Uz nedostatak glukoze dolazi do manjka oksaloacetata i nemogućnosti uključivanja svih ACoA u TCA ciklus. Višak ACoA koristi se za sintezu ketonskih tijela, zaobilaznog dobavljača energije.
Poznavanje patogeneze ketoze u preživača omogućuje primjenu propionske kiseline i glukoze kao terapijskih i korektivnih lijekova.
Sekundarna ketoza javlja se kod životinja i ljudi kao posljedica primarne bolesti bilo kojeg organa. Sekundarna ketoza može se pojaviti kod općeg gladovanja, šećerne bolesti, iscrpljujuće vrućice, velikog opterećenja mišića i patologija jetre.
Ketoacidoza doseže opasne razine kod dijabetes melitusa, koncentracija ketonskih tijela u ovoj bolesti može doseći 400-500 mg/dl. Ketoacidotička koma je jedan od uzroka smrti kod dijabetes melitusa.
Ono što je uobičajeno u patogenezi ketoze bilo koje etiologije je iscrpljivanje zaliha ugljikohidrata i povećana lipoliza. Veliki protok lipidnog materijala u obliku slobodnih masnih kiselina povezanih s albuminom juri u jetru. Jetra prolazi kroz konačni metabolizam ostataka kolesterola, LDL, HDL i luči prekursore VLDL i HDL. Ako opskrba jetre lipidima prevladava nad brzinom sastavljanja i izlučivanja VLDL-a, tada produljeno zadržavanje masti dovodi do steatoze i masne jetre (masna hepatoza). Sadržaj masti u jetri tada prelazi 8-10% mase suhe tvari. Isti se fenomen može primijetiti i u drugim organima. Povećani sadržaj masti u tkivima (osim masnog tkiva) dugo vremena naziva se masna infiltracija. Poremećaj veze masti i proteina dovodi do nakupljanja manjih ili većih masnih kapljica u citoplazmi hepatocita – masna degeneracija. Pojava velikih masnih kapljica pomiče jezgru prema periferiji i pomiče citoplazmatske organele. To može dovesti do nekrobioze, a potom i nekroze hepatocita. Aktivacija makrofaga koji provode fagocitozu nekrotičnih stanica može dovesti do fibroze, au težim slučajevima i nekroze jetre.
Dvije su glavne točke u razvoju masnog hepatitisa: povećanje opskrbe lipidima i smanjenje njihove oksidacije, osobito masnih kiselina. Povećanje dotoka lipida u jetru, kao što je već navedeno, javlja se kod nedostatka ugljikohidrata, intenzivne tjelesne aktivnosti, šećerne bolesti, odnosno kod pojačane lipolize u masnom i mišićnom tkivu. Smanjenje iskorištenja masnih kiselina nastaje kao rezultat inhibicije njihove oksidacije. Ovaj mehanizam steatoze je vodeći kod različitih intoksikacija, koje smanjuju aktivnost oksidativnih enzima. To može biti intoksikacija bakterijskim otrovima, kloroformom, arsenom, fosforom, ugljikovim tetrakloridom, nitratima itd. Čimbenici koji doprinose su hipovitaminoza, hipoksija, acidoza, autoimuni procesi.
Karnitin, transmembranski mitohondrijski shuttle, potreban je za prijenos masnih kiselina i njihovu oksidaciju u mitohondrijima hepatocita. Sastavljanje VLDL-a, koji prenosi endogene masti, zahtijeva fosfolipide koji sadrže kolin. I karnitin i kolin zahtijevaju metilne skupine. Posljedično, sve tvari koje su donori metilnih skupina pospješit će oksidaciju masnih kiselina i izlučivanje VLDL, čime se jetra oslobađa viška masnoće. Takve tvari zajednički se nazivaju "lipotropni čimbenici". Tu, uz karnitin i kolin, spadaju metionin, betain, vitamini B6 i B12.
Fosfolipidi (na primjer, lecitin) potiču aktivniju upotrebu masnih kiselina. Njihovi lipotropni učinci također su posredovani njihovom funkcijom raspršivanja.
Znanstvenici su također pokazali da stanice izvodnih kanala gušterače sadrže tvar koja ima lipotropni učinak na jetru. Zvao se lipokain. Do sada nije izoliran u svom čistom obliku, ali njegovo postojanje ipak priznaju mnogi autori.
Većina lipotropnih čimbenika ne djeluje samo na jetru, već i na bubrege, srce, te na sve organe i tkiva u kojima dolazi do oksidacije masnih kiselina i moguća je masna infiltracija zbog smanjenja tog procesa.
8. Uloga peroksidacije lipida u oštećenju stanica
Sve organske tvari podliježu oksidaciji. Tijekom oksidativnih reakcija organske molekule se uništavaju, a dio oslobođene energije pohranjuje se u obliku ATP-a.
Konačni produkt oksidativnih reakcija je voda, ali nastaju i tzv. reaktivne kisikove vrste - hidroksilni radikal, superoksidni anion, vodikov peroksid. Oni su sposobni ukloniti elektrone iz organskih molekula, pretvoriti ih u aktivne radikale i tako pokrenuti lančane reakcije molekularnog oštećenja. U leukocitima i makrofagima ovaj mehanizam služi kao osnova za "respiratornu eksploziju", tijekom koje se uništavaju bakterije i drugi objekti fagocitoze. Ovo je korisna značajka. Ali u drugim stanicama to dovodi do samouništenja organskih molekula, uključujući DNK. Peroksidacija lipida (LPO) koja se nalazi u staničnim membranama može dovesti do stanične smrti. Nezasićene masne kiseline su najpodložnije djelovanju reaktivnih spojeva kisika.
LPO uništava stanice tijekom ateroskleroze, razvoja tumora i živčane stanice koje sadrže puno lipida. Tijelo ima sustave za zaštitu stanica od reaktivnih spojeva kisika: enzime i vitamine s antioksidativnim djelovanjem. Enzim superoksid dismutaza (SOD) pretvara superoksidne anione u vodikov peroksid. Enzim katalaza razgrađuje vodikov peroksid, koji je i sam naveden kao štetni faktor. Enzim glutation peroksidaza uništava vodikov peroksid i hidroperokside lipida, štiteći membrane od oštećenja. Selen je koenzim glutation peroksidaze pa se, kao i vitamini E, C i β-karoteni, svrstava u antioksidativne zaštitni faktor.
9. Eikozanoidi
Eikozanoidi su biološki aktivne tvari koje se sintetiziraju u mnogim stanicama iz višestruko nezasićenih masnih kiselina koje sadrže 20 ugljikovih atoma (riječ eikoza na grčkom znači 20).
Eikozanoidi su "lokalni hormoni" jer se brzo razgrađuju. Eikozanoidi uključuju prostaglandine (PG), tromboksane (TX), leukotriene (LT) i druge derivate. Polienske masne kiseline, uglavnom arahidonska kiselina, iz koje nastaju eikozanoidi, ulaze u sastav membranskih fosfolipida. Oni se odvajaju od membrana djelovanjem enzima fosfolipaze A, također ugrađenog u membrane. Aktivacija enzima može se dogoditi pod utjecajem mnogih čimbenika: histamina, citokina, kontakta kompleksa antigen-antitijelo s površinom stanice, mehaničkog stresa. U citoplazmi se arahidonska kiselina pretvara u različite eikosanoide („kaskada arahidonske kiseline“). Navedeni etiološki i patogenetski čimbenici javljaju se tijekom upale, stoga se proizvedeni eikozanoidi klasificiraju kao stanični medijatori upale. Prostaglandini šire arteriole, povećavaju propusnost stanične stijenke, što potiče transudaciju i emigraciju leukocita. Leukotrieni su snažni čimbenici ketotaksije koji pospješuju kretanje leukocita do mjesta upale radi fagocitoze. Tako se javljaju glavni znakovi akutne upale: crvenilo (rubor), otok (tumor), povišena lokalna temperatura (calor) i bol (dolor). Bol nastaje zbog pretjerane stimulacije kemoreceptora protonima, tvarima sličnim histaminu, kao i baroreceptora pritiskom eksudata.
Leukociti koje tvore mastociti, alveolarni makrofagi i bronhijalne epitelne stanice uzrokuju bronhospazam i izlučivanje sluzi u lumen ovih cjevčica, čime izazivaju napadaj bronhijalne astme.
Tromboksan, koji proizvode trombociti tijekom njihove aktivacije, djeluje na same trombocite (autokrini mehanizam), povećavajući njihovu sposobnost agregacije, a istovremeno potiče kontrakciju glatkih mišićnih stanica krvnih žila, potičući njihov spazam. To stvara uvjete za stvaranje krvnog ugruška i sprječavanje krvarenja u području oštećenja žila. Trombociti se također aktiviraju kada naiđu na aterosklerotični plak. U ovom slučaju, stvaranje krvnog ugruška dovodi do ishemije i razvoja srčanog udara. Ostali eikozanoidi koje luče vaskularne endotelne stanice sprječavaju agregaciju trombocita i vazokonstrikciju. Dakle, eikozanoidi su uključeni u koagulacijski i antikoagulacijski sustav krvi.
Sintetski analozi prostaglandina nalaze svoju primjenu kao lijekovi. Na primjer, sposobnost PG E2 i PG F2 da stimuliraju kontrakciju mišića maternice koristi se za stimulaciju poroda. PG E1 i PG F1, blokiranjem histaminskih receptora tipa II u stanicama želučane sluznice, potiskuju izlučivanje klorovodične kiseline i time potiču cijeljenje čira na želucu i dvanaesniku.
S druge strane, za upale se koriste steroidni i nesteroidni (aspirin, ibuprofen, indometacin) protuupalni lijekovi. One inaktiviraju enzime koji potiču stvaranje eikosanoida, medijatora upale. Steroidni lijekovi imaju mnogo jače protuupalno djelovanje od nesteroidnih lijekova, inhibiraju aktivnost fosfolipaze A i smanjuju sintezu svih vrsta eikosanoida, jer sprječavaju oslobađanje supstrata za sintezu eikosanoida - arahidonske kiseline.
10. Ateroskleroza
Ateroskleroza(od grčkog athere - kaša, skleros - tvrdo) - progresivne promjene uglavnom u unutarnjoj ovojnici arterija elastičnog i mišićno-elastičnog tipa, koje se sastoje u prekomjernom nakupljanju lipida i drugih komponenti krvi, stvaranju fibroznog tkiva i složenim promjenama koji se u njemu javljaju. Najviše su zahvaćene trbušna aorta, koronarne, karotidne, renalne arterije, arterije mozga, mezenterij i udovi. Kao rezultat aterosklerotskih lezija, lumen arterija se sužava, opskrba krvlju organa i tkiva je poremećena, dolazi do tromboze, embolije, kalcifikacije i aneurizme zidova krvnih žila, što često završava srčanim udarom i krvarenjem.
On je još 1915. godine upozorio na pozitivnu korelaciju između razine kolesterola u krvi i mogućnosti razvoja ateroskleroze. Kako se proučavala patogeneza ateroskleroze, naglasak se počeo stavljati na oštećenje endotelnih stanica, što inicira makrofagno hvatanje krvnih lipida i njihovo kretanje u subendotelni prostor.
Oštećenje endotelnih stanica mogu izazvati radikali lipidne peroksidacije, toksini infektivnog i neinfektivnog podrijetla te imunopatološke reakcije. Alteracija potiče prodiranje makrofaga, prvenstveno monocita, i trombocita u subendotelni prostor i tamo transport lijekova. U stijenci krvnih žila LP su izolirani od antioksidativnih čimbenika krvne plazme, te su stoga podložni promjenama produktima lipidne peroksidacije. Makrofagi fagocitiraju pretežno modificirani LDL i pretvaraju se u tzv. pjenaste stanice. Naziv je dobio zbog činjenice da se nakon obrade posjekotine lipidi isperu i ostaju vakuole koje podsjećaju na pjenu. Ovo je prva faza aterogeneze - stvaranje masne (lipidne) trake. Ali taloženje lipida u arterijskoj stijenci ne znači nužno prijelaz procesa u sljedeću fazu - stvaranje fibroznog plaka.
Fibrozni plak naziva se aterom i fibroaterom. Prvo se formira aterom, karakteriziran značajnim nakupljanjem pjenastih stanica, glatkih mišićnih stanica, limfocita i trombocita. SMC migriraju iz srednje ovojnice arterija pod utjecajem biološki aktivnih tvari iz makrofaga i trombocita - kinini, prostaglandini, čimbenici kemotaksije, čimbenici rasta itd. Pod utjecajem čimbenika rasta aktivno se razmnožavaju i sintetiziraju kolagen, elastin, proteoglikan. - komponente međustanične tvari. Aterom se nalazi u unutarnjoj ovojnici arterija i raste, smanjujući lumen posude. Ima meku kolesterolsku jezgru unutar sebe, jer se zarobljeni LDL sastoji prvenstveno od kolesterola. Postupno, aterom dobiva gustu kapsulu koja se sastoji od endotelnih stanica, SMC, T-limfocita, fibroznog tkiva, pretvarajući se u fibroaterom.
Treća faza su složeni poremećaji s razvojem komplikacija ateroskleroze. Fibroateromi su podvrgnuti kalcifikaciji i ulceraciji, što aktivira trombozu. Komplikacije ovih procesa su ishemija i infarkti organa. Povreda cjelovitosti fibroznog plaka dovodi do stanjivanja vaskularnog zida, krvarenja i krvarenja. U aorti se često primjećuje disekcija njezinih zidova i razvoj aneurizme - izbočine. Aneurizme mogu biti vrlo velike. Aneurizme završavaju rupturom aorte ili stvaranjem velikog krvnog ugruška.
Dakle, lipidi su jedna od glavnih komponenti stanice životinjskog tijela. Lipidi organiziraju rad svake stanice: formiraju membranu kroz koju se percipiraju svi kemijski signali, uključujući hormonalne. Steroidni hormoni i mnoge biološki aktivne tvari lipidnog su podrijetla. Masno i živčano tkivo građeno je uglavnom od lipida. Kada je metabolizam lipida poremećen, razvijaju se disregulirane patologije u obliku ketoze, steatoze jetre, ateroskleroze, pretilosti itd.
BIBLIOGRAFSKI POPIS
1. Zečevi životinje. Fundamentalni i klinički aspekti: Proc. za sveučilišta /, . – 2. izd., rev. i dodatni - Sankt Peterburg, Lan, 2005. – 384 str.
2. Zeko iz patokemije: Udžbenik. za sveučilišta / , . – 2. izd. - ELBI – St. Petersburg, 2001. – 688 str.
3. Lyutinsky fiziologija domaćih životinja: Udžbenik. za sveučilišta / . - M., Kolos, 2001. – 495 str.
4. Novitsky: Zbornik. za sveučilišta / , . – Tomsk, Izdavačka kuća Sveučilišta u Tomsku, 2001. – 716 str.
5. Patofiziologija: U 2 sveska. / – M.: GEOTAR – Med., 2003. – 1t.
6. Severin: Udžbenik. za sveučilišta /. – 4. izd., rev. i dodatni - M.: GEOTAR - Med., 2005. - 784 str.
- VKontakte 0
- Google+ 0
- U REDU 0
- Facebook 0