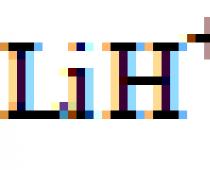Քիմիայում «օքսիդացում» և «վերականգնում» տերմինները վերաբերում են ռեակցիաներին, որոնցում ատոմը կամ ատոմների խումբը համապատասխանաբար կորցնում կամ ստանում է էլեկտրոններ։ Օքսիդացման վիճակը թվային արժեք է, որը վերագրվում է մեկ կամ մի քանի ատոմների, որը բնութագրում է վերաբաշխված էլեկտրոնների թիվը և ցույց է տալիս, թե ինչպես են այդ էլեկտրոնները բաշխվում ատոմների միջև ռեակցիայի ընթացքում։ Այս արժեքի որոշումը կարող է լինել պարզ կամ բավականին բարդ ընթացակարգ՝ կախված ատոմներից և դրանցից բաղկացած մոլեկուլներից։ Ավելին, որոշ տարրերի ատոմները կարող են ունենալ մի քանի օքսիդացման վիճակ: Բարեբախտաբար, կան պարզ, միանշանակ կանոններ օքսիդացման վիճակի որոշման համար՝ դրանք վստահորեն օգտագործելու համար, բավարար է քիմիայի և հանրահաշվի հիմունքների իմացությունը.
Քայլեր
Մաս 1
Օքսիդացման վիճակի որոշում՝ ըստ քիմիայի օրենքների- Օրինակ, Al(s)-ը և Cl2-ն ունեն 0 օքսիդացման աստիճան, քանի որ երկուսն էլ գտնվում են քիմիապես չկապված տարրական վիճակում:
- Խնդրում ենք նկատի ունենալ, որ ծծմբի S8-ի ալոտրոպիկ ձևը կամ օկտասուլֆուրը, չնայած իր ատիպիկ կառուցվածքին, նույնպես բնութագրվում է զրոյական օքսիդացման վիճակով:
-
Որոշեք, թե խնդրո առարկա նյութը բաղկացած է իոններից:Իոնների օքսիդացման աստիճանը հավասար է նրանց լիցքին։ Սա ճիշտ է ինչպես ազատ իոնների, այնպես էլ նրանց համար, որոնք քիմիական միացությունների մաս են կազմում:
- Օրինակ, Cl - իոնի օքսիդացման վիճակը -1 է:
- NaCl քիմիական միացության մեջ Cl իոնի օքսիդացման աստիճանը նույնպես -1 է։ Քանի որ Na իոնը, ըստ սահմանման, ունի +1 լիցք, մենք եզրակացնում ենք, որ Cl իոնն ունի -1 լիցք, հետևաբար նրա օքսիդացման աստիճանը -1 է:
-
Խնդրում ենք նկատի ունենալ, որ մետաղական իոնները կարող են ունենալ մի քանի օքսիդացման վիճակներ:Շատ մետաղական տարրերի ատոմները կարող են իոնացվել տարբեր աստիճաններով: Օրինակ՝ երկաթի (Fe) նման մետաղի իոնների լիցքը +2 կամ +3 է։ Մետաղական իոնների լիցքը (և դրանց օքսիդացման վիճակը) կարող է որոշվել այլ տարրերի իոնների լիցքերով, որոնցով մետաղը քիմիական միացության մաս է. Տեքստում այս լիցքը նշվում է հռոմեական թվերով. օրինակ՝ երկաթը (III) ունի +3 օքսիդացման աստիճան։
- Որպես օրինակ, դիտարկենք ալյումինի իոն պարունակող միացություն: AlCl 3 միացության ընդհանուր լիցքը զրո է: Քանի որ մենք գիտենք, որ Cl-ի իոնները ունեն -1 լիցք, և միացության մեջ կա 3 այդպիսի իոն, որպեսզի տվյալ նյութը չեզոք լինի, Al իոնը պետք է ունենա +3 լիցք: Այսպիսով, այս դեպքում ալյումինի օքսիդացման աստիճանը +3 է։
-
Թթվածնի օքսիդացման վիճակը -2 է (որոշ բացառություններով):Գրեթե բոլոր դեպքերում թթվածնի ատոմներն ունեն -2 օքսիդացման աստիճան։ Այս կանոնից մի քանի բացառություններ կան.
- Եթե թթվածինն իր տարրական վիճակում է (O2), ապա նրա օքսիդացման աստիճանը 0 է, ինչպես որ այլ տարրական նյութերի դեպքում։
- Եթե թթվածինը ներառված է պերօքսիդ, նրա օքսիդացման աստիճանը -1 է։ Պերօքսիդները միացությունների խումբ են, որոնք պարունակում են պարզ թթվածին-թթվածին կապ (այսինքն՝ պերօքսիդի անիոն O 2 -2): Օրինակ՝ H 2 O 2 (ջրածնի պերօքսիդ) մոլեկուլի բաղադրության մեջ թթվածինն ունի լիցք և օքսիդացում -1։
- Ֆտորի հետ զուգակցվելիս թթվածինը ունի +2 օքսիդացման աստիճան, կարդացեք ֆտորի կանոնը ստորև:
-
Ջրածինը ունի +1 օքսիդացման աստիճան, որոշ բացառություններով:Ինչպես թթվածնի դեպքում, այստեղ նույնպես բացառություններ կան։ Սովորաբար, ջրածնի օքսիդացման աստիճանը +1 է (եթե այն գտնվում է տարրական H2 վիճակում): Այնուամենայնիվ, հիդրիդ կոչվող միացություններում ջրածնի օքսիդացման աստիճանը -1 է:
- Օրինակ, H2O-ում ջրածնի օքսիդացման վիճակը +1 է, քանի որ թթվածնի ատոմն ունի -2 լիցք, իսկ ընդհանուր չեզոքության համար անհրաժեշտ է երկու +1 լիցք: Այնուամենայնիվ, նատրիումի հիդրիդի բաղադրության մեջ ջրածնի օքսիդացման աստիճանն արդեն -1 է, քանի որ Na իոնը կրում է +1 լիցք, իսկ ընդհանուր էլեկտրական չեզոքության համար ջրածնի ատոմի լիցքը (և հետևաբար նրա օքսիդացման վիճակը) պետք է. հավասար լինի -1-ի:
-
Ֆտորին Միշտունի -1 օքսիդացման աստիճան:Ինչպես արդեն նշվեց, որոշ տարրերի (մետաղների իոններ, պերօքսիդներում թթվածնի ատոմներ և այլն) օքսիդացման վիճակը կարող է տարբեր լինել՝ կախված մի շարք գործոններից։ Ֆտորի օքսիդացման վիճակը, սակայն, անփոփոխ -1 է: Սա բացատրվում է նրանով, որ այս տարրն ունի ամենաբարձր էլեկտրաբացասականությունը, այլ կերպ ասած, ֆտորի ատոմները ամենաքիչ պատրաստակամ են բաժանվել իրենց սեփական էլեկտրոններից և առավել ակտիվորեն գրավել օտար էլեկտրոնները: Այսպիսով, նրանց վճարը մնում է անփոփոխ։
-
Միացության մեջ օքսիդացման վիճակների գումարը հավասար է նրա լիցքին:Քիմիական միացության բոլոր ատոմների օքսիդացման վիճակները պետք է գումարվեն այդ միացության լիցքին։ Օրինակ, եթե միացությունը չեզոք է, ապա նրա բոլոր ատոմների օքսիդացման վիճակների գումարը պետք է լինի զրո; եթե միացությունը -1 լիցքով բազմատոմ իոն է, ապա օքսիդացման վիճակների գումարը -1 է և այլն։
- Սա ստուգելու լավ միջոց է՝ եթե օքսիդացման վիճակների գումարը չի հավասարվում միացության ընդհանուր լիցքին, ուրեմն ինչ-որ տեղ սխալ եք թույլ տվել։
Մաս 2
Օքսիդացման վիճակի որոշում՝ առանց քիմիայի օրենքների օգտագործման-
Գտեք ատոմներ, որոնք չունեն խիստ կանոններ օքսիդացման թվերի վերաբերյալ:Որոշ տարրերի համար օքսիդացման վիճակը գտնելու հստակ սահմանված կանոններ չկան: Եթե ատոմը չի համապատասխանում վերը թվարկված կանոններից որևէ մեկին, և դուք չգիտեք դրա լիցքը (օրինակ, ատոմը համալիրի մաս է, և դրա լիցքը նշված չէ), կարող եք որոշել այդպիսի ատոմի օքսիդացման վիճակը. վերացում. Նախ որոշեք միացության մյուս բոլոր ատոմների լիցքը, այնուհետև միացության հայտնի ընդհանուր լիցքից հաշվարկեք տվյալ ատոմի օքսիդացման վիճակը։
- Օրինակ, Na 2 SO 4 միացության մեջ ծծմբի ատոմի (S) լիցքը անհայտ է, մենք միայն գիտենք, որ այն զրո չէ, քանի որ ծծումբը տարրական վիճակում չէ: Այս միացությունը ծառայում է որպես լավ օրինակ՝ օքսիդացման վիճակի որոշման հանրահաշվական մեթոդը լուսաբանելու համար։
-
Գտե՛ք միացության մեջ մնացած տարրերի օքսիդացման աստիճանները:Օգտագործելով վերը նկարագրված կանոնները, որոշեք միացության մնացած ատոմների օքսիդացման աստիճանները: Մի մոռացեք O, H ատոմների և այլնի դեպքում կանոններից բացառությունների մասին։
- Na 2 SO 4-ի համար, օգտագործելով մեր կանոնները, մենք գտնում ենք, որ Na իոնի լիցքը (հետևաբար օքսիդացման վիճակը) +1 է, իսկ թթվածնի յուրաքանչյուր ատոմի համար՝ -2։
- Միացություններում բոլոր օքսիդացման վիճակների գումարը պետք է հավասար լինի լիցքին: Օրինակ, եթե միացությունը երկատոմային իոն է, ապա ատոմների օքսիդացման վիճակների գումարը պետք է հավասար լինի ընդհանուր իոնային լիցքին։
- Շատ օգտակար է կարողանալ օգտագործել պարբերական աղյուսակը և իմանալ, թե դրա մեջ որտեղ են գտնվում մետաղական և ոչ մետաղական տարրերը։
- Տարրական ձևով ատոմների օքսիդացման վիճակը միշտ զրոյական է: Մեկ իոնի օքսիդացման վիճակը հավասար է նրա լիցքին: Պարբերական համակարգի 1A խմբի տարրերը, ինչպիսիք են ջրածինը, լիթիումը, նատրիումը, իրենց տարերային տեսքով ունեն +1 օքսիդացման աստիճան; 2A խմբի մետաղները, ինչպիսիք են մագնեզիումը և կալցիումը, իրենց տարերային ձևով ունեն +2 օքսիդացման աստիճան: Թթվածինը և ջրածինը, կախված քիմիական կապի տեսակից, կարող են ունենալ 2 տարբեր օքսիդացման վիճակ։
Որոշեք, թե խնդրո առարկա նյութը տարրական է:Քիմիական միացությունից դուրս ատոմների օքսիդացման վիճակը զրոյական է: Այս կանոնը ճիշտ է ինչպես առանձին ազատ ատոմներից ձևավորված նյութերի, այնպես էլ նրանց համար, որոնք բաղկացած են մեկ տարրի երկու կամ բազմատոմ մոլեկուլներից:
Քիմիայի հիմնական հասկացություններից մեկը, որը լայնորեն օգտագործվում է ռեդոքսային ռեակցիաների հավասարումներ կազմելիս, օքսիդացման վիճակ ատոմներ.
Գործնական նպատակներով (օդոքս ռեակցիաների համար հավասարումներ կազմելիս) հարմար է բևեռային կապերով մոլեկուլներում ատոմների լիցքերը ներկայացնել որպես ամբողջ թվեր, որոնք հավասար են այն լիցքերին, որոնք կառաջանային ատոմների վրա, եթե վալենտային էլեկտրոնները ամբողջությամբ փոխանցվեն ավելի էլեկտրաբացասական ատոմների, այսինքն էլ. եթե կապերն ամբողջությամբ իոնային լինեին: Այս լիցքավորման արժեքները կոչվում են օքսիդացման վիճակներ: Պարզ նյութում ցանկացած տարրի օքսիդացման աստիճանը միշտ 0 է:
Բարդ նյութերի մոլեկուլներում որոշ տարրեր միշտ ունեն մշտական օքսիդացման աստիճան։ Տարրերի մեծ մասը բնութագրվում է փոփոխական օքսիդացման վիճակներով, որոնք տարբերվում են ինչպես նշանով, այնպես էլ մեծությամբ՝ կախված մոլեկուլի բաղադրությունից։
Հաճախ օքսիդացման վիճակը հավասար է վալենտությանը և դրանից տարբերվում է միայն նշանով։ Բայց կան միացություններ, որոնցում տարրի օքսիդացման աստիճանը հավասար չէ նրա վալենտությանը։ Ինչպես արդեն նշվեց, պարզ նյութերում տարրի օքսիդացման վիճակը միշտ զրոյական է, անկախ նրա վալենտությունից: Աղյուսակը համեմատում է որոշ տարրերի արժեքները և օքսիդացման վիճակները տարբեր միացություններում:
Ատոմի (տարրի) օքսիդացման վիճակ միացության մեջ պայմանական լիցքն է, որը հաշվարկվում է այն ենթադրությամբ, որ միացությունը բաղկացած է միայն իոններից։ Օքսիդացման վիճակը որոշելիս պայմանականորեն ենթադրվում է, որ միացության վալենտային էլեկտրոնները փոխանցվում են ավելի էլեկտրաբացասական ատոմների, հետևաբար միացությունները կազմված են դրական և բացասական լիցքավորված իոններից։ Իրականում, շատ դեպքերում, տեղի է ունենում ոչ թե էլեկտրոնների ամբողջական նվիրատվություն, այլ միայն էլեկտրոնային զույգի տեղափոխում մեկ ատոմից մյուսը: Այնուհետև կարող ենք տալ մեկ այլ սահմանում. Օքսիդացման վիճակն այն էլեկտրական լիցքն է, որը կառաջանա ատոմի վրա, եթե այն էլեկտրոնային զույգերը, որոնց հետ այն կապված է միացության այլ ատոմների հետ, տեղափոխվեն ավելի էլեկտրաբացասական ատոմների, և նույն ատոմները միացնող էլեկտրոնային զույգերը՝ բաժանված նրանց միջև.
Օքսիդացման վիճակները հաշվարկելիս օգտագործվում են մի շարք պարզ կանոններ.
1 . Պարզ նյութերում՝ ինչպես միատոմային, այնպես էլ մոլեկուլային, տարրերի օքսիդացման աստիճանը զրո է (Fe 0, O 2 0):
2 . Միատոմ իոնի տեսքով տարրի օքսիդացման աստիճանը հավասար է այս իոնի լիցքին (Na +1, Ca +2, S –2):
3 . Կովալենտային բևեռային կապ ունեցող միացություններում բացասական լիցքը վերաբերում է ավելի էլեկտրաբացասական ատոմին, իսկ դրական լիցքը՝ պակաս էլեկտրաբացասական ատոմին, և տարրերի օքսիդացման վիճակները վերցնում են հետևյալ արժեքները.
Միացություններում ֆտորի օքսիդացման վիճակը միշտ -1 է;
Միացություններում թթվածնի օքսիդացման վիճակը -2 է (); բացառությամբ պերօքսիդների, որտեղ այն ձևականորեն հավասար է -1 (), թթվածնի ֆտորիդին, որտեղ այն հավասար է +2 (), ինչպես նաև սուպերօքսիդների և օզոնիդների, որոնցում թթվածնի օքսիդացման աստիճանը -1/2 է.
Միացություններում ջրածնի օքսիդացման աստիճանը +1 է (), բացառությամբ մետաղների հիդրիդների, որտեղ այն -1 է ( ![]() );
);
Ալկալիների և հողալկալիական տարրերի համար օքսիդացման վիճակներն են՝ համապատասխանաբար +1 և +2:
Տարրերի մեծ մասը կարող է դրսևորել փոփոխական օքսիդացման վիճակներ:
4 . Չեզոք մոլեկուլում օքսիդացման վիճակների հանրահաշվական գումարը հավասար է զրոյի, բարդ իոնում՝ իոնի լիցքին։
Փոփոխական օքսիդացման վիճակ ունեցող տարրերի համար դրա արժեքը հեշտ է հաշվարկել՝ իմանալով միացության բանաձևը և օգտագործելով թիվ 4 կանոնը։ Օրինակ, անհրաժեշտ է որոշել ֆոսֆորի օքսիդացման աստիճանը ֆոսֆորաթթվի H 3 PO 4-ում: Քանի որ թթվածինը ունի CO = –2, իսկ ջրածինը ունի CO = +1, ապա ֆոսֆորի համար զրոյական գումարը պետք է լինի +5:
Օրինակ՝ NH 4 Cl-ում ջրածնի բոլոր ատոմների օքսիդացման վիճակների գումարը 4×(+1) է, իսկ քլորի օքսիդացման աստիճանը՝ -1, հետևաբար ազոտի օքսիդացման աստիճանը պետք է հավասար լինի -3-ի։ SO 4 2– սուլֆատ իոնում թթվածնի չորս ատոմների օքսիդացման վիճակների գումարը -8 է, ուստի ծծումբը պետք է ունենա +6 օքսիդացման աստիճան, որպեսզի իոնի ընդհանուր լիցքը լինի -2։
Միացությունների մեծ մասի համար օքսիդացման վիճակի հասկացությունը պայմանական է, քանի որ չի արտացոլում ատոմի իրական արդյունավետ լիցքը, սակայն այս հասկացությունը շատ լայնորեն կիրառվում է քիմիայում:
Առավելագույնը, իսկ ոչ մետաղների համար, նվազագույն օքսիդացման վիճակը պարբերական կախվածություն ունի D.I.-ի սերիական համարից: Մենդելեևը, որը պայմանավորված է ատոմի էլեկտրոնային կառուցվածքով։
| Տարր | Օքսիդացման վիճակի արժեքներ և միացությունների օրինակներ |
| Ֆ | -1 (HF, KF) |
| Օ | –2 (H 2 O, CaO, CO 2); –1 (H 2 O 2); +2 (2-ԻՑ) |
| Ն | –3 (NH 3); –2(N 2 H 4); –1 (NH 2 OH); +1 (N 2 O); +2 (NO); |
| +3 (N 2 O 3, HNO 2); +4 (NO 2); +5 (N 2 O 5, HNO 3) | Cl |
| –1 (HCl, NaCl); +1 (NaClO); +3 (NaClO 2); +5 (NaClO 3); +7 (Cl 2 O 7, NaClO 4) | եղբ |
| –1 (KBr); +1 (BrF); +3 (BrF 3); +5 (KBrO 3) | Ի |
| -1 (HI); +1 (ICl); +3 (ICl 3); +5 (I 2 O 5); +7 (IO 3 F, K 5 IO 6) | Գ |
| –4 (CH 4); +2 (CO); +4 (CO 2, CCl 4) | Սի |
| –4 (Ca 2 Si); +2 (SiO); +4 (SiO 2, H 2 SiO 3, SiF 4) | Հ |
| -1 (LiH); +1 (H 2 O, HCl) | Ս |
| –2 (H 2 S, FeS); +2 (Na 2 S 2 O 3); +3 (Na 2 S 2 O 4); | +4 (SO 2, Na 2 SO 3, SF 4); +6 (SO 3, H 2 SO 4, SF 6) |
| Սե, Թե | –2 (H 2 Se, H 2 Te); +2 (SeCl 2, TeCl 2); +4 (SeO 2, TeO 2); +6 (H 2 SeO 4, H 2 TeO 4) |
| Պ | –3 (PH 3); +1 (H 3 PO 2); +3 (H 3 PO 3); +5 (P 2 O 5, H 3 PO 4) |
| Ինչպես, Սբ | –3 (GaAs, Zn 3 Sb 2); +3 (AsCl 3, Sb 2 O 3); +5 (H 3 AsO 4, SbCl 5) |
| Լի, Նա, Կ | +1 (NaCl) |
| Be, Mg, Ca | +2 (MgO, CaCO 3) |
| Ալ | +3 (Al 2 O 3, AlCl 3) |
| Քր | +2 (CrCl 2); +3 (Cr 2 O 3, Cr 2 (SO 4) 3); +4 (CrO 2); +6 (K 2 CrO 4, K 2 Cr 2 O 7) |
| Մն | +2 (MnSO 4); +3 (Mn 2 (SO 4) 3); +4 (MnO 2); +6 (K 2 MnO 4); +7 (KMnO 4) |
| Ֆե | +2 (FeO, FeSO 4); +3 (Fe 2 O 3, FeCl 3); +4 (Na 2 FeO 3) |
| Cu | +1 (Cu 2 O); +2 (CuO, CuSO 4, Cu 2 (OH) 2 CO 3) |
| Ագ | +1 (AgNO 3) |
| Ավ | +1 (AuCl); +3 (AuCl 3, KAuCl 4) |
| Zn | +2 (ZnO, ZnSO 4) |
| Հգ | +1 (Hg 2 Cl 2); +2 (HgO, HgCl 2) |
| Սն | +2 (SnO); +4 (SnO 2, SnCl 4) |
Քիմիական ռեակցիաներում պետք է կատարվի բոլոր ատոմների օքսիդացման վիճակների հանրահաշվական գումարի պահպանման կանոնը։ Քիմիական ռեակցիայի ամբողջական հավասարման մեջ օքսիդացման և վերականգնողական գործընթացները պետք է ճշգրտորեն փոխհատուցեն միմյանց: ռեդոքս ռեակցիաների հավասարումներ, երկրորդ՝ միացության մեջ տարրերի ռեդոքսային հատկությունները կանխատեսելու համար։
Շատ տարրեր բնութագրվում են օքսիդացման վիճակների մի քանի արժեքներով, և դրանց օքսիդացման աստիճանը հաշվարկելով՝ կարելի է կանխատեսել ռեդոքս հատկություններ. Դրական օքսիդացման վիճակով այն կարող է ընդունել միայն էլեկտրոններ (նվազեցնել) և լինել օքսիդացնող նյութ, միջանկյալ օքսիդացման վիճակներում՝ և՛ օքսիդացնել, և՛ նվազեցնել:
Օքսիդացում-վերականգնումը մեկ, փոխկապակցված գործընթաց է: Օքսիդացում համապատասխանում է տարրի օքսիդացման վիճակի բարձրացմանը, և վերականգնում - դրա կրճատումը.
Շատ դասագրքեր հավատարիմ են օքսիդացման մեկնաբանմանը որպես էլեկտրոնների կորստի, իսկ կրճատմանը որպես դրանց շահույթի: Այս մոտեցումը, որն առաջարկել է ռուս գիտնական Պիսարժևսկին (1916 թ.), կիրառելի է էլեկտրոդների վրա էլեկտրաքիմիական գործընթացների համար և վերաբերում է իոնների և մոլեկուլների լիցքաթափմանը (լիցքավորմանը):
Այնուամենայնիվ, օքսիդացման վիճակների փոփոխությունների բացատրությունը որպես էլեկտրոնների հեռացման և ավելացման գործընթացներ, ընդհանուր առմամբ, ճիշտ չէ: Այն կարող է կիրառվել որոշ պարզ իոնների վրա, ինչպիսիք են
Cl - - ®Cl 0.
Փոխել ատոմների օքսիդացման վիճակը բարդ իոններում, ինչպիսիք են
CrO 4 2 - ®Cr +3
քրոմի դրական օքսիդացման վիճակի նվազումը +6-ից +3 համապատասխանում է դրական լիցքի ավելի փոքր իրական աճին (CrO 4 2-ում Cr-ում - իրական լիցք «+0,2 էլեկտրոնային լիցք, իսկ Cr +3-ի վրա՝ +2-ից մինչև +1,5 տարբեր միացումներում):
Լիցքի փոխանցումը վերականգնող նյութից դեպի օքսիդացնող նյութ, որը հավասար է օքսիդացման վիճակի փոփոխությանը, տեղի է ունենում այլ մասնիկների մասնակցությամբ, օրինակ՝ H + իոններ.
CrO 4 2 - + 8H + + 3 ®Cr +3 + 4H 2 O:
Ներկայացված մուտքը կոչվում է կես ռեակցիաներ .
Առնչվող տեղեկություններ.
Քիմիական տարրը միացության մեջ, որը հաշվարկվում է այն ենթադրությունից, որ բոլոր կապերը իոնային են:
Օքսիդացման վիճակները կարող են ունենալ դրական, բացասական կամ զրո արժեք, հետևաբար մոլեկուլում տարրերի օքսիդացման վիճակների հանրահաշվական գումարը, հաշվի առնելով դրանց ատոմների թիվը, հավասար է 0-ի, իսկ իոնում՝ իոնի լիցքը։ .
1. Միացություններում մետաղների օքսիդացման աստիճանները միշտ դրական են:
2. Ամենաբարձր օքսիդացման աստիճանը համապատասխանում է պարբերական համակարգի այն խմբի թվին, որտեղ գտնվում է տարրը (բացառություններ են. Au +3(I խումբ), Cu +2(II), VIII խմբից +8 օքսիդացման աստիճանը կարելի է գտնել միայն օսմիումում Օսև ռութենիում Ռու.
3. Ոչ մետաղների օքսիդացման աստիճանները կախված են նրանից, թե որ ատոմին է այն կապված.
- եթե մետաղի ատոմով, ապա օքսիդացման վիճակը բացասական է.
- եթե ոչ մետաղի ատոմով, ապա օքսիդացման վիճակը կարող է լինել կամ դրական կամ բացասական: Դա կախված է տարրերի ատոմների էլեկտրաբացասականությունից։
4. Ոչ մետաղների ամենաբարձր բացասական օքսիդացման վիճակը կարելի է որոշել՝ 8-ից հանելով այն խմբի թիվը, որում գտնվում է տարրը, այսինքն. ամենաբարձր դրական օքսիդացման վիճակը հավասար է արտաքին շերտի էլեկտրոնների թվին, որը համապատասխանում է խմբի թվին։
5. Պարզ նյութերի օքսիդացման աստիճանները 0 են՝ անկախ նրանից՝ մետաղ է, թե ոչ։
Մշտական օքսիդացման վիճակներով տարրեր:
|
Տարր |
Բնութագրական օքսիդացման վիճակ |
Բացառություններ |
|
Մետաղների հիդրիդներ՝ LIH -1 |
||
|
Օքսիդացման վիճակկոչվում է մասնիկի պայմանական լիցք՝ այն ենթադրությամբ, որ կապն ամբողջությամբ խզված է (ունի իոնային բնույթ)։ Հ- Cl = Հ + + Cl - , Աղաթթվի կապը բևեռային կովալենտ է: Էլեկտրոնային զույգն ավելի շատ տեղաշարժված է դեպի ատոմ Cl - , քանի որ դա ավելի էլեկտրաբացասական տարր է։ Ինչպե՞ս որոշել օքսիդացման վիճակը:Էլեկտրոնեգատիվությունատոմների կարողությունն է՝ ներգրավել էլեկտրոններ այլ տարրերից։ Օքսիդացման թիվը նշվում է տարրի վերևում. Եղբ 2 0 , Na 0 , O +2 F 2 -1 ,Կ + Cl - և այլն: Դա կարող է լինել բացասական և դրական: Պարզ նյութի (չկապված, ազատ վիճակ) օքսիդացման վիճակը զրոյական է։ Միացությունների մեծ մասի համար թթվածնի օքսիդացման վիճակը -2 է (բացառություն են կազմում պերօքսիդները H 2 O 2, որտեղ այն հավասար է -1-ի և ֆտորով միացություններ - Օ +2 Ֆ 2 -1 , Օ 2 +1 Ֆ 2 -1 ). - Օքսիդացման վիճակպարզ միատոմ իոնը հավասար է նրա լիցքին. Նա + , Ք.ա +2 . Ջրածինը իր միացություններում ունի +1 օքսիդացման աստիճան (բացառություն են կազմում հիդրիդները. Նա + Հ - և մուտքագրեք կապեր Գ +4 Հ 4 -1 ). Մետաղ-ոչմետաղ կապերում բացասական օքսիդացման վիճակն այն ատոմն է, որն ունի ավելի մեծ էլեկտրաբացասականություն (էլեկտրբացասականության վերաբերյալ տվյալները տրված են Պաուլինգի սանդղակով). Հ + Ֆ - , Cu + Եղբ - , Ք.ա +2 (ՈՉ 3 ) - և այլն: Քիմիական միացություններում օքսիդացման աստիճանի որոշման կանոններ.Վերցնենք կապը KMnO 4 , անհրաժեշտ է որոշել մանգանի ատոմի օքսիդացման վիճակը։ Պատճառաբանություն.
K+Mn X O 4 -2 Թող X- մեզ անհայտ է մանգանի օքսիդացման վիճակը: Կալիումի ատոմների թիվը 1 է, մանգանը՝ 1, թթվածինը 4։ Ապացուցված է, որ մոլեկուլը որպես ամբողջություն էլեկտրականորեն չեզոք է, ուստի նրա ընդհանուր լիցքը պետք է լինի զրո: 1*(+1) + 1*(X) + 4(-2) = 0, X = +7, Սա նշանակում է, որ կալիումի պերմանգանատում մանգանի օքսիդացման վիճակը = +7: Բերենք օքսիդի մեկ այլ օրինակ Fe2O3. Անհրաժեշտ է որոշել երկաթի ատոմի օքսիդացման վիճակը։ Պատճառաբանություն.
2*(X) + 3*(-2) = 0, Եզրակացություն՝ այս օքսիդում երկաթի օքսիդացման աստիճանը +3 է։ Օրինակներ.Որոշեք մոլեկուլի բոլոր ատոմների օքսիդացման աստիճանները: 1. K2Cr2O7. Օքսիդացման վիճակ K +1, թթվածին O -2. Տրված ցուցանիշները. O=(-2)×7=(-14), K=(+1)×2=(+2): Որովհետև մոլեկուլում տարրերի օքսիդացման վիճակների հանրահաշվական գումարը, հաշվի առնելով դրանց ատոմների թիվը, հավասար է 0-ի, ապա դրական օքսիդացման վիճակների թիվը հավասար է բացասականների թվին։ Օքսիդացման վիճակներ K+O=(-14)+(+2)=(-12). Սրանից հետևում է, որ քրոմի ատոմն ունի 12 դրական ուժ, բայց մոլեկուլում կա 2 ատոմ, ինչը նշանակում է, որ յուրաքանչյուր ատոմում կա (+12)՝ 2 = (+6): Պատասխան. K 2 + Cr 2 +6 O 7 -2. 2.(AsO 4) 3- . Այս դեպքում օքսիդացման վիճակների գումարն այլևս հավասար չի լինի զրոյի, այլ իոնի լիցքին, այսինքն. - 3. Կազմենք հավասարում. x+4×(- 2)= - 3 . Պատասխան. (Ինչպես +5 O 4 -2) 3- . |
Դասախոսության նշումներ
ընդհանուր քիմիայի մեջ
Շարունակություն. Տես սկիզբը№ 8, 12, 13, 20, 23, 25-26, 40/2004
Գլուխ 5.
Redox
ռեակցիաներ
5.1. Օքսիդացման վիճակի որոշում
Redox ռեակցիաները ռեակցիաներ են, որոնք ուղեկցվում են էլեկտրոնների տեղափոխմամբ մի ատոմից մյուսը։ Էլեկտրոնների փոխանցումը դատվում է ատոմների օքսիդացման վիճակների փոփոխությամբ։ Եթե փոխվում է ատոմի օքսիդացման վիճակը, ապա փոխվում է նաև նրա էլեկտրոնային միջավայրը։– Ատոմների օքսիդացման վիճակները որոշելու երկու եղանակ կա.
, առաջին– համախառն բանաձեւով
.
երկրորդ ըստ կառուցվածքային բանաձևի
Ատոմների օքսիդացման վիճակներն առաջին եղանակով որոշելիս կիրառվում է հետևյալ կանոնը.
Որպես օրինակ՝ եկեք որոշենք նատրիումի թիոսուլֆատ Na 2 S 2 O 3 ատոմների օքսիդացման վիճակը՝ օգտագործելով առաջին մեթոդը: Մասնիկներ կազմող տարրերի մեջ թթվածինն ամենաէլեկտրաբացասականն է՝ այն կընդունի էլեկտրոններ։ Քանի որ թթվածինը գտնվում է VI խմբի հիմնական ենթախմբում, նրան պակասում է երկու էլեկտրոն՝ էլեկտրոնային շերտը լրացնելու համար։ Այսպիսով, թթվածնի ատոմը կվերցնի երկու էլեկտրոն և ձեռք կբերի –2 օքսիդացման աստիճան:
2 (+1) + 2Առավել էլեկտրադրական ատոմը նատրիումն է, որն իր արտաքին էլեկտրոնային մակարդակում ունի միայն մեկ էլեկտրոն (նատրիումը կտա այն): Այս նկատառումները, հաշվի առնելով նատրիումի թիոսուլֆատի բանաձևը, թույլ են տալիս ստեղծել հավասարումը. + 3 (–2) = 0,
X
որի լուծույթը կտա ծծմբի ատոմի օքսիդացման աստիճանի արժեքը (+2)։
2Առավել էլեկտրադրական ատոմը նատրիումն է, որն իր արտաքին էլեկտրոնային մակարդակում ունի միայն մեկ էլեկտրոն (նատրիումը կտա այն): Այս նկատառումները, հաշվի առնելով նատրիումի թիոսուլֆատի բանաձևը, թույլ են տալիս ստեղծել հավասարումը. + 7 (–2) = –2
Դուք կարող եք որոշել ատոմների օքսիդացման վիճակները բարդ իոններում: Որպես օրինակ, դիտարկենք անիոնը: Դրանում ամենաէլեկտրաբացասական թթվածնի ատոմն ընդունում է երկու էլեկտրոն և ունի –2 օքսիդացման աստիճան։ Քրոմի ատոմի օքսիդացման վիճակը որոշվում է հավասարումից.
և հավասար է +6: օքսիդացման վիճակ
– Ատոմների օքսիդացման վիճակները գտնելու երկրորդ եղանակը՝ օգտագործելով կառուցվածքային բանաձևը, հիմնված է սահմանման վրա.Սա սովորական ամբողջ թվային լիցքն է, որը կլիներ ատոմի վրա, եթե նրա բոլոր բևեռային կովալենտային կապերը դառնան իոնային:

Նկարել նատրիումի թիոսուլֆատի կառուցվածքային բանաձևը
Որոշենք նրա ատոմների օքսիդացման վիճակը։
Նատրիումի ատոմները, որոնք կապված են միայնակ կապերով ավելի էլեկտրաբացասական թթվածնի ատոմների հետ, բնականաբար, իրենց արտաքին էլեկտրոնները կզիջեն նրանց՝ յուրաքանչյուրը ձեռք բերելով +1 օքսիդացման աստիճան: Թթվածնի ատոմները, որոնք ունեն երկու կապ ավելի էլեկտրադրական ատոմների հետ, պայմանականորեն կընդունեն երկու էլեկտրոն և կունենան –2 օքսիդացման աստիճան: Կառուցվածքային բանաձեւից պարզ է դառնում, որ միացությունը պարունակում է ծծմբի երկու ատոմ տարբեր միջավայրերում։ S ատոմներից մեկը միացված է միայն կրկնակի կապով մեկ այլ S ատոմի, և նրա օքսիդացման աստիճանը զրո է։ Երկրորդ ծծմբի ատոմը չորս կապ ունի ևս երեք էլեկտրաբացասական թթվածնի ատոմների հետ և հետևաբար ունի +4 օքսիդացման աստիճան:
Թթվածնի ատոմը միշտ չէ, որ ունի –2 օքսիդացման աստիճան: Օրինակ, ֆտորի ատոմների հետ իր համակցությամբ այն ունի դրական օքսիդացման վիճակ։ Պերօքսիդներում թթվածնի յուրաքանչյուր ատոմի օքսիդացման աստիճանը հավասար է, գերօքսիդներում՝ միայն, իսկ օզոնիդներում՝ հավասար:
Նաև ծծմբի ատոմի օքսիդացման վիճակը կարող է լինել –1, օրինակ՝ դիսուլֆիդներում: Որոշ օքսիդներում, օրինակ՝ Fe 3 O 4 և Pb 3 O 4, ատոմների օքսիդացման աստիճանները որոշվում են՝ ելնելով այն փաստից, որ այդ օքսիդները խառնված են՝ համապատասխանաբար Fe 2 O 3 FeO և PbO 2 2PbO։
5.2. Հավասարումներ գրելը
ռեդոքս ռեակցիաներ
Օքսիդացման ռեակցիաների հավասարումների գործակիցների ընտրությունն իրականացվում է էլեկտրոնային հաշվեկշռի կազմման միջոցով։
Ընտրության մեթոդը, որը հանգում է հավասարման աջ և ձախ կողմերի ատոմների թվերի հաշվմանը, միշտ չէ, որ երաշխավորում է գործակիցների ճիշտ որոշումը։ Այսպիսով, ստորև բերված երեք հավասարումները ազոտաթթուով տրիէթիլամինի օքսիդացման համար պարունակում են հավասար թվով ածխածնի, ջրածնի, թթվածնի և ազոտի ատոմներ ձախ և աջ կողմերում, բայց դրանցից միայն մեկն է իրականացվում.
4(C2H5)3N + 36HNO3 = 24CO2 + 48H2O + 6NO2 + 17N2,
2(C2H5)3N + 78HNO3 = 12CO2 + 54H2O + 78NO2 + N2,
(C 2 H 5) 3 N + 11HNO 3 = 6CO 2 + 13H 2 O + 4NO 2 + 4N 2:

Օքսիդացման գործընթացի տեսությունը ներառում է էլեկտրոնների տեղափոխում վերականգնող նյութի ատոմներից դեպի օքսիդացնող նյութի ատոմներ։
12Առավել էլեկտրադրական ատոմը նատրիումն է, որն իր արտաքին էլեկտրոնային մակարդակում ունի միայն մեկ էլեկտրոն (նատրիումը կտա այն): Այս նկատառումները, հաշվի առնելով նատրիումի թիոսուլֆատի բանաձևը, թույլ են տալիս ստեղծել հավասարումը. = 5Ըստ նյութի պահպանման օրենքի՝ վերականգնող նյութի կողմից տրված էլեկտրոնների ընդհանուր թիվը հավասար է օքսիդացնող նյութի կողմից ընդունված էլեկտրոնների ընդհանուր թվին։ Այս պարզ գաղափարն առաջնորդում է ռեդոքս ռեակցիաների հավասարումների կազմումը: Խնդիրն է ընտրել համաչափության գործակիցները, որոնց դեպքում ձեռք է բերվում էլեկտրոնային հաշվեկշիռը:,
որի նվազագույն դրական ամբողջական լուծումները հավասար են Առավել էլեկտրադրական ատոմը նատրիումն է, որն իր արտաքին էլեկտրոնային մակարդակում ունի միայն մեկ էլեկտրոն (նատրիումը կտա այն): Այս նկատառումները, հաշվի առնելով նատրիումի թիոսուլֆատի բանաձևը, թույլ են տալիս ստեղծել հավասարումը. = 5, ժամը = 12.
Հավասարումների մեջ գործակիցների ընտրությունը անհամաչափ ռեակցիայի միջոցով էլեկտրոնային հաշվեկշռի մեթոդով պետք է կատարվի դրանց աջ կողմում: Որպես օրինակ, եկեք նայենք Berthollet աղի անհամաչափությանը (առանց կատալիզատորի).
![]()
Ռեակցիայի ընթացքում ատոմների օքսիդացման վիճակների փոփոխություններից հետևում է, որ նա ընդունել է 6 էլեկտրոն, բայց ենթադրաբար տվել է 2 էլեկտրոն։
Հետո
(КCl) = 3 (КClО 4):
Հետևաբար, անհրաժեշտ է կալիումի պերքլորատի KClO 4-ի դիմաց դնել 3 գործակից.
4KClO 3 = KCl + 3KClO 4:
5.3. Էլեկտրոլիզ
Էլեկտրոլիտի տարրալուծումը (լուծույթի մեջ կամ հալման մեջ), երբ նրա միջով էլեկտրական հոսանք է անցնում, կոչվում է էլեկտրոլիզ
.
Էլեկտրոլիզի գործընթացի գործիքավորումը հանգում է նրան, որ հոսանքի աղբյուրին միացված երկու էլեկտրոդներ իջեցվում են լուծույթով կամ հալված էլեկտրոլիտով տարայի մեջ (նկ. 5.1):
Բացասական լիցքավորված էլեկտրոդը կոչվում է կաթոդ
(կատիոնները ձգվում են դրան), իսկ դրական լիցքավորված էլեկտրոդը՝ անոդ
(այն գրավում է անիոնները): Էլեկտրական շղթան փակ է էլեկտրոդների մոտ տեղի ունեցող ռեդոքս պրոցեսների պատճառով: Կատիոնների վերականգնումը տեղի է ունենում կաթոդում, իսկ անիոնների օքսիդացումը՝ անոդում։
Եկեք սկսենք դիտարկել գործընթացը ամենապարզ դեպքից. հալվածքների էլեկտրոլիզ.Հալվածքների էլեկտրոլիզի ժամանակ կաթոդի մոտմետաղական կատիոնները վերածվում են մաքուր մետաղի, և անոդումպարզ անիոնները օքսիդացվում են պարզ նյութի, օրինակ.
2Сl – – 2 ե= Cl 2,
S 2– – 2 ե= Ս.
Եթե անիոնն ունի բարդ կառուցվածք, ապա այս դեպքում տեղի է ունենում գործընթաց, որը պահանջում է նվազագույն քանակությամբ էներգիա։ Եթե աղը դիմացկուն է ջերմությանը, իսկ անիոնի տարրի ատոմը գտնվում է ամենաբարձր օքսիդացման վիճակում, ապա թթվածինը սովորաբար օքսիդացվում է պարզ նյութի.
– 2ե= SO 3 + 1/2O 2:
Եթե տարրի ատոմը գտնվում է միջանկյալ օքսիդացման վիճակում, ապա, ամենայն հավանականությամբ, այս դեպքում ոչ թե թթվածինը կօքսիդանա, այլ անիոնի մեկ այլ տարրի ատոմը, օրինակ.
– ե= NO 2.
Էլեկտրոլիզը լուծույթներում ավելի բարդ է արտադրանքի որոշման առումով։ Դա պայմանավորված է մեկ այլ բաղադրիչի` ջրի տեսքով: Ստանդարտ էլեկտրոդային պոտենցիալներով -1,67 Վ (Al) և ցածր (մետաղական լարումների շարքում մանգանից ձախ կողմում գտնվող) մետաղները, որպես կանոն, չեն կրճատվում ջրային լուծույթներից: Նման համակարգերում ջրածինը ազատվում է կաթոդում։ Սա առաջին հերթին պայմանավորված է նրանով, որ այդ մետաղները (ներառյալ մագնեզիումը և ալյումինը առանց պաշտպանիչ օքսիդ թաղանթի) արձագանքում են ջրի հետ: Բայց դա չի նշանակում, որ էլեկտրոդային գործընթացները, ինչպիսիք են
Na++ ե= Նա
չեն առաջանում ջրային լուծույթներում: Նատրիումի մետաղի արտադրության մեթոդներից մեկը NaCl ջրային լուծույթի էլեկտրոլիզն է (աղաջր): Այս գործընթացի գաղտնիքը սնդիկի կաթոդի կիրառման մեջ է: Կրճատված նատրիումի ատոմները կլանում են սնդիկի շերտը, որը պաշտպանում է դրանք ջրի հետ շփումից։ Հետագա տարանջատումը ստացված նատրիումի ամալգամի բաղադրիչների (ամալգամը համաձուլվածք է, որի բաղադրիչներից մեկը սնդիկն է) ձեռք է բերվում ուղղման միջոցով։
Ազատված սնդիկը այնուհետև վերադարձվում է գործառնական ցիկլ:
Համապատասխան էլեկտրոլիտների ջրային լուծույթների էլեկտրոլիզի միջոցով ջրի հետ փոխազդող մետաղներ ստանալու անհնարինության մասին է վկայում նաեւ հետեւյալ պատճառաբանությունը. եԹող կալցիումը նվազեցվի կաթոդում ջրային լուծույթի էլեկտրոլիզի ժամանակ.
Ca 2+ + 2
= Ք.
Մետաղը, վերականգնվելով, արձագանքելու է ջրի հետ.
Ca + 2H 2 O = Ca (OH) 2 + H 2:
Հետևաբար, մետաղի փոխարեն կաթոդում ջրածինը կթողարկվի։
Ստանդարտ էլեկտրոդների պոտենցիալ ունեցող մետաղները -1,05 Վ-ից մինչև 0 Վ միջակայքում (գտնվում են ալյումինի և ջրածնի էլեկտրաքիմիական շարքում) ջրածնի հետ զուգահեռ ջրային լուծույթներից վերականգնվում են: եԱպրանքների (մետաղ և ջրածին) հարաբերակցությունը որոշվում է լուծույթի կոնցենտրացիայից, թթվայնությունից և որոշ այլ գործոններից (լուծույթում այլ, հատկապես բարդ աղերի առկայություն, նյութը, որից պատրաստված է էլեկտրոդը): Որքան բարձր է աղի կոնցենտրացիան, այնքան մեծ է ազատված մետաղի համամասնությունը: Որքան ավելի թթվային է միջավայրը, այնքան ավելի հավանական է մետաղների էվոլյուցիան դրական ստանդարտ էլեկտրոդով
պոտենցիալները (գտնվում են ջրածնի աջ կողմում գտնվող մետաղական լարումների շարքում) արձակվում են առաջին հերթին լուծույթների էլեկտրոլիզի ժամանակ։
Օրինակ. ե Ag + +
= Ագ.
F 2 + H 2 O = 2HF + 1/2O 2:
Եթե էլեկտրոլիզի ենթարկվող աղը պարունակում է բարդ անիոն, որի հետերոատոմը (ոչ թթվածինը) գտնվում է ամենաբարձր օքսիդացման վիճակում, ապա թթվածին առաջանում է անոդում, այսինքն. ջրի տարրալուծումը տեղի է ունենում.
H2O – 2 ե= 2H + + 1/2O 2:
Բարդ անիոնն ինքնին կարող է նաև ծառայել որպես թթվածնի աղբյուր.
– 2ե= SO 3 + 1/2O 2:
Ստացված թթվային անհիդրիդն անմիջապես արձագանքում է ջրի հետ.
SO 3 + H 2 O = H 2 SO 4:
Երբ հետերոատոմը գտնվում է միջանկյալ օքսիդացման վիճակում, օքսիդացված է հետերոատոմը, ոչ թե թթվածնի ատոմը։ Նման գործընթացի օրինակ է սուլֆիտի իոնի օքսիդացումը էլեկտրական հոսանքի ազդեցության տակ.
![]()
Ստացված ծծմբային անհիդրիդը SO 3 անմիջապես փոխազդում է ջրի հետ:
Կարբոքսիլաթթուների անիոնները էլեկտրոլիզի արդյունքում ապակարբոքսիլացվում են՝ առաջացնելով ածխաջրածիններ.
2R–COO – – 2 ե= R–R + 2CO 2:
5.4. Օքսիդացման ուղղությունը
վերականգնման գործընթացները
և շրջակա միջավայրի թթվայնության ազդեցությունը դրա վրա
Ջրային լուծույթներում նյութերի ռեդոքսային ունակության չափանիշը ռեդոքս կամ ստանդարտ էլեկտրոդային պոտենցիալներն են: Եկեք որոշենք, օրինակ, արդյոք երկաթի Fe 3+ կատիոնը կարող է օքսիդացնել հալոգեն անիոնները KCl-ում, KBr-ում և KI-ում: Իմանալով էլեկտրոդների ստանդարտ պոտենցիալները (0), մենք կարող ենք հաշվարկել գործընթացի էլեկտրաշարժիչ ուժը (EMF): Այն սահմանվում է որպես օքսիդացնող նյութի և վերականգնող նյութի պոտենցիալների տարբերություն, և ռեակցիան տեղի է ունենում դրական EMF արժեքով.
![]()
Աղյուսակ 5.1
Արտահոսքի հավանականության որոշում
ռեդոքս գործընթացները
հիմնված ստանդարտ էլեկտրոդների պոտենցիալների վրա
Աղյուսակ 5.1-ը ցույց է տալիս, որ ուսումնասիրվող գործընթացներից միայն մեկն է հնարավոր: Իրոք, վերը նշված բոլոր կալիումի հալոգենիդներից միայն KI-ն է փոխազդում երկաթի տրիկլորիդով.
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl:
Գործընթացի ուղղությունը որոշելու ևս մեկ պարզ միջոց կա. Եթե պրոցեսի երկու կիսա-ռեակցիայի հավասարումներ գրենք մեկը մյուսի տակ այնպես, որ վերին կիսա-ռեակցիայի ստանդարտ էլեկտրոդային պոտենցիալը փոքր լինի ստորինից, ապա դրանց միջև գրված Z տառը (նկ. 5.2) ցույց կտա. իր ծայրերով թույլատրելի գործընթացի փուլերի ուղղությունները (Z կանոն)։
Նույն նյութերից, փոխելով միջավայրի pH-ը, կարելի է ստանալ տարբեր ապրանքներ։
Օրինակ, թթվային միջավայրում պերմանգանատի անիոնը կրճատվում է մանգանի (II) միացություն ստեղծելու համար.
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 5Na 2 SO 4 + 3H 2 O:
Չեզոք միջավայրում ձևավորվում է մանգան երկօքսիդ MnO 2.
Ալկալային միջավայրում պերմանգանատ անիոնը վերածվում է մանգանատի անիոնի.
2КМnО 4 + Na 2 SO 3 + 2KOH = 2К 2 MnO 4 + Na 2 SO 4 + H 2 O:
5.5. Զորավարժություններ
1. Որոշե՛ք ատոմների օքսիդացման աստիճանները հետևյալ միացություններում՝ BaO 2, CsO 2, RbO 3, F 2 O 2, LiH, F 2, C 2 H 5 OH, տոլուոլ, բենզալդեհիդ, քացախաթթու։
- VKontakte 0
- Google+ 0
- Լավ 0
- Ֆեյսբուք 0