Դասակարգելդրա կազմը և բաղադրիչների բնույթը.
Նշեք pH արժեքների միջակայքը, որի շրջանակներում այս համակարգը ունի բուֆերային հզորություն:
Գրելռեակցիայի հավասարումներ, որոնք արտացոլում են դրա գործողության մեխանիզմը (իոնային ձև):
Բացատրիրինչու ամոնիակային բուֆերային համակարգը արյան մաս չէ
1. Բաղադրիչների կազմը և բնույթը.
Ա) NH 4 OH (NH 3 x H 2 O) - ամոնիումի հիդրօքսիդ, թույլ էլեկտրոլիտ
Բ) NH 4 C1 – աղ, ամոնիումի քլորիդ, ուժեղ էլեկտրոլիտ:
Ամոնիումի հիդրօքսիդը լուծույթում թույլ էլեկտրոլիտ է, որը մասամբ բաժանվում է իոնների.
NH 4 OH<=>NH 4 + + OH-
Երբ ամոնիումի քլորիդը ավելացվում է ամոնիումի հիդրօքսիդի լուծույթին, աղը, որպես ուժեղ էլեկտրոլիտ, գրեթե ամբողջությամբ տարանջատվում է իոնների.
NН 4 С1 > NН 4 + + С1-
և ճնշում է հիմքի դիսոցիացիան, որի հավասարակշռությունը փոխվում է դեպի հակադարձ ռեակցիա։
- pH արժեքների միջակայքը, որի շրջանակներում դիտարկվող համակարգը ունի բուֆերային հզորություն, հաշվարկվում է բանաձևով.
որտեղ Kv-ն դիսոցման հաստատուն է NH 4 OH = 1.8 * 10 -5, C 0-ը հիմքի կոնցենտրացիան է, CC-ն աղի կոնցենտրացիան է:
pH=14-4.74+lg(C 0 /Cc)=9.26+lg (C 0 /Cc): Կախված C 0 /Cc հարաբերակցությունից, pH միջակայքը 8,26-10,26 է:
- Ամոնիակային բուֆերի կարողությունը պահպանել լուծույթի գրեթե հաստատուն pH արժեքը հիմնված է այն փաստի վրա, որ դրա բաղկացուցիչ բաղադրիչները կապում են լուծույթի մեջ մտցված կամ այս լուծույթում տեղի ունեցող ռեակցիայի արդյունքում առաջացած H+ և OH- իոնները: Երբ ուժեղ թթու ավելացվում է ամոնիակային բուֆերային խառնուրդին, H+ իոնները կկապվեն մոլեկուլների կամ ամոնիումի հիդրօքսիդի հետ, այլ ոչ թե կբարձրացնեն H+ իոնների կոնցենտրացիան և կնվազեն լուծույթի pH-ը.
NH 4 OH + H + =NH 4 + + H 2 O
Ալկալին ավելացնելիս OH - իոնները կկապեն NH 4 + իոնները՝ ձևավորելով թեթևակի տարանջատված միացություն, այլ ոչ թե կբարձրացնեն լուծույթի pH-ը.
NH 4 + +OH - = NH 4 OH
- Ամոնիակային բուֆերային համակարգը ներառված չէ արյան TOP RT կազմի մեջ, քանի որ pH-ի միջակայքը, որի շրջանակներում այն կունենա բուֆերային հզորություն, գտնվում է ալկալային շրջանում (pH 8-ից ավելի): Արյան պլազմայի նորմալ pH արժեքը 7,40 ± 0,05 է, այսինքն՝ բուֆերային շրջանից ցածր:
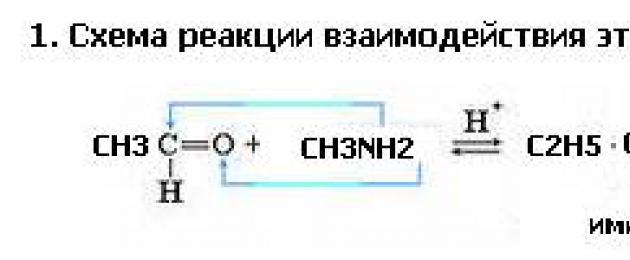
1. 3)ԳրելԷթանալի փոխազդեցության սխեման մեթիլամինի հետ:
Նկարագրեքայս ռեակցիայի մեխանիզմը:
Արդարացնելթթվային կատալիզատորի դերը.
Բացատրիրստացված իմինի հիդրոլիզի ռեակցիայի հավանականությունը թթվային և ալկալային միջավայրում:

2. Այս ռեակցիայի մեխանիզմը նուկլեոֆիլային ավելացումն է, որին հաջորդում է ջրի մոլեկուլի վերացումը

3. Թթվային կատալիզատորի դերը պրոտոնացումն է ա) փուլում.
4. Նոսրացած թթուների առկայության դեպքում իմինները ջրով հիդրոլիզվում են՝ առաջացնելով կարբոնիլային միացություններ և ամիններ, այս ռեակցիան իմինների սինթեզի ռեակցիայի հակառակն է.

Ալկալիների առկայության դեպքում հիդրոլիզ չի լինում
Տոմս 4.
Թերմոդինամիկական համակարգ (TM) -ցանկացած իրական առարկա, որը մեկուսացված է շրջակա միջավայրից՝ իր բաղկացուցիչ մասերի միջև նյութերի և էներգիայի փոխանակման գործընթացները, ինչպես նաև դրա և շրջակա միջավայրի միջև թերմոդինամիկական մեթոդներով ուսումնասիրելու նպատակով։
Ջերմոդինամիկական համակարգերի դասակարգում
3. Բացփոխանակել նյութը և էներգիան ՕՀ-ի հետ (օրգանիզմ, բաց անոթ եռացող ջրով)
4. Փակված է- ՕՀ-ի հետ փոխանակում է միայն էներգիան ջերմության կամ աշխատանքի տեսքով (գազ փակ բալոնում)
5. Մեկուսացված- մի փոխանակեք ոչ նյութեր, ոչ էներգիա: Բնության մեջ բացարձակապես մեկուսացված մարդիկ չկան։
Հիմնվելով մեքենայի ներսում միջերեսի առկայության վրա
1.Համասեռ– չկա միջերես, բոլոր բաղադրիչները գտնվում են ջրային փուլում, բոլոր ֆիզիկական և քիմիական հատկությունները ծավալի ցանկացած մասում նույնն են (գազերի խառնուրդ)
2. Տարասեռ- պարունակում է միջերես, համակարգի բաժանարար մասերը (փուլերը) տարբեր են բնույթով (արյուն)
Ընտրանքներ- քանակություններ, որոնք որոշում են մեքենայի վիճակը
Հնարավորության դեպքում ուղղակի չափում
Հիմնական պարամետրեր - պարամետրեր, որոնք կարող են չափվել համապատասխան գործիքների միջոցով (m, V, C, խտություն, ծավալ)
Պետական գործառույթներ - ներքին էներգիա E(U); էնտրոպիա (S); Գիբսի էներգիա (G); ազատ էներգիա կամ Հելմհոլցի էներգիա
Դուք կարող եք որոշել վիճակի ֆունկցիայի արժեքների փոփոխությունը
∆X(X 2 -X 1), ՈՐՏԵՂ X-U,H,S,G,H
Ջերմոդինամիկական վիճակ- որոշակի թվով ֆիզիկական արժեքների մի շարք: համակարգի բոլոր ֆիզիկական և քիմիական հատկությունները բնութագրող մեծություններ
Պետությունների տեսակները.
Nonequilibrium - պարամետրերը փոխվում են ինքնաբերաբար (մեկ բաժակ տաք ջուր)
Հավասարակշռություն - պարամետրերը չեն փոխվում առանց արտաքին ազդեցության
Ստացիոնար = արտաքին պարամետրերով պայմանավորված պարամետրերի կայունություն (կենդանի օրգանիզմներին բնորոշ)
Գործընթացը- համակարգի անցումը մի վիճակից մյուսին ուղեկցվում է թերմոդինամիկական պարամետրերի փոփոխություններով:
Դասակարգում-
հաստատուն պարամետրերով.
Ա) իզոխորիկ (v=const)
Բ) Իզոբարային (ճնշում - կոնստ)
Գ) իզոթերմային (ջերմաստիճանը =կոնստ)
Ըստ ջերմային ազդեցության նշանի.էկզոթերմիկ և էնդոթերմիկ
Ըստ էներգիայի սպառման՝ ինքնաբուխ, ոչ ինքնաբուխ
Ըստ հոսքի բնութագրերի.- շրջելի - հոսում է առաջ և հակառակ ուղղություններով նույն փուլերով, առանց շրջակա միջավայրի փոփոխության: միջավայրը։
Անշրջելի - բոլոր գործընթացները չեն կարող ընթանալ առաջ և հակառակ ուղղություններով 1 և նույն փուլերով:
Կենդանի օրգանիզմների հիմնական հատկություններից մեկը թթու-բազային հոմեոստազի պահպանումն է որոշակի մակարդակում։ Պրոտոլիտիկ հոմեոստազ- կենսաբանական հեղուկների, հյուսվածքների և օրգանների pH-ի կայունությունը. Սա արտահայտվում է կենսաբանական միջավայրի բավականին հաստատուն pH արժեքներով (արյուն, թուք, ստամոքսահյութ և այլն) և մարմնի կարողությունը վերականգնելու նորմալ pH արժեքները, երբ ենթարկվում են պրոտոլիտների: Համակարգի աջակցություն պրոտոլիտիկ հոմեոստազ,ներառում է ոչ միայն ֆիզիոլոգիական մեխանիզմներ (թոքային և երիկամային փոխհատուցում), այլև ֆիզիկաքիմիական՝ բուֆերային գործողություն, իոնափոխանակություն և դիֆուզիոն։
Բուֆերային լուծումներկոչվում են լուծույթներ, որոնք պահպանում են նույն pH արժեքը, երբ նոսրացվում կամ ավելացվում են փոքր քանակությամբ ուժեղ թթու կամ հիմք:Պրոտոլիտիկ բուֆերային լուծույթները էլեկտրոլիտների խառնուրդներ են, որոնք պարունակում են համանուն իոններ։
Հիմնականում կան երկու տեսակի պրոտոլիտիկ բուֆերային լուծումներ.
Թթվային, այսինքն. որը բաղկացած է թույլ թթվից և դրա զուգակցված հիմքի ավելցուկից (աղ, որը ձևավորվում է ուժեղ հիմքից և այս թթվի անիոնից): Օրինակ՝ CH 3 COOH և CH 3 COONa - ացետատային բուֆեր
CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 COO - ավելցուկային կոնյուգացիա
հիմքերը
CH 3 COONa → Na + + CH 3 COO -
Հիմնականները, այսինքն. որը բաղկացած է թույլ հիմքից և դրա զուգակցված թթվի ավելցուկից (այսինքն՝ ուժեղ թթվից և այս հիմքի կատիոնից առաջացած աղից): Օրինակ՝ NH 4 OH և NH 4 Cl – ամոնիակի բուֆեր:
NH 3 + H 2 O ↔ OH - + NH 4 + ավելցուկ
Հիմք
զուգորդել
NH 4 Cl → Cl - + NH 4 + թթուներ
Բուֆերային համակարգի հավասարումը հաշվարկվում է Հենդերսոն-Հասելբախի բանաձևով.
pH = pK + ℓg, pOH = pK + ℓg  ,
,
որտեղ pK = -ℓg K D.
C – մոլային կամ համարժեք էլեկտրոլիտի կոնցենտրացիան (C = V N)
Բուֆերային լուծույթների գործողության մեխանիզմը
Դիտարկենք այն՝ օգտագործելով ացետատի բուֆերի օրինակը՝ CH 3 COOH + CH 3 COONa
Ացետատ իոնների բարձր կոնցենտրացիան պայմանավորված է ուժեղ էլեկտրոլիտի՝ նատրիումի ացետատի ամբողջական տարանջատմամբ, իսկ քացախաթթուն, համանուն անիոնի առկայության դեպքում, լուծույթում գոյություն ունի գրեթե ոչ իոնացված ձևով։
Երբ ավելացվում է փոքր քանակությամբ աղաթթու, H + իոնները կապվում են CH 3 COO-ի լուծույթում առկա կոնյուգացիոն հիմքին թույլ CH 3 COOH էլեկտրոլիտի մեջ:
CH 3 COO ‾ +H + ↔ CH 3 COOH (1)
(1) հավասարումից պարզ է դառնում, որ ուժեղ թթուն HC1 փոխարինվում է թույլ թթվի CH 3 COOH համարժեք քանակով: CH 3 COOH-ի քանակությունը մեծանում է, և, ըստ Վ. Օստվալդի նոսրացման օրենքի, դիսոցման աստիճանը նվազում է: Արդյունքում բուֆերում H + իոնների կոնցենտրացիան մեծանում է, բայց շատ աննշան։ pH-ը մնում է հաստատուն։
Բուֆերին թթու ավելացնելիս pH-ը որոշվում է բանաձևով.
pH = pK + ℓg 
Երբ բուֆերին ավելացվում է փոքր քանակությամբ ալկալի, այն փոխազդում է CH 3 COOH-ի հետ: Քացախաթթվի մոլեկուլները փոխազդելու են հիդրօքսիդի իոնների հետ՝ ձևավորելով H 2 O և CH 3 COO ‾:
CH 3 COOH + OH ‾ ↔ CH 3 COO ‾ + H 2 O (2)
Արդյունքում, ալկալին փոխարինվում է թույլ հիմնական աղի համարժեք քանակով CH 3 COONa: CH 3 COOH-ի քանակությունը նվազում է և, համաձայն Վ. Օստվալդի նոսրացման օրենքի, դիսոցման աստիճանը մեծանում է մնացած չդիսոցավորված CH 3 COOH մոլեկուլների պոտենցիալ թթվայնության պատճառով: Հետևաբար, H + իոնների կոնցենտրացիան մնում է գրեթե անփոփոխ: pH-ը մնում է հաստատուն։
Ալկալի ավելացնելիս pH-ը որոշվում է բանաձևով.
pH = pK + ℓg 
Բուֆերը նոսրացնելիս pH-ը նույնպես չի փոխվում, քանի որ տարանջատման հաստատունը և բաղադրիչների հարաբերակցությունը մնում են անփոփոխ:
Այսպիսով, բուֆերի pH-ը կախված է՝ դիսոցման հաստատունից և բաղադրիչների կոնցենտրացիայի հարաբերակցությունից։ Որքան բարձր են այս արժեքները, այնքան բարձր է բուֆերի pH-ը: Բուֆերի pH-ը կլինի ամենամեծը, երբ բաղադրիչի հարաբերակցությունը հավասար է մեկին:
Բուֆերը քանակականորեն բնութագրելու համար ներկայացվում է հայեցակարգը բուֆերային հզորություն.
ՆԵՐԱԾՈՒԹՅՈՒՆ
ԲՈՒՖԵՐԱՅԻՆ ԼՈՒԾՈՒՄՆԵՐ (բուֆերային խառնուրդներ, բուֆերներ) - բուֆերային համակարգեր պարունակող լուծույթներ և արդյունքում ունեն pH-ի մշտական մակարդակում պահպանելու հատկություն։ Դրանք սովորաբար պատրաստվում են թույլ թթուն և դրա ալկալի մետաղի աղը համապատասխան չափաբաժիններով լուծելով ջրում, մասամբ չեզոքացնելով թույլ թթուն ուժեղ ալկալով կամ թույլ հիմքը ուժեղ թթվով և լուծելով պոլիբազային թթվի աղերի խառնուրդը: Այս կերպ պատրաստված բուֆերային լուծույթների pH արժեքը փոքր-ինչ տարբերվում է ջերմաստիճանից: pH արժեքների միջակայքը, որում բուֆերային լուծույթն ունի կայուն բուֆերային հատկություններ, գտնվում է pK ± 1-ի սահմաններում (pK-ն իր կազմի մեջ ներառված թույլ թթվի դիսոցման հաստատունի բացասական տասնորդական լոգարիթմն է): Ամենահայտնի բուֆերային լուծույթներն են՝ գլիցին Սերենսեն, ացետատ Վալպոլ, ֆոսֆատ Սերենսեն, բորատ Պալիչ, վերոնալ Միքայելիս, կարբոնատ Կոլթոֆֆ, Տրիս բուֆեր, ունիվերսալ վերոնալ Միքայելիս և այլն։
Լաբորատոր պրակտիկայում բուֆերային լուծույթները օգտագործվում են միջավայրի ակտիվ ռեակցիան որոշակի հաստատուն մակարդակում պահպանելու և pH արժեքը որոշելու համար՝ որպես կայուն pH արժեքներով ստանդարտ լուծույթներ և այլն։
ԲՈՒՖԵՐԱՅԻՆ ԽԱՌՆՈՒՅԹՆԵՐ
Եթե որեւէ թթվի կամ ալկալիի լուծույթին ջուր են ավելացնում, ապա, բնականաբար, ջրածնի կամ հիդրօքսիլ իոնների կոնցենտրացիան համապատասխանաբար նվազում է։ Բայց եթե որոշակի քանակությամբ ջուր ավելացնեք քացախաթթվի և նատրիումի ացետատի կամ ամոնիումի հիդրօքսիդի և ամոնիումի քլորիդի խառնուրդին, ապա այս լուծույթներում ջրածնի և հիդրօքսիլ իոնների կոնցենտրացիան չի փոխվի:
Որոշ լուծույթների կարողությունը պահպանել ջրածնի իոնների մշտական կոնցենտրացիան նոսրացման ժամանակ, ինչպես նաև փոքր քանակությամբ ուժեղ թթուների կամ ալկալիների ավելացման դեպքում, հայտնի է որպես բուֆերային գործողություն:
Լուծումները, որոնք միաժամանակ պարունակում են թույլ թթու և դրա աղ կամ թույլ հիմք և դրա աղը և ունեն բուֆերային ազդեցություն, կոչվում են բուֆերային լուծույթներ: Բուֆերային լուծույթները կարելի է համարել որպես համանուն իոններ ունեցող էլեկտրոլիտների խառնուրդներ։ Թույլ թթվի կամ թույլ հիմքի և դրանց աղերի առկայությունը լուծույթում նվազեցնում է նոսրացման կամ այլ թթուների և հիմքերի ազդեցությունը լուծույթի pH-ի վրա։
Նման բուֆերային լուծույթները հետևյալ CH խառնուրդներն են 3 COOH + CH 3 C OON a, NH 4 OH + NH 4 Cl, Na 2 CO 3 + NaHCO 3 և այլն:
Բուֆերային լուծույթները, որոնք թույլ թթուների և դրանց աղերի խառնուրդներ են, սովորաբար ունենում են թթվային ռեակցիա (pH<7). Например, буферная смесь 0,1М раствора СН 3 COOP + 0.1 M CH լուծույթ 3 CO ONa-ն ունի pH = 4,7:
Բուֆերային լուծույթները, որոնք թույլ հիմքերի և դրանց աղերի խառնուրդներ են, սովորաբար ունենում են ալկալային ռեակցիա (pH>7)։ Օրինակ, 0,1 մ լուծույթի բուֆերային խառնուրդ N H 4 OH + 0.1 M N H 4 C1 լուծույթն ունի pH = 9.3:
Թթու-բազային բուֆերային լուծույթներ
Լայն իմաստով բուֆերային համակարգերը համակարգեր են, որոնք պահպանում են պարամետրի որոշակի արժեքը, երբ կազմը փոխվում է: Բուֆերային լուծումները կարող են լինել
թթու-բազային - պահպանել pH-ի մշտական արժեքը՝ ավելացնելով փոքր քանակությամբ թթու կամ հիմք:
Redox-ը կայուն է պահում համակարգի ներուժը, երբ ներմուծվում են օքսիդացնող կամ վերականգնող նյութեր:
Հայտնի են մետաղական բուֆերային լուծույթներ, որոնք պահպանում են մշտական pH արժեքը:
Բոլոր դեպքերում բուֆերային լուծույթը կոնյուգացիոն զույգ է: Մասնավորապես, թթու-բազային բուֆերային լուծույթները պարունակում են թթու-բազային զուգակցված զույգ: Այս լուծույթների բուֆերային ազդեցությունը պայմանավորված է ընդհանուր թթու-բազային հավասարակշռության առկայությամբ.
ԱԺ ↔ N + + A -
զուգակցված թթու
Հիմք
B + N + ↔ VN +
ՄԱՍԻՆ աղավաղել խոնարհվել
Թթու
Քանի որ այս բաժնում քննարկվում են միայն թթու-բազային բուֆերային լուծույթները, մենք դրանք կանվանենք բուֆերային լուծույթներ՝ անվանման մեջ բաց թողնելով «թթու-բազային»:
Բուֆերային լուծույթները լուծույթներ են, որոնք պահպանում են մշտական pH արժեքը նոսրացման և փոքր քանակությամբ թթվի կամ հիմքի ավելացման միջոցով:
Բուֆերային համակարգերի դասակարգում
1. թույլ թթուների և դրանց աղերի լուծույթների խառնուրդներ. Օրինակ, ացետատի բուֆերային լուծույթ:
2. թույլ հիմքերի լուծույթների և դրանց աղերի խառնուրդներ. Օրինակ, ամոնիումի բուֆերային լուծույթ:
3. փոխարինման տարբեր աստիճանի բազմաբազային թթուների աղերի լուծույթների խառնուրդներ։ Օրինակ, ֆոսֆատի բուֆերային լուծույթ:
4. ամֆոլիտների իոններ և մոլեկուլներ. Դրանք ներառում են, օրինակ, ամինաթթուներ և սպիտակուցային բուֆերային համակարգեր: Լինելով իզոէլեկտրական վիճակում՝ ամինաթթուները և սպիտակուցները բուֆերներ չեն։ Բուֆերային ազդեցությունն առաջանում է միայն այն դեպքում, երբ դրանց ավելացվում է որոշակի քանակությամբ թթու կամ ալկալի: Այս դեպքում ձևավորվում է սպիտակուցի երկու ձևերի խառնուրդ՝ ա) թույլ «սպիտակուցային թթու» + այս թույլ թթվի աղ. բ) թույլ «սպիտակուցային հիմք» + այս թույլ հիմքի աղ. Այսպիսով, այս տեսակի բուֆերային համակարգերը կարելի է դասակարգել որպես առաջին կամ երկրորդ տիպի բուֆերային համակարգեր:
Բուֆերային լուծույթների pH-ի հաշվարկը
Բուֆերային համակարգերի pH-ի հաշվարկման հիմքը թթու-բազային հավասարակշռության զանգվածային գործողության օրենքն է։ Բուֆերային համակարգի համար, որը բաղկացած է թույլ թթվից և դրա աղից, օրինակ՝ ացետատից, իոնի կոնցենտրացիան H+ հեշտ է հաշվարկել քացախաթթվի հավասարակշռության հաստատունի հիման վրա.
CH 3 COOH ↔ CH 3 COO - + H +
(1).
(1)-ից հետևում է, որ ջրածնի իոնների կոնցենտրացիան հավասար է
(2)
CH3-ի առկայության դեպքում COONa Քացախաթթվի թթու-բազային հավասարակշռությունը տեղափոխվում է ձախ: Հետևաբար, չդիսոցացված քացախաթթվի կոնցենտրացիան գրեթե հավասար է թթվի կոնցենտրացիային, այսինքն. [SN 3 COOH] = թթվային
Ացետատ իոնների ուժեղ էլեկտրոլիտի հիմնական աղբյուրը CH3COONa:
CH 3 COONa → Na + + CH 3 COO - ,
Հետևաբար, մենք կարող ենք ընդունել, որ [ CH 3 COO - ] = աղից . Հաշվի առնելով արված ենթադրությունները՝ (2) հավասարումը ստանում է ձև.
Դրանից մենք ստանում ենք Հենդերսոն-Հասելբախի հավասարումը թույլ թթվից և դրա աղից բաղկացած բուֆերային համակարգերի համար.
(3)
Թույլ հիմքից և դրա աղից, օրինակ՝ ամոնիակից, բուֆերային համակարգի համար, լուծույթում ջրածնի իոնների կոնցենտրացիան կարող է հաշվարկվել թույլ հիմքի դիսոցման հաստատունի հիման վրա։
NH 3 × H 2 O = NH 4 OH ↔ NH 4 + + OH -
(4)
Եկեք արտահայտենք իոնների կոնցենտրացիանՕհ- ջրի իոնային արտադրանքից
(5)
և փոխարինիր այն (4-ով):
(6)
(6)-ից հետևում է, որ ջրածնի իոնների կոնցենտրացիան հավասար է
(7)
NH 4 Cl-ի առկայության դեպքում թթու-բազային հավասարակշռությունը տեղափոխվում է ձախ: Հետևաբար, չտարանջատված ամոնիակի կոնցենտրացիան գրեթե հավասար է ամոնիակի կոնցենտրացիային, այսինքն. [ NH 4 OH ] = հիմքով:
Ամոնիումի կատիոնների ուժեղ էլեկտրոլիտի հիմնական աղբյուրը NH4Cl:
NH 4 Cl → NH 4 + + Cl -,
Հետևաբար, մենք կարող ենք ընդունել, որ [ NH 4 + ] = աղից . Հաշվի առնելով արված ենթադրությունները՝ (7) հավասարումը ստանում է ձև.
(8)
Դրանից մենք ստանում ենք Հենդերսոն-Հասելբախի հավասարումը բուֆերային համակարգերի համար, որոնք բաղկացած են թույլ հիմքից և դրա աղից.
(9)
Նմանապես, դուք կարող եք հաշվարկել բուֆերային համակարգի pH-ը, որը բաղկացած է տարբեր աստիճանի փոխարինման պոլիբազային թթուների աղերի լուծույթներից, օրինակ՝ ֆոսֆատ, որը բաղկացած է ջրածնի ֆոսֆատի լուծույթներից ( Na2HPO4 ) և երկջրածին ֆոսֆատ ( NaH2PO4 ) նատրիում. Դրա գործողությունը հիմնված է թթու-բազային հավասարակշռության վրա.
H 2 PO 4 - ↔ H + + HPO 4 2-
Թույլ թթվային կոնյուգացիոն հիմք
(10)
(10)-ից արտահայտելով ջրածնի իոնների կոնցենտրացիան և կատարել հետևյալ ենթադրությունները.
[H 2 PO 4 - ] = c (H 2 PO 4 - ); [ HPO 4 2- ] = c (HPO 4 2- ), մենք ստանում ենք.
(11).
Հաշվի առնելով այս արտահայտության լոգարիթմը և հակադարձելով նշանները՝ մենք ստանում ենք Հենդերսոն-Հասելբախի հավասարումը ֆոսֆատային բուֆերային համակարգի pH-ի հաշվարկման համար։
(12),
Որտեղ pK b (H 2 PO 4 - ) դիսոցման հաստատունի բացասական տասնորդական լոգարիթմ
ֆոսֆորական թթու երկրորդ փուլում; հետ ( H 2 PO 4 - ) և (HPO 4 2- ) համապատասխանաբար թթվի և աղի կոնցենտրացիան.
Բուֆերային լուծույթների հատկությունները
Բուֆերային լուծույթների pH արժեքը նոսրացումից հետո մնում է անփոփոխ, ինչպես հետևում է Հենդերսոն-Հասելբալխի հավասարումից: Երբ բուֆերային լուծույթը նոսրացվում է ջրով, խառնուրդի երկու բաղադրիչների կոնցենտրացիաները նվազում են նույնքան անգամ: Հետեւաբար, pH արժեքը չպետք է փոխվի: Այնուամենայնիվ, փորձը ցույց է տալիս, որ pH-ի որոշակի փոփոխություն, թեև աննշան, այնուամենայնիվ տեղի է ունենում: Դա բացատրվում է նրանով, որ Հենդերսոն-Հասելբալխի հավասարումը մոտավոր է և հաշվի չի առնում միջիոնային փոխազդեցությունները։ Ճշգրիտ հաշվարկներ կատարելիս պետք է հաշվի առնել զուգակցված թթվի և հիմքի ակտիվության գործակիցների փոփոխությունը։
Բուֆերները քիչ են փոխում pH-ը, երբ ավելացվում են փոքր քանակությամբ թթու կամ հիմք: Բուֆերային լուծույթների կարողությունը պահպանել հաստատուն pH, երբ դրանց ավելացվում է փոքր քանակությամբ ուժեղ թթու կամ ուժեղ հիմք, հիմնված է այն փաստի վրա, որ բուֆերային լուծույթի մի բաղադրիչը կարող է արձագանքել H-ի հետ:+ ավելացված թթու, իսկ մյուսը OH-ով- ավելացված բազա: Արդյունքում, բուֆերային համակարգը կարող է կապել երկուսն էլ H + և OH - և պահպանել pH-ի մշտական արժեքը մինչև որոշակի սահման: Եկեք դա ցույց տանք՝ օգտագործելով ֆորմատի բուֆերային համակարգի օրինակը, որը թթու-հիմնային զույգ է։ HCOOH/HCOO- . Ֆորմատային բուֆերային լուծույթում հավասարակշռությունը կարող է ներկայացվել հետևյալ հավասարմամբ.
HCOOH ↔ HCOO - + H +
Երբ ավելացվում է ուժեղ թթու, կոնյուգացիոն հիմքը HCOO- կապում է ավելացված իոնները H+ , վերածվելով թույլ մածուցիկ թթվի.
HCOO - + H + ↔ HCOOH
Լե Շատելիեի սկզբունքի համաձայն՝ հավասարակշռությունը տեղափոխվում է ձախ։
Երբ ալկալին ավելացվում է, մածուցիկ թթվի պրոտոնները կապում են ավելացված OH իոնները- ջրի մոլեկուլների մեջ.
HCOOH + OH - → HCOO - + H 2 O
Ըստ Le Chatelier-ի՝ թթու-բազային հավասարակշռությունը տեղաշարժվում է դեպի աջ։
Երկու դեպքում էլ հարաբերակցության փոքր փոփոխություններ կան HCOOH/HCOO- , բայց այս հարաբերակցության լոգարիթմը քիչ է փոխվում։ Հետևաբար, լուծույթի pH-ը փոքր-ինչ փոխվում է։
Բուֆերային գործողության էությունը
Բուֆերային լուծույթների գործողությունը հիմնված է այն փաստի վրա, որ բուֆերային խառնուրդների առանձին բաղադրիչները կապում են դրանց մեջ ներմուծված թթուների և հիմքերի ջրածնի կամ հիդրօքսիլ իոնները՝ թույլ էլեկտրոլիտներ ձևավորելու համար։ Օրինակ, եթե թույլ թթու HA պարունակող բուֆերային լուծույթ n և այս թթվի աղը Kt А n , ավելացրեք ալկալի, այնուհետև տեղի կունենա թույլ էլեկտրոլիտ-ջրի ձևավորման ռեակցիա.
H + + OH → H 2 O
Հետևաբար, եթե թթու պարունակող բուֆերային լուծույթին ավելացվում է ալկալի, ապա HA թթվի էլեկտրոլիտիկ տարանջատման ժամանակ առաջացած ջրածնի իոնները. n , կապվում են ավելացված ալկալիի հիդրօքսիլ իոններին՝ առաջացնելով թույլ էլեկտրոլիտ-ջուր։ Սպառված ջրածնի իոնների փոխարեն՝ HA թթվի հետագա տարանջատման պատճառով n , առաջանում են ջրածնի նոր իոններ։ Արդյունքում Հ–ի նախկին կոնցենտրացիան+ - բուֆերային լուծույթում իոնները կվերականգնվեն իրենց սկզբնական արժեքին:
Եթե նշված բուֆերային խառնուրդին ավելացվի ուժեղ թթու, ռեակցիան տեղի կունենա.
N + + A n - → NA n
դրանք. A n - - աղի էլեկտրոլիտիկ տարանջատման ժամանակ առաջացած իոններ t A n , միանալով ավելացված թթվի ջրածնի իոններին, ձևավորում են թույլ թթվի մոլեկուլներ։ Հետևաբար, բուֆերային խառնուրդին ուժեղ թթվի ավելացումից ջրածնի իոնների կոնցենտրացիան գործնականում չի փոխվի: Այլ բուֆերային խառնուրդների ազդեցությունը կարելի է բացատրել նույն կերպ:
pH արժեքը բուֆերային լուծույթներում
Հարաբերակցությունները փոխելով դուք կարող եք ստանալ բուֆեր
լուծումներ, որոնք բնութագրվում են pH-ի սահուն փոփոխությամբ իրենց նվազագույն հնարավոր արժեքներից: Թույլ թթվի ջրային լուծույթում
[ H + ] = √K HAn * C HAn
որտեղ
pH = − log [ H + ] = − − log K HAn − − log C HAn
Բայց քանի որ Կ ՀԱՆ հաստատուն արժեք է, ավելի լավ է այն ներկայացնել ձևով pK ՀԱՆ դրանք. Էլեկտրոլիտիկ տարանջատման հաստատունի ցուցիչ. pK Han = − log K HAn .
Այնուհետև մենք գտնում ենք, որ թույլ թթվի ջրային լուծույթում.
рН = − log [Н + ] = − − pK HAn − − pC HAn
Քանի որ թույլ թթվային աղ ավելացվում է ջրային լուծույթին, լուծույթի pH-ը կփոխվի։
Համաձայն հավասարման՝ թույլ թթվի և դրա աղի խառնուրդ պարունակող լուծույթում [Հ+ ] = ԽԱՆ
Դա
рН = − log [Н + ] = − log K HAn − log C HAn + log C Kt А n .
Մենք նմանապես ստանում ենք թույլ հիմքերի բանաձևը.
[OH] = √K KtOH * C KtOH
pOH = − log [ OH ] = − − log K KtOH − − log C KtOH
Ջրածնի իոնների կոնցենտրացիան արտահայտվում է նաև հետևյալ բանաձևով [H+ ] = հետևաբար
pH = pK w − (− pK KtOH − − log C KtOH)
Համաձայն հավասարման՝ թույլ հիմքի և դրա աղի խառնուրդ պարունակող լուծույթում
[H+] =
Տ . ե.
pH = − log [ H + ] = − log K w + log K KtOH − log C Kt A n + log C KtOH:
pH արժեքների համար ստացված բանաձևը անգիր անելու կարիք չկա, քանի որ դրանք շատ հեշտ են ստացվում՝ հաշվի առնելով [H-ի արժեքը արտահայտող պարզ բանաձևերի լոգարիթմը։+ ].
Բուֆերային հզորություն
Բուֆերային լուծույթների՝ pH-ի մշտական արժեքը պահպանելու ունակությունը անսահմանափակ չէ և կախված է բուֆերային լուծույթի որակական կազմից և դրա բաղադրիչների կոնցենտրացիայից: Երբ բուֆերային լուծույթին ավելացվում են զգալի քանակությամբ ուժեղ թթու կամ ալկալի, pH-ի նկատելի փոփոխություն է նկատվում: Ավելին, տարբեր բուֆերային խառնուրդների համար, որոնք միմյանցից տարբերվում են բաղադրությամբ, միմյանցից տարբերվում են բաղադրությամբ, բուֆերային էֆեկտը նույնը չէ։ Հետևաբար, բուֆերային խառնուրդները կարելի է առանձնացնել բուֆերային լուծույթում հավասար քանակությամբ և որոշակի կոնցենտրացիայի մեջ ներծծված թթուների և ալկալիների գործողության նկատմամբ իրենց դիմադրության ուժով: Որոշակի կոնցենտրացիայի թթվի կամ ալկալիի սահմանափակ քանակությունը (մոլ/լ կամ գ-էկ/լ), որը կարող է ավելացվել բուֆերային լուծույթին այնպես, որ դրա pH արժեքը փոխվի միայն մեկ միավորով, կոչվում է բուֆերային հզորություն։
Եթե արժեքը [H + Մեկ բուֆերային լուծույթի ] փոխվում է [H+ ] մեկ այլ բուֆերային լուծույթի նույն քանակությամբ թթու ավելացնելիս, ապա առաջին խառնուրդն ավելի մեծ բուֆերային հզորություն ունի։ Նույն բուֆերային լուծույթի համար, որքան բարձր է դրա բաղադրիչների կոնցենտրացիան, այնքան մեծ է բուֆերային հզորությունը:
Ուժեղ թթուների և հիմքերի լուծույթների բուֆերային հատկությունները.
Բավականին բարձր կոնցենտրացիաներում ուժեղ թթուների և հիմքերի լուծույթներն ունեն նաև բուֆերային ազդեցություն: Կոնյուգացիոն համակարգերն այս դեպքում Հ 3 O + / H 2 O ուժեղ թթուների և OH-ի համար- /Հ 2 O ամուր հիմքերի համար: Ուժեղ թթուները և հիմքերը լիովին տարանջատված են ջրային լուծույթներում և, հետևաբար, բնութագրվում են հիդրոնիումի իոնների բարձր խտությամբ:կամ հիդրօքսիլ իոններ: Դրանց լուծույթներին փոքր քանակությամբ ուժեղ թթու կամ ամուր հիմք ավելացնելը, հետևաբար, միայն աննշան ազդեցություն ունի լուծույթի pH-ի վրա:
Բուֆերային լուծույթների պատրաստում
1. Համապատասխան ֆիքսատորները նոսրացնելով ծավալային կոլբայի մեջ։
2. Հենդերսոն-Հասելբախի հավասարման միջոցով հաշվարկված հարմար զուգակցված թթու-հիմնային զույգերի քանակները խառնելով:
3. Թույլ թթվի մասնակի չեզոքացում ուժեղ ալկալիով կամ թույլ հիմքի ուժեղ թթվով:
Քանի որ բուֆերային հատկությունները շատ թույլ են, եթե մի բաղադրիչի կոնցենտրացիան 10 անգամ կամ ավելի տարբերվում է մյուսի կոնցենտրացիայից, բուֆերային լուծույթները հաճախ պատրաստվում են երկու բաղադրիչների հավասար կոնցենտրացիաների լուծույթները խառնելով կամ մեկ բաղադրիչի լուծույթին ավելացնելով համապատասխանը: ռեագենտի քանակությունը, ինչը հանգեցնում է կոնյուգացիոն ձևի հավասար կոնցենտրացիայի ձևավորմանը: Տեղեկատվական գրականությունը պարունակում է pH տարբեր արժեքների համար բուֆերային լուծույթներ պատրաստելու մանրամասն բաղադրատոմսեր:
Բուֆերային լուծույթների կիրառումը քիմիական անալիզի մեջ
Բուֆերային լուծույթները լայնորեն օգտագործվում են քիմիական վերլուծության մեջ այն դեպքերում, երբ, ըստ փորձարարական պայմանների, պետք է տեղի ունենա քիմիական ռեակցիա՝ պահպանելով ճշգրիտ pH արժեքը, որը չի փոխվում, երբ լուծումը նոսրացվում է կամ երբ դրան ավելացվում են այլ ռեակտիվներ: Օրինակ՝ օքսիդացում-վերականգնման ռեակցիայի ժամանակ՝ սուլֆիդների, հիդրօքսիդների, կարբոնատների, քրոմատների, ֆոսֆատների և այլնի տեղումների ժամանակ։
Ահա դրանց վերլուծության նպատակով օգտագործելու մի քանի դեպքեր.
Ացետատի բուֆերային լուծույթ (CH3COOH + CH 3 COO Na ; pH = 5) օգտագործվում է նստվածքների նստեցման համար, որոնք չեն կարող նստեցվել թթվային կամ ալկալային լուծույթներում: Թթուների վնասակար ազդեցությունը ճնշում է նատրիումի ացետատը, որը փոխազդում է ուժեղ թթվի հետ։ Օրինակ:
HC1 + CH 3 COO N a → CH 3 COOH + Na C1
կամ իոնային ձևով
H + + CH 3 COO → CH 3 COOH.
Ամոնիակ-ամոնիումի բուֆերային լուծույթ ( N H 4 OH + N H 4 C1; pH = 9) օգտագործվում է բարիումի, ստրոնցիումի, կալցիումի կարբոնատների նստեցման և մագնեզիումի իոններից դրանց անջատման համար. նիկելի, կոբալտի, ցինկի, մանգանի, երկաթի սուլֆիդների տեղումների ժամանակ; ինչպես նաև ալյումինի, քրոմի, բերիլիումի, տիտանի, ցիրկոնիումի, երկաթի և այլն հիդրօքսիդների արտազատման ժամանակ։
Ֆորմատ բուֆերային լուծույթ (HCOOH + HCOOՆ Ա; pH = 2) օգտագործվում է ձևով նստված ցինկի իոնները առանձնացնելու համար ZnS կոբալտի, նիկելի, մանգանի, երկաթի, ալյումինի և քրոմի իոնների առկայության դեպքում։
Ֆոսֆատի բուֆերային լուծույթ ( N a 2 NPO 4 + N aH 2 RO; pH = 8) օգտագործվում է օքսիդացում-վերականգնման բազմաթիվ ռեակցիաներում:
Բուֆերային խառնուրդները վերլուծական նպատակներով հաջողությամբ օգտագործելու համար անհրաժեշտ է հիշել, որ ոչ ամեն բուֆերային խառնուրդ է հարմար վերլուծության համար: Բուֆերային խառնուրդը ընտրվում է կախված իր նպատակից: Այն պետք է բավարարի որոշակի որակական բաղադրություն, և դրա բաղադրիչները պետք է առկա լինեն լուծույթում որոշակի քանակությամբ, քանի որ բուֆերային խառնուրդների ազդեցությունը կախված է դրանց բաղադրիչների կոնցենտրացիաների հարաբերակցությունից:
Վերոնշյալը կարելի է ներկայացնել աղյուսակի տեսքով:
Բուֆերային լուծույթներ, որոնք օգտագործվում են վերլուծության մեջ
|
Բուֆերային խառնուրդ |
Խառնուրդի կազմը (1:1 մոլային հարաբերակցությամբ) |
pH |
|
Ձևաչափել |
Մրջնաթթու և նատրիումի ֆորմատ |
|
|
Բենզոատ |
Բենզոաթթու և ամոնիումի բենզոատ |
|
|
Ացետատ |
Քացախաթթու և նատրիումի ացետատ |
|
|
Ֆոսֆատ |
Մոնո- և դի-նատրիումի ֆոսֆատ |
|
|
Ամոնիում |
Ամոնիումի հիդրօքսիդ և ամոնիումի քլորիդ |
Թթվային աղերի խառնուրդները՝ ջրածինը մետաղով տարբեր փոխարինելով, նույնպես բուֆերային ազդեցություն ունեն։ Օրինակ՝ երկհիդրոֆոսֆատի և նատրիումի հիդրոֆոսֆատի բուֆերային խառնուրդում առաջին աղը թույլ թթվի դեր է խաղում, իսկ երկրորդը՝ նրա աղի դերը։
Թույլ թթվի և դրա աղի կոնցենտրացիան փոփոխելով՝ հնարավոր է ստանալ բուֆերային լուծույթներ՝ սահմանված pH արժեքներով:
Կենդանական և բուսական օրգանիզմներն ունեն նաև բարդ բուֆերային համակարգեր, որոնք պահպանում են արյան, ավշի և այլ հեղուկների մշտական pH: Հողը ունի նաև բուֆերային հատկություններ, որոնք հակված են հակազդելու արտաքին գործոններին, որոնք փոխում են հողի լուծույթի pH-ը, օրինակ, երբ թթուները կամ հիմքերը ներմուծվում են հող:
ԵԶՐԱԿԱՑՈՒԹՅՈՒՆ
Այսպիսով, բուֆերային լուծումները լուծումներ են, որոնք աջակցում ենմշտական pH արժեք, երբ նոսրացվում է և ավելացվում է փոքր քանակությամբ թթու կամ հիմք: Բուֆերային լուծույթների կարևոր հատկությունն այն է, որ լուծույթը նոսրացնելիս pH-ի մշտական արժեքը պահպանելու ունակությունն է: Թթուների և հիմքերի լուծույթները չեն կարող կոչվել բուֆերային լուծույթներ, քանի որ Երբ դրանք նոսրացվում են ջրով, լուծույթի pH-ը փոխվում է։ Առավել արդյունավետ բուֆերային լուծույթները պատրաստվում են թույլ թթվի և դրա աղի կամ թույլ հիմքի և դրա աղի լուծույթներից.
Բուֆերային լուծույթները կարելի է համարել որպես համանուն իոններ ունեցող էլեկտրոլիտների խառնուրդներ։ Բուֆերային լուծումները կարևոր դեր են խաղում բազմաթիվ տեխնոլոգիական գործընթացներում: Դրանք օգտագործվում են, օրինակ, պաշտպանիչ ծածկույթների էլեկտրաքիմիական կիրառման, ներկանյութերի, կաշվի և լուսանկարչական նյութերի արտադրության մեջ։ Բուֆերային լուծույթները լայնորեն օգտագործվում են քիմիական վերլուծության և pH մետրերի չափորոշման համար:
Շատ կենսաբանական հեղուկներ բուֆերային լուծույթներ են: Օրինակ՝ մարդու օրգանիզմում արյան pH-ը պահպանվում է 7,35-ից 7,45-ի սահմաններում; ստամոքսահյութ 1,6-ից 1,8; թուք 6.35-ից 6.85: Նման լուծույթների բաղադրիչներն են կարբոնատները, ֆոսֆատները և սպիտակուցները։ Մանրէաբանական հետազոտություններում բակտերիաներ աճեցնելիս անհրաժեշտ է նաև օգտագործել բուֆերային լուծույթներ։
ՄԱՏԵՆԱԳՐԱԿԱՆ ՑԱՆԿ
1. Կրեշկով Ա.Պ. Անալիտիկ քիմիայի հիմունքներ. Գիրք 1. - Մ: Քիմիա, 1965 թ. -498 էջ.
2. Ցիտովիչ Ի.Կ. Անալիտիկ քիմիայի դասընթաց. Դասագիրք բուհերի համար. - Սանկտ Պետերբուրգ: «Lan», 2007 - 496 p.
3. Կրեշկով Ա.Պ., Յարոսլավցև Ա.Ա. Անալիտիկ քիմիայի դասընթաց. Գիրք 1. Որակական վերլուծություն - 2-րդ խմբ. - Մ.: Քիմիա, 1964 - 432 էջ.
4. Քիմիա. տեղեկատու ավագ դպրոցի աշակերտների և բուհ դիմորդների համար / Ed. Լիդիա Ռ.Ա., Ալիկբերովա Լ.Յու. - Մ.:ՀՍՏ-ՄԱՄՈՒԼԻ ԴՊՐՈՑ, 2007թ. -512ս.
5. Օսիպով Յու.Ս., Ռուսական մեծ հանրագիտարան: 30 հատորով T.4.- M.: Great Russian Encyclopedia 2006 թ. - 751 էջ
6. Միխայլենկո Յա.Ի., Քիմիական վերլուծության ներածություն, Գոսխիմտեխիզդատ, 1933 թ.
Բուֆերային համակարգեր(բուֆերներ) լուծույթներ են, որոնք ունեն ջրածնի իոնների բավականաչափ, կայուն և մշտական կոնցենտրացիան պահպանելու հատկություն ինչպես թթուներ կամ ալկալիներ ավելացնելիս, այնպես էլ նոսրացման ժամանակ:
Բուֆերային համակարգերը (խառնուրդներ կամ լուծույթներ) կազմով երկու հիմնական տեսակի են:
ա) թույլ թթվից և դրա աղից, որը ձևավորվում է ուժեղ հիմքով.
բ) թույլ հիմքից և ուժեղ թթվից առաջացած դրա աղից.
Գործնականում հաճախ օգտագործվում են հետևյալ բուֆերային խառնուրդները. բուֆեր NaH 2 PO 4 + Na 2 HPO 4
Ֆոսֆատային բուֆերային խառնուրդը բաղկացած է երկու աղից, որոնցից մեկը մոնոմետաղային թթու է, իսկ մյուսը՝ ֆոսֆորաթթվի երկմետաղ աղ։
Ացետատի բուֆեր:
Եկեք դիտարկենք բուֆերային մեխանիզմ. Երբ աղաթթուն ավելացվում է ացետատի բուֆերին, փոխազդեցությունը տեղի է ունենում խառնուրդի բաղադրիչներից մեկի հետ (CH3COOH); (ա) հավասարումից ուժեղ թթուն փոխարինվում է թույլ թթվի համարժեք քանակով (այս դեպքում HCl-ը փոխարինվում է CH 3 COOH-ով): Օստվալդի նոսրացման օրենքի համաձայն՝ քացախաթթվի կոնցենտրացիայի աճը նվազեցնում է դրա տարանջատման աստիճանը, և արդյունքում H + իոնների կոնցենտրացիան բուֆերում փոքր-ինչ մեծանում է։ Երբ բուֆերային լուծույթին ավելացվում է ալկալի, ջրածնի իոնների կոնցենտրացիան և pH-ը նույնպես փոքր-ինչ փոխվում է։ Ալկալին փոխազդելու է բուֆերի մեկ այլ բաղադրիչի հետ (CH 3 COOH) չեզոքացման ռեակցիայի միջոցով: Դրա արդյունքում ավելացված ալկալին փոխարինվում է թույլ հիմնական աղի համարժեք քանակով, որն ավելի փոքր չափով ազդում է միջավայրի ռեակցիայի վրա։ Այս աղի տարանջատման ժամանակ առաջացած CH3COO~ անիոնները որոշակի արգելակող ազդեցություն կունենան քացախաթթվի տարանջատման վրա:
Բուֆերային լուծույթները, կախված իրենց բաղադրությունից, բաժանվում են 2 հիմնական տեսակի՝ թթվային և հիմնային։
Թթվային բուֆերի օրինակ է ացետատի բուֆերային լուծույթը, որը պարունակում է քացախաթթվի և նատրիումի ացետատի խառնուրդ (CH3COOH + CH3COONa): Երբ նման լուծույթին ավելացվում է թթու, այն փոխազդում է աղի հետ և տեղահանում թույլ թթվի համարժեք քանակություն՝ CH3COONa + HCl ó CH 3 COOH + NaCl: Լուծման մեջ ուժեղ թթվի փոխարեն ձևավորվում է թույլ, և, հետևաբար, pH-ի արժեքը փոքր-ինչ նվազում է: Եթե այս բուֆերային լուծույթին ավելացնեն ալկալի, այն չեզոքացվում է թույլ թթվով, և լուծույթում առաջանում է համարժեք աղ՝ CH3COOH + NaOH ó CH3COONa + H 2 O: Արդյունքում pH-ը գրեթե չի բարձրանում։ . Բուֆերային լուծույթում pH-ը հաշվարկելու համար, որպես օրինակ օգտագործելով ացետատի բուֆերը, մենք կդիտարկենք դրանում տեղի ունեցող գործընթացները և դրանց ազդեցությունը միմյանց վրա: Նատրիումի ացետատը գրեթե ամբողջությամբ տարանջատվում է իոնների, ացետատի իոնը ենթարկվում է հիդրոլիզի, ինչպես թույլ թթվի իոնը՝ CH3COONa -> Na + + CH 3 COO ~ CH3COO - + NOH ó CH3COON + OH - ։ Քացախաթթուն, որը նույնպես ներառված է բուֆերի մեջ, տարանջատվում է միայն փոքր չափով. CH3COOH ó CH 3 COO + H - CH3COOH-ի թույլ դիսոցիացիան էլ ավելի ճնշվում է CH3COON-ի առկայության դեպքում, հետևաբար չդիսոցացված քացախաթթվի կոնցենտրացիան համարվում է. գրեթե հավասար է իր սկզբնական կոնցենտրացիային՝ [CH3COOH] = c r . Մյուս կողմից, աղի հիդրոլիզը նույնպես ճնշվում է լուծույթում թթվի առկայությամբ։ Հետևաբար, կարելի է ենթադրել, որ բուֆերային խառնուրդում ացետատի իոնների կոնցենտրացիան գործնականում հավասար է աղի սկզբնական կոնցենտրացիայիը՝ առանց հաշվի առնելու թթվի տարանջատման արդյունքում ձևավորված ացետատի իոնների կոնցենտրացիան. [CH3COO] = c c. . Այս հավասարումը կոչվում է բուֆերային լուծման հավասարում (Հենդերսոն Հասելբախի հավասարում ) Թույլ թթվի և դրա աղի կողմից ձևավորված բուֆերային լուծույթի համար նրա վերլուծությունը ցույց է տալիս, որ ջրածնի իոնների կոնցենտրացիան բուֆերային լուծույթում որոշվում է թույլ թթվի դիսոցման հաստատունով և թթվի և աղի կոնցենտրացիաների հարաբերակցությամբ: Հենդերսոն-Հասելբախի հավասարումը հիմնական տիպի բուֆերային համակարգերի համար.
31. Բուֆերային լուծույթների հզորությունը և այն որոշող գործոնները. Արյան բուֆերային համակարգեր. Ջրածնի կարբոնատային բուֆեր: Ֆոսֆատային բուֆեր:
Բուֆերային հզորություն(B) ուժեղ թթվի կամ ուժեղ հիմքի քանակն է, որը պետք է ավելացվի մեկ լիտր բուֆերային լուծույթին, որպեսզի փոխվի դրա pH-ը մեկով: Այն արտահայտվում է մոլ/լ-ով կամ ավելի հաճախ մմոլ/լ-ով և որոշվում է բանաձևով. B = (c V) / d pH Vb, որտեղ B-ն բուֆերային հզորությունն է; c-ն ուժեղ թթվի կամ հիմքի կոնցենտրացիան է (մոլ/լ); V-ը ավելացված ուժեղ էլեկտրոլիտի ծավալն է (l); V b - բուֆերային լուծույթի ծավալը (l); դ pH - pH-ի փոփոխություն:
Հաստատուն pH արժեք պահպանելու լուծույթների կարողությունը անսահմանափակ չէ։ Բուֆերային խառնուրդները կարելի է առանձնացնել բուֆերային լուծույթում ներմուծված թթուների և հիմքերի ազդեցության նկատմամբ իրենց դիմադրության ուժով:
Թթվի կամ ալկալիի քանակությունը, որը պետք է ավելացվի 1 լիտր բուֆերային լուծույթին, որպեսզի դրա pH արժեքը փոխվի մեկով, կոչվում է բուֆերային հզորություն:
Այսպիսով, բուֆերային հզորությունը լուծույթի բուֆերային ազդեցության քանակական միջոց է: Բուֆերային լուծույթն ունի առավելագույն բուֆերային հզորություն թթվի կամ հիմքի pH = pK-ում, որը կազմում է խառնուրդ, որի բաղադրիչների հարաբերակցությունը հավասար է միասնությանը: Որքան բարձր է բուֆերային խառնուրդի սկզբնական կոնցենտրացիան, այնքան բարձր է նրա բուֆերային հզորությունը: Բուֆերային հզորությունը կախված է բուֆերային լուծույթի բաղադրությունից, կոնցենտրացիայից և բաղադրիչների հարաբերակցությունից:
Դուք պետք է կարողանաք ընտրել ճիշտ բուֆերային համակարգը: Ընտրությունը որոշվում է պահանջվող pH միջակայքով: Բուֆերային գործողության գոտին որոշվում է թթվի (բազայի) ±1 միավոր ուժով:
Բուֆերային խառնուրդ ընտրելիս անհրաժեշտ է հաշվի առնել դրա բաղադրիչների քիմիական բնույթը, քանի որ լուծույթի այն նյութերը, որոնց ավելացվում են.
բուֆերային համակարգ, կարող է առաջացնել չլուծվող միացություններ և փոխազդել բուֆերային համակարգի բաղադրիչների հետ։
- հետ շփման մեջ 0
- Google+ 0
- լավ 0
- Ֆեյսբուք 0