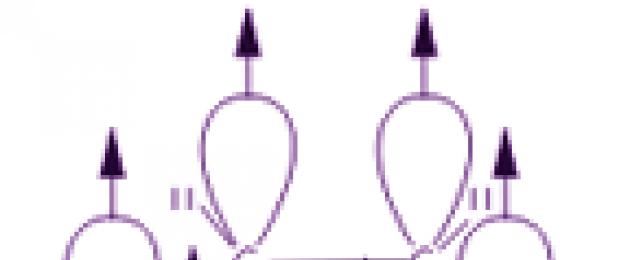
«Բենզոլային օղակ» հասկացությունն անմիջապես պահանջում է վերծանում: Դա անելու համար անհրաժեշտ է գոնե հակիրճ դիտարկել բենզոլի մոլեկուլի կառուցվածքը։ Բենզոլի առաջին կառուցվածքը առաջարկվել է 1865 թվականին գերմանացի գիտնական Ա. Կեկուլեի կողմից.
Ամենակարևոր անուշաբույր ածխաջրածիններից են բենզոլը C 6 H 6 և նրա հոմոլոգները՝ տոլուոլ C 6 H 5 CH 3, քսիլեն C 6 H 4 (CH 3) 2 և այլն; նաֆթալին C 10 H 8, անտրացին C 14 H 10 և դրանց ածանցյալները:
Բենզոլի մոլեկուլում ածխածնի ատոմները կազմում են կանոնավոր հարթ վեցանկյուն, թեև այն սովորաբար գծվում է որպես երկարավուն:
Բենզոլի մոլեկուլի կառուցվածքը վերջնականապես հաստատվել է ացետիլենից դրա առաջացման ռեակցիայով։ Կառուցվածքային բանաձևը պատկերում է երեք միայնակ և երեք կրկնակի փոփոխվող ածխածին-ածխածին կապեր: Բայց նման պատկերը չի փոխանցում մոլեկուլի իրական կառուցվածքը։ Իրականում բենզոլում ածխածին-ածխածին կապերը համարժեք են, և դրանք ունեն այնպիսի հատկություններ, որոնք նման չեն միայնակ կամ կրկնակի կապերի: Այս հատկանիշները բացատրվում են բենզոլի մոլեկուլի էլեկտրոնային կառուցվածքով։
Բենզոլի էլեկտրոնային կառուցվածքը
Բենզոլի մոլեկուլում ածխածնի յուրաքանչյուր ատոմ գտնվում է sp 2 հիբրիդացման վիճակում։ Այն միացված է երկու հարեւան ածխածնի ատոմների և ջրածնի ատոմի երեք σ կապերով։ Ստացվում է հարթ վեցանկյուն. բոլոր վեց ածխածնի ատոմները և բոլոր σ կապերը C-C և C-H գտնվում են նույն հարթության մեջ: Չորրորդ էլեկտրոնի (p-էլեկտրոն) էլեկտրոնային ամպը, որը չի մասնակցում հիբրիդացմանը, ունի համրի ձև և ուղղահայաց է բենզոլային օղակի հարթությանը։ Հարևան ածխածնի ատոմների նման p-էլեկտրոնային ամպերը համընկնում են օղակի հարթությունից վերևում և ներքևում:

Արդյունքում վեց p-էլեկտրոններ կազմում են ընդհանուր էլեկտրոնային ամպ և մեկ քիմիական կապ ածխածնի բոլոր ատոմների համար։ Էլեկտրոնային մեծ հարթության երկու շրջաններ գտնվում են σ կապի հարթության երկու կողմերում։

p-էլեկտրոնային ամպը հանգեցնում է ածխածնի ատոմների միջև հեռավորության կրճատմանը: Բենզոլի մոլեկուլում դրանք նույնն են և հավասար են 0,14 նմ: Միակ և կրկնակի կապի դեպքում այդ հեռավորությունները կկազմեն համապատասխանաբար 0,154 և 0,134 նմ: Սա նշանակում է, որ բենզոլի մոլեկուլում չկան միայնակ կամ կրկնակի կապեր։ Բենզոլի մոլեկուլը նույն հարթության մեջ ընկած միանման CH խմբերի կայուն վեցանդամ ցիկլ է։ Բենզոլում ածխածնի ատոմների միջև բոլոր կապերը համարժեք են, ինչը որոշում է բենզոլի օղակի բնորոշ հատկությունները: Սա առավել ճշգրիտ կերպով արտացոլվում է բենզոլի կառուցվածքային բանաձևով կանոնավոր վեցանկյունի տեսքով, որի ներսում շրջանագիծ է (I): (Շրջանակը խորհրդանշում է ածխածնի ատոմների միջև կապերի համարժեքությունը:) Այնուամենայնիվ, Կեկուլեի բանաձևը, որը ցույց է տալիս կրկնակի կապերը (II) նույնպես հաճախ օգտագործվում է.

Բենզոլի օղակն ունի որոշակի հատկություններ, որոնք սովորաբար կոչվում են բուրավետություն:
Հոմոլոգ շարք, իզոմերիզմ, նոմենկլատուրա
Պայմանականորեն ասպարեզները կարելի է բաժանել երկու շարքի. Առաջինը ներառում է բենզոլի ածանցյալներ (օրինակ, տոլուոլ կամ բիֆենիլ), երկրորդը ներառում է խտացված (պոլիմիջուկային) արեններ (դրանցից ամենապարզը նաֆթալինն է).

Բենզոլի հոմոլոգ շարքն ունի C n H 2 n -6 ընդհանուր բանաձև: Հոմոլոգները կարելի է համարել որպես բենզոլի ածանցյալներ, որոնցում ջրածնի մեկ կամ մի քանի ատոմները փոխարինվում են տարբեր ածխաջրածնային ռադիկալներով։ Օրինակ, C 6 H 5 -CH 3 - մեթիլբենզոլ կամ տոլուոլ, C 6 H 4 (CH 3) 2 - դիմեթիլբենզոլ կամ քսիլեն, C 6 H 5 -C 2 H 5 - էթիլբենզոլ և այլն:

Քանի որ բենզոլում ածխածնի բոլոր ատոմները համարժեք են, դրա առաջին հոմոլոգը՝ տոլուոլը, չունի իզոմերներ։ Երկրորդ հոմոլոգը՝ դիմեթիլբենզոլը, ունի երեք իզոմեր, որոնք տարբերվում են մեթիլ խմբերի (փոխարինիչներ) հարաբերական դասավորությամբ։ Սա օրթո- (կրճատ՝ o-) կամ 1,2-իզոմեր է, որում փոխարինողները գտնվում են հարևան ածխածնի ատոմների վրա: Եթե փոխարինիչները բաժանված են մեկ ածխածնի ատոմով, ապա դա մետա- (կրճատ m-) կամ 1,3-իզոմեր է, իսկ եթե դրանք բաժանված են ածխածնի երկու ատոմներով, ապա դա պարա- (կրճատ՝ p-) կամ 1,4-իզոմեր. Անուններում փոխարինողները նշանակվում են տառերով (o-, m-, p-) կամ թվերով:

Ֆիզիկական հատկություններ
Բենզոլի հոմոլոգ շարքի առաջին անդամները հատուկ հոտով անգույն հեղուկներ են։ Նրանց խտությունը 1-ից պակաս է (ջրից թեթև)։ Ջրի մեջ չլուծվող։ Բենզոլը և նրա հոմոլոգներն իրենք լավ լուծիչներ են շատ օրգանական նյութերի համար: Արենաներն այրվում են ծխագույն բոցով` իրենց մոլեկուլներում ածխածնի բարձր պարունակության պատճառով:
Քիմիական հատկություններ
Արոմատիկությունը որոշում է բենզոլի և նրա հոմոլոգների քիմիական հատկությունները: Վեց էլեկտրոնային π համակարգն ավելի կայուն է, քան սովորական երկէլեկտրոնային π կապերը։ Հետևաբար, հավելման ռեակցիաները ավելի քիչ տարածված են արոմատիկ ածխաջրածինների համար, քան չհագեցած ածխաջրածինների համար: Արենների համար առավել բնորոշ ռեակցիաները փոխարինման ռեակցիաներն են։ Այսպիսով, արոմատիկ ածխաջրածիններն իրենց քիմիական հատկություններով միջանկյալ դիրք են զբաղեցնում հագեցած և չհագեցած ածխաջրածինների միջև։
I. Փոխարինման ռեակցիաներ
1. Հալոգենացում (Cl 2, Br 2-ով)

2. Նիտրացիա

3. Սուլֆոնացիա

4. Ալկիլացում (առաջանում են բենզոլային հոմոլոգներ) - Ֆրիդել-Կրաֆթսի ռեակցիաներ.

Բենզոլի ալկիլացումը տեղի է ունենում նաև, երբ այն փոխազդում է ալկենների հետ.

Ստիրոլը (վինիլբենզոլ) ստացվում է էթիլբենզոլի ջրազրկումից.

II. Ավելացման ռեակցիաներ
1. Հիդրոգենացում

2. Քլորացում

III. Օքսիդացման ռեակցիաներ
1. Այրում
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Օքսիդացում KMnO 4, K 2 Cr 2 O 7, HNO 3 և այլն ազդեցությամբ:
Քիմիական ռեակցիա չի լինում (ալկանների նման):
Բենզոլի հոմոլոգների հատկությունները
Բենզոլի հոմոլոգներում առանձնանում են միջուկ և կողային շղթա (ալկիլային ռադիկալներ)։ Ալկիլային ռադիկալների քիմիական հատկությունները նման են ալկաններին. Բենզոլի օղակի ազդեցությունը դրանց վրա դրսևորվում է նրանով, որ փոխարինման ռեակցիաները միշտ ներառում են ջրածնի ատոմներ բենզոլի օղակին ուղղակիորեն կապված ածխածնի ատոմում, ինչպես նաև C-H կապերի ավելի հեշտ օքսիդացումով:

Էլեկտրոն նվիրաբերող ալկիլ ռադիկալի (օրինակ՝ -CH 3) ազդեցությունը բենզոլային օղակի վրա դրսևորվում է օրթո և պարա դիրքերում ածխածնի ատոմների արդյունավետ բացասական լիցքերի ավելացմամբ. արդյունքում հեշտանում է հարակից ջրածնի ատոմների փոխարինումը։ Հետևաբար, բենզոլի հոմոլոգները կարող են ձևավորել եռփոխարինված արտադրանքներ (իսկ բենզոլը սովորաբար կազմում է մոնոփոխարինված ածանցյալներ)։
ԹԵՄԱ 20. Բենզոլային շարքի արոմատիկ ածխաջրածիններ.
Հոմոլոգ շարք. Ընդհանուր բանաձև. Անվանակարգ. Իզոմերիզմ.
Բնական աղբյուրներ և արտադրության եղանակներ՝ ալիֆատիկ, ալիցիկլիկ և արոմատիկ միացություններից։ Wurtz-Fittig և Friedel-Crafts ռեակցիաները.
Բենզոլի և նրա հոմոլոգների ֆիզիկական հատկությունները.
Քիմիական հատկություններ. Էլեկտրաֆիլային փոխարինման ռեակցիաներ՝ հալոգենացում, նիտրացում, սուլֆոնացում, ալկիլացում և ացիլացում։ Ջրածնի, հալոգենների, օզոնի ավելացման ռեակցիաներ. Բենզոլի օքսիդացում. Բենզոլի հոմոլոգների ռեակցիաները, որոնք ներառում են կողային շղթան՝ հալոգենացում, նիտրացում, օքսիդացում, ջրազրկում:
Հոմոլոգ շարք. Ընդհանուր բանաձև.
Միացիկլիկ արոմատիկ ածխաջրածինների (արենների) առաջին և ամենակարևոր ներկայացուցիչն է բենզոլ C 6 H 6 .
Այստեղից էլ բուրավետ ածխաջրածինների հոմոլոգ շարքի ընդհանուր անվանումը. բենզոլային շարք.
Ընդհանուր բանաձևբենզոլի հոմոլոգ շարք. S p N 2p-6.
Արենայի նոմենկլատուրա.
Չնչին անունները հաճախ օգտագործվում են ասպարեզներ անվանելու համար. բենզոլ, տոլուոլ, ստիրոլ, կումեն և այլն:
Համաձայն միջազգային փոխարինման նոմենկլատուրայիարենները համարվում են բենզոլի ածանցյալներ, որոնցում փոխարինողների դիրքը նշվում է թվերով, մինչդեռ ածխածնի ատոմների թիվը, որոնց վրա տեղակայված են փոխարինողները, պետք է լինեն ամենափոքրը.
մեթիլբենզոլ էթիլբենզոլ իզոպրոպիլբենզոլ
(տոլուոլ) (կումեն)

վինիլբենզոլ էթինիլբենզոլ
(ստիրոլ) (ֆենիլացետիլեն)
Երկու նույնական փոխարինողների դեպքում թվերի փոխարեն կարող եք օգտագործել նախածանցներ՝ 1,2- (օրթո-), 1,3- (մետա-), 1,4- (պարա-):

1,2-դիմեթիլբենզոլ 1,3-դիմեթիլբենզոլ 1,4-դիմեթիլբենզոլ
(օրթո-քսիլեն) (մետա-քսիլեն) (պարա-քսիլեն)
Բենզենը՝ որպես արենների ներկայացուցիչ։ Բենզոլի մոլեկուլի կառուցվածքը. Pi-bond խոնարհում. Արենների իզոմերիզմ և նոմենկլատուրա. Բենզոլի հոմոլոգներ. Արենների պատրաստում, նրանց ֆիզիկական հատկությունները
A RENES (արոմատիկ ածխաջրածիններ)
- Արենները կամ արոմատիկ ածխաջրածինները միացություններ են, որոնց մոլեկուլները պարունակում են ատոմների կայուն ցիկլային խմբեր (բենզոլի միջուկներ)՝ խոնարհված կապերի փակ համակարգով։
Ամենապարզ ներկայացուցիչները (մեկ հիմնական ասպարեզներ).
Բազմամիջուկ ասպարեզներ՝ նաֆթալին C 10 H 8, անտրացին C 14 N 10և այլն։«Անուշաբույր միացություններ» տերմինը առաջացել է շատ վաղուց՝ պայմանավորված այն հանգամանքով, որ այս շարքի նյութերի որոշ ներկայացուցիչներ ունեն հաճելի հոտ։ Սակայն մեր օրերում «արոմատիկություն» հասկացությունը բոլորովին այլ իմաստ ունի։Մոլեկուլի անուշաբույրությունը նշանակում է նրա կայունության բարձրացում՝ ցիկլային համակարգում π-էլեկտրոնների տեղակայման պատճառով։Արենի անուշաբույրության չափանիշներ.
- Ածխածնի ատոմները sp 2 հիբրիդացված վիճակում կազմում են ցիկլային համակարգ։
- Ածխածնի ատոմները գտնվում են նույն հարթության վրա (ցիկլը հարթ կառուցվածք ունի)։
- Կոնյուգացիոն կապերի փակ համակարգը պարունակում է
- 4n+2π էլեկտրոններ ( n- ամբողջ թիվ):
Բենզոլի մոլեկուլը լիովին համապատասխանում է այս չափանիշներին։ C 6 H 6.
1. Բենզոլի կառուցվածքը
Բենզոլ C 6 H 6- անուշաբույր ածխաջրածինների նախահայրը:
Իր մոլեկուլի վեց ածխածնի ատոմներից յուրաքանչյուրը գտնվում է sp 2 հիբրիդացման վիճակում և միացված է երկու հարեւան ածխածնի ատոմներին և ջրածնի ատոմին երեք σ կապերով։ Յուրաքանչյուր զույգ π կապերի միջև կապի անկյունները 120° են։ Այսպիսով, σ կապերի կմախքը կանոնավոր վեցանկյուն է, որում ածխածնի բոլոր ատոմները և բոլոր σ կապերը C–C և C–H գտնվում են նույն հարթության մեջ.
Ածխածնի բոլոր ատոմների p-էլեկտրոնները փոխազդում են միմյանց հետ բենզոլային օղակի σ-կմախքի հարթությանը ուղղահայաց տեղակայված հարեւան 2p-AO-ների կողային համընկնմամբ։ Նրանք կազմում են մեկ ցիկլային π-էլեկտրոնային ամպ, որը կենտրոնացած է օղակի հարթությունից վեր և ներքև։
Բենզոլում C–C բոլոր կապերը համարժեք են, դրանց երկարությունը 0,140 նմ է, որը համապատասխանում է մեկ կապի երկարության (0,154 նմ) և կրկնակի կապի (0,134 նմ) երկարության միջանկյալ արժեքին։ Սա նշանակում է, որ բենզոլի մոլեկուլում չկան ածխածնի ատոմների միջև զուտ պարզ և կրկնակի կապեր (ինչպես գերմանացի քիմիկոս Ֆ. Կեկուլեի կողմից 1865 թվականին առաջարկված բանաձևում), և դրանք բոլորը հավասարեցված են (դելոկալիզացված, տես անիմացիա)։ Հետևաբար, բենզոլի կառուցվածքային բանաձևը պատկերված է որպես կանոնավոր վեցանկյուն (σ-կմախք) և նրա ներսում շրջան՝ ցույց տալով տեղայնացված π-կապերը.
Հաճախ օգտագործվում է նաեւ Կեկուլեի բանաձեւը, սակայն հաշվի է առնվում, որ այն միայն պայմանականորեն է փոխանցում մոլեկուլի կառուցվածքը։
2. Բենզոլի հոմոլոգներ. Անվանակարգ և իզոմերիզմ
Բենզոլի հոմոլոգները միացություններ են, որոնք ձևավորվում են բենզոլի մոլեկուլում ջրածնի մեկ կամ մի քանի ատոմները ածխաջրածնային ռադիկալներով (R) փոխարինելով.
Բենզոլի հոմոլոգ շարքի ընդհանուր բանաձևըCnH2n-6(n ≥ 6):
Անվանակարգ. Լայնորեն կիրառվում են չնչին անունները (տոլուոլ, քսիլեն, կումեն և այլն)։ Համակարգային անվանումները կառուցված են ածխաջրածնային ռադիկալի (նախածանցի) անունից և բառից բենզոլ(արմատ):
C 6 H 5 -CH 3 C 6 H 5 -C 2 H 5 C 6 H 5 - C 3 H 7
Մեթիլբենզոլ (տոլուոլ) էթիլբենզոլ պրոպիլբենզոլ
Եթե կան երկու կամ ավելի ռադիկալներ, ապա նրանց դիրքը նշվում է օղակի ածխածնի ատոմների թվով, որին դրանք կապված են: Օղակի համարակալումն իրականացվում է այնպես, որ ռադիկալների թիվը լինի ամենափոքրը։ Օրինակ:
Փոխարինված բենզոլների համար R-C 6 H 4 -RԿիրառվում է նաև անունների կառուցման մեկ այլ մեթոդ, որում նախածանցներով միացության աննշան անվանումից առաջ նշվում է փոխարինողների դիրքը.
օրթո- (Օ-) փոխարինիչներ օղակի հարևան ածխածնի ատոմների վրա, այսինքն. 1,2-;
մետա- (մ-) փոխարինիչներ մեկ ածխածնի ատոմի միջոցով (1,3-);
զույգ- (Պ-) փոխարինիչներ օղակի հակառակ կողմերում (1,4-):
Արոմատիկ միավալենտ ռադիկալներն ունեն ընդհանուր անվանումը « արիլԴրանցից երկուսն առավել տարածված են օրգանական միացությունների անվանացանկում. C6H5- (ֆենիլ) Եվ C6H5CH2- (բենզիլ).
Իզոմերիզմ(կառուցվածքային):
1) պատգամավորների պաշտոններըՀամար դի-, երեք- Եվ տետրա- փոխարինված բենզոլներ (օրինակ. Օ-, մ- Եվ Պ-քսիլեններ);
2) ածխածնային կմախք կողային շղթայումպարունակում է առնվազն 3 ածխածնի ատոմ.
3) փոխարինողների իզոմերիզմ R, սկսած R - C 2 H 5-ով:
Օրինակ, մոլեկուլային բանաձեւը C 8 H 10Համապատասխանում է 4 իզոմեր.
երեք քսիլեն CH 3 -C 6 H 4 -CH 3 (o-, m-, p-) և էթիլբենզոլ C6H5 -C2H5.
Ալկիլբենզոլներում բենզոլային օղակի համեմատ տարածական իզոմերիզմ չկա։
Արոմատիկ ածխաջրածինների պատրաստում
Արոմատիկ ածխաջրածինների հիմնական բնական աղբյուրներն են ածուխ և նավթ:
Արենների արտադրության ռեակցիաները ցույց են տալիս ածխաջրածինների տարբեր խմբերի կապը և դրանց փոխակերպման հնարավորությունը։
Արեններ կամ անուշաբույր(բենզենոիդ) ածխաջրածինները միացություններ են, որոնց մոլեկուլները պարունակում են ատոմների կայուն ցիկլային խմբեր (բենզոլային օղակներ)՝ խոնարհված կապերի փակ համակարգով։
Արենների անուշաբույր բնույթը բացատրվում է բենզոլային օղակի էլեկտրոնային կառուցվածքով։
Արոմատիկության չափանիշներ. Ցիկլային զուգակցված համակարգերի ուսումնասիրության հիման վրա պարզվել է, որ միացությունը անուշաբույր է, եթե այն ենթարկվում է. Հյուկելի կանոնըՋերմոդինամիկական կայունության (արոմատիկության) բարձրացում ունեն միայն միացիկլիկ խոնարհված համակարգերը (պոլիեններ), որոնք ունեն հարթ կառուցվածք և պարունակում են 4n + 2 -էլեկտրոններ փակ խոնարհման շղթայում (որտեղ n-ն ամբողջ թիվ է՝ 0, 1, 2, 3, և այլն): 4n -էլեկտրոններ պարունակող օղակները հակաարոմատիկ են (ապակայունացված)։
Բուրավետության պայմաններԼիովին համապատասխանում է C 6 H 6 բենզոլի մոլեկուլը, որի զուգակցման համակարգում ներգրավված են 6 -էլեկտրոններ՝ անուշաբույր սեքստետ (ըստ 4n + 2 բանաձևի՝ n = 1-ով)։ Անուշաբույր օղակները շատ ավելի կայուն են, քան նույն թվով π-էլեկտրոններով իրենց խոնարհված ացիկլիկ անալոգները, այսինքն. բենզոլն ավելի կայուն է, քան CH 2 =CH–CH=CH–CH=CH2 (հեքսատրիեն-1,3,5):
Անվանակարգ. Լայնորեն կիրառվում են չնչին անունները (տոլուոլ, քսիլեն, կումեն և այլն)։ Բենզոլի հոմոլոգների համակարգային անվանումները կառուցված են ածխաջրածնային ռադիկալի (նախածանց) և բենզոլ (արմատ) բառից՝ C 6 H 5 - CH 3 - մեթիլբենզոլ (տոլուոլ), C 6 H 5 - C 2 H 5 - էթիլբենզոլ, C 6 H 5 - CH (CH 3) 2 - իզոպրոպիլբենզոլ (կումեն): Եթե կան երկու կամ ավելի ռադիկալներ, նրանց դիրքը նշվում է օղակի ածխածնի ատոմների թվով, որին դրանք կապված են: Օղակի համարակալումն իրականացվում է այնպես, որ ռադիկալների թիվը լինի ամենափոքրը։
Չփոխարինված բենզոլների համար RC 6 H 4 R օգտագործվում է նաև անվանումների կառուցման մեկ այլ մեթոդ, որում փոխարինողների դիրքը նշվում է միացության աննշան անունից առաջ՝ նախածանցներով՝ օրտո-(o-) փոխարինիչներ հարևան ածխածնի վրա: օղակի ատոմները, այսինքն. դիրքում 1,2-; մետա- (m-) փոխարինիչներ մեկ ածխածնի ատոմի միջոցով (1,3-); para- (p-) փոխարինիչներ հակառակ կողմերում (1,4-).
Իզոմերիզմ. Բենզոլի հոմոլոգների շարքում ի հայտ է գալիս կառուցվածքային իզոմերիզմը. 2) ածխածնի կմախք կողային շղթայում, որը պարունակում է առնվազն 3 ածխածնի ատոմ (C 6 H 5 -CH 2 CH 2 CH 3 - n-պրոպիլբենզոլ և C 6 H 5 -CH (CH 3) 2 - իզոպրոպիլբենզոլ կամ կումեն). 3) R փոխարինիչների իզոմերիզմը՝ սկսած R = C 2 H 5-ով (օրինակ՝ C 8 H 10 մոլեկուլային բանաձեւը համապատասխանում է 4 իզոմերի՝ o-, m-, p-xylenes CH 3 -C 6 H 4 -CH 3. և էթիլբենզոլ C 6 H 5 C 2 H 5); 4) միջդասակարգային իզոմերիզմ չհագեցած միացությունների հետ (օրինակ՝ C 6 H 6 բանաձևը, բացառությամբ բենզոլի.
ունեն CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2 և այլն միացություններ, ինչպես նաև չհագեցած ցիկլեր)։ Փոխարինված արեններում բենզոլային օղակի համեմատ տարածական իզոմերիզմ չկա:
Հյուկելի կանոն.
Մոլեկուլները, որոնք ենթարկվում են Հյուկելի կանոնին, արոմատիկ են. հարթ միացիկլիկ խոնարհված համակարգը, որը պարունակում է (4n + 2) π-էլեկտրոններ (որտեղ n = 0,1,2...) անուշաբույր է:
Էլեկտրաֆիլային փոխարինման մեխանիզմ:
1Փուլ 1. p-համալիրի ձևավորում:Այս դեպքում բենզոլային օղակի p-էլեկտրոնային ամպի և էլեկտրոնային խտության պակասով էլեկտրոֆիլ ռեագենտի միջև ձևավորվում է թույլ կապ՝ պահպանելով արոմատիկ սեքստետը։ Էլեկտրաֆիլային ռեագենտը սովորաբար գտնվում է օղակի հարթությանը ուղղահայաց իր համաչափության առանցքի երկայնքով: Այս փուլը տեղի է ունենում արագ և չի ազդում ռեակցիայի արագության վրա: Ուլտրամանուշակագույն սպեկտրոսկոպիայի միջոցով ապացուցված է p-համալիրի առկայությունը...
2-րդ փուլ՝ բ-կոմպլեքսի ձևավորում. Այս փուլը դանդաղ է և գործնականում անշրջելի: Բենզոլի օղակի էլեկտրոֆիլի և ածխածնի ատոմի միջև ձևավորվում է կովալենտային b-կապ, իսկ ածխածնի ատոմը spI-ից անցնում է spI-վալենտ վիճակի` անուշաբույր սեքստետի խախտմամբ և ցիկլոհեքսադիենիլ կատիոնի (բենզենիումի իոն) ձևավորմամբ: Բենզոլի կատիոնը հակաիոնի հետ միասին կազմում է իոնային միացություն, որը լավ փոխանցում է էլեկտրական հոսանքը։ Բենզոլի իոնում ածխածնի բոլոր ատոմները գտնվում են նույն հարթության մեջ, և ysp-հիբրիդացված ածխածնի ատոմի փոխարինիչները ուղղահայաց են դրան։
3-րդ և 4-րդ փուլեր՝ երկրորդ պ-կոմպլեքսի ձևավորում և արոմատիզացիա։ b-կոմպլեքսը կարող է փոխակերպվել նոր, փոքր-ինչ կայուն p-համալիրի, որը ապապրոտոնացված է բազայի, սովորաբար հակաիոնի ազդեցության տակ։
Արոմատիկ ածխաջրածիններ (արեններ)- ածխաջրածիններ, որոնց մոլեկուլները պարունակում են մեկ կամ մի քանի բենզոլային օղակներ. Մեկ բենզոլային օղակով արենների բաղադրությունը համապատասխանում է C ընդհանուր բանաձևին nՀ 2n-6 .
Ամենապարզ արենի՝ բենզոլի (C 6 H 6) մոլեկուլում կապերը կազմում են կապերի մեկ տեղաբաշխված կոնյուգացված (արոմատիկ) համակարգ։
Ամենապարզ արենի՝ բենզոլի մոլեկուլի կառուցվածքը կարող է արտահայտվել տարբեր տեսակի կառուցվածքային բանաձևերով.
Իզոմերներ և հոմոլոգներ
| Գ | բենզոլ |
|||||
մեթիլբենզոլ (տոլուոլ) |
||||||
էթիլբենզոլ |
1,2-դիմեթիլբենզոլ ( օրթո-քսիլեն) |
1,3-դիմեթիլբենզոլ ( մետա-քսիլեն) |
1,4-դիմեթիլբենզոլ ( զույգ-քսիլեն) |
|||
պրոպիլբենզոլ |
իզոպրոպիլբենզոլ |
1,2,4-տրի-մեթիլբենզոլ |
1-մեթիլ-2-էթիլբենզոլ |
1-մեթիլ-3-էթիլբենզոլ |
1-մեթիլ-4-էթիլբենզոլ |
|
| իզոմերներ | ||||||
Փոխարինված բենզոլի ածանցյալի անվանումը հիմնված է «բենզոլ» բառի վրա։ Բենզոլի օղակի ատոմները համարակալված են ամենաբարձրից մինչև ամենացածր փոխարինող: Օրինակ՝ 1-մեթիլ-2-էթիլբենզոլ, ոչ թե 1-էթիլ-2-մեթիլբենզոլ: Եթե փոխարինողները նույնն են, ապա համարակալումն իրականացվում է ամենակարճ ճանապարհով: Օրինակ՝ 1,3-դիմեթիլբենզոլ, ոչ թե 1,5-դիմեթիլբենզոլ:
Կոնսուլներ օրթո-, մետա-, զույգ-(հունարեն orthos - ուղիղ, մետա - հետո, միջոցով, միջև, պարա - դեմ, մոտ, անցյալ) օրգանական նյութերի անուններով (կրճատ. Օ-, մ-, Պ-) օգտագործվում են բենզոլային օղակի վրա երկու փոխարինողների հարաբերական դիրքերը նշելու համար։
Բենզոլի ֆիզիկական հատկությունները. անգույն, ջրում չլուծվող հեղուկ յուրահատուկ հոտով, հալման ջերմաստիճանը 5,4 o C, եռման ջերմաստիճանը 80,1 o C, խտությունը 0,88 գ/սմ 3: Բենզոլի գոլորշիները թունավոր են։
Քիմիական հատկություններ
Բենզոլը նորմալ պայմաններում չի գունաթափում բրոմային ջուրը և կալիումի պերմանգանատի լուծույթը:
Արենաներ ստանալը
Խնդիրներ և թեստեր «Թեմա 3. «Անուշոտ ածխաջրածիններ» թեմայով։
- Ածխաջրածիններ. Պոլիմերներ - Օրգանական նյութեր 8–9 աստիճան
Դասեր՝ 7 առաջադրանք՝ 9 թեստ՝ 1
- - Մարդը նյութերի, նյութերի և քիմիական ռեակցիաների աշխարհում, 8–9 դասարաններ
Դասեր՝ 2 առաջադրանք՝ 6 թեստ՝ 1
- Նյութերի դասակարգում - Անօրգանական նյութերի դասեր 8–9 աստիճան
Դասեր՝ 2 առաջադրանք՝ 9 թեստ՝ 1
- Բյուրեղյա վանդակաճաղեր - նյութի կառուցվածքը 8–9 դասարան
Դասեր՝ 1 առաջադրանք՝ 9 թեստ՝ 1
- Լուծումների կազմը - Լուծումներ 8–9 դասարան
Դասեր՝ 3 առաջադրանք՝ 8 թեստ՝ 1
Ուսումնասիրելով թեման՝ դուք պետք է հասկանաք արոմատիկ ածխաջրածինների, անուշաբույր կապերի հասկացությունները, իմանաք արենների ընդհանուր բանաձևը, անվանացանկի կանոնները, փոխարինման ռեակցիաների տեսակները (հալոգենացում կատալիզատորի առկայությամբ, նիտրացիա), ավելացում (հալոգենացում լույսի ներքո): , հիդրոգենացում):
Ստուգեք՝ կարո՞ղ եք հաշվարկներ կատարել՝ օգտագործելով ռեակցիայի հավասարումները և դուրս բերել նյութերի մոլեկուլային բանաձևեր՝ հիմնված տարրերի զանգվածային բաժնետոմսերի վրա, գտնել ռեակցիայի արտադրանքի ելքը և լուծել խնդիրներ՝ հաշվի առնելով կեղտերի զանգվածային բաժինը:
Օրինակ 1.Ածխաջրածինը, որի գոլորշիների խտությունը ջրածնի համար 15 է, պարունակում է 80% ածխածին։ Գտեք դրա մոլեկուլային բանաձևը.
Պատասխան. C2H6
Օրինակ 2. 7,8 գ բենզոլից ստացվել է 8,61 գ նիտրոբենզոլ։ Որոշեք ռեակցիայի արտադրանքի եկամտաբերությունը:
Պատասխան. 70%
Օրինակ 3. 20 գ կշռող տեխնիկական կալցիումի կարբիդը մշակվել է ավելորդ ջրով: Ինչ ծավալի ացետիլեն է ստացվել, եթե տեխնիկական կարբիդում կեղտերի զանգվածային բաժինը 20% է:
Պատասխան. 5,6 լ
Համոզվելով, որ այն ամենը, ինչ ձեզ անհրաժեշտ է, յուրացված է, անցեք թեմայի առաջադրանքների կատարմանը: Մաղթում ենք հաջողություն։
Առաջարկվող ընթերցում.
- Օ.Ս.Գաբրիելյան և ուրիշներ Քիմիա 10-րդ դասարան. Մ., Բուստարդ, 2002;
- Լ. Ս. Գուզեյ, Ռ. Պ. Սուրովցևա, Գ. Գ. Լիսովա: Քիմիա 11-րդ դասարան. Բաստարդ, 1999 թ.
- Գ.Գ.Լիսովա. Հիմնական նշումներ և թեստեր օրգանական քիմիայում: Մ., «Գլիկ Պլյուս» ՍՊԸ, 1999 թ.
- հետ շփման մեջ 0
- Google+ 0
- լավ 0
- Ֆեյսբուք 0