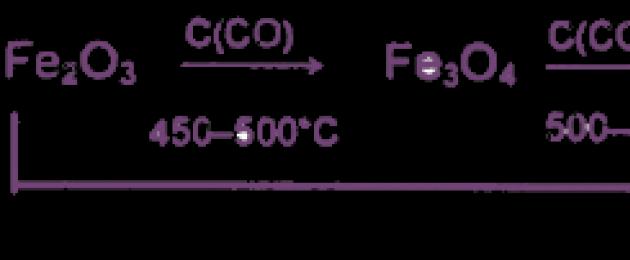Il corpo umano contiene circa 5 g di ferro, la maggior parte (70%) fa parte dell'emoglobina nel sangue.
Proprietà fisiche
Allo stato libero, il ferro è un metallo bianco-argenteo con una sfumatura grigiastra. Il ferro puro è duttile e ha proprietà ferromagnetiche. In pratica, le leghe di ferro sono comunemente usate: ghise e acciai.
Fe è l'elemento più importante e più comune dei nove d-metalli del sottogruppo secondario del gruppo VIII. Insieme al cobalto e al nichel forma la "famiglia del ferro".
Quando si formano composti con altri elementi, spesso utilizza 2 o 3 elettroni (B \u003d II, III).
Il ferro, come quasi tutti gli elementi d del gruppo VIII, non mostra una valenza superiore pari al numero del gruppo. La sua valenza massima raggiunge VI ed è estremamente rara.
I composti più tipici sono quelli in cui gli atomi di Fe si trovano negli stati di ossidazione +2 e +3.
Metodi per ottenere il ferro
1. Il ferro commerciale (in una lega con carbonio e altre impurità) si ottiene per riduzione carbotermica dei suoi composti naturali secondo lo schema:

Il recupero avviene gradualmente, in 3 fasi:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe3O4 + CO = 3FeO + CO2
3) FeO + CO \u003d Fe + CO 2
La ghisa risultante da questo processo contiene più del 2% di carbonio. In futuro, gli acciai saranno ottenuti da ghisa - leghe di ferro contenenti meno dell'1,5% di carbonio.
2. Il ferro purissimo si ottiene in uno dei seguenti modi:
a) decomposizione del pentacarbonil Fe
Fe(CO)5 = Fe + 5CO
b) riduzione dell'idrogeno di FeO puro
FeO + H 2 \u003d Fe + H 2 O
c) elettrolisi di soluzioni acquose di sali Fe+2
FeC 2 O 4 \u003d Fe + 2СO 2
ossalato di ferro (II).
Proprietà chimiche
Fe - un metallo di media attività, presenta proprietà generali caratteristiche dei metalli.
Una caratteristica unica è la capacità di "arrugginire" nell'aria umida:
In assenza di umidità con aria secca, il ferro inizia a reagire sensibilmente solo a T > 150°C; quando calcinato, si forma la "scaglia di ferro" Fe 3 O 4:
3Fe + 2O2 = Fe3O4
Il ferro non si dissolve in acqua in assenza di ossigeno. A temperature molto elevate, Fe reagisce con il vapore acqueo, spostando l'idrogeno dalle molecole d'acqua:
3 Fe + 4H 2 O (g) \u003d 4H 2
Il processo di ruggine nel suo meccanismo è la corrosione elettrochimica. Il prodotto ruggine è presentato in forma semplificata. Si forma infatti uno strato lasco di una miscela di ossidi e idrossidi di composizione variabile. A differenza del film Al 2 O 3, questo strato non protegge il ferro da ulteriori distruzioni.
Tipi di corrosione

Protezione dalla corrosione del ferro

1. Interazione con alogeni e zolfo ad alta temperatura.
2Fe + 3Cl2 = 2FeCl3
2Fe + 3F2 = 2FeF3
Fe + I 2 \u003d FeI 2
Si formano composti in cui predomina il tipo di legame ionico.
2. Interazione con fosforo, carbonio, silicio (il ferro non si combina direttamente con N 2 e H 2, ma li dissolve).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = FexSiy
Si formano sostanze di composizione variabile, poiché berthollides (nei composti prevale la natura covalente del legame)
3. Interazione con acidi "non ossidanti" (HCl, H 2 SO 4 dil.)
Fe 0 + 2H + → Fe 2+ + H 2
Poiché Fe si trova nella serie di attività a sinistra dell'idrogeno (E ° Fe / Fe 2+ \u003d -0,44 V), è in grado di spostare H 2 dagli acidi ordinari.
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
4. Interazione con acidi "ossidanti" (HNO 3 , H 2 SO 4 conc.)
Fe 0 - 3e - → Fe 3+
HNO 3 e H 2 SO 4 concentrati "passivano" il ferro, quindi a temperature normali il metallo non si dissolve in essi. Con un forte riscaldamento si verifica una lenta dissoluzione (senza rilascio di H 2).
In razb. Il ferro HNO 3 si dissolve, va in soluzione sotto forma di cationi Fe 3+ e l'anione acido viene ridotto a NO *:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O
Si dissolve molto bene in una miscela di HCl e HNO 3
5. Atteggiamento verso gli alcali
Fe non si dissolve in soluzioni acquose di alcali. Reagisce con alcali fusi solo a temperature molto elevate.
6. Interazione con sali di metalli meno attivi
Fe + CuSO 4 \u003d FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Interazione con monossido di carbonio gassoso (t = 200°C, P)
Fe (polvere) + 5CO (g) \u003d Fe 0 (CO) 5 ferro pentacarbonile
Composti Fe(III).
Fe 2 O 3 - ossido di ferro (III).
Polvere rosso-marrone, n. R. in H 2 O. In natura - "minerale di ferro rosso".
Modi per ottenere:
1) decomposizione dell'idrossido di ferro (III)
2Fe(OH)3 = Fe2O3 + 3H2O
2) tostatura alla pirite
4FeS 2 + 11O 2 \u003d 8SO 2 + 2Fe 2 O 3
3) decomposizione del nitrato
Proprietà chimiche
Fe 2 O 3 è un ossido basico con segni di anfoterismo.
I. Le proprietà principali si manifestano nella capacità di reagire con gli acidi:
Fe 2 O 3 + 6H + = 2Fe 3+ + ZH 2 O
Fe 2 O 3 + 6HCI \u003d 2FeCI 3 + 3H 2 O
Fe 2 O 3 + 6HNO 3 \u003d 2Fe (NO 3) 3 + 3H 2 O
II. Proprietà acide deboli. Fe 2 O 3 non si dissolve in soluzioni acquose di alcali, ma quando fusi con ossidi solidi, alcali e carbonati, si formano ferriti:
Fe 2 O 3 + CaO \u003d Ca (FeO 2) 2
Fe 2 O 3 + 2NaOH \u003d 2NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 \u003d Mg (FeO 2) 2 + CO 2
III. Fe 2 O 3 - materia prima per la produzione di ferro nella metallurgia:
Fe 2 O 3 + ZS \u003d 2Fe + ZSO o Fe 2 O 3 + ZSO \u003d 2Fe + ZSO 2
Fe (OH) 3 - idrossido di ferro (III).
Modi per ottenere:
Ottenuto dall'azione degli alcali sui sali solubili Fe 3+:
FeCl 3 + 3NaOH \u003d Fe (OH) 3 + 3NaCl
Al momento della ricezione di Fe (OH) 3 - precipitato mucomorfo rosso-marrone.
L'idrossido di Fe (III) si forma anche durante l'ossidazione di Fe e Fe (OH) 2 in aria umida:
4Fe + 6H 2O + 3O 2 \u003d 4Fe (OH) 3
4Fe(OH) 2 + 2Í 2 O + O 2 = 4Fe(OH) 3
L'idrossido di Fe(III) è il prodotto finale dell'idrolisi dei sali di Fe 3+.
Proprietà chimiche
Fe(OH) 3 è una base molto debole (molto più debole di Fe(OH) 2). Mostra notevoli proprietà acide. Pertanto, Fe (OH) 3 ha un carattere anfotero:
1) le reazioni con gli acidi procedono facilmente:
2) un precipitato fresco di Fe(OH) 3 viene sciolto in conc. soluzioni di KOH o NaOH con formazione di idrossi complessi:
Fe (OH) 3 + 3KOH \u003d K 3
In una soluzione alcalina, Fe (OH) 3 può essere ossidato a ferrati (sali dell'acido di ferro H 2 FeO 4 non isolati allo stato libero):
2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8H2O
Fe 3+ sali
I più praticamente importanti sono: Fe 2 (SO 4) 3, FeCl 3, Fe (NO 3) 3, Fe (SCN) 3, K 3 4 - sale di sangue giallo \u003d Fe 4 3 Blu di Prussia (precipitato blu scuro)
b) Fe 3+ + 3SCN - \u003d Fe (SCN) 3 Fe (III) tiocianato (soluzione rosso sangue)
Dettagli Categoria: Visualizzazioni: 9555 FERRO DA STIRO, Fe, elemento chimico, peso atomico 55,84, numero di serie 26; situato nell'VIII gruppo del sistema periodico nella stessa fila con cobalto e nichel, punto di fusione - 1529 ° C, punto di ebollizione - 2450 ° C; allo stato solido ha un colore bluastro-argenteo. In forma libera, il ferro si trova solo nei meteoriti, che però contengono miscele di Ni, P, C e altri elementi. In natura, i composti del ferro sono ampiamente distribuiti in tutto (suolo, minerali, emoglobina animale, clorofilla vegetale), cap. arr. sotto forma di ossidi, idrati di ossidi e composti di zolfo, nonché carbonato di ferro, di cui è composta la maggior parte dei minerali di ferro.
FERRO DA STIRO, Fe, elemento chimico, peso atomico 55,84, numero di serie 26; situato nell'VIII gruppo del sistema periodico nella stessa fila con cobalto e nichel, punto di fusione - 1529 ° C, punto di ebollizione - 2450 ° C; allo stato solido ha un colore bluastro-argenteo. In forma libera, il ferro si trova solo nei meteoriti, che però contengono miscele di Ni, P, C e altri elementi. In natura, i composti del ferro sono ampiamente distribuiti in tutto (suolo, minerali, emoglobina animale, clorofilla vegetale), cap. arr. sotto forma di ossidi, idrati di ossidi e composti di zolfo, nonché carbonato di ferro, di cui è composta la maggior parte dei minerali di ferro.
Il ferro chimicamente puro si ottiene riscaldando il ferro ossalico, ea 440°C, dapprima, si ottiene una polvere opaca di ossido ferroso, che ha la capacità di infiammarsi all'aria (il cosiddetto ferro piroforico); alla successiva riduzione di questo ossido, la polvere risultante acquista un colore grigio e perde le sue proprietà piroforiche, trasformandosi in ferro metallico. Durante la riduzione dell'ossido ferroso a 700°C, il ferro precipita sotto forma di piccoli cristalli, che vengono poi fusi sotto vuoto. Un altro modo per ottenere ferro chimicamente puro è l'elettrolisi di una soluzione di sali di ferro, come FeSO 4 o FeCl 3 miscelati con MgSO 4 , CaCl 2 o NH 4 Cl (a temperature superiori a 100°C). Tuttavia, allo stesso tempo, il ferro occlude una quantità significativa di idrogeno elettrolitico, per cui acquisisce durezza. Quando viene calcinato a 700 ° C, viene rilasciato idrogeno e il ferro diventa morbido e viene tagliato con un coltello, come il piombo (la durezza sulla scala Mohs è 4,5). Il ferro molto puro può essere ottenuto alluminotermicamente dall'ossido di ferro puro. (vedi Alluminotermia). I cristalli di ferro ben formati sono rari. I cristalli ottaedrici a volte si formano nelle cavità di grandi pezzi di ghisa. Una proprietà caratteristica del ferro è il suo rammollimento, malleabilità e duttilità a una temperatura molto inferiore al punto di fusione. Quando l'acido nitrico forte (non contenente ossidi di azoto inferiori) agisce sul ferro, il ferro si ricopre di uno strato di ossidi e diventa insolubile nell'acido nitrico.
Composti di ferro
Combinandosi facilmente con l'ossigeno, il ferro forma diversi ossidi: FeO - ossido ferroso, Fe 2 O 3 - ossido di ferro, FeO 3 - anidride ferrica e FeO 4 - anidride dell'acido ironico. Inoltre, il ferro forma anche un ossido del tipo misto Fe 3 O 4 - ossido ferroso, il cosiddetto. scala di ferro. Nell'aria secca, invece, il ferro non si ossida; la ruggine è un ossido di ferro acquoso formato con la partecipazione di umidità dell'aria e CO 2 . L'ossido ferroso FeO corrisponde all'idrato Fe (OH) 2 e ad un certo numero di sali di ferro bivalente, suscettibili di essere ossidati in sali di ossido di ferro, Fe 2 O 3, in cui il ferro si manifesta come elemento trivalente; in aria, l'ossido di ferro idrato, che ha forti proprietà riducenti, si ossida facilmente trasformandosi in ossido di ferro idrato. L'idrato di ossido di ferro è leggermente solubile in acqua e questa soluzione ha una reazione chiaramente alcalina, indicando il carattere basico del ferro ferroso. L'ossido di ferro si trova in natura (vedi. Ferro minio), mentre artificialmente m. ottenuto sotto forma di polvere rossa calcinando polvere di ferro e bruciando pirite di zolfo per ottenere anidride solforosa. Ossido di ferro anidro, Fe 2 O 3, m. ottenuto in due modifiche, e il passaggio da uno di essi all'altro avviene quando riscaldato ed è accompagnato da un significativo rilascio di calore (autoriscaldamento). Con una forte calcinazione, Fe 2 O 3 rilascia ossigeno e passa in ossido magnetico, Fe 3 O 4. Sotto l'azione di alcali su soluzioni di sali di ferro ferrico, precipita un precipitato di idrato Fe 4 O 9 H 6 (2Fe 2 O 3 3H 2 O); quando viene bollito con acqua si forma Fe 2 O 3 ·H 2 O idrato, che è difficile da sciogliere negli acidi. Il ferro forma composti con vari metalloidi: con C, P, S, con alogenuri, nonché con metalli, ad esempio con Mn, Cr, W, Cu, ecc.
I sali di ferro sono divisi in ferroso - ferro ferroso (ferro-sale) e ossido - ferro ferrico (ferri-sale).
sali ferrosi . cloruro ferrico, FeCl 2 , ottenuto per azione del cloro secco sul ferro, sotto forma di foglie incolori; quando il ferro viene sciolto in HCl, si ottiene il cloruro ferrico sotto forma di FeCl 2 4H 2 O idrato e viene utilizzato sotto forma di soluzioni acquose o alcoliche in medicina. Lo ioduro di ferro, FeJ 2 , è ottenuto da ferro e iodio sott'acqua sotto forma di foglie verdi ed è usato in medicina (Sirupus ferri jodati); con ulteriore azione dello iodio si forma FeJ 3 (Liquor ferri sesquijodati).
solfato ferroso, solfato ferroso, FeSO 4 7H 2 O (cristalli verdi) si forma in natura a seguito dell'ossidazione di pirite e pirite di zolfo; questo sale si forma anche come sottoprodotto nella produzione dell'allume; se esposto alle intemperie o riscaldato a 300 ° C, si trasforma in un sale anidro bianco - FeSO 4; forma anche idrati con 5, 4, 3, 2 e 1 particelle d'acqua; facilmente solubile in acqua fredda (in acqua calda fino al 300%); la soluzione è acida per idrolisi; si ossida all'aria, particolarmente facilmente in presenza di un'altra sostanza ossidante, ad esempio sali di acido ossalico, che FeSO 4 coinvolge in una reazione di ossidazione accoppiata, scolorisce KMnO 4; il processo procede secondo la seguente equazione:
2KMnO 4 + 10FeSO 4 + 8H 2 SO 4 \u003d 2MnSO 4 + K 2 SO 4 + 5Fe 2 (SO 4) 2 + 8H 2 O.
A tale scopo, tuttavia, viene utilizzato il doppio sale più permanente di Mohr (NH 4) 2 Fe (SO 4) 2 6H 2 O. -colore marrone del complesso (FeNO) SO 4, nonché per il produzione di inchiostro (con acidi tannici), come colorante per tintura, per legare gas maleodoranti (H 2 S, NH 3) nelle latrine, ecc.
I sali ferrosi di ferro sono utilizzati in fotografia per la loro capacità di ridurre i composti d'argento in un'immagine latente impressa su una lastra fotografica.
carbonato di ferro, FeCO 3 , si presenta naturalmente come siderite o longarone di ferro; ottenuto per precipitazione di soluzioni acquose di sali ferrosi di ferro con carbonati, il carbonato di ferro perde facilmente CO 2 e si ossida all'aria a Fe 2 O 3.
Bicarbonato di ferro, H 2 Fe (CO 3) 2, solubile in acqua e presente naturalmente in fonti ferruginose, dalle quali, ossidandosi, viene rilasciato sulla superficie terrestre sotto forma di ossido di ferro idrato, Fe (OH) 3, trasformandosi in minerale di ferro bruno.
Ferro fosfato, Fe 3 (PO 4) 2 8H 2 O, precipitato bianco; si presenta in natura leggermente colorata, per ossidazione del ferro, di colore azzurro, sotto forma di vivianite.
Sali di ossido di ferro . Il cloruro ferrico, FeCl 3 (Fe 2 Cl 6), si ottiene per azione del cloro in eccesso sul ferro sotto forma di lastre rosse esagonali; il cloruro ferrico si dissolve nell'aria; cristallizza dall'acqua sotto forma di FeCl 3 6H 2 O (cristalli gialli); le soluzioni sono acide; durante la dialisi viene gradualmente idrolizzato quasi fino alla fine con la formazione di una soluzione colloidale di Fe (OH) 3 idrato. FeCl 3 si dissolve in alcool e in una miscela di alcool ed etere, quando riscaldato, FeCl 3 6H 2 O si decompone in Hcl e Fe 2 O 3; utilizzato come medicazione e come agente emostatico (Liquor ferri sesquichlorati).
Ossido di ferro solfato, Fe 2 (SO 4) 3 , giallastro allo stato anidro, altamente idrolizzato in soluzione; quando la soluzione viene riscaldata precipitano i sali basici; allume ferroso, MFe(SO 4) 2 12H 2 O, M - metallo alcalino monovalente; l'allume di ammonio cristallizza meglio di tutti, NH 4 Fe (SO 4) 2 12H 2 O.
L'ossido FeO 3 è un'anidride dell'acido di ferro, così come l'idrato di questo ossido H 2 FeO 4 - acido ferrico- in uno stato libero non m. ottenuti in considerazione della loro estrema fragilità; ma nelle soluzioni alcaline possono esserci sali di acido di ferro, ferrati (ad esempio K 2 FeO 4), che si formano riscaldando polvere di ferro con nitrato o KClO 3. Noto anche sale di bario scarsamente solubile dell'acido di ferro BaFeO 4 ; quindi, l'acido ferrico è per certi aspetti molto simile agli acidi solforico e cromico. Nel 1926, il chimico di Kiev Goralevich descrisse composti di ossido di ferro ottavalente: anidride superferrosa FeO 4 ottenuto fondendo Fe 2 O 3 con salnitro o sale di Bertolet sotto forma di sale di potassio dell'acido ironico K 2 FeO 5; FeO 4 è una sostanza gassosa che non forma acido ironico H 2 FeO 5 con l'acqua, che però può. isolato allo stato libero mediante decomposizione del sale K 2 FeO 5 con acidi. Il sale di bario BaFeO 5 7H 2 O, così come i sali di calcio e di stronzio, sono stati ottenuti da Goralevich sotto forma di cristalli bianchi non decomponibili che rilasciano acqua solo a 250-300 °C e contemporaneamente diventano verdi.
Il ferro dà composti: con azoto - ferro nitroso(nitruro) Fe 2 N quando la polvere di ferro viene riscaldata in un getto di NH 3 , con carburo di carbonio - Fe 3 C quando il ferro viene saturato con carbone in un forno elettrico. Inoltre, sono stati studiati numerosi composti di ferro con monossido di carbonio: carbonili di ferro, ad esempio, pentacarbonil Fe(CO) 5 - liquido leggermente colorato con circa 102,9 ° C (a 749 mm, peso specifico 1,4937), quindi un solido arancione Fe 2 (CO) 9, insolubile in etere e cloroformio, con peso specifico 2,085 .
Di grande importanza sono composti di cianuro di ferro. Oltre ai semplici cianuri Fe (CN) 2 e Fe (CN) 3, il ferro forma una serie di composti complessi con sali di cianuro, come i sali dell'acido ferrico H 4 Fe (CN) 6 e i sali dell'acido ferrico H 3 Fe (CN) 6, ad esempio, sale rosso sangue, che a sua volta entra in reazioni di decomposizione metabolica con sali di ferro e ossido di ferro, formando composti di colore blu - blu di Prussia e blu turnbull. Quando si sostituisce un gruppo CN con gruppi monovalenti (NO, NO 2, NH 3, SO 3, CO) nei sali dell'acido ferruginoso H 4 Fe (CN) 6 , si formano sali prusso, ad esempio nitroprussiato di sodio (cianuro nitroferroso sodio ) Na 2 2H 2 O, ottenuto per azione di HNO 3 fumante su K 4 Fe (CN) 6, seguita da neutralizzazione con soda, sotto forma di cristalli rosso rubino, separati per cristallizzazione dal salnitro formatosi contemporaneamente; anche il corrispondente acido nitroferrico-cianotico H 2 cristallizza come cristalli rosso scuro. Il nitroprussiato di sodio viene utilizzato come reagente sensibile per l'idrogeno solforato e i solfuri metallici, con i quali dà un colore rosso sangue, che poi vira al blu. Sotto l'azione del solfato di rame sul nitroprussiato di sodio, si forma un precipitato verde pallido, insolubile in acqua e alcool, che viene utilizzato per testare gli oli essenziali.
Analiticamente il ferro viene rilevato dall'azione sui suoi sali, in soluzione alcalina, del sale giallo sangue. I sali di ferro ferrico formano un precipitato blu di blu di Prussia. I sali di ferro ferroso formano un precipitato blu di turnbull blu se esposti al sale rosso sangue. Con il tiocianato di ammonio NH 4 CNS, i sali di ferro ferrico formano ferro rhodan Fe(CNS) 3 solubile in acqua, di colore rosso sangue; con il tannino, i sali di ossido di ferro formano l'inchiostro. I sali di rame dell'acido ferrico-cianotico si distinguono anche per l'intensa colorazione, che viene utilizzata (metodo uvachrome) nella fotografia a colori. Tra i composti del ferro usati in medicina, oltre ai citati alogenuri di ferro, sono importanti: ferro metallico (F. hydrogenio reductum), citrato di ferro (F. Citricum - 20% Fe), estratto di ferro malico (Extractum ferri pomatum) , albuminato di ferro (Liquor ferri albuminatum), la ferratina è un composto proteico con il 6% di ferro; ferratosio - una soluzione di ferratina, carniferrina - un composto di ferro con nucleina (30% Fe); ferratogeno da nucleina di lievito (1% Fe), ematogeno - soluzione al 70% di emoglobina in glicerolo, emolo - emoglobina ridotta da polvere di zinco.
Proprietà fisiche del ferro
I dati numerici disponibili in letteratura che caratterizzano le varie proprietà fisiche del ferro oscillano a causa della difficoltà di ottenere ferro allo stato chimicamente puro. Pertanto, i dati più affidabili sono ottenuti per il ferro elettrolitico, in cui il contenuto totale di impurità (C, Si, Mn, S, P) non supera lo 0,01-0,03%. I dati seguenti nella maggior parte dei casi si riferiscono a tale hardware. Per esso, il punto di fusione è 1528°C ± 3°C (Ruer e Klesper, 1914), e il punto di ebollizione è ≈ 2450°C. Allo stato solido, il ferro esiste in quattro diverse modificazioni: α, β, γ e δ, per le quali i seguenti limiti di temperatura sono stabiliti in modo abbastanza accurato:

La transizione del ferro da una modifica all'altra viene rilevata sulle curve di raffreddamento e riscaldamento da punti critici, per i quali sono accettate le seguenti designazioni:

 Questi punti critici sono mostrati in Fig. 1 con curve schematiche di riscaldamento e raffreddamento. L'esistenza di modifiche δ-, γ- e α-Fe è attualmente considerata indiscutibile, mentre l'esistenza indipendente di β-Fe è contestata a causa della differenza non sufficientemente netta tra le sue proprietà e quelle di α-Fe. Tutte le modifiche del ferro si cristallizzano sotto forma di un cubo e α, β e δ hanno un reticolo spaziale di un cubo centrato e γ-Fe - un cubo con facce centrate. Le caratteristiche cristallografiche più distinte delle modificazioni del ferro sono ottenute dagli spettri di raggi X, come mostrato in Fig. 2 (Westgreen, 1929).
Questi punti critici sono mostrati in Fig. 1 con curve schematiche di riscaldamento e raffreddamento. L'esistenza di modifiche δ-, γ- e α-Fe è attualmente considerata indiscutibile, mentre l'esistenza indipendente di β-Fe è contestata a causa della differenza non sufficientemente netta tra le sue proprietà e quelle di α-Fe. Tutte le modifiche del ferro si cristallizzano sotto forma di un cubo e α, β e δ hanno un reticolo spaziale di un cubo centrato e γ-Fe - un cubo con facce centrate. Le caratteristiche cristallografiche più distinte delle modificazioni del ferro sono ottenute dagli spettri di raggi X, come mostrato in Fig. 2 (Westgreen, 1929).  Dai modelli di diffrazione dei raggi X presentati risulta che per α-, β- e δ-Fe le linee dello spettro dei raggi X sono le stesse; corrispondono al reticolo di un cubo centrato con parametri 2.87, 2.90 e 2.93 Ȧ, e per γ-Fe lo spettro corrisponde al reticolo di un cubo con facce centrate e parametri 3.63-3.68 A.
Dai modelli di diffrazione dei raggi X presentati risulta che per α-, β- e δ-Fe le linee dello spettro dei raggi X sono le stesse; corrispondono al reticolo di un cubo centrato con parametri 2.87, 2.90 e 2.93 Ȧ, e per γ-Fe lo spettro corrisponde al reticolo di un cubo con facce centrate e parametri 3.63-3.68 A.
Il peso specifico del ferro varia da 7,855 a 7,864 (Cross e Gill, 1927). Quando riscaldato, il peso specifico del ferro diminuisce a causa dell'espansione termica, per cui i coefficienti aumentano con la temperatura, come mostrato in Tabella. 1 (Driesen, 1914).

La diminuzione dei coefficienti di espansione negli intervalli 20–800°C, 20–900°C, 700–800°C e 800–900°C è spiegata da anomalie nell'espansione al passaggio attraverso i punti critici A C2 e LA C3. Questa transizione è accompagnata da contrazione, particolarmente pronunciata nel punto A C3 come mostrato dalle curve di contrazione ed espansione in FIG. 3. La fusione del ferro è accompagnata dalla sua espansione del 4,4% (Gonda ed Enda, 1926). La capacità termica del ferro è piuttosto significativa rispetto ad altri metalli ed è espressa per diversi intervalli di temperatura da 0,11 a 0,20 Cal, come mostrato in Tabella. 2 (Obergoffer e Grosse, 1927) e la curva da essi costruita (Fig. 4).

 Nei dati forniti, le trasformazioni A 2 , A 3 , A 4 e la fusione del ferro si trovano così chiaramente che gli effetti termici sono facilmente calcolabili per loro: A 3 ... + 6.765 Cal, A 4 ... + 2.531 Cal , fusione del ferro ... - 64,38 Cal (secondo S. Umino, 1926, - 69,20 Cal).
Nei dati forniti, le trasformazioni A 2 , A 3 , A 4 e la fusione del ferro si trovano così chiaramente che gli effetti termici sono facilmente calcolabili per loro: A 3 ... + 6.765 Cal, A 4 ... + 2.531 Cal , fusione del ferro ... - 64,38 Cal (secondo S. Umino, 1926, - 69,20 Cal).
Il ferro è caratterizzato da una conduttività termica circa 6-7 volte inferiore a quella dell'argento e 2 volte inferiore a quella dell'alluminio; in particolare, la conduttività termica del ferro è a 0°C - 0,2070, a 100°C - 0,1567, a 200°C - 0,1357 ea 275°C - 0,1120 Cal/cm·s·°С. Le proprietà più caratteristiche del ferro sono magnetiche, espresse da un numero di costanti magnetiche ottenute durante un ciclo completo di magnetizzazione del ferro. Queste costanti per il ferro elettrolitico sono espresse dai seguenti valori in gauss (Gumlich, 1909 e 1918):

Quando si passa attraverso il punto A c2, le proprietà ferromagnetiche del ferro quasi scompaiono e possono esserlo. rilevato solo con misurazioni magnetiche molto precise. In pratica, le modifiche β-, γ- e δ sono considerate non magnetiche. La conducibilità elettrica del ferro a 20°C è R -1 mo m/mm 2 (dove R è la resistenza elettrica del ferro, pari a 0,099 Ω mm 2 /m). Il coefficiente di temperatura della resistenza elettrica a0-100 ° x10 5 varia da 560 a 660, dove
![]()
 La lavorazione a freddo (laminazione, forgiatura, brocciatura, stampaggio) ha un effetto molto evidente sulle proprietà fisiche del ferro. Quindi, la loro variazione % durante la laminazione a freddo è espressa dalle seguenti cifre (Gerens, 1911): tensione coercitiva + 323%, isteresi magnetica + 222%, resistenza elettrica + 2%, peso specifico - 1%, permeabilità magnetica - 65%. Quest'ultima circostanza rende comprensibili quelle fluttuazioni significative delle proprietà fisiche osservate da diversi ricercatori: l'influenza delle impurità è spesso accompagnata dall'influenza del trattamento meccanico a freddo.
La lavorazione a freddo (laminazione, forgiatura, brocciatura, stampaggio) ha un effetto molto evidente sulle proprietà fisiche del ferro. Quindi, la loro variazione % durante la laminazione a freddo è espressa dalle seguenti cifre (Gerens, 1911): tensione coercitiva + 323%, isteresi magnetica + 222%, resistenza elettrica + 2%, peso specifico - 1%, permeabilità magnetica - 65%. Quest'ultima circostanza rende comprensibili quelle fluttuazioni significative delle proprietà fisiche osservate da diversi ricercatori: l'influenza delle impurità è spesso accompagnata dall'influenza del trattamento meccanico a freddo.
Si sa molto poco sulle proprietà meccaniche del ferro puro. Ferro elettrolitico fuso in un vuoto trovato: resistenza alla trazione 25 kg / mm 2, allungamento - 60%, compressione della sezione trasversale - 85%, durezza Brinell - da 60 a 70.
La struttura del ferro dipende dal contenuto di impurità in esso contenute (anche in piccole quantità) e dal pretrattamento del materiale. La microstruttura del ferro, come altri metalli puri, è costituita da grani più o meno grandi (cristalliti), che qui vengono chiamati ferrite.


Le dimensioni e la nitidezza dei loro contorni dipendono da ch. arr. sulla velocità di raffreddamento del ferro: più bassa è quest'ultima, più sviluppati sono i grani e più nitidi i loro contorni. Dalla superficie, i grani sono spesso colorati in modo disuguale a causa della cristallografia disuguale, del loro orientamento e dell'azione di attacco disuguale dei reagenti in diverse direzioni nel cristallo. Non è raro che i grani si allunghino in una direzione a causa della lavorazione meccanica. Se la lavorazione è avvenuta a basse temperature, sulla superficie dei grani compaiono delle linee di taglio (linee di Neumann) a seguito dello scorrimento di singole parti dei cristalliti lungo i loro piani di scissione. Queste linee sono uno dei segni di indurimento e quei cambiamenti nelle proprietà che sono stati menzionati sopra.
Ferro in metallurgia
Il termine ferro nella metallurgia moderna è assegnato solo al ferro battuto, cioè un prodotto a basso contenuto di carbonio ottenuto allo stato pastoso a una temperatura non sufficiente a fondere il ferro, ma così alta che le sue singole particelle sono ben saldate tra loro, dando dopo forgiare un prodotto morbido omogeneo, non accettare l'indurimento. Il ferro (nel senso indicato del termine) si ottiene: 1) direttamente dal minerale allo stato pastoso mediante un processo di soffiatura del formaggio; 2) allo stesso modo, ma a temperatura inferiore, insufficiente per saldare particelle di ferro; 3) ridistribuzione della ghisa mediante il processo di fioritura; 4) ridistribuzione della ghisa mediante pozzanghera.
1) Processo di soffiatura del formaggio in corso. il tempo è utilizzato solo da popoli incolti e in aree in cui (a causa della mancanza di convenienti mezzi di comunicazione) il ferro americano o europeo, ottenuto con metodi moderni, non può penetrare. Il processo viene eseguito in forni e fornaci grezzi aperti. Le materie prime per esso sono il minerale di ferro (solitamente minerale di ferro marrone) e il carbone di legna. Il carbone viene versato nel focolare in quella metà dove viene fornita l'esplosione, mentre il minerale è in un mucchio, dal lato opposto. Il monossido di carbonio formato in uno spesso strato di carbone ardente passa attraverso l'intero spessore del minerale e, avendo una temperatura elevata, riduce il ferro. Il recupero del minerale viene effettuato gradualmente, dalla superficie dei singoli pezzi al nucleo. Partendo dalla sommità del mucchio, accelera man mano che il minerale si sposta in un'area a temperatura più elevata; in questo caso, l'ossido di ferro passa prima nell'ossido magnetico, poi nell'ossido e, infine, il ferro metallico appare sulla superficie dei pezzi di minerale. Allo stesso tempo, le impurità terrose del minerale (roccia di scarto) si combinano con l'ossido di ferro non ancora ridotto e formano una scoria ferrosa a basso punto di fusione, che si scioglie attraverso le fessure del guscio metallico, che forma, per così dire, , un guscio in ogni pezzo di minerale. Essendo riscaldati a un calore incandescente, questi gusci sono saldati l'uno all'altro, formando una massa spugnosa di ferro sul fondo del focolare - un kritsu, penetrato dalle scorie. Per separarsi da quest'ultimo, la kritsa estratta dal focolare viene tagliata in più parti, ciascuna delle quali viene forgiata, saldata, previo raffreddamento nello stesso focolare a strisce o direttamente in prodotti (articoli per la casa, armi). In India, il processo di produzione del formaggio viene ancora eseguito in forni per la produzione di formaggio, che differiscono dai forni solo per un'altezza leggermente superiore - circa 1,5 M. Le pareti dei forni sono fatte di massa di argilla (non di mattoni) e servono solo una fusione. La raffica viene immessa nel forno attraverso una tubiera da soffietti azionati da piedi o mani. Una certa quantità di carbone ("testa inattiva") viene caricata in una fornace vuota, e poi alternativamente, in strati separati, minerale e carbone, con la quantità del primo che aumenta gradualmente fino a raggiungere un certo rapporto con il carbone; il peso dell'intero minerale riempito è determinato dal peso desiderato del blumo, che, in generale, è trascurabile. Il processo di recupero è lo stesso della fucina; anche il ferro non viene completamente ripristinato e la fioritura risultante contiene molte scorie ferruginose. Il kritsu viene estratto rompendo il forno e tagliato a pezzi, del peso di 2-3 kg. Ciascuno di essi viene riscaldato in una fucina e lavorato sotto un martello; il risultato è un ottimo ferro dolce, che, tra l'altro, è il materiale per la fabbricazione dell'acciaio indiano "woots" (acciaio damascato). La sua composizione è la seguente (in%):
Il contenuto trascurabile di elementi - impurità di ferro - o la loro completa assenza è spiegato dalla purezza del minerale, dalla riduzione incompleta del ferro e dalla bassa temperatura nella fornace. Il consumo di carbone a causa delle ridotte dimensioni di fornaci e fornaci e della frequenza della loro azione è molto elevato. In Finlandia, Svezia e Urali, il ferro veniva fuso nell'altoforno per formaggio Husgavel, in cui era possibile controllare il processo di riduzione e saturazione del ferro con il carbonio; consumo di carbone in esso - fino a 1,1 per unità di ferro, la cui produzione ha raggiunto il 90% del suo contenuto nel minerale.
2) In futuro, è necessario prevedere lo sviluppo della produzione di ferro direttamente dal minerale, non utilizzando un processo di granigliatura grezza, ma riducendo il ferro a una temperatura insufficiente per la formazione di scorie e persino per la sinterizzazione del minerale di scarto (1000 °C). I vantaggi di tale processo sono la possibilità di utilizzare combustibili di bassa qualità, l'eliminazione del flusso e il consumo di calore per la fusione delle scorie.
3) La produzione di ferro battuto mediante ridistribuzione della ghisa mediante il processo di fioritura viene effettuata nei forni di fioritura di Ch. arr. in Svezia (abbiamo - negli Urali). Per la ridistribuzione viene fusa una ghisa speciale, la cosiddetta. Lancashire, dando il minimo spreco. Contiene: 0,3-0,45% Si, 0,5-0,6% Mn, 0,02 P,<0,01% S. Такой чугун в изломе кажется белым или половинчатым. Горючим в кричных горнах может служить только древесный уголь.
Il processo viene seguito. arr.: il focolare, liberato dal grido, ma con le scorie mature della fine del processo rimaste sul piano di fondo, si riempie di carbone, cap. arr. pino, su cui viene posata la ghisa riscaldata dai prodotti della combustione nella quantità di 165-175 kg (per 3/8 m 2 della sezione del focolare ci sono 100 kg di gabbie in ghisa). Ruotando la valvola nel condotto dell'aria, il getto viene indirizzato attraverso i tubi posti nel vano sottotetto del focolare, e qui viene riscaldato ad una temperatura di 150-200 °C, accelerando così. ferro fuso. La ghisa in fusione è costantemente appoggiata (con l'ausilio di piedi di porco) sul carbone sopra le tuyeres. Durante tale lavoro, l'intera massa di ghisa è sottoposta all'azione ossidativa dell'ossigeno atmosferico e dell'anidride carbonica, attraversando la zona di combustione sotto forma di goccioline. La loro ampia superficie contribuisce alla rapida ossidazione del ferro e delle sue impurità: silicio, manganese e carbonio. A seconda del contenuto di queste impurità, la ghisa le perde in misura maggiore o minore prima di raccogliersi sul fondo del focolare. Poiché la ghisa a basso contenuto di silicio e manganese viene rielaborata nella fucina svedese, quindi, oltrepassando l'orizzonte di tuyere, perde tutto il suo Si e Mn (i cui ossidi formano la scoria principale con l'ossido di ferro) e una parte significativa del carbonio. La fusione della ghisa dura 20-25 minuti. Alla fine di questo processo, il getto d'aria fredda viene immesso nel forno. Il metallo che si è depositato sul fondo del focolare inizia a reagire con le scorie mature ivi situate, che contengono un grande eccesso (rispetto alla quantità di silice) di ossidi di ferro - Fe 3 O 4 e FeO, che ossidano il carbonio con il rilascio di monossido di carbonio, che fa bollire l'intero metallo. Quando il metallo si ispessisce (per la perdita di carbonio) e "si siede come una merce", quest'ultima viene sollevata con dei piedi di porco sopra le tuyeres, si riaccende l'esplosione di calore e la "merce" viene fusa.
Durante la fusione secondaria, il metallo viene ossidato dall'ossigeno sia dell'esplosione che delle scorie che ne vengono sciolte. In fondo alla fucina, dopo la prima salita, cade del metallo, abbastanza morbido da raccogliere kritsu da alcune delle sue parti più mature. Ma prima, quando si utilizzavano tipi di ghisa al silicio, era necessario ricorrere a un secondo e persino terzo aumento delle merci, che, ovviamente, riduceva la produttività del forno, aumentava il consumo di carburante e lo spreco di ferro. I risultati del lavoro sono stati influenzati dalla distanza delle lance dal piano di fondo (la profondità del focolare) e dalla pendenza delle lance: più ripida è impostata la tubiera e minore è la profondità del focolare, maggiore è l'effetto dell'atmosfera ossidante sul metallo. L'inclinazione più dolce delle lance, nonché la maggiore profondità del focolare, riduce l'azione diretta dell'ossigeno d'aria, conferendo così un ruolo maggiore all'azione della scoria sulle impurità ferrose; l'ossidazione da parte loro è più lenta, ma senza fumi di ferro. In ogni condizione, la posizione più vantaggiosa delle lance rispetto alla tavola inferiore è determinata dall'esperienza; in una moderna fucina svedese, la cruna della lancia è posta a una distanza di 220 mm dall'asse inferiore, e l'inclinazione delle tuyeres varia entro limiti ristretti - da 11 a 12°.
La fessura ottenuta sul fondo del focolare contiene, contrariamente al colpo grezzo, pochissime scorie trascinate meccanicamente; per quanto riguarda le impurità chimiche del ferro, allora possono essere Si, Mn e C. vengono completamente rimossi (il contenuto trascurabile di Si e Mn indicato dalle analisi fa parte dell'impurità meccanica - scoria), e lo zolfo viene solo parzialmente ossidato per esplosione durante la fusione. Allo stesso tempo, anche il fosforo viene ossidato, lasciando nelle scorie sotto forma di sale di fosforo-ferro, ma quest'ultimo viene poi ridotto dal carbonio, e il metallo finale può contenere anche relativamente più fosforo (dai fumi di ferro) rispetto all'originale ghisa. Ecco perché, al fine di ottenere metallo di prima classe per l'esportazione in Svezia, nella ridistribuzione viene presa esclusivamente ghisa pura in relazione a P. Il kritsa finito estratto dalla fucina viene tagliato in tre parti (50-55 kg ciascuna) e pressato sotto un martello, dando l'aspetto di un parallelepipedo.
La durata del processo di ridistribuzione nella fioritura svedese va dai 65 agli 80 minuti; si ottengono da 2,5 a 3,5 tonnellate di pezzi compressi “per il fuoco” al giorno, con un consumo di carbone di appena 0,32-0,40 per unità di materiale finito e la sua resa dall'89 al 93,5% della ghisa specificata nella ridistribuzione. Più recentemente, in Svezia sono stati fatti esperimenti di successo nella conversione del ferro liquido prelevato dagli altiforni e nell'accelerazione del processo di ebollizione agitando il metallo con un rastrello meccanico; mentre i rifiuti sono scesi al 7% e il consumo di carbone - allo 0,25.
I seguenti dati (in%) danno il concetto della composizione chimica del ferro svedese e degli Urali meridionali:
Di tutti i tipi di ferro ottenuti con metodi industriali, la fioritura svedese è la più vicina alla purezza chimica e viene utilizzata al posto di quest'ultima nella pratica di laboratorio e nei lavori di ricerca. Differisce dal ferro grezzo per la sua uniformità, e dal più tenero metallo da focolare aperto (ghisa) per l'assenza di manganese; è caratterizzato dal più alto grado di saldabilità, duttilità e malleabilità. Il ferro da stiro svedese presenta una resistenza alla trazione trascurabile di soli 30 kg/mm2 circa, con un allungamento del 40% e una riduzione della sezione trasversale del 75%. Attualmente, la produzione annua di ferro da stiro in Svezia è scesa a 50.000 tonnellate, dal dopoguerra del 1914-18. la portata delle applicazioni industriali di questo ferro è stata notevolmente ridotta. La maggior parte di esso viene utilizzata nella fabbricazione (in Inghilterra, arr. principale e in Germania) dei gradi più alti di acciai per utensili e speciali; nella stessa Svezia viene utilizzato per realizzare fili speciali ("fiore"), chiodi a ferro di cavallo, ben forgiati a freddo, catene e sbozzati per tubi saldati. Per gli ultimi due scopi, le proprietà del ferro da fiore sono particolarmente importanti: saldabilità affidabile e, per i tubi, inoltre, la massima resistenza alla ruggine.
4) Lo sviluppo della produzione di ferro per fioritura ha comportato la distruzione delle foreste; dopo che questi ultimi furono posti sotto la tutela di una legge in vari paesi, che ne limitava l'abbattimento ad un incremento annuo, la Svezia, e poi la Russia - paesi boscosi e ricchi di minerali di alta qualità - divennero i principali fornitori di ferro sul mercato internazionale in tutto il 18mo secolo. Nel 1784, l'inglese Cort inventò il puddling, il processo di ridistribuzione della ghisa sul focolare di una fornace ardente, nella cui fornace veniva bruciato il carbone. Dopo la morte di Cort, Rogers e Gall introdussero miglioramenti significativi nella progettazione della fornace di pozzanghera, che contribuirono alla rapida diffusione della pozzanghera in tutti i paesi industriali e cambiarono completamente la natura e l'entità della loro produzione di ferro durante la prima metà del XIX secolo. Con questo processo ottennero la massa di metallo necessaria per la costruzione di navi in ferro, ferrovie, locomotive, caldaie a vapore e automobili.
Il combustibile per la pozzanghera è il carbone bituminoso a fiamma lunga, ma dove non è disponibile, abbiamo dovuto ricorrere alla lignite, e qui negli Urali - alla legna da ardere. Il legno di pino dà una fiamma più lunga del carbon fossile; si riscalda bene, ma il contenuto di umidità nel legno non deve superare il 12%. Successivamente, il forno rigenerativo Siemens è stato utilizzato per la pozzanghera negli Urali. Infine, negli Stati Uniti e nel nostro paese (nei bacini del Volga e del Kama) i forni a pozzanghera funzionavano con olio spruzzato direttamente nello spazio di lavoro del forno.
Per la velocità di ridistribuzione e la riduzione del consumo di carburante, è auspicabile avere ghisa a freddo; fondendolo su coke, invece, si ottiene molto zolfo nel prodotto (0,2 e anche 0,3%) e con un alto contenuto di fosforo nel minerale, fosforo. Per i normali gradi commerciali di ferro, tale ghisa con un basso contenuto di silicio (meno dell'1%), chiamata ghisa, veniva precedentemente fusa in grandi quantità. La ghisa a carbone, che veniva rilavorata negli Urali e nella Russia centrale, non conteneva zolfo e dava un prodotto che veniva utilizzato anche per la fabbricazione del ferro da copertura. Attualmente, il puddling viene utilizzato per produrre metallo di alta qualità secondo specifiche speciali, e quindi non viene fornita la normale ghisa ai forni per pudding, ma di alta qualità, ad esempio manganese o "ematite" (a basso contenuto di fosforo), o, al contrario, ad alto contenuto di fosforo per la produzione di ferro dado. Di seguito è riportato il contenuto (in%) degli elementi principali in alcuni gradi di ghisa utilizzati per la puddling:

Il forno a pozzanghera, al termine della precedente operazione, presenta normalmente sul fondo una normale quantità di scoria per lavorare con il carico successivo. Durante la lavorazione di ghisa fortemente silicica, nel forno rimangono molte scorie e devono essere abbassate; al contrario, la ghisa bianca viene lasciata “a secco” sotto il forno, e si deve iniziare il lavoro gettando la quantità necessaria di scoria, che viene prelevata da sotto il maglio (“matura”, la più ricca di ossido magnetico) . Sulla scoria viene gettata una carica di ferro, riscaldata in ghisa (250-300 kg in forni ordinari e 500-600 kg in doppi forni); quindi una nuova porzione di combustibile viene gettata nella fornace, la griglia viene pulita e nella fornace viene installato un tiraggio completo. Entro 25-35 min. la ghisa si scioglie, subendo b. o m. un cambiamento significativo nella sua composizione. La ghisa dura viene ossidata dall'ossigeno della fiamma, e ferro, manganese e silicio danno un doppio silicato che scende sul focolare della fornace; la fusione della ghisa espone sempre più strati di ghisa solida, che si ossida e si scioglie. Al termine del periodo di fusione, sul focolare si formano due strati liquidi: ghisa e scoria, sulla cui superficie di contatto il carbonio viene ossidato, seppur in misura debole, dall'ossido di ferro magnetico, come evidenziato dalle bolle di monossido di carbonio uscito dal bagno. A seconda del contenuto di silicio e manganese nella ghisa, una quantità disuguale di essi rimane nel metallo fuso: nella ghisa a carbone a basso contenuto di silicio o nella ghisa bianca - fusione del coke - il silicio nella maggior parte dei casi brucia completamente durante la fusione; a volte una certa quantità rimane nel metallo (0,3-0,25%), così come il manganese. Anche il fosforo viene ossidato in questo momento, trasformandosi in un sale di ferro fosforico. Da una diminuzione del peso del metallo durante la combustione di queste impurità, la percentuale di contenuto di carbonio può anche aumentare, anche se una parte di esso viene indubbiamente bruciata dall'ossigeno della fiamma e dalle scorie che ricoprono le prime porzioni del metallo fuso.
Per accelerare l'esaurimento delle rimanenti quantità di silicio, manganese e carbonio, si ricorre al pudding, cioè mescolando la ghisa con le scorie usando una mazza con un'estremità ad angolo retto. Se il metallo è liquido (ghisa grigia, altamente carboniosa), allora la miscelazione non raggiunge lo scopo, e il bagno viene dapprima addensato gettandovi dentro scoria fredda e matura, oppure riducendo la spinta, si instaura una combustione incompleta nel fornace, accompagnata da una fiamma molto fumosa (languente). Dopo alcuni minuti, durante i quali si effettua un'agitazione continua, sulla superficie del bagno compaiono abbondanti bolle di monossido di carbonio ardente, prodotto dell'ossidazione del carbonio di ghisa da parte dell'ossigeno dell'ossido magnetico disciolto nelle principali scorie ferrose. Man mano che il processo procede, l'ossidazione di C si intensifica e si trasforma in una violenta "ebollizione" dell'intera massa del metallo, che è accompagnata dal suo rigonfiamento e da un aumento di volume così significativo che parte della scoria tracima attraverso la soglia del fori di lavoro. Man mano che C brucia, il punto di fusione del metallo aumenta e, affinché l'ebollizione continui, la temperatura nella fornace viene continuamente aumentata. L'ebollizione completata a bassa temperatura dà un prodotto grezzo, cioè una massa spugnosa di ferro ad alto tenore di carbonio, incapace di saldare; i prodotti maturi "si siedono" in un forno caldo. Il processo di ossidazione delle impurità di ferro in un forno a pozzanghera inizia con l'ossigeno della scoria, che è una lega di monosilice di ferro (Fe 2 SiO 4) con ossido magnetico e ossido di ferro di composizione variabile. Nei forni inglesi la composizione della miscela di ossidi è espressa dalla formula 5Fe 3 O 4 5 FeO; alla fine dell'ebollizione, il rapporto degli ossidi nella scoria impoverita è espresso dalla formula Fe 3 O 4 5FeO, cioè l'80% dell'intero ossido magnetico della scoria prende parte al processo di ossidazione. Reazioni di ossidazione m.b. sono rappresentate dalle seguenti equazioni termochimiche:

Come si può vedere da queste equazioni, l'ossidazione di Si, P e Mn è accompagnata dalla cessione di calore e, quindi, riscalda il bagno, mentre l'ossidazione di C durante la riduzione di Fe 3 O 4 a FeO assorbe calore e quindi richiede una temperatura elevata. Questo spiega l'ordine di rimozione delle impurità di ferro e il fatto che la combustione del carbonio termina prima in una fornace calda. Fe 3 O 4 non viene ridotto a metallo, perché questo richiede una temperatura più alta di quella a cui avviene la “bollitura”.
La "merce" rimpicciolita, per diventare ferro ben saldato, necessita ancora di essere cotta a vapore: la merce viene lasciata per alcuni minuti nel forno e di tanto in tanto viene rivoltata con dei piedi di porco, e le sue parti inferiori vengono appoggiate sopra superiore; sotto l'azione combinata dell'ossigeno della fiamma e delle scorie, impregnando l'intera massa di ferro, il carbonio in questo momento continua a bruciare. Non appena si ottiene una certa quantità di metallo ben saldato, le urla iniziano a rotolare fuori da esso, evitando un'eccessiva ossidazione. In totale vengono laminati da 5 a 10 kritz man mano che la merce matura (non più di 50 kg ciascuno); I cracker vengono mantenuti (vaporati) alla soglia nella zona di massima temperatura e alimentati sotto il martello per la compressione, che realizza la separazione delle scorie, e dando loro la forma di un pezzo (sezione da 10x10 a 15x15 cm), comodo per rotolare in rotoli. Al luogo delle grida emesse, le successive avanzano avanzando, fino all'ultima. La durata del processo nella produzione del metallo di altissima qualità (ferro fibroso) dalla ghisa a carbone matura (ad alto tenore di carbonio) negli Urali era la seguente: 1) impianto di ghisa - 5 minuti, 2) fusione - 35 minuti, 3) languire - 25 minuti, 4) pudding (mescolare) - 20 min., 5) cuocere a vapore la merce - 20 min., 6) zigrinare e cuocere a vapore i cracker - 40 minuti, 7) emettere i cracker (10-11 pezzi) - 20 minuti; totale - 165 min. Lavorando su ghisa bianca, su normale ferro commerciale, la durata del processo è stata ridotta (in Europa occidentale) a 100 e anche 75 minuti.
Per quanto riguarda i risultati del lavoro, nelle diverse regioni metallurgiche variavano a seconda del tipo di combustibile, della qualità della ghisa e del grado di ferro prodotto. Le stufe Ural, che funzionavano a legna, davano una resa di ferro utilizzabile per 1 m 3 di legna da 0,25 a 0,3 tonnellate; il consumo di petrolio per unità di ferro è 0,33, il carbone nelle fornaci europee va da 0,75 a 1,1. La produzione giornaliera delle nostre grandi stufe (600 kg di ghisa) lavorando su legna essiccata era di 4-5 tonnellate; la resa di materiale idoneo alla produzione di ferro da copertura era del 95-93% della quantità di ghisa fornita al processo. In Europa, la produttività giornaliera dei forni ordinari (gabbia 250-300 kg) è di circa 3,5 tonnellate con una perdita del 9% e per il ferro di alta qualità - 2,5 tonnellate con una perdita dell'11%.
In termini di composizione chimica e proprietà fisiche, il ferro da pudding è un prodotto molto peggiore del ferro da fiore, da un lato, e del ferro da focolare aperto, dall'altro. I gradi ordinari di ferro precedentemente prodotti nell'Europa occidentale contenevano molto zolfo e fosforo, poiché erano prodotti da ferri da coke impuri, ed entrambe queste impurità dannose passano solo in parte nelle scorie; la quantità di scorie nel ferro da stiro è del 3-6%, nel metallo di alta qualità non supera il 2%. La presenza di scoria riduce notevolmente i risultati delle prove meccaniche del ferro da stiro. Di seguito sono riportati alcuni dati in% che caratterizzano il ferro puddling - ordinario dell'Europa occidentale e buon Ural:

Una pregevole proprietà, per amore della quale oggi si sostiene la produzione di ferro da stiro, è la sua eccellente saldabilità, che a volte è di particolare importanza dal punto di vista della sicurezza. Specifiche ferroviarie Le società richiedono la produzione di dispositivi di accoppiamento in ferro battuto, aste per interruttori di trasferimento e bulloni. Per la sua migliore resistenza all'azione corrosiva dell'acqua, il ferro da stiro viene utilizzato anche per la produzione di tubi dell'acqua. Viene anche utilizzato per produrre dadi (metallo grezzo fosforoso) e ferro fibroso di alta qualità per rivetti e catene.
La struttura del ferro battuto, rilevata al microscopio anche a basso ingrandimento, è caratterizzata dalla presenza di componenti nere e chiare nell'immagine fotografica; le prime appartengono alle scorie, le seconde ai grani o fibre di ferro ottenute dalla trafilatura del metallo.
Commercio ferro
Gli impianti metallurgici producono ferro di due tipi principali per le esigenze dell'industria: 1) lamiera e 2) di alta qualità.
La lamiera viene attualmente arrotolata fino a 3 m di larghezza; con uno spessore di 1-3 mm, lo chiamiamo laminato fine; da 3 mm e oltre (di solito fino a 40 mm) - caldaia, serbatoio, nave, a seconda dello scopo, che corrisponde alla composizione e alle proprietà meccaniche del materiale. Il più morbido è il ferro da stiro; di solito contiene 0,10-0,12% C, 0,4-0,5% Mn, P e S - ciascuno non più dello 0,05%; la sua temporanea resistenza alla rottura non è b. più di 41 kg / mm 2 (ma non meno di 34 kg / mm 2), allungamento a rottura - circa il 28%. Il ferro del serbatoio è reso più solido e durevole; contiene 0,12-0,15% C; 0,5-0,7% Mn e non più dello 0,06% sia di P che di S; resistenza allo strappo 41-49 kg/mm 2 , allungamento 25-28%. La lunghezza dei fogli di caldaia e ferro da stiro viene stabilita su ordinazione in base alle dimensioni del prodotto rivettato dai fogli (evitando inutili giunzioni e rifiniture), ma di solito non supera gli 8 m, in quanto è limitata per fogli sottili da il loro rapido raffreddamento durante il processo di laminazione e, per fogli spessi, in base al peso del lingotto .
La lamiera di ferro di spessore inferiore a 1 mm è chiamata banda stagnata; è usato per fare banda stagnata e come materiale di copertura. A quest'ultimo scopo, in URSS, vengono laminati fogli con dimensioni di 1422x711 mm, del peso di 4-5 kg, con uno spessore di 0,5-0,625 mm. Il ferro per coperture è prodotto dalle fabbriche in confezioni del peso di 82 kg. All'estero, la latta nera è classificata in commercio in base a speciali numeri di calibro - da 20 a 30 (lo spessore normale della latta tedesca va da 0,875 a 0,22 mm e inglese - da 1,0 a 0,31 mm). Lo stagno è ottenuto dalla ghisa più tenera, contenente 0,08-0,10% di C, 0,3-0,35% di Mn, se è fatto di ghisa a carbone (ce l'abbiamo) e 0,4-0,5% di Mn, se il materiale di partenza è coke di maiale ferro da stiro; resistenza allo strappo - da 31 a 34 kg / mm 2, allungamento - 28-30%. Una varietà di lamiera è di ferro ondulato (ondulato). È diviso secondo la natura delle onde in ferro con onde basse e alte; nel primo il rapporto tra larghezza e profondità dell'onda varia da 3 a 4, nel secondo da 1 a 2. Il ferro ondulato è realizzato con uno spessore di 0,75-2,0 mm e una larghezza della lamiera di 0,72-0,81 m (con onde basse) e 0,4-0,6 m (con onde alte). Il ferro ondulato viene utilizzato per tetti, pareti di strutture leggere, persiane e con onde alte, inoltre, viene utilizzato per la costruzione di soffitti senza travi.
Il ferro profilato è diviso in due classi in base alla forma della sezione trasversale: ferro profilato ordinario e sagomato.
La prima classe comprende il ferro tondo (con diametro inferiore a 10 mm detto filo), quadro, piatto o piatto. Quest'ultimo, a sua volta, è suddiviso in: la striscia stessa - larga da 10 a 200 mm e spessa più di 5 mm; cerchio - la stessa larghezza, ma con uno spessore da 5 a 1 mm, indicato dal numero di calibro (dal 3 al 19 tedesco normale e dal 6 al 20 nuovo calibro inglese); pneumatico - da 38 a 51 mm di larghezza e fino a 22 mm di spessore; universale - da 200 a 1000 mm di larghezza e almeno 6 mm di spessore (arrotolato in rotoli speciali - universale). Sia i pneumatici che i cerchi in ferro sono prodotti da fabbriche in pendenza, filo laminato - in bobine; altri gradi - sotto forma di strisce diritte (raddrizzate), di solito non più lunghe di 8 m (normale - da 4,5 a 6 m), ma su ordine speciale per strutture in calcestruzzo, le strisce vengono tagliate fino a 18 mm di lunghezza e talvolta di più .
I principali tipi di ferro sagomato: angolare (equilatero e disuguale), scatolare (canale), tee, trave a I (trave), colonna (quadrato) e ferro zet; esistono anche altri tipi meno comuni di ferro sagomato. Secondo il nostro normale assortimento metrico, le dimensioni del ferro sagomato sono indicate dal numero del profilo (# - il numero, vedi la larghezza del ripiano o l'altezza massima del profilo). Angolare disuguale e tee iron hanno un numero doppio; ad esempio, N. 16/8 significa angolo con ripiani da 16 e 8 cm o tee con un ripiano di 16 cm e un'altezza del tee di 8 cm - doppio tee.
La composizione del normale ferro sezionale saldabile: 0,12% C, 0,4% Mn, meno dello 0,05% P e S - ciascuno; la sua resistenza allo strappo è di 34-40 kg/mm 2 ; ma il ferro tondo per rivetti è costituito da un materiale di composizione più morbido: meno dello 0,10% C, 0,25-0,35% Mn, circa 0,03% P e S ciascuno. Carico di rottura 32-35 kg/mm2 e allungamento 28-32%. Il ferro sagomato non saldabile, ma rivettato ("acciaio da costruzione") contiene: 0,15 - 0,20% C, 0,5% Mn, fino allo 0,06% P e S - ciascuno; la sua resistenza allo strappo è di 40-50 kg/mm 2 , l'allungamento è del 25-20%. Per la produzione di noci si produce ferro (Thomas), contenente circa lo 0,1% di C, ma dallo 0,3 allo 0,5% di P (più grandi sono le noci, più P). All'estero, per soddisfare le esigenze di laminatoi speciali, circola in commercio un prodotto semilavorato: una billetta quadrata, solitamente di sezione 50 x 50 mm.
È noto alle persone fin dall'antichità: gli scienziati attribuiscono antichi oggetti domestici realizzati con questo materiale al IV millennio a.C.
La vita umana non può essere immaginata senza ferro. Si ritiene che il ferro sia utilizzato per scopi industriali più spesso di altri metalli. Le strutture più importanti sono fatte da esso. Il ferro si trova anche in piccole quantità nel sangue. È il contenuto del ventiseiesimo elemento che colora il sangue di rosso.
Proprietà fisiche del ferro
In ossigeno, il ferro brucia per formare un ossido:
3Fe + 2O₂ = Fe₃O₄.
Quando riscaldato, il ferro può reagire con i non metalli:
Inoltre, a una temperatura di 700-900 ° C, reagisce con il vapore acqueo:
3Fe + 4H₂O = Fe₃O₄ + 4H₂.
Composti di ferro
Come sapete, gli ossidi di ferro hanno ioni con due stati di ossidazione: +2 e + 3. È estremamente importante saperlo, perché per elementi diversi verranno eseguite reazioni qualitative completamente diverse.
Reazioni qualitative al ferro
È necessaria una reazione qualitativa per determinare facilmente la presenza di ioni di una sostanza in soluzioni o impurità di un'altra. Considera le reazioni qualitative del ferro ferroso e ferrico.
Reazioni qualitative per il ferro (III)
Il contenuto di ioni ferrici in una soluzione può essere determinato utilizzando alcali. Con un risultato positivo, si forma una base: idrossido di ferro (III) Fe (OH) ₃.
 Idrossido di ferro(III) Fe(OH)₃
Idrossido di ferro(III) Fe(OH)₃
La sostanza risultante è insolubile in acqua e ha un colore marrone. È il precipitato marrone che può indicare la presenza di ioni ferrici nella soluzione:
FeCl3 + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Gli ioni Fe(III) possono anche essere determinati utilizzando K3.
Una soluzione di cloruro ferrico viene miscelata con una soluzione salina giallastra. Di conseguenza, puoi vedere un bellissimo precipitato bluastro, che indicherà la presenza di ioni ferrici nella soluzione. troverete spettacolari esperimenti sullo studio delle proprietà del ferro.
Reazioni qualitative per il ferro (II)
Gli ioni Fe²⁺ reagiscono con il sale rosso sangue K₄. Se quando si aggiunge il sale si forma un precipitato bluastro, questi ioni sono presenti nella soluzione.

Ferro da stiro(latino ferrum), fe, un elemento chimico del gruppo viii del sistema periodico di Mendeleev; numero atomico 26, massa atomica 55,847; metallo bianco argentato lucido. L'elemento in natura è costituito da quattro isotopi stabili: 54 fe (5,84%), 56 fe (91,68%), 57 fe (2,17%) e 58 fe (0,31%).
Riferimento storico. Il ferro era conosciuto in epoca preistorica, ma ha trovato ampia applicazione molto più tardi, poiché è estremamente raro in natura allo stato libero e la sua produzione dai minerali è diventata possibile solo a un certo livello di sviluppo tecnologico. Probabilmente, per la prima volta, una persona ha conosciuto il ferro meteorico, come dimostrano i suoi nomi nelle lingue dei popoli antichi: l'antico egiziano "beni-pet" significa "ferro celeste"; l'antico greco sideros è associato al latino sidus (genitivo sideris) - una stella, un corpo celeste. Nei testi ittiti del XIV secolo. AVANTI CRISTO e. Zh. è menzionato come un metallo caduto dal cielo. Nelle lingue romanze è stata conservata la radice del nome dato dai romani (ad esempio, il francese fer, l'italiano ferro).
Il metodo per ottenere ferro dai minerali fu inventato nella parte occidentale dell'Asia nel II millennio a.C. e.; successivamente l'uso di Zh. si diffuse in Babilonia, in Egitto e in Grecia; per cambiare Età del bronzoè venuto età del ferro. Omero (nel 23° canto dell'Iliade) racconta che Achille premiò il vincitore di una gara di lancio del disco con un disco dal grido di ferro. In Europa e nell'antica Rus' per molti secoli, Zh processo di formaggio. Il minerale di ferro veniva ridotto con carbone in una fornace costruita in una fossa; l'aria veniva pompata nella fornace con il soffietto, il prodotto di riduzione - kritsu veniva separato dalle scorie con colpi di martello e da esso venivano forgiati vari prodotti. Man mano che i metodi di soffiaggio venivano migliorati e l'altezza del focolare aumentava, la temperatura del processo aumentava e parte del ferro veniva carburato, cioè risultava ghisa; questo prodotto relativamente fragile era considerato un prodotto di scarto. Da qui il nome ghisa, ghisa - ghisa inglese. Successivamente, si è notato che quando nel focolare non viene caricato minerale di ferro, ma ghisa, si ottiene anche una fioritura di ferro a basso tenore di carbonio e un tale processo a due stadi si è rivelato più redditizio di quello grezzo soffiato. Nel XII-XIII secolo. il metodo dell'urlo era già diffuso. Nel XIV secolo la ghisa iniziò a essere fusa non solo come semilavorato per ulteriori lavorazioni, ma anche come materiale per la fusione di vari prodotti. Allo stesso periodo risale anche la ricostruzione del focolare in forno a tino (“domnitsa”), e poi in altoforno. A metà del XVIII secolo in Europa, il processo crogiolo per ottenere diventare, che era conosciuto sul territorio della Siria nel primo periodo del Medioevo, ma in seguito si rivelò essere dimenticato. Con questo metodo si otteneva l'acciaio fondendo miscele metalliche in piccoli recipienti (crogioli) da una massa altamente refrattaria. Nell'ultimo quarto del XVIII sec Il processo di ridistribuzione della ghisa in ferro iniziò a svilupparsi sul focolare di una fornace a riverbero ardente. La rivoluzione industriale del XVIII e dell'inizio del XIX secolo, l'invenzione della macchina a vapore e la costruzione di ferrovie, grandi ponti e flotte a vapore crearono un enorme bisogno di ferro e delle sue leghe. Tuttavia, tutti i metodi esistenti per produrre ferro non potevano soddisfare le esigenze del mercato. La produzione in serie di acciaio iniziò solo a metà del XIX secolo, quando furono sviluppati i processi Bessemer, Thomas e a focolare aperto. Nel 20 ° secolo il processo di produzione dell'acciaio elettrico è nato e si è diffuso, dando acciaio di alta qualità.
distribuzione in natura. In termini di contenuto nella litosfera (4,65% in peso), l'alluminio è al secondo posto tra i metalli (l'alluminio è al primo posto). Migra vigorosamente nella crosta terrestre, formando circa 300 minerali (ossidi, solfuri, silicati, carbonati, titanati, fosfati, ecc.). Zh. prende parte attiva ai processi magmatici, idrotermali e supergenici, che sono associati alla formazione di vari tipi dei suoi depositi. Zh. - metallo delle profondità terrestri, si accumula nelle prime fasi della cristallizzazione del magma, nelle rocce ultrabasiche (9,85%) e basiche (8,56%) (nei graniti è solo il 2,7%). Nella biosfera, il ferro si accumula in molti sedimenti marini e continentali, formando minerali sedimentari.
Un ruolo importante nella geochimica del ferro è svolto dalle reazioni redox: la transizione del ferro bivalente al ferro trivalente e viceversa. Nella biosfera, in presenza di sostanze organiche, fe 3+ si riduce a fe 2+ e migra facilmente, e quando incontra l'ossigeno atmosferico, fe 2+ si ossida, formando accumuli di idrossidi di ferro 3-valente. Il ferro 3-valente ha i colori rosso, giallo, marrone. Ciò determina il colore di molte rocce sedimentarie e il loro nome - "formazione di colore rosso" (argille e argille rosse e marroni, sabbie gialle, ecc.).
Proprietà fisiche e chimiche. Il valore di Zh. nella tecnologia moderna è determinato non solo dalla sua ampia distribuzione in natura, ma anche da una combinazione di proprietà molto preziose. È di plastica, facilmente forgiabile sia a freddo che a caldo, può essere arrotolato, stampato e trafilato. La capacità di dissolvere il carbonio e altri elementi serve come base per ottenere varie leghe di ferro.
Zh può esistere sotto forma di due reticoli cristallini: a - e g - cubico centrato sul corpo (bcc) e cubico centrato sulla faccia (fcc). Al di sotto di 910 °C, a - fe è stabile con un reticolo bcc (a = 2,86645 å a 20 °C). Tra 910°C e 1400°C, la g-modifica con il reticolo fcc è stabile (a = 3.64 å). Sopra i 1400°C si forma nuovamente il reticolo bcc d-fe (a = 2.94 å), stabile fino al punto di fusione (1539°C). a - fe ferromagnetico fino a 769°C (punto di Curie). Le modifiche g -fe e d -fe sono paramagnetiche.
Le trasformazioni polimorfiche del ferro e dell'acciaio durante il riscaldamento e il raffreddamento furono scoperte nel 1868 da D.K. Černov. Il carbonio si forma con J. soluzioni solide interstiziali, in cui gli atomi di C con un piccolo raggio atomico (0,77 å) si trovano negli interstizi del reticolo cristallino metallico, che consiste di atomi più grandi (raggio atomico fe 1,26 å). Una soluzione solida di carbonio in g -fe chiamata. austenite, e in (a -fe- ferrite. Soluzione solida satura di carbonio in g - fe contiene 2,0% C in massa a 1130°C; a-fe dissolve solo lo 0,02-0,04% C a 723°C e meno dello 0,01% a temperatura ambiente. Pertanto, quando indurimento si forma austenite martensite - soluzione solida sovrasatura di carbonio in a - fe, molto dura e fragile. combinazione di indurimento con vacanza(riscaldando a temperature relativamente basse per ridurre le sollecitazioni interne) consente di conferire all'acciaio la combinazione richiesta di durezza e duttilità.
Le proprietà fisiche dello zinco dipendono dalla sua purezza. Di norma, i materiali ferrosi industriali sono accompagnati da impurità di carbonio, azoto, ossigeno, idrogeno, zolfo e fosforo. Anche a concentrazioni molto basse, queste impurità modificano notevolmente le proprietà del metallo. Quindi, lo zolfo provoca il cosiddetto. fragilità rossa, fosforo (anche 10 -20% P) - fragilità fredda; riduzione di carbonio e azoto plastica, e l'idrogeno aumenta fragilità Zh.(la cosiddetta fragilità da idrogeno). Riducendo il contenuto di impurità a 10 -7 - Il 10 -9% porta a cambiamenti significativi nelle proprietà del metallo, in particolare ad un aumento della duttilità.
Di seguito sono riportate le proprietà fisiche dello zinco, relative principalmente ad un metallo con un contenuto totale di impurità inferiore allo 0,01% in peso:
Raggio atomico 1,26 å
Raggi ionici fe 2+ o.80 å, fe 3+ o.67 å
Densità (20°C) 7.874 g/cm 3
tpl 1539°С
t kip circa 3200 oC
Coefficiente di temperatura di dilatazione lineare (20°C) 11,7 10 -6
Conducibilità termica (25°C) 74.04 Mar/(m K)
La capacità termica di un liquido dipende dalla sua struttura e varia con la temperatura in modo complesso; capacità termica specifica media (0-1000 oc) 640,57 j/(kg·A) .
Resistività elettrica (20°C)
9,7 10 -8 ohm m
Coefficiente di temperatura della resistenza elettrica
(0-100°C) 6,51 10 -3
Modulo di Young 190-210 10 3 Mn/m 2
(19-21 10 3 kgf/mm 2)
Coefficiente di temperatura del modulo di Young
Modulo di taglio 84,0 10 3 MN/m2
Resistenza alla trazione a breve termine
170-210 MN/m2
Allungamento relativo 45-55%
Durezza Brinell 350-450 MN/m2
Forza di snervamento 100 MN/m2
Forza d'urto 300 MN/m2
La configurazione del guscio elettronico esterno dell'atomo fe 3 d 6 4s 2 . Zh. esibisce valenza variabile (i composti più stabili sono Zh. 2 e 3 valenti). Con l'ossigeno, il ferro forma feo ossido, fe 2 o 3 ossido e fe 3 o 4 ossido (composto feo con fe 2 o 3 , avente la struttura spinelli) . In aria umida a temperature ordinarie, il ferro si ricopre di ruggine sciolta (fe 2 o 3 n h2o). A causa della sua porosità, la ruggine non impedisce l'accesso di ossigeno e umidità al metallo e quindi non lo protegge da ulteriore ossidazione. A causa di vari tipi di corrosione, ogni anno vengono perse milioni di tonnellate di ferro: quando il ferro viene riscaldato in aria secca a una temperatura superiore a 200°C, viene ricoperto da un sottile film di ossido, che protegge il metallo dalla corrosione a temperature normali; questa è la base del metodo tecnico di protezione di J. - blu. Quando viene riscaldato in vapore acqueo, il ferro viene ossidato per formare fe 3 o 4 (sotto i 570°C) o feo (sopra i 570°C) e rilasciare idrogeno.
L'idrossido fe (oh) 2 si forma come un precipitato bianco per azione di alcali caustici o ammoniaca su soluzioni acquose di sali fe 2+ in un'atmosfera di idrogeno o azoto. A contatto con l'aria, fe (oh) 2 diventa prima verde, poi annerisce e infine si trasforma rapidamente in idrossido rosso-marrone fe (oh) 3 . L'ossido di feo presenta proprietà di base. Ossido fe 2 o 3 anfotero e con funzione debolmente acida; reagendo con ossidi più basici (ad esempio con mgo), forma ferriti - composti del tipo fe 2 o 3 n meo, che hanno proprietà ferromagnetiche e sono ampiamente utilizzate nell'elettronica radio. Le proprietà acide sono espresse anche nel ferro 6-valente, che esiste sotto forma di ferrati, ad esempio k 2 feo 4 , sali di acido di ferro non isolati allo stato libero.
Zh. reagisce facilmente con alogeni e alogenuri di idrogeno, dando sali, ad esempio cloruri fecl 2 e fecl 3. Quando il ferro viene riscaldato con zolfo, si formano solfuri fes e fes 2. Carburi Zh. - fe 3 c ( cementite) e fe 2 c (e-carburo) - precipitato da soluzioni solide di carbonio in liquido al raffreddamento. fe 3 c viene rilasciato anche da soluzioni di carbonio in ferro liquido ad alte concentrazioni di carbonio L'azoto, come il carbonio, fornisce soluzioni solide interstiziali con ferro; da essi spiccano i nitruri fe 4 n e fe 2 n. Con l'idrogeno, l'idrogeno dà solo idruri instabili, la cui composizione non è stata determinata con precisione. Quando riscaldato, il ferro reagisce vigorosamente con silicio e fosforo, formando siliciuri (ad esempio fe 3 si) e fosfuri (ad esempio fe 3 p).
Zh. composti con molti elementi (O, s, ecc.), che formano una struttura cristallina, hanno una composizione variabile (ad esempio, il contenuto di zolfo nel monosolfuro può variare dal 50 al 53,3 at.%). Ciò è dovuto a difetti nella struttura cristallina. Ad esempio, nell'ossido di ferro, alcuni degli ioni fe 2+ nei siti del reticolo sono sostituiti da ioni fe 3+; per mantenere la neutralità elettrica, alcuni siti reticolari appartenenti agli ioni fe 2+ rimangono vuoti e la fase (wustite) in condizioni normali ha formula fe 0.947 o.
Stranamente, l'interazione di Zh l'acido nitrico. Hno 3 concentrato (densità 1.45 g/cm 3) passiva il ferro a causa della comparsa di un film protettivo di ossido sulla sua superficie; hno 3 più diluito dissolve il ferro con la formazione di ioni fe 2+ o fe 3+, recuperando a mh 3 o n 2 o e n 2 .
Le soluzioni di sali di ferro 2-valente sono instabili nell'aria - fe 2+ si ossida gradualmente a fe 3+. Soluzioni acquose di sali Zh idrolisi avere una reazione acida. L'aggiunta di ioni tiocianato scn - a soluzioni di sali di fe 3+ conferisce un colore rosso sangue brillante dovuto alla comparsa di fe (scn) 3, che consente di rivelare la presenza di 1 parte di fe 3+ in circa 10 6 parti d'acqua. Zh. è caratterizzato dall'istruzione composti complessi.
Ricevuta e domanda. Il ferro puro si ottiene in quantità relativamente piccole per elettrolisi di soluzioni acquose dei suoi sali o per riduzione dei suoi ossidi con idrogeno. È in fase di sviluppo un metodo per la produzione diretta di ferro dai minerali mediante elettrolisi delle fusioni. La produzione di ferro sufficientemente puro sta gradualmente aumentando mediante la sua riduzione diretta da concentrati di minerale con idrogeno, gas naturale o carbone a temperature relativamente basse.
Zh - il metallo più importante della tecnologia moderna. Il ferro non viene praticamente mai utilizzato nella sua forma pura a causa della sua bassa resistenza, anche se nella vita di tutti i giorni i prodotti in acciaio o ghisa sono spesso chiamati "ferro". La maggior parte del ferro viene utilizzata sotto forma di leghe molto diverse per composizione e proprietà. Le leghe di ferro rappresentano circa il 95% di tutti i prodotti in metallo. Le leghe ricche di carbonio (oltre il 2% in peso) - ghisa, vengono fuse in altiforni da minerali di ferro arricchiti. L'acciaio di vari gradi (contenuto di carbonio inferiore al 2% in peso) viene fuso dalla ghisa in forni e convertitori a focolare aperto ed elettrici ossidando (bruciando) il carbonio in eccesso, rimuovendo le impurità dannose (principalmente s, P, O) e aggiungendo elementi leganti. Gli acciai altolegati (con un alto contenuto di nichel, cromo, tungsteno e altri elementi) vengono fusi in forni ad arco elettrico ea induzione. Per la produzione di acciai e leghe di ferro di particolare importanza vengono utilizzati nuovi processi come la rifusione sottovuoto, la rifusione con elettroscoria, la fusione con plasma e fascio di elettroni, ecc.. Sono in fase di sviluppo metodi per la fusione dell'acciaio in unità a funzionamento continuo che garantiscono un'elevata qualità del metallo e automazione di processo.
Sulla base del ferro vengono creati materiali in grado di resistere agli effetti di alte e basse temperature, vuoto e alte pressioni, fluidi aggressivi, alte tensioni alternate, radiazioni nucleari, ecc. La produzione di ferro e delle sue leghe è in costante crescita. Nel 1971, 89,3 milioni di tonnellate furono fuse in URSS. t ghisa e 121 mln. t diventare.
L. A. Shvartsman, L. V. Vanyukova.
Il ferro come materiale artistico è stato utilizzato fin dall'antichità in Egitto (un poggiacapo dalla tomba di Tutankhamon vicino a Tebe, metà del XIV secolo a.C., Ashmolean Museum, Oxford), Mesopotamia (pugnali trovati vicino a Carchemish, 500 a.C., British Museum, Londra) , India (colonna di ferro a Delhi, 415). Fin dal Medioevo, nei paesi europei (Inghilterra, Francia, Italia, Russia, ecc.) sono stati conservati numerosi oggetti altamente artistici realizzati in Zh.: recinzioni forgiate, cardini delle porte, staffe a muro, banderuole, accessori per casse e lampade . I prodotti forgiati a base di ramoscelli e prodotti in lamiera forata (spesso con rivestimento in mica) si distinguono per le forme planari, una chiara silhouette grafica lineare e sono efficacemente visibili su uno sfondo leggero. Nel 20 ° secolo Zh. viene utilizzato per la fabbricazione di reticoli, recinzioni, tramezzi interni traforati, candelabri e monumenti.
T. L.
Ferro nel corpo. Zh. è presente negli organismi di tutti gli animali e nelle piante (in media circa lo 0,02%); è necessario principalmente per lo scambio di ossigeno e i processi ossidativi. Esistono organismi (i cosiddetti concentratori) che possono accumularlo in grandi quantità (ad esempio, batteri del ferro - fino al 17-20% W.). Quasi tutto il ferro negli organismi animali e vegetali è associato alle proteine. La mancanza di Zh causa un ritardo di crescita e il fenomeno clorosi delle piante, associato all'istruzione inferiore clorofilla. L'eccesso di ferro ha anche un effetto dannoso sullo sviluppo delle piante, causando, ad esempio, sterilità dei fiori di riso e clorosi. Nei terreni alcalini si formano composti di ferro inaccessibili alle radici delle piante, e le piante non lo ricevono in quantità sufficiente; nei terreni acidi, il ferro passa in composti solubili in eccesso. Con una carenza o un eccesso di composti assimilabili nei suoli, si possono osservare malattie delle piante in vaste aree.
Zh. entra nel corpo di animali e umani con il cibo (fegato, carne, uova, legumi, pane, cereali, spinaci e barbabietole ne sono i più ricchi). Normalmente, una persona riceve con una dieta di 60-110 mg Zh., che supera significativamente il suo fabbisogno giornaliero. L'assorbimento del ferro assunto con il cibo avviene nella parte superiore dell'intestino tenue, da dove entra nel sangue in forma legata alle proteine e viene trasportato con il sangue a vari organi e tessuti, dove si deposita sotto forma di ferro - un complesso proteico - ferritina. Il principale deposito di ferro nel corpo è il fegato e la milza. A causa della G. ferritina, si verifica la sintesi di tutti i composti contenenti ferro del corpo: un pigmento respiratorio viene sintetizzato nel midollo osseo emoglobina, nei muscoli mioglobina, nei vari tessuti citocromi e altri enzimi contenenti ferro. Zh. viene escreto dal corpo principalmente attraverso la parete dell'intestino crasso (nell'uomo, circa 6-10 mg al giorno) e in piccola parte dai reni. Il fabbisogno di grasso del corpo cambia con l'età e le condizioni fisiche. Per 1 kg di peso, i bambini hanno bisogno di - 0,6, adulti - 0,1 e donne incinte - 0,3 mg F. al giorno. Negli animali, il fabbisogno di grasso è di circa (per 1 kg sostanza secca della razione): per le vacche da latte - almeno 50 mg, per animali giovani - 30-50 mg, per suinetti - fino a 200 mg, per suini gravidi - 60 mg.
VV Kovalsky.
In medicina, i medicinali Zh. (Zh. ricostituito, lattato Zh., glicerofosfato Zh., solfato di Zh. 2-valente, compresse Blo, soluzione di acido malico, feramid, emostimulina, ecc.) sono usati nel trattamento di malattie accompagnate da una mancanza di Zh nel corpo (anemia da carenza di ferro), nonché tonico generale (dopo malattie infettive, ecc.). Gli isotopi Zh. (52 fe, 55 fe e 59 fe) sono usati come indicatori nella ricerca biomedica e nella diagnosi delle malattie del sangue (anemia, leucemia, policitemia, ecc.).
Illuminato.: Metallurgia generale, Mosca, 1967; Nekrasov B.V., Fondamenti di chimica generale, volume 3, M., 1970; Remi G., Corso di chimica inorganica, trad. dal tedesco, volume 2, M., 1966; Breve enciclopedia chimica, v. 2, M., 1963; Levinson N. R., [Prodotti di metalli non ferrosi e ferrosi], nel libro: Arte decorativa russa, volumi 1-3, M., 1962-65; Vernadsky V.I., Saggi biogeochimici. 1922-1932, M. - L., 1940; Granik S., Metabolismo del ferro negli animali e nelle piante, nella raccolta: Oligoelementi, trad. dall'inglese, M., 1962; Dixon M., Webb F., enzimi, trans. dall'inglese, M., 1966; neogi p., ferro nell'antica india, calcutta, 1914; amico j. n., ferro nell'antichità, l., 1926; franco e. b., vecchio ferro battuto francese, camb. (messa.), 1950; lister r., ferro battuto decorativo in gran bretagna, l., 1960.
scarica l'estratto
Ferro da stiro
FERRO DA STIRO-un; cfr.
1. Un elemento chimico (Fe), un metallo argenteo malleabile che si combina con il carbonio per formare acciaio e ghisa.
2. Il nome comune per l'acciaio dolce, un metallo color argento. Fucina Il vento scuote il ferro del tetto.
3. Su ciò che è forte, solido, forte (sulle qualità fisiche esterne). Hai le tue mani! // Su ciò che è duro, inflessibile (sulle qualità morali interne). Il suo carattere è.
4. Razg. Di un rimedio contenente sostanze ghiandolari. Il corpo manca di ferro. Bevi bene. Le mele contengono
5. Razg. tech. Hardware del computer (al contrario del software). Compra il ferro mancante.
◊ Brucia con il ferro caldo. Sradicare, distruggere qualcosa, ricorrendo a misure estreme, straordinarie. Colpisci mentre il ferro è caldo (vedi Forgia).
◁ Ferro da stiro; ghiandolare; pezzo di ferro; Ferro (vedi).
ferro da stiro(lat. Ferrum), un elemento chimico del gruppo VIII del sistema periodico. Metallo bianco argentato lucido. Forma modifiche polimorfiche; a temperatura ordinaria, α-Fe è stabile (reticolo cristallino - corpo cubico centrato) con una densità di 7,874 g/cm 3. α-Fe fino a 769°C (punto di Curie) ferromagnetico; t pl 1535°C. Si ossida all'aria - coperto di ruggine sciolta. Secondo la prevalenza degli elementi in natura, il ferro è al 4° posto; forma circa 300 minerali. Le leghe di ferro con carbonio e altri elementi rappresentano circa il 95% di tutti i prodotti metallici (ghisa, acciaio, ferroleghe). Nella sua forma pura, non viene praticamente utilizzato (nella vita di tutti i giorni, i prodotti in acciaio o ghisa sono spesso chiamati ferro). Necessario per la vita degli organismi animali; fa parte dell'emoglobina.
FERRO DA STIROFERRO (lat. Ferrum), Fe (leggi "ferrum"), elemento chimico, numero atomico 26, massa atomica 55,847. L'origine di entrambi i nomi latino e russo dell'elemento non è stata stabilita in modo univoco. Il ferro naturale è una miscela di quattro nuclidi (centimetro. NUCLIDE) con numeri di massa 54 (contenuto nella miscela naturale 5,82% in massa), 56 (91,66%), 57 (2,19%) e 58 (0,33%). Configurazione di due strati elettronici esterni 3 S 2
p 6
d 6
4s 2
. Di solito forma composti negli stati di ossidazione +3 (valenza III) e +2 (valenza II). Esistono anche composti noti con atomi di ferro negli stati di ossidazione +4, +6 e alcuni altri.
Nel sistema periodico di Mendeleev, il ferro è incluso nel gruppo VIIIB. Nel quarto periodo, a cui appartiene il ferro, questo gruppo comprende anche il cobalto. (centimetro. COBALTO) e nichel (centimetro. NICHEL). Questi tre elementi formano una triade e hanno proprietà simili.
Il raggio dell'atomo di ferro neutro è 0,126 nm, il raggio dello ione Fe 2+ è 0,080 nm e lo ione Fe 3+ è 0,067 nm. Le energie di ionizzazione successiva dell'atomo di ferro sono 7.893, 16.18, 30.65, 57, 79 eV. Affinità elettronica 0,58 eV. Sulla scala Pauling, l'elettronegatività del ferro è di circa 1,8.
Il ferro ad alta purezza è un metallo brillante, grigio-argenteo e duttile che si presta bene a vari metodi di lavorazione.
Essere nella natura
Nella crosta terrestre, il ferro è ampiamente distribuito: rappresenta circa il 4,1% della massa della crosta terrestre (4 ° posto tra tutti gli elementi, 2 ° tra i metalli). È noto un gran numero di minerali e minerali contenenti ferro. Minerale di ferro rosso (minerale di ematite (centimetro. EMATITE), Fe 2 O 3 ; contiene fino al 70% di Fe), minerale di ferro magnetico (minerale di magnetite (centimetro. MAGNETITE), Fe 3 O 4; contiene il 72,4% di Fe), minerale di ferro bruno (minerale hydrogoethite HFeO 2 n H 2 O), così come il minerale di ferro del longherone (minerale di siderite (centimetro. SIDERITE), carbonato di ferro, FeСО 3 ; contiene circa il 48% di Fe). Esistono anche grandi depositi di pirite in natura. (centimetro. PIRITE) FeS 2 (altri nomi sono pirite di zolfo, pirite di ferro, disolfuro di ferro e altri), ma i minerali con un alto contenuto di zolfo non sono ancora di importanza pratica. In termini di riserve di minerale di ferro, la Russia è al primo posto nel mondo. In acqua di mare 1 10 -5 -1 10 -8% di ferro.
Storia della produzione del ferro
Il ferro ha svolto e svolge un ruolo eccezionale nella storia materiale dell'umanità. Il primo ferro metallico caduto nelle mani dell'uomo era probabilmente di origine meteorica. I minerali di ferro sono molto diffusi e spesso si trovano anche sulla superficie della Terra, ma il ferro nativo in superficie è estremamente raro. Probabilmente, qualche migliaio di anni fa, una persona ha notato che dopo aver bruciato un incendio, in alcuni casi si osserva la formazione di ferro da quei pezzi di minerale che sono caduti accidentalmente in un incendio. Quando si brucia un incendio, la riduzione del ferro dal minerale avviene a causa della reazione del minerale sia direttamente con il carbone che con il monossido di carbonio (II) CO formatosi durante la combustione. La possibilità di ottenere ferro dai minerali ha notevolmente facilitato la scoperta del fatto che riscaldando il minerale con il carbone si forma un metallo che può essere ulteriormente raffinato durante la forgiatura. L'ottenimento del ferro dal minerale utilizzando un processo di produzione del formaggio fu inventato nell'Asia occidentale nel II millennio a.C. e. Periodo dal IX al VII sec. AVANTI CRISTO e., quando la metallurgia del ferro si sviluppò tra molte tribù dell'Europa e dell'Asia, fu chiamata l'età del ferro, (centimetro. ETÀ DEL FERRO) successivo all'età del bronzo (centimetro. ETÀ DEL BRONZO). Il miglioramento dei metodi di soffiatura (il tiraggio naturale fu sostituito dalle pellicce) e l'aumento dell'altezza del focolare (apparvero i forni a pozzo basso) portarono alla produzione di ghisa, che iniziò ad essere ampiamente fusa nell'Europa occidentale dal XIV secolo secolo. La ghisa risultante è stata trasformata in acciaio. Dalla metà del 18° secolo, il coke di carbone iniziò ad essere utilizzato nel processo dell'altoforno al posto del carbone. (centimetro. COCA COLA). In futuro, i metodi per produrre ferro dai minerali sono stati notevolmente migliorati e attualmente vengono utilizzati dispositivi speciali per questo: altiforni, convertitori di ossigeno, forni elettrici ad arco.
Proprietà fisiche e chimiche
A temperature dalla temperatura ambiente a 917 °C, così come nell'intervallo di temperatura 1394-1535 °C, a-Fe esiste con un reticolo cubico a corpo centrato; a temperatura ambiente, il parametro del reticolo un = 0,286645nm. A temperature di 917-1394 ° C, b-Fe è stabile con un reticolo cubico centrato sulla faccia T (a = 0,36468 nm). A temperature dalla temperatura ambiente a 769 °C (il cosiddetto punto di Curie (centimetro. PUNTO DI CURIE)) il ferro ha forti proprietà magnetiche (si dice che sia ferromagnetico), a temperature più elevate il ferro si comporta come un paramagnete. A volte paramagnetico a-Fe con reticolo cubico a corpo centrato, stabile a temperature da 769 a 917 ° C, è considerato come la g-modifica del ferro, e b-Fe, stabile ad alte temperature (1394-1535 ° C), è tradizionalmente chiamato d- Fe (l'idea dell'esistenza di quattro modificazioni del ferro - a, b, g e d- è nata quando l'analisi di diffrazione dei raggi X non esisteva ancora e non c'erano informazioni oggettive sulla struttura interna di ferro da stiro). Punto di fusione 1535 ° C, punto di ebollizione 2750 ° C, densità 7,87 g / cm 3. Il potenziale standard della coppia Fe 2+ /Fe 0 è -0,447V, la coppia Fe 3+ /Fe 2+ è +0,771V.
Se immagazzinato all'aria a temperature fino a 200 °C, il ferro viene gradualmente ricoperto da una densa pellicola di ossido, che impedisce l'ulteriore ossidazione del metallo. Nell'aria umida, il ferro è ricoperto da uno strato sciolto di ruggine, che non impedisce l'accesso di ossigeno e umidità al metallo e la sua distruzione. La ruggine non ha una composizione chimica costante; approssimativamente la sua formula chimica può essere scritta come Fe 2 O 3 xH 2 O.
Il ferro reagisce con l'ossigeno quando viene riscaldato. Quando il ferro viene bruciato nell'aria, si forma l'ossido di Fe 2 O 3; quando viene bruciato nell'ossigeno puro, si forma l'ossido di Fe 3 O 4. Quando l'ossigeno o l'aria passano attraverso il ferro fuso, si forma l'ossido di FeO. Quando lo zolfo e la polvere di ferro vengono riscaldati, si forma il solfuro, la cui formula approssimativa può essere scritta come FeS.
Il ferro reagisce con gli alogeni quando viene riscaldato (centimetro. ALOGENI). Poiché FeF 3 non è volatile, il ferro è resistente al fluoro fino a una temperatura di 200-300°C. Quando il ferro viene clorurato (a una temperatura di circa 200°C), si forma FeCl 3 volatile. Se l'interazione di ferro e bromo procede a temperatura ambiente o con riscaldamento e pressione di vapore di bromo elevata, si forma FeBr 3. Quando riscaldato, FeCl 3 e, in particolare, FeBr 3 separano l'alogeno e si trasformano in alogenuri di ferro (II). Quando ferro e iodio interagiscono, si forma lo ioduro di Fe 3 I 8 .
Quando riscaldato, il ferro reagisce con l'azoto, formando nitruro di ferro Fe 3 N, con fosforo, formando fosfuri FeP, Fe 2 P e Fe 3 P, con carbonio, formando carburo Fe 3 C, con silicio, formando diversi siliciuri, ad esempio FeSi .
A pressione elevata, il ferro metallico reagisce con il monossido di carbonio CO e il liquido, in condizioni normali, si forma ferro pentacarbonil Fe (CO) 5 facilmente volatile. Sono noti anche carbonili di ferro delle composizioni Fe 2 (CO) 9 e Fe 3 (CO) 12. I carbonili di ferro servono come materiali di partenza nella sintesi di composti organo-ferrosi, compreso il ferrocene (centimetro. FERROCENE) composizione.
Il ferro metallico puro è stabile in acqua e in soluzioni alcaline diluite. Negli acidi solforico e nitrico concentrati, il ferro non si dissolve, poiché un forte film di ossido ne passiva la superficie.
Con acido cloridrico e acido solforico diluito (circa il 20%), il ferro reagisce formando sali di ferro (II):
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Quando il ferro interagisce con circa il 70% di acido solforico, la reazione procede con la formazione di solfato di ferro (III):
2Fe + 4H 2 SO 4 \u003d Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
L'ossido di ferro (II) FeO ha proprietà di base, corrisponde alla base Fe (OH) 2. L'ossido di ferro (III) Fe 2 O 3 è debolmente anfotero, corrisponde a una base Fe (OH) 3 ancora più debole di Fe (OH) 2, che reagisce con gli acidi:
2Fe(OH)3 + 3H2SO4 = Fe2 (SO4)3 + 6H2O
L'idrossido di ferro (III) Fe(OH) 3 presenta proprietà debolmente anfotere; è in grado di reagire solo con soluzioni alcaline concentrate:
Fe (OH) 3 + KOH \u003d K
Gli idrossicomplessi di ferro (III) così formati sono stabili in soluzioni fortemente alcaline. Quando le soluzioni vengono diluite con acqua, vengono distrutte e precipita l'idrossido di ferro (III) Fe (OH) 3.
I composti di ferro (III) in soluzione sono ridotti dal ferro metallico:
Fe + 2FeCl 3 \u003d 3FeCl 2
Quando si conservano soluzioni acquose di sali di ferro (II), si osserva l'ossidazione del ferro (II) in ferro (III):
4FeCl 2 + O 2 + 2H 2 O \u003d 4Fe (OH) Cl 2
Dei sali di ferro (II) in soluzioni acquose, il sale di Mohr è stabile: doppio solfato di ammonio e ferro (II) (NH 4) 2 Fe (SO 4) 2 6H 2 O.
Il ferro (III) è in grado di formare doppi solfati con cationi di tipo allume a carica singola, ad esempio KFe (SO 4) 2 - allume di ferro di potassio, (NH 4) Fe (SO 4) 2 - allume di ferro ammonio, ecc.
Sotto l'azione del cloro gassoso o dell'ozono su soluzioni alcaline di composti di ferro (III), si formano composti di ferro (VI) - ferrati, ad esempio ferrato di potassio (VI) K 2 FeO 4. Ci sono rapporti sulla produzione di composti di ferro (VIII) sotto l'azione di forti agenti ossidanti.
Per rilevare i composti di ferro (III) in soluzione, viene utilizzata una reazione qualitativa di ioni Fe 3+ con ioni tiocianato CNS -. Quando gli ioni Fe 3+ interagiscono con gli anioni CNS, si forma il tiocianato di ferro rosso vivo Fe(CNS) 3. Un altro reagente per gli ioni Fe 3+ è l'esacianoferrato di potassio (II) K 4 (in precedenza questa sostanza era chiamata sale del sangue giallo). Quando gli ioni Fe 3+ e 4- interagiscono, si forma un precipitato blu brillante.
Una soluzione di esacianoferrato di potassio (III) K 3, precedentemente chiamata sale rosso sangue, può servire come reagente per gli ioni Fe 2+ in soluzione. Durante l'interazione degli ioni Fe 3+ e 3-, precipita un precipitato blu brillante della stessa composizione come nel caso dell'interazione degli ioni Fe 3+ e 4-.
Leghe di ferro con carbonio
Il ferro viene utilizzato principalmente nelle leghe, principalmente nelle leghe con carbonio - varie ghise e acciai. Nella ghisa il contenuto di carbonio è superiore al 2,14% in massa (solitamente al livello del 3,5-4%), negli acciai il contenuto di carbonio è inferiore (solitamente al livello dello 0,8-1%).
La ghisa si ottiene negli altiforni. L'altoforno è un gigantesco tronco di cono (alto fino a 30-40 m), cavo all'interno. Le pareti dell'altoforno sono rivestite dall'interno con mattoni refrattari, lo spessore della muratura è di diversi metri. Dall'alto, minerale di ferro arricchito (liberato dalla roccia di scarto), coke agente riducente (gradi speciali di antracite sottoposti a coke - riscaldato a una temperatura di circa 1000 ° C senza aria), nonché materiali di fusione (calcare e altri) che contribuire alla separazione dalle impurità del metallo fuso - scorie. Dal basso, il getto d'aria (ossigeno puro o aria arricchita di ossigeno) viene immesso nell'altoforno. Man mano che i materiali caricati nell'altoforno scendono, la loro temperatura sale a 1200-1300 °C. Come risultato delle reazioni di riduzione che si verificano principalmente con la partecipazione di coke C e CO:
Fe 2 O 3 + 3C \u003d 2Fe + 3CO;
Fe2O3 + 3CO = 2Fe + 3CO 2
si forma il ferro metallico, che è saturo di carbonio e scorre verso il basso.
Questo fuso viene periodicamente scaricato dall'altoforno attraverso un foro speciale - un foro di rubinetto - e il fuso viene lasciato solidificare in forme speciali. La ghisa è bianca, la cosiddetta ghisa grezza (è usata per produrre acciaio) e grigia, o ghisa. La ghisa bianca è una soluzione solida di carbonio nel ferro. I microcristalli di grafite possono essere distinti nella microstruttura della ghisa grigia. A causa della presenza di grafite, la ghisa grigia lascia un segno sulla carta bianca.
La ghisa è fragile, punge all'impatto, quindi non è possibile ricavarne molle, molle e tutti i prodotti che devono lavorare in flessione.
La ghisa piena è più leggera della ghisa fusa, quindi quando si solidifica non si contrae (come è normale con la solidificazione di metalli e leghe), ma si espande. Questa funzione consente di realizzare varie fusioni dalla ghisa, incluso l'utilizzo come materiale per la fusione artistica.
Se il contenuto di carbonio nella ghisa viene ridotto all'1,0-1,5%, si forma l'acciaio. Gli acciai sono al carbonio (in tali acciai non ci sono altri componenti tranne Fe e C) e legati (tali acciai contengono additivi di cromo, nichel, molibdeno, cobalto e altri metalli che migliorano le proprietà meccaniche e di altro tipo dell'acciaio).
L'acciaio si ottiene dalla lavorazione di ghisa e rottami metallici in un convertitore di ossigeno, in un arco elettrico o in un forno a focolare aperto. Con tale lavorazione, il contenuto di carbonio nella lega viene ridotto al livello richiesto, come si suol dire, il carbonio in eccesso brucia.
Le proprietà fisiche dell'acciaio differiscono in modo significativo dalle proprietà della ghisa: l'acciaio è elastico, può essere forgiato, laminato. Poiché l'acciaio, a differenza della ghisa, si contrae durante la solidificazione, i getti di acciaio risultanti sono sottoposti a compressione nei laminatoi. Dopo la laminazione, vuoti e gusci scompaiono nel volume del metallo, che è apparso durante la solidificazione delle fusioni.
La produzione di acciaio in Russia ha tradizioni lunghe e profonde e gli acciai ottenuti dai nostri metallurgisti sono di alta qualità.
L'uso del ferro, delle sue leghe e dei suoi composti
Il ferro puro ha usi piuttosto limitati. Viene utilizzato nella produzione di nuclei di elettromagneti, come catalizzatore per processi chimici e per altri scopi. Ma le leghe di ferro - ghisa e acciaio - costituiscono la base della tecnologia moderna. Anche molti composti del ferro sono ampiamente utilizzati. Quindi, il solfato di ferro (III) viene utilizzato nel trattamento delle acque, gli ossidi di ferro e il cianuro fungono da pigmenti nella produzione di coloranti e così via.
ferro nel corpo
Il ferro è presente in tutte le piante e gli animali come oligoelemento. (centimetro. MICROELEMENTI) cioè in quantità molto piccole (circa lo 0,02% in media). Tuttavia, i batteri del ferro (centimetro. BATTERI DEL FERRO), utilizzando l'energia di ossidazione del ferro (II) a ferro (III) per la chemiosintesi (centimetro. CHEMIOSINTESI), possono accumulare fino al 17-20% di ferro nelle loro cellule. La principale funzione biologica del ferro è la partecipazione al trasporto dell'ossigeno e ai processi ossidativi. Il ferro svolge questa funzione come parte di proteine complesse - emoproteine. (centimetro. EMOPROTEIDI), il cui gruppo protesico è il complesso della porfirina di ferro - eme (centimetro. GEMME). Tra le emoproteine più importanti, i pigmenti respiratori sono l'emoglobina. (centimetro. EMOGLOBINA) e mioglobina (centimetro. MIOGLOBINA) portatori di elettroni universali nelle reazioni di respirazione cellulare, ossidazione e fotosintesi del citocromo, (centimetro. CITOCROMI) enzimi catalosio e perossido e altri. In alcuni invertebrati, i pigmenti respiratori contenenti ferro eloeritrina e clorocruorina hanno una struttura diversa dalle emoglobine. Durante la biosintesi delle emoproteine, il ferro passa loro dalla ferritina proteica (centimetro. FERRITINA) che immagazzina e trasporta il ferro. Questa proteina, una molecola della quale comprende circa 4.500 atomi di ferro, è concentrata nel fegato, nella milza, nel midollo osseo e nella mucosa intestinale dei mammiferi e dell'uomo. Il fabbisogno umano giornaliero di ferro (6-20 mg) è coperto in eccesso dal cibo (carne, fegato, uova, pane, spinaci, barbabietole e altri sono ricchi di ferro). Il corpo di una persona media (peso corporeo 70 kg) contiene 4,2 g di ferro, 1 litro di sangue contiene circa 450 mg. Con una mancanza di ferro nel corpo, si sviluppa l'anemia ghiandolare, che viene trattata con farmaci contenenti ferro. I preparati di ferro sono usati anche come tonico generale. Una dose eccessiva di ferro (200 mg o più) può essere tossica. Il ferro è necessario anche per il normale sviluppo delle piante, quindi esistono microfertilizzanti a base di preparati di ferro.
Dizionario enciclopedico. 2009 .
Sinonimi:Guarda cos'è "ferro" in altri dizionari:
mer sala (s) zo sud., ovest. metallo, frantoio, fuso dal minerale sotto forma di ghisa e forgiato da quest'ultimo sotto un martello fiorito. Quando combinato con il carbonio, forma l'acciaio. Il ferro viene messo in vendita sotto forma di: nastro o di alta qualità; prima dritta... Dizionario esplicativo di Dahl
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0