È stato a lungo stabilito che tutti gli enzimi sono proteine e possiedono tutte le proprietà delle proteine. Pertanto, come le proteine, gli enzimi si dividono in semplici e complessi.
Enzimi semplici sono costituiti solo da aminoacidi - ad esempio, pepsina , trypsin , lisozima.
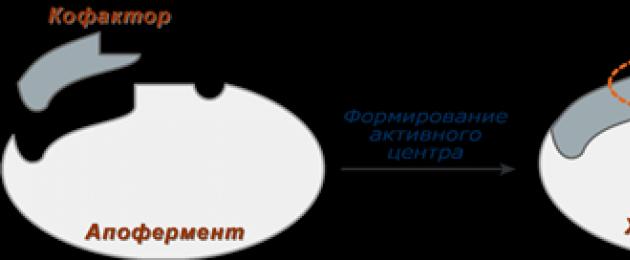
Enzimi complessi(oloenzimi) hanno una parte proteica costituita da aminoacidi - apoenzima, e una parte non proteica - cofattore. Esempi di enzimi complessi sono succinato deidrogenasi(contiene FAD), aminotransferasi(contengono piridossal fosfato), vari perossidasi(contengono eme), lattato deidrogenasi(contiene Zn 2+), amilasi(contiene Ca2+).
Cofattore, a sua volta, può essere chiamato un coenzima (NAD+, NADP+, FMN, FAD, biotina) o un gruppo prostetico (eme, oligosaccaridi, ioni metallici Fe2+, Mg2+, Ca2+, Zn2+).
La divisione in coenzimi e gruppi prostetici non è sempre chiara:
se la connessione del cofattore con la proteina è forte, in questo caso si parla di presenza gruppo prostetico,
ma se un derivato vitaminico funge da cofattore, allora viene chiamato coenzima, indipendentemente dalla forza della connessione.
Per effettuare la catalisi è necessario un complesso completo di apoproteina e cofattore non possono effettuare la catalisi separatamente; Il cofattore fa parte del centro attivo e partecipa al legame del substrato o alla sua trasformazione.
Come molte proteine, gli enzimi possono esserlo monomeri, cioè. sono costituiti da una subunità e polimeri, costituito da più subunità.
Organizzazione strutturale e funzionale degli enzimi
L'enzima contiene aree che svolgono diverse funzioni:
1. Centro attivo - una combinazione di residui di amminoacidi (solitamente 12-16) che fornisce un legame diretto alla molecola del substrato ed effettua la catalisi. I radicali di amminoacidi nel centro attivo possono trovarsi in qualsiasi combinazione, con amminoacidi situati nelle vicinanze che sono significativamente distanti tra loro nella catena lineare. Ci sono due regioni nel centro attivo:
- ancora(contatto, legame) – responsabile del legame e dell’orientamento del substrato nel centro attivo,
- catalitico– è direttamente responsabile dell’implementazione della reazione.
Diagramma della struttura dell'enzima
Gli enzimi che contengono più monomeri possono avere più centri attivi a seconda del numero di subunità. Inoltre, due o più subunità possono formare un sito attivo.
Negli enzimi complessi, i gruppi funzionali del cofattore si trovano necessariamente nel centro attivo.

Schema di formazione di un enzima complesso
2. Centro allosterico (allos- estraneo) è un centro di regolazione dell'attività enzimatica, che è spazialmente separato dal centro attivo e non è presente in tutti gli enzimi. Il legame al centro allosterico di qualsiasi molecola (chiamato attivatore o inibitore, nonché effettore, modulatore, regolatore) provoca un cambiamento nella configurazione della proteina enzimatica e, di conseguenza, nella velocità della reazione enzimatica.
Gli enzimi allosterici sono proteine polimeriche; i centri attivi e regolatori sono localizzati in diverse subunità.

Schema della struttura di un enzima allosterico
Tale regolatore può essere il prodotto di questa o di una delle reazioni successive, un substrato di reazione o un'altra sostanza (vedi “Regolazione dell'attività enzimatica”).
Isoenzimi
Gli isoenzimi sono forme molecolari dello stesso enzima che derivano da lievi differenze genetiche nella struttura primaria dell'enzima, ma catalizzano la stessa reazione. Gli isoenzimi sono diversi affinità al substrato, massimo velocità reazione catalizzata sensibilità agli inibitori e agli attivatori, condizioni lavoro (pH e temperatura ottimali).
Di regola, gli isoenzimi hanno quaternario struttura, cioè sono costituiti da due o più subunità. Ad esempio, l'enzima dimerico creatina chinasi (CK) è rappresentato da tre forme isoenzimatiche composte da due tipi di subunità: M (eng. muscolo– muscolo) e B (ing. cervello- cervello). La creatina chinasi-1 (CK-1) è costituita da subunità di tipo B ed è localizzata nel cervello, la creatina chinasi-2 (CK-2) - ciascuna una subunità M e una B, attiva nel miocardio, la creatina chinasi-3 ( CK-3) contiene due subunità M, specifiche per il muscolo scheletrico. Ha la determinazione dell'attività di diversi isoenzimi CK nel siero del sangue.
Ci sono anche cinque isoenzimi lattato deidrogenasi(ruolo di LDH) - un enzima coinvolto nel metabolismo del glucosio. Le differenze tra loro risiedono nel diverso rapporto delle subunità H. cuore– cuore) e M (inglese) muscolo– muscolo). Le lattato deidrogenasi di tipo 1 (H 4) e 2 (H 3 M 1) sono presenti nei tessuti con aerobico metabolismo (miocardio, cervello, corteccia renale), hanno un'elevata affinità per l'acido lattico (lattato) e lo convertono in piruvato. LDH-4 (H 1 M 3) e LDH-5 (M 4) si trovano nei tessuti soggetti a anaerobico metabolismo (fegato, muscolo scheletrico, pelle, midollo renale), hanno una bassa affinità per il lattato e catalizzano la conversione del piruvato in lattato. Nei tessuti con intermedio tipo di metabolismo (milza, pancreas, ghiandole surrenali, linfonodi) predomina LDH-3 (H 2 M 2). La determinazione dell'attività dei diversi isoenzimi LDH nel siero sanguigno ha significato clinico e diagnostico.
Un altro esempio di isoenzimi è il gruppo esochinasi, che attaccano un gruppo fosfato ai monosaccaridi esosi e li coinvolgono nelle reazioni metaboliche cellulari. Dei quattro isoenzimi, l'esochinasi IV ( glucochinasi), che differisce dagli altri isoenzimi per la sua elevata specificità per il glucosio, bassa affinità per esso e insensibilità all'inibizione da parte del prodotto di reazione.
Enzimi (enzimi)- Queste sono proteine altamente specifiche che svolgono le funzioni di catalizzatori biologici. Un catalizzatore è una sostanza che accelera una reazione chimica, ma non si consuma durante la reazione.
Le condizioni necessarie per l'interazione chimica delle molecole affinché avvenga una reazione chimica:
- le molecole devono avvicinarsi (scontrarsi). Ma non tutte le collisioni portano all’interazione;
- è necessario che questa collisione diventi effettiva, che si concluda con una trasformazione chimica. Un prerequisito per l'efficacia di una collisione è che la riserva energetica delle molecole al momento della collisione non sia inferiore al livello energetico della reazione.
Livello energetico della reazione- questa è la quantità di energia che le molecole devono avere affinché la loro collisione diventi efficace (perché avvenga una reazione chimica). Questa riserva di energia è una caratteristica costante (costante) per ogni data reazione.
Livello energetico medio delle molecoleè l'energia posseduta dalla maggior parte delle molecole del sistema in un dato momento nel tempo. Questo è il valore medio della riserva energetica, che caratterizza la totalità di queste molecole in queste condizioni specifiche (temperatura, pressione, ecc.). La riserva energetica delle molecole è un concetto statistico (probabilistico). Le molecole sono costantemente in movimento termico. Pertanto, la riserva energetica di ciascuna di esse cambia continuamente, oscillando attorno ad un valore che rappresenta il livello energetico medio delle molecole.
In ogni momento, la maggior parte delle molecole di una data popolazione possiede proprio questa riserva media di energia. E quanto più l'energia di un certo gruppo di molecole differisce dal livello energetico medio (in qualsiasi direzione), tanto più piccolo è questo gruppo. In qualsiasi insieme di molecole, una certa proporzione ha un'energia superiore al livello energetico medio ed è sufficiente affinché avvenga una reazione chimica.
La differenza tra il livello energetico medio delle molecole e il livello energetico della reazione è chiamata barriera energetica o energia di attivazione. Maggiore è questa energia di attivazione, più lenta procede la reazione chimica.
Come accelerare una reazione chimica? Aumentare il livello energetico medio delle molecole (aumento della temperatura, della pressione e di altri parametri ambientali, utilizzato negli impianti e nelle fabbriche chimiche) è impossibile per gli organismi viventi, che funzionano normalmente solo a valori costanti di temperatura, pressione e altri parametri. Anche un altro modo è impossibile: ridurre l'energia di attivazione abbassando il livello di energia della reazione, poiché questo valore è una caratteristica costante di questa reazione.
Pertanto, solo il fenomeno della catalisi (l'uso di catalizzatori) può accelerare le reazioni chimiche negli organismi viventi. Consideriamo due reazioni.
Nel caso generale, le energie di attivazione delle reazioni 1, 2a e 2b non coincidono tra loro e l'intera varietà di opzioni possibili può essere divisa in due gruppi:
- Eact2a e/o Eact2b sono maggiori di Eact1.
- In tutti questi casi, la reazione di formazione della sostanza “AB” con la partecipazione della sostanza “K” procederà più lentamente. Ciò significa che la sostanza “K” è un inibitore (moderatore) di questa reazione;
- Eact2a e/o Eact2b è inferiore a Eact1.
In questi casi, la reazione con la partecipazione della sostanza “K” procederà più velocemente che senza di essa. Ciò significa che la sostanza “K” è un catalizzatore (acceleratore) di questa reazione chimica.
Catalizzatoreè una sostanza che dirige una reazione lungo un percorso di bypass in cui le barriere energetiche sono più basse.
L'energia che deve essere spesa per “sollevare” la molecola dal livello energetico medio della reazione è completamente compensata quando la molecola “rotola” autonomamente lungo il pendio del “vulcano”. Con un ulteriore “rotolamento” spontaneo sul fondo del “vulcano” (cioè al livello energetico medio delle molecole che sono i prodotti di questa reazione). L’energia che viene rilasciata in questo caso è chiamata “risultato energetico della reazione”.
Risultato energetico della reazioneè la differenza tra il livello energetico delle sostanze di partenza (substrati) e il livello energetico dei prodotti di reazione.
Il risultato energetico della reazione non dipende dal percorso lungo il quale procede la reazione (è lo stesso per una reazione con la partecipazione di un catalizzatore e per una reazione senza la sua partecipazione). Non dipende dall'entità dell'energia di attivazione: da essa dipende solo la velocità con cui si verifica ciascuno dei percorsi di questa reazione.
Derivazione dall'equazione di Arrhenius: Poiché l'energia di attivazione in questa equazione è inclusa nell'esponente, anche un piccolo cambiamento nell'energia di attivazione porta a grandi cambiamenti nella velocità di reazione.
Proprietà generali dei catalizzatori
- I catalizzatori stessi non provocano una reazione chimica, ma accelerano solo la reazione, che procede senza di essi.
- Non influenzano il risultato energetico della reazione.
- Nelle reazioni reversibili, i catalizzatori accelerano sia la reazione diretta che quella inversa nella stessa misura, il che significa che i catalizzatori:
- non influenzano la direzione della reazione reversibile, che è determinata solo dal rapporto tra le concentrazioni delle sostanze di partenza (substrati) e dei prodotti finali;
- non influenzano la posizione di equilibrio della reazione reversibile, ma ne accelerano solo il raggiungimento.
Caratteristiche degli enzimi come catalizzatori biologici
Gli enzimi hanno tutte le proprietà generali dei catalizzatori convenzionali. Ma, rispetto ai catalizzatori convenzionali, tutti gli enzimi sono proteine. Presentano quindi caratteristiche che li distinguono dai catalizzatori convenzionali.
Queste caratteristiche degli enzimi come catalizzatori biologici sono talvolta chiamate proprietà enzimatiche generali. Questi includono quanto segue.
- Alta efficienza. Gli enzimi possono accelerare una reazione di 10 8 -10 12 volte.
- Elevata selettività degli enzimi ai substrati (specificità del substrato) e al tipo di reazione catalizzata (specificità d'azione).
- Elevata sensibilità degli enzimi a fattori ambientali fisici e chimici non specifici: temperatura, pH, forza ionica della soluzione, ecc.
- Elevata sensibilità ai reagenti chimici.
- Sensibilità elevata e selettiva agli effetti fisici e chimici di alcune sostanze chimiche, che per questo motivo possono interagire con l'enzima, migliorando o complicandone il lavoro.
La struttura degli enzimi
Un substrato (S) è una sostanza la cui trasformazione chimica in un prodotto (P) è catalizzata da un enzima (E). Quella porzione della superficie della molecola dell'enzima che interagisce direttamente con la molecola del substrato è chiamata centro attivo dell'enzima.
Il centro attivo dell'enzima è formato da residui amminoacidici situati in diverse parti della catena polipeptidica o in diverse catene polipeptidiche spazialmente vicine tra loro. Si forma a livello della struttura terziaria della proteina enzimatica.
All'interno dei suoi confini si distinguono un sito di adsorbimento (al centro) e un sito catalitico (al centro). Inoltre, si trovano siti funzionali speciali al di fuori del centro attivo dell'enzima; ciascuno di essi è designato con il termine centro allosterico.
Centro catalitico- questa è l'area (zona) del centro attivo dell'enzima che è direttamente coinvolta nelle trasformazioni chimiche del substrato. Si forma a causa dei radicali di due, a volte tre amminoacidi, situati in punti diversi nella catena polipeptidica dell'enzima, ma spazialmente vicini tra loro a causa delle curve di questa catena. Ad esempio, il centro catalitico degli enzimi “serina-istidina” è formato dai radicali degli aminoacidi serina e istidina. Se l'enzima è una proteina complessa, il gruppo prostetico della molecola enzimatica (coenzima) spesso partecipa alla formazione del centro catalitico. Tutte le vitamine idrosolubili e la vitamina K liposolubile svolgono una funzione coenzimatica.
Centro di assorbimento- questo è il sito del centro attivo della molecola dell'enzima in cui avviene l'assorbimento (legame) della molecola del substrato. È formato da uno, due, spesso tre radicali di amminoacidi, che di solito si trovano vicino al centro catalitico. La sua funzione principale è quella di legare una molecola di substrato e trasferire questa molecola al centro catalitico nella posizione più conveniente (per il centro catalitico). Questo assorbimento avviene solo a causa di legami deboli ed è quindi reversibile. Quando questi legami si formano, si verifica un riarrangiamento conformazionale del centro di adsorbimento, che porta ad una maggiore vicinanza del substrato e al centro attivo dell'enzima, e ad una corrispondenza più accurata tra le loro configurazioni spaziali. Lo scienziato americano Koshland ha costituito la base di tale corrispondenza - non "già pronta" in anticipo, ma formata durante l'interazione - come base per la teoria della corrispondenza indotta (o corrispondenza indotta), che ha superato i limiti del blocco precedentemente esistente e teoria chiave (corrispondenza rigida della struttura del substrato alla struttura del centro di adsorbimento).
Ovviamente, è la struttura del centro di adsorbimento che determina la specificità del substrato dell’enzima, cioè i requisiti dell’enzima per una molecola chimica affinché possa diventare un substrato adatto per essa.
Alcune sostanze con caratteristiche adeguate (cioè simili al substrato) possono legarsi anche al sito di adsorbimento dell'enzima. Ma se la loro molecola non ha un legame chimico che possa essere influenzato dal centro catalitico di un dato enzima, allora non si verificheranno trasformazioni chimiche di questa sostanza. Occupando il centro attivo di un enzima, tali molecole ne bloccano il lavoro, cioè sono inibitori reversibili di questo enzima (reversibili, perché sono collegate all'enzima da legami deboli). Aumentando la concentrazione del substrato, possono essere spostati dal centro di adsorbimento. Pertanto, tali inibitori sono chiamati competitivi. Competono con il vero substrato di un dato enzima per il possesso del suo sito di adsorbimento.
I centri allosterici sono quelle sezioni della molecola enzimatica al di fuori del suo centro attivo che sono in grado di legarsi con legami deboli (cioè in modo reversibile) con una particolare sostanza (ligando). Inoltre, tale legame porta ad un riarrangiamento conformazionale della molecola dell'enzima, che si estende fino al centro attivo, facilitando o complicando (rallentando) il suo lavoro. Di conseguenza, tali sostanze sono chiamate attivatori allosterici o inibitori allosterici di questo enzima.
Il termine “allosterico” (cioè “avente una struttura spaziale diversa”) è apparso per il fatto che questi effettori, nella loro configurazione spaziale, non sono affatto simili alla molecola substrato di un dato enzima (e quindi non possono legarsi alla molecola centro attivo dell'enzima). Si è concluso che il centro allosterico non ha una struttura simile al centro attivo dell'enzima.
I centri allosterici non si trovano in tutti gli enzimi. Sono presenti in quegli enzimi il cui lavoro può cambiare sotto l'influenza di ormoni, mediatori e altre sostanze biologicamente attive. Alcuni farmaci sintetizzati artificialmente hanno attività biologica perché le loro molecole sono complementari al centro allosterico di alcuni enzimi nel corpo.
Specificità enzimatica
Esistono due tipi principali di specificità enzimatica: specificità del substrato e specificità d’azione.
La specificità del substrato è la capacità di un enzima di catalizzare la trasformazione di un solo substrato specifico o di un gruppo di substrati strutturalmente simili. Determinato dalla struttura del sito di adsorbimento del centro attivo dell'enzima.
Esistono 3 tipi di specificità del substrato:
- la specificità assoluta del substrato è la capacità di un enzima di catalizzare la trasformazione di un solo substrato rigorosamente definito;
- specificità relativa del substrato: la capacità di un enzima di catalizzare la trasformazione di diversi substrati simili nella struttura;
- stereospecificità: la capacità di un enzima di catalizzare la trasformazione di determinati stereoisomeri.
Ad esempio, l'enzima L-aminoacido ossidasi è in grado di ossidare tutti gli aminoacidi, ma solo quelli appartenenti alla serie L. Pertanto, questo enzima ha una specificità relativa del substrato e una stereospecificità allo stesso tempo.
Specificità dell'azioneè la capacità di un enzima di catalizzare solo un certo tipo di reazione chimica.
In base alla specificità dell'azione, tutti gli enzimi sono divisi in 6 classi. Le classi di enzimi sono designate da numeri latini. Il nome di ciascuna classe di enzimi corrisponde a questo numero.
Classificazione degli enzimi
Classe I - ossidoriduttasi
Questa classe include enzimi che catalizzano le reazioni redox. Durante l'ossidazione può verificarsi la rimozione dell'idrogeno dalla sostanza ossidata o l'aggiunta di ossigeno alla sostanza ossidata. A seconda del metodo di ossidazione, si distinguono le seguenti sottoclassi di ossidoreduttasi:
- deidrogenasi. Catalizzare reazioni in cui l'idrogeno viene rimosso dalla sostanza da ossidare;
- ossigenasi. Gli enzimi di questa sottoclasse catalizzano l'inclusione dell'ossigeno nella sostanza ossidata:
- monoossigenasi: includono un atomo di ossigeno nella sostanza ossidata;
- diossigenasi: includono 2 atomi di ossigeno nella sostanza ossidata. Ciò è spesso accompagnato da una rottura della struttura ciclica. Gli atomi di ossigeno vengono aggiunti nel punto in cui il legame è rotto.
Classe II - transferasi
Catalizzano reazioni che trasferiscono gruppi chimici da una molecola di una sostanza a una molecola di un'altra sostanza.
III classe - idrolasi
Catalizza le reazioni di distruzione dei legami chimici con la partecipazione dell'acqua.
IV classe - liasi
Catalizza le reazioni di distruzione dei legami chimici senza la partecipazione dell'acqua.
Classe V - isomerasi
Catalizzare le reazioni di trasformazioni isomeriche.
Classe VI - ligasi (sintasi, sintetasi)
Catalizzare le reazioni di sintesi.
Principali fasi della catalisi enzimatica
Qualsiasi reazione enzimatica procede attraverso una serie di fasi intermedie.
Esistono tre fasi principali della catalisi enzimatica.
Fase 1. Assorbimento approssimativo del substrato sul sito attivo dell'enzima con formazione di un complesso E-S reversibile (substrato enzimatico). In questa fase avviene l'interazione del centro di adsorbimento dell'enzima con la molecola del substrato. In questo caso anche il substrato subisce un riarrangiamento conformazionale. Tutto ciò si verifica a causa dell'emergere di tipi deboli di legami tra il substrato e il centro di adsorbimento dell'enzima. Di conseguenza, la molecola del substrato viene fornita al centro catalitico nella posizione più conveniente per questo. Questo passaggio è facilmente reversibile perché sono coinvolti solo tipi deboli di legami. La caratteristica cinetica del 1° stadio della catalisi enzimatica è la costante di Michaelis (Km).
Fase 2. Trasformazioni chimiche di una molecola di substrato come parte di un complesso enzima-substrato con la formazione di un complesso enzimatico con un substrato trasformato chimicamente. In questa fase alcuni legami covalenti si rompono e se ne formano di nuovi. Pertanto, questa fase procede molto più lentamente della 1a e della 3a fase. È la velocità del secondo stadio che determina la velocità dell'intera reazione enzimatica nel suo insieme. Ciò significa che la velocità del processo enzimatico nel suo complesso è caratterizzata dal valore k+2, che è quasi sempre la più piccola di tutte le costanti di velocità parziali. La caratteristica cinetica del 2° stadio è la velocità massima (Vmax).
Fase 3. Desorbimento del prodotto finito dal suo complesso con l'enzima. Questa fase è più semplice della seconda. Anche questo, come il 2o stadio, è irreversibile. L'eccezione sono le reazioni enzimatiche reversibili.
Particolarità della catalisi enzimatica
Qualsiasi reazione chimica è caratterizzata, oltre alla possibilità fondamentale del suo verificarsi (dovuta alle leggi della termodinamica), dalla velocità del processo. La velocità di una reazione enzimatica è la variazione di [S] o [P] per unità di tempo. Misurata la sua velocità, cioè la velocità in presenza di un enzima, dobbiamo misurare la velocità della reazione in assenza dell'enzima (reazione che avviene spontaneamente). È questa differenza che caratterizza il lavoro dell'enzima.
Quando si misura la velocità di una reazione, è sempre necessario misurare la velocità iniziale del processo, cioè la velocità della reazione enzimatica, in un periodo di tempo sufficientemente breve quando cambia la concentrazione del substrato, non in modo così significativo da influisce sulla velocità del processo. Le unità della velocità di reazione possono variare. È meglio usare unità molari e il tempo è minuti o secondi, meno spesso ore. Pertanto la velocità di reazione può essere espressa, ad esempio, in µmol/min o mmol/ora. L'entità della velocità è determinata dalla legge dell'azione di massa. In generale, la velocità di una reazione chimica è proporzionale al prodotto della concentrazione dei reagenti. Nel caso della cinetica enzimatica, una delle sostanze reagenti è un enzima, la cui concentrazione è di molti ordini di grandezza inferiore alla concentrazione del substrato. Ciò determina alcune caratteristiche della cinetica della catalisi enzimatica.
V = k+2 [E] x [S].
Dipendenza della velocità della reazione enzimatica dalla concentrazione ([E]) a una concentrazione costante e piuttosto elevata del substrato ([S]>>[E], [S]=const).
La deviazione dalla linearità del grafico a concentrazioni di enzima molto elevate si verifica a causa della mancanza di substrato, pertanto la velocità di fornitura del substrato al sito attivo dell'enzima diminuisce. È necessario determinare la velocità di una reazione enzimatica solo nell'intervallo di concentrazioni enzimatiche in cui il grafico è lineare.
La linearità di questo grafico ci permette di esprimerlo in una figura: tangente dell'angolo di inclinazione all'asse delle ascisse. Questa tangente rappresenta la quantità di attività enzimatica. È il lavoro (efficienza) di ciascun enzima che è caratterizzato quantitativamente dal valore della sua attività, cioè dalla velocità della reazione enzimatica per unità di quantità di enzima. Le unità di attività possono essere diverse: µmol S/min.mg o µmol S/min.ml siero sanguigno.
Attività molecolareè il numero di molecole di substrato che vengono convertite da una molecola di enzima in un minuto a 30 °C e in altre condizioni ottimali. Il vantaggio di questa unità è che è possibile confrontare non solo l'attività di enzimi provenienti da fonti diverse, ma anche l'efficacia di enzimi diversi. Ad esempio, l'attività molecolare dell'enzima catalasi è 5 x 10 6 e l'anidrasi carbonica è 36 x 10 6.
Dalla linearità del grafico segue che la velocità di reazione può essere utilizzata per giudicare la quantità di enzima:
- catal è la quantità di enzima che assicura la conversione di 1 mole di substrato in 1 s;
- l'unità è la quantità di enzima che converte 1 µmol di substrato in 1 minuto. 1 unità = 16,67 nkatal.
Dipendenza della velocità di una reazione enzimatica dalla concentrazione del substrato in [E] = cost e [S] >> [E]: maggiore è la concentrazione del substrato, maggiore è la velocità di reazione. Questa dipendenza è iperbolica.
Il valore limite a cui tende l'iperbole - Vmax di una data reazione - caratterizza la massima efficienza dell'enzima: Vmax=k+2 x [E].
Pertanto, Vmax è il limite al quale tende la velocità di reazione quando la concentrazione del substrato aumenta indefinitamente.
km è la costante di Michaelis. È numericamente uguale alla concentrazione del substrato alla quale la velocità di reazione è la metà del valore massimo.
Questa curva è descritta dall'equazione di Michaelis-Menten.
Il significato fisico di Km è che rappresenta la costante di equilibrio tra due reazioni che portano alla decomposizione del complesso enzima-substrato e la reazione che porta alla formazione di tale complesso.
Ks - costante del substrato. Caratterizza la costante di equilibrio del 1° stadio della reazione enzimatica. Di conseguenza, anche Km è solitamente abbastanza vicino a Ks. Di conseguenza Km, come Ks, caratterizza l'affinità del substrato per un dato enzima. Ma è molto difficile determinare sperimentalmente k-1 e k+2, quindi è difficile determinare Ks. Ma i Km possono essere determinati semplicemente utilizzando le coordinate Lineweaver-Burk.
Utilizzando Km è possibile caratterizzare l'affinità di un dato enzima per un dato substrato. Minore è il Km, maggiore è l'affinità dell'enzima per un dato substrato, e quindi più l'equilibrio del primo stadio della reazione enzimatica viene spostato a destra, verso la formazione di un complesso enzima-substrato. Ciò significa che verranno create le migliori condizioni affinché possa avvenire la seconda fase del processo enzimatico. In tali condizioni, è necessaria una bassa concentrazione di substrato per ottenere una conversione efficiente del substrato. Ciò significa che la Vmax può teoricamente essere raggiunta con piccole quantità di substrato.
Se Km è alto, ciò significa che l'affinità dell'enzima per tale substrato è bassa e la reazione a basse concentrazioni del substrato è inefficace.
Km e Vmax sono due costanti cinetiche che possono essere utilizzate per caratterizzare l'efficienza dell'enzima, anche in vivo.
introduzione
Oggi esiste un problema acuto nel miglioramento dei metodi per diagnosticare varie malattie umane. Gli esami del sangue e delle urine vengono utilizzati da tempo in medicina come strumenti diagnostici. In questo caso, viene spesso utilizzato un esame del sangue biochimico. Tuttavia, come dimostra la pratica, per identificare alcuni tipi di malattie, ad esempio patologie dei reni e delle vie urinarie, non è l'analisi biochimica del siero del sangue ad avere un valore diagnostico maggiore, ma l'analisi biochimica delle urine. Tutto ciò determina la rilevanza della scelta dell'argomento di lavoro.
E se prima i medici curanti prestavano attenzione principalmente al livello di glucosio, proteine totali, urea, creatinina nelle urine e degli enzimi - al livello di amilasi (diastasi), negli ultimi dieci anni i test per lo spettro enzimatico delle urine hanno guadagnato una notevole popolarità. Questa tecnica è molto richiesta non solo nella diagnosi delle nefropatologie, ma anche nella diagnosi precoce di malattie gravi nei neonati e nella complessa diagnosi delle malattie.
La diagnostica enzimatica è una delle sezioni più importanti della biochimica clinica, che ha i propri compiti, indicazioni e tecniche di ricerca specifiche. Sono stati compiuti progressi significativi in questo settore: sono stati scoperti e isolati numerosi nuovi enzimi; è stato studiato il loro ruolo nelle diverse fasi del metabolismo; fu creato il concetto di scienza degli enzimi, che considera la malattia come successivi disturbi nella struttura e nella funzione degli enzimi. Grazie a questi risultati è stato possibile scoprire la patogenesi di molte malattie a livello molecolare, per creare non solo metodi diagnostici efficaci, ma anche prevenzione e trattamento dei pazienti. Pertanto, nel rapporto considereremo l'essenza biochimica e fisiologica degli enzimi e l'insieme dei principali enzimi presenti nell'urina umana.
Enzimi: struttura biochimica e ruolo fisiologico
Gli enzimi sono proteine specifiche che agiscono come catalizzatori biologici nel corpo.
Essendo proteine, gli enzimi hanno una struttura primaria, secondaria, terziaria e molti di loro hanno una struttura quaternaria.
Quando gli enzimi si idrolizzano, si forma una miscela di aminoacidi. Esistono oltre 20 diversi aminoacidi noti come componenti delle proteine.
Gli enzimi hanno proprietà fisiche e chimiche comuni con le proteine:
Durante l'idrolisi vengono scomposti in amminoacidi;
Hanno un peso molecolare elevato;
Creare soluzioni colloidali;
Scarsa cristallizzazione;
Molto instabile alle alte temperature di sali, metalli pesanti, acidi, alcali, ecc.;
Hanno proprietà antigeniche.
Il peso molecolare degli enzimi è caratterizzato da ampie variazioni: da diverse decine di migliaia a diversi milioni.
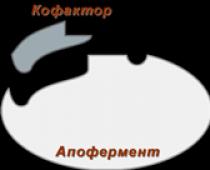
Gli enzimi differiscono nella loro struttura. Sono divisi in 2 gruppi: semplici e complessi. Gli enzimi semplici o monocomponenti sono costituiti solo da aminoacidi. Questi includono un piccolo numero di enzimi (ribonucleasi, amilasi, aldolasi, ureasi, pepsina, ecc.). Ma la maggior parte degli enzimi è costituita da due componenti: una parte non proteica o gruppo prostetico e una parte proteica, l'apoenzima (Fig. 1). Queste due parti dell'enzima non hanno potere separatamente, ma solo in combinazione tra loro mostrano capacità catalitica.
La componente non proteica della degradazione enzimatica è chiamata coenzima.
Molti coenzimi sono vitamine o loro derivati. Attualmente la biochimica conosce oltre 300 singoli enzimi (e forse nel prossimo futuro ce ne saranno di più, visto che la scienza non si ferma) che contengono vitamine o loro derivati come coenzimi. Di conseguenza, con carenze vitaminiche nel corpo, si verifica un'interruzione dell'attività di tutti i sistemi enzimatici.
Figura 1 Schema della struttura degli enzimi
Sono state proposte molte teorie per determinare il meccanismo d'azione degli enzimi. Si è scoperto che i catalizzatori riducono solo il tempo necessario per raggiungere l'equilibrio in una reazione chimica. La maggior parte delle reazioni chimiche negli organismi viventi deve essere “avviata”, che è ciò che fanno gli enzimi (Fig. 2).
L'attività vitale del corpo si basa sulle trasformazioni chimiche di varie sostanze, la cui velocità è determinata dagli enzimi - catalizzatori biologici. La digestione, l'uso di tutte le sostanze utili che entrano nel corpo, la crescita, la coagulazione del sangue, le contrazioni muscolari e molti altri processi fisiologici: tutto questo si basa sul lavoro chiaro e coerente dei sistemi enzimatici.
La caratteristica più importante degli enzimi non è solo la loro capacità di accelerare il verificarsi di reazioni chimiche, ma di catalizzare selettivamente solo un certo percorso di trasformazione di un dato substrato. Questa è una delle funzioni principali degli enzimi rispetto ai catalizzatori non biologici.
La reciprocità delle reazioni enzimatiche risiede nella capacità degli enzimi di catalizzare reazioni dirette e inverse. Ad esempio, la lipasi può, in determinate condizioni, disaccoppiare il grasso in glicerolo e acidi grassi e anche catalizzare la sua sintesi dai prodotti di decomposizione. La capacità degli enzimi di accelerare i processi chimici, sia nella direzione della sintesi che della degradazione, è di grande importanza, poiché crea la possibilità di passare questi processi dall'uno all'altro, il che garantisce una stretta relazione tra catabolismo e anabolismo, flessibilità e adattabilità del metabolismo all'influenza di fattori esterni ed interni.

Figura 2 Diagramma del meccanismo d'azione degli enzimi
Gli enzimi sono molto sensibili ai cambiamenti del pH dell'ambiente (cioè al grado di acidità e alcalinità) in cui operano. Ogni enzima ha un pH ottimale al quale è più attivo.
Per la maggior parte degli enzimi, l'ambiente ottimale è vicino al livello neutro dell'ambiente acido-base (ph circa 7,0), poiché la massima attività enzimatica si verifica a valori di pH fisiologici e in un ambiente acido o alcalino la loro attività diminuisce. Ma ci sono eccezioni a questa regola, e ce ne sono molte. Ad esempio, la pepsina, contenuta nel succo gastrico, si attiva solo in un ambiente molto acido (ph 1,5 - 2,5). Gli enzimi sono anche molto sensibili alla temperatura, come abbiamo visto. Quando la temperatura sale a 40-500 °C, aumenta l'attività della maggior parte degli enzimi, il che corrisponde alla nota legge dell'accelerazione delle reazioni chimiche con l'aumento della temperatura. È stato accertato che un aumento della temperatura ogni 100 °C aumenta la velocità della reazione enzimatica di 1,5 - 2 volte. E quindi è necessario rispettare il regime di temperatura quando si eseguono test sugli enzimi.
La conversione degli enzimi avviene in modo simile al metabolismo di altre proteine nel corpo. Gli enzimi vengono costantemente rinnovati, sintetizzati e scomposti, garantendo così il loro corretto livello nei tessuti.
Come risultato della secrezione o della morte cellulare, gli enzimi entrano nel sangue. I percorsi per rimuovere gli enzimi dal sangue sono diversi. Gli enzimi vengono inattivati nel plasma sanguigno, quindi vengono assorbiti dalle cellule del sistema reticoloendoteliale, dove, a causa del catabolismo, si disintegrano. Alcuni enzimi vengono escreti attraverso il tratto urinario e il tratto gastrointestinale. Ma la rimozione degli enzimi con l’urina e la bile occupa una piccola parte nel meccanismo di rimozione degli enzimi dal corpo. Fondamentalmente gli enzimi vengono scomposti nel plasma sanguigno e nei tessuti e i loro prodotti finali non utilizzati vengono espulsi attraverso i normali canali proteici. Tuttavia, l'analisi delle urine per il contenuto enzimatico è uno strumento diagnostico molto importante che ci consente di identificare molti processi patologici nel corpo.
A seconda del tipo di reazioni catalizzate, tutti gli enzimi sono divisi in sei classi e diverse sottoclassi. Secondo questa classificazione, ciascun enzima è designato da un codice, che comprende i numeri della classe, della sottoclasse e il numero di serie dell'enzima nella sottoclasse (Tabella 1).
Tabella 1 Classificazione degli enzimi secondo A.Sh. Bishevskij e O.A. Tersenov
Biochimica
Enzimi
Enzimi
Per la loro funzione, gli enzimi sono catalizzatori biologici. L'essenza dell'azione degli enzimi, così come dei catalizzatori inorganici, è:
Tuttavia, gli enzimi non catalizzano reazioni energeticamente impossibili; accelerano solo quelle reazioni che possono verificarsi in determinate condizioni. 
Enzimi Le somiglianze tra enzimi e catalizzatori inorganici sono le seguenti: 
Enzimi
Le differenze tra enzimi e catalizzatori inorganici permettono loro di “lavorare” all’interno dei corpi viventi e rendono il loro studio un’area molto importante della chimica: 
Fasi della catalisi enzimatica
In una reazione enzimatica si possono distinguere i seguenti passaggi: 
Meccanismi di catalisi
1. Catalisi acido-base– nel centro attivo dell’enzima sono presenti gruppi di residui aminoacidici specifici che sono buoni donatori o accettori di protoni. Tali gruppi sono potenti catalizzatori per molte reazioni organiche. 2. Catalisi covalente– gli enzimi reagiscono con i loro substrati, formando complessi enzima-substrato molto instabili mediante legami covalenti, dai quali si formano prodotti di reazione durante i riarrangiamenti intramolecolari. 
Tipi di reazioni enzimatiche A seconda della sequenza di interazione tra l'enzima e i reagenti, si distinguono i seguenti tipi di reazioni enzimatiche: 
Schema di reazione casuale
Nelle reazioni casuali, la sequenza delle interazioni tra il substrato e i reagenti non ha importanza: 
Schema di reazioni sequenziali
In questo caso, i substrati A e B vengono aggiunti successivamente all'enzima, formando un “complesso ternario”, dopo il quale avviene la catalisi. Anche i prodotti della reazione vengono scissi sequenzialmente dall'enzima. 
Schema “ping-pong” In questo caso l'enzima interagisce prima con il substrato A, selezionando da esso eventuali gruppi chimici e convertendolo nel prodotto corrispondente. Il substrato B viene quindi attaccato all'enzima, ricevendo questi gruppi chimici. 
La struttura degli enzimi Tutti gli enzimi sono proteine, quindi, come le altre proteine, sono divisi in composizione semplice e complessa.
Per effettuare la catalisi è necessario un complesso completo di apoproteina e cofattore non possono effettuare la catalisi separatamente; Come molte proteine, gli enzimi possono essere monomeri o polimeri. 
La struttura degli enzimi L'enzima è costituito da due regioni: il centro attivo e il centro allosterico. Il centro attivo è una combinazione di residui aminoacidici (solitamente 12-16) che fornisce un legame diretto alla molecola del substrato ed effettua la catalisi. Ci sono due regioni nel centro attivo: 
Diagramma del centro attivo
approvo
Testa Dipartimento prof., dottore in scienze mediche
Meshchaninov V.N.
_____‘’_______________2005
Lezione n. 1 Argomento: Introduzione alla biochimica. Enzimi: struttura, proprietà, localizzazione, nomenclatura e classificazione.
Facoltà: terapeutica e preventiva, medica e preventiva, pediatrica.
Biochimica - una scienza che studia le sostanze che compongono gli organismi viventi, le loro trasformazioni, nonché la relazione di queste trasformazioni con l'attività di organi e tessuti. Biochimica – scienza sulle basi chimiche dei processi vitali.
La biochimica è emersa come scienza indipendente alla fine del XIX secolo. All'incrocio tra biologia e chimica, anche se le sue origini risalgono a un lontano passato. Della prima metà del XVI secolo. I chimici medici hanno dato il loro contributo allo sviluppo della chimica e della medicina: il medico e naturalista tedesco F. Paracelsus, gli scienziati olandesi J. B. van Helmont, F. Silvius e altri, che hanno studiato succhi digestivi, bile e processi di fermentazione.
La biochimica si divide in: 1) statica (analizza la composizione chimica degli organismi); 2) dinamico (studia il metabolismo e l'energia nel corpo); 3) funzionale (esplora le basi molecolari di varie manifestazioni della vita).
Secondo gli oggetti della ricerca, la biochimica si divide in: 1) biochimica dell'uomo e degli animali; 2) biochimica vegetale; 3) biochimica dei microrganismi.
Tu ed io studieremo biochimica medica, uno dei rami della biochimica dell'uomo e degli animali. Soggetto la biochimica medica è umana.
Scopo corso la biochimica medica è lo studio di: 1) le basi molecolari delle funzioni fisiologiche umane; 2) meccanismi molecolari di patogenesi delle malattie; 3) basi biochimiche per la prevenzione e il trattamento delle malattie; 4) metodi biochimici per diagnosticare malattie e monitorare l'efficacia del trattamento.
Obiettivi del corso biochimica medica: 1) studiare materiale teorico; 2) acquisire competenze pratiche nella ricerca biochimica; 3) imparare a interpretare i risultati degli studi biochimici.
Natura chimica, proprietà fisico-chimiche e ruolo biologico degli enzimi.
La base dell'attività vitale di qualsiasi organismo sono i processi chimici. Quasi tutte le reazioni in un organismo vivente avvengono con la partecipazione di biocatalizzatori naturali chiamati enzimi o enzimi.
Enzimi - Si tratta di proteine (istituite nel 1922) che agiscono come catalizzatori nei sistemi biologici.
Essendo sostanze di natura proteica, gli enzimi possiedono tutte le proprietà delle proteine:
idrolizzare in amminoacidi;
dare reazioni di colore positive alle proteine (biureto, xantoproteine);
come le proteine, si dissolvono in acqua per formare soluzioni colloidali;
sono composti anfoteri;
soggetto a denaturazione sotto l'influenza degli stessi fattori: temperatura, variazioni di pH, azione di sali di metalli pesanti, azione di fattori fisici (ultrasuoni, radiazioni ionizzanti, ecc.);
hanno diversi livelli di organizzazione delle macromolecole, il che è confermato dall'analisi di diffrazione dei raggi X, dai dati NMR e ESR.
Il ruolo biologico degli enzimi è quello di garantire il verificarsi controllato di tutti i processi metabolici nel corpo.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0