Quando riscaldato, lo zolfo reagisce con l'idrogeno. Si forma un gas velenoso con un odore pungente: idrogeno solforato. Altrimenti chiamato idrogeno solforato, idrogeno solforato, diidrosolfuro.
Struttura
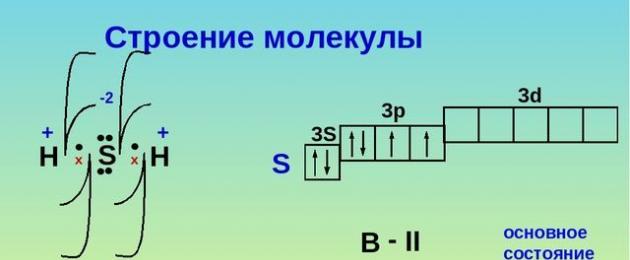
L'idrogeno solforato è un composto binario di zolfo e idrogeno. La formula dell'idrogeno solforato è H 2 S. La struttura della molecola è simile alla struttura della molecola d'acqua. Tuttavia, lo zolfo si forma con l'idrogeno non idrogeno, ma covalente connessione polare. Ciò è dovuto al fatto che, a differenza dell'atomo di ossigeno, l'atomo di zolfo ha un volume maggiore, ha un'elettronegatività inferiore e una densità di carica inferiore.

Riso. 1. La struttura dell'idrogeno solforato.
Ricevuta
Il solfuro di idrogeno è raro in natura. In piccole concentrazioni fa parte dei gas vulcanici associati, naturali. I mari e gli oceani contengono idrogeno solforato a grandi profondità. Ad esempio, l'idrogeno solforato si trova a una profondità di 200 metri nel Mar Nero. Inoltre, l'idrogeno solforato viene rilasciato quando le proteine contenenti zolfo marciscono.
Nell'industria si ottiene in diversi modi:
- reazione degli acidi con solfuri:
FeS + 2HCl → FeCl2 + H2S;
- l'effetto dell'acqua sul solfuro di alluminio:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S;
- fondendo lo zolfo con la paraffina:
C 18 H 38 + 18S → 18H 2 S + 18C.
Il gas più puro si ottiene dall'interazione diretta di idrogeno e zolfo. La reazione avviene a 600°C.
Proprietà fisiche
Il diidrosolfuro è un gas incolore con odore di uova marce e sapore dolciastro. Questa è una sostanza tossica, pericolosa in alte concentrazioni. A causa della sua struttura molecolare, l'idrogeno solforato non si liquefa in condizioni normali.
Generale proprietà fisiche idrogeno solforato:
- scarsamente solubile in acqua;
- presenta proprietà superconduttrici ad una temperatura di -70°C e una pressione di 150 GPa;
- infiammabile;
- solubile in etanolo;
- liquefa a -60,3°C;
- si trasforma in solido a -85,6°C;
- fonde a -86°C;
- bolle a -60°C;
- si decompone in sostanze semplici(zolfo e idrogeno) a 400°C.
In condizioni normali, è possibile preparare una soluzione di idrogeno solforato (acqua di idrogeno solforato). Tuttavia, l'idrogeno solforato non reagisce con l'acqua. Nell'aria la soluzione si ossida rapidamente e diventa torbida a causa del rilascio di zolfo. L'acqua di idrogeno solforato presenta proprietà acide deboli.

Riso. 2. Acqua di idrogeno solforato.
Proprietà chimiche
L'idrogeno solforato è un potente agente riducente. Di base proprietà chimiche le sostanze sono descritte nella tabella.
|
Reazione |
Descrizione |
Equazione |
|
Con ossigeno |
Brucia all'aria con una fiamma blu producendo anidride solforosa. Quando manca l'ossigeno si formano zolfo e acqua |
2H2S + 4O2 → 2H2O + 2SO2; 2H2S + O2 → 2S + 2H2O |
|
Con agenti ossidanti |
Si ossida producendo anidride solforosa o zolfo |
3H2S + 4HClO3 → 3H2SO4 + 4HCl; 2H2S + SO2 → 2H2O + 3S; 2H2S + H2SO3 → 3S + 3H2O |
|
Con alcali |
Con un eccesso di alcali si formano sali medi, in rapporto 1:1 - sali acidi |
H2S + 2NaOH → Na2S + 2H2O; H2S + NaOH → NaHS + H2O |
|
Dissociazioni |
Si dissocia gradualmente nella soluzione |
H 2 S ⇆ H + + HS – ; SA – ⇆H + + S 2- |
|
Alta qualità |
Formazione di precipitato nero - solfuro di piombo |
H2S + Pb(NO3)2 → PbS↓ + 2HNO3 |

Riso. 3. Combustione dell'idrogeno solforato.
L'idrogeno solforato è un gas tossico, quindi il suo utilizzo è limitato. Maggior parte L'idrogeno solforato prodotto viene utilizzato nella chimica industriale per la produzione di zolfo, solfuro e acido solforico.
Cosa abbiamo imparato?
Dall'argomento della lezione abbiamo appreso la struttura, la produzione e le proprietà dell'idrogeno solforato o dell'idrogeno solforato. È un gas incolore con un odore sgradevole. È una sostanza tossica. Forma acqua idrogeno solforata senza interagire con l'acqua. Nelle reazioni mostra le proprietà di un agente riducente. Reagisce con l'ossigeno atmosferico, i forti agenti ossidanti (ossidi, acidi dell'ossigeno) e gli alcali. Si dissocia in soluzione in due fasi. L'idrogeno solforato viene utilizzato in industria chimica per la produzione di derivati.
Prova sull'argomento
Valutazione del rapporto
Voto medio: 4.4. Totale voti ricevuti: 66.
- (idrogeno solforato) H2S, un gas incolore con odore di uova marce; punto di fusione?85.54.C, punto di ebollizione?60.35.C; a 0°C si liquefa sotto una pressione di 1 MPa. Agente riducente. Un sottoprodotto durante la raffinazione dei prodotti petroliferi, la coking del carbone, ecc.; formato durante la decomposizione... ... Grande Dizionario enciclopedico
- (H2S), un gas incolore e velenoso con odore di uova marce. Formato durante i processi di decadimento, presente nel petrolio greggio. Ottenuto dall'azione dell'acido solforico sui solfuri metallici. Utilizzato nella tradizionale ANALISI QUALITATIVA. Proprietà: temperatura... ... Dizionario enciclopedico scientifico e tecnico
IDROGENO Solfuro, idrogeno solforato, molti altri. no, marito (chimica). Gas prodotto dalla putrefazione di sostanze proteiche, che emana odore di uova marce. Dizionario Ushakova. D.N. Ushakov. 1935 1940… Dizionario esplicativo di Ushakov
SOLFURO DI IDROGENO, eh, marito. Un gas incolore con un odore acuto e sgradevole, formato durante la decomposizione delle sostanze proteiche. | agg. idrogeno solforato, oh, oh. Il dizionario esplicativo di Ozhegov. S.I. Ozhegov, N.Yu. Shvedova. 1949 1992 … Dizionario esplicativo di Ozhegov
Sostantivo, numero di sinonimi: 1 gas (55) Dizionario dei sinonimi ASIS. V.N. Trishin. 2013… Dizionario dei sinonimi
Gas velenoso incolore H2S con un odore specifico sgradevole. Ha proprietà leggermente acide. 1 litro di C. a t 0 °C e una pressione di 760 mm è 1.539 g Si trova negli oli, nelle acque naturali e nei gas di origine biochimica, come... ... Enciclopedia geologica
Solfuro di idrogeno- SOLFURO DI IDROGENO, H2S ( peso molecolare 34.07), un gas incolore con odore caratteristico di uova marce. Un litro di gas in condizioni normali (0°, 760 mm) pesa 1,5392 g. Temperatura di ebollizione 62°, fusione 83°; S. fa parte delle emissioni gassose... ... Grande Enciclopedia Medica
idrogeno solforato- - Argomenti di biotecnologia EN idrogeno solforato ... Guida del traduttore tecnico
idrogeno solforato- SOLFURO DI IDROGENO, a, m Un gas incolore con un odore acuto e sgradevole, formato durante la decomposizione di sostanze proteiche e che rappresenta un composto di zolfo con idrogeno. L'idrogeno solforato si trova in alcune acque minerali e fanghi medicinali e viene utilizzato... ... Dizionario esplicativo dei sostantivi russi
Libri
- Come smettere di fumare! (DVD), Pelinsky Igor. "Niente è più facile che smettere di fumare: ho già smesso trenta volte" (Mark Twain). Perché le persone iniziano a fumare? Per rilassarsi, distrarsi, raccogliere i pensieri, liberarsi dallo stress o...
- I vestimentiferi sono invertebrati intestinali delle profondità marine, V.V. Malakhov. La monografia è dedicata a un nuovo gruppo di animali giganti (fino a 2,5 m) di acque profonde che vivono in aree di attività idrotermale di acque profonde e infiltrazioni fredde di idrocarburi. Maggior parte… e-book
- Riflessioni di un medico praticante sulla salute dei lavoratori dell'industria del gas, I. V. Fomichev. Svetlana Vladimirovna Fomicheva – Ph.D. Miele. Scienze, ricercatore senior Istituto di simbiosi cellulare e intracellulare, filiale degli Urali dell'Accademia delle scienze russa. Fomichev Ilya Vladimirovich – gastroenterologo, capo dell'ambulatorio medico...
DEFINIZIONE
Solfuro di idrogenoè un gas incolore con un odore caratteristico di proteine in decomposizione.
È leggermente più pesante dell'aria, si liquefa ad una temperatura di -60,3 o C e solidifica a -85,6 o C. Nell'aria, l'idrogeno solforato brucia con una fiamma bluastra, formando anidride solforosa e acqua:
2H2S + 3O2 = 2H2O + 2SO2.
Se si introduce nella fiamma dell'idrogeno solforato un oggetto freddo, ad esempio una tazza di porcellana, la temperatura della fiamma diminuisce notevolmente e l'idrogeno solforato si ossida solo in zolfo libero, che si deposita sulla tazza sotto forma di un rivestimento giallo:
2H2S + O2 = 2H2O + 2S.
Il solfuro di idrogeno è altamente infiammabile; la sua miscela con l'aria esplode. Il solfuro di idrogeno è molto velenoso. Inalazione prolungata di aria contenente questo gas, anche in piccole quantità, provoca gravi avvelenamenti.
A 20°C un volume di acqua scioglie 2,5 volumi di idrogeno solforato. Una soluzione di idrogeno solforato in acqua è chiamata acqua di idrogeno solforato. Quando si sta in aria, soprattutto alla luce, l'acqua di idrogeno solforato diventa presto torbida a causa dello zolfo rilasciato. Ciò si verifica a seguito dell'ossidazione dell'idrogeno solforato da parte dell'ossigeno atmosferico.
Produzione di idrogeno solforato
A alta temperatura lo zolfo reagisce con l'idrogeno per formare gas di idrogeno solforato.
In pratica, l'idrogeno solforato viene solitamente prodotto dall'azione di acidi diluiti sui metalli solforati, ad esempio il solfuro di ferro:
FeS + 2HCl = FeCl2 + H2S.
L'idrogeno solforato più puro può essere ottenuto mediante idrolisi di CaS, BaS o A1 2 S 3. Il gas più puro si ottiene dalla reazione diretta di idrogeno e zolfo a 600 °C.
Proprietà chimiche dell'idrogeno solforato
Una soluzione di idrogeno solforato in acqua ha le proprietà di un acido. L'idrogeno solforato è un acido dibasico debole. Si dissocia passo dopo passo e principalmente in base al primo passo:
H 2 S↔H + + HS - (K 1 = 6 × 10 -8).
Dissociazione del secondo stadio
SA - ↔H + + S 2- (K 2 = 10 -14)
avviene in misura trascurabile.
L'idrogeno solforato è un forte agente riducente. Se esposto a forti agenti ossidanti, viene ossidato ad anidride solforosa o acido solforico; la profondità dell'ossidazione dipende dalle condizioni: temperatura, pH della soluzione, concentrazione dell'ossidante. Ad esempio, la reazione con il cloro procede solitamente con la formazione di acido solforico:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
I sali medi di idrogeno solforato sono chiamati solfuri.
Applicazione dell'idrogeno solforato
L'uso dell'idrogeno solforato è piuttosto limitato, principalmente a causa della sua elevata tossicità. Ha trovato applicazione nella pratica di laboratorio come precipitante metalli pesanti. L'idrogeno solforato serve come materia prima per la produzione di acido solforico, zolfo in forma elementare e solfuri
Esempi di risoluzione dei problemi
ESEMPIO 1
| Esercizio | Determina quante volte più pesante dell'aria è l'idrogeno solforato H 2 S. |
| Soluzione | Il rapporto tra la massa di un dato gas e la massa di un altro gas preso nello stesso volume, alla stessa temperatura e alla stessa pressione è chiamato densità relativa del primo gas rispetto al secondo. Questo valore mostra quante volte il primo gas è più pesante o più leggero del secondo gas. Si considera che il peso molecolare relativo dell'aria sia 29 (tenendo conto del contenuto di azoto, ossigeno e altri gas nell'aria). Va notato che il concetto di “relativo peso molecolare air" è usato in modo condizionale, poiché l'aria è una miscela di gas. D aria (H 2 S) = M r (H 2 S) / M r (aria); D aria (H 2 S) = 34 / 29 = 1,17. M r (H 2 S) = 2 × A r (H) + A r (S) = 2 × 1 + 32 = 2 + 32 = 34. |
| Risposta | L'idrogeno solforato H 2 S è 1,17 volte più pesante dell'aria. |
ESEMPIO 2
| Esercizio | Trova la densità dell'idrogeno di una miscela di gas in cui la frazione volumetrica di ossigeno è del 20%, l'idrogeno è del 40% e il resto è idrogeno solforato H 2 S. |
| Soluzione | Le frazioni volumetriche dei gas coincideranno con quelle molari, cioè con frazioni di quantità di sostanze, ciò è una conseguenza della legge di Avogadro. Troviamo il peso molecolare condizionale della miscela: M r condizionale (miscela) = φ (O 2) × M r (O 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
L'idrogeno solforato - H2S - è un gas incolore con un odore pungente di uova marce. Scarsamente solubile in acqua. La molecola di idrogeno solforato ha una forma angolare. La molecola è polare. A causa del fatto che l'idrogeno solforato non forma forti legami idrogeno, in condizioni normali l'idrogeno solforato è un gas. soluzione acquosa L'idrogeno solforato forma un debole acido idrogeno solforato.
Ricevuta
Spostamento dei sali da parte di acidi forti:
FeS + 2HCl = FeCl2 + H2S (apparato di Kipp)
Reazioni dell'idrogeno solforato: ossidato dall'ossigeno atmosferico a zolfo o anidride solforosa
2H2S + O2 = 2S(SO2) + 2H2O
Acido solfidrico– debole, dibasico
Acido solfidrico
I sali medi insolubili dell'acido idrosolfuro (solfuri) si ottengono facendo reagire lo zolfo con metalli o in reazioni di scambio tra soluzioni saline:
Na2S + CuSO4 = CuS↓ + Na2SO4
K2S + FeCl2 = FeS↓ + 2KCl
I solfuri solubili sono formati da metalli alcalini e alcalino terrosi. Possono essere ottenuti facendo reagire soluzioni acide con metalli o alcali. In questo caso, a seconda del rapporto molare tra le sostanze di partenza, si possono formare sia sali acidi (idrosolfuri) che medi.
H2S + NaOH = NaHS + H2O (senza alcali)
H2S + 2NaOH = Na2S + 2H2O (in eccesso di alcali)
Alcuni solfuri (CuS, HgS, Ag2S, PbS) non vengono decomposti da soluzioni di acidi forti. Pertanto, l'acido idrogeno solforato può spostarsi acidi forti da soluzioni acquose dei loro sali formati da questi metalli:
CuSO4 + H2S = CuS↓ + H2SO4
HgCl2 + H2S = HgS↓ +2HCl
L'acido solfidrico presente nell'aria viene lentamente ossidato dall'ossigeno, rilasciando zolfo:
2H2S + O2 = 2S↓ + 2H2O
Pertanto, nel tempo, le soluzioni H2S diventano torbide durante lo stoccaggio.
Solfuri metalli alcalino terrosi in una soluzione acquosa nella prima fase vengono idrolizzati quasi al 100% ed esistono sotto forma di sali acidi solubili:
2CaS + 2HOH = Ca(HS)2 + Ca(OH)2
I solfuri di alcuni metalli (Al2S3, Fe2S3, Cr2S3) sono completamente idrolizzati in H2O:
Al2S3 + 6 H2O = 2Al(OH)3 + 3 H2S
La maggior parte dei solfuri di metalli pesanti sono scarsamente solubili in H2O.
50) Fosforo. Modifiche allotropiche del fosforo……
Fosforo - componente proteine vegetali e animali. Nelle piante, il fosforo è concentrato nei semi, negli animali - in tessuto nervoso, muscoli, scheletro. Il corpo umano contiene circa 1,5 kg di fosforo: 1,4 kg nelle ossa,
130 g - nei muscoli e 13 g nel tessuto nervoso. In natura il fosforo si trova in forma legata.
Minerali essenziali:
apatite Ca5(PO4)3F e fosforite Ca3(PO4)2.
Il fosforo può essere ottenuto riscaldando una miscela di fosforite,
carbone e sabbia in una fornace speciale:
Ca3(PO4)2 + 5C + 3SiO2 2P + 3CaSiO3 + 5CO
La fosfina è un gas velenoso dall'odore agliaceo, può essere ottenuto dal fosfuro di zinco per azione di acidi o acqua:
Zn3P2 + 6HCl → 2PH3 + 3ZnCl2
Le principali proprietà della fosfina sono più deboli di quelle dell'ammoniaca:
PH3 + HCl → PH4Cl
I sali di fosfonio in soluzioni acquose sono instabili:
PH4 + H2O → PH3 + H3O
La fosfina ha uno stato riducente (lo stato di ossidazione più basso del fosforo), brucia nell'aria:
2PH3 + 4O2 → P2O5 + 3H2O
La fosfina è un gas velenoso incolore con l'odore di pesce marcio. Si autoinfiamma nell'aria
2РН3 + 4О2 → P2O5 + 2Н2О
È leggermente solubile in acqua e, a differenza dell'NH3, non reagisce con essa.
Forma sali di fosfonio simili all'ammoniaca con ossigeno e acidi molto forti.
PH3+HI=PH4I
ioduro di fosfonio
Difosfina (analogo dell'idrazina) (P2H4) – è un liquido,
autoinfiammabile nell'aria.
Preparazione: Dalla roccia fosfatica per fusione con carbonio e ossido di silicio
Ca3(PO4)2 + C +SiO2 → P4 + CaSiO3 + CO
Dal fosfato di Ca, a temperature superiori a 1500°C: Ca3(PO4)2 + C → CaO + P4 + CO
Proprietà chimiche: P+O2 = P2O3; P+O2 = P2O5; P+S = P2S3; P+Cl2 = PCl3; P+H2 non funziona
Modifiche allotropiche: Il fosforo bianco è un veleno potente, anche a piccole dosi è fatale. Si ottiene allo stato solido mediante raffreddamento rapido dei vapori di fosforo. Nella sua forma pura è completamente incolore, trasparente, aspetto simile alla cera: fragile al freddo, molle a temperature superiori a 15 °C, si taglia facilmente con il coltello.
Il fosforo rosso è una polvere rosso-marrone, atossica, non volatile, insolubile in acqua e in molti solventi organici e solfuro di carbonio; non si accende all'aria e non si illumina al buio. Si accende solo se riscaldato a 260 °C. Con forte riscaldamento, senza accesso all'aria, senza fusione (bypass stato liquido) evapora – sublima. Una volta raffreddato si trasforma in fosforo bianco.
Il fosforo nero è prodotto dal calore elevato e dall'alta pressione del fosforo bianco. Il fosforo nero è più pesante di altre modifiche. È usato molto raramente - come semiconduttore nella composizione del gallio e del fosfato di indio nella metallurgia.
Reagisce con gli acidi P + HNO3 = HPO4 + NO + H2O; P + H2SO4 = H3PO4 + SO2 + H2O
Reagisce con gli alcali P + KOH + H2O = KH 2PO2 + PH3
DEFINIZIONE
Acido solfidrico(idrogeno solforato, monosolfano) in condizioni normali è un gas incolore.
Termicamente instabile. Scarsamente solubile in acqua fredda. Una soluzione satura (0,1 M) è chiamata “acqua di idrogeno solforato”, che diventa torbida se esposta all’aria. Mostra deboli proprietà acide. L'OVR è un forte agente riducente.
Formula chimica dell'acido idrosolfuro
Formula chimica acido idrosolfuro H 2 S. Mostra che questa molecola contiene due atomi di idrogeno (Ar = 1 amu) e un atomo di zolfo (Ar = 32 amu). Usando la formula chimica, puoi calcolare il peso molecolare dell'acido idrogeno solforato:
Mr(H2S) = 2×Ar(H) + Ar(S);
Mr(H2S) = 2×1 + 32 = 2+32 = 34.
Formula grafica (strutturale) dell'acido idrogeno solforato
La formula strutturale (grafica) dell'acido idrogeno solforato è più chiara. Mostra come gli atomi sono collegati tra loro all'interno di una molecola (Fig. 1).
Riso. 1. La struttura della molecola di idrogeno solforato, che indica l'angolo di legame tra i legami e la lunghezza dei legami chimici.
Formula ionica
L'acido solfidrico è un elettrolita, cioè in soluzione acquosa è capace di dissociarsi in ioni secondo la seguente equazione:
H2S ↔ 2H + + S2- .
Esempi di risoluzione dei problemi
ESEMPIO 1
| Esercizio | Determinare la formula molecolare di un composto contenente 49,4% potassio, 20,2% zolfo, 30,4% ossigeno, se la massa molecolare relativa di questo composto è 3,95 volte la massa atomica relativa del calcio. |
| Soluzione |
Indichiamo il numero di moli di elementi inclusi nel composto come “x” (potassio), “y” (zolfo) e “z” (ossigeno). Quindi, il rapporto molare sarà simile a questo (valori delle masse atomiche relative presi da tavola periodica DI. Mendeleev, arrotondamento ai numeri interi): x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 49,4/39: 20,2/32: 30,4/16; x:y:z= 1,3: 0,63:1,9 = 2: 1: 3. Ciò significa che la formula più semplice per un composto di potassio, zolfo e ossigeno sarà K 2 SO 3 e massa molare 158 g/mol. Troviamo la vera massa molare di questo composto: Sostanza M = Ar(Ca) × 3,95 = 40 × 3,95 = 158 g/mol. Per trovare la vera formula composto organico Troviamo il rapporto tra le masse molari risultanti: Sostanza M / M(K 2 SO 3) = 158 / 158 = 1. Ciò significa che la formula del composto di potassio, zolfo e ossigeno è K 2 SO 3 . |
| Risposta | K2SO3 |
ESEMPIO 2
| Esercizio | La sostanza contiene il 32,5% di sodio, il 22,5% di zolfo e il 45% di ossigeno. Derivare la formula chimica della sostanza. |
| Soluzione | La frazione di massa dell'elemento X in una molecola della composizione NX viene calcolata utilizzando la seguente formula: ω (X) = n × Ar (X) / M (HX) × 100%. Indichiamo il numero di moli di elementi inclusi nel composto come “x” (sodio), “y” (zolfo) e “z” (ossigeno). Quindi, il rapporto molare sarà simile a questo (i valori delle masse atomiche relative presi dalla tavola periodica di D.I. Mendeleev sono arrotondati a numeri interi): x:y:z = ω(Na)/Ar(Na) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 32,5/23: 22,5/32: 45/16; x:y:z= 1,4: 0,7: 2,8 = 2: 1: 4. Ciò significa che la formula per il composto di sodio, zolfo e ossigeno sarà Na 2 SO 4. Questo è solfato di sodio. |
| Risposta | Na2SO4 |
- VKontakte 0
- Google+ 0
- OK 0
- Facebook 0