DEFINIZIONE
Nichelè il ventottesimo elemento della tavola periodica. Designazione - Ni dal latino "niccolom". Situato nel quarto periodo, gruppo VIIIB. Si riferisce ai metalli. La carica nucleare è 28.
Come il cobalto, il nichel si presenta in natura principalmente sotto forma di composti con arsenico o zolfo; tali, ad esempio, sono i minerali kupfernickel NiAs, il lustro di arsenico-nichel NiAsS, ecc. Il nichel è più comune del cobalto [circa lo 0,01% (massa) della crosta terrestre].
Il nichel metallico ha un colore argenteo con una sfumatura giallastra (Fig. 1), è molto duro, si lucida bene ed è attratto da un magnete. È caratterizzato da un'elevata resistenza alla corrosione - stabile nell'atmosfera, nell'acqua, negli alcali e in numerosi acidi. Si dissolve attivamente in acido nitrico. La resistenza chimica del nichel è dovuta alla sua tendenza alla passivazione - alla formazione di pellicole di ossido sulla superficie, che hanno un forte effetto protettivo.
Riso. 1. Nichel. Aspetto esteriore.
Peso atomico e molecolare del nichel
DEFINIZIONE
Peso molecolare relativo di una sostanza (M r)è un numero che mostra quante volte la massa di una data molecola è maggiore di 1/12 della massa di un atomo di carbonio, e massa atomica relativa di un elemento (A r)- quante volte la massa media degli atomi di un elemento chimico è maggiore di 1/12 della massa di un atomo di carbonio.
Poiché il nichel esiste allo stato libero sotto forma di molecole di Ni monoatomiche, i valori delle sue masse atomiche e molecolari coincidono. Sono pari a 58,6934.
Isotopi del nichel
È noto che il nichel può presentarsi in natura sotto forma di cinque isotopi stabili 58Ni, 60Ni, 61Ni, 62Ni e 64Ni. I loro numeri di massa sono rispettivamente 58, 60, 61, 62 e 64. Il nucleo dell'isotopo di nichel 58 Ni contiene ventotto protoni e trenta neutroni, e gli isotopi rimanenti differiscono da esso solo per il numero di neutroni.
Esistono isotopi di nichel instabili artificiali con numeri di massa da 48 a 78, nonché otto stati metastabili, tra cui l'isotopo 59 Ni con un'emivita di 76 mila anni è il più longevo.
ioni nichel
La formula elettronica che mostra la distribuzione orbitale degli elettroni di nichel è la seguente:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 .
Come risultato dell'interazione chimica, il nichel cede i suoi elettroni di valenza, cioè è il loro donatore e si trasforma in uno ione caricato positivamente:
Ni 0 -2e → Ni 2+;
Ni 0 -3e → Ni 3+.
Molecola e atomo di nichel
Allo stato libero, il nichel esiste sotto forma di molecole di Ni monoatomiche. Ecco alcune proprietà che caratterizzano l'atomo e la molecola di nichel:
Leghe di nichel
La maggior parte del nichel viene utilizzata per produrre varie leghe con ferro, rame, zinco e altri metalli. L'aggiunta di nichel all'acciaio ne aumenta la tenacità e la resistenza alla corrosione.
Le leghe a base di nichel possono essere suddivise in resistenti al calore (nimonic, inconel, hastella [oltre il 60% di nichel, 15-20% di cromo e altri metalli]), magnetiche (permalloy) e leghe con proprietà speciali (monel metal, nickelin, costantana , invar, platino).
Esempi di risoluzione dei problemi
ESEMPIO 1
| Esercizio | Scrivi le equazioni di reazione che possono essere utilizzate per effettuare le seguenti trasformazioni: NiCl 2 → Ni → NiSO 4 → Ni(NO 3) 2 → Ni(OH) 2 → NiCl 2. Disegna le equazioni delle reazioni che avvengono nelle soluzioni in forma ionica e ionica abbreviata. |
| Risposta | Inserendo una soluzione di cloruro di nichel (II) più attiva del nichel metallico, è possibile ottenere il nichel nella sua forma libera (reazione di sostituzione): NiCl 2 + Zn → Ni + ZnCl 2 ; Ni 2+ + Zn 0 → Ni 0 + Zn 2+ . Il nichel si dissolve in acido solforico diluito per formare solfato di nichel (II): Ni + H 2 SO 4 (diluito) → NiSO 4 + H 2; Ni 0 + 2H + → Ni 2+ + H 2 . Il nitrato di nichel (II) può essere ottenuto mediante la reazione di scambio: NiSO 4 + Ba(NO 3) 2 → Ni(NO 3) 2 + BaSO 4 ↓; SO 4 2- + Ba 2+ → BaSO 4 ↓. Agendo sul nitrato di nichel (II) con alcali, si può ottenere idrossido di nichel (II): Ni(NO 3) 2 + 2NaOH → Ni(OH) 2 ↓+ 2NaNO 3 ; Ni 2+ + 2OH - \u003d Ni (OH) 2 ↓. Il cloruro di nichel (II) dall'idrossido di nichel (II) può essere ottenuto mediante una reazione di neutralizzazione con acido cloridrico: Ni(OH) 2 + 2HCl → NiCl 2 + 2H 2 O; OH - + H + \u003d H 2 O. |
ESEMPIO 2
| Esercizio | Quale massa di cloruro di nichel (II) si può ottenere riscaldando 17,7 g di nichel e 12 litri di cloro (n.a.)? Quale volume di soluzione 0,06 M può essere preparato da questa massa di sale? |
| Soluzione | Scriviamo l'equazione di reazione: Ni + Cl 2 \u003d NiCl 2. Troviamo il numero di moli di nichel (massa molare - 59 g / mol) e cloro che hanno reagito utilizzando i dati indicati nella condizione del problema: n (Ni) = m (Ni) / M (Ni); n (Ni) \u003d 17,7 / 59 \u003d 0,3 mol. n (Cl 2) \u003d V (Cl 2) / V m; n (Cl 2) \u003d 12 / 22,4 \u003d 0,54 mol. Secondo l'equazione del problema n (Ni): n (Cl 2) = 1:1. Ciò significa che il cloro è in eccesso e tutti gli altri calcoli devono essere effettuati utilizzando il nichel. Troviamo la quantità di sostanza e la massa del cloruro di nichel (II) risultante (massa molare 130 g / mol): n (Ni): n (NiCl2) = 1:1; n (Ni) \u003d n (NiCl 2) \u003d 0,3 mol. m (NiCl 2)= n (NiCl 2)×M (NiCl 2); m (NiCl 2) \u003d 0,3 × 130 \u003d 39 g. Calcolare il volume di una soluzione 0,06M ottenibile da 39 g di cloruro di nichel (II): V (NiCl 2) \u003d n (NiCl 2) / c (NiCl 2); V (NiCl 2) \u003d 0,3 / 0,06 \u003d 0,5 l. |
| Risposta | La massa del cloruro di nichel (II) è di 39 g, il volume di una soluzione 0,06 M è di 0,5 l (500 ml). |
sul tema: Il nichel e le sue proprietà
Il lavoro è stato compilato dagli studenti del 2° anno del gruppo 5202
Nikitin Dmitry e Sharhemullin Emil.
Kazan 2013
Proprietà fisiche del Nichel.
L'elemento è stato scoperto nel 1761. Il nichel è un elemento del decimo gruppo, il quarto periodo del sistema periodico degli elementi chimici. I. Mendeleev, con numero atomico 28. Metallo bianco-argento che non si appanna all'aria. Nella sua forma pura, è molto plastico e può essere lavorato a pressione. È un ferromagnete, cioè quando conduce corrente attraverso di esso, ha proprietà magnetiche pronunciate. Gli atomi di nichel hanno una configurazione elettronica esterna 3d 8 4s 2 . È un metallo malleabile e malleabile, che consente di produrre fogli e tubi più sottili da esso.
Proprietà chimiche del nichel
Chimicamente, Ni è simile a Fe e Co, ma anche a Cu e metalli nobili. Nei composti, mostra valenza variabile (più spesso 2-valente). Il nichel è un metallo di media attività. Assorbe (soprattutto nello stato finemente suddiviso) grandi quantità di gas
Il nichel brucia solo sotto forma di polvere. In questo caso, forma due ossidi NiO e Ni 2 O 3 e, di conseguenza, due idrossidi Ni(OH) 2 e Ni(OH) 3 . I più importanti sali solubili di nichel sono acetato, cloruro, nitrato e solfato. Le soluzioni acquose di sali sono generalmente di colore verde e i sali anidri sono gialli o giallo-marroni. che è spesso usato in chimica analitica.
La saturazione di N. con i gas ne peggiora le proprietà meccaniche. L'interazione con l'ossigeno inizia a 500 °C; in uno stato finemente disperso, N. è piroforico - si accende spontaneamente nell'aria. Tra gli ossidi, l'ossido più importante è NiO - cristalli verdastri, praticamente insolubili in acqua (il minerale bunsenite). L'idrossido precipita da soluzioni di sali di nichel quando vengono aggiunti alcali sotto forma di un voluminoso precipitato verde mela. Quando riscaldato, H. si combina con gli alogeni, formando NiX 2 . Bruciando in vapore di zolfo, si ottiene un solfuro di composizione simile a Ni 3 S 2 . Il monosolfuro NiS può essere ottenuto riscaldando NiO con zolfo. N. non reagisce con l'azoto anche ad alte temperature (fino a 1400°C)
Allo stato liquido, N. dissolve una quantità apprezzabile di C, che precipita per raffreddamento sotto forma di grafite. Quando la grafite viene isolata, N. perde la malleabilità e la capacità di essere lavorata a pressione.
Il nichel è resistente all'acqua. Gli acidi organici agiscono su N. solo dopo un contatto prolungato con esso. Gli acidi solforico e cloridrico dissolvono lentamente N.; acido nitrico diluito - molto facile; concentrato HNO 3 passiva N., ma in misura minore rispetto al ferro. Quando si interagisce con gli acidi, si formano sali di Ni 2-valente. Quasi tutti i sali di Ni (II) e gli acidi forti sono altamente solubili in acqua, le loro soluzioni sono acide a causa dell'idrolisi.
Composti complessi del Nichel.
Il legame del nichel in complessi è un importante processo diagnostico per la chimica analitica.
Il nichel è caratterizzato dalla formazione di complessi. Pertanto, il catione Ni 2+ con ammoniaca forma un complesso esaamminico 2+ e un complesso diquatetraamminico 2+. Questi complessi con anioni formano composti blu o viola.
I sali insolubili includono ossalato e fosfato (colore verde), tre solfuri: NiS (nero), Ni 3 S 2 (bronzo-giallastro) e Ni 3 S 4 (bianco-argento). Oppure, nichel dimetilgliossimato Ni (C 4 H 6 N 2 O 2) 2, che conferisce un colore rosso chiaro in un ambiente acido, che è ampiamente utilizzato nell'analisi qualitativa per la rilevazione del nichel.
Le soluzioni acquose di sali di nichel (II) contengono lo ione esaaquanickel (II) 2+. Quando una soluzione di ammoniaca viene aggiunta a una soluzione contenente questi ioni, l'idrossido di nichel (II), una sostanza gelatinosa verde, precipita. Questo precipitato si dissolve quando viene aggiunta una quantità eccessiva di ammoniaca a causa della formazione di ioni esameminonichel(II) 2+.
Il nichel forma complessi con strutture quadrate tetraedriche e piatte. Ad esempio, il complesso tetracloronichelato (II) 2− ha una struttura tetraedrica, mentre il complesso tetracianonichelato (II) 2− ha una struttura quadrata planare.
La reazione degli ioni Ni 2+ con la dimetilgliossima è caratteristica, portando alla formazione di dimetilgliossimato di nichel rosa-rosso. Questa reazione viene utilizzata nella determinazione quantitativa del nichel e il prodotto di reazione viene utilizzato come pigmento nei materiali cosmetici e per altri scopi.
Quantificazione dell'elemento.
Viene eseguito principalmente con i seguenti metodi:
1) Precipitazioni sotto forma di nichel dimetoigliossimato, come già detto.
2) precipitazione sotto forma di enickel-alfa-benzildiossima.
3) Precipitazione sotto forma di idrossido di nichel (3) . Questa reazione viene effettuata utilizzando potassa caustica e acqua bromo.
4) Precipitazioni sotto forma di solfuro. Dove l'ossido di nichel verrà utilizzato come forma di peso2.
5) Metodo elettrolitico
6) Metodo volumetrico - ovvero titolazione del cianuro di potassio alla formazione di cianuro complesso (potassio 2 nichel ce en quattro volte)
7) Un metodo colorimetrico basato su un cambiamento nel colore dello ione nichel esamemina, o il colore rosso di un composto complesso solubile, che si forma dalla reazione degli ioni nichel 3 con la dimetilgliossima in una soluzione alcalina in presenza di un agente ossidante agente.
8) Metodo complessometrico.
METODO GRAVIMETRICO PER LA DETERMINAZIONE DEL NICHEL Il metodo si basa sulla precipitazione del nichel in una soluzione ammoniacale con dimetilgliossima come composto intercomplesso scarsamente solubile in presenza di acido citrico o tartarico.
METODO TITRIMETRICO PER LA DETERMINAZIONE DEL NICHEL
Il metodo si basa sulla precipitazione del nichel in una soluzione ammoniacale con dimetilgliossima come composto intracomplesso scarsamente solubile in presenza di acido citrico o tartarico e sulla determinazione del nichel mediante titolazione complessometrica con nero eriocromo T come indicatore.
Storia
Il nichel (nickel inglese, francese e tedesco) fu scoperto nel 1751. Tuttavia, molto prima, i minatori sassoni erano ben consapevoli del minerale, che sembrava minerale di rame ed era usato nella produzione del vetro per colorare il vetro di verde. Tutti i tentativi di ottenere rame da questo minerale non ebbero successo, e quindi alla fine del XVII secolo. Il minerale è stato chiamato Kupfernickel, che significa approssimativamente "Copper Devil". Questo minerale (pirite di nichel rosso NiAs) fu studiato nel 1751 dal mineralogista svedese Kronstedt. Riuscì ad ottenere l'ossido verde e, riducendo quest'ultimo, un nuovo metallo chiamato nichel. Quando Bergman ricevette il metallo in una forma più pura, scoprì che le proprietà del metallo erano simili a quelle del ferro; Il nichel è stato studiato in modo più approfondito da molti chimici, a cominciare da Proust. Nikkel è una parolaccia nel linguaggio dei minatori. Era formato dal distorto Nicolaus, una parola generica che aveva diversi significati. Ma soprattutto la parola Nicolaus serviva a caratterizzare le persone bifronte; inoltre, significava "un piccolo spirito dispettoso", "mocassino ingannevole", ecc. Nella letteratura russa dell'inizio del XIX secolo. furono usati i nomi nikolan (Scherer, 1808), nikolan (Zakharov, 1810), nicol e nickel (Dvigubsky, 1824).
Proprietà fisiche
Il metallo nichel ha un colore argenteo con una sfumatura giallastra, è molto duro, duttile e malleabile, si lucida bene, è attratto da un magnete, mostrando proprietà magnetiche a temperature inferiori a 340 ° C.
Proprietà chimiche
Nichel dicloruro (NiCl2)
Gli atomi di nichel hanno una configurazione elettronica esterna di 3d84s2. Lo stato di ossidazione di Ni(II) è il più stabile per il nichel.
Il nichel forma composti con stati di ossidazione +2 e +3. In questo caso, il nichel con uno stato di ossidazione di +3 è solo sotto forma di sali complessi. Per i composti di nichel +2 è noto un gran numero di composti ordinari e complessi. L'ossido di nichel Ni2O3 è un forte agente ossidante.
Il nichel è caratterizzato da un'elevata resistenza alla corrosione: è stabile nell'aria, nell'acqua, negli alcali, in numerosi acidi. La resistenza chimica è dovuta alla sua tendenza alla passivazione - la formazione di un denso film di ossido sulla sua superficie, che ha un effetto protettivo. Il nichel si dissolve attivamente in acido nitrico.
Con il monossido di carbonio CO, il nichel forma facilmente un carbonile volatile e altamente tossico Ni(CO)4.
La polvere di nichel finemente dispersa è piroforica (si autoinfiamma all'aria).
Il nichel brucia solo sotto forma di polvere. Forma due ossidi NiO e Ni2O3 e, rispettivamente, due idrossidi Ni(OH)2 e Ni(OH)3. I più importanti sali solubili di nichel sono acetato, cloruro, nitrato e solfato. Le soluzioni sono solitamente di colore verde, mentre i sali anidri sono gialli o giallo-marrone. I sali insolubili includono ossalato e fosfato (verde), i tre solfuri NiS (nero), Ni2S3 (bronzo giallastro) e Ni3S4 (nero). Il nichel forma anche numerose coordinazioni e composti complessi. Ad esempio, il nichel dimetilgliossimato Ni(C4H6N2O2)2, che conferisce un colore rosso chiaro in ambienti acidi, è ampiamente utilizzato nell'analisi qualitativa per la rilevazione del nichel.
Una soluzione acquosa di solfato di nichel in un barattolo è verde.
Le soluzioni acquose di sali di nichel (II) contengono lo ione esaaquanickel (II) 2+. Quando una soluzione di ammoniaca viene aggiunta a una soluzione contenente questi ioni, l'idrossido di nichel (II), una sostanza gelatinosa verde, precipita. Questo precipitato si dissolve quando viene aggiunta una quantità eccessiva di ammoniaca a causa della formazione di ioni esameminonichel(II) 2+.
Il nichel forma complessi con strutture quadrate tetraedriche e piatte. Ad esempio, il complesso tetracloronichelato (II) 2− ha una struttura tetraedrica, mentre il complesso tetracianonichelato (II) 2− ha una struttura quadrata planare.
L'analisi qualitativa e quantitativa utilizza una soluzione alcalina di butandionediossima, nota anche come dimetilgliossima, per rilevare gli ioni nichel (II). Quando interagisce con gli ioni nichel (II), si forma un composto di coordinazione rosso bis (butandionediossimato) nichel (II). È un composto chelato e il ligando butandionediossimato è bidentato.
Essere nella natura
Il nichel è abbastanza comune in natura: il suo contenuto nella crosta terrestre è di ca. 0,01% (massa). Si presenta nella crosta terrestre solo in forma legata; i meteoriti di ferro contengono nichel nativo (fino all'8%). Il suo contenuto nelle rocce ultrabasiche è circa 200 volte superiore a quello in quelle acide (1,2 kg/t e 8 g/t). Nelle rocce ultramafiche, la quantità predominante di nichel è associata a olivine contenenti 0,13–0,41% di Ni. Sostituisce isomorfo ferro e magnesio. Una piccola parte di nichel è presente sotto forma di solfuri. Il nichel presenta proprietà siderofile e calcofile. Con un aumento del contenuto di zolfo nel magma, compaiono solfuri di nichel insieme a rame, cobalto, ferro e platinoidi. In un processo idrotermale, insieme a cobalto, arsenico e zolfo, e talvolta con bismuto, uranio e argento, il nichel forma concentrazioni elevate sotto forma di arseniuri e solfuri di nichel. Il nichel si trova comunemente nei minerali di rame-nichel contenenti solfuro e arsenico.
*Nichel (pirite di nichel rossa, kupfernickel) NiAs
* cloantite (pirite di nichel bianco) (Ni, Co, Fe)As2
* garnierite (Mg, Ni)6(Si4O11)(OH)6*H2O e altri silicati
* piriti magnetiche (Fe, Ni, Cu)S
* arsenico-nichel lucido (gersdorfite) NiAsS,
* pentlandite (Fe,Ni)9S8
Nelle piante, in media, 5 × 10 −5 percento in peso di nichel, negli animali marini - 1,6 × 10 −4, negli animali terrestri - 1 × 10 −6, nel corpo umano - 1 ... 2 × 10 −6 . Si sa molto sul nichel negli organismi. È stato stabilito, ad esempio, che il suo contenuto nel sangue umano cambia con l'età, che negli animali la quantità di nichel nel corpo aumenta e, infine, che esistono alcune piante e microrganismi - "concentratori" di nichel, contenenti migliaia e persino centinaia di migliaia di volte più nichel dell'ambiente.
Depositi di minerali di nichel
I principali depositi di minerali di nichel si trovano in Canada, Russia, Nuova Caledonia, Filippine, Indonesia, Cina, Finlandia e Australia. Isotopi naturali del nichel.
Il nichel naturale contiene 5 isotopi stabili: 58Ni (68,27%), 60Ni (26,10%), 61Ni (1,13%), 62Ni (3,59%), 64Ni (0,91%).
Ricevuta
Le riserve totali di nichel nei minerali all'inizio del 1998 sono stimate a 135 milioni di tonnellate, comprese le riserve affidabili di 49 milioni di tonnellate.
I principali minerali di nichel - nichel (kupfernickel) NiAs, millerite NiS, pentlandite (FeNi)9S8 - contengono anche arsenico, ferro e zolfo; Le inclusioni di pentlandite si verificano anche nella pirrotite ignea. Altri minerali da cui viene estratto anche il Ni contengono impurità di Co, Cu, Fe e Mg. A volte il nichel è il prodotto principale del processo di raffinazione, ma più spesso si ottiene come sottoprodotto in altre tecnologie dei metalli. Delle riserve affidabili, secondo varie fonti, dal 40 al 66% del nichel si trova nei "minerali di nichel ossidato" (ONR), il 33% - in solfuro, lo 0,7% - in altri. Nel 1997, la quota di nichel prodotta dalla lavorazione dell'OHP era circa il 40% della produzione mondiale. In condizioni industriali, l'OHP è diviso in due tipi: magnesiaco e ferruginoso.
I minerali magnesiaci refrattari, di norma, sono sottoposti a fusione elettrica per ferronichel (5-50% Ni + Co, a seconda della composizione della materia prima e delle caratteristiche tecnologiche).
I minerali più ferruginosi - lateritici vengono lavorati con metodi idrometallurgici utilizzando la lisciviazione di carbonato di ammoniaca o la lisciviazione in autoclave di acido solforico. A seconda della composizione delle materie prime e degli schemi tecnologici applicati, i prodotti finali di queste tecnologie sono: ossido di nichel (76-90% Ni), sinterizzazione (89% Ni), concentrati di solfuro di varie composizioni, nonché metallo elettrolitico nichel, polveri di nichel e cobalto.
Meno ferruginoso: i minerali non troniti vengono sciolti in matte. Nelle imprese che operano a ciclo completo, un ulteriore schema di lavorazione comprende la conversione, la tostatura opaca, la fusione elettrica dell'ossido di nichel per ottenere nichel metallico. Lungo il percorso, il cobalto estratto viene prodotto sotto forma di metallo e/o sali. Un'altra fonte di nichel: nelle ceneri dei carboni del Galles meridionale in Inghilterra - fino a 78 kg di nichel per tonnellata. L'aumento del contenuto di nichel in alcuni carboni, petrolio, scisti indica la possibilità di concentrazione di nichel da parte della materia organica fossile. Le ragioni di questo fenomeno non sono state ancora chiarite.
La maggior parte del nichel è ottenuta da garnierite e pirite magnetiche.
1. Il minerale di silicato viene ridotto con polvere di carbone in forni tubolari rotanti in pellet di ferro-nichel (5-8% Ni), che vengono poi purificati dallo zolfo, calcinati e trattati con una soluzione di ammoniaca. Dopo che la soluzione è stata acidificata, da essa si ottiene elettroliticamente un metallo.
2. Metodo carbonilico (metodo Mond). In primo luogo, l'opaco di rame-nichel si ottiene dal minerale di solfuro, sul quale la CO viene fatta passare ad alta pressione. Si forma tetracarbonilnichel facilmente volatile, la cui decomposizione termica produce un metallo particolarmente puro.
3. Metodo alluminotermico di recupero del nichel dal minerale di ossido: 3NiO + 2Al = 3Ni + Al2O3
Applicazione
Leghe
Il nichel è la base della maggior parte delle superleghe, materiali ad alta temperatura utilizzati nell'industria aerospaziale per parti di centrali elettriche.
* Monel metallo (65 - 67% Ni + 30 - 32% Cu + 1% Mn), resistente al calore fino a 500 °C, molto resistente alla corrosione;
* oro bianco (ad esempio, 585 campioni contengono il 58,5% di oro e una lega (legatura) di argento e nichel (o palladio));
* nicromo, lega di resistenza (60% Ni + 40% Cr);
* permalloy (76% Ni + 17% Fe + 5% Cu + 2% Cr), ha un'elevata suscettività magnetica con perdite per isteresi molto basse;
* Invar (65% Fe + 35% Ni), quasi non si allunga se riscaldato;
* Inoltre, le leghe di nichel includono acciai al nichel e cromo-nichel, alpacca e varie leghe di resistenza come costantana, nichel e manganina.
placcatura al nichel
La nichelatura è la creazione di un rivestimento di nichel sulla superficie di un altro metallo per proteggerlo dalla corrosione. Viene eseguito mediante galvanica utilizzando elettroliti contenenti solfato di nichel (II), cloruro di sodio, idrossido di boro, tensioattivi e sostanze lucide e anodi di nichel solubili. Lo spessore dello strato di nichel risultante è di 12-36 µm. La stabilità della brillantezza superficiale può essere garantita dalla successiva cromatura (spessore dello strato di cromo 0,3 µm).
La nichelatura senza corrente viene eseguita in una soluzione di una miscela di cloruro di nichel (II) e ipofosfito di sodio in presenza di citrato di sodio:
NiCl2 + NaH2PO2 + H2O = Ni + NaH2PO3 + 2HCl
Il processo viene condotto a pH 4-6 e 95 °C.
Produzione di batterie
Fabbricazione di batterie ferro-nichel, nichel-cadmio, nichel-zinco, nichel-idrogeno.
Tecnologie di radiazione
Il nuclide 63Ni che emette particelle β+ ha un tempo di dimezzamento di 100,1 anni ed è utilizzato nei krytron.
La medicina
* Viene utilizzato nella produzione di sistemi di staffe (nicheluro di titanio).
* Protesi
conio
Il nichel è ampiamente utilizzato nella produzione di monete in molti paesi. Negli Stati Uniti, la moneta da 5 cent è colloquialmente nota come nichel.
Ruolo biologico
Ruolo biologico: il nichel è uno degli oligoelementi necessari per il normale sviluppo degli organismi viventi. Tuttavia, si sa poco del suo ruolo negli organismi viventi. È noto che il nichel prende parte alle reazioni enzimatiche negli animali e nelle piante. Negli animali si accumula nei tessuti cheratinizzati, specialmente nelle piume. Un aumento del contenuto di nichel nel suolo porta a malattie endemiche: forme brutte compaiono nelle piante e malattie degli occhi negli animali associate all'accumulo di nichel nella cornea. Dose tossica (per ratti) - 50 mg. Particolarmente dannosi sono i composti volatili del nichel, in particolare il suo tetracarbonil Ni(CO)4. L'MPC dei composti di nichel in aria varia da 0,0002 a 0,001 mg/m3 (per vari composti).
Azione fisiologica
Il nichel è la principale causa di allergia (dermatite da contatto) ai metalli che vengono a contatto con la pelle (gioielli, orologi, borchie dei jeans). Nell'Unione Europea, il contenuto di nichel nei prodotti che vengono a contatto con la pelle umana è limitato.
Il nichel carbonile è altamente tossico. La concentrazione massima consentita dei suoi vapori nell'aria dei locali industriali è di 0,0005 mg/m³.
Nel XX secolo si è scoperto che il pancreas è molto ricco di nichel. Quando somministrato dopo l'insulina, il nichel prolunga l'azione dell'insulina e quindi aumenta l'attività ipoglicemizzante. Il nichel influenza i processi enzimatici, l'ossidazione dell'acido ascorbico, accelera la transizione dei gruppi sulfidrilici a quelli disolfuro. Il nichel può inibire l'azione dell'adrenalina e abbassare la pressione sanguigna. L'eccessiva assunzione di nichel nel corpo provoca la vitiligine. Il nichel si deposita nel pancreas e nelle ghiandole paratiroidi.
Nichel- una sostanza semplice, duttile, malleabile, metallo di transizione bianco-argenteo, a temperature ordinarie in aria è ricoperta da un sottile film di ossido. Chimicamente inattivo. Appartiene ai metalli pesanti non ferrosi, non si trova nella sua forma pura sulla terra - di solito è incluso in vari minerali, ha un'elevata durezza, è ben levigato, è un ferromagnete - è attratto da un magnete, nel sistema periodico di Mendeleev è designato dal simbolo Ni e ha 28 numeri di serie.
Guarda anche:
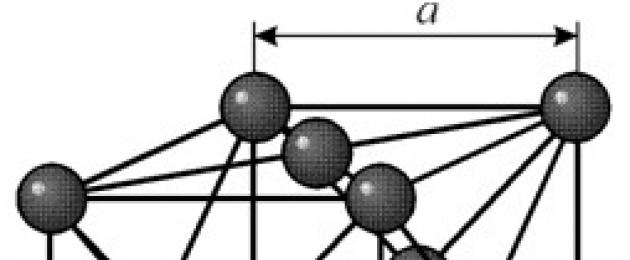
STRUTTURA
 Ha un reticolo cubico a facce centrate con un periodo a = 0.35238 å nm, gruppo spaziale Fm3m. Questa struttura cristallina è resistente alla pressione di almeno 70 GPa. In condizioni normali, il nichel esiste sotto forma di b-modifica avente un reticolo cubico centrato sulla faccia (a = 3,5236 å). Ma il nichel, sottoposto a sputtering catodico in un'atmosfera di h 2 , forma una modifica a con un reticolo esagonale compatto (a = 2,65 å, c = 4,32 å), che, riscaldato oltre i 200 °C, si trasforma in un uno cubico. Il nichel cubico compatto ha una densità di 8,9 g / cm 3 (20 ° C), un raggio atomico di 1,24 å
Ha un reticolo cubico a facce centrate con un periodo a = 0.35238 å nm, gruppo spaziale Fm3m. Questa struttura cristallina è resistente alla pressione di almeno 70 GPa. In condizioni normali, il nichel esiste sotto forma di b-modifica avente un reticolo cubico centrato sulla faccia (a = 3,5236 å). Ma il nichel, sottoposto a sputtering catodico in un'atmosfera di h 2 , forma una modifica a con un reticolo esagonale compatto (a = 2,65 å, c = 4,32 å), che, riscaldato oltre i 200 °C, si trasforma in un uno cubico. Il nichel cubico compatto ha una densità di 8,9 g / cm 3 (20 ° C), un raggio atomico di 1,24 å PROPRIETÀ
 Il nichel è un metallo malleabile e malleabile che può essere utilizzato per realizzare i fogli e i tubi più sottili. Carico di rottura 400-500 MN/m 2 , limite elastico 80 MN/m 2 , carico di snervamento 120 MN/m 2 ; allungamento 40%; modulo di elasticità normale 205 Gn/m 2 ; Durezza Brinell 600-800 MN/m 2 . Nell'intervallo di temperatura da 0 a 631K (il limite superiore corrisponde al punto di Curie). Il ferromagnetismo del nichel è dovuto alle peculiarità della struttura dei gusci elettronici esterni dei suoi atomi. Il nichel è un componente dei più importanti materiali e leghe magnetiche con un minimo coefficiente di dilatazione termica (permalloy, monel metal, invar, ecc.).
Il nichel è un metallo malleabile e malleabile che può essere utilizzato per realizzare i fogli e i tubi più sottili. Carico di rottura 400-500 MN/m 2 , limite elastico 80 MN/m 2 , carico di snervamento 120 MN/m 2 ; allungamento 40%; modulo di elasticità normale 205 Gn/m 2 ; Durezza Brinell 600-800 MN/m 2 . Nell'intervallo di temperatura da 0 a 631K (il limite superiore corrisponde al punto di Curie). Il ferromagnetismo del nichel è dovuto alle peculiarità della struttura dei gusci elettronici esterni dei suoi atomi. Il nichel è un componente dei più importanti materiali e leghe magnetiche con un minimo coefficiente di dilatazione termica (permalloy, monel metal, invar, ecc.).
RISERVE E PRODUZIONE
 Il nichel è abbastanza comune in natura: il suo contenuto nella crosta terrestre è di circa lo 0,01% (massa). Si trova nella crosta terrestre solo in forma legata; i meteoriti di ferro contengono nichel nativo (fino all'8%). Il suo contenuto nelle rocce ultrabasiche è circa 200 volte superiore a quello in quelle acide (1,2 kg/t e 8 g/t). Nelle rocce ultramafiche, la quantità predominante di nichel è associata a olivine contenenti 0,13 - 0,41% di Ni.
Il nichel è abbastanza comune in natura: il suo contenuto nella crosta terrestre è di circa lo 0,01% (massa). Si trova nella crosta terrestre solo in forma legata; i meteoriti di ferro contengono nichel nativo (fino all'8%). Il suo contenuto nelle rocce ultrabasiche è circa 200 volte superiore a quello in quelle acide (1,2 kg/t e 8 g/t). Nelle rocce ultramafiche, la quantità predominante di nichel è associata a olivine contenenti 0,13 - 0,41% di Ni.
Nelle piante, in media, 5 10 -5 percento in peso di nichel, negli animali marini - 1,6 10 -4, negli animali terrestri - 1 10 -6, nel corpo umano - 1 ... 2 10 -6.
La maggior parte del nichel è ottenuta da garnierite e pirite magnetiche.
Il minerale di silicato viene ridotto con polvere di carbone in forni tubolari rotanti in pellet di ferro-nichel (5-8% Ni), che vengono poi purificati dallo zolfo, calcinati e trattati con una soluzione di ammoniaca. Dopo che la soluzione è stata acidificata, da essa si ottiene elettroliticamente un metallo.
Metodo carbonilico (metodo Mond): in primo luogo, il matte di rame-nichel viene ottenuto dal minerale di solfuro, sul quale viene fatta passare la CO ad alta pressione. Si forma tetracarbonilnichel facilmente volatile, la cui decomposizione termica produce un metallo particolarmente puro.
Metodo alluminotermico per recuperare il nichel dal minerale di ossido: 3NiO + 2Al = 3Ni + Al 2 O 3
ORIGINE
 I depositi di minerali di solfuro di rame-nichel sono associati a massicci simili a lopolit oa placche di gabbroidi stratificati confinati in zone di faglie profonde su antichi scudi e piattaforme. Una caratteristica dei depositi di rame-nichel in tutto il mondo è la consistente composizione minerale dei minerali: pirrotite, pentlandite, calcopirite, magnetite; oltre a questi, nei minerali si trovano pirite, cubanite, polidimite, nichel, millerite, violarite, minerali del gruppo del platino, occasionalmente cromite, nichel e arsenidi di cobalto, galena, sfalerite, bornite, makinavite, wallerite, grafite, oro nativo.
I depositi di minerali di solfuro di rame-nichel sono associati a massicci simili a lopolit oa placche di gabbroidi stratificati confinati in zone di faglie profonde su antichi scudi e piattaforme. Una caratteristica dei depositi di rame-nichel in tutto il mondo è la consistente composizione minerale dei minerali: pirrotite, pentlandite, calcopirite, magnetite; oltre a questi, nei minerali si trovano pirite, cubanite, polidimite, nichel, millerite, violarite, minerali del gruppo del platino, occasionalmente cromite, nichel e arsenidi di cobalto, galena, sfalerite, bornite, makinavite, wallerite, grafite, oro nativo.
I depositi esogeni di minerali di nichel silicato sono universalmente associati a uno o un altro tipo di crosta di alterazione delle serpenteniti. durante l'erosione avviene la decomposizione graduale dei minerali, nonché il trasferimento di elementi mobili, con l'ausilio dell'acqua, dalle parti superiori della crosta a quelle inferiori. Lì, questi elementi precipitano sotto forma di minerali secondari.
I depositi di questo tipo contengono riserve di nichel che sono 3 volte superiori alle sue riserve nei minerali di solfuro e le riserve di alcuni depositi raggiungono 1 milione di tonnellate o più di nichel. Grandi riserve di minerali di silicato sono concentrate in Nuova Caledonia, Filippine, Indonesia, Australia e altri paesi. Il contenuto medio di nichel in essi è dell'1,1-2%. Inoltre, i minerali contengono spesso cobalto.
APPLICAZIONE
La stragrande maggioranza del nichel viene utilizzata per ottenere leghe con altri metalli (fe, cr, cu, ecc.), che si distinguono per elevate proprietà meccaniche, anticorrosive, magnetiche o elettriche e termoelettriche. In connessione con lo sviluppo della tecnologia a getto e la creazione di impianti a turbina a gas, le leghe di cromo-nichel resistenti al calore e resistenti al calore sono particolarmente importanti. Le leghe di nichel sono utilizzate nella costruzione di reattori nucleari.
Una quantità significativa di nichel viene consumata per la produzione di batterie alcaline e rivestimenti anticorrosione. Il nichel malleabile nella sua forma pura viene utilizzato per la fabbricazione di lastre, tubi, ecc. Viene anche utilizzato nell'industria chimica per la fabbricazione di attrezzature chimiche speciali e come catalizzatore per molti processi chimici. Il nichel è un metallo molto raro e, se possibile, dovrebbe essere sostituito da altri materiali più economici e comuni.
Viene utilizzato nella produzione di sistemi di staffe (nicheluro di titanio), protesi. È ampiamente utilizzato nella produzione di monete in molti paesi. Negli Stati Uniti, la moneta da 5 cent è colloquialmente nota come nichel. Il nichel è utilizzato anche per la produzione di corde di avvolgimento di strumenti musicali.
Nichel - Ni
CLASSIFICAZIONE
| Strunz (ottava edizione) | 1/A.08-10 |
| Nickel-Strunz (10a edizione) | 1.AA.05 |
| Dana (7a edizione) | 1.1.17.2 |
| Dana (ottava edizione) | 1.1.11.5 | Hey's CIM Rif | 1.61 |
Le proprietà del nichel sono parametri importanti per la ricerca, la lavorazione e le applicazioni del metallo. Sono presi in considerazione quando si formano composizioni con altri materiali.
Le proprietà del nichel determinano il suo utilizzo nella produzione
Il nichel è un metallo dal caratteristico colore bianco-argenteo. Alla temperatura di 1453 °C diventa liquido e bolle a 2732 °C. Il nichel è duttile e facilmente lavorabile sotto pressione.
La proprietà chimica del nichel è caratterizzata dalla sua capacità di formare composti con vari gradi di ossidazione. In condizioni naturali, sulla superficie metallica appare un sottile film di ossido.
Il metallo ha un alto tasso di resistenza alla corrosione. Il nichel non reagisce con un numero di acidi e alcali concentrati, ma si dissolve attivamente in acido nitrico diluito.

Entrando nelle reazioni chimiche, il nichel forma metalli volatili e sali solubili/insolubili
Non reagiscono con il nichel.
- gas inerti;
- litio;
- potassio;
- sodio;
- cesio;
- rubidio;
- stronzio;
- bario;
- iridio;
- cesio.
Il nichel si combina con il carbonio per formare il carbonile, un metallo di transizione volatile utilizzato nella produzione di materiali di elevata purezza. La polvere di nichel è in grado di autoaccendersi a contatto con l'aria per formare ossidi.
Il nichel produce una serie di sali solubili e insolubili. Ad esempio, una soluzione di solfato metallico conferisce al liquido un colore verde. I sali insolubili di solito hanno un colore giallo intenso.
Forme per trovare il metallo
In condizioni naturali, il nichel si trova in combinazione con un numero di elementi chimici e sotto forma di pepite si trova nei meteoriti di ferro.
In condizioni idrotermali, il nichel forma composti con arsenico, cobalto e argento. Elevate concentrazioni di metalli sono associate a formazioni minerali: arseniuri e solfuri.

In natura, il nichel si trova solitamente in composti con altri elementi.
La materia prima per l'estrazione di un componente prezioso è il solfuro, minerali di rame-nichel contenenti arsenico:
- nichelina: un composto con arsenico;
- cloantite - pirite bianca contenente cobalto e ferro;
- garnierite - roccia silicatica contenente magnesio;
- piriti magnetiche - un composto di zolfo con ferro e rame;
- gersdorfite: lucentezza di arsenico-nichel;
- pentlandite è un composto di zolfo, ferro e nichel.
Il contenuto di metallo negli organismi viventi dipende dalle condizioni e dall'ambiente. Alcuni rappresentanti della flora e della fauna sono in grado di concentrare il metallo.
I principali depositi di minerali si trovano in Canada, Federazione Russa, Albania, Sud Africa, Cuba e Grecia.
Il processo di estrazione del metallo dai minerali comporta l'uso di tecnologie a seconda del tipo di materia prima. Il nichel a volte è un materiale di arricchimento minore per la roccia.
I minerali refrattari contenenti magnesio sono sottoposti a fusione elettrica. I minerali lateritici contenenti ferro vengono lavorati con il metodo idrometallurgico, seguito dal trattamento con soluzioni alcaline.
La roccia con un contenuto di ferro inferiore viene fusa, cotta e fusa elettricamente. Lungo il percorso vengono recuperati cobalto metallico o suoi sali. Un contenuto maggiore del metallo si osserva nelle ceneri dei carboni fossili in Inghilterra. Questo fatto è associato all'attività dei microrganismi che concentrano il nichel.
La plasticità e altre proprietà fisiche dei composti di nichel dipendono dalla purezza del materiale. Una leggera mescolanza di zolfo rende fragile il metallo. L'aggiunta di magnesio al materiale fuso purifica la miscela dalle impurità minori con la formazione di un composto con lo zolfo.
Industrie in cui viene utilizzato il nichel
Le proprietà fisiche e chimiche del metallo ne determinano l'uso:
- nella produzione di acciaio inossidabile;
- per la formazione di leghe che non contengono ferro;
- allo scopo di applicare rivestimenti protettivi ai prodotti mediante metodo galvanico;
- per la produzione di reagenti chimici;
- nella metallurgia delle polveri.
Il metallo viene utilizzato nella produzione di batterie, con il suo aiuto si verificano processi catalitici di reazioni chimiche nella produzione industriale. Le leghe di titanio sono un materiale eccellente per realizzare protesi dentarie e dispositivi di allineamento dei denti.
La composizione basata sull'elemento chimico n. 28 è una materia prima per coniare monete, produrre bobine di sigarette elettroniche. Viene utilizzato per avvolgere le corde degli strumenti musicali.
Nella produzione di nuclei per elettromagneti vengono utilizzate composizioni: permalloy, incluso il 20-60% di ferro. Il nichel è utilizzato nella fabbricazione di varie parti e attrezzature per l'industria chimica.
Gli ossidi metallici sono utilizzati nella produzione di vetro, smalti e ceramica. La produzione moderna è specializzata nella produzione di una varietà di prodotti laminati: filo, nastro, lamina, tubi.

Il nichel ha una vasta gamma di applicazioni, dai rivestimenti ai prodotti chimici
La resistenza agli ambienti aggressivi consente di utilizzare il nichel laminato per il trasporto di alcali nell'industria chimica.
Gli strumenti in lega a base di nichel sono utilizzati in medicina e nella ricerca scientifica. Il metallo viene utilizzato per creare strumenti di precisione per il controllo remoto di processi nell'industria nucleare e installazioni radar.
Caratteristiche delle leghe di nichel
Nelle composizioni il metallo è abbinato principalmente al ferro e al cobalto. Viene utilizzato come componente di lega madre per la produzione di vari acciai strutturali, leghe magnetiche e non magnetiche.
Le leghe metalliche basate sull'elemento chimico n. 28 hanno resistenza, resistenza alle temperature, deformazione e influenze ambientali. Il loro numero raggiunge diverse migliaia. Le composizioni più comuni sono combinazioni con cromo, molibdeno, alluminio, titanio, berillio.
Il metallo è considerato il componente della legatura dell'oro, che conferisce ai gioielli il caratteristico colore bianco e la forza. In relazione a questa composizione, ci sono opinioni sull'effetto allergico del nichel sulla pelle.
In combinazione con il cromo si forma un composto di nicromo resistente alle alte temperature, con coefficiente minimo di resistenza elettrica e duttilità.
Viene utilizzato per la fabbricazione di dispositivi di riscaldamento, parti, come rivestimento. L'elevata resistenza della connessione consente di lavorarla, tornita, saldata, stampata.

Le leghe di nichel hanno un'elevata resistenza, che consente loro di essere ampiamente utilizzate nella produzione.
Un gruppo speciale è formato da leghe, che includono il rame. Tra questi, i più popolari sono:
- monel;
- ottone;
- bronzo;
- argento alpacca.
Più di un secolo fa, si è scoperto che una composizione ferro-nichel contenente il 28% del metallo descritto perde le sue proprietà di magnetizzazione. Le leghe contenenti il 36% di nichel sono caratterizzate da una leggera espansione lineare, che ne consente l'utilizzo nella fabbricazione di strumenti e strumenti di precisione.
Questa composizione, designata FeNi36, è chiamata invar, cioè "immutabile". La lega Kovar contenente il 29% di nichel, il 17% di cobalto e il 54% di ferro ha trovato ampia applicazione nella produzione.
Ha un'elevata adesione al vetro fuso, che consente di utilizzare la composizione per realizzare cavi elettrici che passano attraverso questa sostanza.
- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0