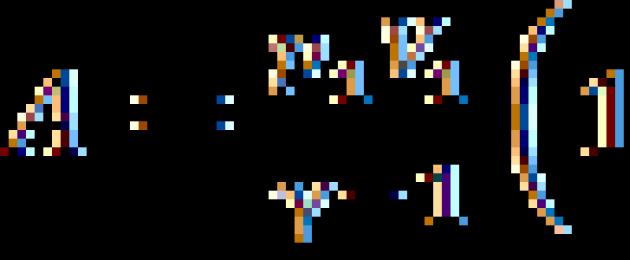INTRODUZIONE
Secondo il primo principio della termodinamica, la quantità di energia impartita al sistema nel processo di scambio termico dQ va a modificare la sua energia interna dU e al sistema compiendo lavoro dA contro le forze esterne:
La quantità di calore necessaria per riscaldare una (chilo) mole di gas di un grado è determinata dalla capacità termica molare - CON.
L'entità della capacità termica dipende dalle condizioni di riscaldamento. Esistono due tipi di capacità termica: C p - capacità termica molare a pressione costante e C v - capacità termica molare a volume costante, correlata dall'equazione:
С p = С v +R, (2)
dove R è la costante universale dei gas, numericamente uguale al lavoro compiuto riscaldando una mole di gas ideale di un Kelvin a pressione costante.
Un processo che avviene senza scambio di calore con l'ambiente (dQ = 0) è detto adiabatico. È descritto dall'equazione di Poisson:
Il lavoro di una trasformazione adiabatica, come segue dalla Prima Legge della Termodinamica (3), si compie solo grazie a variazioni di energia interna:
Il lavoro totale di una trasformazione adiabatica può essere calcolato utilizzando la formula:
![]() (5)
(5)
Strumenti e accessori: manometro del liquido, bottiglia di vetro chiusa con valvola a tre vie, pompa.
TEORIA DEL METODO E DESCRIZIONE DELL'IMPIANTO.
Metodo per determinare C p / C v , utilizzato nel lavoro si basa sul processo di espansione adiabatica dell'aria.
L'installazione (Fig. 22) è costituita da un cilindro a pareti spesse 2, collegato alla pompa di iniezione 3 e manometro dell'acqua a forma di U aperto 1. Valvola a tre vie 4 consente di collegare il cilindro ad una pompa o ad un'atmosfera.
Indichiamo la massa di gas in una bombola a pressione atmosferica: m1.
Se si collega una bombola a una pompa e si pompa aria, la pressione nella bombola aumenterà e diventerà uguale p1 =p0 +h1, Dove h 1- eccesso rispetto alla pressione atmosferica p0, misurato dal manometro, (p 0, E h 1 devono essere espressi nelle stesse unità).
Nota. Poiché l'aria nel cilindro si riscalda durante l'iniezione, misurare la pressione in eccesso h 1 dovrebbe essere effettuato quando la temperatura dell'aria nel cilindro raggiunge la temperatura ambiente (dopo 1-2 minuti).
Massa di gas m1 occuperà ora un volume V 1 inferiore al volume del cilindro.
La sua condizione è caratterizzata dai seguenti parametri: p1, V1, T1 (figura 23). Se colleghi brevemente il palloncino all'atmosfera usando un rubinetto, l'aria si espanderà rapidamente (cioè adiabaticamente). Parte della massa d'aria M uscirà dal contenitore. La massa d'aria rimanente m 1, che occupava parte del volume della bombola prima dell'apertura della valvola, occuperà nuovamente l'intero volume Vk = V2. La pressione nel cilindro diventerà uguale a quella atmosferica (p2 =p0). La temperatura dell'aria a causa della sua espansione adiabatica sarà inferiore alla temperatura ambiente. Pertanto, nel momento in cui il rubinetto è chiuso, l'aria è nello stato II (p2, V2, T2).
Per massa di gas m 1, secondo la legge di Poisson (3), otteniamo:


Poiché la temperatura negli stati I e III è la stessa, secondo la legge Boyle-Mariotte:
Confrontando le uguaglianze (6) e (7), otteniamo:
Prendiamo il logaritmo di questa espressione
e risolverlo relativamente
Considerando questo p1 =p0 +h1; p2 = p0; p3 =p0 +h2 otteniamo:
![]()
Poiché le pressioni differiscono leggermente l'una dall'altra, approssimativamente nell'ultima espressione i logaritmi possono essere sostituiti da numeri:
![]() O
O
Per calcolare il lavoro di espansione adiabatica, utilizziamo la formula (5). Poiché secondo la legge di Poisson
allora la formula (5) assumerà la forma:
A= ![]()
Dove V≈V a, specificato sull'installazione.
FARE IL LAVORO
1. Utilizzando un rubinetto, collegare la bombola alla pompa e pompare aria fino a quando la differenza di livello del liquido nel manometro diventa 20-30 cm.
2. Chiudere il rubinetto e attendere finché non si stabiliscono i livelli del liquido nel manometro. Contare la differenza nei livelli del liquido nei gomiti del manometro h 1(contare lungo il bordo inferiore del menisco).
3. Aprire il rubinetto e nel momento in cui i livelli del liquido in entrambi i gomiti del manometro sono uguali, chiuderlo rapidamente.
4. Dopo aver atteso 1-2 minuti affinché l'aria nella bombola si scaldi fino a raggiungere la temperatura ambiente, misurare la differenza di livello del liquido in entrambi i gomiti del manometro h 2
5. Utilizzare un barometro per misurare la pressione atmosferica r0.
6. Immettere i dati nella tabella.
7. Ripeti l'esperimento (passaggi 1-4) almeno cinque volte.
| №№ | h 1,mm acqua. Arte. | h 2,mm acqua. Arte. | h 1 -h 2, mm acqua. Arte. | |||
INFORMATICA
1. Calcolare il valore per ciascuna misurazione utilizzando la formula (8).
Un gas ideale è un modello matematico di un gas in cui si assume che l'energia potenziale delle molecole sia trascurabile rispetto alla loro energia cinetica. Non ci sono forze di attrazione o repulsione tra le molecole, le collisioni delle particelle tra loro e con le pareti del vaso sono assolutamente elastiche, e il tempo di interazione tra le molecole è trascurabile rispetto al tempo medio tra le collisioni.
2. Quali sono i gradi di libertà delle molecole? In che modo il numero di gradi di libertà è correlato al rapporto di Poisson γ?
Il numero di gradi di libertà di un corpo è il numero di coordinate indipendenti che devono essere specificate per determinare completamente la posizione del corpo nello spazio. Ad esempio, un punto materiale che si muove arbitrariamente nello spazio ha tre gradi di libertà (coordinate x, y, z).
Le molecole di un gas monoatomico possono essere considerate punti materiali in quanto la massa di tale particella (atomo) è concentrata in un nucleo le cui dimensioni sono molto piccole (10 -13 cm). Pertanto, una molecola di gas monoatomica può avere solo tre gradi di libertà di movimento traslazionale.
Le molecole costituite da due, tre o più atomi non possono essere paragonate a punti materiali. Una molecola di gas biatomico, in prima approssimazione, è costituita da due atomi strettamente legati situati a una certa distanza l'uno dall'altro
3. Qual è la capacità termica di un gas ideale durante una trasformazione adiabatica?
La capacità termica è un valore pari alla quantità di calore che deve essere impartita a una sostanza per aumentare la sua temperatura di un kelvin.
4. In quali unità vengono misurate la pressione, il volume, la temperatura e la capacità termica molare nel sistema SI?
Pressione – kPa, volume – dm 3, temperatura – in Kelvin, capacità termiche molari – J/(molK)
5. Quali sono le capacità termiche molari Cp e Cv?
Un gas ha una capacità termica a volume costante C v e una capacità termica a pressione costante C p.
A volume costante, il lavoro delle forze esterne è zero e l'intera quantità di calore impartita al gas dall'esterno va interamente ad aumentare la sua energia interna U. Quindi, la capacità termica molare di un gas a volume costante C v è numericamente uguale alla variazione dell'energia interna di una mole di gas ∆U quando la sua temperatura aumenta di 1 K:
∆U=i/2*R(T+1)-i/2RT=i/2R
Pertanto, la capacità termica molare di un gas a volume costante
CON v=i/2R
capacità termica specifica a volume costante
CON v=i/2*R/μ
Quando un gas viene riscaldato a pressione costante, il gas si espande; la quantità di calore impartitagli dall'esterno va non solo ad aumentare la sua energia interna U, ma anche a compiere lavoro A contro le forze esterne. Di conseguenza, la capacità termica di un gas a pressione costante è maggiore della capacità termica a volume costante della quantità di lavoro A compiuto da una mole di gas durante l'espansione risultante da un aumento della sua temperatura di 1 K a pressione costante P:
C p = CON v+A
Si può dimostrare che per una mole di gas il lavoro è quindi A=R
C p = CON v+R=(i+2)/2*R
Utilizzando la relazione tra capacità termica specifica e capacità molare, troviamo per la capacità termica specifica:
C p = (i+2)/2*R
La misurazione diretta delle capacità termiche specifiche e molari è difficile, poiché la capacità termica del gas sarà una piccola frazione della capacità termica del contenitore in cui si trova il gas, e quindi la misurazione sarà estremamente imprecisa.
È più semplice misurare il rapporto di grandezza C p / CON v
γ=Cp/ CON v=(i+2)/i.
Questo rapporto dipende solo dal numero di gradi di libertà delle molecole che compongono il gas.
Oltre alla capacità termica specifica, viene introdotto il concetto di capacità termica molare, che è determinata dalla quantità di energia termica necessaria per riscaldare una mole di una sostanza di 1K.
Pertanto, se indichiamo la capacità termica specifica con Con e la capacità termica molare attraverso CON, allora è ovvio С = μс, dove μ è la massa di una mole della sostanza.
Per i gas, la capacità termica specifica, così come la capacità termica molare, dipende dalle condizioni in cui il gas viene riscaldato. Viene introdotto il concetto di due capacità termiche: capacità termica specifica a pressione costante con pag e capacità termica specifica a volume costante ConV.
Poiché il gas, quando si espande, funziona contro le forze della pressione esterna, la capacità termica specifica del gas a pressione costante è maggiore della capacità termica specifica a volume costante. Questo è s p > ConV.
Differenza di valori s p - ConV per un gas ideale si calcola teoricamente: è pari alla costante dei gas divisa per la massa di una mole della sostanza
Una trasformazione adiabatica, in cui non avviene scambio termico tra il gas e l'ambiente, è descritta dall'equazione di Poisson
dove γ è il rapporto tra il calore specifico di un gas ideale a pressione costante e il calore specifico dello stesso gas a volume costante, ovvero
Da considerazioni teoriche segue che per un gas biatomico il rapporto è 1,4. L'esperienza mostra che per i gas biatomici, ad esempio idrogeno, ossigeno, ecc., così come per l'aria, questo rapporto è vicino al suo valore teorico.
1. Descrizione del dispositivo e del metodo
Il dispositivo con cui si determina il rapporto è costituito da una bombola B, un manometro M, due rubinetti K 1 e K 2 e una pompa (Fig. 13).
Prima di iniziare il lavoro, nel cilindro m è presente una massa d'aria che, con le valvole K 1 e K 2 aperte, cioè a pressione atmosferica p 0, occupa il volume V 0. Temperatura ambiente TK.
Usando una pompa, pompiamo una certa massa d'aria nel cilindro e chiudiamo la valvola K1. La massa d'aria m che era nel cilindro viene compressa, cedendo parte del volume del cilindro ad una nuova porzione d'aria. Ora la massa d'aria occupa un volume inferiore al volume del cilindro V 1< V 0 , давление внутри баллона возрастает до р 1 = р 0 +Δh 1 .
Il contenuto del cilindro si riscaldava leggermente quando veniva pompata un'ulteriore porzione di aria. A causa della compressione adiabatica, il processo procede rapidamente e lo scambio termico con l'ambiente esterno non ha il tempo di avvenire. Pertanto è necessario attendere che la temperatura nella bombola diventi uguale a TK e si stabilisca la differenza di livello nel manometro Δh 1.
Quindi, il primo stato della massa d'aria m è caratterizzato dai parametri: p 1, V 1, T c.
ð 1 = ð 0 +Δh 1
Apriamo velocemente il rubinetto K2 e facciamo uscire l'aria finché la pressione all'interno della bombola non diventa uguale alla p0 atmosferica, quindi chiudiamo nuovamente il rubinetto K2. La massa m occuperà il volume dell'intero cilindro V 0, ma poiché il processo è avvenuto molto rapidamente, non essendoci stato scambio termico con l'ambiente esterno, la temperatura del contenuto del cilindro è scesa a T 2< Т 0 , то есть имеет место адиабатическое расширение.
Quindi, il secondo stato del gas è caratterizzato dai seguenti parametri:
p2 = p0; V2 = V0; T2< Т К.
Con le valvole K 1 e K 2 chiuse, attendere qualche minuto finché la temperatura non raggiunge la temperatura ambiente TK. Di conseguenza, la pressione all'interno della bombola aumenta a
ð 3 = ð 0 +Δh 2
dove Δh 2 è la differenza dei livelli del liquido nel manometro.
Il volume occupato dalla massa m d'aria è pari al volume del cilindro V 3 = V 0 . La temperatura è diventata temperatura ambiente TK. Il terzo stato dell'aria è caratterizzato dai seguenti parametri:
ð 3 = ð 0 +Δh 2 ; V3 = V0; TK.
Quindi la massa d’aria contenuta nel cilindro ha attraversato i seguenti stati:
IO. ð 1 = ð 0 +Δh 1 ; V1< V 0 ; Т К.
II. p2 = p0; V2 = V0; T2< Т К.
III. ð 3 = ð 0 +Δh 3 ;
V3 = V0; TK.
(40)
Il passaggio dallo stato I allo stato II è un processo adiabatico. Soddisfa l'equazione
(41)
Il passaggio dallo stato I allo stato III è isotermico. Soddisfa l'equazione Boyle-Marriott

Trasformiamo le equazioni (40) e (41)
 (42)
(42)
![]() (43)
(43)
ma p 1 = p 0 +Δh 1, V 2 = V 3 = V 0, p 3 = p 0 +Δh 3, p 2 = p 0

Sostituiamo in (42) invece del rapporto il suo valore da (43), otteniamo:
![]()
Prendendo il logaritmo di questa equazione, abbiamo


dalla teoria dei calcoli approssimati è noto che per piccoli valori di x:
(44)
Pertanto, misurando sperimentalmente e, possiamo determinare il rapporto tra le capacità termiche specifiche dell'aria:
II. L'ordine di lavoro.
1. Chiudere il rubinetto K 2 e aprire il rubinetto K 1. Con una pompa immettere aria nella bombola ad una pressione corrispondente alla differenza di livello del liquido Δh = 10 ÷ 15 cm e chiudere il rubinetto.
2.Attendere finché non si stabilisce la differenza di livello nel manometro, annotare questa differenza.
3. Aprire il rubinetto K 2 e nel momento in cui i livelli nel manometro sono uguali, chiuderlo, senza attendere che le vibrazioni del fluido nel manometro cessino.
4.Attendere che l'aria nel cilindro, raffreddata per espansione adiabatica, si riscaldi fino a raggiungere la temperatura ambiente. Annotare questa differenza Δh 2.
5. Utilizzando i valori ottenuti Δh 1 e Δh 2, calcolare
6. Esegui l'esperimento cinque volte e, in base ai dati ottenuti, calcola il valore medio
7. Far uscire l'aria dal cilindro aprendo brevemente il rubinetto K 2.
8.Calcola gli errori assoluti e relativi nella determinazione di γ
|
NO. |
Δh 1 , mm |
Δh 2 , mm |
||
|
1 |
||||
|
2 |
||||
|
3 |
||||
|
4 |
||||
|
5 |
Domande di sicurezza
1.Come si chiama capacità termica? capacità termica specifica? capacità termica molare? Annotare la relazione tra capacità termica specifica e molare.
2. Definire c p e c V, C p e C V. Da cosa dipende la capacità termica?
3. Derivare l'equazione di Mayer (relazione tra C p e C V).
4.Quale è maggiore e perché C p o CV V?
5.Quale processo è chiamato adiabatico. Scrivi l'equazione adiabatica. Cosa e perché l'adiabat o l'isoterma sono più ripide?
6.Scrivi la prima legge della termodinamica per una trasformazione adiabatica. Quali sono le quantità di calore, energia interna e lavoro in una trasformazione adiabatica?
7.Deriva l'equazione di Poisson.
8.Qual è l'esponente adiabatico? Da cosa dipende?
9. Quante volte e quando si verifica un processo adiabatico nel lavoro di laboratorio?
10. Definire l'entropia. Quale parametro è costante durante una trasformazione adiabatica? Scrivi la seconda legge della termodinamica.
11.Quale processo è chiamato ciclico? Ciclo di Carnot. Efficienza del ciclo di Carnot. In quali parti del ciclo di Carnot viene fornito e sottratto calore, e in quali parti viene compiuto lavoro dal gas e sul gas?
Viene chiamato il rapporto tra la quantità di calore ricevuta da un corpo con una variazione infinitesima del suo stato e la variazione associata della temperatura corporea capacità termica organismi in questo processo:
Tipicamente la capacità termica è riferita ad una quantità unitaria di una sostanza e, a seconda dell'unità scelta, si distingue:
capacità termica specifica di massaC , riferito a 1 kg di gas,
J/(kg·K);
capacità termica volumetrica specificaC, riferito alla quantità di gas contenuta in 1 m 3 di volume in condizioni fisiche normali, J/(m 3 K);
capacità termica molare specifica, riferito a una kilomole, J/(kmol·K).
La relazione tra le capacità termiche specifiche è stabilita da ovvie relazioni: ;
Ecco la densità del gas in condizioni normali.
La variazione della temperatura corporea a parità di calore impartito dipende quindi dalla natura del processo che si verifica durante questo processo la capacità termica è una funzione del processo. Ciò significa che lo stesso fluido di lavoro, a seconda del processo, richiede una diversa quantità di calore per riscaldarlo di 1 K. Numericamente, il valore di c varia da +∞ a -∞.
Nei calcoli termodinamici, sono di grande importanza:
capacità termica a pressione costante
pari al rapporto tra la quantità di calore impartita al corpo in un processo a pressione costante e la variazione della temperatura corporea dT
capacità termica a volume costante
uguale al rapporto tra la quantità di calore , fornito al corpo nel processo a volume costante, al cambiamento della temperatura corporea .
In accordo con la prima legge della termodinamica per i sistemi chiusi in cui si verificano processi di equilibrio ![]() , E
, E
Per una trasformazione isocora ( v=const) questa equazione assume la forma ![]() , e, tenendo conto della (1.5), otteniamo che
, e, tenendo conto della (1.5), otteniamo che
![]() ,
,
cioè, la capacità termica di un corpo a volume costante è uguale alla derivata parziale della sua energia interna rispetto alla temperatura e caratterizza la velocità di crescita dell'energia interna in un processo isocoro con aumento della temperatura.
Per un gas ideale
Per il processo isobarico () dall'equazione (2.16) e (2.14) otteniamo
Questa equazione mostra la relazione tra le capacità termiche con pag E cv. Per un gas ideale la cosa è molto semplificata. Infatti, l'energia interna di un gas ideale è determinata solo dalla sua temperatura e non dipende dal volume, quindi, e inoltre risulta dall'equazione di stato ![]() , Dove
, Dove
Questa relazione è chiamata equazione di Mayer ed è una delle principali nella termodinamica tecnica dei gas ideali.
In corso v=const il calore impartito al gas va solo a modificare la sua energia interna, durante il processo R= il calore costante viene speso sia per aumentare l'energia interna che per compiere lavoro contro le forze esterne. Ecco perché con pag Di più cv sull'importo di questo lavoro.
Per i gas reali, poiché quando si espandono (at P=const) il lavoro viene svolto non solo contro le forze esterne, ma anche contro le forze di attrazione che agiscono tra le molecole, il che provoca un ulteriore consumo di calore.
In genere, le capacità termiche vengono determinate sperimentalmente, ma per molte sostanze possono essere calcolate utilizzando metodi di fisica statistica.
Il valore numerico della capacità termica di un gas ideale può essere trovato mediante la teoria classica della capacità termica, basata sul teorema della distribuzione uniforme dell'energia sui gradi di libertà delle molecole. Secondo questo teorema l’energia interna di un gas ideale è direttamente proporzionale al numero di gradi di libertà delle molecole e all’energia kT/2, per un grado di libertà. Per 1 mole di gas
![]() ,
,
Dove NO- Numero di Avogadro; io- il numero di gradi di libertà (il numero di coordinate indipendenti che devono essere specificate per determinare completamente la posizione della molecola nello spazio).
Una molecola di gas monoatomica ha tre gradi di libertà, corrispondenti a tre componenti nella direzione degli assi coordinati, in cui può essere scomposto il movimento traslatorio. Una molecola di gas biatomico ha cinque gradi di libertà, poiché oltre al movimento traslazionale, può ruotare attorno a due assi perpendicolari alla linea che collega gli atomi (l'energia di rotazione attorno all'asse che collega gli atomi è zero se gli atomi sono considerati punti) . La molecola di un gas triatomico e generalmente poliatomico ha sei gradi di libertà: tre traslazionali e tre rotazionali.
Poiché per un gas ideale ![]() , allora le capacità termiche molari dei gas mono-, di- e poliatomici sono uguali, rispettivamente:
, allora le capacità termiche molari dei gas mono-, di- e poliatomici sono uguali, rispettivamente:
![]() ;
;![]() ;
; ![]() .
.
I risultati della teoria classica della capacità termica sono in buon accordo con i dati sperimentali nella regione della temperatura ambiente (Tabella 2.1), ma la conclusione principale sull’indipendenza dalla temperatura non è confermata dall’esperimento. Le discrepanze, particolarmente significative nella regione delle temperature basse e abbastanza elevate, sono associate al comportamento quantistico delle molecole e sono spiegate nel quadro della teoria quantistica della capacità termica.
Capacità termica di alcuni gas a t = 0°C in uno stato di gas ideale
Capacità termica specifica di una sostanza- un valore pari alla quantità di calore necessaria per riscaldare 1 kg di una sostanza di 1 K:
L'unità di capacità termica specifica è joule per chilogrammo kelvin (J/(kg K)).
Capacità termica molare- un valore pari alla quantità di calore necessaria per riscaldare 1 mole di una sostanza di 1 K:
Dove ν =m/M è la quantità di sostanza.
L'unità di capacità termica molare è joule per mole kelvin (J/(mol K)).
La capacità termica specifica c è correlata alla capacità termica molare C m, la relazione
dove M è la massa molare della sostanza.
Le capacità termiche si identificano a volume e pressione costanti se, durante il processo di riscaldamento di una sostanza, il suo volume o pressione vengono mantenuti costanti. Scriviamo l'espressione della prima legge della termodinamica per una mole di gas, tenendo conto della (1) e δA=pdV
Se il gas viene riscaldato a volume costante, allora dV = 0 e anche il lavoro delle forze esterne è zero. Quindi il calore impartito al gas dall'esterno non fa altro che aumentare la sua energia interna:
(4) cioè la capacità termica molare di un gas a volume costante C V è uguale alla variazione dell'energia interna di una mole di gas con un aumento della sua temperatura di 1 K. Poiché U m =( io/2)RT ,
Se il gas viene riscaldato a pressione costante, l'espressione (3) può essere rappresentata nella forma
Considerando che (U m/dT) non dipende dal tipo di processo (l'energia interna di un gas ideale non dipende né da p né da V, ma è determinata solo dalla temperatura T) ed è sempre pari a C V, e differenziando l'equazione di Clapeyron-Mendeleev pV m = RT per T (p=const), otteniamo
L'espressione (6) è chiamata equazione di Mayer; dice che C p è sempre maggiore di CV esattamente della quantità della costante molare dei gas. Ciò si spiega con il fatto che per riscaldare un gas a pressione costante è necessaria una quantità addizionale di calore per compiere il lavoro di espansione del gas, poiché la costanza della pressione è assicurata da un aumento del volume del gas il gas. Utilizzando (5), la formula (6) può essere scritta come
Quando si studiano i processi termodinamici è importante conoscere il rapporto C p/C V caratteristico di ciascun gas:
![]() (8)
(8)
chiamato indice adiabatico. Dalla teoria cinetica molecolare dei gas ideali si conoscono i valori numerici dell'esponente adiabatico che dipendono dal numero di atomi presenti nella molecola del gas:
Gas monoatomico γ = 1,67;
Gas biatomico γ = 1,4;
Gas tri- e poliatomici γ = 1,33.
(L'esponente adiabatico è indicato anche con k)
11. Calore. La prima legge della termodinamica.
L'energia interna di un sistema termodinamico può cambiare in due modi: attraverso il lavoro svolto sul sistema e attraverso lo scambio di calore con l'ambiente. Si chiama energia l'energia che un corpo riceve o perde nel processo di scambio termico con l'ambiente quantità di calore o semplicemente calore.
L'unità di misura in (SI) è joule. La caloria viene utilizzata anche come unità di misura del calore.
La prima legge della termodinamica è uno dei principi fondamentali della termodinamica, che è essenzialmente la legge di conservazione dell'energia applicata ai processi termodinamici.
La prima legge della termodinamica fu formulata a metà del XIX secolo come risultato del lavoro di J. R. Mayer, Joule e G. Helmholtz. La prima legge della termodinamica è spesso formulata come l'impossibilità dell'esistenza di una macchina a moto perpetuo del primo tipo, che compirebbe lavoro senza attingere energia da alcuna fonte.
Formulazione
La quantità di calore ricevuta dal sistema va a modificare la sua energia interna e a compiere lavoro contro le forze esterne.
La prima legge della termodinamica può essere formulata come segue:
“La variazione dell’energia totale del sistema in un processo quasi statico è uguale alla quantità di calore Q impartita al sistema, sommata alla variazione di energia associata alla quantità di sostanza N al potenziale chimico, e alla variazione di energia totale del sistema in un processo quasi statico. lavoro A” eseguito sul sistema da forze e campi esterni, meno il lavoro A eseguito dal sistema stesso contro forze esterne":
Per una quantità elementare di calore, lavoro elementare e un piccolo incremento (differenziale totale) di energia interna, la prima legge della termodinamica ha la forma:
Dividendo il lavoro in due parti, una delle quali descrive il lavoro svolto sul sistema, e la seconda - il lavoro svolto dal sistema stesso, sottolinea che questi lavori possono essere eseguiti da forze di diversa natura a causa di diverse fonti di forza.
È importante notare che e sono differenziali completi e e non lo sono. L'incremento di calore è spesso espresso in termini di incremento di temperatura e di entropia: .
- VKontakte 0
- Google+ 0
- OK 0
- Facebook 0