I processi più comuni per la formazione di questo composto sono la decomposizione di resti animali e vegetali, la combustione di vari tipi di combustibile e la respirazione di animali e piante. Ad esempio, una persona emette nell’atmosfera circa un chilogrammo di anidride carbonica al giorno. Il monossido e il biossido di carbonio possono formarsi anche in natura inanimata. L'anidride carbonica viene rilasciata durante l'attività vulcanica e può essere prodotta anche da fonti di acqua minerale. L'anidride carbonica si trova in piccole quantità nell'atmosfera terrestre.
Le peculiarità della struttura chimica di questo composto gli consentono di partecipare a numerose reazioni chimiche, la cui base è l'anidride carbonica.
Formula
Nel composto di questa sostanza, l'atomo di carbonio tetravalente forma un legame lineare con due molecole di ossigeno. L'aspetto di tale molecola può essere rappresentato come segue:

La teoria dell'ibridazione spiega la struttura della molecola di anidride carbonica come segue: i due legami sigma esistenti si formano tra gli orbitali sp degli atomi di carbonio e i due orbitali 2p dell'ossigeno; Gli orbitali p del carbonio, che non prendono parte all'ibridazione, sono legati insieme ad orbitali simili dell'ossigeno. Nelle reazioni chimiche l'anidride carbonica si scrive come: CO 2.
Proprietà fisiche
In condizioni normali, l’anidride carbonica è un gas incolore e inodore. È più pesante dell'aria, motivo per cui l'anidride carbonica può comportarsi come un liquido. Ad esempio, può essere versato da un contenitore all'altro. Questa sostanza è leggermente solubile in acqua: in un litro d'acqua a 20 ⁰C si sciolgono circa 0,88 litri di CO 2 . Una leggera diminuzione della temperatura cambia radicalmente la situazione: 1,7 litri di CO 2 possono dissolversi nello stesso litro d'acqua a 17⁰C. Con un forte raffreddamento, questa sostanza precipita sotto forma di fiocchi di neve: si forma il cosiddetto "ghiaccio secco". Questo nome deriva dal fatto che a pressione normale la sostanza, bypassando la fase liquida, si trasforma immediatamente in un gas. L'anidride carbonica liquida si forma a una pressione appena superiore a 0,6 MPa e a temperatura ambiente.

Proprietà chimiche
Quando interagisce con forti agenti ossidanti, l'anidride carbonica 4 mostra proprietà ossidanti. La reazione tipica di questa interazione è:
C + CO2 = 2CO.
Pertanto, con l'aiuto del carbone, l'anidride carbonica viene ridotta alla sua modifica bivalente: il monossido di carbonio.
In condizioni normali, l’anidride carbonica è inerte. Ma alcuni metalli attivi possono bruciare al suo interno, rimuovendo l'ossigeno dal composto e rilasciando gas di carbonio. Una reazione tipica è la combustione del magnesio:
2Mg + CO2 = 2MgO + C.
Durante la reazione si formano ossido di magnesio e carbonio libero.

Nei composti chimici, la CO 2 mostra spesso le proprietà di un tipico ossido acido. Ad esempio, reagisce con basi e ossidi basici. Il risultato della reazione sono i sali dell'acido carbonico.
Ad esempio, la reazione di un composto di ossido di sodio con anidride carbonica può essere rappresentata come segue:
Na2O + CO2 = Na2CO3;
2NaOH + CO2 = Na2CO3 + H2O;
NaOH + CO2 = NaHCO3.
Soluzione di acido carbonico e CO2
L'anidride carbonica nell'acqua forma una soluzione con un piccolo grado di dissociazione. Questa soluzione di anidride carbonica è chiamata acido carbonico. È incolore, debolmente espresso e ha un sapore aspro.
Registrazione di una reazione chimica:
CO2 + H2O ↔ H2CO3.
L'equilibrio viene spostato piuttosto fortemente a sinistra: solo circa l'1% dell'anidride carbonica iniziale viene convertito in acido carbonico. Maggiore è la temperatura, minore è il numero di molecole di acido carbonico nella soluzione. Quando il composto bolle, scompare completamente e la soluzione si disintegra in anidride carbonica e acqua. La formula strutturale dell'acido carbonico è presentata di seguito.

Proprietà dell'acido carbonico
L'acido carbonico è molto debole. Nelle soluzioni si scompone negli ioni idrogeno H+ e nei composti HCO 3 -. Gli ioni CO 3 si formano in quantità molto piccole.
L'acido carbonico è bibasico, quindi i sali da esso formati possono essere medi e acidi. Nella tradizione chimica russa, i sali medi sono chiamati carbonati, mentre i sali forti sono chiamati bicarbonati.
Reazione qualitativa
Un modo possibile per rilevare il gas di anidride carbonica è modificare la limpidezza della malta di calce.
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O.
Questa esperienza è nota da un corso di chimica scolastica. All'inizio della reazione si forma una piccola quantità di precipitato bianco, che successivamente scompare quando l'anidride carbonica viene fatta passare attraverso l'acqua. Il cambiamento di trasparenza avviene perché durante il processo di interazione, un composto insolubile - carbonato di calcio - viene convertito in una sostanza solubile - bicarbonato di calcio. La reazione procede lungo questo percorso:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Produzione di anidride carbonica
Se è necessario ottenere una piccola quantità di CO2, è possibile avviare la reazione dell'acido cloridrico con carbonato di calcio (marmo). La notazione chimica per questa interazione è simile alla seguente:
CaCO3 + HCl = CaCl2 + H2O + CO2.
Anche a questo scopo vengono utilizzate reazioni di combustione di sostanze contenenti carbonio, ad esempio l'acetilene:
CH4 + 2O2 → 2H2O + CO2 -.
Un apparato Kipp viene utilizzato per raccogliere e immagazzinare la sostanza gassosa risultante.
Per le esigenze dell’industria e dell’agricoltura, la scala di produzione di anidride carbonica deve essere ampia. Un metodo popolare per questa reazione su larga scala è quello di bruciare il calcare, che produce anidride carbonica. La formula di reazione è riportata di seguito:
CaCO3 = CaO + CO2.
Applicazioni dell'anidride carbonica
L’industria alimentare, dopo la produzione su larga scala di “ghiaccio secco”, è passata a un metodo fondamentalmente nuovo di conservazione degli alimenti. È indispensabile nella produzione di bevande gassate e acqua minerale. Il contenuto di CO 2 nelle bevande conferisce loro freschezza e ne aumenta notevolmente la durata di conservazione. E la carburazione delle acque minerali consente di evitare la muffa e il sapore sgradevole.

In cucina viene spesso utilizzato il metodo di estinzione dell'acido citrico con l'aceto. L'anidride carbonica rilasciata durante questo processo conferisce morbidezza e leggerezza ai prodotti dolciari.
Questo composto viene spesso utilizzato come additivo alimentare per aumentare la durata di conservazione dei prodotti alimentari. Secondo gli standard internazionali per la classificazione degli additivi chimici contenuti nei prodotti, è codificato E 290,
L'anidride carbonica in polvere è una delle sostanze più diffuse incluse nelle miscele estinguenti. Questa sostanza si trova anche nella schiuma degli estintori.
È meglio trasportare e immagazzinare l'anidride carbonica in bombole di metallo. A temperature superiori a 31⁰C, la pressione nella bombola può raggiungere il livello critico e la CO 2 liquida entrerà in uno stato supercritico con un forte aumento della pressione operativa fino a 7,35 MPa. Il cilindro metallico può resistere a una pressione interna fino a 22 MPa, quindi l'intervallo di pressione a temperature superiori a trenta gradi è considerato sicuro.
Continuazione. Cfr. 21, 22, 23, 24, 25-26, 27-28, 29/2003
6. Sottogruppo del carbonio
Sapere: modifiche allotropiche del carbonio, dipendenza delle loro proprietà dalla struttura del reticolo cristallino; le più importanti proprietà e utilizzi del carbonio, ossidi di carbonio, acido carbonico, carbonati, silicio, ossidi di silicio, acido silicico; composizione e produzione di materiali da costruzione - vetro, cemento, calcestruzzo, ceramica, condizioni per il loro stoccaggio e utilizzo razionale; reazione qualitativa allo ione carbonato; metodi per rilevare l'anidride carbonica.
Essere in grado di: caratterizzare un sottogruppo di elementi in base alla struttura degli atomi e alla posizione degli elementi nella tavola periodica; descrivere le proprietà chimiche delle sostanze studiate utilizzando le equazioni di reazione; determinare nella pratica lo ione carbonato e l'anidride carbonica; risolvere problemi combinati.
Concetti basilari: adsorbimento, desorbimento, adsorbente, acqua di calce, latte di calce, carburi, siliciuri, anidride di silicio, ceramica.
Domande di controllo
1. Qual è la valenza del carbonio nei composti? Perché?
2. Quali forme allotropiche si forma il carbonio?
3. Qual è la differenza tra le proprietà della grafite e del diamante? Perché le proprietà di queste sostanze sono così diverse?
4. Perché il carbone attivo è in grado di adsorbire?
5. Cosa si chiama adsorbimento? Dove viene utilizzata questa proprietà?
6. Quali reazioni può subire il carbonio? Scrivi le equazioni di reazione.
7. Quali ossidi si forma il carbonio?
8. Come è strutturata la molecola del monossido di carbonio, che tipo di legame chimico ha?
9. Come si può ottenere il monossido di carbonio (II)? Fornisci l'equazione della reazione chimica.
10. Quali sono le proprietà fisiche del monossido di carbonio?
11. Quali reazioni può subire il monossido di carbonio? Fornire le equazioni delle reazioni chimiche.
12. Dove viene utilizzato il monossido di carbonio (II)?
13. In che modo il monossido di carbonio influisce su un organismo vivente? Come proteggersi dall'avvelenamento con esso?
14. Come è strutturata la molecola dell'anidride carbonica, che tipo di legame chimico ha?
15. Come si può ottenere CO 2? Scrivi un'equazione per la reazione.
16. Quali sono le proprietà fisiche dell'anidride carbonica?
17. Quali reazioni sono possibili per l'anidride carbonica? Fornisci le equazioni di reazione corrispondenti.
18. Come si formano i sali medi e acidi nelle reazioni della CO 2 con gli alcali? Scrivi le equazioni di reazione.
19. Come riconoscere l'anidride carbonica? Scrivi un'equazione per la reazione qualitativa alla CO 2.
20. Perché la CO 2 non supporta la combustione e la respirazione?
21. Qual è la disposizione degli atomi in una molecola di acido carbonico?
22. Che tipo di legame chimico tra gli atomi in una molecola di acido carbonico?
23. Come si può ottenere l'acido carbonico? Fornisci l'equazione della reazione.
24. Come si dissocia l'acido carbonico? È un elettrolita forte?
25. Come si idrolizza il carbonato di sodio in soluzione? Scrivi l'equazione di reazione.
26. Qual è il colore del tornasole in una soluzione di acido carbonico? Perché?
27. Quali sali può formare l'acido carbonico? Fornire esempi di formule di sostanze.
28. Quali sali dell'acido carbonico si trovano in natura e come si chiamano?
29. Quali carbonati vengono prodotti nell'industria?
30. Quali sono le proprietà fisiche dei sali dell'acido carbonico?
31. Come si comportano i carbonati quando riscaldati? Scrivi le equazioni di reazione.
32. Cosa succede ai bicarbonati quando riscaldati?
33. Quali altre reazioni (oltre alla decomposizione) sono possibili per i carbonati?
34. Qual è la reazione qualitativa ai carbonati? Scrivi l'equazione di reazione.
35. Descrivi la struttura dell'atomo di silicio.
36. Quali sono i possibili stati di ossidazione del silicio nei suoi composti?
37. Quali sono le proprietà fisiche del silicio?
38. Come si può ottenere il silicio puro? Scrivi un'equazione per la reazione.
39. Quali reazioni sono possibili per il silicio? Scrivi le equazioni di reazione.
40. Come interagisce il silicio con gli alcali? Scrivi un'equazione per la reazione.
41. Dove viene utilizzato il silicio?
42. Quale ossido forma il silicio? In che forma si trova in natura l'ossido di silicio?
43. Perché il biossido di silicio è duro e refrattario?
44. Quali sono le proprietà chimiche del biossido di silicio? Scrivi le equazioni di reazione.
45. Dove viene utilizzato il biossido di silicio?
46. Qual è la formula più semplice dell'acido silicico?
47. Come si può ottenere l'acido silicico? Fornisci l'equazione della reazione.
48. Quali sono le proprietà fisiche dell'acido silicico?
49. Come si ottengono i silicati? Scrivi le equazioni di reazione.
50. Quali sono le proprietà chimiche dei silicati? Scrivi le equazioni di reazione.
51. Dove viene utilizzato l'acido silicico?
52. Dove vengono utilizzati i silicati?
53. Quali materiali produce l’industria dei silicati?
54. Qual è la materia prima per la produzione del vetro?
55. Come si possono modificare le proprietà del vetro?
56. Dove viene utilizzato il vetro?
57. Dove vengono utilizzati i prodotti ceramici?
58. Qual è la materia prima per la produzione del cemento?
59. Dove viene utilizzato il cemento?
60. Quali elementi compongono la famiglia del carbonio?
61. Come cambiano le proprietà degli elementi nel sottogruppo del carbonio con l'aumentare della carica del nucleo atomico? Perché?
62. Dove vengono utilizzati gli elementi della famiglia del carbonio?
6.1. Risoluzione dei problemi sull'argomento "Sottogruppo di carbonio"
Compito 1. Quando 3,8 g di una miscela di carbonato di sodio e bicarbonato di sodio furono trattati con acido cloridrico, si formarono 896 ml di gas
(BENE.). Quale volume di acido cloridrico (frazione di massa - 20%, densità - 1,1 g/cm3) è stato consumato e qual era la composizione della miscela iniziale?
Soluzione
1. Calcolo della quantità di sostanza:
(CO2) = 0,896 (l)/22,4 (l/mol) = 0,04 mol.
Indichiamo con X la quantità di gas CO 2 rilasciata nella reazione di Na 2 CO 3 con acido cloridrico. Poi
(CO 2) rilasciato durante la reazione di NaHCO 3 con HCl è pari a (0,04 - X) neo. Scriviamo le equazioni di reazione:
2. Facciamo una registrazione per determinare la composizione quantitativa della miscela:
106X + 84 (0,04 – X) = 3,8, da qui X= 0,02 moli;
M(Na2CO3) = 0,02 106 = 2,12 g,
M(NaHCO3) = 0,02 84 = 1,68 g.
3. Calcola il volume dell'acido. La reazione con Na 2 CO 3 consuma 0,04 mol di HCl, mentre la reazione con NaHCO 3 consuma 0,02 mol di HCl.
Risposta. 9,95 ml di acido cloridrico; 2,12 g Na2CO3 e 1,68 g NaHCO3.
Compito 2. Quale volume di anidride carbonica deve essere fatto passare (n.) attraverso una soluzione del peso di 80 g con una frazione in massa di idrossido di bario disciolta al 5% per ottenere bicarbonato di bario?
Soluzione
1. Creiamo l'equazione di reazione:
2. Calcoliamo le quantità di sostanze dei composti originali che hanno reagito:
M(Ba(OH)2) = 80 0,05 = 4 g,
(Ba(OH)2) = 4/171 = 0,0234 mol;
(CO2) = 2(Ba(OH)2) = 2 0,0234 = 0,0468 mol.
3. Calcola il volume del gas:
V(CO2) = 0,0468 22,4 = 1,05 l.
Risposta. 1,05 l di CO2.
Compito 3. 1 litro di una miscela di ossidi di carbonio (II) e (IV) è stato fatto passare attraverso acqua di calce. Il precipitato formatosi è stato filtrato ed essiccato, la massa del precipitato era di 2,45 g. Stabilire il contenuto di gas nella miscela iniziale come percentuale in volume
(BENE.).
Soluzione
1. Scriviamo le equazioni di reazione:

2. Calcola la quantità di sostanza CO 2:
(CO2) = (CaCO3) = 2,45/100 = 0,0245 mol.
3. Calcolare i volumi e le frazioni di volume () dei gas nella miscela:
V(CO2) = 22,4 0,0245 = 0,5488 l, (CO2) = 54,88%;
V(SD) = 1 – 0,5488 = 0,4512 l, (SD) = 45,12%.
Risposta. Frazioni volumetriche (CO2) = 54,88%; (DS) = 45,12%.
Compiti di autocontrollo
1. Con quali sostanze reagisce il monossido di carbonio (IV): idrossido di sodio, acqua, carbonato di magnesio, cloruro di sodio, ossido di calcio, idrossido di rame (II), carbone, acqua di calce? Scrivi le equazioni per le possibili reazioni.
2. Una provetta contiene una soluzione di carbonato di sodio e l'altra contiene solfato di sodio. In ciascuna provetta è stata aggiunta una soluzione di cloruro di bario e in entrambi i casi si è formato un precipitato bianco. Come determinare quale provetta contiene carbonato? Scrivere le equazioni delle reazioni molecolari e ioniche.
3. Spiegare i processi redox, mostrando le transizioni elettroniche utilizzando il metodo del bilancio elettronico:
4. Scrivi le equazioni di reazione per le seguenti trasformazioni:
5. Quando esposto ad acido cloridrico in eccesso su un campione di dolomite MgCO 3 CaCO 3 del peso di 50 g, vengono rilasciati 11,2 litri di anidride carbonica (n.e.). Determinare la frazione di massa delle impurità in questo campione di dolomite.
Risposta. 8%.
6. È noto che quando si brucia carbone vengono rilasciati 402 kJ/mol e quando si brucia calcare vengono assorbiti 180 kJ/mol di calore. Utilizzando questi dati, determinare la massa di carbone (contenente una frazione di carbonio di 0,98) necessaria per decomporre 1 kg di calcare contenente il 5% di impurità.
Risposta. '52
7. 1,68 l di una miscela di ossidi di carbonio (II) e (IV) sono stati fatti passare a temperatura ambiente attraverso 50 ml di soluzione di idrossido di sodio con una concentrazione di 2 mol/l, dopo di che il contenuto di alcali nella soluzione è stato dimezzato. Determinare la composizione della miscela iniziale di gas in percentuale in massa e volume.
Risposta. (SD) = 33,3%, (DS) = 24,1%;
(CO2) = 66,7%, (CO2) = 75,9%.
8. Il gas ottenuto dalla riduzione completa di 16 g di ossido di ferro(III) con monossido di carbonio viene fatto passare attraverso 98,2 ml di una soluzione di idrossido di potassio al 15% (densità - 1,14 kg/dm 3). Quanti litri di monossido di carbonio (II) sono stati consumati?
(BENE.)? Qual è la composizione e la massa del sale formato?
Risposta. 6,72 l di CO, 30 g di KHSO 3.
7. Proprietà generali dei metalli
Sapere: posizione dei metalli nella tavola periodica degli elementi chimici di D.I. struttura e proprietà fisiche dei metalli; presenza di metalli in natura; proprietà chimiche generali dei metalli; tipi di corrosione e metodi di protezione contro di essa; elettrolisi come processo redox e sue applicazioni; classificazione delle leghe, composizione di alcune leghe, loro proprietà e applicazioni; l'essenza e il significato della serie elettrochimica delle tensioni metalliche.
Essere in grado di: caratterizzare i metalli in base alla posizione degli elementi nella tavola periodica e alla struttura degli atomi; caratterizzare le proprietà fisiche dei metalli; elaborare equazioni di reazione che riflettono le proprietà generali dei metalli; elaborare diagrammi ed equazioni per l'elettrolisi di fusi e soluzioni di sali e alcali; risolvere problemi standard e combinati.
Concetti basilari: legame metallico, reticolo cristallino metallico, cella galvanica, cella elettrochimica, corrosione, elettrolisi, elettroestrazione, affinazione elettrolitica dei metalli, galvanica, galvanica, leghe.
Reazioni dei metalli con acidi
I metalli attivi possono reagire con gli acidi per rilasciare idrogeno (reazioni di sostituzione).
I metalli a bassa attività non spostano l'idrogeno dagli acidi.
Domande di controllo
1. Qual è l'importanza dei metalli nella vita umana?
2. Quali sono le caratteristiche strutturali degli atomi metallici?
3. Dove si trovano i metalli nella tavola periodica degli elementi chimici di D.I.
4. Quanti elettroni esterni hanno gli atomi metallici dei sottogruppi principale e secondario?
5. In quali forme possono presentarsi i metalli in natura?
6. Come si possono ottenere i metalli dai loro composti?
7. Come è strutturato il reticolo cristallino dei metalli?
8. Quali sono le proprietà fisiche dei metalli?
9. Come si comportano gli atomi metallici nelle reazioni chimiche e perché?
10. Quali proprietà - agenti ossidanti o agenti riducenti - mostrano i metalli nelle reazioni chimiche?
11. Parlaci della serie di tensioni elettrochimiche dei metalli.
12. Elenca le reazioni che i metalli possono subire.
13. Come sono correlate le attività chimiche degli atomi metallici e degli ioni metallici?
14. Vapore S Quale metallo è mortale? Descrivi i segni di avvelenamento.
15. Cos'è la corrosione del metallo e come proteggerlo?
16. Elenca i metalli alcalini. Perché si chiamano così?
17. Quali sono le caratteristiche strutturali degli atomi di metalli alcalini?
18. Come si possono ottenere i metalli alcalini?
19. Quali sono le proprietà fisiche dei metalli alcalini?
20. Quali ossidi e perossidi si ottengono dall'ossidazione dei metalli alcalini?
21. Qual è lo stato di ossidazione del metallo alcalino nel composto? Perché?
22. Come si forma un idruro di metallo alcalino? Qual è lo stato di ossidazione dell'idrogeno in esso contenuto?
23. Come reagisce un metallo alcalino con una soluzione salina?
24. In che modo gli atomi e gli ioni dei metalli alcalini colorano la fiamma?
25. Quali reazioni sono caratteristiche dei metalli alcalini?
26. Quali legami chimici formano i metalli alcalini con i non metalli?
27. In che modo il perossido di sodio interagisce con l'anidride carbonica?
28. Dove vengono utilizzati i metalli alcalini?
29. Quale metallo alcalino è il più attivo e perché?
30. Come interagisce il superossido CO 2 con la CO 2? Scrivi l'equazione di reazione.
7.1. Elettrolisi dei fusi
Catodo
– un agente riducente, su di esso avviene il processo di accettazione degli elettroni da parte dei cationi metallici.
Anodo
– un agente ossidante, su di esso avviene il processo di donazione di elettroni da parte di anioni di residui acidi o ioni idrossido.
Nel caso dell'ossidazione degli ioni OH – viene redatto un diagramma:
4OH – – 4e = 2H 2 O + O 2.
Elettrolisi dei sali fusi.
(Algoritmo 30.)
Esercizio 1. Elaborare uno schema per l'elettrolisi del bromuro di sodio fuso.
Compito 2. Elaborare uno schema per l'elettrolisi del solfato di sodio fuso.
Elettrolisi dei fusi alcalini.
(Algoritmo 31.)
Esercizio 1. Elaborare uno schema per l'elettrolisi dell'idrossido di sodio fuso.
7.2. Elettrolisi delle soluzioni
L'elettrolisi è il processo redox che si verifica sugli elettrodi quando una corrente elettrica viene fatta passare attraverso l'elettrolita. Durante l'elettrolisi, il catodo è un agente riducente, perché cede elettroni, e l'anodo è un agente ossidante, perché accetta elettroni dagli anioni.
Per selezionare il processo più probabile al catodo e all'anodo durante l'elettrolisi di soluzioni utilizzando un anodo inerte (insolubile) (ad esempio grafite, carbone, platino, iridio), utilizzare quanto segue regole.
1. All'anodo si formano:
a) durante l'elettrolisi di soluzioni contenenti anioni F, –
, , , OH – , – O2 ;
b) durante l'ossidazione degli anioni Cl – , Br – , I – – Cl 2 , Br 2 , I 2 , rispettivamente.
2. Al catodo si formano:
a) durante l'elettrolisi di soluzioni contenenti ioni situati nella serie di tensioni a sinistra di Al 3+, – H 2;
b) se gli ioni si trovano nella serie di tensioni a destra dell'idrogeno - metalli;
c) se gli ioni si trovano nell'intervallo di tensione compreso tra Al 3+ e H +, al catodo possono verificarsi processi concorrenti: la riduzione sia dei metalli che dell'idrogeno;
d) se una soluzione acquosa contiene cationi di vari metalli, la loro riduzione avviene in ordine decrescente del valore del potenziale dell'elettrodo standard (da destra a sinistra lungo la serie delle tensioni metalliche).
Nel caso di utilizzo di un anodo attivo (solubile) (composto da rame, argento, zinco, nichel, cadmio), l'anodo stesso subisce ossidazione (si dissolve) e al catodo, oltre ai cationi metallici, sali e ioni idrogeno, metalli i cationi ottenuti sciogliendo l'anodo vengono ridotti.
È conveniente confrontare le proprietà di riduzione dei metalli utilizzando la serie di tensioni elettrochimiche, che include l'idrogeno. La capacità riducente degli elementi di questa serie diminuisce da sinistra a destra e la capacità ossidante dei cationi corrispondenti aumenta nella stessa direzione.
Elettrolisi di una soluzione salina acquosa.
(Algoritmo 32.)
Esercizio 1. Elaborare uno schema per l'elettrolisi di una soluzione acquosa di cloruro di sodio utilizzando elettrodi inerti.
Compito 2. Elaborare uno schema per l'elettrolisi di una soluzione acquosa di solfato di rame(II) utilizzando elettrodi inerti.
Elettrolisi della soluzione acquosa alcalina.
(Algoritmo 33.)
Esercizio 1. Elaborare uno schema per l'elettrolisi di una soluzione acquosa di idrossido di sodio.
Compiti di autocontrollo
1. Realizza schemi di elettrolisi:
a) fusioni di cloruro di calcio, idrossido di potassio, solfato di litio;
b) soluzioni acquose di cloruro di magnesio, solfato di potassio, nitrato di mercurio(II).
2. Quali reazioni sono praticamente realizzabili:
a) Cu + HCl...;
b) Mg + H 2 SO 4 (diluito) ...;
c) Zn + Pb(NO 3) 2 ...;
d) Cu + ZnCl 2 ...;
e) Ca + H 2 O ...;
e) Fe + Cl 2 ... ?
3. Sul coperchio in acciaio è presente un rivetto in rame. Cosa si romperà prima: il coperchio o il rivetto? Perché?
4. Esiste un prodotto in ferro ricoperto da una pellicola protettiva di stagno (ferro stagnato). Cosa accadrà quando un prodotto del genere verrà riscaldato nell'aria? Scrivi le equazioni delle reazioni che si verificano.
5. Quale volume di idrogeno (n.u.) verrà rilasciato quando 20 g di un prodotto costituito da una lega di sodio, potassio e rame in un rapporto di massa di 1:1:2 vengono immersi in acqua?
Risposta. 3,86 l.
6. Calcolare la massa di una soluzione di acido solforico al 9,8% necessaria per sciogliere quattro granuli di zinco se la massa di ciascun granulo è 0,2 g.
Risposta. 12,3 g.
7. Calcolare quale sarà la frazione di massa di idrossido di potassio nella soluzione se il potassio metallico del peso di 3,9 g viene sciolto in acqua con un volume di 80 ml.
Risposta. 6,68%.
8. Durante l'elettrolisi di un certo solfato metallico, all'anodo sono stati rilasciati 176 ml di ossigeno (n.o.) e nello stesso tempo al catodo è stato rilasciato 1 g di metallo. Quale solfato metallico è stato preso?
Risposta. CuSO4.
9. Una piastra di ferro del peso di 18 g è immersa in una soluzione di solfato di rame(II). Quando fu rivestito di rame, la sua massa divenne 18,2 g. Quale massa di ferro entrò in soluzione?
Risposta. 1,4 g.
10. Una piastra di ferro del peso di 5 g viene immersa per qualche tempo in 50 ml di una soluzione al 15% di solfato di rame(II), la cui densità è 1,12 g/cm 3 . Dopo che la piastra fu rimossa, la sua massa risultò essere 5,16 g. Qual è la massa del solfato di rame(II) nella soluzione rimanente?
Risposta. 5,2 g.
Risposte ai compiti per l'autocontrollo
6.1. Risoluzione dei problemi sull'argomento "Sottogruppo di carbonio"


Soda, vulcano, Venere, frigorifero: cosa hanno in comune? Diossido di carbonio. Abbiamo raccolto per te le informazioni più interessanti su uno dei composti chimici più importanti sulla Terra.
Cos'è l'anidride carbonica
L’anidride carbonica è conosciuta principalmente allo stato gassoso, cioè come anidride carbonica con la semplice formula chimica CO2. In questa forma esiste in condizioni normali - a pressione atmosferica e temperature "ordinarie". Ma a una pressione maggiore, superiore a 5.850 kPa (come, ad esempio, la pressione ad una profondità del mare di circa 600 m), questo gas si trasforma in liquido. E quando viene fortemente raffreddato (meno 78,5°C), cristallizza e diventa il cosiddetto ghiaccio secco, ampiamente utilizzato in commercio per conservare gli alimenti congelati nei frigoriferi.
L’anidride carbonica liquida e il ghiaccio secco vengono prodotti e utilizzati nelle attività umane, ma queste forme sono instabili e si disintegrano facilmente.
Ma il gas di anidride carbonica è onnipresente: viene rilasciato durante la respirazione di animali e piante ed è una parte importante della composizione chimica dell'atmosfera e dell'oceano.
Proprietà dell'anidride carbonica
L'anidride carbonica CO2 è incolore e inodore. In condizioni normali non ha sapore. Tuttavia, se si inalano elevate concentrazioni di anidride carbonica, si potrebbe avvertire un sapore acido in bocca, causato dal fatto che l'anidride carbonica si dissolve nelle mucose e nella saliva, formando una debole soluzione di acido carbonico.
A proposito, è la capacità dell'anidride carbonica di dissolversi nell'acqua che viene utilizzata per produrre acqua gassata. Le bolle della limonata sono la stessa anidride carbonica. Il primo apparecchio per saturare l'acqua con CO2 fu inventato nel 1770 e già nel 1783 l'intraprendente svizzero Jacob Schweppes iniziò la produzione industriale di soda (il marchio Schweppes esiste ancora).
L'anidride carbonica è 1,5 volte più pesante dell'aria, quindi tende a “depositarsi” nei suoi strati inferiori se la stanza è poco ventilata. È noto l'effetto “caverna del cane”, dove la CO2 viene rilasciata direttamente dal terreno e si accumula a un'altezza di circa mezzo metro. Un adulto, entrando in una grotta del genere, nel pieno della sua crescita non avverte l'eccesso di anidride carbonica, ma i cani si ritrovano direttamente in uno spesso strato di anidride carbonica e vengono avvelenati.
La CO2 non supporta la combustione, motivo per cui viene utilizzata negli estintori e nei sistemi antincendio. Il trucco di spegnere una candela accesa con il contenuto di un bicchiere apparentemente vuoto (ma in realtà anidride carbonica) si basa proprio su questa proprietà dell'anidride carbonica.
Anidride carbonica in natura: fonti naturali
L’anidride carbonica si forma in natura da varie fonti:
- Respirazione di animali e piante.
Ogni scolaretto sa che le piante assorbono l'anidride carbonica CO2 dall'aria e la utilizzano nei processi di fotosintesi. Alcune casalinghe cercano di compensare le carenze con un'abbondanza di piante da interno. Tuttavia, le piante non solo assorbono, ma rilasciano anche anidride carbonica in assenza di luce: questo fa parte del processo di respirazione. Pertanto, una giungla in una camera da letto poco ventilata non è una buona idea: i livelli di CO2 aumenteranno ancora di più di notte. - Attività vulcanica.
L'anidride carbonica fa parte dei gas vulcanici. Nelle aree ad alta attività vulcanica, la CO2 può essere rilasciata direttamente dal terreno, da crepe e fessure chiamate mofet. La concentrazione di anidride carbonica nelle valli con mofet è così alta che molti piccoli animali muoiono quando arrivano lì. - Decomposizione della materia organica.
L'anidride carbonica si forma durante la combustione e il decadimento della materia organica. Grandi emissioni naturali di anidride carbonica accompagnano gli incendi boschivi.
L'anidride carbonica viene “immagazzinata” in natura sotto forma di composti di carbonio nei minerali: carbone, petrolio, torba, calcare. Enormi riserve di CO2 si trovano in forma disciolta negli oceani del mondo.

Il rilascio di anidride carbonica da un serbatoio aperto può portare a una catastrofe limnologica, come è accaduto, ad esempio, nel 1984 e nel 1986. nei laghi Manoun e Nyos in Camerun. Entrambi i laghi si sono formati sul sito di crateri vulcanici: ora sono estinti, ma nelle profondità il magma vulcanico rilascia ancora anidride carbonica, che sale nelle acque dei laghi e in esse si dissolve. Come risultato di una serie di processi climatici e geologici, la concentrazione di anidride carbonica nelle acque ha superato un valore critico. Un'enorme quantità di anidride carbonica è stata rilasciata nell'atmosfera, che è caduta lungo i pendii delle montagne come una valanga. Circa 1.800 persone sono rimaste vittime dei disastri limnologici sui laghi del Camerun.
Fonti artificiali di anidride carbonica
Le principali fonti antropiche di anidride carbonica sono:
- emissioni industriali associate ai processi di combustione;
- trasporto automobilistico.
Nonostante il fatto che la quota di trasporti rispettosi dell’ambiente nel mondo sia in crescita, la stragrande maggioranza della popolazione mondiale non avrà presto l’opportunità (o il desiderio) di passare alle nuove auto.
La deforestazione attiva per scopi industriali porta anche ad un aumento della concentrazione di anidride carbonica CO2 nell'aria.
La CO2 è uno dei prodotti finali del metabolismo (la scomposizione del glucosio e dei grassi). Viene secreto nei tessuti e trasportato dall'emoglobina ai polmoni, attraverso i quali viene espirato. L'aria espirata da una persona contiene circa il 4,5% di anidride carbonica (45.000 ppm) - 60-110 volte di più rispetto all'aria inalata.
L’anidride carbonica svolge un ruolo importante nella regolazione del flusso sanguigno e della respirazione. Un aumento dei livelli di CO2 nel sangue provoca la dilatazione dei capillari, consentendo il passaggio di più sangue, che fornisce ossigeno ai tessuti e rimuove l’anidride carbonica.

Il sistema respiratorio viene stimolato anche dall'aumento dell'anidride carbonica e non dalla mancanza di ossigeno, come potrebbe sembrare. In realtà, la mancanza di ossigeno non viene avvertita dal corpo per molto tempo ed è del tutto possibile che nell'aria rarefatta una persona perda conoscenza prima di sentire la mancanza d'aria. La proprietà stimolante della CO2 viene utilizzata nei dispositivi di respirazione artificiale: dove l'anidride carbonica viene miscelata con l'ossigeno per “avviare” il sistema respiratorio.
L’anidride carbonica e noi: perché la CO2 è pericolosa
L'anidride carbonica è necessaria per il corpo umano proprio come l'ossigeno. Ma proprio come con l’ossigeno, un eccesso di anidride carbonica nuoce al nostro benessere.
Un'elevata concentrazione di CO2 nell'aria porta all'intossicazione dell'organismo e provoca uno stato di ipercapnia. Con l'ipercapnia, una persona sperimenta difficoltà di respirazione, nausea, mal di testa e può persino perdere conoscenza. Se il contenuto di anidride carbonica non diminuisce, si verifica la carenza di ossigeno. Il fatto è che sia l'anidride carbonica che l'ossigeno si muovono in tutto il corpo con lo stesso "trasporto": l'emoglobina. Normalmente “viaggiano” insieme, attaccandosi a punti diversi della molecola di emoglobina. Tuttavia, l’aumento delle concentrazioni di anidride carbonica nel sangue riduce la capacità dell’ossigeno di legarsi all’emoglobina. La quantità di ossigeno nel sangue diminuisce e si verifica l'ipossia.
Tali conseguenze dannose per l'organismo si verificano quando si inala aria con un contenuto di CO2 superiore a 5.000 ppm (questa può essere ad esempio l'aria nelle miniere). A dire il vero, nella vita ordinaria non incontriamo praticamente mai un'aria del genere. Tuttavia, una concentrazione molto più bassa di anidride carbonica non ha l’effetto migliore sulla salute.
Secondo alcuni risultati, anche 1.000 ppm di CO2 causano stanchezza e mal di testa nella metà dei soggetti. Molte persone iniziano a provare senso di soffocamento e disagio anche prima. Con un ulteriore aumento critico della concentrazione di anidride carbonica fino a 1.500 – 2.500 ppm, il cervello è “pigro” nel prendere l’iniziativa, elaborare le informazioni e prendere decisioni.
E se un livello di 5.000 ppm è quasi impossibile nella vita di tutti i giorni, allora 1.000 e anche 2.500 ppm possono facilmente far parte della realtà dell’uomo moderno. Il nostro studio ha dimostrato che nelle aule scolastiche raramente ventilate, i livelli di CO2 rimangono al di sopra di 1.500 ppm per la maggior parte del tempo, e talvolta superano i 2.000 ppm. Ci sono tutte le ragioni per credere che la situazione sia simile in molti uffici e persino in appartamenti.
I fisiologi considerano 800 ppm un livello di anidride carbonica sicuro per il benessere umano.
Un altro studio ha trovato un legame tra i livelli di CO2 e lo stress ossidativo: maggiore è il livello di anidride carbonica, più soffriamo di stress ossidativo, che danneggia le cellule del nostro corpo.
Anidride carbonica nell'atmosfera terrestre
Nell’atmosfera del nostro pianeta c’è solo circa lo 0,04% di CO2 (pari a circa 400 ppm), e più recentemente era ancora meno: l’anidride carbonica ha superato la soglia delle 400 ppm solo nell’autunno del 2016. Gli scienziati attribuiscono l’aumento dei livelli di CO2 nell’atmosfera all’industrializzazione: a metà del XVIII secolo, alla vigilia della rivoluzione industriale, era solo di circa 270 ppm.
Anidride carbonica, monossido di carbonio, anidride carbonica: tutti questi sono nomi per una sostanza a noi nota come anidride carbonica. Quali proprietà ha quindi questo gas e quali sono i suoi campi di applicazione?
Anidride carbonica e sue proprietà fisiche
L’anidride carbonica è costituita da carbonio e ossigeno. La formula per l'anidride carbonica è simile a questa: CO₂. In natura si forma durante la combustione o il decadimento delle sostanze organiche. Anche il contenuto di gas nell'aria e nelle sorgenti minerali è piuttosto elevato. Inoltre, anche gli esseri umani e gli animali emettono anidride carbonica quando espirano.

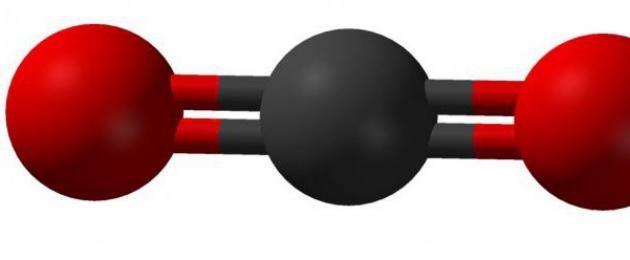
Riso. 1. Molecola di anidride carbonica.
L'anidride carbonica è un gas completamente incolore e non può essere visto. Inoltre non ha odore. Tuttavia, con concentrazioni elevate, una persona può sviluppare ipercapnia, cioè soffocamento. La mancanza di anidride carbonica può anche causare problemi di salute. A causa della mancanza di questo gas si può sviluppare la condizione opposta al soffocamento: l'ipocapnia.
Se metti l'anidride carbonica in condizioni di bassa temperatura, a -72 gradi si cristallizza e diventa come la neve. Pertanto, l’anidride carbonica allo stato solido è chiamata “neve secca”.

Riso. 2. Neve secca – anidride carbonica.
L’anidride carbonica è 1,5 volte più densa dell’aria. La sua densità è 1,98 kg/m³. Il legame chimico nella molecola di anidride carbonica è covalente polare. È polare perché l'ossigeno ha un valore di elettronegatività più elevato.
Un concetto importante nello studio delle sostanze è la massa molecolare e molare. La massa molare dell'anidride carbonica è 44. Questo numero è formato dalla somma delle masse atomiche relative degli atomi che compongono la molecola. I valori delle masse atomiche relative sono presi dalla tabella di D.I. Mendeleev e sono arrotondati a numeri interi. Di conseguenza, la massa molare di CO₂ = 12+2*16.
Per calcolare le frazioni di massa degli elementi nell'anidride carbonica, è necessario seguire la formula per calcolare le frazioni di massa di ciascun elemento chimico in una sostanza.
N– numero di atomi o molecole.
UN R– massa atomica relativa di un elemento chimico.
Sig– massa molecolare relativa della sostanza.
Calcoliamo la massa molecolare relativa dell'anidride carbonica.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 o 27% Poiché la formula dell'anidride carbonica include due atomi di ossigeno, allora n = 2 w(O) = 2 * 16 /44 = 0,73 o 73%
Risposta: w(C) = 0,27 o 27%; w(O) = 0,73 o 73%
Proprietà chimiche e biologiche dell'anidride carbonica
L'anidride carbonica ha proprietà acide perché è un ossido acido e quando disciolto in acqua forma acido carbonico:
CO₂+H₂O=H₂CO₃
Reagisce con gli alcali causando la formazione di carbonati e bicarbonati. Questo gas non brucia. Solo alcuni metalli attivi, come il magnesio, bruciano al suo interno.
Quando riscaldata, l'anidride carbonica si scompone in monossido di carbonio e ossigeno:
2CO₃=2CO+O₃.
Come altri ossidi acidi, questo gas reagisce facilmente con altri ossidi:
СaO+Co₃=CaCO₃.
L'anidride carbonica fa parte di tutte le sostanze organiche. La circolazione di questo gas in natura viene effettuata con l'aiuto di produttori, consumatori e decompositori. Nel corso della vita, una persona produce circa 1 kg di anidride carbonica al giorno. Quando inspiriamo riceviamo ossigeno, ma in questo momento negli alveoli si forma anidride carbonica. In questo momento avviene uno scambio: l'ossigeno entra nel sangue e l'anidride carbonica esce.
L'anidride carbonica viene prodotta durante la produzione di alcol. Questo gas è anche un sottoprodotto nella produzione di azoto, ossigeno e argon. L'uso dell'anidride carbonica è necessario nell'industria alimentare, dove l'anidride carbonica funge da conservante e l'anidride carbonica in forma liquida si trova negli estintori.
Carbonio
L'elemento carbonio 6 C si trova nel 2° periodo, nel sottogruppo principale del gruppo IV PS.
Le capacità di valenza del carbonio sono determinate dalla struttura dello strato elettronico esterno del suo atomo negli stati fondamentale ed eccitato:
Essendo nello stato fondamentale, un atomo di carbonio può formare due legami covalenti utilizzando il meccanismo di scambio e un legame donatore-accettore utilizzando un orbitale libero. Tuttavia, nella maggior parte dei composti gli atomi di carbonio sono in uno stato eccitato e mostrano valenza IV.
Gli stati di ossidazione più caratteristici del carbonio sono: nei composti con più elementi elettronegativi +4 (meno spesso +2); nei composti con meno elementi elettronegativi -4.
Essere nella natura
Il contenuto di carbonio nella crosta terrestre è dello 0,48% in massa. Il carbonio libero si trova sotto forma di diamante e grafite. La maggior parte del carbonio si trova sotto forma di carbonati naturali, nonché nei combustibili fossili: torba, carbone, petrolio, gas naturale (una miscela di metano e dei suoi omologhi più vicini). Nell'atmosfera e nell'idrosfera, il carbonio si trova sotto forma di anidride carbonica CO 2 (0,046% in massa nell'aria).
CaCO 3 – calcare, gesso, marmo, longarone islandese
CaCO 3 ∙MgCO 3 – dolomite
SiC – carborundum
CuCO 3 ∙Cu(OH) 2 – malachite
Proprietà fisiche
Diamante ha un reticolo cristallino atomico, una disposizione tetraedrica degli atomi nello spazio (angolo di legame 109°), molto duro, refrattario, dielettrico, incolore, trasparente, conduce male il calore.
Grafite ha un reticolo cristallino atomico, i suoi atomi sono disposti in strati ai vertici di esagoni regolari (angolo di legame 120°), di colore grigio scuro, opaco, con lucentezza metallica, morbido, untuoso al tatto, conduce calore e corrente elettrica, come il diamante ha punti di fusione (3700°C) e di ebollizione (4500°C) molto elevati. La lunghezza del legame carbonio-carbonio nel diamante (0,537 nm) è maggiore che nella grafite (0,142 nm). La densità del diamante è maggiore di quella della grafite.
Carbina – polimero lineare, costituito da due tipi di catene: –C≡C–C≡C– o =C=C=C=C=, l'angolo di legame è di 180°, polvere nera, semiconduttore.
Fullereni– sostanze cristalline di colore nero con una lucentezza metallica, costituite da molecole sferiche cave (ha una struttura molecolare) di composizione C 60, C 70, ecc. Gli atomi di carbonio sulla superficie delle molecole sono interconnessi in pentagoni ed esagoni regolari.
Fullereni di grafite di diamante
Proprietà chimiche
Il carbonio è inattivo e reagisce solo con il fluoro al freddo; l'attività chimica si verifica a temperature elevate.
Ossidi di carbonio
Il carbonio forma l'ossido CO non formante sale e l'ossido CO 2 formante sale.
Monossido di carbonio (II) CO, monossido di carbonio, monossido di carbonio– un gas incolore e inodore, poco solubile in acqua, velenoso. Il legame nella molecola è triplo e molto forte. Il monossido di carbonio è caratterizzato da proprietà riducenti nelle reazioni con sostanze semplici e complesse.
CuO+CO = Cu+CO2
Fe2O3 + 3CO = 2FeO + 3CO3
2CO + O2 = 2CO2
CO + Cl2 = COCl2
CO + H2O = H2 + CO2
Il monossido di carbonio (II) reagisce con H2, NaOH e metanolo:
CO + 2H 2 = CH 3 OH
CO+NaOH = HCOONa
CO + CH3OH = CH3COOH
Produzione di monossido di carbonio
1) Nell'industria (nei generatori di gas):
C + O 2 = CO 2 + 402 kJ, quindi CO 2 + C = 2CO – 175 kJ
C + H2O = CO + H2 – Q,
2) In laboratorio- decomposizione termica dell'acido formico o ossalico in presenza di H 2 SO4 (conc.):
HCOOH → H2O + CO
H2C2O4 → CO+CO2+H2O
Monossido di carbonio (IV) CO 2, anidride carbonica, anidride carbonica- un gas incolore, inodore e insapore, solubile in acqua, in grandi quantità provoca soffocamento, sotto pressione si trasforma in una massa solida bianca - "ghiaccio secco", che viene utilizzato per raffreddare gli alimenti deperibili.
La molecola di CO 2 non è polare e ha una struttura lineare O=C=O.
Ricevuta
1. Decomposizione termica dei sali dell'acido carbonico (carbonati). Combustione del calcare – nell’industria:
CaCO3 → CaO + CO2
2. L'azione degli acidi forti su carbonati e bicarbonati - in laboratorio:
CaCO 3 (marmo) + 2HCl → CaCl 2 + H 2 O + CO 2
NaHCO3 + HCl → NaCl + H2O + CO2
Metodi di raccolta
spostamento d'aria
3. Combustione di sostanze contenenti carbonio:
CH4 + 2O2 → 2H2O + CO2
4. Con lenta ossidazione nei processi biochimici (respirazione, putrefazione, fermentazione)
Proprietà chimiche
1) Con acqua dà acido carbonico debole:
CO2 + H2O ↔ H2CO3
2) Reagisce con ossidi e basi basici, formando sali dell'acido carbonico
Na2O+CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO 2 (in eccesso) → NaHCO 3
3) A temperature elevate può mostrare proprietà ossidanti - ossida i metalli
CO2 + 2Mg → 2MgO + C
4) Reagisce con perossidi e superossidi:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
4KO2 + 2CO2 = 2K2CO3 + 2O2
Reazione qualitativa all'anidride carbonica
Torbidità dell'acqua di calce Ca(OH) 2 dovuta alla formazione di un precipitato bianco - sale insolubile CaCO 3:
Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
Acido carbonico
H 2 CO 3 esiste solo in soluzioni, è instabile, debole, bibasico, si dissocia gradualmente, forma sali medi (carbonati) e acidi (idrocarbonati), una soluzione di CO 2 in acqua diventa cartina di tornasole non rossa, ma rosa.
Proprietà chimiche
1) con metalli attivi
H2CO3 + Ca = CaCO3 + H2
2) con ossidi basici
H2CO3 + CaO = CaCO3 + H2O
3) con basi
H2CO3(g) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
4) Acido molto debole: si decompone
H2CO3 = H2O + CO2
I sali dell'acido carbonico vengono preparati utilizzando CO 2:
CO2 + 2NaOH = Na2CO3 + H2O
CO2+KOH = KHCO3
o per reazione di scambio:
K2CO3 + BaCl2 = 2KCl + BaCO3
Quando interagiscono con la CO 2 in una soluzione acquosa, i carbonati vengono convertiti in bicarbonati:
Na2CO3 + CO2 + H2O = 2NaHCO3
CaCO3 + CO2 + H2O = Ca(HCO3)2
Al contrario, quando riscaldati (o sotto l'influenza di alcali), i bicarbonati vengono convertiti in bicarbonati:
2NaHCO3 = Na2CO3 + CO2 + H2O
KHCO3 + KOH = K2CO3 + H2O
I carbonati di metalli alcalini (eccetto il litio) sono resistenti al riscaldamento; i carbonati di altri metalli si decompongono quando riscaldati:
MgCO = MgO + CO2
I sali di ammonio dell'acido carbonico si decompongono particolarmente facilmente:
(NH4) 2CO3 = 2NH3 + CO2 + H2O
NH4HCO3 = NH3 + CO2 + H2O
Applicazione
Carbonio utilizzato per ottenere fuliggine, coke, metalli da minerali, lubrificanti, in medicina, come assorbitore di gas, per la produzione di punte di trapano (diamante).
Na 2 CO 3 ∙10H 2 O – soda cristallina (carbone di sodio); utilizzato per produrre sapone, vetro, coloranti, composti di sodio;
NaHCO3 – bicarbonato di sodio; utilizzato nell'industria alimentare;
CaCO 3 viene utilizzato nell'edilizia per produrre CO 2, CaO;
K2CO3 – potassa; utilizzato per produrre vetro, sapone, fertilizzanti;
CO – come agente riducente, carburante;
CO 2 – per conservare alimenti, gassare l'acqua, produrre soda, zucchero.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0