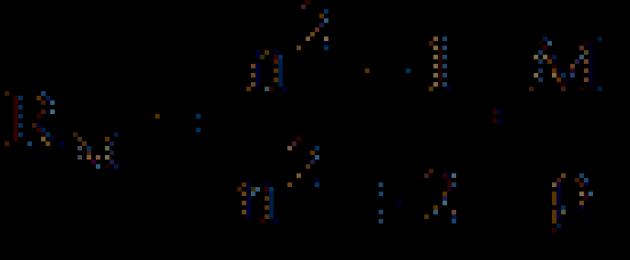Из электромагнитной теории света Максвелла следует, что для длин волн, значительно удалённых от области их поглощения молекулами вещества, справедливо равенство:
где n ∞ - показатель преломления света для определённых длин волн.
С учётом этого уравнение Клаузиуса-Мосотти (15) принимает следующий вид:
 (21)
(21)
Размерность молярной рефракции: [ см 3 /(г·моль)]
Из полученного выражения видно, что показатель R М, называемыймолярной рефракцией , имеет размерность объёма молекул, содержащихся в 1 моль вещества.
Уравнение (15), которое носит название уравнения Лорентца - Лоренца, выведено в 1880 г. независимо друг от друга Х. Лорентцем и Л. Лоренцем.
На практике часто пользуются показателем удельной рефракции r, то есть рефракцией одного грамма вещества. Удельная и молярная рефракции связаны соотношением: R = r∙M, где М - молярная масса.
Поскольку R = r∙M, то удельная рефракция равна:
 (22)
(22)
Размерность удельной рефракции: [см 3 /г]
Х. Лорентц и Л. Лоренц вскрыли физический смысл понятия рефракции как меры электронной поляризуемости и подвели под учение о рефракции прочный теоретический фундамент.
Величина удельной рефракции практически не зависит от температуры, давления и агрегатного состояния вещества. В исследовательской практике кроме молярной и удельной рефракции R М и r используют и другие производные от показателя преломления n .
Показатель преломления неполярных веществ практически не зависит от частоты волн света, и поэтому уравнение (19) справедливо при всех частотах. Например, для бензола n 2 = 2,29 (длина волны 289,3 нм), тогда как ε = 2,27. Поэтому, если для приближённых расчётов рефракции достаточно пользоваться показателем преломления видимого спектра, то для точных расчётов необходимо производить экстраполяцию по формуле Коши.
(R) - связывает электронную поляризуемость a эл вещества (см. Поляризуемость атомов, ионов и молекул) с его прелом. В пределах применимости выражений для M. р. она, характеризуя, как и п, способность вещества преломлять свет, отличается от n тем, что практически не зависит от плотности, темп-ры и агрегатного состояния вещества.
Осн.ф-ла M. р. имеет вид
где M - молекулярная масса вещества, r - его плотность, N A - Авогадро постоянная. Ф-ла (*) является эквивалентом Лоренца - Лоренца формулы (с теми же ограничениями на применимость), но во мн. случаях более удобна для практич. приложений. Часто M. р. можно представить как сумму "рефракций" атомов или групп атомов, составляющих молекулу сложного вещества, или их связей в такой молекуле. Напр., M. р. предельного углеводорода CkH 2k +2 равна kR C+ + (2k + 2)R Н (k= 1, 2,...). Это важное свойство M. р. - аддитивность - позволяет успешно применять рефрак-тометрич. методы для исследования структуры соединений, определения дипольных моментов молекул, изучения водородных связей, определения состава смесей и для др. физ.-хим. задач.
Лит.: Волькенштейн M. В., Молекулы и их строение, M.- Л., 1955; Иоффе Б. В., Рефрактометрические методы химии, 3 изд., Л., 1983; см. также лит. при ст. Лоренца - Лоренца формула.
Физическая энциклопедия. В 5-ти томах. - М.: Советская энциклопедия .Главный редактор А. М. Прохоров .1988 .
Смотреть больше слов в «
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
Цель работы : определить температуру плавления нафталина и по его температурному интервалу оценить степень его чистоты.
2.1.1. Материалы, реактивы, оборудование:
Стеклянный капилляр (диаметр 1мм, длина 40-50 мм) запаянный с одного конца, стеклянная трубка(диаметр 10 мм,длина 40-50 мм),прибор для определения температуры плавления, нафталин, электроплитка.
Общие положения.
Определение температуры плавления
Температурой плавления вещества называют температуру, при которой его твердая фаза находится в равновесии с собственным расплавом.
Температура плавления – важнейшая характеристика соединения. По значению температуры плавления можно проводить идентификацию соединения, так как эта константа всегда приводится в справочниках по свойствам соединений, например, /2, 4/.
Для идентификации веществ часто используют также т. н. «смешанную пробу плавления». Для этого тщательно смешивают равные количества вещества, которое идентифицируют, и заведомо известного вещества. Если температура плавления смеси остается неизменной, то делают заключение об идентичности обоих веществ. Если же температура плавления пробы ниже температуры плавления исходных веществ, то, следовательно, эти вещества различны. Это способ основан на установленном факте, что чистые вещества обладают четко выраженной («резкой») температурой плавления (с точностью до 0,01 С). Наличие примесей, как правило, понижает температуру плавления. Кроме того, вещества, содержащие какие-либо примеси, плавятся в температурном интервале, т. е. не имеют четко выраженной температуры плавления. Таким образом, определение температуры плавления может дать качественную информацию о степени чистоты вещества.
Определение температуры плавления позволяет также сделать косвенные выводы о возможном молекулярном строении вещества. Например, установлено, что изомеры с симметричными молекулами плавятся при более высокой температуре, чем вещества менее симметричного строения. Температура плавления растет также с увеличением степени ассоциации молекул (например, вследствие межмолекулярных водородных связей).
Приблизительно оценить температуру плавления вещества можно, используя обычный лабораторный термометр. Несколько кристаллов исследуемого соединения аккуратно помещают непосредственно на ртутный шарик термометра. Далее термометр с кристаллами осторожно располагают над поверхностью предварительно нагретой электроплитки с закрытой спиралью. Регулируя высоту положения термометра над нагретой поверхностью, грубо задают скорость подъема температуры. Внимательно наблюдая попеременно за состоянием кристаллов и значением температуры, отмечают начало плавления вещества (появление первых капелек жидкой фазы). Этот процесс можно повторить несколько раз, добиваясь наиболее точного определения начала процесса плавления. Разумеется, этот метод дает только приблизительное представление о температуре плавления, однако он позволяет существенно упростить дальнейший эксперимент по точному определению этой константы.
Общая методика процесса
Для точного определения температуры плавления существует несколько конструктивно отличающихся приборов различной степени сложности и удобства в работе, однако принцип их работы одинаков. Исследуемое соединение помещают в стеклянный капилляр (диаметр 1 мм, длина 40 – 50 мм), запаянный с одного конца. Предварительно вещество растирают в ступке в тонкий порошок. Для заполнения капилляра его открытый конец погружают в порошок, при этом некоторое количество вещества попадает в верхнюю часть капилляра. Далее (для перемещения вещества в нижнюю часть капилляра и уплотнения слоя) капилляр бросают запаянным концом вниз в длинную, узкую, вертикально поставленную стеклянную трубку (диаметр10 мм, длина 40 – 50 см). Повторяя этот прием несколько раз, добиваются получения плотного слоя вещества в капилляре высотой 3-5 мм.
Непосредственное определение температуры плавления производится в специальном стеклянном приборе (рисунок 5), состоящем из круглодонной колбы (1) с высококипящим теплоносителем, пробирки (2) и термометра (3). Капилляр (4) с испытуемым веществом прикрепляют к термометру колечком из резиновой трубки (5) так, чтобы столбик вещества находился на уровне середины ртутного шарика. Прибор нагревают на воздушной бане (колбонагреватель, электроплитка) сначала быстро, а последние 15-20 ниже предполагаемой температуры плавления температуру повышают со скоростью не более 2 град · мин –1 . Точкой плавления считают температуру в момент полного расплавления вещества.
Обычно вещество плавится в интервале температур и этот интервал тем меньше, чем чище вещество. Началом плавления считают момент появления первой капли в капилляре, а окончанием – исчезновение последних кристалликов вещества.
Обработка результатов
В ходе проделанной работы была определена температура плавления нафталина, было установлено, что температурный интервал превышает допустимые значения, таким образом можно говорить о том, что технический нафталин недостаточно чистый. Также можно добавить, что смеси разных веществ, как правило, плавятся при более низкой температуре, чем сами индивидуальные вещества. Чтобы установить, являются ли вещества с близкими температурами плавления одинаковыми или разными, определяют температуру плавления смеси этих веществ (смешанной пробы), если температура плавления пробы ниже температуры плавления веществ, взятых для приготовления, то, следовательно мы имеем дело с разными веществами. Наоборот, отсутствие депрессии температуры плавления у смешанной пробы считается доказательством идентичности взятых веществ.
Лабораторная работа 2.2
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ РЕФРАКЦИИ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы : определить показатель преломления и идентифицировать неизвестное органическое соединение.
2.2.1. Материалы, реактивы, оборудование:
Рефрактометр Аббе, коническая колба с неизвестным соединением, пипетка, вата (смоченная эфиром).
Общие положения
Показатель преломления по отношению к вакууму называется абсолютным показателем преломления. При измерении показателей преломления  жидких и твердых тел обычно определяют относительные показатели преломления по отношению к воздуху лабораторного помещения.
жидких и твердых тел обычно определяют относительные показатели преломления по отношению к воздуху лабораторного помещения.
Показатель преломления вещества определяется его природой, но зависит также от внешних условий – температуры и длины волны света. У органических жидкостей с ростом температуры на 1 он падает на 4·10 –4 -5 · 10 –4 .
Показатель преломления характеризует поляризуемость молекулы, под которой понимают способность ее к поляризации, т. е. к изменению состояния электронного облака под действием внешнего электрического поля. По мере возрастания поляризуемости молекулы возрастает n, и эта величина связана с молекулярной рефракцией МR по уравнению Лорентц-Лоренца:
 ,
,
где n – показатель преломления вещества или раствора;
М – молекулярная масса вещества;
d- удельная масса вещества (плотность).
В отличие от показателя преломления молекулярная рефракция не зависит от температуры.
В электромагнитном поле видимого света поляризуемость молекул практически целиком обусловлена смещением электронов и равна сумме эффектов смещений отдельных электронов. Последнее обстоятельство придает МR химических соединений характер аддитивной константы. Она может быть определена теоретически как сумма рефракций отдельных атомов, входящих в состав молекулы с учетом добавок (инкрементов), учитывающих наличие и количество кратных связей:
MR теор. = Σ AR ат. + Σ ink. ,
где AR ат. – атомная рефракция одного атома;
ink – инкремент одной связи.
Величины АR для отдельных атомов и инкременты кратных связей известны и приведены в большинстве соответствующих пособий и справочников
/5, с. 17/ (таблица 1). Зная предположительную структурную формулу соединения, можно рассчитать для него МR теор. как сумму АR ат.
Например, для изопропилбензола (кумола) MR теор. равна:

MR теор. = AR C · 9 + AR H · 12 + ink дв. св. · 3
Подставляя соответствующие значения AR и ink (таблица 1), получаем:
MR теор. = 2,418 ∙ 9 + 1,100 ∙ 12 + 1,733 ∙ 3 = 40,161
Таблица 1 – Атомные рефракции отдельных атомов и инкременты
Для определения величины показателя преломления используют специальный прибор – рефрактометр. Стандартным прибором для лабораторий органической химии служит рефрактометр Аббе. Он сконструирован таким образом, что при использовании полихроматического (солнечного или искусственного) света дает значение показателя преломления для D-линии натрия. Для измерения необходимо лишь несколько капель жидкости, точность измерения составляет 0,0001 единиц показателя преломления. Чтобы добиться такой точности, во время измерения следует поддерживать постоянную температуру с точностью до 0,2 С (что достигается с помощью термостата). Показатель преломления целесообразно измерять при 20С, а у низкоплавких твердых веществ – несколько выше температуры плавления.
Поскольку каждое вещество характеризуется своим значением показателя преломления, рефрактометрию совместно с другими методами можно использовать для идентификации (узнавания) веществ. Идентификация осуществляется на основе совпадения измеренного и справочного значений показателя преломления чистых веществ, найденных при одинаковых условиях. Ввиду того, что различные вещества могут иметь близкие значения показателей преломления, рефрактометрию обычно дополняют другими методами идентификации веществ (спектральные измерения, определение температуры плавления или кипения и др.). С помощью показателя преломления можно также судить о чистоте вещества. Расхождение в величинах измеренного и справочного (для чистого вещества) значений показателей преломления веществ, найденных в одинаковых условиях, указывает на присутствие в нем примесей. В тех случаях, когда в литературе отсутствуют сведения о физических константах веществ (в том числе и показателе преломления), его можно признать чистым только тогда, когда физические константы не изменяются в процессах повторной очистки. Наибольшую точность рефрактометрический структурный анализ дает для жидких веществ. При этом необходимо располагать данными о составе и молекулярной массе (брутто-формуле) или основаниями для предположения о структурной формуле вещества. Заключение о структуре вещества выносится на основании сравнения МR эксп, найденной по формуле Лорентц-Лоренца, и Мr теор. Совпадение значений МR эксп и Мr теор с точностью 0,3-0,4 подтверждает вероятность предполагаемой брутто-формулы и структуры. Расхождение Мr теор Мr эксп. более чем на 0,3-0,4 единицы указывает на неправильность сделанных при подсчете МR теор. предположений о строении и составе вещества. В этом случае необходимо рассмотреть другие возможные для данной брутто-формулы молекулярные структуры вещества.
Поскольку показатель преломления зависит от концентрации растворов, рефрактометрию используют также для определения их концентрации, для проверки чистоты веществ и контроля за процессами разделения, например, можно контролировать перегонку (в аналитических целях). Показатель преломления бинарной смеси линейно зависит от концентрации компонентов (в объемных процентах), если только при смешивании не происходит изменения объема. Если происходят отклонения от линейной зависимости, необходимо строить калибровочную кривую.
Молярная поляризация в области оптических частот называется молярной рефракцией R М . Рефракция вещества при условии F=E (разреженный газ) описывается одним и тем же выражением как для полярных, так и неполярных веществ
R М = (n n 2 – 1)V 0 =(N A /e 0)a эл, (39)
где a эл – электронная (оптическая) поляризуемость молекулы. Оптическая поляризуемость отличается от деформационной тем, что она учитывает только смещение электронной плотности при неизменном расположении ядер молекул. Выражение (39) служит для определения значений электронной поляризуемости атомов и молекул любых веществ (как полярных, так и не полярных).
Иногда отличие a деф и a е не учитывается и для оценки величины дипольного момента используют выражение
P М - R М =(N A /e 0)× (m 2 / 3kT ) (40)
Если почему-либо затруднительно измерять молярную поляризацию при разных температурах, то можно ограничиться нахождением величин P М и R М при одной температуре.
В случае конденсированных состояний вещества выражение для молярной рефракции представляет собой формулу Лоренц-Лорентца:
R М = (n n 2 – 1)V 0 /(n n 2 + 2)= (N A /3e 0) a эл. (41)
При этом предполагается, что величина R М постоянна. Это означает постоянство поляризуемости молекул (N A и e 0 – константы), благодаря чему рефракция считается молекулярной константой данного вещества (в первом приближении).
Нагревание жидкости в замкнутом объеме, т. е. при постоянной плотности, почти всегда влечет за собой небольшое изменение рефракции; в большинстве случаев величина R М уменьшается. В процессе нагревания вещества при постоянном объеме (при постоянстве концентрации n ) уменьшается энергия взаимодействия между молекулами. Это означает, что электронная поляризуемость зависит от агрегатного состояния вещества и изменяется при фазовых переходах (твердое тело – жидкость и жидкость – газ) и при нагревании вещества.
Рефракция любого вещества зависит от длины волны проходящего света, другими словами, рефракция подчиняется явлению дисперсии. Если ограничиться рассмотрением видимой области спектра, то почти всегда будет наблюдаться возрастание показателя преломления с уменьшением длины волны. Такая зависимость называется нормальной дисперсией . Однако имеются вещества, у которых удается наблюдать обратную зависимость. В этом случае дисперсия является аномальной ; она всегда связана с поглощением света. Для наблюдения аномальной дисперсии были разработаны специальные методы. Известен, например, так называемый метод "крюков" Д.С. Рождественского. Аномальную дисперсию можно наблюдать в видимой, ультрафиолетовой и в инфракрасной областях спектра.
Попытки представить рефракции различных химических соединений в виде суммы рефракций отдельных атомов или связей предпринимались давно. Для более глубокого понимания свойств различных химических соединений необходимо учитывать взаимодействие связей и различных групп атомов. Hаличие таких взаимодействий, естественно, приводит к отклонению от аддитивности, поэтому рефракция, вычисленная по аддитивной схеме, почти всегда отличается от ее экспериментального значения.
В предположении аддитивности молярная рефракция записывается в виде
R М »Sn i R ат »Sn j R св , (42)
где R ат –рефракции атомов или групп атомов; R св – инкременты молярной рефракции связей; n i – число атомов или групп атомов в молекуле определенного типа; n j – число связей определенного типа.
В табл. 7 приведены составляющие электронной поляризуемости атомов, входящих в различные группы.
Таблица 7
Составляющие электронной поляризуемости атомов,
входящих в различные группы (Викторов М.М
., 1977)
Таблица 8
Значения молярной рефракции некоторых атомов или связей
(Викторов М.М
. 1977)
В табл. 9 приведены значения молярных поляризации и рефракции некоторых веществ.
Молярная рефракция
Из электромагнитной теории света Максвелла следует, что для длин волн, значительно удалённых от области их поглощения молекулами вещества, справедливо равенство:
где n ? - показатель преломления света для определённых длин волн.
С учётом этого уравнение Клаузиуса-Мосотти (15) принимает следующий вид:

[ см 3 /(г·моль)] (19)
Из полученного выражения видно, что показатель RМ, называемый молярной рефракцией, имеет размерность объёма молекул, содержащихся в 1 моль вещества.
Уравнение (15), которое носит название уравнения Лорентца - Лоренца, выведено в 1880 г. независимо друг от друга Х. Лорентцем и Л. Лоренцем.
На практике часто пользуются показателем удельной рефракции r, то есть рефракцией одного грамма вещества. Удельная и молярная рефракции связаны соотношением: R = r M, где М молярная масса.
Поскольку в уравнении (19) N пропорционально плотности, то его можно представить в следующем виде:

[ см 3 /г] (20)
Х. Лорентц и Л. Лоренц вскрыли физический смысл понятия рефракции - как меры электронной поляризуемости и подвели под учение о рефракции прочный теоретический фундамент.
Величина удельной рефракции практически не зависит от температуры, давления и агрегатного состояния вещества.
В исследовательской практике кроме молярной и удельной рефракции R М и r используют и другие производные от показателей преломления n (табл. 2).
Показатель преломления неполярных веществ практически не зависит от частоты волн света и поэтому уравнение (19) справедливо при всех частотах. Например, для бензола n 2 = 2,29 (длина волны 289,3 нм), тогда как е = 2,27. поэтому, если для приближённых расчётов рефракции достаточно пользоваться показателем преломления видимого спектра, то для точных расчётов необходимо производить экстраполяцию по формуле Коши:
nл = n? + a/л2, (21) где nл - показатель преломления при длине волны л;
а - эмпирический коэффициент.
Таблица 2 Рефрактометрические константы
Для полярных веществ е > n 2 . Для воды, например, n 2 = 1,78 (л = 589,3 нм), а е = 78. Более того, в этих случаях нельзя непосредственно экстраполировать n л по формуле Коши вследствие того, что показатель преломления полярных веществ часто аномально изменяется с частотой. Однако обычно нет необходимости производить такую экстраполяцию, так как рефракция является величиной аддитивной и сохраняется, если показатели преломления всех веществ измерять при определённой длине волны. За такую стандартную длину волны выбрана жёлтая линия в спектре натрия (л D = 589,3). В справочных таблицах приводятся данные именно для этой длины волны. Таким образом, для расчёта молекулярной рефракции (в см 3 /моль) пользуются формулой, в которой n ? заменён на n D.