Det är sedan länge etablerat att alla enzymer är proteiner och har alla proteiners egenskaper. Därför, liksom proteiner, är enzymer uppdelade i enkla och komplexa.
Enkla enzymer består endast av aminosyror - t.ex. pepsin , trypsin , lysozym.
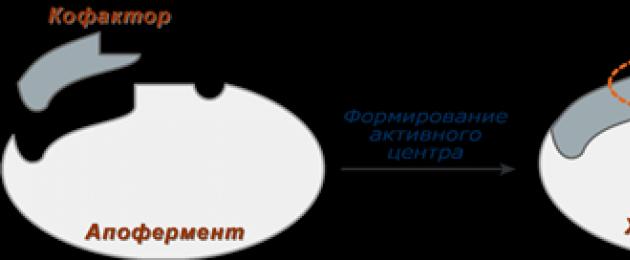
Komplexa enzymer(holoenzymer) har en proteindel som består av aminosyror - apoenzym, och en icke-proteindel - kofaktor. Exempel på komplexa enzymer är succinatdehydrogenas(innehåller FAD), aminotransferaser(innehåller pyridoxalfosfat), olika peroxidaser(innehåller hem), laktatdehydrogenas(innehåller Zn 2+), amylas(innehåller Ca2+).
Kofaktor, i sin tur kan kallas ett koenzym (NAD+, NADP+, FMN, FAD, biotin) eller en protesgrupp (hem, oligosackarider, metalljoner Fe2+, Mg2+, Ca2+, Zn2+).
Indelningen i koenzymer och protesgrupper är inte alltid tydlig:
om kopplingen mellan kofaktorn och proteinet är stark, talar de i det här fallet om närvaron protesgrupp,
men om ett vitaminderivat fungerar som en kofaktor, så kallas det koenzym, oavsett anslutningens styrka.
För att utföra katalys är ett komplett komplex av apoprotein och kofaktor nödvändig, de kan inte utföra katalys separat. Kofaktorn är en del av det aktiva centret och deltar i bindningen av substratet eller i dess transformation.
Liksom många proteiner kan enzymer vara monomerer, dvs. består av en underenhet, och polymerer, bestående av flera underenheter.
Strukturell och funktionell organisation av enzymer
Enzymet innehåller områden som utför olika funktioner:
1. Aktivt centrum - en kombination av aminosyrarester (vanligtvis 12-16) som ger direkt bindning till substratmolekylen och utför katalys. Aminosyraradikaler i det aktiva centret kan vara i vilken kombination som helst, med aminosyror som är belägna i närheten som är betydligt avlägsna från varandra i den linjära kedjan. Det finns två regioner i det aktiva centret:
- ankare(kontakt, bindning) – ansvarig för bindning och orientering av substratet i det aktiva centret,
- katalytisk– är direkt ansvarig för genomförandet av reaktionen.
Enzymstrukturdiagram
Enzymer som innehåller flera monomerer kan ha flera aktiva centra beroende på antalet subenheter. Dessutom kan två eller flera underenheter bilda en aktiv plats.
I komplexa enzymer är funktionella grupper av kofaktorn nödvändigtvis lokaliserade i det aktiva centret.

Schema för bildning av ett komplext enzym
2. Allosteriskt centrum (allos- främmande) är ett centrum för reglering av enzymaktivitet, som är rumsligt separerat från det aktiva centret och inte finns i alla enzymer. Bindning till det allosteriska centrumet av någon molekyl (kallad en aktivator eller inhibitor, såväl som en effektor, modulator, regulator) orsakar en förändring i konfigurationen av enzymproteinet och, som en konsekvens, hastigheten för den enzymatiska reaktionen.
Allosteriska enzymer är polymera proteiner de aktiva och regulatoriska centra är belägna i olika underenheter.

Schema för strukturen av ett allosteriskt enzym
En sådan regulator kan vara produkten av denna eller en av de efterföljande reaktionerna, ett reaktionssubstrat eller en annan substans (se "Reglering av enzymaktivitet").
Isoenzymer
Isoenzymer är molekylära former av samma enzym som uppstår som ett resultat av små genetiska skillnader i enzymets primära struktur, men som katalyserar samma reaktion. Isoenzymer är olika affinitet till underlaget, max fart katalyserad reaktion känslighet till inhibitorer och aktivatorer, betingelser arbete (optimalt pH och temperatur).
Som regel har isoenzymer kvartär- struktur, dvs. består av två eller flera underenheter. Till exempel representeras det dimera enzymet kreatinkinas (CK) av tre isoenzymformer som består av två typer av underenheter: M (eng. muskel– muskel) och B (eng. hjärna- hjärna). Kreatinkinas-1 (CK-1) består av subenheter av typ B och är lokaliserade i hjärnan, kreatinkinas-2 (CK-2) - en M- och B-subenhet vardera, aktiv i myokardiet, kreatinkinas-3 ( CK-3) innehåller två M-subenheter, specifika för skelettmuskulatur. Bestämning av aktiviteten av olika CK-isoenzymer i blodserum har.
Det finns också fem isoenzymer laktatdehydrogenas(roll av LDH) - ett enzym involverat i glukosmetabolism. Skillnaderna mellan dem ligger i det olika förhållandet mellan H-subenheter. hjärta- hjärta) och M (eng. muskel– muskler). Laktatdehydrogenaser typ 1 (H 4) och 2 (H 3 M 1) finns i vävnader med aerob metabolism (myokard, hjärna, njurbark), har hög affinitet för mjölksyra (laktat) och omvandlar den till pyruvat. LDH-4 (H 1 M 3) och LDH-5 (M 4) finns i vävnader som är benägna att anaerob metabolism (lever, skelettmuskel, hud, njurmärg), har låg affinitet för laktat och katalyserar omvandlingen av pyruvat till laktat. I vävnader med mellanliggande typ av metabolism (mjälte, bukspottkörtel, binjurar, lymfkörtlar) LDH-3 (H 2 M 2) dominerar. Bestämning av aktiviteten av olika LDH-isoenzymer i blodserum har klinisk och diagnostisk betydelse.
Ett annat exempel på isozymer är gruppen hexokinas, som binder en fosfatgrupp till hexosmonosackarider och involverar dem i cellulära metaboliska reaktioner. Av de fyra isoenzymer, hexokinas IV ( glukokinas), som skiljer sig från andra isoenzymer i sin höga specificitet för glukos, låg affinitet för det och okänslighet för inhibering av reaktionsprodukten.
Enzymer (enzymer)– Det här är mycket specifika proteiner som utför funktionerna som biologiska katalysatorer. En katalysator är ett ämne som påskyndar en kemisk reaktion, men som inte i sig förbrukas under reaktionen.
De villkor som krävs för den kemiska interaktionen mellan molekyler för att en kemisk reaktion ska inträffa:
- molekylerna måste komma närmare (krocka). Men inte varje kollision leder till interaktion;
- det är nödvändigt för att denna kollision ska bli effektiv - för att sluta i en kemisk omvandling. En förutsättning för effektiviteten av en kollision är att molekylernas energireserv i kollisionsögonblicket inte är lägre än reaktionens energinivå.
Reaktionens energinivå- det här är mängden energi som molekyler måste ha för att deras kollision ska bli effektiv (för att en kemisk reaktion ska inträffa). Denna energireserv är en konstant egenskap (konstant) för varje given reaktion.
Genomsnittlig energinivå för molekylerär den energi som de flesta av systemets molekyler besitter vid ett givet ögonblick. Detta är medelvärdet av energireserven, som kännetecknar helheten av dessa molekyler under dessa specifika förhållanden (temperatur, tryck, etc.). Molekylernas energireserv är ett statistiskt (probabilistiskt) begrepp. Molekyler är ständigt i termisk rörelse. Därför förändras energireserven för var och en av dem hela tiden och fluktuerar runt ett värde som representerar molekylernas genomsnittliga energinivå.
Vid varje tidpunkt har den största andelen molekyler i en given population just denna genomsnittliga energireserv. Och ju mer energin för en viss grupp av molekyler skiljer sig från den genomsnittliga energinivån (i vilken riktning som helst), desto mindre är denna grupp. I vilken uppsättning molekyler som helst har en viss andel av den en energi som ligger över medelenerginivån och är tillräcklig för att en kemisk reaktion ska inträffa.
Skillnaden mellan den genomsnittliga energinivån för molekyler och reaktionens energinivå kallas energibarriären eller aktiveringsenergin. Ju större denna aktiveringsenergi, desto långsammare fortskrider den kemiska reaktionen.
Hur påskyndar man en kemisk reaktion? Att öka den genomsnittliga energinivån för molekyler (ökande temperatur, tryck och andra miljöparametrar, som används i kemiska anläggningar och fabriker) är omöjligt för levande organismer, som normalt fungerar endast vid konstanta värden av temperatur, tryck och andra parametrar. Ett annat sätt är också omöjligt - att minska aktiveringsenergin genom att sänka reaktionens energinivå, eftersom detta värde är en konstant egenskap hos denna reaktion.
Därför kan endast fenomenet katalys (användningen av katalysatorer) påskynda kemiska reaktioner i levande organismer. Låt oss överväga två reaktioner.
I det allmänna fallet sammanfaller inte aktiveringsenergierna för reaktionerna 1, 2a och 2b med varandra, och hela mängden möjliga alternativ kan delas in i två grupper:
- Eact2a och/eller Eact2b är större än Eact1.
- I alla sådana fall kommer reaktionen av bildningen av ämnet "AB" med deltagande av ämnet "K" att gå långsammare. Detta betyder att ämnet "K" är en hämmare (moderator) av denna reaktion;
- Eact2a och/eller Eact2b är mindre än Eact1.
I dessa fall kommer reaktionen med deltagande av ämnet "K" att gå snabbare än utan den. Detta betyder att ämnet "K" är en katalysator (accelerator) för denna kemiska reaktion.
Katalysatorär ett ämne som styr en reaktion längs en bypassbana där energibarriärerna är lägre.
Energin som måste förbrukas för att "lyfta" molekylen från reaktionens genomsnittliga energinivå kompenseras helt när molekylen självständigt "rullar" nedför "vulkanens sluttning". Med ytterligare spontan "rullning ner" till botten av "vulkanen" (d.v.s. till den genomsnittliga energinivån för molekylerna som är produkterna av denna reaktion). Energin som frigörs i detta fall kallas "energiresultatet av reaktionen."
Energiresultat av reaktionenär skillnaden mellan energinivån för utgångsämnena (substraten) och energinivån för reaktionsprodukterna.
Energiresultatet av reaktionen beror inte på vägen längs vilken reaktionen fortskrider (det är samma sak för en reaktion med deltagande av en katalysator och för en reaktion utan dess deltagande). Det beror inte på storleken på aktiveringsenergin - bara förekomsthastigheten för var och en av vägarna för denna reaktion beror på den.
Härledning från Arrhenius ekvation: Eftersom aktiveringsenergin i denna ekvation ingår i exponenten leder även en liten förändring i aktiveringsenergin till stora förändringar i reaktionshastigheten.
Allmänna egenskaper hos katalysatorer
- Katalysatorer i sig orsakar inte en kemisk reaktion, utan accelererar bara reaktionen, som fortsätter utan dem.
- De påverkar inte reaktionens energiresultat.
- I reversibla reaktioner accelererar katalysatorer både framåt- och bakåtreaktionerna i samma utsträckning, vilket innebär att katalysatorer:
- påverkar inte riktningen för den reversibla reaktionen, som endast bestäms av förhållandet mellan koncentrationerna av utgångsämnena (substrat) och slutprodukterna;
- påverkar inte den reversibla reaktionens jämviktsposition, utan påskyndar bara dess uppnående.
Funktioner hos enzymer som biologiska katalysatorer
Enzymer har alla de allmänna egenskaperna hos konventionella katalysatorer. Men jämfört med konventionella katalysatorer är alla enzymer proteiner. Därför har de egenskaper som skiljer dem från konventionella katalysatorer.
Dessa egenskaper hos enzymer som biologiska katalysatorer kallas ibland allmänna enzymegenskaper. Dessa inkluderar följande.
- Hög effektivitet. Enzymer kan påskynda en reaktion med 10 8 -10 12 gånger.
- Hög selektivitet av enzymer till substrat (substratspecificitet) och till typen av reaktion som katalyseras (verkningsspecificitet).
- Hög känslighet hos enzymer för ospecifika fysikaliska och kemiska miljöfaktorer - temperatur, pH, lösningens jonstyrka, etc.
- Hög känslighet för kemiska reagenser.
- Hög och selektiv känslighet för de fysiska och kemiska effekterna av vissa kemikalier, som på grund av detta kan interagera med enzymet, förbättra eller försvåra dess arbete.
Enzymernas struktur
Ett substrat (S) är ett ämne vars kemiska omvandling till en produkt (P) katalyseras av ett enzym (E). Den del av ytan av enzymmolekylen som direkt interagerar med substratmolekylen kallas enzymets aktiva centrum.
Enzymets aktiva centrum bildas av aminosyrarester belägna i olika delar av polypeptidkedjan eller olika polypeptidkedjor som är rumsligt nära varandra. Det bildas på nivån av den tertiära strukturen av enzymproteinet.
Inom dess gränser särskiljs ett adsorptionsställe (mitten) och ett katalytiskt ställe (mitten). Dessutom förekommer speciella funktionella platser utanför enzymets aktiva centrum; var och en av dem betecknas med termen allosteriskt centrum.
Katalytiskt centrum- detta är området (zonen) av enzymets aktiva centrum som är direkt involverat i de kemiska omvandlingarna av substratet. Det bildas på grund av radikalerna av två, ibland tre aminosyror, belägna på olika ställen i enzymets polypeptidkedja, men rumsligt nära varandra på grund av denna kedjas böjningar. Till exempel bildas det katalytiska centrumet för "serin-histidin"-enzymer av radikaler av aminosyrorna serin och histidin. Om enzymet är ett komplext protein, deltar protesgruppen i enzymmolekylen (koenzym) ofta i bildandet av det katalytiska centret. Alla vattenlösliga vitaminer och fettlösliga vitamin K utför en koenzymfunktion.
Adsorptionscenter- detta är platsen för enzymmolekylens aktiva centrum där sorption (bindning) av substratmolekylen sker. Den bildas av en, två, ofta tre aminosyraradikaler, som vanligtvis är belägna nära det katalytiska centrumet. Dess huvudsakliga funktion är att binda en substratmolekyl och överföra denna molekyl till det katalytiska centret i den mest bekväma positionen (för det katalytiska centret). Denna sorption sker endast på grund av svaga typer av bindningar och är därför reversibel. När dessa bindningar bildas sker en konformationell omarrangering av adsorptionscentrum, vilket leder till närmare närhet av substratet och enzymets aktiva centrum, och en mer exakt överensstämmelse mellan deras rumsliga konfigurationer. Den amerikanska vetenskapsmannen Koshland utgjorde grunden för en sådan korrespondens - inte "färdiggjord" i förväg, utan bildad under interaktion - som grund för teorin om inducerad korrespondens (eller inducerad korrespondens), som övervann begränsningarna i det tidigare befintliga låset och nyckelteori (styv överensstämmelse mellan strukturen hos substratet och strukturen hos adsorptionscentret).
Uppenbarligen är det strukturen hos adsorptionscentret som bestämmer enzymets substratspecificitet, det vill säga enzymets krav på en kemisk molekyl så att den kan bli ett lämpligt substrat för det.
Vissa substanser med lämpliga egenskaper (dvs. liknar substratet) kan också binda till enzymets adsorptionsställe. Men om deras molekyl inte har en kemisk bindning som kan påverkas av ett givet enzyms katalytiska centrum, kommer kemiska omvandlingar av detta ämne inte att ske. När de upptar det aktiva centrumet av ett enzym blockerar sådana molekyler dess arbete, det vill säga de är reversibla hämmare av detta enzym (reversibla, eftersom de är anslutna till enzymet genom svaga typer av bindningar). Genom att öka koncentrationen av substratet kan de förskjutas från adsorptionscentret. Därför kallas sådana hämmare för konkurrenskraftiga. De konkurrerar med det verkliga substratet för ett givet enzym om innehavet av dess adsorptionsställe.
Allosteriska centra är de sektioner av enzymmolekylen utanför dess aktiva centrum som kan binda genom svaga typer av bindningar (vilket betyder reversibelt) med en eller annan substans (ligand). Dessutom leder sådan bindning till en konformationell omarrangemang av enzymmolekylen, som sträcker sig till det aktiva centret, vilket underlättar eller komplicerar (bromsar) dess arbete. Följaktligen kallas sådana substanser allosteriska aktivatorer eller allosteriska inhibitorer av detta enzym.
Termen "allosterisk" (dvs. "har en annan rumslig struktur") uppstod på grund av det faktum att dessa effektorer, i sin rumsliga konfiguration, inte alls liknar substratmolekylen för ett givet enzym (och därför inte kan binda till enzymets aktiva centrum). Man drog slutsatsen att det allosteriska centret inte är strukturellt likt enzymets aktiva centrum.
Allosteriska centra finns inte i alla enzymer. De finns i de enzymer vars arbete kan förändras under påverkan av hormoner, mediatorer och andra biologiskt aktiva substanser. Vissa artificiellt syntetiserade läkemedel har biologisk aktivitet eftersom deras molekyler är komplementära till det allosteriska centrumet av vissa enzymer i kroppen.
Enzymspecificitet
Det finns två huvudtyper av enzymspecificitet: substratspecificitet och verkansspecificitet.
Substratspecificitet är förmågan hos ett enzym att katalysera transformationen av endast ett specifikt substrat eller en grupp av strukturellt liknande substrat. Bestäms av strukturen av adsorptionsstället för enzymets aktiva centrum.
Det finns tre typer av substratspecificitet:
- absolut substratspecificitet är förmågan hos ett enzym att katalysera transformationen av endast ett strikt definierat substrat;
- relativ substratspecificitet - förmågan hos ett enzym att katalysera omvandlingen av flera substrat liknande struktur;
- stereospecificitet - förmågan hos ett enzym att katalysera omvandlingen av vissa stereoisomerer.
Till exempel kan enzymet L-aminosyraoxidas oxidera alla aminosyror, men bara de som tillhör L-serien. Således har detta enzym relativ substratspecificitet och stereospecificitet på samma gång.
Handlingens specificitetär förmågan hos ett enzym att katalysera endast en viss typ av kemisk reaktion.
I enlighet med verkningsspecificiteten är alla enzymer indelade i 6 klasser. Enzymklasser betecknas med latinska siffror. Namnet på varje enzymklass motsvarar detta nummer.
Klassificering av enzymer
Klass I - oxidoreduktaser
Denna klass inkluderar enzymer som katalyserar redoxreaktioner. Under oxidation kan antingen avlägsnande av väte från det oxiderade ämnet eller tillsats av syre till det oxiderade ämnet ske. Beroende på oxidationsmetoden särskiljs följande underklasser av oxidoreduktaser:
- dehydrogenas. Katalysera reaktioner där väte avlägsnas från ämnet som oxideras;
- oxygenaser. Enzymer av denna underklass katalyserar införandet av syre i det oxiderade ämnet:
- monooxygenaser - inkluderar en syreatom i den oxiderade substansen;
- dioxygenaser - inkluderar 2 syreatomer i det oxiderade ämnet. Detta åtföljs ofta av ett brott i den cykliska strukturen. Syreatomer tillsätts på platsen där bindningen bryts.
Klass II - transferaser
De katalyserar reaktioner som överför kemiska grupper från en molekyl av ett ämne till en molekyl av ett annat ämne.
III klass - hydrolaser
Katalysera reaktioner av förstörelse av kemiska bindningar med deltagande av vatten.
IV klass - lyaser
Katalysera reaktioner av förstörelse av kemiska bindningar utan deltagande av vatten.
Klass V - isomeraser
Katalysera reaktioner av isomera transformationer.
Klass VI - ligaser (syntaser, syntetaser)
Katalysera syntesreaktioner.
Huvudstadier av enzymatisk katalys
Varje enzymatisk reaktion fortskrider genom ett antal mellanstadier.
Det finns tre huvudstadier av enzymatisk katalys.
Steg 1. Ungefärlig sorption av substratet på enzymets aktiva plats med bildning av ett reversibelt E-S-komplex (enzym-substrat). I detta skede sker interaktionen av enzymets adsorptionscentrum med substratmolekylen. I detta fall genomgår substratet också en konformationell omarrangering. Allt detta sker på grund av uppkomsten av svaga typer av bindningar mellan substratet och enzymets adsorptionscentrum. Som ett resultat tillförs substratmolekylen till det katalytiska centret i den mest lämpliga positionen för den. Detta steg är lätt reversibelt eftersom endast svaga typer av obligationer är inblandade. Den kinetiska egenskapen för det första steget av enzymatisk katalys är Michaelis-konstanten (Km).
Steg 2. Kemiska transformationer av en substratmolekyl som en del av ett enzym-substratkomplex med bildning av ett enzymkomplex med ett kemiskt transformerat substrat. I detta skede bryts några kovalenta bindningar och nya bildas. Därför går detta steg mycket långsammare än det första och tredje steget. Det är hastigheten i det andra steget som bestämmer hastigheten för hela den enzymatiska reaktionen som helhet. Detta betyder att hastigheten för den enzymatiska processen som helhet kännetecknas av värdet k+2, vilket nästan alltid är det minsta av alla partiella hastighetskonstanter. Den kinetiska karaktäristiken för det andra steget är maximal hastighet (Vmax).
Steg 3. Desorption av den färdiga produkten från dess komplex med enzymet. Detta steg är lättare än det andra. Den är, liksom den andra etappen, också oåterkallelig. Undantaget är reversibla enzymatiska reaktioner.
Specifikationer för enzymatisk katalys
Varje kemisk reaktion kännetecknas, förutom den grundläggande möjligheten att dess förekomst (på grund av termodynamikens lagar), av processens hastighet. Hastigheten för en enzymatisk reaktion är förändringen i [S] eller [P] per tidsenhet. Efter att ha mätt dess hastighet, det vill säga hastigheten i närvaro av ett enzym, måste vi mäta reaktionshastigheten i frånvaro av enzymet (spontant reaktion). Det är denna skillnad som kännetecknar enzymets arbete.
När man mäter en reaktionshastighet är det alltid nödvändigt att mäta den initiala hastigheten för processen, dvs. hastigheten för den enzymatiska reaktionen, under en tillräckligt kort tidsperiod när koncentrationen av substratet ändras, inte så signifikant att den påverkar processens hastighet. Reaktionshastighetsenheter kan variera. Det är bättre att använda molära enheter, och tiden är minuter eller sekunder, mer sällan timmar. Därför kan reaktionshastigheten uttryckas t.ex. i µmol/min eller mmol/timme. Storleken på hastigheten bestäms av lagen om massverkan. I allmänhet är hastigheten för en kemisk reaktion proportionell mot produkten av koncentrationen av reaktanterna. När det gäller enzymatisk kinetik är ett av de reagerande ämnena ett enzym, vars koncentration är många storleksordningar lägre än koncentrationen av substratet. Detta bestämmer vissa egenskaper hos kinetiken för enzymatisk katalys.
V = k+2 [E] x [S].
Beroende av hastigheten för enzymatisk reaktion på koncentration ([E]) vid en konstant och ganska hög koncentration av substratet ([S]>>[E], [S]=const).
Avvikelse från grafens linjäritet vid mycket höga enzymkoncentrationer uppstår på grund av brist på substrat, därför minskar tillförselhastigheten av substrat till enzymets aktiva plats. Det är nödvändigt att bestämma hastigheten för en enzymatisk reaktion endast inom det intervall av enzymkoncentrationer där grafen är linjär.
Linjäriteten i denna graf tillåter oss att uttrycka den i en figur - tangens av lutningsvinkeln till abskissaxeln. Denna tangent representerar mängden enzymaktivitet. Det är varje enzyms arbete (effektivitet) som kvantitativt kännetecknas av värdet av dess aktivitet, dvs. hastigheten för enzymatisk reaktion per enhetsmängd enzym. Aktivitetsenheterna kan vara olika: µmol S/min.mg eller µmol S/min.ml blodserum.
Molekylär aktivitetär antalet substratmolekyler som omvandlas av en enzymmolekyl på en minut vid 30 °C och andra optimala förhållanden. Fördelen med denna enhet är att det är möjligt att jämföra inte bara aktiviteten hos enzymer från olika källor, utan också effektiviteten hos olika enzymer. Till exempel är den molekylära aktiviteten för enzymet katalas 5 x 10 6 och kolsyraanhydras är 36 x 10 6.
Av linjäriteten i grafen följer att reaktionshastigheten kan användas för att bedöma mängden enzym:
- catal är mängden enzym som säkerställer omvandlingen av 1 mol substrat på 1 s;
- enhet är mängden enzym som omvandlar 1 µmol substrat på 1 minut. 1 enhet = 16,67 nkatal.
Beroende av hastigheten för en enzymatisk reaktion på substratkoncentrationen vid [E] = const och [S] >> [E]: ju högre substratkoncentration desto högre reaktionshastighet. Detta beroende är hyperboliskt.
Det gränsvärde som hyperbeln tenderar mot - Vmax för en given reaktion - kännetecknar enzymets maximala effektivitet: Vmax=k+2 x [E].
Sålunda är Vmax gränsen till vilken reaktionshastigheten tenderar när substratkoncentrationen ökar oändligt.
km är Michaelis konstant. Det är numeriskt lika med substratkoncentrationen vid vilken reaktionshastigheten är halva maxvärdet.
Denna kurva beskrivs av Michaelis-Mentens ekvation.
Den fysiska betydelsen av Km är att den representerar jämviktskonstanten mellan två reaktioner som leder till nedbrytningen av enzym-substratkomplexet och reaktionen som leder till bildandet av detta komplex.
Ks - substratkonstant. Karakteriserar jämviktskonstanten för det första steget av den enzymatiska reaktionen. Följaktligen är Km också vanligtvis ganska nära Ks. Följaktligen karakteriserar Km, liksom Ks, affiniteten hos substratet för ett givet enzym. Men det är väldigt svårt att bestämma k-1 och k+2 experimentellt, så det är svårt att bestämma Ks. Men Km kan enkelt bestämmas med Lineweaver-Burk-koordinater.
Med hjälp av Km kan man karakterisera affiniteten för ett givet enzym för ett givet substrat. Ju mindre Km, desto större affinitet har enzymet för ett givet substrat, och därför förskjuts jämvikten i det första steget av den enzymatiska reaktionen åt höger - mot bildandet av ett enzym-substratkomplex. Detta innebär att de bästa förutsättningarna skapas för att det andra steget i den enzymatiska processen ska kunna äga rum. Under sådana förhållanden krävs en låg substratkoncentration för att uppnå effektiv substratomvandling. Detta innebär att Vmax teoretiskt kan uppnås med små mängder substrat.
Om Km är hög betyder detta att enzymets affinitet för ett sådant substrat är låg och reaktionen vid låga koncentrationer av substratet är ineffektiv.
Km och Vmax är två kinetiska konstanter som kan användas för att karakterisera enzymets effektivitet, inklusive in vivo.
Introduktion
Idag finns det ett akut problem med att förbättra metoder för att diagnostisera olika mänskliga sjukdomar. Blodprover och urintester har använts inom medicinen under lång tid som diagnostiska verktyg. I detta fall används oftast ett biokemiskt blodprov. Men som praxis visar, för att identifiera vissa typer av sjukdomar, till exempel patologier i njurarna och urinvägarna, är det inte den biokemiska analysen av blodserum som har större diagnostiskt värde, utan den biokemiska analysen av urin. Allt detta avgör relevansen av att välja ämnet för arbetet.
Och om tidigare behandlande läkare huvudsakligen uppmärksammade nivån av glukos, totalt protein, urea, kreatinin i urinen och enzymer - till nivån av amylas (diastas), så har tester för enzymspektrum av urin under det senaste decenniet vunnit betydande popularitet. Denna teknik är mycket efterfrågad inte bara vid diagnos av nefropatologier, utan också vid tidig upptäckt av allvarliga sjukdomar hos nyfödda och vid komplex diagnos av sjukdomar.
Enzymodiagnostik är en av de viktigaste delarna av klinisk biokemi, som har sina egna uppgifter, riktningar och specifika forskningstekniker. Betydande framsteg har gjorts på detta område: ett antal nya enzymer har upptäckts och isolerats; deras roll i olika stadier av metabolism har studerats; begreppet enzymvetenskap skapades, som betraktar sjukdom som successiva störningar i enzymers struktur och funktion. Tack vare dessa prestationer blev det möjligt att avslöja patogenesen av många sjukdomar på molekylär nivå, för att skapa inte bara effektiva diagnostiska metoder, utan också förebyggande och behandling av patienter. Därför kommer vi i rapporten att överväga den biokemiska och fysiologiska essensen av enzymer och uppsättningen av huvudenzymer i mänsklig urin.
Enzymer: biokemisk struktur och fysiologisk roll
Enzymer är specifika proteiner som fungerar som biologiska katalysatorer i kroppen.
Eftersom enzymer är proteiner har de en primär, sekundär, tertiär, och många av dem - kvartär struktur.
När enzymer hydrolyserar bildas en blandning av aminosyror. Det finns över 20 olika aminosyror som är kända för att vara komponenter i proteiner.
Enzymer har gemensamma fysikaliska och kemiska egenskaper med proteiner:
Under hydrolys bryts de ner till aminosyror;
De har en hög molekylvikt;
Skapa kolloidala lösningar;
Dålig kristallisation;
Mycket instabil mot höga temperaturer av salter, tungmetaller, syror, alkalier, etc.;
De har antigena egenskaper.
Enzymers molekylvikt kännetecknas av stor variation - från flera tiotusentals till flera miljoner.
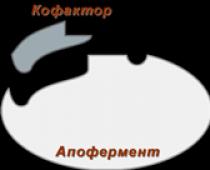
Enzymer skiljer sig i sin struktur. De är indelade i 2 grupper - enkla och komplexa. Enkla enzymer eller enzymer med en komponent består endast av aminosyror. Dessa inkluderar ett litet antal enzymer (ribonukleas, amylas, aldolas, ureas, pepsin, etc.). Men de flesta enzymer består av två komponenter: en icke-proteindel eller protesgrupp och en proteindel - apoenzymet (Fig. 1). Dessa två delar av enzymet har ingen kraft separat, men endast i kombination med varandra uppvisar de katalytisk förmåga.
Den icke-proteinkomponent som ingår i enzymnedbrytning kallas ett koenzym.
Många koenzymer är vitaminer eller deras derivat. För närvarande känner biokemin till över 300 individuella enzymer (och kanske inom en snar framtid kommer det att finnas fler, eftersom vetenskapen inte står stilla), som innehåller vitaminer eller deras derivat som koenzymer. Som ett resultat, med vitaminbrist i kroppen, uppstår en störning i aktiviteten hos alla enzymsystem.
Figur 1 Schema över enzymers struktur
Många teorier har föreslagits för att bestämma verkningsmekanismen för enzymer. Det visade sig att katalysatorer bara förkortar tiden som krävs för att uppnå jämvikt i en kemisk reaktion. De flesta kemiska reaktioner i levande organismer måste "startas", vilket är vad enzymer gör (fig. 2).
Kroppens vitala aktivitet är baserad på kemiska omvandlingar av olika ämnen, vars hastighet bestäms av enzymer - biologiska katalysatorer. Matsmältningen, användningen av alla användbara ämnen som kommer in i kroppen, tillväxt, blodkoagulering, muskelsammandragningar och många andra fysiologiska processer - allt detta bygger på enzymsystemens tydliga, konsekventa arbete.
Den viktigaste egenskapen hos enzymer är inte bara deras förmåga att påskynda förekomsten av kemiska reaktioner, utan att selektivt katalysera endast en viss väg för transformation av ett givet substrat. Detta är en av enzymernas huvudfunktioner jämfört med icke-biologiska katalysatorer.
Enzymatiska reaktioners ömsesidighet ligger i enzymernas förmåga att katalysera framåt- och bakåtreaktioner. Till exempel kan lipas under vissa förhållanden frikoppla fett till glycerol och fettsyror och även katalysera dess syntes från nedbrytningsprodukter. Enzymens förmåga att påskynda kemiska processer, både i riktning mot syntes och nedbrytning, är av stor betydelse, eftersom det skapar möjligheten att byta dessa processer från en till en annan, vilket säkerställer ett nära samband mellan katabolism och anabolism, flexibilitet och anpassningsförmåga av metabolism till påverkan av yttre och inre faktorer.

Figur 2 Diagram över enzymers verkningsmekanism
Enzymer är mycket känsliga för förändringar i pH i miljön (det vill säga graden av surhet och alkalinitet) där de verkar. Varje enzym har ett optimalt pH vid vilket det är mest aktivt.
För de flesta enzymer är den optimala miljön nära den neutrala nivån i syra-basmiljön (ph ca 7,0), eftersom maximal enzymaktivitet sker vid fysiologiska pH-värden, och i en sur eller alkalisk miljö minskar deras aktivitet. Men det finns undantag från denna regel, och det finns många av dem. Till exempel aktiveras pepsin, som finns i magsaft, endast i en mycket sur miljö (ph 1,5 - 2,5). Enzymer är också väldigt känsliga för temperatur, som vi har sett. När temperaturen stiger till 40-500 C ökar aktiviteten hos de flesta enzymer, vilket motsvarar den välkända lagen om acceleration av kemiska reaktioner med ökande temperatur. Det har fastställts att en ökning av temperaturen för varje 100 °C ökar hastigheten för den enzymatiska reaktionen med 1,5 - 2 gånger. Och därför är det nödvändigt att följa temperaturregimen när man utför tester för enzymer.
Enzymomvandling sker på samma sätt som annan proteinmetabolism i kroppen. Enzymer förnyas ständigt, syntetiseras och bryts ner, vilket säkerställer deras rätta nivåer i vävnaderna.
Som ett resultat av utsöndring eller celldöd kommer enzymer in i blodet. Vägarna för att avlägsna enzymer från blodet är olika. Enzymer inaktiveras i blodplasman, sedan absorberas de av cellerna i retikuloendotelsystemet, där de, på grund av katabolism, sönderfaller. Vissa enzymer utsöndras genom urinvägarna och mag-tarmkanalen. Men avlägsnandet av enzymer med urin och galla tar upp en liten del av mekanismen för att avlägsna enzymer från kroppen. I grund och botten bryts enzymer ner i blodplasma och vävnader och deras oanvända slutprodukter utsöndras genom normala proteinkanaler. Urinanalys för enzyminnehåll är dock ett mycket viktigt diagnostiskt verktyg som gör att vi kan identifiera många patologiska processer i kroppen.
Beroende på vilken typ av reaktioner som katalyseras är alla enzymer indelade i sex klasser och flera underklasser. Enligt denna klassificering betecknas varje enzym med en kod, som inkluderar numren för klassen, underklassen och serienumret för enzymet i underunderklassen (tabell 1).
Tabell 1 Klassificering av enzymer enligt A.Sh. Bishevsky och O.A. Tersenov
Biokemi
Enzymer
Enzymer
Genom sin funktion är enzymer biologiska katalysatorer. Kärnan i verkan av enzymer, såväl som oorganiska katalysatorer, är:
Emellertid kommer enzymer inte att katalysera energetiskt omöjliga reaktioner de accelererar endast de reaktioner som kan inträffa under givna förhållanden. 
Enzymer Likheterna mellan enzymer och oorganiska katalysatorer är som följer: 
Enzymer
Skillnaderna mellan enzymer och oorganiska katalysatorer tillåter dem att "arbeta" inuti levande kroppar och gör deras studier till ett mycket viktigt område inom kemi: 
Stadier av enzymatisk katalys
Följande steg kan särskiljas i en enzymatisk reaktion: 
Katalysmekanismer
1. Syra-bas-katalys– i enzymets aktiva centrum finns grupper av specifika aminosyrarester som är bra donatorer eller acceptorer av protoner. Sådana grupper är kraftfulla katalysatorer för många organiska reaktioner. 2. Kovalent katalys– enzymer reagerar med sina substrat och bildar mycket instabila enzym-substratkomplex med hjälp av kovalenta bindningar, från vilka reaktionsprodukter bildas vid intramolekylära omarrangemang. 
Typer av enzymreaktioner Beroende på sekvensen av interaktion mellan enzymet och reagenserna särskiljs följande typer av enzymatiska reaktioner: 
Slumpmässigt reaktionsschema
I slumpmässiga reaktioner spelar sekvensen av interaktioner mellan substratet och reaktanterna ingen roll: 
Schema för sekventiella reaktioner
I detta fall tillsätts substrat A och B sekventiellt till enzymet, vilket bildar ett "ternärt komplex", varefter katalys sker. Reaktionsprodukterna klyvs också sekventiellt från enzymet. 
"Ping-pong"-schema I det här fallet interagerar enzymet först med substrat A, väljer eventuella kemiska grupper från det och omvandlar det till motsvarande produkt. Substrat B fästs sedan till enzymet och tar emot dessa kemiska grupper. 
Enzymernas struktur Alla enzymer är proteiner, därför är de, precis som andra proteiner, uppdelade i enkla och komplexa i sammansättning.
För att utföra katalys är ett komplett komplex av apoprotein och kofaktor nödvändig, de kan inte utföra katalys separat. Liksom många proteiner kan enzymer vara monomerer eller polymerer. 
Enzymernas struktur Enzymet består av två regioner - det aktiva centret och det allosteriska centret. Det aktiva centret är en kombination av aminosyrarester (vanligtvis 12-16) som ger direkt bindning till substratmolekylen och utför katalys. Det finns två regioner i det aktiva centret: 
Aktivt mittdiagram
jag godkänner
Huvud avdelning prof., doktor i medicinska vetenskaper
Meshchaninov V.N.
_____‘’_______________2005
Föreläsning nr 1 Ämne: Introduktion till biokemi. Enzymer: struktur, egenskaper, lokalisering, nomenklatur och klassificering.
Fakulteter: terapeutiska och förebyggande, medicinska och förebyggande, pediatriska.
Biokemi - en vetenskap som studerar de ämnen som utgör levande organismer, deras omvandlingar, såväl som förhållandet mellan dessa omvandlingar och aktiviteten hos organ och vävnader. Biokemi – vetenskap om de kemiska baserna för livsprocesser.
Biokemi uppstod som en självständig vetenskap i slutet av 1800-talet. I skärningspunkten mellan biologi och kemi, även om dess ursprung går tillbaka till det avlägsna förflutna. Från 1:a hälften av 1500-talet. Läkarkemister gjorde sitt bidrag till utvecklingen av kemi och medicin: den tyske läkaren och naturforskaren F. Paracelsus, de holländska forskarna J. B. van Helmont, F. Silvius och andra, som studerade matsmältningssafter, galla och jäsningsprocesser.
Biokemi är indelad i: 1) statisk (analyserar den kemiska sammansättningen av organismer); 2) dynamisk (studerar ämnesomsättning och energi i kroppen); 3) funktionell (utforskar den molekylära grunden för olika manifestationer av livet).
Enligt forskningsobjekten är biokemi indelad i: 1) biokemi hos människor och djur; 2) växtbiokemi; 3) biokemi av mikroorganismer.
Du och jag kommer att studera medicinsk biokemi, en av grenarna inom biokemi för människor och djur. Ämne medicinsk biokemi är mänsklig.
Syfte kurs Medicinsk biokemi är studiet av: 1) den molekylära basen för mänskliga fysiologiska funktioner; 2) molekylära mekanismer för sjukdomspatogenes; 3) biokemisk grund för förebyggande och behandling av sjukdomar; 4) biokemiska metoder för att diagnostisera sjukdomar och övervaka behandlingens effektivitet.
Kursens mål medicinsk biokemi: 1) studera teoretiskt material; 2) få praktiska färdigheter i biokemisk forskning; 3) lära sig att tolka resultaten av biokemiska studier.
Kemisk natur, fysikalisk-kemiska egenskaper och enzymers biologiska roll.
Grunden för varje organisms livsaktivitet är kemiska processer. Nästan alla reaktioner i en levande organism sker med deltagande av naturliga biokatalysatorer som kallas enzymer eller enzymer.
Enzymer - Dessa är proteiner (etablerade 1922) som fungerar som katalysatorer i biologiska system.
Eftersom enzymer är ämnen av proteinnatur, har enzymer alla egenskaper hos proteiner:
hydrolysera till aminosyror;
ge positiva färgreaktioner på proteiner (biuret, xantoprotein);
liksom proteiner löses de i vatten för att bilda kolloidala lösningar;
är amfotera föreningar;
benägna att denatureras under påverkan av samma faktorer: temperatur, förändringar i pH, verkan av tungmetallsalter, verkan av fysikaliska faktorer (ultraljud, joniserande strålning, etc.);
har flera nivåer av organisering av makromolekyler, vilket bekräftas av röntgendiffraktionsanalys, NMR och ESR-data.
Enzymers biologiska roll är att de säkerställer en kontrollerad förekomst av alla metaboliska processer i kroppen.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0