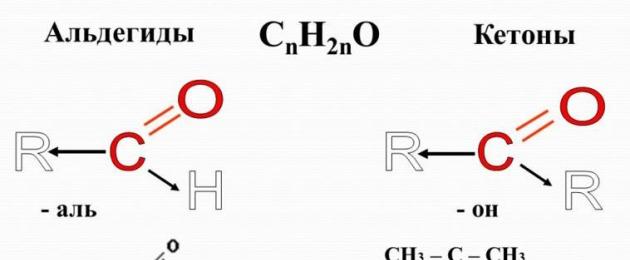
Aldehyder – organiskt material, vars molekyler innehåller en karbonylgrupp C=O, kopplad till en väteatom och en kolväteradikal.
Aldehyder – organiskt material, vars molekyler innehåller en karbonylgrupp C=O, kopplad till en väteatom och en kolväteradikal.
Den allmänna formeln för aldehyder är:

I den enklaste aldehyden, formaldehyd, spelas rollen som en kolväteradikal av en annan väteatom:

En karbonylgrupp bunden till en väteatom kallas ofta aldehyd:
Ketoner– organiska ämnen i vars molekyler karbonylgruppen är associerad med två kolväteradikaler. Självklart, allmän formel ketoner ser ut så här:

Karbonylgruppen av ketoner kallas keto grupp.
I den enklaste ketonen, aceton, är karbonylgruppen kopplad till två metylradikaler:

Nomenklatur och isomerism av aldehyder och ketoner
Beroende på strukturen hos kolväteradikalen ansluten till aldehydgruppen, särskiljs mättade, omättade, aromatiska, heterocykliska och andra aldehyder:

I enlighet med IUPAC-nomenklaturen bildas namnen på mättade aldehyder från namnet på en alkan med samma antal kolatomer i molekylen med suffixet -al. Till exempel:

Numreringen av kolatomerna i huvudkedjan börjar med kolatomen i aldehydgruppen. Därför är aldehydgruppen alltid belägen vid den första kolatomen, och det finns inget behov av att ange dess position.
Tillsammans med systematisk nomenklatur används också triviala namn på allmänt använda aldehyder. Dessa namn är vanligtvis härledda från namnen karboxylsyror motsvarande aldehyder.
För att namnge ketoner enligt systematisk nomenklatur betecknas ketogruppen med suffixet -Han och ett tal som indikerar numret på kolatomen i karbonylgruppen (numreringen bör börja från slutet av kedjan närmast ketogruppen). Till exempel:
Aldehyder kännetecknas av endast en typ av strukturell isomerism - isomerism av kolskelettet, vilket är möjligt med butanal, och för ketoner också isomerism av karbonylgruppens position. Dessutom kännetecknas de av interklassisk isomerism (propanal och propanon).

Fysikaliska egenskaper hos aldehyder
I en aldehyd- eller ketonmolekyl, på grund av den större elektronegativiteten hos syreatomen jämfört med kolatomen, bindningen C=O mycket polariserad på grund av en förskjutning i elektrondensitet π - binder till syre:

Aldehyder och ketoner är polära ämnen med överdriven elektrondensitet på syreatomen. De nedre delarna av serien av aldehyder och ketoner (formaldehyd, acetaldehyd, aceton) är obegränsat lösliga i vatten. Deras kokpunkter är lägre än motsvarande alkoholers. Detta beror på det faktum att i molekylerna av aldehyder och ketoner, till skillnad från alkoholer, finns det inga mobila väteatomer och de bildar inte associerade på grund av vätebindningar. Lägre aldehyder har en stickande lukt; Aldehyder som innehåller fyra till sex kolatomer i kedjan har en obehaglig lukt; högre aldehyder och ketoner har blomdofter och används i parfymeri .

Kemiska egenskaper hos aldehyder och ketoner
Närvaron av en aldehydgrupp i en molekyl avgör karakteristiska egenskaper aldehyder.
1. Reduktionsreaktioner.
Tillsatsen av väte till aldehydmolekyler sker genom dubbelbindningen i karbonylgruppen. Produkten av hydrering av aldehyder är primära alkoholer och ketoner är sekundära alkoholer. Sålunda, vid hydrering av acetaldehyd på en nickelkatalysator, bildas etylalkohol, och vid hydrering av aceton bildas 2-propanol.

Hydrering av aldehyder- en reduktionsreaktion där oxidationstillståndet för kolatomen som ingår i karbonylgruppen minskar.
2. Oxidationsreaktioner. Aldehyder kan inte bara reduceras, utan också oxidera. När de oxideras bildar aldehyder karboxylsyror.
Oxidation med luftsyre. Till exempel bildas propionsyra från propionaldehyd (propanal):

Oxidation med svaga oxidationsmedel(ammoniaklösning av silveroxid).

Om ytan på kärlet i vilket reaktionen utförs har avfettats tidigare, täcker det silver som bildas under reaktionen det med en tunn, jämn film. Detta gör en underbar silverspegel. Därför kallas denna reaktion för "silverspegelreaktionen". Det används ofta för att göra speglar, försilvra dekorationer och julgransdekorationer.
3. Polymerisationsreaktion:
n CH2=O → (-CH2-O-) n paraformer n=8-12
Framställning av aldehyder och ketoner

Applicering av aldehyder och ketoner
Formaldehyd(metanal, myrsyraaldehyd) H 2 C=O:
a) för framställning av fenol-formaldehydhartser;
b) erhållande av urea-formaldehyd (urea) hartser;
c) polyoximetylenpolymerer;
d) syntes mediciner(urotropin);
e) desinfektionsmedel;
e) ett konserveringsmedel för biologiska preparat (på grund av förmågan att koagulera proteiner).
Acetaldehyd
(etanal, acetaldehyd) CH3CH=O:
a) produktion ättiksyra;
b) organisk syntes.
Aceton CH3-CO-CH3:
a) lösningsmedel för fernissor, färger, cellulosaacetater;
b) råvaror för syntes av olika organiska ämnen.
Acetaldehyd har den kemiska formeln CH3COH. Den är färglös, genomskinlig, med en stickande lukt, kan koka redan vid rumstemperatur 20°C och löser sig lätt i vatten och organiska föreningar. Eftersom vetenskapen inte står stilla är det nu ganska enkelt att få fram acetaldehyd från etylalkohol.
De två huvudämnenas natur

Acetaldehyd (etanal) är vanligt i naturen, finns i livsmedel och i de flesta växter. Etanal är också en komponent i bilavgaser och cigarettrök, så det tillhör kategorin starka giftiga ämnen. Det kan syntetiseras artificiellt på olika sätt. Den mest populära metoden är att få acetaldehyd från etylalkohol. Koppar (eller silver) oxid används som en katalysator. Reaktionen ger aldehyd, väte och vatten.
Etylalkohol (etanol) är den vanliga livsmedelskvaliteten C2H5OH. Det används i stor utsträckning vid produktion av alkoholhaltiga drycker, inom medicin för desinfektion, vid produktion av hushållskemikalier, parfymer, hygienprodukter och annat.
Etylalkohol förekommer inte i naturen; den produceras med kemiska reaktioner. De viktigaste metoderna för att erhålla ämnet är följande:

- Jäsning: Vissa frukter eller grönsaker utsätts för jäst.
- Tillverkning under industriella förhållanden (användning av svavelsyra).
Den andra metoden ger en högre koncentration av etanol. Med det första alternativet kan du uppnå endast cirka 16% av detta ämne.
Metoder för framställning av acetaldehyd från etanol
Processen att erhålla acetaldehyd från etylalkohol sker enligt följande formel: C2H5OH + CuO = CH3CHO + Cu + H2O
I detta fall används etanol och kopparoxid, under inverkan av hög temperatur sker en oxidationsreaktion och acetaldehyd erhålls.
Det finns också en annan metod för att producera aldehyd - dehydrering av alkohol. Den dök upp för cirka 60 år sedan och är fortfarande populär idag. Dehydrering har många positiva egenskaper:

- det finns inga utsläpp av giftiga gifter som förgiftar atmosfären;
- bekväma och säkra reaktionsförhållanden;
- under reaktionen frigörs väte, som också kan användas;
- det finns ingen anledning att spendera pengar på ytterligare komponenter - bara etylalkohol räcker.
Produktionen av aldehyd med denna metod sker enligt följande: etanol värms upp till fyrahundra grader och väte frigörs från det katalytiskt. Processformeln ser ut så här: C2H5OH ͢ CH3CHO + H2.
Elimineringen av väte sker pga hög temperatur och lågtryck. Så fort temperaturen sjunker och trycket stiger kommer H2 tillbaka och acetaldehyden blir en alkohol igen.
Vid användning av dehydratiseringsmetoden används även en koppar- eller zinkkatalysator. Koppar är i detta fall en mycket aktiv substans som kan tappa aktivitet under reaktionen. Därför görs en blandning av koppar-, kobolt- och kromoxider som sedan appliceras på asbesten. Detta gör det möjligt att utföra reaktionen vid en temperatur på 270–300°C. I detta fall når omvandlingen av etanol från 34 till 50%.
Att bestämma den bästa metoden

Om vi jämför metoden för alkoholoxidation med dehydreringsmetoden, har den andra en klar fördel, eftersom den producerar mycket mindre giftiga ämnen och samtidigt upptäcker närvaron av en hög koncentration av etanal i kontaktgaserna. När de är dehydrerade innehåller dessa gaser endast acetaldehyd och väte, och när de oxideras innehåller de etanol utspädd med kväve. Därför är det lättare att få acetaldehyd från kontaktgaser och dess förluster blir mycket mindre än under oxidationsprocessen.

En annan viktig egenskap hos dehydreringsmetoden är att den resulterande substansen används för att producera ättiksyra. För att göra detta, ta kvicksilversulfat och vatten. Resultatet är en reaktion enligt följande schema: CH3CHO + HgSO4 + H2O = CH3COOH + H2SO4 + Hg.
För att slutföra reaktionen tillsätts järnsulfat som oxiderar kvicksilvret. För att isolera ättiksyra filtreras den resulterande lösningen och en alkalisk lösning tillsätts.
Om det inte finns någon färdig HgSO4 (en oorganisk förening av ett metallsalt och svavelsyra), framställs det oberoende. Det är nödvändigt att tillsätta 1 del kvicksilveroxid till 4 delar svavelsyra.
Ytterligare metod

Det finns ett annat sätt att få acetaldehyd. Det används för att bestämma kvaliteten på den resulterande alkoholen. För att implementera det behöver du: fuchsinussyra, etylalkohol och en kromblandning (K2Cr2O7 + H2SO4).
Häll kromblandningen (2 ml) i en torr kolv, tillsätt en kokande sten och tillsätt etylalkohol (2 ml). Provröret är täckt med ett rör för att avlägsna gaser och den andra änden sätts in i en behållare med fuchsinussyra. Blandningen värms upp, som ett resultat ändrar den sin färg till grön. Under reaktionen oxideras etanol och omvandlas till acetaldehyd, som strömmar genom röret i form av ånga och, som kommer in i ett provrör med fuchsinussyra, färgar det röd.
ACETALDEHYD (acetaldehyd, etanal) - alifatisk aldehyd, CH3CHO; en metabolit som bildas under alkoholjäsning, oxidation av etylalkohol, inklusive i människokroppen, och i andra metaboliska reaktioner. U. a. används vid framställning av olika läkemedel (se), ättiksyra (se), perättiksyra CH 3 COOOH, ättiksyraanhydrid (CH 3 CO) 2 O, etylacetat, samt vid framställning av syntetiska hartser etc. I relevanta industrier utgör en yrkesrisk.
U. a. är en färglös vätska med en stickande lukt, smälttemperatur -123,5°, koktemperatur 20,2°, dess relativa densitet vid 20° 0,783, brytningsindex vid 20° 1,3316, koncentrationsexplosionsgränser (CEL) 3, 97 - 57%. Med vatten, etylalkohol, eter och andra organiska lösningsmedel U. a. blandar i valfritt förhållande.
U. a. går in i alla reaktioner som är karakteristiska för aldehyder (se), i synnerhet oxideras den till ättiksyra, genomgår aldol- och krotonisk kondensation, bildar ättiksyra-etyleter enligt Tishchenko-reaktionen och derivat som är karakteristiska för aldehyder vid karbonylgruppen. I närvaro av syror, U. a. polymeriserar till en cyklisk kristallin tetramer av metalldehyd eller flytande paraldehyd. I industriell skala, U. a. erhålls genom hydratisering av acetylen (se) i närvaro av katalysatorer - kvicksilversalter, oxidation av etylalkohol (se) och den mest ekonomiska metoden - oxidation av etylen (se Kolväten) i närvaro av en palladiumkatalysator.
Kvalitativ upptäckt av U. a. baserat på utseendet av blå färg som ett resultat av interaktionen mellan U. a. med natriumnitroprussid i närvaro av aminer. Kvantitativ bestämning består av att erhålla vilken som helst derivat av U. a. efter karbonylgrupp och dess vikt, volym (se titrimetrisk analys) eller kolorimetrisk bestämning (se kolorimetri).
Utbildning U. a. som en mellanprodukt av metabolism förekommer i både växt- och djurorganismer. Det första steget i omvandlingen av etylalkohol i kroppen hos människor och djur är dess oxidation till uran. i närvaro av alkoholdehydrogenas (se). U. a. bildas även under dekarboxyleringen (se) av pyruvat (se Pyruvinsyra) under alkoholjäsning och under nedbrytningen av treonin (se) under inverkan av treonin aldolas (EC 4.1.2.5). I människokroppen U. a. oxideras till ättiksyra. arr. i levern under påverkan av NAD-beroende aldehydoxidas (EC 1.2.3. 1), acetaldehydoxidas och xantokinas. U. a. deltar i biosyntesen av treonin från glycin (se). I läkemedelsbehandlingsrummet I praktiken är användningen av te tu ram (se) baserad på förmågan hos detta läkemedel att specifikt blockera acetaldehydoxidas, vilket leder till ackumulering av U. a. och, som ett resultat, till en stark autonom reaktion - utvidgning av perifera kärl, hjärtklappning, huvudvärk, kvävning, illamående.
Acetaldehyd som en yrkesrisk
Med kroniska exponering av människor för låga koncentrationer av U. a. Övergående irritation av slemhinnorna i de övre luftvägarna och bindhinnan noteras. Par U. a. i inandningsluft i höga koncentrationer orsakar de ökad hjärtfrekvens och ökad svettning; tecken på en skarp irriterande effekt av U. a. i dessa fall förstärks de (särskilt på natten) och kan kombineras med kvävning, torr smärtsam hosta och huvudvärk. Konsekvenserna av sådan förgiftning är bronkit och lunginflammation.
Hudkontakt med vätska U. a. kan orsaka hyperemi och uppkomsten av infiltrat.
Första hjälpen och akutbehandling
Vid förgiftning med U. a. offret måste tas ut i frisk luft, förses med inandning av vattenånga med ammoniak, om indikerat - inandning av fuktat syre, hjärtmediciner, andningsstimulerande medel (lobeline, cytoton), valerianatinktur, brompreparat. Vid allvarlig irritation av slemhinnorna i luftvägarna - alkaliska eller oljeinhalationer. För en smärtsam hosta - kodein, etylmorfinhydroklorid (dionin), senapsplåster, koppar. Om bindhinnan är irriterad, tvätta ögonen rikligt med vatten eller isotonisk natriumkloridlösning. Vid förgiftning genom munnen, skölj omedelbart magen med vatten med tillsats av ammoniaklösning (ammoniak), 3% natriumbikarbonatlösning. Ytterligare behandling är symptomatisk. När träffad av U. a. på huden - tvätta omedelbart det drabbade området med vatten, men helst 5% ammoniaklösning.
Offret måste avlägsnas från att arbeta med farliga ämnen tills han återhämtar sig (se Arbetssjukdomar).
Åtgärder för att förhindra berusning U. a. bestå av tätningsutrustning, problemfri drift av ventilation (se), mekanisering och automatisering av tappning och transport av U. a. Butik U. a. nödvändigt i hermetiskt tillslutna behållare. I produktionsanläggningar och laboratorier i samband med kontakt med kemikalier måste personliga hygienåtgärder, användning av speciella kläder och skor, skyddsglasögon och universella andningsskydd strikt observeras.
Högsta tillåtna koncentration av U. a. i luften i arbetsområdet 5 mg/m3.
Bibliografi: Skadliga ämnen i industrin, red. N.V. Lazarev och E.N. Levina, vol. 1, L., 1976; Lebedev N. N. Kemi och teknologi för grundläggande organisk och petrokemisk syntes, M., 1981; White A. et al. Fundamentals of biochemistry, trans. från engelska, vol. 1-3, M., 1981,
A.N. Klimov, D.V. Ioffe; N. G. Budkovskaya (spelning),
Acetaldehyd tillhör organiska föreningar och tillhör klassen aldehyder. Vilka egenskaper har detta ämne, och hur ser formeln för acetaldehyd ut?
generella egenskaper
Acetaldehyd har flera namn: acetaldehyd, etanal, metylformaldehyd. Denna förening är en aldehyd av ättiksyra och etanol. Dess strukturformel är följande: CH 3 -CHO.

Ris. 1. Kemisk formel acetaldehyd.
Det speciella med denna aldehyd är att den förekommer både i naturen och produceras på konstgjord väg. Inom industrin kan produktionsvolymen av detta ämne vara upp till 1 miljon ton per år.
Etanal finns i livsmedel som kaffe, bröd och syntetiseras också av växter under ämnesomsättningen.
Acetaldehyd är en färglös vätska med en stickande lukt. Lösligt i vatten, alkohol och eter. Är giftig.

Ris. 2. Acetaldehyd.
Vätskan kokar vid en ganska låg temperatur - 20,2 grader Celsius. På grund av detta uppstår problem med dess lagring och transport. Därför lagras ämnet i form av paraldehyd, och acetaldehyd erhålls från det, om nödvändigt, genom uppvärmning med svavelsyra (eller någon annan mineralsyra). Paraldehyd är en cyklisk trimer av ättiksyra.
Metoder för att erhålla
Acetaldehyd kan erhållas på flera sätt. Det vanligaste alternativet är etylenoxidation eller, som denna metod också kallas, Wacker-processen:
2CH2=CH2+O2-2CH3CHO
Oxidationsmedlet i denna reaktion är palladiumklorid.
Acetaldehyd kan också erhållas genom att omsätta acetylen med kvicksilversalter. Denna reaktion bär namnet på den ryska vetenskapsmannen och kallas Kucherov-reaktionen. Som ett resultat av den kemiska processen bildas en enol, som isomeriserar till en aldehyd
C2H2+H2O=CH3CHO

Ris. 3. M. G. Kucherov porträtt.
DEFINITION
Aldehyder– organiska ämnen som tillhör klassen karbonylföreningar som innehåller den funktionella gruppen –CH = O, som kallas karbonyl.
Den allmänna formeln för mättade aldehyder och ketoner är C n H 2 n O. Namnen på aldehyder innehåller suffixet –al.
De enklaste representanterna för aldehyder är formaldehyd (formaldehyd) -CH 2 = O, acetaldehyd (ättiksyraaldehyd) - CH 3 -CH = O. Det finns cykliska aldehyder, till exempel cyklohexan-karbaldehyd; aromatiska aldehyder har triviala namn - bensaldehyd, vanillin.
Kolatomen i karbonylgruppen är i ett tillstånd av sp 2-hybridisering och bildar 3σ-bindningar (två C-H-bindningar och en C-O-bindning). π-bindningen bildas av p-elektronerna i kol- och syreatomerna. C=O-dubbelbindningen är en kombination av σ- och π-bindningar. Elektrondensitet flyttas mot syreatomen.
Aldehyder kännetecknas av isomerism av kolskelettet, såväl som interklassisomerism med ketoner:
CH3-CH2-CH2-CH = O (butanal);
CH3-CH (CH3) -CH = O (2-metylpentanal);
CH3-C (CH2-CH3) = O (metyletylketon).
Kemiska egenskaper hos aldehyder
Aldehydmolekyler har flera reaktionscentra: ett elektrofilt centrum (karbonylkolatom), som deltar i nukleofila additionsreaktioner; huvudcentret är en syreatom med ensamma elektronpar; a-CH-syracentrum som ansvarar för kondensationsreaktioner; C-H anslutning, bryts isär i oxidationsreaktioner.
1. Tilläggsreaktioner:
- vatten med bildning av hemdioler
R-CH = O + H2O ↔ R-CH(OH)-OH;
— alkoholer med bildning av hemiacetaler
CH3-CH = O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
— tioler med bildning av ditioacetaler (i en sur miljö)
CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5) -SC2H5 + H2O;
— natriumhydrosulfit med bildning av natrium-α-hydroxisulfonater
C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-SO3Na;
- aminer med bildning av N-substituerade iminer (Schiff-baser)
C6H5CH = O + H2NC6H5 ↔ C6H5CH = NC6H5 + H2O;
- hydraziner för att bilda hydrazoner
CH3-CH = O + 2 HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
— Blåvätesyra med bildning av nitriler
CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
- återhämtning. När aldehyder reagerar med väte erhålls primära alkoholer:
R-CH = O + H2 → R-CH2-OH;
2. Oxidation
- "silverspegelreaktion" - oxidation av aldehyder med en ammoniaklösning av silveroxid
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
- oxidation av aldehyder med koppar(II)hydroxid, vilket resulterar i bildandet av en röd fällning av koppar(I)oxid
CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu2O↓ + 2H2O;
Dessa reaktioner är kvalitativa reaktioner till aldehyder.
Fysikaliska egenskaper hos aldehyder
Förste representant homolog serie aldehyder - formaldehyd (formaldehyd) - ett gasformigt ämne (n.s.), aldehyder med ogrenad struktur och sammansättning C 2 -C 12 - vätskor, C 13 och längre - fasta ämnen. Ju fler kolatomer en rak aldehyd innehåller, desto högre är dess kokpunkt. Med ökning molekylvikt aldehyder, värdena för deras viskositet, densitet och brytningsindex ökar. Formaldehyd och acetaldehyd kan blandas med vatten i obegränsade mängder, men med tillväxten av kolvätekedjan minskar aldehydernas förmåga. Lägre aldehyder har en stickande lukt.
Framställning av aldehyder
De viktigaste metoderna för att erhålla aldehyder:
- hydroformylering av alkener. Denna reaktion består av tillsats av CO och väte till en alken i närvaro av karbonyler av vissa grupp VIII-metaller, till exempel oktakarbonyldikobalt (Co 2 (CO) 8. Reaktionen utförs genom upphettning till 130 C och a tryck på 300 atm
CH3-CH = CH2 + CO +H2 →CH3-CH2-CH2-CH = O+ (CH3) 2CHCH = O;
- hydrering av alkyner. Interaktionen av alkyner med vatten sker i närvaro av kvicksilver (II) salter och i en sur miljö:
HC=CH + H2O → CH3-CH = O;
- oxidation av primära alkoholer (reaktionen sker vid upphettning)
CH3-CH2-OH + CuO → CH3-CH = O + Cu + H2O.
Applicering av aldehyder
Aldehyder används i stor utsträckning som råmaterial för syntes av olika produkter. Från formaldehyd (produktion i stor skala) erhålls olika hartser (fenol-formaldehyd, etc.) och mediciner (urotropin); acetaldehyd är ett råmaterial för syntes av ättiksyra, etanol, olika pyridinderivat, etc. Många aldehyder (smörsyra, kanel, etc.) används som ingredienser i parfymer.
Exempel på problemlösning
EXEMPEL 1
| Träning | Genom bromering av CnH2n+2 erhöll vi 9,5 g monobromid, som, när den behandlades med en utspädd NaOH-lösning, förvandlades till en syrehaltig förening. Dess ångor med luft leds över ett varmt kopparnät. Vid bearbetning av den resulterande nya gasformigt ämne ett överskott av ammoniaklösning av Ag 2 O frigjorde 43,2 g sediment. Vilket kolväte som togs och i vilken mängd, om utbytet vid bromeringssteget är 50 %, fortgår de återstående reaktionerna kvantitativt. |
| Lösning | Låt oss skriva ner ekvationerna för alla förekommande reaktioner: CnH2n+2 + Br2 = CnH2n+1 Br + HBr; CnH2n+1 Br + NaOH = CnH2n+1 OH + NaBr; CnH2n+1 OH → R-CH = O; R-CH = O + Ag2O → R-CO-OH + 2Ag↓. Fällningen som frigjordes i den senaste reaktionen är silver, därför kan du hitta mängden av ämnet som frigörs silver: M(Ag) = 108 g/mol; v(Ag) = m/M = 43,2/108 = 0,4 mol. Enligt villkoren för problemet, efter att ha passerat ämnet som erhållits i reaktion 2 över ett hett metallnät, bildades en gas, och den enda gasen - aldehyd - är metanal, därför är utgångsämnet metan. CH4 + Br2 = CH3Br + HBr. Mängd brommetanämne: v(CH3Br) = m/M = 9,5/95 = 0,1 mol. Då är mängden metansubstans som krävs för 50 % utbyte av brommetan 0,2 mol. M(CH4) = 16 g/mol. Därför är massan och volymen av metan: m(CH4) = 0,2 x 16 = 3,2 g; V(CH4) = 0,2 x 22,4 = 4,48 1. |
| Svar | Metanmassa - vikt 3,2 g, metanvolym - 4,48 l |
EXEMPEL 2
| Träning | Skriv reaktionsekvationerna som kan användas för att utföra följande omvandlingar: buten-1 → 1-bromobutan + NaOH → A – H 2 → B + OH → C + HCl → D. |
| Lösning | För att erhålla 1-bromobutan från buten-1 är det nödvändigt att utföra en hydrobromeringsreaktion i närvaro av peroxidföreningar R 2 O 2 (reaktionen fortsätter mot Markovnikovs regel): CH3-CH2-CH = CH2 + HBr → CH3-CH2-CH2-CH2Br. När man interagerar med vattenlösning alkali 1-bromobutan genomgår hydrolys för att bilda butanol-1 (A): CH3-CH2-CH2-CH2Br + NaOH → CH3-CH2-CH2-CH2OH + NaBr. Butanol-1, när den dehydreras, bildar en aldehyd-butanal (B): CH3-CH2-CH2-CH2OH → CH3-CH2-CH2-CH = O. En ammoniaklösning av silveroxid oxiderar butanal till ammoniumsalt – ammoniumbutyrat (C): CH3-CH2-CH2-CH = O + OH →CH3-CH2-CH2-COONH4 + 3NH3 + 2Ag↓ +H2O. Ammoniumbutyrat reagerar med saltsyra och bildar smörsyra (D): CH3-CH2-CH2-COONH4 + HCl → CH3-CH2-CH2-COOH + NH4Cl. |
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0