Förord
"En praktisk guide till kemi. 10:e klass" är avsedd för att studera kemi i 10:e klass på gymnasiet med hjälp av en av de moderna läroböckerna, till exempel, enligt boken av E.E. Nifantiev och L.A. Tsvetkov "Kemi 10–11". Den här handboken är den tredje boken med praktisk utveckling för en fyraårig kemikurs.
Med otvivelaktigt samband med oorganisk kemi, studerad i årskurs 8 och 9, är organisk kemi (10 årskurs) väsentligen ett självständigt ämne. Den har sitt eget språk, specifik terminologi och en repetitiv, cyklisk karaktär av att presentera material om kopplingar mellan olika klasser. Till exempel är ordningen för att studera alkaner som följer: sammansättning av föreningar, deras struktur, isomerism, namn, reaktioner av beredning och kemiska omvandlingar, tillämpningar och beräkningsproblem. Samma ordning används när man överväger efterföljande klasser av organiska föreningar - alkener, alkoholer, etc.
I grunden är ”Praktisk guide” en kortfattad och lättillgänglig presentation av kursen i organisk kemi för årskurs 10 i två ämnen: ”Kolväten” (14 lektioner) och ”Syrehaltiga föreningar” (22 lektioner). Varje ämne följs av ett testpapper. Det avslutande kunskapsprovet i organisk kemikursen på grundläggande utbildningsnivå erbjuds också i form av prov (31 frågor).
Varje lektion i den här handboken börjar med en kort presentation av de teoretiska grunderna för en specifik fråga. Typiska exempel som illustrerar materialet och metoder för att lösa problem beaktas. Lektionen avslutas med övningar (6–8 frågor) som testar elevernas färdigheter och förmågor. Svar på många uppgifter, inklusive lösningar på beräkningar och komplexa problem, ges också i manualen. De första lektionerna (nr 1–3, 7–12) innehåller organisk kemi som introducerades i årskurs 9. Dessa lektioner är sammanställda i form av ett kemiskt diktat. I diktatet anges namnen på nyckeltermer endast med de första bokstäverna och sedan med prickar. Studenter anger sådana termer självständigt.
Manualen är utformad för skolbarn med olika utbildningsnivåer. Vissa kommer att kunna återge de diskuterade exemplen, andra kommer att klara av de föreslagna uppgifterna och liknande frågor från andra källor. Som ett resultat av denna arbetsform får eleverna den nödvändiga teoretiska och praktiska informationen som gör det möjligt för dem att navigera i de viktigaste lagarna för organisk kemi.
Den här praktiska guiden hjälper eleverna att lära sig kemi. Det kommer att vara användbart för lärare när de organiserar utbildningsprocessen och för sökande när de förbereder sig för universitetsprov.
Ämne 1. Kolväten.
Lektion 1. Organiska föreningars struktur.
Lektion 2. Strukturformler och namn på mättade kolväten.
Lektion 3. Isomerism av mättade kolväten.
Lektion 4. Kovalenta bindningar av organiska föreningar.
Lektion 5. Hybridisering av kolatomära orbitaler.
Lektion 6. Klassificering av reaktioner i organisk kemi.
Lektion 7. Kemiska egenskaper hos alkaner.
Lektion 8. Omättade kolväten.
Lektion 9. Kemiska egenskaper hos alkener.
Lektion 10. Beredning och applicering av alkener.
Lektion 11. Dienes. Naturgummi.
Lektion 12. Acetylen och dess homologer.
Lektion 13. Aromatiska kolväten (arener).
Lektion 14. Beredning, kemiska egenskaper och tillämpningar av bensen.
Lektion 15. Test nr 1 (test) på ämne 1 "Kolväten".
Ämne 2. Syrehaltiga föreningar.
Lektion 16. Envärda mättade alkoholer.
Lektion 17. Beredning av alkoholer.
Lektion 18. Kemiska egenskaper hos alkoholer.
Lektion 19. Användning av alkoholer. Kedjor av kemiska omvandlingar som involverar alkoholer.
Lektion 20. Flervärda alkoholer.
Lektion 21. Fenoler.
Lektion 22. Problem om ämnet "Alkoholer och fenoler."
Lektion 23. Aldehyder.
Lektion 24. Kemiska egenskaper och tillämpningar av aldehyder.
Lektion 25. Ketoner.
Lektion 26. Karboxylsyror.
Lektion 27. Karboxylsyrors kemiska egenskaper.
Lektion 28. Att känna igen syrehaltiga ämnen.
Lektion 29. Estrar och andra derivat av karboxylsyror.
Lektion 30. Ursprung och användning av karboxylsyror och estrar.
Lektion 31. Genetiskt samband mellan kolväten, deras halogenderivat och syrehaltiga föreningar.
Lektion 32. Fetter.
Lektion 33. Kolhydrater.
Lektion 34. Cykliska former av monosackarider.
Lektion 35. Disackarider och oligosackarider.
Lektion 36. Polysackarider.
Lektion 37. Kolhydraters kemiska egenskaper.
Lektion 38. Test nr 2 (tester) på ämnet "Syrehaltiga föreningar."
Lektion 39. Slutarbete ”All organisk kemi”.
Ordlista med termer
Vi kan inte förutsäga
hur vårt ord kommer att reagera i våra hjärtan.
R. Kazakova
Ämne 1. Kolväten
Lektion 1. Organiska föreningars struktur
Organisk kemi är vetenskapen om kolföreningar. Mr. Carbon kommer att vara din guide genom denna handledning.
Kolväten är organiska föreningar som består av atomer av två grundämnen - y....... och i……. .
Mångfalden av organiska föreningar beror på C-atomernas förmåga att bilda c..., d.v.s. ansluta med varandra. Kolkedjor kommer i ...... , r………… och c………. .
Linjära kedjor är de där alla C-atomer är belägna på samma linje (rakt, brutet eller vridet). Om C-atomer betecknas med prickar och kemiska bindningar mellan atomer med streck, så ser linjära kedjor ut så här:
Grenade kedjor är de där några av C-atomerna inte faller på en kontinuerlig linje som förbinder det största antalet kolatomer i molekylen. Den längsta kedjan av C-atomer kallas g…… y……… c….. . För att markera den huvudsakliga kolkedjan är dess C-atomer numrerade. Atomer och grupper av atomer som inte ingår i huvudkedjan (inklusive heteroatomer* för kolvätederivat) associerade med huvudkedjan av C-atomer kallas s………….
I den konventionella förkortade notationen av grenade kedjor kommer kolatomer - substituenter - att visas med prickar i en cirkel och heteroatomer - med kemiska symboler.
Exempel på grenade kolkedjor:
Cykliska kedjor (cykler) innehåller 3, 4, 5, 6 eller fler C-atomer slutna i en ring. Huvudkedjan i cykliska föreningar är kolatomerna i cykeln, och deras räkning börjar från den mer komplexa substituenten som ingår i kedjan.
Exempel på cykliska kretsar:
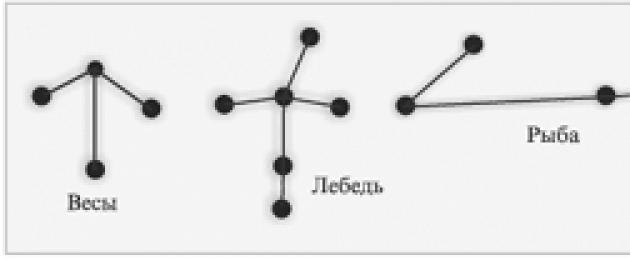
Grupper av stjärnor på himlen kan också representeras som kedjor av olika typer:
 |
Övning 1.Skriv ett exempel på tre typer av kolkedjor: linjära, grenade, cykliska, som var och en innehåller sju C-atomer.
Uppgift 2. I serien av kemiska symboler, understryka heteroatomerna: H, Li, C, N, O, F, Cl.
Kolväten med linjär och grenad struktur, alla bindningar mellan kolatomer i vilka är enkla (mättade eller mättade):

har namnet "a...".
Allmän formel alkaner- MED n H 2 n+2, var n= 1, 2, 3, 4, etc. (vilket heltal som helst). Till exempel om i en molekyl mättat kolväte tre kolatomer ( n= 3), då blir antalet väteatomer åtta (2 n+ 2 = 2 3 + 2 = 8), molekylformeln för detta ämne är C 3 H 8. För alkaner med fem och femtio C-atomer är molekylformlerna C 5 H ... och C 50 H ....
Alkaner som har en cyklisk struktur (som innehåller en cykel i molekylen) kallas c…………. Allmän formel cykloalkaner- MED n H 2 n. Således, för cykliska kolväten som innehåller fem C-atomer, kommer molekylformeln att vara C 5 H 10. För cykliska kedjor med sammansättning C 5 H 10, där det erforderliga antalet H-atomer anges vid kolatomerna (valens C – IV), är formlerna som följer:
Känd omättade kolväten. De innehåller kol-kol dubbel (C=C) eller trippel (CC) bindningar, vanligtvis tillsammans med enkelbindningar (C–C):
Det är intressant att vid ett enda kol kan det finnas fyra heteroatomära substituenter (struktur A), vid kanten C-atomer av kolkedjan - upp till tre heteroatomära substituenter (strukturer B 1 - B 3), och vid de inre atomerna i kolkedjan kedja - en eller två substituenter (strukturer B 1 , AT 2):
* Inom organisk kemi är heteroatomer alla andra atomer än C och H, till exempel heteroatomer - F, Cl, Br, N, O, etc.
Lektion 2. Strukturformler och namn
mättade kolväten
Valensen för kol är ... (antal). Därför, när du skriver strukturformler, bör fyra rader avvika från kol, som visar kemiska bindningar.
Formen för att skriva sammansättningen av en organisk molekyl där varje C-atom visas separat med bindningar kallas c………. f…….. . Kemiskt bundna kolatomer representerar kolskelett materia molekyler.
Tre typer av strukturformler
1. Den mest kompletta formen för att skriva en kolväteformel är när varje atom i molekylen visas separat:

Denna typ av inspelning är skrymmande, tar mycket plats och används sällan.
2.
En form av registrering där det totala antalet väteatomer för varje C-atom anges, och streck placeras mellan intilliggande kol,
betyder x……… med…. :
CH3-CH2-CH3, Cl-CH2-CH2-Br.
3. En strukturformel där streck mellan atomer som finns i en post på en linje inte indikeras, medan atomer som förekommer på andra linjer är anslutna med streck till en rak kedja:
Ibland avbildas kolkedjor med brutna linjer eller geometriska former (triangel, kvadrat, kub). I detta fall, vid varje brott i kedjan, såväl som i början och slutet av kedjan, antyds en C-atom. Till exempel i bilderna
motsvarar strukturformlerna
Nedan visas några egenskaper hos enskilda mättade kolväten och deras registreringsformer (tabell 1).
bord 1
Namn på mättade kolväten (alkaner) med linjär struktur
| namn alkan |
Molekyl formel |
Strukturell formel |
Aggregat stat |
Temperatur kokpunkt, °C |
|---|---|---|---|---|
| Metan | CH 4 | CH 4 | Gas | –161,6 |
| Etan | C2H6 | CH 3 CH 3 | Gas | –88,6 |
| Propan | C3H8 | CH 3 CH 2 CH 3 | Gas | –42,1 |
| Butan | C4H10 | CH 3 CH 2 CH 2 CH 3 | Gas | –0,5 |
| Pentan | C5H12 | CH 3 (CH 2) 3 CH 3 | Flytande | 36,1 |
| Hexan | C6H 14 | CH 3(CH 2) 4 CH 3 | Flytande | 68,7 |
| Heptan | C7H 16 | CH 3 (CH 2) 5 CH 3 | Flytande | 98,5 |
| Oktan | C8H 18 | CH 3 (CH 2) 6 CH 3 | Flytande | 125,6 |
| Nonan | C9H20 | CH 3 (CH 2) 7 CH 3 | Flytande | 150,7 |
| Dekanus | C10H 22 | CH 3 (CH 2) 8 CH 3 | Flytande | 174,0 |
Sammanställning av namn på grenade och substituerade alkaner
1. Välj huvudkolkedjan och numrera den på ett sådant sätt (vänster eller höger) att de inkommande substituenterna får de minsta talen.
2. Namnet börjar med en digital lokant - numret på kolet där substituenten är belägen. Efter numret skrivs ställföreträdarens namn med ett streck. De olika substituenterna listas sekventiellt. Om identiska substituenter upprepas två gånger, skrivs prefixet "di" i namnet efter de digitala lokaliseringarna som indikerar positionen för dessa substituenter. Följaktligen, med tre identiska substituenter är prefixet "tre", med fyra - "tetra", med fem substituenter - "penta", etc.
Namn på suppleanter

3. Namnet på kolvätet numrerat som den huvudsakliga kolkedjan skrivs tillsammans med prefixet och substituenten:
a) 2-metylbutan; b) 2,3-dimetylpentan; c) 2-klor-4-metylpentan.
Namnen på cykloalkaner bildas på ett liknande sätt, endast prefixet "cyklo" läggs till namnet på kolvätet - enligt antalet kolatomer i cykeln:
Ämnen som liknar strukturen men skiljer sig åt i en eller flera grupper -CH 2 - är kända som g....... .
Exempel homologer:
CH 3 -CH 3, CH 3 - CH 2 - CH 3, CH 3 - CH 2 - CH 2 - CH 3.
Likhetselement – linjärkedjealkaner:
Likheten mellan de tre formlerna för ämnena i det sista exemplet - i varje fall, vid den andra C-atomen i huvudkolkedjan finns samma substituent - CH 3-gruppen.
Övningar.
1. Ange vilka klasser följande föreningar kan tillhöra (stryk under alkaner med en linje, cykloalkaner med två):
C 5 H 8, C 4 H 8, C 4 H 10, C 5 H 12, C 3 H 4, C 3 H 8, C 4 H 6, C 6 H 12, C 7 H 16, C 6 H 6.
2.
Skapa strukturformlerna för kolväten som innehåller sju C-atomer i molekylen:
a) linjär struktur; b) med en grenad kedja; c) med en kedja som inkluderar en cykel.
3. Välj homologer från följande ämnen (markera på samma sätt). Förklara deras likheter och skillnader:
CH 3 Cl, CH 3 CH 2 CH 3, CH 3 CH 2 CH 2 CH 3,

4. Skapa strukturformlerna för: a) en högre homolog(+CH2); b) lägre homolog – för följande ämnen:
5. Välj huvudkedjorna av kolatomer, numrera dem och matcha namnen (givna nedan) med strukturen för följande föreningar:
a) l-brom-2-metylcyklopropan; b) 1-brom-3-metylbutan; V) n-oktan; d) 2-bromobutan.
6. Namnge föreningarna utifrån deras strukturformler: likhet - båda ämnena innehåller
likhet - båda ämnena innehåller
trekolsring, och skiljer sig i två CH2-grupper.
Typer av isomerism i organiska föreningar
Isomerism är fenomenet med att det finns isomerer En isomer är ett ämne som har samma sammansättning av atomer, men olika i struktur.
A) Strukturell isomer 1) Isomerism av kolskelettet.
Skillnader i det relativa arrangemanget av C-atomer.
2)Isomerism genom position av multipelbindning
(dubbel).
3) Från den funktionella gruppens position Skillnader i den funktionella gruppens position i förhållande till kolskelettet.
I) Rumslig isomer
Associerad med olika positioner av atomer eller grupper av atomer i förhållande till dubbelbindningen (cis-(bad) och trans-isomerism (stol), spegelisohierism)
Mättade kolväten, deras kemiska egenskaper.
Alkaner (paraffiner) är mättade (mättade) kolväten med öppen kedja. De har den allmänna formeln СnН2n+ 2. I alkaner är kolatomer anslutna till varandra endast genom enkla (enkel)bindningar, och de återstående valenserna av kol är mättade med väteatomer. Det karakteristiska suffixet för mättade kolväten är en.,
CH4 - metan; C2H6-etan; C3H8 - propan
C4H10 - butan (2 isomerer)
C5H12 - pentan (3 isomerer)
C6H14 - hexan, C7H16 - heptan
Kemiska egenskaper:
1) Substitution: CH4+Cl2→CH3Cl+HCl (metylklorid)
CH3Cl+HCl→CH2Cl2+HCl (metylenklorid) CH2Cl2+Cl2→CHCl3+HCl (kloroform)
3) Nitrering: karakteristiskt för de som har en sekundär eller tertiär kolatom.

KONOVALOV-distriktet
4) Vid en temperatur på 100-500ºС och tillgång till syre bildas fettsyror, och vid en temperatur på 500-600ºС observeras en sprickningsprocess
Förbränningsrader CH4+2O2 →CO2+H20(komplett), 2СН4+О2à2СО+4Н2(ofullständig)
Katalytisk oxidation 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH (ättiksyra),
Strippningsreaktion: (sprickbildning)
![]()
Isomerisering ![]()
![]()
Framställning av alkaner.
Metanproduktion
inom industrin:
1. Fraktionering av naturgas och destillation av olja.
2. Syntes från grundämnen vid hög temperatur (voltaisk båge),
C + 2H2 →CH4
Kemiska tillverkningsmetoder: 1) Från salter av organiska syror. Fusion av natriumacetat med alkali: CH3COONa + NaOH →CH4 + Na2CO3
2) Wurtz-syntes: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3) Från organiska magnesiumföreningar: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4) Berthelot-syntes: C2H5I+HI→C2H6+I2
5) Från alkener
6) Reduktion av halogenerade alkaner. CH3Cl+H2→(p,pt)→CH4+HCl
Orienteringsregler
1. Substituenterna närvarande i bensenringen styr den nyinträdda gruppen till vissa positioner, dvs. ha en orienterande effekt.
2. Enligt deras styrverkan är alla substituenter indelade i två grupper: orientanter av det första slaget Och orientanter av det andra slaget.
Orientanter av 1:a slaget (orto-para-orientatorer) direkt efterföljande substitution främst till orto- Och par- bestämmelser.
Dessa inkluderar elektrondonator grupper (elektroniska effekter av grupper anges inom parentes):
R( +I); -ÅH (+M,-I); -ELLER (+M,-I); -NH 2 (+M,-I); -NR 2 (+M,-I)
+M-effekten är starkare än -I-effekten i dessa grupper.
Orientanter av det första slaget ökar elektrontätheten i bensenringen, speciellt på kolatomerna i orto- Och par-positioner, vilket gynnar interaktionen av dessa speciella atomer med elektrofila reagens.  Exempel:
Exempel:

Orientanter av det första slaget, som ökar elektrondensiteten i bensenringen, ökar dess aktivitet i elektrofila substitutionsreaktioner jämfört med osubstituerad bensen.
En speciell plats bland de 1: a sortens orientanter upptas av halogener, som ställer ut elektronbortdragande egenskaper:- F (+M<–I
), -Cl (+M<–I
), -Br (+M<–I
).
Varelse orto-para-orientanter bromsar de elektrofil substitution. Anledning - stark –Jag-effekten av elektronegativa halogenatomer, vilket minskar elektrondensiteten i ringen.
Orientanter av 2:a slaget ( meta-orienterare) direkt efterföljande substitution övervägande till meta-placera.
Dessa inkluderar elektronbortdragande grupper:
-NO 2 (–M, –Jag); -COOH (–M, –Jag); -CH=O (–M, –Jag); -SO3H (–Jag); -NH3+ (–Jag); -CCl3 (–Jag).
Orientanter av 2:a slaget minskar elektrontätheten i bensenringen, speciellt i orto- Och par- bestämmelser. Därför angriper elektrofilen kolatomer inte i dessa positioner, utan i meta-position där elektrontätheten är något högre.
Exempel:
Alla orientanter av det andra slaget, som i allmänhet minskar elektrondensiteten i bensenringen, minskar dess aktivitet i elektrofila substitutionsreaktioner.
Således minskar lättheten för elektrofil substitution av föreningarna (givna som exempel) i ordningen:
toluen C 6 H 5 CH 3 > bensen C 6 H 6 > nitrobensen C 6 H 5 NO 2.
Chem. helgon.
TILLÄGGSREAKTIONER
1. Hydrogenering av karbonylföreningar, som alkener, sker i närvaro av katalytiska
lyser (Ni, Pt, Pd). Primära alkoholer bildas av aldehyder vid reduktion.
du, H-COH + H2→СH3OH;
2. Tillsats av H2O
R-COH+H2O=R-CH(OH)2 (tvåvärd alkohol) 3. Reaktion med sensyra R-COH+H-CN=R-CH(OH)(CN) (hydroxinitril)
4. Interaktion med alkoholer R-COH+R1-OH=R-CH(OR1)(OH)(hemiacetal) R-COH+R1-OH=(t* HCl)=R-CH(OR1)(OR1) (acetal) )
ERSÄTTNINGSREAKTIONER FÖR KARBONYLGRUPPEN
CH3-COH+PCl5→CH3-CHCl2+POCl3
REAKTIONER ORSAKADE AV ERSÄTTNING I EN RADIKAL
CH3-COH+Br2=Br-CH2-COH+HBr (bromättiksyraaldehyd)
R.OXIDATION
CH3-COH+Ag2O→CH3COOH+2Ag
R.ALDOL KONCENTRATION
CH3COH+ CH3COH→CH3-CH(CH3)-CH2-COH→CH3-CH=CH-COH+H2O
Framställning av aldehyder.
Aldehyder inkluderar organiska föreningar som innehåller en karbonylgrupp C=O, sammankopplade i aldehyder med en kolväteradikal
1 oxidation av metanol på en kopparkatalysator vid 300O
CH3OH + O2 →2H-COH(formaldehyd, myrsyraaldehyd) + 2H2O;
2. Dehydrering av metanol i gasfas på en katalysator (Cu, Ni).CH3OH→H-COH + H2
С2H2 + H2O CH2=CH-OH CH3-COH(ättiksyraanhedral
3 ALKALI HYDROLYS AV DIGALOGENDERIVAT
CH3-CHCl2+2NaOH→CH3-C(OH)3+2NaCl→CH3COH+H2O+2NaCl
4. R. KUCHEROVA CH≡CH+H2O→CH3COH
Dikarboxylsyror.
Karboxylsyror är derivat av kolväten innehållande
en eller flera karboxylgrupper. Den allmänna formeln för karboxylsyror är R-COOH. Karboxylgruppen består i sin tur av
karbonyl (>C=O) och hydroxyl (-OH) grupper Beroende på antalet karboxylgrupper delas karboxylsyror in i
monobasiska (monokarboxylsyra), dibasiska (dikarboxylsyra) och flerbasiska syror. Dessa är organiska föreningar som innehåller två karboxylgrupper. Tvåbasiska syror
NOOS-SNART oxalsyra (etandisyra)
NOOS-CH2-COON malonpropandiat
NOOS-CH2-CH2-COOH bärnsten (butandiovye)
NOOS-CH2-CH2-CH2-COOHpentandivy, glutarsyra
HOOC-CH2-CH2-COOH bärnstenssyra=(-H2O)=bärnstenssyraanhydrid
TAR EMOT:
1) oxidation av 2-hydroxialkoholer CH2(OH)-CH2(OH)→[O],-H2O→COH-COH→[O]→COOH-COOH
2) från dihalogenderivat Cl-CH2-CH2-Cl→(2KCl)→N≡C-CH2-CH2-C≡N→(+6H2O,-2NH3)→HOOC-CH2-CH2-COOH+2H2O
KEMISKA SV-VA
1) substitutionsreaktioner
COOH-COOH→(+NaOH,-H2O)→ COONa-COOH→(+NaOH,-H2O)→ COONa-COONa
2) utsläpp av CO2 vid uppvärmning
COOH-COOH→CO2+HC0OH
COOH-CH2-COOH→CO2+CH3COOH
3) utsläpp av H2O och uppvärmning
COOH-CH2-CH2-COOH→(t,-H2O)→ (-CH2-COOOC-CH2-) CYKEL
4) COOH-COOH→[O]→CO2+CO+H2O
5) COOH-CH2-COOH+2C2H5O→CO(O-C2H5)-CH2-CO(O-C2H5)+H2O
6) COOH-CH2-CH2-COOH+2NH4OH→ COONH4-CH2-CH2-COONH4→(-H2O)→ СONH2-CH2-CH2-CONH2→(-NH3)→(-CH2-C(O)-NH-C (O)-CH2-)→(-CH=CH-NH-CH=CH-)
Khim St.
1) Harmoni av alla reaktioner på karboxylgruppen - oxidation
Bildning av etrar
Bildning av två typer av estrar
Värmenedbrytning
Utsläpp av vatten vid upphettning (alfasyror)
Betasyror
Gama syra
Optisk isomerism.
Kolamin
Serin
Lecetin

![]()
Di- och tripeptider.
– Dessa är organiska ämnen vars molekyler är uppbyggda av aminosyror sammankopplade med en peptidbindning. Beroende på antalet aminosyror som ingår i molekylen särskiljs dipeptider, tripeptider, etc., såväl som polypeptider. Typiskt är peptidmolekyler linjära, med ena änden av kedjan som slutar i en karboxylgrupp ( -RÄNNA), och den andra med en aminogrupp ( -NH 2). Men kedjan kan också slutas i en cyklisk struktur. Tillsatsen sker på grund av frigörandet av vatten från karbonylgruppen i en aminosyra och aminogruppen i den andra. Eftersom proteiner syntetiseras i form av polypeptidkedjor är gränsen mellan en polypeptid och ett enkelt protein godtycklig. Peptider är många ämnen som är viktiga för organismer - vissa hormoner, antibiotika, gifter.
Nukleosider och nukleotider.
Nukleinsyror består av mononukleotider. Nukleotid består av tre komponenter: 1 kvävebas (purin eller perimedin), 2 socker: ribos (C 5 H 10 O 5) eller deoxiribos C 5 H 10 O 4, fosforsyra. Purinbaser. Förfadern är PURIN:
Pyrimidinbaser. PYRIMIDIN:
Kvävebaser: AMP adenosinmonofosfat (adenylsyra):
ATP adenosintrifosfat:
Nukleosider– dessa är nukleotider utan fosforsyra. Adenosin:
Fosforsyra kan tillsättas till tre positioner av riboshydroxylgrupper: 2, 3, 5. Adenin, guanin och cytosin finns i både DNA och RNA. Tymin finns bara i DNA, uracil finns bara i RNA.
Schema för strukturen av RNA och DNA.
DNA-struktur: DNA-strängen är en kolhydratfosfatsekvens till vilken kvävebaser är kopplade. Fosforsyramolekyler förbinder molekyler av oxyribos, OH 3 och 5 kolgrupper. En DNA-molekyl har 2 kedjor av nukleotider placerade parallellt med varandra. Dessa två kedjor hålls samman av vätebindningar. Komplementaritet säkerställer lika avstånd mellan kvävehaltiga baser. Sekvensen för de kvävehaltiga baserna i en kedja motsvarar strikt sekvensen för baserna i den andra kedjan.
Struktur av RNA. RNA-sträng – Detta är en sekvens av ribonukleotider kopplade till en kedja. (linjär struktur) . Kopplingen av ribonukleotider med varandra utförs av en esterbindning mellan den 3:e -HAN ribos en nukleotid och 5:a -HAN ribos av nästa nukleotid. De kvävehaltiga baserna av RNA är A och G (purin) och C och U (pyrimidin). A och D sammanfogar pentose via N 9:e plats. C och U - genom N-atomen i 1:a position. Ett utmärkande drag för DNA från RNA är att det inte kännetecknas av en stabil spiralstruktur. Det är linjärt. RNA)
Dialys. Elektrofores.
Dialys är en metod för att rena proteinlösningar från föroreningar med låg molekylvikt. För att utföra dialys behöver du en cylinder, som istället för dagen har en PPM, vars porer tillåter små molekyler att passera igenom, men inte tillåter proteinmolekyler att passera igenom. En cylinder med en proteinlösning med föroreningar nedsänks i en behållare med destillerat vatten. Små molekyler av föroreningar passerar fritt genom membranets porer, jämnt fördelade mellan områdena inuti och utanför cylindern. För fullständig rengöring, sänk ned cylindern i rinnande vatten. Med hjälp av dialys renas proteinlösningar från läkemedelsindustrin. Denna metod är grunden för den "konstgjorda njuren".
Elektroferes är en metod för att separera proteiner i separata fraktioner. Funktionen av EF-apparaten är baserad på förmågan hos laddade proteinmolekyler att röra sig i ett elektriskt fält till en motsatt laddad elektrod. Olika molekyler har olika hastighet, beroende på molekylvikt, total laddning, form. EF-apparaten består av en horisontellt placerad bärare (helium) och elektroder som skapar ett elektriskt fält. En lösning med elektrolyter appliceras på bäraren. Testlösningen appliceras på startzonen och spänning appliceras. Efter en viss tid fördelas proteiner med olika molekylvikter mellan zonerna. Från varje zon kan proteiner extraheras och kvantifieras.
Katalys. Typer av katalys.
Katalys är ett kemiskt fenomen, vars essens är att ändra hastigheten för kemiska reaktioner under inverkan av vissa ämnen (de kallas katalysatorer).
Homogen katalys - katalysatorn och reaktanterna är i samma fas.
Heterogen katalys - katalysatorn är vanligtvis fast, och reaktionen äger rum på dess yta.
Adsorption, essens, mening.
Adsorption är sedimenteringen av partiklar på ytan av adsorbenten. Aktivt kol i gasmasker skyddar mot exponering för giftiga gaser.
67) Kromatografi:
Kromatografi är en metod för att separera och analysera blandningar av ämnen och studera ämnens fysikaliska och kemiska egenskaper, baserat på fördelningen av komponenter mellan två faser: mobil och stationär. Det stationära ämnet är ett fast ämne (sorbent) eller en film av vätska avsatt på ett fast ämne. Mobil är en vätska eller gas som strömmar genom en stationär fas. Ämnet kan renas från föroreningar.
Fenomenet diffusion.
Diffusion är envägsövergången av ett lösligt ämne från en högre koncentration till en lägre.
Typer av kemiska bindningar i organiska föreningar
En kovalent bindning är en intramolekylär kemisk bindning som utförs av ett eller flera elektronpar som interagerar starkt med kärnorna hos båda atomerna som är anslutna.
En sigmabindning är en bindning som bildas som ett resultat av överlappande elektronmoln och ligger på en rät linje som förbinder atomkärnornas centra.
Pi – bindning – en bindning som bildas som ett resultat av överlappande elektronmoln och ligger utanför den raka linjen som förbinder atomkärnors centrum.
| Parameternamn | Menande |
| Artikelns ämne: | Kemiska bindningar i organiska föreningar |
| Rubrik (tematisk kategori) | Utbildning |
De flesta organiska föreningar innehåller bara ett fåtal grundämnen: kol, väte, kväve, syre, svavel och, mycket mindre ofta, andra grundämnen. Hela variationen av organiska föreningar bestäms emellertid å ena sidan av deras kvalitativa och kvantitativa sammansättning och å andra sidan av ordningen och naturen hos bindningarna mellan atomerna.
1.1 Elektronegativitet hos element
Elektronegativiteten hos en atom är dess förmåga att attrahera element. Elektronegativitetsvärden är inte signifikanta konstanter, utan visar bara atomernas relativa förmåga att attrahera elektroner mer eller mindre när de bildas med andra atomer.
Atomer som ligger i elektronegativitetsserien framför kol och som har ett elektronegativitetsvärde mindre än 2,5 ökar elektrontätheten på kolatomen när de bildar en bindning med den. Tvärtom, atomer vars elektronegativitetsvärde överstiger 2,5 minskar elektrontätheten på kolatomen när de bildar en bindning.
1.2 Jonbindning
Den elektroniska konfigurationen för vilken atom som helst kan bildas på två olika sätt. En av dem är elektronöverföring: atomer av ett element ger upp elektroner, som går till atomerna i ett annat element. I detta fall en sk jonisk (elektrovalent, heteropolär) bindning:
En atom som donerar elektroner blir en positiv jon ( katjon); en atom som har accepterat en elektron blir en negativ jon ( anjon).
Utmärkande egenskaper hos joniska föreningar är den momentana förekomsten av reaktioner, dissociation och solvatisering av joner i vattenlösningar, höga smält- och kokpunkter, löslighet i polära lösningsmedel, elektrisk ledningsförmåga hos lösningar och smältor.
En heteropolär bindning uppstår mellan atomer som skiljer sig mycket i elektronegativitet.
1.3 Kovalent bindning
När atomer med lika eller liknande elektronegativitet interagerar sker ingen elektronöverföring. Bildandet av en elektronisk konfiguration för sådana atomer sker på grund av generaliseringen av två, fyra eller sex elektroner genom interagerande atomer. Vart och ett av de generaliserade elektronparen bildar ett kovalent (homeopolär) bindning:
De viktigaste fysikaliska parametrarna för en kovalent bindning är de som kännetecknar deras symmetri, storlek, elektriska och termokemiska egenskaper.
Länklängd- ϶ᴛᴏ jämviktsavståndet mellan kärnornas centra och det beror på vilka andra atomer de är associerade med. Således varierar längden på C-C-bindningen, beroende på miljön, inom 0,154 – 0,14 nm.
Bindningsvinklar– vinklar mellan linjer som förbinder bundna atomer. Kunskaper om bindningslängder och bindningsvinklar är oerhört viktigt för att konstruera en korrekt rumslig modell, en idé om elektrondensitetsfördelningen, och används i kvantkemiska beräkningar.
Energi för att bryta en kemisk bindning- ϶ᴛᴏ energi som spenderas på att bryta denna bindning eller frigörs under dess bildning per mol partiklar. I fallet med molekyler som innehåller två eller flera identiska bindningar, särskiljs energin för att bryta en av dessa bindningar eller medelenergin för att bryta dessa bindningar. Ju högre kemisk bindningsenergi, desto starkare bindning. En bindning anses stark, eller stark, om dess energi överstiger 500 kJ/mol, svag - om dess energi är mindre än 100 kJ/mol. Om växelverkan mellan atomer frigör energi mindre än 15 kJ/mol, anses det att en kemisk bindning inte bildas, men en intermolekylär växelverkan observeras. Bindningsstyrkan minskar i allmänhet när bindningslängden ökar.
Polaritet av kemiska bindningar– karakteristisk för en kemisk bindning, som visar en förändring i fördelningen av elektrontätheten i utrymmet runt kärnorna i jämförelse med fördelningen av elektrontätheten i de neutrala atomerna som bildar denna bindning. Att känna till polariteten hos en bindning är extremt viktigt för att bedöma fördelningen av elektrondensitet i en molekyl, och därför arten av dess reaktivitet.
Bindningspolariserbarhet uttrycks i förskjutningen av bindningselektroner under påverkan av ett yttre elektriskt fält, inkl. och en annan reagerande partikel. Polariserbarheten bestäms av elektronrörlighet. Elektroner är mer rörliga ju längre de är från kärnorna.
1.4 Bryta banden
Att bryta en kovalent bindning mellan två atomer kan ske på olika sätt:
När A varje atom separeras med en elektron, vilket resulterar i bildandet av partiklar som kallas radikaler, som är mycket reaktiva på grund av närvaron av en oparad elektron; en sådan lucka kallas homolytisk klyvning kommunikation. I fall b Och V en atom kan hålla båda elektronerna, lämnar den andra atomen utan elektroner, vilket resulterar i negativa respektive positiva joner. Om R- och X-atomerna inte är identiska kan splittring ske längs en av dessa banor baserat på vilken atom - R eller X - som innehåller ett elektronpar. Dessa typer av luckor kallas heterolytisk klyvning och leda till bildandet av ett jonpar.
Kemiska bindningar i organiska föreningar - koncept och typer. Klassificering och egenskaper för kategorin "Kemiska bindningar i organiska föreningar" 2017, 2018.
1. Elektronisk struktur för kolatomen;
2. Hybridisering av atomära orbitaler;
3. Den kemiska bindningens natur;
4. Typer av kemiska bindningar.
När en kemisk bindning bildas frigörs energi, så uppkomsten av två nya valensmöjligheter leder till frigöring av ytterligare energi (1053,4 kJ/mol), vilket överstiger energin som förbrukas på parningen av 2s elektroner (401 kJ/mol) .
Orbitaler av olika former (s, p) blandas när de bildar en bindning, vilket ger nya ekvivalenta hybridiserade orbitaler (hybridiseringsteori, L. Pauling, D. Slater, 1928-1931). Begreppet hybridisering gäller bara molekyler, inte atomer, och endast orbitaler går in i hybridisering, inte elektronerna på dem.
Till skillnad från de ohybridiserade s- och p-orbitalen är hybridorbitalen polär (elektrondensiteten är förskjuten) och kan bilda starkare bindningar.

Valenstillstånd för kolatomen
|
Axel. komp. |
Interagerar orbitaler |
Plats sida |
Kommunikationstyp |
Axel. hörn |
|
|
tetraedrisk | |||
|
| ||||
|
|
linjär |
När typen av hybridisering av en kolatom förändras ändras också dess egenskaper. När man går från sp 3 till sp- ökar andelen av s-orbitalen i det hybridiserade molnets sammansättning, vilket medför en förändring av dess form. Gränserna för elektronmolnet närmar sig kärnan när det gäller sp 2- och sp-orbitaler, jämfört med sp 3-molnet. Detta återspeglas i ökningen av elektronegativitet för kolatomen i serien: sp 3< sp 2 < sp. В связи с этим, уменьшается ковалентный радиус, увеличивается полярность связи.
Typer av kemisk bindning
Jonbindning
Förekommer i fallet med fullständig donation av elektroner av vissa atomer och förvärv av dem av andra. I detta fall förvandlas atomer till joner.
Kovalent bindning
Bildas genom att dela elektroner. Bindningen av atomer i en molekyl utförs av ett elektronpar som samtidigt tillhör två atomer. Att dela elektroner är möjligt på två sätt:
1) colligation (utbytesmekanism);
2) koordination (donator-acceptor-mekanism).
Det finns två typer av kovalenta bindningar: σ (sigma)- och π (pi)-bindningar.

En σ-bindning är en enkel kovalent bindning som bildas när atomära orbitaler överlappar varandra längs en rät linje (axel) som förbinder kärnorna hos två bundna atomer med en maximal överlappning på denna räta linje.
En π-bindning är en bindning som bildas av den laterala överlappningen av ohybridiserade sid z-atomära orbitaler med maximal överlappning på båda sidor av den raka linjen som förbinder atomkärnorna.
Kvantitativa egenskaper hos kovalenta bindningar
1. Bindningsenergi är den energi som frigörs när en bindning bildas eller krävs för att bryta den.
2. Bindningslängd är avståndet mellan centra för bundna atomer.
3. Bindningspolaritet – ojämn fördelning av elektrondensitet.
4. Bindningspolariserbarhet – förskjutning av bindningselektroner under påverkan av ett externt elektriskt fält, inklusive det från en annan reagerande partikel.
Intermolekylära interaktioner

- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0