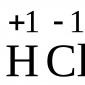1) Biuret reaktion(för alla proteiner)
Protein + CuSO 4 + NaOH ljus lila färg
СuSO4 + 2NaOH Cu(OH)2 + Na2SO4
blått sediment
C = O: Cu: O = C C = O: N
NHOHN:O=C
lösligt komplex
ljust lila
2) Xantoproteinreaktion(för proteiner som innehåller AA med en aromatisk radikal)
protein + HNO3 (k) gul fällning
| || -- H2O | ||
N CH C─ + HONO 2 N CH C─
|
gul färg
Om du tillsätter en koncentrerad ammoniaklösning framträder en orange färg eftersom elektrondensiteten skiftar i nitrobensen.
3) Cysteinreaktion- reaktion på en AK-rest innehållande S
Protein + NaOH + Pb(CH3COO) 2 PbS + protein
Svart färg
| Pb + PbS
BIOKATALYS
En av de viktiga egenskaperna hos kemiska reaktioner som förekommer i levande organismer är deras katalytiska natur. Levande cell kan ses som en katalytisk miniatyrreaktor. Skillnaden mellan en cell och en kemistkolv är att om alla reaktioner i en kolv fortskrider oberoende (den grundläggande principen om reaktionsoberoende är implementerad), så händer allt i en cell sammankopplat.
Detta händer inte för att fysiska lagar bryts eller cellen lyder andra lagar - nej, bara lagar gäller i levande materia. Det är bara det att i evolutionsprocessen skapade naturen en effektiv apparat för att reglera alla cellulära reaktioner, som gör att hela cellen kan kontrollera förhållandet mellan produkter på ett sådant sätt att alla reaktioner fungerar optimalt.
Så allt är bio kemiska reaktioner– det här är reaktioner katalytisk.
Biologiska katalysatorer kallas enzymer eller enzymer.
I princip sker samma kemiska reaktioner i cellen som i ett kemiskt laboratorium, men stränga restriktioner ställs på förutsättningarna för reaktionerna i cellen, nämligen T = 37 ◦ C och P = 1 atm.
Därför utförs ofta processer som sker i ett steg i laboratoriet i flera steg i levande celler.
Kärnan i katalytiska reaktioner, trots deras mångfald, kokar ner till det faktum att utgångsmaterialen bildas med katalysatorn mellanförbindelse, som relativt snabbt förvandlas till reaktionsprodukter, som regenererar katalysatorn.
Ibland kan intermediärer isoleras i ren form, men vanligtvis består de av instabila molekyler som bara kan detekteras med mycket känsliga spektralinstrument.
Processen som involverar en katalysator är cyklisk eller cirkulär.

Ett mått på enzymaktivitet - fart(antal mol substrat som genomgår en förändring på 1 minut per 1 mol enzym)
Antalet varv kan nå 10 8.
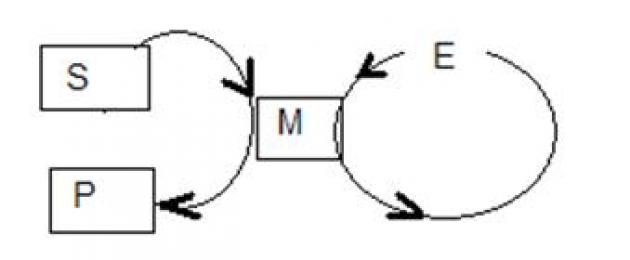
Ganska ofta kombineras cyklerna för flera katalysatorer tillsammans och bildar en cirkulär process.

Ämnen S1 och S2 omvandlas till produkterna P1 och P2. Under denna omvandling reagerar först S1 med en tredje substans X och katalysator E1 och bildar mellanprodukt M1, som i sin tur omvandlas av katalysator E2 till mellanprodukt M2, etc.
Den accelererande effekten av en katalysator är associerad med en minskning av aktiveringsenergin (detta är den extra energi som måste tillföras en mol av ett ämne för att partiklarna i ämnet ska bli reaktiva och kunna övervinna energibarriären i ämnet. reaktion).
De viktigaste egenskaperna hos enzymer inkluderar:
Verkningsgrad, som ligger i graden av acceleration (acceleration med 100 miljoner gånger).
Ökad substratspecificitet. Enzymer särskiljer substratet genom biologisk igenkänning (komplementaritet).
Ökad specificitet för den katalyserade reaktionen. De flesta enzymer påskyndar en typ av reaktion.
Ökad specificitet för optiska isomerer (kan känna igen vänsterhänta och högerhänta isomerer).
Anledningen till enzymers unika egenskaper är deras rumsliga struktur. Vanligtvis är dessa klotformiga proteiner, mycket större än substratet i storlek. Denna omständighet leder till det faktum att i evolutionsprocessen bildades ett aktivt centrum på ytan av enzymet, vilket är komplementärt till substratet. Detta är ett lås och en nyckel.
Villkorligt aktiva centra är indelade i: bindande och katalytiska.
Bindningscentret binder substratet och orienterar det optimalt i förhållande till den katalyserade gruppen, medan alla aktiva grupper är koncentrerade i det katalytiska centret.
Om hydrolys (av proteiner, lipider) är nödvändig för att utföra en reaktion, bildas det katalyserade centret av sidoradikaler av AA-rester.
I detta fall består enzymet endast av polypeptidkedjor. Men förutom hydrolytiska reaktioner förekommer även andra: redoxreaktioner, överföringsreaktioner av alla grupper.
I dessa fall innehåller enzymerna en icke-proteindel. Den här delen är koenzym(r-faktor, protesgrupp). Proteindelen ger den bindande effekten, och koenzymet ger den katalytiska effekten. Protein del - apoenzym.
Apoenzym + koenzym ↔holoenzym
Betydelsen av färgreaktioner är att de gör det möjligt att detektera förekomst av protein i biologiska vätskor, lösningar och att fastställa aminosyrasammansättningen av olika naturliga proteiner. Dessa reaktioner används för både kvalitativ och kvantitativ bestämning av protein och de aminosyror det innehåller. Vissa reaktioner är inneboende inte bara för proteiner, utan också för andra ämnen, till exempel ger fenol, som tyrosin, en rosa-röd färg med Millons reagens, så att utföra en reaktion är inte tillräckligt för att bestämma närvaron av ett protein.
Det finns två typer av färgreaktioner: 1) universal - biuret (för alla proteiner) och ninhydrin (för alla A-aminosyror och proteiner); 2) specifik - endast för vissa aminosyror både i proteinmolekylen och i lösningar av enskilda aminosyror, till exempel Foll-reaktionen (för aminosyror som innehåller svagt bundet svavel), Millon-reaktionen (för tyrosin), Sakaguchi-reaktionen ( för arginin), etc.
När du utför färgreaktioner för proteiner och aminosyror måste du först sammanställa följande tabell:
Färgreaktioner på proteiner (kvalitativa reaktioner)
Färgreaktioner på proteiner Experiment 1. Biuretreaktion.
Biuret reaktion– kvalitet för allt utan undantag ekorrar, samt produkter av deras ofullständiga hydrolys, som innehåller minst två peptidbindningar.
Metodens princip. Biuretreaktionen orsakas av förekomsten i proteiner peptidbindningar(- CO – NH -), som i en alkalisk miljö bildar rödvioletta kopparsalter med koppar(II)sulfat komplex. Biuretreaktionen produceras också av vissa icke-proteinämnen, till exempel biuret(NH2-CO-NH-CO-NH2), oxamid(NH2CO-CO-NH2), serie aminosyror (histidin, serin, treonin, asparagin).
Biuretreaktion med glycin
Ordningen på arbetet.
En lika stor volym av en 10% lösning tillsätts till 1 ml av testet 1% proteinlösning. natriumhydroxid(NaOH) alkali och sedan 2-3 droppar 1% lösning kopparsulfat(CuSO 4). utspädd, nästan färglös lösning av kopparsulfat.
Om reaktionen är positiv visas en lila färg med en röd eller blå nyans.
Erfarenhet 2.Reaktiontill "svagt bundet svavel".
Metodens princip. Detta är en reaktion på cystein och cystin. Under alkalisk hydrolys spjälkas det "svagt bundna svavlet" i cystein och cystin ganska lätt, vilket resulterar i bildningen av vätesulfid, som, som reagerar med alkali, producerar natrium- eller kaliumsulfider. När bly(II)acetat tillsätts bildas en gråsvart fällning av bly(II)sulfid.
Ordningen på arbetet.
1 ml outspätt kycklingprotein hälls i ett provrör, 2 ml 20% natriumhydroxidlösning tillsätts. Blandningen kokas försiktigt (för att förhindra att blandningen slängs).
I det här fallet frigörs ammoniak, vilket upptäcks av blåheten hos vått lackmuspapper som förs till öppningen av provröret (vidrör inte väggen). Den lätta fällningen som bildas löser sig vid kokning och sedan tillsätts 0,5 ml bly(II)acetatlösning. En gråsvart fällning av bly(II)sulfid observeras:


Reaktionens kemi:

|
svart sediment |
1 ml hälls i ett provrör. tillsätt 2 ml outspätt kycklingprotein. koncentrerad alkalilösning, sätt flera pannor. En lösning av natriumplumbite läggs till den varma lösningen - en gulbrun eller svart färg bildas. (Natriumplumbite framställs enligt följande: en alkalilösning tillsätts droppvis till 1 ml blyacetat tills blyhydroxidfällningen som initialt bildar en fällning är upplöst).
Om en proteinmolekyl innehåller svavelhaltiga aminosyror (cystin, cystein), spjälkas svavel gradvis från dessa aminosyror i form av en jon i oxidationstillstånd – 2, vars närvaro detekteras av blyjonen, som bildar svart olöslig blysulfid med svaveljonen:
Pb(CH 3 COO) 2 + 2 NaOH Pb(OH) 2 + 2 CH 3 COONa,
Pb(OH)2 + 2NaOH Na2PbO2 + H2O,
Na2S + Na2PbO2 + 2H2O PbS + 4NaOH.
Experiment 3. Xantoproteinreaktion av proteiner.
Metodens princip. Denna reaktion används för att detektera a-aminosyror som innehåller aromatiska radikaler. Tyrosin, tryptofan, fenylalanin, när de interagerar med koncentrerad salpetersyra, bildar nitroderivat som är gula till färgen. I en alkalisk miljö ger nitroderivaten av dessa a-aminosyror orangefärgade salter. Gelatin, till exempel, som inte innehåller aromatiska aminosyror, ger inget xantoproteintest.
Ordningen på arbetet.
Till 1 ml av en 10 % kycklingäggvitalösning tillsätt 0,5 ml koncentrerad salpetersyra. Som ett resultat av proteinkoagulering bildas en vit fällning eller grumlighet i innehållet i provröret. Vid upphettning blir lösningen och fällningen ljusgul. I detta fall är fällningen nästan helt upplöst till följd av hydrolys. Efter kylning, tillsätt 1–2 ml 20 % natriumhydroxidlösning (tills lösningen blir orange).
Låt oss överväga mekanismen för xantoproteinreaktionen vid tyrosinradikalen:


Reaktionskemi:

Experimentets design: dra en slutsats och skriv reaktionsekvationen.
Experiment 4. Adamkiewicz-reaktion (på närvaron av tryptofan i proteiner).
Metodens princip. Proteiner som innehåller tryptofan ger en röd-violett färg i närvaro av glyoxyl- och svavelsyror. Reaktionen är baserad på tryptofans förmåga att interagera i en sur miljö med glyoxylsyraaldehyder (som är en förorening i koncentrerad ättiksyra) för att bilda färgade kondensationsprodukter. Reaktionen fortskrider enligt ekvationen:

Gelatin ger inte denna reaktion, eftersom. den innehåller inte tryptofan. Färgen uppstår på grund av reaktionen mellan tryptofan och glyoxylsyra, som alltid finns i ättiksyra som en förorening.
Samma reaktion på tryptofan kan utföras med användning av formaldehyd istället för ättiksyra, en 2,5% lösning av koncentrerad H 2 SO 4. Rör om lösningen och efter 2-3 minuter. tillsätt 10 droppar 5% natriumnitrit under omskakning. En intensiv violett färg utvecklas, detta är grunden principen för metoden reaktioner.
Ordningen på arbetet.
Häll några droppar outspätt protein i ett provrör och tillsätt 2 ml. isättika och några droppar glyoxylsyra. Blandningen värms upp något tills fällningen som bildas löser sig, svalnar och, genom att luta provröret kraftigt, hälls koncentrerad H 2 SO 4 försiktigt längs väggen så att de två vätskorna inte blandas.
Efter 5-10 minuter observeras bildandet av en rödviolett ring vid gränsytan mellan de två skikten.
Experiment 5. Ninhydrinreaktion.
Metodens princip. a-aminosyror reagerar med ninhydrin och bildar ett blåviolett komplex (Ruemann lila), vars färgintensitet är proportionell mot mängden aminosyra. Reaktionen fortskrider enligt följande schema:

Reaktionskemi :


Reaktionen med ninhydrin används för visuell detektering av a-aminosyror i kromatogram (på papper, i ett tunt lager), samt för kolorimetrisk bestämning av koncentrationen av aminosyror baserat på färgintensiteten hos reaktionsprodukten.
Produkten av denna reaktion innehåller radikalen (R) av den ursprungliga aminosyran, vilket orsakar olika färger: blått, rött, etc. föreningar som härrör från reaktionen mellan aminosyror och ninhydrin.
För närvarande används ninhydrinreaktionen i stor utsträckning både för upptäckten av individuella aminosyror och för att bestämma deras kvantitet.
Ordningen på arbetet.
1 ml av en 1-10% utspädd lösning av kycklingäggvita och 1-2 ml av en 1% lösning av ninhydrin i aceton hälls i ett provrör. Innehållet i provröret blandas och värms försiktigt i ett vattenbad i 2-3 minuter tills en blåviolett färg visas, vilket indikerar närvaron av protein α -aminosyror.
Experimentets design: dra en slutsats och skriv reaktionsekvationen.
Experiment 6. Sakaguchi-reaktion.
Metodens princip. Denna reaktion på aminosyran arginin är baserad på interaktionen mellan arginin och a-naftol i närvaro av ett oxidationsmedel. Dess mekanism har ännu inte helt klarlagts. Uppenbarligen utförs reaktionen enligt följande ekvation:

Eftersom derivat av kinoniminer (i detta fall naftokinon), i vilka vätet i iminogruppen –NH– är ersatt med en alkyl- eller arylradikal, alltid färgas gul-röd, är uppenbarligen den orange-röda färgen av lösningen under Sakaguchi-reaktionen förklaras av uppkomsten av naftokinoneiminderivat. Möjligheten för bildandet av en ännu mer komplex förening på grund av ytterligare oxidation av de återstående NH-grupperna i argininresten och bensenringen av a-naftol kan dock inte uteslutas:
Ordningen på arbetet.
Till 2 ml. Tillsätt 2 ml av en 1% utspädd lösning av kycklingäggvita. 10 % natriumhydroxid (NaOH) och några droppar 0,2 % alkohollösning α -naftol. Innehållet i provröret blandas väl. Tillsätt sedan 0,5 ml. natriumhypobromit (NaBrO) eller natriumhypoklorit (natriumhypoklorit - NaOCl), blanda. En röd färg visas omedelbart, som gradvis intensifieras.
Tillsätt omedelbart 1 ml 40 % urealösning för att stabilisera den snabbt växande orange-röda färgen.
Denna reaktion är typisk för föreningar som innehåller en guanidinrest
NH = C –NH2,
och indikerar närvaron av aminosyran arginin i proteinmolekylen:
NH = C –NH – (CH 2) 3 –CH –COOH
Experimentets design: dra en slutsats och skriv reaktionsekvationen.
proteiner som ... byggs upp.
I strukturen av ett protein finns det... strukturer.
Funktioner av proteiner i kroppen...
Proteiner; a-aminosyrarester.
S, N, O, N, S.
Tio tusen, miljoner.
Vatten, lösningar av salter, syror; alkalier.
Vävnader från levande organismer: hud, senor, muskler, naglar, hår.
Primär, sekundär, tertiär, kvartär.
Konstruktion, katalytisk, framdrivning, transport, skydd, energi.
Kriterier för utvärdering:
"5" - alla svar är korrekta; "3" - 3 felaktiga svar;
"4" - 1-2 felaktiga svar; "2" - 4 eller fler felaktiga svar.
Grundläggande sammanfattning:
Proteiner är komplexa högmolekylära naturliga föreningar byggda av α - aminosyrarester sammankopplade med peptid (amid) bindningar - CO - NH -.
Antalet aminosyrarester som ingår i proteinmolekyler är olika: insulin - 51, myoglobin - 140. Mr (protein) = från 10 000 till flera miljoner.
Mr (äggvita) = 36 000; Mr (muskelprotein) = 1 500 000.
Hemoglobin (C738H1166O208N203S2Fe) 4.
Proteinstrukturer.
Primär- sekvens av alternering av aminosyrarester (alla bindningar är kovalenta, starka).
Sekundär- formen på polypeptidkedjan i rymden (oftast en spiral). Proteinkedjan vrids till en spiral (på grund av många vätebindningar). Tertiär- den verkliga tredimensionella konfigurationen som en vriden helix tar i rymden (på grund av hydrofoba bindningar), vissa har S - S - bindningar (bisulfidbindningar).
Kvartär- proteinmakromolekyler kopplade till varandra.
Kemiska egenskaper
1) hydrolys(vid upphettning med lösningar av syror, alkalier, under inverkan av enzymer)
H2N - CH2 - C -: N - CH - C -: N - CH - C = O → H2N - CH2 - C = O +
H2O CH2 H2O CH2 OH OH
| | glycin
tripeptid
H2N – CH – C = O + H2N – CH – C = O
serincystein
Proteinhydrolys reduceras till hydrolys av polypeptidbindningar. Matsmältningen av proteiner kommer också ner till detta:
protein ↔ aminosyror → blod in i alla kroppens celler och vävnader.
2) denaturering - kränkning av naturliga proteinstruktur(under påverkan av värme och kemiska reagenser)
3) amfotericitet:
Syrors egenskaper
|__________ egenskaper hos baser
4) proteinfärgreaktioner- kvalitativa reaktioner
a) xantoproteinreaktion.
Protein + HNO3 konc. → gul färg
b) biuretreaktion.
Protein + Cu (OH) 2 ↓ → lila lösning.
c) förbränning- lukten av brända fjädrar.
Slutsats: kvalitativa reaktioner för proteiner är reaktioner med koncentrerad salpetersyra (gul färg), med nyutfälld koppar(II)hydroxid (lila lösning) och förbränning av proteiner (lukt av brända fjädrar).
Proteinernas roll i cellen.
1. Byggnadsmaterial - bildandet av cellens skal, organeller och membran. Blodkärl, senor och hår byggs upp.
2. Katalytisk roll - alla cellulära katalysatorer är proteiner.
3. Motorisk funktion - kontraktila proteiner orsakar alla rörelser.
4. Transportfunktion - blodproteinet hemoglobin fäster syre och distribuerar det till alla vävnader.
5. Skyddande roll - produktionen av proteinkroppar av antikroppar för att neutralisera främmande ämnen.
6. Energiroll: 1 g protein → 17,6 kJ.
Riktlinjer för lärare
2. Frågor om kemi som förberedelse inför seminariet ska ges till studenterna senast två veckor före lektionen.
4. Kemiläraren ger motivation till lektionen, överväger proteiners sammansättning och egenskaper. En biologilärare generaliserar och uppdaterar kunskap om proteinmolekylers struktur, deras funktioner och tillämpningar.
5. I slutet av lektionen utvärderar lärare elevernas arbete i den här lektionen. Utrustning: kodfilmer, overheadprojektor, duk, overheadprojektor, diabilder, kemikalier, demonstrationsbord, bord.
Lektionsplan (skriven på tavlan)
1. Proteinets sammansättning och struktur.
2. Proteinegenskaper (denaturering, renaturering, hydrolys, färgreaktioner).
3. Funktioner av protein och dess syntes i cellen.
4. Applicering av protein, artificiell syntes av peptider.
Kemilärare. Idag genomför vi en ovanlig lektion - den täcker problemen med kemi och biologi på samma gång. Syftet med vår lektion är att systematisera och fördjupa kunskapen om ämnet "Protein". Vi ägnar särskild uppmärksamhet åt studiet av proteiner, eftersom proteiner är de viktigaste integrerad del av allt liv på jorden. Kom ihåg F. Engels uttalande om vad liv är: "Varhelst vi möter livet, finner vi att det är förknippat med någon form av proteinkropp, och varhelst vi hittar någon proteinkropp som inte är i sönderfallsprocess, vi, utan undantag , möta livets fenomen. Livet är ett sätt att existera för proteinkroppar." Inget ämne utför så specifika och olika funktioner i kroppen som protein.
Låt oss komma ihåg vilka föreningar som kallas proteiner. ( Naturliga polymerer vars monomerer är aminosyror.)
Studiet av vilken process hjälpte till att fastställa strukturen av proteiner? ( Studie av proteinhydrolys.)
Vilken process kallas hydrolys?
Vilka föreningar bildas vid hydrolys av proteiner?
Vilka föreningar kallas aminosyror?
Hur många aminosyror är kända i naturen?
Hur många aminosyror finns i proteiner?
En kemilärare demonstrerar en kodfilm.

Kemilärare. Var uppmärksam på aminogruppens position i aminosyror. I enlighet med aminogruppens position kallas aminosyrorna som utgör proteiner a-aminosyror. Den allmänna formeln för någon av dessa aminosyror kan skrivas enligt följande:
På kodfilmen ser du två aminosyror, varav den ena innehåller två karboxylgrupper – COOH, den andra – två aminogrupper – NH2. Sådana syror kallas aminodikarboxyl- respektive diaminokarboxylsyror.
Från din kemikurs känner du till optiska isomerer av naturliga föreningar. Nästan alla proteiner innehåller bara L-aminosyror.
Aminosyror är monomerer av proteiner. De kan ansluta till varandra genom en amid (peptid) bindning, som bildas vid frisättning av vatten - detta är en kondensationsreaktion.
Låt oss skapa en ekvation för reaktionen mellan aminosyrorna glycin och alanin.
(Eleverna arbetar självständigt och jämför sedan sina resultat med skriften på tavlan eller bandet.)
Den resulterande strukturen kallas en dipeptid. En polymer av många aminosyror kallas en polypeptid.
Biologilärare. Låt oss fortsätta att studera egenskaperna hos proteiner, men först ska vi svara på följande frågor.
1. Hur kan vi förklara mångfalden av proteiner som finns i naturen? ( Skillnader i sammansättningen av aminosyror och deras olika sekvens i polypeptidkedjan.)
2. Vilka är organiseringsnivåerna för en proteinmolekyl? ( Primär – aminosyrasekvens; sekundär – a -spiral eller b - vikt struktur av kedjesektioner; tertiär - proteinets rumsliga struktur, bildad på grund av interaktionen av aminosyrarester i avlägsna delar av kedjan: en kula för globulära proteiner, en filamentös struktur för fibrillära proteiner; kvartär - föreningen av två eller flera separata proteinmolekyler.)
3. Vilken typ av bindning uppstår mellan aminosyror i primärstrukturen? Vad är ett annat namn för denna koppling? ( Kovalent bindning. Amid- eller peptidbindning.)
4. Vilka bindningar ger främst den sekundära strukturen hos en proteinmolekyl? ( Vätebindningar, disulfhydrylbryggor.)
5. Vilka kopplingar ger tertiär struktur? ( Vätebindningar, hydrofoba och joniska interaktioner.)
6. Vilka bindningar ger en proteinmolekyls kvartära struktur? ( Elektrostatiska, hydrofoba och joniska interaktioner.)
7. Ge ett exempel på ett protein som du känner till och som har en kvartär struktur. ( ATPas, hemoglobin.)
Låt oss nu lösa följande problem ( uppgiftens tillstånd projiceras genom en overheadprojektor, en bild visas med blodutstryk från en frisk person och en patient med sicklecellanemi).
Sjukdomen sicklecellanemi åtföljs av att aminosyraresten glutaminsyra i hemoglobinmolekylens polypeptidkedja ersätts med en valinrest. Fragment av kedjan av normalt hemoglobin: - glu–glu–Liz–. Fragment av en onormal hemoglobinkedja: - axel–glu–Liz–
(glu– glutaminsyra; Liz– lysin; axel– valin). Rita dessa fragment som kemiska formler.
Lösning.
Fragment av en kedja av normalt hemoglobin:
Fragment av en onormal hemoglobinkedja:
Av exemplet ovan följer att den primära strukturen hos en proteinmolekyl kan bestämma alla dess efterföljande organisationsnivåer. Förändringar i den strukturella organisationen av ett protein kan störa dess funktioner, vilket i vissa fall leder till utvecklingen av patologi - sjukdom.
Strukturen av ett protein bestämmer dess fysikalisk-kemiska egenskaper, såsom löslighet.
En kemilärare demonstrerar en kodfilm.
Klassificering av proteiner efter deras löslighet

Kemilärare. För att behålla sin funktionella aktivitet måste proteiner ha en naturlig (native) strukturell organisation på alla nivåer.
Störningar i den primära organisationen, som leder till att amidbindningen brister med tillsats av en vattenmolekyl, kallas proteinhydrolys. Med fullständig hydrolys bryts proteinet ner till sina ingående aminosyror.
Brott mot sekundära och tertiära strukturer s protein, dvs. förlusten av dess naturliga struktur kallas proteindenaturering.
Proteindenaturering orsakas av olika faktorer: betydande förändringar i temperatur, ökande och sänkande pH i miljön, exponering för tungmetalljoner, vissa kemiska föreningar till exempel fenoler.
En kemilärare demonstrerar experiment.
Erfarenhet 1. Protein + värme -->
Erfarenhet 2. Protein + fenol --> denaturering (utfällning).
Erfarenhet 3. Protein + Pb eller CH 3 COOH --> denaturering (utfällning).
Erfarenhet 4. Protein + CuSO4 --> denaturering (utfällning).
Biologilärare. Denaturering uppstår som ett resultat av förstörelsen av väte och disulfid kovalenta bindningar(men inte peptidbindningar, joniska och hydrofoba interaktioner), som säkerställer bildandet och underhållet av proteinets sekundära och tertiära strukturer. I detta fall förlorar proteinet sina inneboende biologiska egenskaper.
Reaktioner som används för att bestämma sammansättningen av ett ämne kallas kvalitativa.
Vilka reaktioner är kvalitativa på protein?
En kemilärare demonstrerar följande experiment.
Erfarenhet 1. Xantoproteinreaktion (nitrering av bensenringar av aromatiska aminosyror av protein):
protein (kylt) + HNO 3 (konc.) + värme --> gul färg
Erfarenhet 2. Biuretreaktion (låter dig bestämma antalet peptidbindningar):
protein + CuSO 4
+ NaOH --> violett färg (urea ger denna reaktion);
CuSO 4
+ NaOH --> Cu(OH) 2
+Na 2
SÅ 4
;
protein + Cu(OH) 2
--> violett färg.
Är det möjligt att känna igen glycerol, protein och glukos med ett reagens? Burk! Detta reagens är kopparhydroxid, det ger olika färger till lösningar av dessa ämnen:
a) glycerol + Cu(OH) 2
--> ljusblå lösning;
b) glukos + Cu(OH) 2
+ uppvärmning --> röd fällning;
c) protein + Cu(OH) 2
--> violett färg.
Biologilärare. Nämn funktionerna hos polypeptider som du känner till. ( Konstruktion Polypeptider är en del av cellväggarna hos svampar och mikroorganismer och är involverade i konstruktionen av membran. Hår, naglar och klor är gjorda av keratinprotein. Kollagenprotein är grunden för senor och ligament. En annan viktig funktion hos protein är enzymatisk, katalytisk.
Proteiner ger också alla typer av biologisk rörlighet. Dessutom utför proteiner transport-, hormonella eller reglerande, receptor-, hemostatiska, toxigena, skyddande och energifunktioner.)
Definiera enzymer. ( Enzymer är proteiner som har katalytisk aktivitet, dvs. accelererande reaktioner.)
Alla enzymer är mycket specifika för sitt substrat och katalyserar som regel bara en mycket specifik reaktion. Titta på den schematiska representationen av ett enzyms struktur. ( En biologilärare visar en kodfilm med en schematisk representation av ett enzym.) Varje enzym har ett aktivt ställe där den kemiska omvandlingen av reaktionssubstratet sker. Ibland kan det finnas flera substratbindningsställen. Strukturen av bindningsstället är komplementär till strukturen av substratet, dvs. de passar ihop "som en nyckel passar ett lås."
Enzymens arbete påverkas av många faktorer: pH, temperatur, mediets jonsammansättning, närvaron av små organiska molekyler, som binder till enzymet eller är en del av dess struktur och annars kallas kofaktorer (koenzymer). Vissa vitaminer, såsom pyridoxin (B 6
) och kobalamin (B 12
).
Biologilärare introducerar eleverna till praktisk applikation enzymer.
Enzymers kliniska betydelse
1. Sjukdomar orsakade av enzymbrist är allmänt kända. Exempel: osmältbarhet av mjölk (inget laktasenzym); hypovitaminos (vitaminbrist) – bristen på koenzymer minskar enzymaktiviteten (hypovitaminos av vitamin B1 leder till beriberi-sjukdom); fenylketonuri (orsakad av en kränkning av den enzymatiska omvandlingen av aminosyran fenylalanin till tyrosin).
2. Bestämning av enzymaktivitet i biologiska vätskor har stor betydelse för att diagnostisera sjukdomar. Till exempel bestäms viral hepatit av aktiviteten hos enzymer i blodplasman.
3. Enzymer används som reagens vid diagnos av vissa sjukdomar.
4. Enzymer används för att behandla vissa sjukdomar. Exempel på några enzymbaserade läkemedel: pankreatin, festal, lidas.
Användning av enzymer inom industrin
1. Inom livsmedelsindustrin används enzymer vid beredning av läsk, ostar, konserver, korvar och rökt kött.
2. Inom djurhållningen används enzymer vid beredning av foder.
3. Enzymer används vid framställning av fotografiskt material.
4. Enzymer används vid bearbetning av lin och hampa.
5. Enzymer används för att mjuka upp läder inom läderindustrin.
6. Enzymer är en del av tvättpulver.
Biologilärare. Låt oss titta på andra funktioner hos proteiner. Motoriska funktioner utförs av speciella kontraktila proteiner, som inkluderar till exempel aktin och myosin, som ingår i muskelfibrer.
En annan viktig funktion hos proteiner är transport. Proteiner bär till exempel kaliumjoner, aminosyror, sockerarter och andra föreningar över cellmembranet in i cellen. Proteiner är också interstitiell bärare.
Genom att reglera ämnesomsättningen inom celler och mellan celler och vävnader i hela kroppen, utför proteiner en hormonell eller reglerande funktion. Till exempel är hormonet insulin involverat i regleringen av både protein- och fettomsättningen.
På ytan av cellmembran finns proteinreceptorer som selektivt binder hormoner och mediatorer och därigenom utför en receptorfunktion.
Proteiners homeostatiska funktion är att bilda en propp när man stoppar blödningen.
Vissa proteiner och peptider som frigörs av organismer, såsom patogener eller några giftiga djur, är giftiga för andra levande organismer - detta är den toxikogena funktionen hos proteiner.
Proteiners skyddande funktion är mycket viktig. Antikroppar är proteiner som produceras av kroppens immunsystem när det invaderas av ett främmande protein, bakterier eller virus. De identifierar "främlingen" och deltar i hans förstörelse.
Proteiner som fungerar som energireserv inkluderar till exempel kasein, det huvudsakliga proteinet i mjölk.
Svara på följande frågor.
2. Vad orsakar avstötning av transplanterade organ och vävnader hos patienter? ( Antikroppar, som utför en skyddande funktion, känner igen det främmande proteinet i de transplanterade organen och orsakar reaktioner på dess avstötning.)
3. Varför producerar kokta ägg aldrig en kyckling? ( Äggvita har irreversibelt förlorat sin naturliga struktur på grund av värmedenaturering.)
4. Varför minskar vikten av kött och fisk efter tillagning? ( Under värmebehandling sker denaturering av kött- eller fiskproteiner. Proteiner blir praktiskt taget olösliga i vatten och ger upp en betydande del av vattnet de innehåller, medan köttets vikt minskar med 20–40 %.)
5. Vad indikerar bildningen av "flingor" eller grumlighet i buljongen vid tillagning av kött? ( Om kött nedsänks i kallt vatten och värms upp, överförs lösliga proteiner från köttets yttre lager till vattnet. Under tillagning denatureras de, vilket resulterar i att det bildas flingor, skum som flyter till vattenytan eller en fin suspension som gör lösningen grumlig.)
Alla proteinmolekyler har en begränsad livslängd – de bryts ner med tiden. Därför förnyas proteiner ständigt i kroppen. Låt oss i detta avseende komma ihåg grunderna för proteinbiosyntes. Svara på följande frågor.
1. Var sker proteinsyntesen i cellen? ( På ribosomer.)
2. I vad cellulär organell information om proteinets primära struktur lagras. ( I kromosomerna är informationsbäraren DNA.)
3. Vad menas med termen "gen"? ( Nukleotidsekvens som kodar för syntesen av ett protein.)
4. Vad kallas huvudstadierna av proteinbiosyntes? ( Transkription, sändning.)
5. Vad består transkription av? ( Detta är att läsa information från DNA genom att syntetisera budbärar-RNA som är komplementär till den DNA-region som läses.)
6. I vilken del av cellen sker transkription? ( I kärnan.)
7. Vad består sändningen av? ( Detta är syntesen av protein från aminosyror i sekvensen registrerad i mRNA; det sker med deltagande av transport-tRNA som levererar motsvarande aminosyror till ribosomen.)
8. I vilken del av cellen sker translation? ( I cytosolen, på ribosomer, i mitokondrier.)
Proteinbiosyntes sker i kroppen under hela livet, mest intensivt i barndomen. Intensiteten av proteinsyntesen kan i vissa fall justeras. Verkan av många antibiotika är baserad på undertryckande av proteinsyntes, inklusive i bakterier som orsakar sjukdomen. Till exempel förhindrar antibiotikumet tetracyklin tRNA från att binda till ribosomer.
Låt oss höra korta meddelanden om proteinpreparat som används inom modern medicin.
Antihistaminer
Det moderna hektiska livets tempo åtföljs av en ökning av antalet sjukdomar, såsom hjärtinfarkt, högt blodtryck, fetma och alla typer av allergier. Allergi är kroppens överdrivna känslighet för specifika yttre irriterande ämnen. Alla dessa sjukdomar kännetecknas av ökade nivåer av histamin i blodet. Histaminer är ämnen som bildas genom dekarboxylering av aminosyran histidin. Antihistaminer stör denna reaktion och histaminnivåerna minskar.
Interferon
I evolutionsprocessen, i kampen mot virus, har djur utvecklat en mekanism för syntesen av det skyddande proteinet interferon. Programmet för bildandet av interferon, som vilket protein som helst, kodas i DNA i cellkärnan och slås på efter att cellerna har infekterats med ett virus. Nedkylning, nervchock och brist på vitaminer i mat leder till en minskning av förmågan att producera interferon. För närvarande görs interferonpreparat för medicinska ändamål från leukocyter av donatorblod eller med hjälp av genteknik. Interferon används för att förebygga och behandla virusinfektioner - influensa, herpes, såväl som för maligna neoplasmer.
Insulin
Insulin är ett protein som består av 51 aminosyror. Det frisätts som svar på ökade blodsockernivåer. Insulin styr kolhydratmetabolismen och orsakar följande effekter:
– öka omvandlingshastigheten av glukos till glykogen;
– acceleration av glukosöverföring genom cellmembran i muskler och fettvävnad;
– ökad protein- och lipidsyntes;
– hastighetsökning ATP-syntes DNA och RNA.
Insulin är nödvändigt för livet, eftersom det är det enda hormonet som minskar koncentrationen av glukos i blodet. Otillräcklig utsöndring av insulin leder till en metabolisk störning som kallas diabetes mellitus. Insulinberedningar erhålls från bukspottkörteln hos nötkreatur eller genom genteknik.
Kemilärare. Insulin var det första proteinet vars primära struktur dechiffrerades. Det tog nästan 10 år att fastställa sekvensen av aminosyror i insulin. För närvarande har den primära strukturen för ett mycket stort antal proteiner, inklusive de med en mycket mer komplex struktur, dechiffrerats.
Syntesen av proteinämnen utfördes först med exemplet med två hypofyshormoner (vasopressin och oxytocin).
Slutligen ger lärare eleverna betyg för deras arbete i kemi- och biologiklassen.
Laboratoriearbete 15 "Ekorrar"
Aminosyror kallas kvävehaltiga organiska föreningar, vars molekyler innehåller aminogrupper och karboxylgrupper.
Beroende på den relativa positionen för karboxyl- och aminogrupperna skiljer de -, b-, g-, etc. aminosyror. Till exempel,
Oftast används termen "aminosyra" för att hänvisa till karboxylsyror vars aminogrupp är i -positionen, dvs. för - aminosyror. Allmän formel- Aminosyror kan representeras enligt följande:
Beroende på radikalens (R) natur delas aminosyror in i alifatiska, aromatiska och heterocykliska.
Aminosyror reagerar med varandra genom en polykondensationsreaktion, vilket leder till sura amider. Produkterna av sådan kondensation kallas peptider. När två aminosyror interagerar bildas en dipeptid:
Den framväxande gruppen -CO-NH- ringde peptidbindning.
När en dipeptid interagerar med en ny aminosyramolekyl erhålls en tripeptid osv.
Exempel på de enklaste aminosyrorna
Ekorrar - dessa innehåller kväve högmolekylära organiska ämnen med en komplex sammansättning och molekylstruktur. De är naturliga polymerer (komplexa polypeptider), vars molekyler är uppbyggda av aminosyrarester kopplade till varandra genom en amid (peptid) bindning.
Dessa är naturliga polypeptider med höga värden molekylvikt (från 5-10 tusen till 1 miljon eller mer). De är en del av celler och vävnader i alla levande organismer och är huvudkomponenten i vår mat.
Proteiner innehåller kol, väte, syre och kväve. I mycket mindre mängder kan deras sammansättning även innehålla svavel, fosfor och andra element. Proteiner är mycket instabila föreningar, vilket gör det svårt att studera deras fysiska och kemiska egenskaper. Slutprodukter proteinnedbrytning är
b-aminosyror. Molekylär massa det finns väldigt många av dem.
Alla livsprocesser är förknippade med proteiner. De fungerar som näringsämnen, reglerar ämnesomsättningen, spelar rollen som enzymer - metaboliska katalysatorer, främjar överföringen av syre i hela kroppen och dess absorption, spelar viktig roll i att fungera nervsystem, är den mekaniska grunden för muskelkontraktion, deltar i överföringen genetisk information etc.
Experiment 1. Proteinkoagulering vid upphettning.
Proteinveckning, d.v.s. denaturering - processen med att ett protein förlorar sin naturliga (naturliga) konformation, vanligtvis åtföljd av förlusten av dess biologiska funktion. Under denaturering under påverkan av yttre faktorer (temperatur, mekanisk stress, verkan av kemiska reagens och ett antal andra faktorer) förstörs de sekundära, tertiära och kvartära strukturerna hos proteinmakromolekylen. Primär struktur, och följaktligen, kemisk sammansättning proteiner förändras inte. håller på att förändras fysikaliska egenskaper: löslighet, hydreringsförmågan minskar, biologisk aktivitet går förlorad. Formen på proteinmakromolekylen förändras och förstoring sker.
För att arbeta, använd kycklingäggvita löst i vatten (en äggvita per 150 ml vatten).
Beskrivning av upplevelsen. Värm en liten mängd proteinlösning på en brännare tills det kokar. Grumlighet i vätskan observeras. Den resulterande fällningen löser sig inte vare sig vid kylning eller vid utspädning med vatten, dvs. reaktionen är irreversibel.
Experiment 2. Xantoproteinreaktion
Xantoproteinreaktionen indikerar närvaron av aromatiska aminosyrarester (fenylalanin, tyrosin, tryptofan) i proteiner. När de utsätts för koncentrerad salpetersyra sker nitreringsreaktionen av aromatiska kärnor med bildning av gulfärgade nitroföreningar. När de utsätts för ammoniak, isomeriserar nitroföreningar för att bilda intensivt färgade saltliknande produkter.
Beskrivning av upplevelsen. Tillsätt 5-6 droppar koncentrerad HNO3 till 1 ml proteinlösning tills en vit fällning uppträder (eller grumlighet från proteinet som koagulerat under påverkan av syra). Vid upphettning blir lösningen och fällningen ljusgul (fällningen kommer nästan helt att hydrolysera och lösas upp).
Kyl blandningen, tillsätt (försiktigt, utan att skaka) överskott av koncentrerad vattenhaltig ammoniak (eller kaustikalkali) droppe för droppe tills en alkalisk reaktion inträffar. Den sura albuminatfällningen som faller ut först kommer att lösas upp och vätskan blir ljust orange.
Biuretreaktionen indikerar närvaron av upprepade peptidgrupper -CO-NH- i proteinet. Detta bekräftas av det faktum att proteiner ger en violett färg när de utsätts för litet antal lösning av kopparsulfat i närvaro av alkali. Färgen beror på bildandet av kopparkomplex.
Experiment 3. Biuretreaktion
Beskrivning av upplevelsen. Häll 1 ml äggvitelösning, 1 ml natriumhydroxidlösning och 1-2 droppar koppar(II)sulfatlösning i ett provrör. Vätskan blir rödviolett (om proteinhalten är låg, tillsätt försiktigt 0,5-1 ml CuSO4-lösning till lösningen i alkali; färgen kommer att synas vid gränsen för skikten). Reaktionsekvation:
CuSO4 + 2NaOH > Na2SO4 + Cu(OH)2v
2R - CH - COOH + Cu(OH)2 > (R-CH-COO)2Cu + 2H2O
Experiment 4. Utfällning av protein med tungmetallsalter
Beskrivning av upplevelsen. Ta två provrör och lägg 1 ml äggvitelösning i dem och tillsätt långsamt, under omskakning, droppe för droppe en mättad lösning av koppar(II)sulfat i det ena provröret och en 20 % lösning av blyacetat till det andra. . Utfällningar av svårlösliga saltliknande proteinföreningar bildas. Erfarenheten illustrerar användningen av protein som motgift mot förgiftning med tungmetallsalter. Reaktionsekvationer:
- 2R - CH - COOH + CuSO4 > (R- CH-COO)2Cu + H2SO4
- 2R-CH-COOH + (CH3COO)2Pb> (R-CH-COO)2Pb + CH3COOH
Experiment 4. Upptäckt av svavel i proteiner
Beskrivning av upplevelsen. Cirka 0,5 ml av en lösning av blyacetat hälls i ett provrör och en lösning av kaliumhydroxid tillsätts tills den resulterande fällningen av blyhydroxid löser sig. Cirka 2-3 ml proteinlösning hälls i ett annat provrör och samma volym av den resulterande plumbitlösningen tillsätts. Värm blandningen till koka i 2-3 minuter. Utseendet av mörk färg indikerar bildandet av blysulfit. Skriv reaktionsekvationerna.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0