DEFINITION
Nickelär det tjugoåttonde elementet i det periodiska systemet. Beteckning - Ni från latinets "niccolum". Beläget i den fjärde perioden, VIIIB-gruppen. Avser metaller. Kärnladdningen är 28.
Liksom kobolt förekommer nickel i naturen huvudsakligen i form av föreningar med arsenik eller svavel; sådana är till exempel mineralen kupfernickel NiAs, arsenik-nickel-glansen NiAsS, etc. Nickel är vanligare än kobolt [cirka 0,01 % (massa) av jordskorpan].
Metalliskt nickel har en silverfärgad färg med en gulaktig nyans (Fig. 1), är mycket hårt, polerar väl och attraheras av en magnet. Den kännetecknas av hög korrosionsbeständighet - stabil i atmosfären, i vatten, i alkalier och ett antal syror. Det löses aktivt i salpetersyra. Den kemiska resistensen hos nickel beror på dess tendens till passivering - på bildandet av oxidfilmer på ytan, som har en stark skyddande effekt.
Ris. 1. Nickel. Utseende.
Atom- och molekylvikt för nickel
DEFINITION
Relativ molekylvikt för ett ämne (M r)är ett tal som visar hur många gånger massan av en given molekyl är större än 1/12 av massan av en kolatom, och relativ atommassa för ett grundämne (A r)- hur många gånger den genomsnittliga massan av atomer i ett kemiskt element är större än 1/12 av massan av en kolatom.
Eftersom nickel finns i det fria tillståndet i form av monoatomiska Ni-molekyler, sammanfaller värdena för dess atom- och molekylmassa. De är lika med 58,6934.
Nickelisotoper
Det är känt att nickel kan förekomma i naturen i form av fem stabila isotoper 58Ni, 60Ni, 61Ni, 62Ni och 64Ni. Deras massnummer är 58, 60, 61, 62 respektive 64. Kärnan i nickelisotopen 58 Ni innehåller tjugoåtta protoner och trettio neutroner, och de återstående isotoperna skiljer sig från den endast i antalet neutroner.
Det finns konstgjorda instabila nickelisotoper med masstal från 48 till 78, såväl som åtta metastabila tillstånd, bland vilka 59 Ni-isotopen med en halveringstid på 76 tusen år är den längsta livslängden.
Nickeljoner
Den elektroniska formeln som visar orbitalfördelningen av nickelelektroner är följande:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 .
Som ett resultat av kemisk interaktion ger nickel upp sina valenselektroner, d.v.s. är deras donator och förvandlas till en positivt laddad jon:
Nio-2e → Ni2+;
Nio-3e → Ni3+.
Molekyl och nickelatom
I det fria tillståndet finns nickel i form av monoatomiska Ni-molekyler. Här är några egenskaper som kännetecknar nickelatomen och molekylen:
Nickellegeringar
Huvuddelen av nickel används för att tillverka olika legeringar med järn, koppar, zink och andra metaller. Tillsatsen av nickel till stål ökar dess seghet och motståndskraft mot korrosion.
Nickelbaserade legeringar kan delas in i värmebeständiga (nimonisk, inconel, hastella [över 60% nickel, 15-20% krom och andra metaller]), magnetiska (permalloy) och legeringar med speciella egenskaper (monelmetall, nickelin, konstantan) , invar, platina).
Exempel på problemlösning
EXEMPEL 1
| Övning | Skriv reaktionsekvationerna som kan användas för att utföra följande transformationer: NiCl2 → Ni → NiSO4 → Ni(NO3)2 → Ni(OH)2 → NiCl2. Rita ekvationerna för reaktioner som sker i lösningar i jonisk och förkortad jonform. |
| Svar | Genom att placera en nickel(II)kloridlösning som är mer aktiv än nickelmetall, är det möjligt att erhålla nickel i sin fria form (substitutionsreaktion): NiCl2 + Zn → Ni + ZnCl2; Ni2+ + Zno → Ni0 + Zn2+. Nickel löses i utspädd svavelsyra för att bilda nickel(II)sulfat: Ni + H2SO4 (utspädd) → NiSO4 + H2; Ni0 + 2H+ → Ni2+ + H2. Nickel (II) nitrat kan erhållas genom utbytesreaktionen: NiSO4 + Ba(NO3)2 → Ni(NO3)2 + BaSO4 ↓; SO 4 2- + Ba 2+ → BaSO 4 ↓. Genom att verka på nickel(II)nitrat med alkali kan nickel(II)hydroxid erhållas: Ni(NO3)2 + 2NaOH → Ni(OH)2 ↓+ 2NaNO3; Ni 2+ + 2OH - \u003d Ni (OH) 2 ↓. Nickel(II)klorid från nickel(II)hydroxid kan erhållas genom en neutralisationsreaktion med saltsyra: Ni(OH)2 + 2HCl → NiCl2 + 2H2O; OH - + H + \u003d H2O. |
EXEMPEL 2
| Övning | Vilken massa nickel(II)klorid kan erhållas genom att värma 17,7 g nickel och 12 liter klor (n.o.)? Vilken volym av 0,06 M lösning kan framställas av denna saltmassa? |
| Beslut | Låt oss skriva reaktionsekvationen: Ni + Cl 2 \u003d NiCl 2. Låt oss ta reda på antalet mol nickel (molmassa - 59 g / mol) och klor som har reagerat med hjälp av data som anges i problemets tillstånd: n(Ni) = m(Ni)/M(Ni); n (Ni) \u003d 17,7 / 59 \u003d 0,3 mol. n (Cl 2) \u003d V (Cl 2) / V m; n (Cl 2) \u003d 12 / 22,4 \u003d 0,54 mol. Enligt problemets ekvation n (Ni): n (Cl 2) = 1:1. Detta innebär att klor är i överskott och alla ytterligare beräkningar bör göras med nickel. Låt oss hitta mängden ämne och massan av den resulterande nickel(II)kloriden (molmassa 130 g / mol): n (Ni): n (NiCl2) = 1:1; n (Ni) \u003d n (NiCl 2) \u003d 0,3 mol. m (NiCl2)= n (NiCl2)xM (NiCl2); m (NiCl 2) \u003d 0,3 × 130 \u003d 39 g. Beräkna volymen av en 0,06M lösning som kan erhållas från 39 g nickel(II)klorid: V (NiCl2) \u003d n (NiCl2)/c (NiCl2); V (NiCl 2) \u003d 0,3 / 0,06 \u003d 0,5 l. |
| Svar | Massan av nickel(II)klorid är 39 g, volymen av en 0,06M lösning är 0,5 l (500 ml). |
på ämnet: Nickel och dess egenskaper
Arbetet har sammanställts av andraårsstudenter i grupp 5202
Nikitin Dmitry och Sharhemullin Emil.
Kazan 2013
Nickels fysikaliska egenskaper.
Elementet upptäcktes 1761. Nickel är ett grundämne i den tionde gruppen, den fjärde perioden av det periodiska systemet av kemiska grundämnen. I. Mendeleev, med atomnummer 28. Silvervit metall som inte mattas i luften. I sin rena form är den mycket plastig och kan bearbetas genom tryck. Det är en ferromagnet, d.v.s. när den leder ström genom den har den uttalade magnetiska egenskaper. Nickelatomer har en extern elektronisk konfiguration 3d 8 4s 2 . Det är en formbar och formbar metall, vilket gör det möjligt att tillverka de tunnaste plåtarna och rören av den.
Nickels kemiska egenskaper
Kemiskt liknar Ni Fe och Co, men också Cu och ädelmetaller. I föreningar uppvisar den variabel valens (oftast 2-valent). Nickel är en medelaktiv metall. Absorberar (särskilt i finfördelat tillstånd) stora mängder gaser
Nickel brinner endast i pulverform. I detta fall bildar den två oxider NiO och Ni2O3 och följaktligen två hydroxider Ni(OH)2 och Ni(OH)3. De viktigaste lösliga nickelsalterna är acetat, klorid, nitrat och sulfat. Vattenlösningar av salter är vanligtvis gröna och vattenfria salter är gula eller brungula. som ofta används inom analytisk kemi.
N:s mättnad med gaser försämrar dess mekaniska egenskaper. Interaktion med syre börjar vid 500 °C; i fint dispergerat tillstånd är N. pyrofor - den antänds spontant i luft. Av oxiderna är den viktigaste oxiden NiO - grönaktiga kristaller, praktiskt taget olösliga i vatten (mineralet bunsenit). Hydroxid fälls ut från lösningar av nickelsalter när alkalier tillsätts i form av en voluminös äppelgrön fällning. Vid upphettning kombineras H. med halogener och bildar NiX 2 . Förbränning i svavelånga ger en sulfid som i sammansättning liknar Ni 3 S 2 . Monosulfid NiS kan erhållas genom att värma NiO med svavel. N. reagerar inte med kväve även vid höga temperaturer (upp till 1400 ° C)
I flytande tillstånd löser N. en avsevärd mängd C, som vid avkylning utfaller i form av grafit. När grafit isoleras förlorar N. formbarhet och förmågan att bearbetas genom tryck.
Nickel är resistent mot vatten. Organiska syror verkar på N. först efter långvarig kontakt med den. Svavelsyra och saltsyror löser långsamt N.; utspädd salpetersyra - mycket lätt; koncentrerad HNO 3 passiverar N., men i mindre utsträckning än järn. Vid interaktion med syror bildas salter av 2-valent Ni. Nästan alla salter av Ni (II) och starka syror är mycket lösliga i vatten, deras lösningar är sura på grund av hydrolys.
Komplexa föreningar av nickel.
Bindningen av nickel till komplex är en viktig diagnostisk process för analytisk kemi.
Nickel kännetecknas av bildandet av komplex. Ni 2+-katjonen med ammoniak bildar således ett hexaaminkomplex 2+ och ett dikvatetraamminkomplex 2+. Dessa komplex med anjoner bildar blå eller violetta föreningar.
Olösliga salter inkluderar oxalat och fosfat (grön färg), tre sulfider: NiS (svart), Ni 3 S 2 (gulaktig-brons) och Ni 3 S 4 (silver-vit). Eller nickeldimetylglyoximat Ni (C 4 H 6 N 2 O 2) 2, som ger en klar röd färg i en sur miljö, som används i stor utsträckning i kvalitativ analys för detektering av nickel.
Vattenlösningar av nickel(II)salter innehåller hexaaquanickel(II)2+-jonen. När en ammoniaklösning tillsätts till en lösning som innehåller dessa joner fälls nickel(II)hydroxid, en grön gelatinös substans, ut. Denna fällning löses upp när en överskottsmängd ammoniak tillsätts på grund av bildningen av hexamminenickel(II) 2+-joner.
Nickel bildar komplex med tetraedriska och platta kvadratiska strukturer. Till exempel har tetrakloronickelat(II) 2−-komplexet en tetraedrisk struktur, medan tetracyanonickelat(II) 2−-komplexet har en plan kvadratisk struktur.
Reaktionen av Ni 2+-joner med dimetylglyoxim är karakteristisk, vilket leder till bildandet av rosa-rött nickel-dimetylglyoximat. Denna reaktion används vid kvantitativ bestämning av nickel, och reaktionsprodukten används som pigment i kosmetiska material och för andra ändamål.
Kvantifiering av elementet.
Det utförs huvudsakligen med följande metoder:
1) Nederbörd i form av nickeldimetoiglioximat, som redan nämnts.
2) utfällning i form av enickel-alfa-bensyldioxim.
3) Utfällning i form av nickelhydroxid (3) . Denna reaktion utförs med användning av kaustikkali och bromvatten.
4) Utfällning i form av sulfid. Där nickeloxid kommer att användas som viktform2.
5) Elektrolytisk metod
6) Volumetrisk metod - dvs titrering av kaliumcyanid till bildning av komplex cyanid (Kalium 2 nickel ce en fyra gånger)
7) En kolorimetrisk metod baserad på en förändring i färgen på hexaminnickeljonen, eller den röda färgen på en löslig komplex förening, som bildas genom reaktionen av nickeljoner 3 med dimetylglyoxim i en alkalisk lösning i närvaro av en oxiderande ombud.
8) Komplexometrisk metod.
GRAVIMETRISK METOD FÖR BESTÄMNING AV NICKEL Metoden bygger på utfällning av nickel i en ammoniaklösning med dimetylglyoxim som en svårlöslig interkomplex förening i närvaro av citron- eller vinsyra.
TITRIMETRISK METOD FÖR BESTÄMNING AV NICKEL
Metoden bygger på utfällning av nickel i en ammoniaklösning med dimetylglyoxim som en svårlöslig intrakomplex förening i närvaro av citron- eller vinsyra och bestämning av nickel genom komplexometrisk titrering med eriokromsvart T som indikator.
Historia
Nickel (engelsk, fransk och tysk nickel) upptäcktes 1751. Men långt innan dess var sachsiska gruvarbetare väl medvetna om malmen, som såg ut som kopparmalm och användes vid glastillverkning för att färga glas grönt. Alla försök att få koppar från denna malm misslyckades och därför i slutet av 1600-talet. Malmen fick namnet Kupfernickel, vilket betyder ungefär "koppardjävulen". Denna malm (röd nickelkis NiAs) studerades 1751 av den svenske mineralogen Kronstedt. Han lyckades få fram grön oxid och, genom att reducera den senare, en ny metall som kallas nickel. När Bergman fick metallen i renare form fann han att metallens egenskaper liknade järnets; Nickel har studerats mer i detalj av många kemister, till att börja med Proust. Nikkel är ett förbannelseord på gruvarbetarnas språk. Det bildades av den förvrängda Nicolaus, ett generiskt ord som hade flera betydelser. Men framför allt tjänade ordet Nicolaus till att karakterisera tvåsidiga människor; dessutom betydde det "en busig liten ande", "bedräglig loafer" etc. I rysk litteratur från tidigt 1800-tal. namnen nikolan (Scherer, 1808), nikolan (Zakharov, 1810), nikol och nickel (Dvigubsky, 1824) användes.
Fysikaliska egenskaper
Nickelmetall har en silverfärgad färg med en gulaktig nyans, är mycket hård, seg och formbar, polerar väl, attraheras av en magnet och visar magnetiska egenskaper vid temperaturer under 340 ° C.
Kemiska egenskaper
Nickeldiklorid (NiCl2)
Nickelatomer har en extern elektronisk konfiguration av 3d84s2. Oxidationstillståndet för Ni(II) är det mest stabila för nickel.
Nickel bildar föreningar med oxidationstillstånden +2 och +3. I detta fall är nickel med ett oxidationstillstånd på +3 endast i form av komplexa salter. För nickel +2-föreningar är ett stort antal vanliga och komplexa föreningar kända. Nickeloxid Ni2O3 är ett starkt oxidationsmedel.
Nickel kännetecknas av hög korrosionsbeständighet - det är stabilt i luft, i vatten, i alkalier, i ett antal syror. Kemisk resistens beror på dess tendens till passivering - bildandet av en tät oxidfilm på dess yta, vilket har en skyddande effekt. Nickel löses aktivt i salpetersyra.
Med kolmonoxid CO bildar nickel lätt en flyktig och mycket giftig karbonyl Ni(CO)4.
Finfördelat nickelpulver är pyrofor (självantänder i luft).
Nickel brinner endast i pulverform. Bildar två oxider NiO och Ni2O3 respektive två hydroxider Ni(OH)2 och Ni(OH)3. De viktigaste lösliga nickelsalterna är acetat, klorid, nitrat och sulfat. Lösningar är vanligtvis gröna, medan vattenfria salter är gula eller brungula. Olösliga salter inkluderar oxalat och fosfat (grönt), de tre sulfiderna NiS (svart), Ni2S3 (gulaktig brons) och Ni3S4 (svart). Nickel bildar också många koordinations- och komplexa föreningar. Till exempel används nickeldimetylglyoximat Ni(C4H6N2O2)2, som ger en klar röd färg i sura medier, i stor utsträckning i kvalitativ analys för att detektera nickel.
En vattenlösning av nickelsulfat i en burk är grön.
Vattenlösningar av nickel(II)salter innehåller hexaaquanickel(II)2+-jonen. När en ammoniaklösning tillsätts till en lösning som innehåller dessa joner fälls nickel(II)hydroxid, en grön gelatinös substans, ut. Denna fällning löses upp när en överskottsmängd ammoniak tillsätts på grund av bildningen av hexamminenickel(II) 2+-joner.
Nickel bildar komplex med tetraedriska och platta kvadratiska strukturer. Till exempel har tetrakloronickelat(II) 2−-komplexet en tetraedrisk struktur, medan tetracyanonickelat(II) 2−-komplexet har en plan kvadratisk struktur.
Den kvalitativa och kvantitativa analysen använder en alkalisk lösning av butandiondioxim, även känd som dimetylglyoxim, för att detektera nickel(II)joner. När det interagerar med nickel(II)joner bildas en röd koordinationsförening bis(butandiondioximato)nickel(II). Det är en kelatförening och butandiondioxymatliganden är tvåtandad.
Att vara i naturen
Nickel är ganska vanligt i naturen - dess innehåll i jordskorpan är ca. 0,01 % (massa). Det förekommer i jordskorpan endast i bunden form; järnmeteoriter innehåller naturligt nickel (upp till 8%). Dess innehåll i ultrabasiska bergarter är ungefär 200 gånger högre än i sura (1,2 kg/t och 8 g/t). I ultramafiska bergarter är den övervägande mängden nickel associerad med oliviner som innehåller 0,13–0,41 % Ni. Det ersätter järn och magnesium isomorft. En liten del av nickel finns i form av sulfider. Nickel uppvisar siderofila och kalkofila egenskaper. Med en ökad halt av svavel i magman uppstår nickelsulfider tillsammans med koppar, kobolt, järn och platinoider. I en hydrotermisk process, tillsammans med kobolt, arsenik och svavel, och ibland med vismut, uran och silver, bildar nickel förhöjda koncentrationer i form av nickelarsenider och sulfider. Nickel finns vanligtvis i sulfid- och arsenikhaltiga koppar-nickelmalmer.
* Nickel (röd nickelkis, kupfernickel) NiAs
* kloantit (vit nickelkis) (Ni, Co, Fe)As2
* garnierit (Mg, Ni)6(Si4O11)(OH)6*H2O och andra silikater
* magnetiska pyriter (Fe, Ni, Cu)S
* arsenik-nickel glans (gersdorfit) NiAsS,
* pentlandit (Fe,Ni)9S8
I växter, i genomsnitt 5 × 10 −5 viktprocent nickel, hos marina djur - 1,6 × 10 −4, hos landdjur - 1 × 10 −6, i människokroppen - 1 ... 2 × 10 −6 . Mycket är känt om nickel i organismer. Det har till exempel fastställts att dess innehåll i mänskligt blod förändras med åldern, att hos djur ökar mängden nickel i kroppen, och slutligen att det finns några växter och mikroorganismer - "koncentratorer" av nickel, som innehåller tusentals och till och med hundratusentals gånger mer nickel än miljö.
Avlagringar av nickelmalmer
De viktigaste fyndigheterna av nickelmalmer finns i Kanada, Ryssland, Nya Kaledonien, Filippinerna, Indonesien, Kina, Finland och Australien. Naturliga isotoper av nickel.
Naturligt nickel innehåller 5 stabila isotoper: 58Ni (68,27%), 60Ni (26,10%), 61Ni (1,13%), 62Ni (3,59%), 64Ni (0,91%).
Mottagande
De totala reserverna av nickel i malmer i början av 1998 uppskattas till 135 miljoner ton, inklusive tillförlitliga reserver på 49 miljoner ton.
De viktigaste malmerna av nickel - nickel (kupfernickel) NiAs, millerit NiS, pentlandit (FeNi)9S8 - innehåller också arsenik, järn och svavel; Inneslutningar av pentlandit förekommer också i magmatisk pyrrotit. Andra malmer som Ni också bryts ur innehåller Co-, Cu-, Fe- och Mg-föroreningar. Ibland är nickel huvudprodukten i raffineringsprocessen, men oftare erhålls det som en biprodukt i andra metallteknologier. Av de pålitliga reserverna, enligt olika källor, finns från 40 till 66% nickel i "oxiderade nickelmalmer" (ONR), 33% - i sulfid, 0,7% - i andra. Från och med 1997 var andelen nickel som producerades genom bearbetning av OHP cirka 40 % av världens produktion. Under industriella förhållanden delas OHP in i två typer: magnesia och järnhaltig.
Eldfasta magnesianska malmer utsätts som regel för elektrisk smältning för ferronickel (5-50% Ni + Co, beroende på råmaterialets sammansättning och tekniska egenskaper).
De mest järnhaltiga - lateritiska malmerna bearbetas med hydrometallurgiska metoder med användning av ammoniakkarbonatlakning eller svavelsyraautoklavlakning. Beroende på sammansättningen av råvarorna och de tillämpade tekniska systemen är slutprodukterna av dessa tekniker: nickeloxid (76-90% Ni), sinter (89% Ni), sulfidkoncentrat av olika sammansättningar, såväl som elektrolytisk metall nickel, nickelpulver och kobolt.
Mindre järnhaltiga - nontronitmalmer smälts till matta. På företag som arbetar på en hel cykel, inkluderar ett ytterligare bearbetningssystem konvertering, rostning av matten, elektrisk smältning av nickeloxid för att erhålla metalliskt nickel. Längs vägen framställs den extraherade kobolten i form av metall och/eller salter. En annan källa till nickel: i askan från kolen i södra Wales i England - upp till 78 kg nickel per ton. Det ökade innehållet av nickel i vissa kol, olja, skiffer indikerar möjligheten av nickelkoncentration av fossilt organiskt material. Orsakerna till detta fenomen har ännu inte klarlagts.
Huvuddelen av nickel erhålls från garnierit och magnetisk pyrit.
1. Silikatmalm reduceras med koldamm i roterande rörugnar till järn-nickelpellets (5-8 % Ni), som sedan renas från svavel, kalcineras och behandlas med en ammoniaklösning. Efter att lösningen surgjorts erhålls en metall elektrolytiskt från den.
2. Karbonylmetod (Mond-metoden). Först erhålls koppar-nickel-skärsten från sulfidmalm, över vilken CO leds under högt tryck. Lättflyktigt tetrakarbonylnickel bildas, vars termiska sönderdelning ger en särskilt ren metall.
3. Aluminiumtermisk metod för nickelutvinning från oxidmalm: 3NiO + 2Al = 3Ni + Al2O3
Ansökan
Legeringar
Nickel är basen i de flesta superlegeringar, högtemperaturmaterial som används inom flygindustrin för delar av kraftverk.
* Monelmetall (65 - 67% Ni + 30 - 32% Cu + 1% Mn), värmebeständig upp till 500 °C, mycket korrosionsbeständig;
* vitt guld (till exempel innehåller 585 prover 58,5 % guld och en legering (ligatur) av silver och nickel (eller palladium));
* nikrom, motståndslegering (60% Ni + 40% Cr);
* permalloy (76% Ni + 17% Fe + 5% Cu + 2% Cr), har en hög magnetisk känslighet med mycket låga hysteresförluster;
* Invar (65% Fe + 35% Ni), förlängs nästan inte vid upphettning;
* Dessutom inkluderar nickellegeringar nickel- och kromnickelstål, nickelsilver och olika motståndslegeringar som konstantan, nickelin och manganin.
nickelplätering
Nickelplätering är skapandet av en nickelbeläggning på ytan av en annan metall för att skydda den från korrosion. Den utförs genom elektroplätering med elektrolyter som innehåller nickel(II)sulfat, natriumklorid, borhydroxid, ytaktiva ämnen och glansiga ämnen samt lösliga nickelanoder. Tjockleken på det resulterande nickelskiktet är 12–36 µm. Ytglansstabilitet kan säkerställas genom efterföljande kromplätering (kromskikttjocklek 0,3 µm).
Strömlös nickelplätering utförs i en lösning av en blandning av nickel(II)klorid och natriumhypofosfit i närvaro av natriumcitrat:
NiCl2 + NaH2PO2 + H2O = Ni + NaH2PO3 + 2HCl
Processen utförs vid pH 4-6 och 95 °C.
Batteriproduktion
Tillverkning av järn-nickel, nickel-kadmium, nickel-zink, nickel-vätebatterier.
Strålningstekniker
De 63Ni-nuklidemitterande β+-partiklarna har en halveringstid på 100,1 år och används i krytroner.
Medicin
* Det används vid tillverkning av konsolsystem (titannickelid).
* Proteser
mynt
Nickel används i stor utsträckning vid tillverkning av mynt i många länder. I USA kallas 5-centsmyntet i dagligt tal nickel.
Biologisk roll
Biologisk roll: Nickel är ett av de spårämnen som är nödvändiga för den normala utvecklingen av levande organismer. Men lite är känt om dess roll i levande organismer. Nickel är känt för att delta i enzymatiska reaktioner hos djur och växter. Hos djur ackumuleras det i keratiniserade vävnader, särskilt i fjädrar. En ökad halt av nickel i jordar leder till endemiska sjukdomar - fula former uppstår i växter, och ögonsjukdomar hos djur förknippade med ansamling av nickel i hornhinnan. Toxisk dos (för råttor) - 50 mg. Särskilt skadliga är flyktiga nickelföreningar, i synnerhet dess tetrakarbonyl Ni(CO)4. MPC för nickelföreningar i luft varierar från 0,0002 till 0,001 mg/m3 (för olika föreningar).
Fysiologisk verkan
Nickel är den främsta orsaken till allergi (kontaktdermatit) mot metaller som kommer i kontakt med huden (smycken, klockor, jeansnubbar). I Europeiska unionen är nickelhalten i produkter som kommer i kontakt med mänsklig hud begränsad.
Nickelkarbonyl är mycket giftigt. Den högsta tillåtna koncentrationen av dess ångor i luften i industrilokaler är 0,0005 mg/m³.
På 1900-talet fann man att bukspottkörteln är mycket rik på nickel. Vid administrering efter insulin förlänger nickel insulinets verkan och ökar därmed den hypoglykemiska aktiviteten. Nickel påverkar enzymatiska processer, oxidation av askorbinsyra, accelererar övergången av sulfhydrylgrupper till disulfidgrupper. Nickel kan hämma verkan av adrenalin och sänka blodtrycket. Överdrivet intag av nickel i kroppen orsakar vitiligo. Nickel deponeras i bukspottkörteln och bisköldkörtlarna.
Nickel- en enkel substans, formbar, formbar, silvervit övergångsmetall, vid vanliga temperaturer i luft är täckt med en tunn film av oxid. Kemiskt inaktiv. Den tillhör tunga icke-järnmetaller, den förekommer inte i sin rena form på jorden - den ingår vanligtvis i olika malmer, har hög hårdhet, är välpolerad, är en ferromagnet - attraheras av en magnet, i det periodiska systemet av Mendeleev det betecknas med symbolen Ni och har 28 serienummer.
Se även:
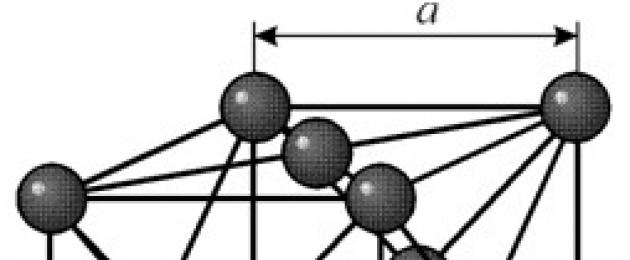
STRUKTURERA
 Den har ett ansiktscentrerat kubiskt gitter med en period a = 0,35238 å nm, rymdgrupp Fm3m. Denna kristallstruktur är tryckbeständig till minst 70 GPa. Under normala förhållanden existerar nickel i form av en b-modifiering med ett ansiktscentrerat kubiskt gitter (a = 3,5236 å). Men nickel, som utsätts för katodförstoftning i en atmosfär av h 2 , bildar en a-modifiering med ett hexagonalt tätpackat gitter (a = 2,65 å, c = 4,32 å), som vid upphettning över 200 °C omvandlas till ett kubisk en. Kompakt kubiskt nickel har en densitet på 8,9 g/cm 3 (20 ° C), en atomradie på 1,24 å
Den har ett ansiktscentrerat kubiskt gitter med en period a = 0,35238 å nm, rymdgrupp Fm3m. Denna kristallstruktur är tryckbeständig till minst 70 GPa. Under normala förhållanden existerar nickel i form av en b-modifiering med ett ansiktscentrerat kubiskt gitter (a = 3,5236 å). Men nickel, som utsätts för katodförstoftning i en atmosfär av h 2 , bildar en a-modifiering med ett hexagonalt tätpackat gitter (a = 2,65 å, c = 4,32 å), som vid upphettning över 200 °C omvandlas till ett kubisk en. Kompakt kubiskt nickel har en densitet på 8,9 g/cm 3 (20 ° C), en atomradie på 1,24 å EGENSKAPER
 Nickel är en formbar och formbar metall som kan användas för att göra de tunnaste plåtarna och rören. Draghållfasthet 400-500 MN/m 2 , elasticitetsgräns 80 MN/m 2 , sträckgräns 120 MN/m 2 ; töjning 40%; normal elasticitetsmodul 205 Gn/m2; Brinell hårdhet 600-800 MN/m 2 . I temperaturområdet från 0 till 631K (den övre gränsen motsvarar Curie-punkten). Nikkels ferromagnetism beror på särdragen i strukturen hos dess atomers yttre elektronskal. Nickel är en komponent i de viktigaste magnetiska materialen och legeringarna med en minsta termisk expansionskoefficient (permalloy, monelmetall, invar, etc.).
Nickel är en formbar och formbar metall som kan användas för att göra de tunnaste plåtarna och rören. Draghållfasthet 400-500 MN/m 2 , elasticitetsgräns 80 MN/m 2 , sträckgräns 120 MN/m 2 ; töjning 40%; normal elasticitetsmodul 205 Gn/m2; Brinell hårdhet 600-800 MN/m 2 . I temperaturområdet från 0 till 631K (den övre gränsen motsvarar Curie-punkten). Nikkels ferromagnetism beror på särdragen i strukturen hos dess atomers yttre elektronskal. Nickel är en komponent i de viktigaste magnetiska materialen och legeringarna med en minsta termisk expansionskoefficient (permalloy, monelmetall, invar, etc.).
RESERVER OCH PRODUKTION
 Nickel är ganska vanligt i naturen - dess innehåll i jordskorpan är cirka 0,01 % (massa). Det finns i jordskorpan endast i bunden form; järnmeteoriter innehåller naturligt nickel (upp till 8%). Dess innehåll i ultrabasiska bergarter är ungefär 200 gånger högre än i sura (1,2 kg/t och 8 g/t). I ultramafiska bergarter är den övervägande mängden nickel associerad med oliviner som innehåller 0,13 - 0,41% Ni.
Nickel är ganska vanligt i naturen - dess innehåll i jordskorpan är cirka 0,01 % (massa). Det finns i jordskorpan endast i bunden form; järnmeteoriter innehåller naturligt nickel (upp till 8%). Dess innehåll i ultrabasiska bergarter är ungefär 200 gånger högre än i sura (1,2 kg/t och 8 g/t). I ultramafiska bergarter är den övervägande mängden nickel associerad med oliviner som innehåller 0,13 - 0,41% Ni.
I växter i genomsnitt 5 10 -5 viktprocent nickel, i marina djur - 1,6 10 -4, hos landlevande djur - 1 10 -6, i människokroppen - 1 ... 2 10 -6.
Huvuddelen av nickel erhålls från garnierit och magnetisk pyrit.
Silikatmalm reduceras med koldamm i roterande rörugnar till järn-nickel-pellets (5-8 % Ni), som sedan renas från svavel, kalcineras och behandlas med en ammoniaklösning. Efter att lösningen surgjorts erhålls en metall elektrolytiskt från den.
Karbonylmetoden (Mond-metoden): Först erhålls koppar-nickel-skärsten från sulfidmalm, över vilken CO leds under högt tryck. Lättflyktigt tetrakarbonylnickel bildas, vars termiska sönderdelning ger en särskilt ren metall.
Aluminiumtermisk metod för att utvinna nickel från oxidmalm: 3NiO + 2Al = 3Ni + Al 2 O 3
URSPRUNG
 Avlagringar av sulfidkoppar-nickelmalmer är förknippade med lopolitliknande eller plattliknande massiv av skiktade gabbroider begränsade till zoner med djupa förkastningar på forntida sköldar och plattformar. Ett karakteristiskt kännetecken för koppar-nickel-avlagringar runt om i världen är den konsekventa mineralsammansättningen av malmer: pyrrotit, pentlandit, kopparkis, magnetit; förutom dem finns pyrit, kubanit, polydymit, nickelin, millerit, violarit, platinagruppmineraler, ibland kromit, nickel- och koboltarsenider, galena, sfalerit, bornit, makinavit, wallerit, grafit, naturligt guld i malmer.
Avlagringar av sulfidkoppar-nickelmalmer är förknippade med lopolitliknande eller plattliknande massiv av skiktade gabbroider begränsade till zoner med djupa förkastningar på forntida sköldar och plattformar. Ett karakteristiskt kännetecken för koppar-nickel-avlagringar runt om i världen är den konsekventa mineralsammansättningen av malmer: pyrrotit, pentlandit, kopparkis, magnetit; förutom dem finns pyrit, kubanit, polydymit, nickelin, millerit, violarit, platinagruppmineraler, ibland kromit, nickel- och koboltarsenider, galena, sfalerit, bornit, makinavit, wallerit, grafit, naturligt guld i malmer.
Exogena avlagringar av silikatnickelmalmer är allmänt förknippade med en eller annan typ av vittringsskorpa av serpenteniter. under vittring sker stegvis nedbrytning av mineraler, liksom överföring av rörliga element, med hjälp av vatten, från de övre delarna av skorpan till de nedre. Där faller dessa grundämnen ut i form av sekundära mineraler.
Fyndigheter av denna typ innehåller reserver av nickel som är 3 gånger högre än dess reserver i sulfidmalmer, och reserverna av vissa fyndigheter når 1 miljon ton eller mer nickel. Stora reserver av silikatmalmer är koncentrerade till Nya Kaledonien, Filippinerna, Indonesien, Australien och andra länder. Den genomsnittliga nickelhalten i dem är 1,1-2%. Dessutom innehåller malmer ofta kobolt.
ANSÖKAN
Den stora majoriteten av nickel används för att erhålla legeringar med andra metaller (fe, cr, cu, etc.), som kännetecknas av höga mekaniska, korrosionsskyddande, magnetiska eller elektriska och termoelektriska egenskaper. I samband med utvecklingen av jetteknik och skapandet av gasturbinanläggningar är värmebeständiga och värmebeständiga krom-nickellegeringar särskilt viktiga. Nickellegeringar används vid konstruktion av kärnreaktorer.
En betydande mängd nickel förbrukas för tillverkning av alkaliska batterier och rostskyddsbeläggningar. Formbart nickel i sin rena form används för tillverkning av plåtar, rör etc. Det används också inom den kemiska industrin för tillverkning av speciell kemisk utrustning och som katalysator för många kemiska processer. Nickel är en mycket knapp metall och bör om möjligt ersättas med andra, billigare och vanligare material.
Det används vid tillverkning av konsolsystem (titannickelid), proteser. Det används i stor utsträckning vid tillverkning av mynt i många länder. I USA kallas 5-centsmyntet i dagligt tal nickel. Nickel används också för tillverkning av lindningssträngar av musikinstrument.
Nickel - Ni
KLASSIFICERING
| Strunz (8:e upplagan) | 1/A.08-10 |
| Nickel-Strunz (10:e upplagan) | 1.AA.05 |
| Dana (7:e upplagan) | 1.1.17.2 |
| Dana (8:e upplagan) | 1.1.11.5 | Hejs CIM Ref | 1.61 |
Nickels egenskaper är viktiga parametrar för att hitta, bearbeta och använda metallen. De beaktas när man bildar kompositioner med andra material.
Nickels egenskaper bestämmer dess användning i produktionen
Nickel är en metall med en karakteristisk silvervit färg. Vid en temperatur på 1453 °C blir det flytande och kokar vid 2732 °C. Nickel är formbart och lätt att bearbeta under tryck.
Nickels kemiska egenskaper kännetecknas av dess förmåga att bilda föreningar med varierande grad av oxidation. Under naturliga förhållanden uppstår en tunn oxidfilm på metallytan.
Metallen har en hög motståndskraft mot korrosion. Nickel reagerar inte med ett antal koncentrerade syror och alkalier, utan löser sig aktivt i utspädd salpetersyra.

Genom att ingå i kemiska reaktioner bildar nickel flyktiga metaller och lösliga/olösliga salter
De reagerar inte med nickel.
- inerta gaser;
- litium;
- kalium;
- natrium;
- cesium;
- rubidium;
- strontium;
- barium;
- iridium;
- cesium.
Nickel kombineras med kol för att bilda karbonyl, en flyktig övergångsmetall som används vid tillverkning av material med hög renhet. Nickelpulver kan självantända vid kontakt med luft för att bilda oxider.
Nickel producerar ett antal lösliga och olösliga salter. Till exempel ger en lösning av metallsulfat vätskan en grön färg. Olösliga salter har vanligtvis en rik gul färg.
Former för att hitta metall
Under naturliga förhållanden finns nickel i kombination med ett antal kemiska grundämnen, och i form av nuggets finns i järnmeteoriter.
Under hydrotermiska förhållanden bildar nickel föreningar med arsenik, kobolt och silver. Förhöjda metallkoncentrationer är förknippade med mineralformationer - arsenider och sulfider.

I naturen finns nickel vanligtvis i föreningar med andra grundämnen.
Råmaterialet för utvinning av en värdefull komponent är sulfid, koppar-nickelmalmer som innehåller arsenik:
- nickelin - en förening med arsenik;
- kloantit - vit pyrit som innehåller kobolt och järn;
- garnierit - silikatsten som innehåller magnesium;
- magnetiska pyriter - en förening av svavel med järn och koppar;
- gersdorfite - arsenik-nickel lyster;
- pentlandit är en förening av svavel, järn och nickel.
Metallhalten i levande organismer beror på förhållandena och miljön. Vissa representanter för flora och fauna kan koncentrera metallen.
De huvudsakliga malmfyndigheterna finns i Kanada, Ryska federationen, Albanien, Sydafrika, Kuba och Grekland.
Processen att utvinna metall från malmer innebär användning av teknik beroende på typen av råmaterial. Nickel är ibland ett mindre anrikningsmaterial för berget.
Eldfasta malmer som innehåller magnesium utsätts för elektrisk smältning. Järnhaltiga lateritiska malmer bearbetas med den hydrometallurgiska metoden, följt av behandling med alkaliska lösningar.
Berg med lägre järnhalt smälts, eldas och elektriskt smälts. Längs vägen återvinns metallisk kobolt eller dess salter. En ökad halt av metallen observeras i askan från stenkol i England. Detta faktum är förknippat med aktiviteten hos mikroorganismer som koncentrerar nickel.
Plasticitet och andra fysikaliska egenskaper hos nickelföreningar beror på materialets renhet. En lätt inblandning av svavel gör metallen spröd. Tillsatsen av magnesium till det smälta materialet renar blandningen av mindre föroreningar med bildning av en förening med svavel.
Branscher där nickel används
Metallens fysikaliska och kemiska egenskaper bestämmer dess användning:
- vid tillverkning av rostfritt stål;
- för bildning av legeringar som inte innehåller järn;
- i syfte att applicera skyddande beläggningar på produkter med galvanisk metod;
- för produktion av kemiska reagenser;
- inom pulvermetallurgi.
Metallen används vid tillverkning av batterier, med dess hjälp inträffar katalytiska processer av kemiska reaktioner i industriell produktion. Titanlegeringar är ett utmärkt material för tillverkning av proteser och tandjusteringsanordningar.
Kompositionen baserad på det kemiska elementet nr 28 är ett råmaterial för att prägla mynt, tillverka elektroniska cigarettspolar. Den används för att spola strängar av musikinstrument.
Vid tillverkning av kärnor för elektromagneter används kompositioner - permalloys, inklusive 20-60% järn. Nickel används vid tillverkning av olika delar och utrustning för den kemiska industrin.
Metalloxider används vid tillverkning av glas, glasyrer och keramik. Modern produktion är specialiserad på tillverkning av en mängd olika valsade produkter: tråd, tejp, folie, rör.

Nickel har ett brett användningsområde från beläggningar till kemikalier
Motståndskraft mot aggressiva miljöer gör det möjligt att använda valsad nickel för transport av alkalier i den kemiska industrin.
Nickelbaserade legeringsverktyg används inom medicin och vetenskaplig forskning. Metallen används för att skapa precisionsinstrument för fjärrstyrning av processer inom kärnkraftsindustrin och radarinstallationer.
Egenskaper hos nickellegeringar
I kompositionerna kombineras metallen huvudsakligen med järn och kobolt. Den används som en huvudlegeringskomponent för tillverkning av olika konstruktionsstål, magnetiska och icke-magnetiska legeringar.
Metallegeringar baserade på kemiskt element nr 28 har styrka, motståndskraft mot temperaturer, deformation och miljöpåverkan. Deras antal når flera tusen. De vanligaste kompositionerna är kombinationer med krom, molybden, aluminium, titan, beryllium.
Metallen anses vara ligaturkomponenten i guld, vilket ger smycken dess karaktäristiska vita färg och styrka. I förhållande till denna komposition finns det åsikter om den allergiska effekten av nickel på huden.
I kombination med krom bildas en nikromförening, som är resistent mot höga temperaturer, har en minsta koefficient för elektriskt motstånd och duktilitet.
Det används för tillverkning av värmeanordningar, delar, som en beläggning. Den höga hållfastheten hos anslutningen gör att den kan bearbetas, svarva, svetsas, stansas.

Nickellegeringar har hög hållfasthet, vilket gör att de kan användas i stor utsträckning i produktionen.
En speciell grupp bildas av legeringar, som inkluderar koppar. Bland dem är de mest populära:
- monel;
- mässing;
- brons;
- nysilver.
För mer än ett sekel sedan fann man att en järn-nickel-komposition innehållande 28% av den beskrivna metallen förlorar sina magnetiseringsegenskaper. Legeringar som innehåller 36% nickel kännetecknas av en lätt linjär expansion, vilket gör att den kan användas vid tillverkning av precisionsinstrument och -instrument.
Denna komposition, som betecknas FeNi36, kallas invar, det vill säga "oföränderlig". Kovar-legering som innehåller 29 % nickel, 17 % kobolt och 54 % järn har fått bred användning i produktionen.
Den har hög vidhäftning till smält glas, vilket gör att kompositionen kan användas för att göra elektriska ledningar som passerar genom detta ämne.
- I kontakt med 0
- Google Plus 0
- OK 0
- Facebook 0