Basen för ammoniumsalter är ammoniak. Det används i produktionen av många organiska ämnen. Generellt kan man hävda att användbarheten av ammoniumsalter är i nivå med användbarheten av bordssalt.
Av alla användningsområden för ammoniumsalter bör särskild uppmärksamhet ägnas åt deras användning i folkmedicin. Det vanligaste ammoniumsaltet är . Det används populärt i form av en 10% alkohollösning. Verkan av denna lösning är baserad på kraftig irritation av nervändarna i de övre luftvägarna.
Handlingen används främst för att föra en person till ett medvetande tillstånd. Den kan också användas för att väcka dig under naturlig sömn och snabbt ta dig ur ett tillstånd av svimning. I mindre utsträckning är ammoniak effektivt vid kolmonoxidförgiftning, drunkning och kvävning, eftersom Det är svårt att avgöra när topikala medel inte längre är effektiva.
Applicera ammoniak på följande sätt. Några droppar alkohol appliceras på en bomullsbit (bandage, servett) och förs till offrets näsa på ett avstånd av 0,5–1 cm i 1–2 minuter.
En separat artikel för användning av ammoniak anses vara en nödsituation för personer som har konsumerat alkoholhaltiga drycker överdrivet. I många fall, vid alkoholförgiftning, används en vattenlösning av ammoniak. Det här receptet är enkelt: tillsätt 5-6 droppar ammoniak i ett glas vatten och ge det till personen som behöver återupplivas för att dricka.
Jämfört med mer välbekanta medel, som att hälla vatten eller gnugga öronen, tillåter denna metod inte bara att vakna utan också att helt nykter upp en person; han blir i stånd att tydligt uttrycka sina tankar och svara på frågor.
Ammoniak
Ammoniak kan användas för att sterilisera till exempel en nål som ska användas för att ta bort en splitter från ett finger. Det räcker att torka av det med en bomullstuss indränkt i alkohol eller doppa det i en flaska alkohol i några sekunder.
I outspätt tillstånd rekommenderas ammoniak för användning som kauteriseringsmedel för att ta bort papillom. För att göra detta, ta en bomullspinne, doppa den i alkohol och tryck den mot huden med papillom i 5-6 sekunder. Det är viktigt att alkohol inte kommer i kontakt med frisk hud, annars kan du få en kemisk brännskada.
Och om du späder det 10 gånger hjälper det mycket bra att bli av med klåda i områden med insektsbett eller brännskador
Ammoniumsalter är mycket speciella. Alla sönderdelas lätt, vissa spontant, till exempel ammoniumkarbonat:
(NH4)2CO3 = 2NH3 + H2O + CO2 (reaktionen accelererar vid upphettning).
Andra salter, till exempel ammoniumklorid (ammoniak), sublimeras vid upphettning, d.v.s. de sönderdelas först till ammoniak och klorid under inverkan av uppvärmning, och när temperaturen sjunker, bildas ammoniumklorid igen på de kalla delarna av kärlet:
uppvärmning
NH4Cl ⇄ NH3 + HCl
kyl-
Vid upphettning sönderfaller ammoniumnitrat till dikväveoxid och vatten. Denna reaktion kan uppstå explosivt:
NH4NO3 = N2O + H2O
Ammoniumnitrit NH4NO2 sönderdelas vid upphettning för att bilda kväve och vatten, så det används i laboratoriet för att få kväve.
När ammoniumsalter utsätts för alkalier frigörs ammoniak:
NH4Cl + NaOH = NaCl + NH3 + H2O
Frigörandet av ammoniak är ett karakteristiskt tecken för igenkänning av ammoniumsalter. Alla ammoniumsalter är komplexa föreningar.
Ammoniak och ammoniumsalter används i stor utsträckning. Ammoniak används som råvara för framställning av salpetersyra och dess salter, samt ammoniumsalter, som fungerar som bra kvävegödselmedel. Sådana gödselmedel är ammoniumsulfat (NH4)2SO4 och särskilt ammoniumnitrat NH4NO3 eller ammoniumnitrat, vars molekyl innehåller två kväveatomer: en ammonium, den andra nitrat. Växter absorberar först ammoniak och sedan nitrat. Denna slutsats tillhör grundaren av rysk agrokemi, Acad. D. N. Pryanishnikov, som ägnade sina verk åt växtfysiologi och underbyggde betydelsen av mineralgödselmedel i jordbruket.
Ammoniak i form av ammoniak används inom medicinen. Flytande ammoniak används i kylaggregat. Ammoniumklorid används för att göra Leclanché torr galvanisk cell. En blandning av ammoniumnitrat med aluminium och kol, kallad ammonal, är ett kraftfullt sprängämne.
Ammoniumkarbonat används i konfektyrindustrin som jäsmedel.
■ 25. På vilken egenskap hos ammoniumkarbonat är dess användning för att lossa deg baserad?
26. Hur upptäcker man ammoniumjon i salt?
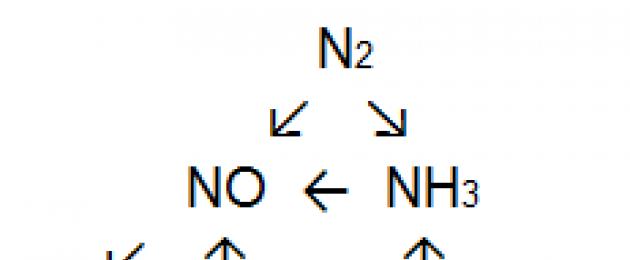
27. Hur man genomför en serie transformationer:
N2 ⇄ NH3 → NO
↓
NH4N03
Syreföreningar av kväve
Det bildar flera föreningar med syre, där det uppvisar olika oxidationstillstånd.
Det finns dikväveoxid N2O, eller, som det kallas, "skratgas". Den uppvisar ett oxidationstillstånd på + 1. I kväveoxid NO uppvisar kväve ett oxidationstillstånd på + 2, i dikväveanhydrid N2O3 - + 3, i kvävedioxid NO2 - +4, i kvävepentoxid eller salpeter
anhydrid, N2O5 - +5.
Lustgas N2O är en icke-saltbildande oxid. Detta är en gas som är ganska löslig i vatten, men som inte reagerar med vatten. Lustgas blandat med syre (80 % N2O och 20 % O2) ger en narkotisk effekt och används för så kallad gasanestesi, vars fördel är att den inte har lång efterverkan.
Resten av kvävet är mycket giftigt. Deras toxiska effekt uppträder vanligtvis inom några timmar efter inandning. Första hjälpen består av att få i sig en stor mängd mjölk, andas in rent syre och vila offret.
■ 28. Lista de möjliga oxidationstillstånden för kväve och motsvarande dessa oxidationstillstånd.
29. Vilka första hjälpen-åtgärder bör vidtas vid förgiftning med kväveoxider?
De mest intressanta och viktigaste kväveoxiderna är kväveoxid och kvävedioxid, som vi ska studera.
Kväveoxid NO bildas av kväve och syre vid kraftiga elektriska urladdningar. Bildandet av kväveoxid observeras ibland i luften under åskväder, men i mycket små mängder. Kväveoxid är en färglös, luktfri gas. Kväveoxid är olösligt i vatten, så det kan samlas upp ovanför vattnet i de fall beredningen utförs i ett laboratorium. I laboratoriet erhålls kväveoxid från måttligt koncentrerad salpetersyra genom dess verkan på:
HNO3 + Cu → Cu(NO3)2 + NO + H2O
Ordna själv koefficienterna i denna ekvation.
Kväveoxid kan framställas på andra sätt, till exempel i en ljusbågslåga:
N2 + O2 ⇄ 2NO.
Vid framställning av salpetersyra erhålls kväveoxid genom katalytisk oxidation av ammoniak, vilket diskuterades i § 68, sidan 235.
Kväveoxid är en icke-saltbildande oxid. Det oxideras lätt av atmosfäriskt syre och omvandlas till kvävedioxid NO2. Om oxidation utförs i ett glaskärl förvandlas färglös kväveoxid till en brun gas - kvävedioxid.
■ 30. När koppar interagerar med salpetersyra frigörs 5,6 liter kväveoxid. Räkna ut hur mycket koppar som reagerade och hur mycket salt som bildades.
Kvävedioxid NO2 är en brun gas med en karakteristisk lukt. Det är mycket lösligt i vatten, eftersom det reagerar med vatten enligt ekvationen:
3NO2 + H2O = 2HNO3 + NO
I närvaro av syre kan endast salpetersyra erhållas:
4N02 + 2H2O + O2 = 4HNO3
Molekyler av kvävedioxid NO2 kombineras ganska lätt i par och bildar kvävetetroxid N2O4 - en färglös vätska, vars strukturformel är
Denna process sker i kylan. Vid upphettning omvandlas kvävetetroxid tillbaka till kvävedioxid.
Kvävedioxid är en sur oxid eftersom den kan reagera med alkalier och bilda salt och vatten. Men på grund av det faktum att kväveatomer i N2O4-modifieringen har ett annat antal valensbindningar, när kvävedioxid reagerar med alkali, bildas två salter - nitrat och nitrit:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Kvävedioxid erhålls, som nämnts ovan, genom oxidation av oxiden:
2NO + O2 = 2NO2
Dessutom produceras kvävedioxid genom inverkan av koncentrerad salpetersyra på:
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(konc.)
eller bättre genom att kalcinera blynitrat:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
■ 31. Lista metoderna för framställning av kvävedioxid och ge ekvationer för motsvarande reaktioner.
32. Rita ett diagram över strukturen av kväveatomen i +4 oxidationstillstånd och förklara hur dess beteende bör vara i redoxreaktioner.
33. 32 g av en blandning av koppar och kopparoxid placerades i koncentrerad salpetersyra. Kopparhalten i blandningen är 20%. Vilken mängd gas kommer att släppas ut? Hur många gram molekyler salt producerar detta?
Salpetersyrlighet och nitriter
Salpetersyrlighet HNO2 är en mycket svag instabil syra. Det finns endast i utspädda lösningar (a = 6,3 % i en 0,1 N lösning). Salpetersyrlighet sönderdelas lätt och bildar kväveoxid och kvävedioxid
2HNO2 = NO + NO2 + H2O.
Oxidationstillståndet för kväve i salpetersyrlighet är +3. Med denna grad av oxidation kan vi konventionellt anta att 3 elektroner har getts upp från det yttre lagret av kväveatomen och 2 valenselektroner finns kvar. I detta avseende finns det två möjligheter för N+3 i redoxreaktioner: den kan uppvisa både oxiderande och reducerande egenskaper, beroende på vilken miljö - oxidativ eller reducerande - den kommer in i.
Salter av salpetersyrlighet kallas nitriter. Genom att behandla nitriter med svavelsyra kan du få salpetersyrlighet:
2NaNO2 + H2S04 = Na2S04 + 2HNO2.
Nitriter är salter som är ganska lösliga i vatten. Liksom salpetersyra i sig kan nitriter uppvisa oxiderande egenskaper när de reagerar med reduktionsmedel, till exempel:
NaNO2 + KI + H2SO4 → I2 + NO...
Försök själv hitta slutprodukterna och ordna koefficienter utifrån den elektroniska balansen.
Eftersom frisättningen är lätt att upptäcka med hjälp av stärkelse kan denna reaktion fungera som ett sätt att detektera även små mängder nitriter i dricksvatten, vars närvaro är oönskad på grund av toxicitet. Å andra sidan kan nitritkväve oxideras till N +5 under inverkan av ett starkt oxidationsmedel.
NaNO2 + K2Cr2O7 + H2SO4 → NaNO3 + Cr2(SO4)3 + …
Hitta de återstående reaktionsprodukterna själv, rita upp en elektronisk våg och ordna koefficienterna.
■ 34. Slutför ekvationen.
HNO2 + KMnO4 + H2SO4 → … (N +5, Mn +2).
35. Lista egenskaperna hos salpetersyrlighet och nitriter.
Salpetersyra
HNO3 är en stark elektrolyt. Detta är en flyktig vätska. Rena kokar vid en temperatur av 86°, har ingen färg; dess densitet är 1,53. Laboratorier får vanligtvis 65 % HNO3 med en densitet på 1,40.
röker i luften, eftersom dess ångor, som stiger upp i luften och kombineras med vattenånga, bildar dimdroppar. Salpetersyra blandas med vatten i valfritt förhållande. Den har en stickande lukt och avdunstar lätt, så koncentrerad salpetersyra bör endast hällas under tryck. Om det kommer i kontakt med huden kan salpetersyra orsaka allvarliga brännskador. En liten brännskada gör sig känd som en karakteristisk gul fläck på huden. Allvarliga brännskador kan orsaka sår. Om salpetersyra kommer i kontakt med huden, bör den snabbt tvättas bort med mycket vatten och sedan neutraliseras med en svag lösning av soda.
Koncentrerad 96-98% salpetersyra kommer sällan in i laboratoriet och under lagring ganska lätt, speciellt i ljus, sönderdelas den enligt ekvationen:
4HNO3 = 2H2O + 4N02 + O2
Den färgas permanent gul av kvävedioxid. Överskott av kvävedioxid avdunstar gradvis från lösningen, ackumuleras i lösningen och syran fortsätter att sönderdela. I detta avseende minskar koncentrationen av salpetersyra gradvis. Vid en koncentration på 65 % kan salpetersyra lagras under lång tid.
Salpetersyra är ett av de starkaste oxidationsmedlen. Det reagerar med nästan alla metaller, men utan att frigöra väte. Salpetersyrans uttalat oxiderande egenskaper har en så kallad passiverande effekt på vissa (,) föreningar. Detta gäller särskilt för koncentrerade syror. När den utsätts för det bildas en mycket tät syraolöslig oxidfilm på metallytan, vilket skyddar metallen från ytterligare exponering för syra. Metallen blir "passiv". .
Salpetersyra reagerar dock med de flesta metaller. I alla reaktioner med metaller reduceras kväve i salpetersyra, och ju mer fullständigt, desto mer utspädd är syran och desto aktivare är metallen.
Den koncentrerade syran reduceras till kvävedioxid. Ett exempel på detta är reaktionen med koppar som ges ovan (se § 70). Utspädd salpetersyra med koppar reduceras till kväveoxid (se § 70). Mer aktiva reducerar till exempel utspädd salpetersyra till dikväveoxid.
Sn + HNO3 → Sn(NO3)2 + N2O
Med mycket stark utspädning med en aktiv metall, till exempel zink, når reaktionen bildandet av ett ammoniumsalt:
Zn + HNO3 → Zn(NO3)2 + NH4NO3
I alla givna reaktionsscheman, ordna koefficienterna genom att själv skapa en elektronisk balans.
■ 36. Varför minskar koncentrationen av salpetersyra vid förvaring i laboratoriet, även i väl förslutna behållare?
37. Varför har koncentrerad salpetersyra en gulbrun färg?
38. Skriv ekvationen för reaktionen mellan utspädd salpetersyra och järn. Reaktionsprodukterna är järn(III)nitrat och en brun gas frigörs.
39. Skriv ner i din anteckningsbok alla reaktionsekvationer som kännetecknar växelverkan mellan salpetersyra och metaller. Lista vilka metaller, förutom metallnitrater, som bildas i dessa reaktioner.
Många kan brinna i salpetersyra, såsom kol och:
C + HNO3 → NO + CO2
P + HNO3 → NO + H3PO4
Den fria oxideras till fosforsyra. när den kokas i salpetersyra förvandlas den till S+6 och från fritt svavel bildas:
HNO3 + S → NO + H2SO4
Gör själv reaktionsekvationerna.
Komplexa kan också brinna i salpetersyra. Till exempel brinner terpentin och uppvärmt sågspån i salpetersyra.
Salpetersyra kan också oxidera saltsyra. En blandning av tre delar saltsyra och en del salpetersyra kallas aqua regia. Detta namn ges eftersom denna blandning också oxiderar platina, som inte påverkas av några syror. Reaktionen fortskrider i följande steg: i själva blandningen oxideras klorjonen till en fri och kväve reduceras för att bilda nitrosylklorid:
HNO3 + 3HCl ⇄ Cl2 + 2H2O + NOCl
aqua regia nitrosylklorid
Den senare sönderdelas lätt till kväveoxid och är fri enligt ekvationen:
2NOCl = 2NO + Cl2
Metall placerad i aqua regia oxideras lätt av nitrosylklorid:
Au + 3NOCl = AuCl3 + 3NO
Salpetersyra kan reagera med nitrering med organiska ämnen. I detta fall måste koncentrerad vara närvarande. En blandning av koncentrerad salpetersyra och svavelsyra kallas en nitreringsblandning. Med användning av en sådan blandning kan nitroglycerin erhållas från glycerin, nitrobensen från bensen, nitrocellulosa från fiber, etc. I ett mycket utspätt tillstånd uppvisar salpetersyra de karakteristiska egenskaperna hos syror.
■ 40. Ge egna exempel på typiska egenskaper hos syror i förhållande till salpetersyra. Skriv ekvationerna i molekylär och. joniska former.
41. Varför är flaskor med koncentrerad salpetersyra förbjudna att transporteras förpackade i träspån?
42. När koncentrerad salpetersyra testas med fenolftalein, får fenolftalein en orange färg snarare än att förbli färglös. Vad förklarar detta?
Det är mycket lätt att få salpetersyra i laboratoriet. Det erhålls vanligtvis genom att ersätta dess salter med svavelsyra, till exempel:
2KNO3 + H2SO4 = K2S04 + 2HNO3
I fig. 61 visar en laboratorieanläggning för framställning av salpetersyra.
Inom industrin används ammoniak som råvara för framställning av salpetersyra. Som ett resultat av oxidationen av ammoniak i närvaro av en platinakatalysator bildas kväveoxid:
4NH3 + 5O2 = 4NO + 6H2O
Som nämnts ovan oxideras kväveoxid lätt av atmosfäriskt syre till kvävedioxid:
2NO + O2 = 2NO2
och kvävedioxid, i kombination med vatten, bildar salpetersyra och återigen kväveoxid enligt ekvationen:
3NO2 + H2O = 2HNO3 + NO.
Sedan tillförs kväveoxiden igen för oxidation:
Det första steget i processen - oxidationen av ammoniak till kväveoxid - utförs i en kontaktapparat vid en temperatur av 820°. Katalysatorn är ett rutnät av platina med en blandning av rodium, som upphettas innan apparaten startas. Eftersom reaktionen är exoterm, värms gallren därefter på grund av värmen från själva reaktionen. Kväveoxiden som frigörs från kontaktapparaten kyls till en temperatur av cirka 40°, eftersom oxidationsprocessen av kväveoxid fortskrider snabbare vid en lägre temperatur. Vid en temperatur på 140° sönderdelas den resulterande kvävedioxiden igen till oxider av kväve och syre.
Oxidationen av kväveoxid till dioxid utförs i torn som kallas absorbatorer, vanligtvis under ett tryck på 8-10 atm. De absorberar (absorberar) samtidigt den resulterande kvävedioxiden med vatten. För att bättre absorbera kvävedioxid kyls lösningen. Resultatet är 50-60% salpetersyra.
Koncentrationen av salpetersyra utförs i närvaro av koncentrerad svavelsyra i destillationskolonner. bildar hydrater med det tillgängliga vattnet med en kokpunkt högre än den för salpetersyra, så salpetersyraångor frigörs ganska lätt från blandningen. Genom att kondensera dessa ångor kan 98-99% salpetersyra erhållas. Vanligtvis används en mer koncentrerad syra sällan.
■ 43. Skriv ner i din anteckningsbok alla ekvationer för de reaktioner som uppstår vid framställning av salpetersyra med laboratorie- och industriella metoder.
44. Hur man genomför en serie transformationer:

45. Hur mycket av en 10% lösning kan framställas av salpetersyra som erhålls genom att reagera 2,02 kg kaliumnitrat med ett överskott av svavelsyra?
46. Bestäm molariteten för 63% salpetersyra.
47. Hur mycket salpetersyra kan erhållas från 1 ton ammoniak vid 70 % utbyte?
48. Cylindern fylldes med kväveoxid genom att vatten ersattes. Sedan, utan att ta bort det från vattnet, placerades ett rör från en gasometer under det.
(se fig. 34) och började hoppa över. Beskriv vad som bör observeras i cylindern om överskott av syre inte tillåts. Motivera ditt svar med reaktionsekvationer.

Ris. 62. Förbränning av kol i smält salpeter. 1 - smält salpeter; 2 - brinnande kol; 3 - sand.
Salpetersyrasalter
Salter av salpetersyra kallas nitrater. Nitrater av alkalimetaller, liksom kalcium och ammonium, kallas nitrater. Till exempel är KNO3 kaliumnitrat, NH4NO3 är ammoniumnitrat. Naturliga avlagringar av natriumnitrat finns i enorma mängder i Chile, varför detta salt kallas chilenskt nitrat.
Ris. 62. Brinnande kol i smält salpeter. 1 - smält salpeter; 2 - brinnande kol; 3 - sand.
Salter av salpetersyra, liksom den själv, är starka oxidationsmedel. Till exempel separeras alkalimetallsalter under smältning enligt ekvationen:
2KNO3 = 2KNO2+ O2
Tack vare detta brinner kol och andra brandfarliga ämnen i smält salpeter (bild 62).
Salter av tungmetaller sönderfaller också vid frigöring av syre, men enligt ett annat mönster.
2Pb(NO3)2 = 2PbO + 4NO2 + O2

Ris. 63. Kvävets kretslopp i naturen
Kaliumnitrat används för att göra svart krut. För att göra detta blandas det med kol och svavel. Den används inte för detta ändamål, eftersom den är hygroskopisk. När det antänds brinner svartkrut intensivt enligt ekvationen:
2KNO3 + 3C + S = N2 + 3CO2 + K2S
Kalcium- och ammoniumnitrat är mycket bra kvävegödselmedel. På senare tid har även kaliumnitrat blivit utbrett som gödningsmedel.
Salpetersyra används i stor utsträckning vid tillverkning av kemiska läkemedel (streptocid), organiska färgämnen, celluloid, film och fotografiska filmer. Salter av salpetersyra används i stor utsträckning inom pyroteknik.
I naturen finns det ett kvävekretslopp där växter, när de dör, återför det kväve de får tillbaka till jorden. Djur, som livnär sig på växter, återför kväve till jorden i form av avföring, och efter döden ruttnar deras lik och återför därigenom också det kväve som erhållits från den till jorden (bild 63). Genom att skörda en gröda stör en person denna cykel, stör den och därigenom tömmer jorden på kväve, så det är nödvändigt att applicera kväve på fälten i form av mineralgödsel.
■ 49. Hur man genomför en serie transformationer

Teknisk salpetersyra Produktionen av salpetersyra utförs på tre sätt, som vi kommer att beskriva i den ordning som de började användas...
KONTROLLERA SLUTFÖRANDE AV UPPGIFTER OCH SVAR PÅ FRÅGOR 4. För att besvara dessa frågor, läs noggrant §...
Ammoniumsalter När neutraliserade ammoniaklösningar förångas, kombineras ammoniumjoner med anjonerna från de tagna syrorna och bildar fasta kristallina ämnen som har joniska...
>> Kemi: Ammoniumsalter
Som sagt spelar ammoniumkatjonen NH4+ rollen som en metallkatjon och den bildar salter med sura rester: NH4NO3 - ammoniumnitrat, eller ammoniumnitrat, (NH4)2SO4 - ammoniumsulfat, etc.
Alla ammoniumsalter är kristallina fasta ämnen, mycket lösliga i vatten. I ett antal egenskaper liknar de alkalimetallsalter, och i första hand kaliumsalter, eftersom radierna för K+- och NH+-jonerna är ungefär lika.
Ammoniumsalter erhålls genom att reagera ammoniak eller dess vattenlösning med syror.
De har alla egenskaper hos salter på grund av närvaron av sura rester. Till exempel reagerar ammoniumklorid eller sulfat med silvernitrat respektive bariumklorid och bildar karakteristiska fällningar. Ammoniumkarbonat reagerar med syror eftersom reaktionen producerar koldioxid.
Dessutom tillhandahåller ammoniumjonen en annan egenskap som är gemensam för alla ammoniumsalter: dess salter reagerar med alkalier när de upphettas för att frigöra ammoniak.
Denna reaktion är en kvalitativ reaktion på ammoniumsalter, eftersom den bildade ammoniaken lätt kan upptäckas (hur exakt?).
Den tredje gruppen av egenskaper hos ammoniumsalter är deras förmåga att sönderdelas vid upphettning och frigöra ammoniakgas, till exempel:
NH4Cl = NH3 + HCl
Denna reaktion producerar också gasformig väteklorid, som avdunstar tillsammans med ammoniak, och vid kylning återigen kombineras med den och bildar ett salt, dvs. när den upphettas i ett provrör sublimeras torr ammoniumklorid, men vita kristaller uppträder på de övre kalla väggarna av provröret igen NН4Сl (Fig. 32).
De huvudsakliga användningsområdena för ammoniumsalter visades tidigare, i figur 31. Här uppmärksammar vi att nästan alla ammoniumsalter används som kvävegödselmedel. Som ni vet kan växter absorbera kväve endast i bunden form, det vill säga i form av NH4- eller N03-joner. Den anmärkningsvärda ryske agrokemisten D.N. Pryanishnikov fann att om en växt har ett val, föredrar den ammoniumkatjonen framför nitratanjonen, så användningen av ammoniumsalter som kvävegödselmedel är särskilt effektiv. Ett mycket värdefullt kvävegödselmedel är ammoniumnitrat NH4NO3.
Låt oss notera andra användningsområden för vissa ammoniumsalter.
Ammoniumklorid NH4Cl används för lödning, eftersom det rengör metallytan på oxidfilmen och lod fäster väl vid den.
Ammoniumbikarbonat NH4NC03 och ammoniumkarbonat (NH4)2CO3 används i konfektyr, eftersom de lätt sönderdelas vid upphettning och bildar gaser som lossar degen och gör den fluffig, till exempel:
NH4HC03 = NH3 + H20 + CO2
Ammoniumnitrat NН4NO3 blandat med aluminium- och kolpulver används som ett sprängämne - ammonal, som används ofta i gruvdrift.
1. Ammoniumsalter.
2. Ammoniumsalters egenskaper på grund av ammoniumjon, sura rester. Nedbrytning av ammoniumsalter.
3. Kvalitativ reaktion på ammoniumjon.
4. Ammoniumklorid, nitrat, karbonat och deras tillämpningar.
Skriv reaktionsekvationerna (i molekylär och jonisk form) mellan följande ämnespar: a) ammoniumsulfat och bariumklorid; b) ammoniumklorid och silvernitrat.
Skriv reaktionsekvationer som karakteriserar egenskaperna hos ammoniumkarbonat: interaktion med syra, alkali, salt och sönderdelningsreaktion. Skriv även de tre första ekvationerna i jonform.
Med flerbasiska syror bildar ammoniak inte bara mellanliggande, utan också sura salter. Skriv formlerna för de sura salter som den kan ge när den reagerar med fosforsyra. Namnge dem och skriv dissociationsekvationerna för dessa salter.
Rita upp molekylära och om möjligt joniska reaktionsekvationer som kan användas för att utföra följande övergångar:
N2 -> NH3 -> (NH4)2 HPO4 -> NH4Cl -> NH4NO3
Bestäm mängden ämne, volym och massa ammoniak som krävs för att producera 250 kg ammoniumsulfat som används som gödningsmedel.
Lektionens innehåll lektionsanteckningar stödja frame lektion presentation acceleration metoder interaktiv teknik Öva uppgifter och övningar självtest workshops, utbildningar, fall, uppdrag läxor diskussionsfrågor retoriska frågor från elever Illustrationer ljud, videoklipp och multimedia fotografier, bilder, grafik, tabeller, diagram, humor, anekdoter, skämt, serier, liknelser, ordspråk, korsord, citat Tillägg sammandrag artiklar knep för nyfikna spjälsängar läroböcker grundläggande och ytterligare ordbok över termer andra Förbättra läroböcker och lektionerrätta fel i läroboken uppdatera ett fragment i en lärobok, inslag av innovation i lektionen, ersätta föråldrad kunskap med nya Endast för lärare perfekta lektioner kalenderplan för året, metodologiska rekommendationer, diskussionsprogram Integrerade lektionerAmmoniumsalter
TILL Ammoniumjonen NH4+ spelar rollen som en metallkatjon och den bildar salter med sura rester: NH4NO3 - ammoniumnitrat, eller ammoniumnitrat, (NH4)2SO4 - ammoniumsulfat, etc.
Alla ammoniumsalter är kristallina fasta ämnen, mycket lösliga i vatten. I ett antal egenskaper liknar de alkalimetallsalter, och i första hand kaliumsalter, eftersom radierna för K+- och NH+-jonerna är ungefär lika.
Ammoniumsalter erhålls genom att reagera ammoniak eller dess vattenlösning med syror.
De har alla egenskaper hos salter på grund av närvaron av sura rester. Till exempel reagerar ammoniumklorid eller sulfat med silvernitrat respektive bariumklorid och bildar karakteristiska fällningar. Ammoniumkarbonat reagerar med syror eftersom reaktionen producerar koldioxid.
Dessutom tillhandahåller ammoniumjonen en annan egenskap som är gemensam för alla ammoniumsalter: dess salter reagerar med alkalier när de upphettas för att frigöra ammoniak.
Denna reaktion är en kvalitativ reaktion på ammoniumsalter, eftersom den bildade ammoniaken lätt kan upptäckas (hur exakt?).
Den tredje gruppen av egenskaper hos ammoniumsalter är deras förmåga att sönderdelas vid upphettning och frigöra ammoniakgas, till exempel:
NH4Cl = NH3 + HCl
Denna reaktion producerar också gasformig väteklorid, som avdunstar tillsammans med ammoniak, och vid kylning återigen kombineras med den och bildar ett salt, dvs. när den upphettas i ett provrör sublimeras torr ammoniumklorid, men vita kristaller uppträder på de övre kalla väggarna av provröret igen NН4Сl (Fig. 32).
De huvudsakliga användningsområdena för ammoniumsalter visades tidigare, i figur 31. Här uppmärksammar vi att nästan alla ammoniumsalter används som kvävegödselmedel. Som ni vet kan växter absorbera kväve endast i bunden form, det vill säga i form av NH4- eller N03-joner. Den anmärkningsvärda ryske agrokemisten D.N. Pryanishnikov fann att om en växt har ett val, föredrar den ammoniumkatjonen framför nitratanjonen, så användningen av ammoniumsalter som kvävegödselmedel är särskilt effektiv. Ett mycket värdefullt kvävegödselmedel är ammoniumnitrat NH4NO3.
Låt oss notera andra användningsområden för vissa ammoniumsalter.
Ammoniumklorid NH4Cl används för lödning, eftersom det rengör metallytan på oxidfilmen och lod fäster väl vid den.
Ammoniumbikarbonat NH4NC03 och ammoniumkarbonat (NH4)2CO3 används i konfektyr, eftersom de lätt sönderdelas vid upphettning och bildar gaser som lossar degen och gör den fluffig, till exempel:
NH4HC03 = NH3 + H20 + CO2
Ammoniumnitrat NН4NO3 blandat med aluminium- och kolpulver används som ett sprängämne - ammonal, som används ofta i gruvdrift.
I kemiska föreningar visar sig NH4+ som en positiv enkelladdad alkalimetallkatjon. Vid interaktion med sura anjoner bildas ämnen med en kristallin struktur - salter NH4N03, klorid NH4C1, sulfat (NH4)2S04, som består av en sur anjon och en ammoniumgrupp.
Ammoniumsalter erhålls under reaktionen av ammoniak med syror.
Ammoniumsalter, som i princip de flesta alkalimetaller, kan dissociera (delas i katjoner och anjoner) i vattenlösningar till joner: ammoniumsalter, som alkalimetallsalter, dissocierar till joner:
NH4N03 ↔ NH4++ NO3-
Under uppvärmningsprocessen sönderdelas torra ammoniumsalter till ammoniak och syra; Denna process kallas även termisk dissociation.
Den resulterande syran (till exempel saltsyra) avdunstar tillsammans med NH3 och kombineras vid kylning med ammoniak för att bilda ett salt. Det bör sägas att en reversibel nedbrytningsprocess också är möjlig:
NH3 + HCl ↔ NH4Cl
Således sublimeras ammoniak vid upphettning, men efter en tid uppträder en vit beläggning av ammoniumklorid på de övre delarna av provröret. Som ett resultat av bildandet av ett salt av en icke-flyktig syra, till exempel (NH4)2S04, avdunstar endast NH3 under upphettning och syran finns kvar. Denna process kallas irreversibel nedbrytning.
Alla ammoniumsalter sönderdelas bra med alkalier (vid upphettning) och frigör ammoniak:
NH4+ + OH -↔NH3+ H20
Denna reaktion används för att känna igen mineralgödsel med ammoniumformen av kväve.
När ammoniumkarbonat interagerar med mineraler frigörs koldioxid. När ammoniumsulfat eller -klorid reagerar med AgNO3 eller BaCl bildas karakteristiska vita fällningar.
Ammoniumsalter: exempel
Ammoniumsalter används i stor utsträckning inom jordbruket. Detta är ett utmärkt material för mineralmatning av växter (till exempel ammoniumsulfat - (NH4)2S04). Som bekant kan växter endast ta upp kväve i bunden form (NO3, NH4). Därför är kväveföreningar mycket effektiva. Ammoniumnitrat, som innehåller ammonium NH4 och nitrat NO3-kväve, är av stor betydelse.
Divätefosfat och ammoniumvätefosfat, känd under namnen ammophos NH4H2P04 och diammophos (NH4)2НР04, innehåller två kemiska växtnäringsämnen - kväve och fosfor. Ammoniumsalter ingår i gödselblandningar.
När ammoniak reagerar med kol(IV)oxid, syntetiseras urea eller karbamid NH2-CO-NH2.
Ammoniumklorid (NH4C1) eller ammoniak används i galvaniska celler, färgning och kalikotryck, förtenning och lödning. I kontakt med uppvärmd metall sönderdelas ammoniak till väteklorid och ammoniak. interagerar med oxiden som förorenar metallytan, vilket resulterar i bildandet av ett flyktigt salt.
Observera att lod fäster mycket bra på den rengjorda ytan. NH4NO3 (ammoniumnitrat) tillsammans med kol och aluminiumsalter är en integrerad del av sprängämnet - ammonal. Dessa föreningar används i utvecklingen av stenar. (NH4НСО3) används mycket ofta inom livsmedels- och konfektyrindustrin. Denna förening används också som konserveringsmedel för olika typer av foder. NH4HCO3 har denitrifierande egenskaper, vilket påskyndar grödans mognad.
Kvalitativ reaktion på ammoniumsalter. När en lösning av ammoniumsalter och alkalier värms upp bildas den som spjälkas för att frigöra ammoniak.
Förekomsten av ammoniak kan bestämmas av dess specifika lukt, såväl som genom att använda färgade pappersindikatorer. För att utföra denna reaktion måste du ta 1,0 cm3 ammoniumsaltlösning, tillsätt 0,5 cm3 av lösningen och värm den. Under uppvärmningsprocessen frigörs ammoniak, en karakteristisk lukt bildas och röd lackmus blir blå.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0