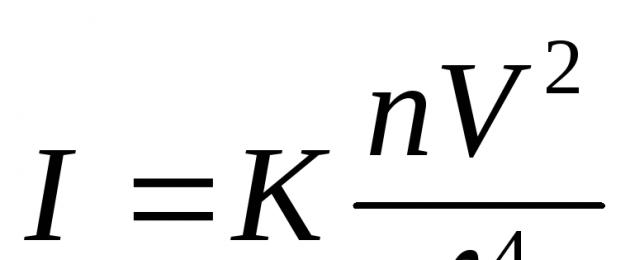I grumliga miljöer sprids violett och blått ljus mest, medan orange och rött ljus sprids minst.
Tyndall-effekten upptäcktes som ett resultat av en vetenskapsmans studie av ljusstrålars interaktion med olika medier. Han fann att när ljusstrålar passerar genom ett medium som innehåller en suspension av små fasta partiklar - till exempel dammig eller rökig luft, kolloidala lösningar, grumligt glas - minskar spridningseffekten när strålens spektrala färg ändras från violettblå till gul. -röd del av spektrumet. Om emellertid vitt ljus, såsom solljus, som innehåller hela färgspektrumet, passeras genom ett grumligt medium, så kommer ljuset i den blå delen av spektrumet att delvis spridas, medan intensiteten hos den grön-gul-röda en del av ljuset förblir nästan detsamma. Därför, om vi tittar på spritt ljus efter att det har passerat genom ett grumligt medium bort från ljuskällan, kommer det att se blåare ut än det ursprungliga ljuset. Om vi tittar på en ljuskälla längs spridningslinjen, det vill säga genom ett grumligt medium, kommer källan att verka rödare för oss än vad den faktiskt är. Det är därför till exempel dis från skogsbränder ser blåviolett ut för oss.
Tyndall-effekten uppstår vid spridning på suspenderade partiklar vars dimensioner överstiger atomernas dimensioner tiotals gånger. När suspensionspartiklar förstoras till storlekar i storleksordningen 1/20 av ljusvåglängden (från cirka 25 nm och uppåt), blir spridningen polykrom, det vill säga ljuset börjar spridas jämnt över hela det synliga färgintervallet från violett till rött. Som ett resultat försvinner Tyndall-effekten. Det är därför tät dimma eller cumulusmoln verkar vita för oss - de består av en tät suspension av vattendamm med partikeldiametrar som sträcker sig från mikron till millimeter, vilket är långt över Tyndalls spridningströskel.
Du kanske tror att himlen verkar blå för oss på grund av Tyndall-effekten, men så är det inte. I frånvaro av moln eller rök blir himlen blå på grund av spridningen av "dagsljus" av luftmolekyler. Denna typ av spridning kallas Rayleigh sprider sig(för att hedra Sir Rayleigh; centimeter. Rayleigh-kriteriet). I Rayleigh-spridning sprids blått och cyanljus ännu mer än i Tyndall-effekten: till exempel sprids blått ljus med en våglängd på 400 nm i ren luft nio gånger starkare än rött ljus med en våglängd på 700 nm. Det är därför himlen ser blå ut för oss - solljus sprider sig över hela spektralområdet, men i den blå delen av spektrat är nästan en storleksordning starkare än i det röda. Ultravioletta strålar som orsakar solning sprids ännu starkare. Det är därför solbrännan fördelas ganska jämnt över kroppen och täcker även de områden på huden som inte utsätts för direkt solljus.
John Tyndall, 1820-93
Irländsk fysiker och ingenjör. Född i Leighlin Bridge, County Carlow. I slutet gymnasium arbetade som topograf-lantmätare i militära organisationer och inom byggnation järnvägar. Samtidigt tog han examen från Mechanical Institute i Preston. Avskedad från den militära geodetiska tjänsten för att ha protesterat mot dåliga arbetsförhållanden. Han undervisade vid Queenwood College (Hampshire), samtidigt som han fortsatte sin självutbildning. Åren 1848-51. deltog i föreläsningar vid universiteten i Marburg och Berlin. När han återvände till England blev han lärare och sedan professor vid Royal Institution i London. Forskarens huvudsakliga arbeten ägnas åt magnetism, akustik, absorption av termisk strålning av gaser och ångor, ljusspridning i grumliga medier . Han studerade strukturen och rörelsen av glaciärer i Alperna.
Tyndall var extremt passionerad över idén om att popularisera vetenskapen. Han höll regelbundet offentliga föreläsningar, ofta i form av kostnadsfria föreläsningar för alla: för arbetare på fabriksgårdar under lunchrasterna, julföreläsningar för barn på Kungl. Tyndalls berömmelse som populariserare nådde också andra sidan Atlanten - hela upplagan av den amerikanska upplagan av hans bok Fragments of Science Vetenskap, 1871) såldes slut på en dag. Han dog en absurd död 1893: medan forskarens fru (som överlevde honom med 47 år) när hon förberedde middagen använde av misstag ett av de kemiska reagenserna som förvarades i köket istället för bordssalt.
Spridning av ljus. Ur en klassisk synvinkel är ljusspridning det
Elektromagnetiska vågor som passerar genom materia orsakar vibrationer av elektroner i atomer. Förklaring: om partikelstorleken är liten, då gör elektronerna
påtvingade vibrationer i atomer är likvärdiga med en oscillerande dipol. Denna dipol svänger med frekvensen av ljusvågen som infaller på den. Därför sprids kortvågsdelen av spektrumet mycket mer intensivt än långvågsdelen. Blått ljus sprids nästan 5 gånger mer intensivt än rött ljus. Därför är spritt ljus blått och genomsläppt ljus är rödaktigt. På mycket höga höjder (hundratals kilometer) är koncentrationen av atmosfäriska molekyler mycket liten, spridningen försvinner praktiskt taget, himlen ska se svart ut och stjärnorna är synliga i solens närvaro. På rymdflyg alla dessa förutsägelser bekräftades fullständigt.
Rayleigh-Jeans lag är strålningens lag för jämviktsstrålningstätheten för en absolut svart kropp och för emissiviteten hos en absolut svart kropp.
Tyndall-effekt, Tyndall-effekt - optisk effekt, ljusspridning när en ljusstråle passerar genom ett optiskt inhomogent medium. Ses vanligtvis som en lysande kon ( Tyndall kon), synlig mot en mörk bakgrund.
Karakteristiskt för lösningar av kolloidala system (till exempel soler, metaller, utspädda latexar, tobaksrök), där partiklarna och deras miljö skiljer sig åt i brytningsindex.
Nephelometri är en metod för att studera och analysera ett ämne baserat på intensiteten av ljusflödet som sprids av suspenderade partiklar av detta ämne.
Kärnan i metoden
Intensiteten av det spridda ljusflödet beror på många faktorer, särskilt på koncentrationen av partiklar i det analyserade provet. Stor betydelse i nefelometri har den en volym av partiklar som sprider ljus. Ett viktigt krav för reaktioner som används inom nefelometri är att reaktionsprodukten måste vara praktiskt taget olöslig och vara en suspension (suspension). För att hålla fasta partiklar i suspension används olika stabilisatorer (till exempel gelatin) för att förhindra partikelkoagulering.
50. Termisk strålning av kroppar. Lagar för svart kroppsstrålning (Stephan–Boltzmann, Wien).
Det finns en oändlig process av energiutbyte mellan alla naturkroppar. Kroppen avger och absorberar kontinuerligt energi. Om excitationen av atomer sker som ett resultat av deras kollision med andra atomer i samma kropp i processen termisk rörelse, då kallas den resulterande elektromagnetiska strålningen termisk.
Termisk strålning uppstår vid vilken temperatur som helst. I detta fall, oavsett temperatur, avger kroppen alla våglängder utan undantag, d.v.s. spektrumet av termisk strålning är kontinuerligt och sträcker sig från noll till oändlighet. Men ju högre temperatur, desto mer kortvågig strålning är den främsta i strålningsspektrumet. Processen för emission av elektromagnetiska vågor från kroppen sker samtidigt och oberoende med deras absorption.
En kropp som helt absorberar energi över hela våglängdsområdet, d.v.s. för vilken α = 1 kallas absolut svart (svart)
STEPHAN-BOLZMANN LAG. Wiens förskjutningslag
Stefan och Boltzmann fick ett integrerat uttryck för den energetiska ljusstyrkan hos en svart kropp, som inte tar hänsyn till fördelningen av energi över våglängder:
R = σT4, σ är Stefan-Boltzmann-konstanten (σ = 5,6696·10-8 W/(m2·K4)).
För grå kroppar tillåter Kirchhoffs lag oss att skriva r λ = α λ ε λ , då har vi för grå kroppars energetiska ljusstyrka: .
Genom att analysera kurvorna fann Wien att våglängden vid vilken den maximala spektrala tätheten för energiluminositet faller bestäms av förhållandet: .
Detta är Wiens lag, där b = 0,28978·10 -2 m·K är Wiens konstant.
Låt oss bestämma värdet på den våglängd som ε λ har maximalt värde vid en given temperatur, baserat på förhållandet. Enligt reglerna för att hitta extrema kommer detta att tillhandahållas . Beräkningar visar att detta kommer att ske om λ = b/T.
Från sambandet är det tydligt att med ökande temperatur skiftar våglängden vid vilken den maximala emissiviteten för en absolut svart kropp inträffar till kortvågsområdet. Av denna anledning är förhållandet även känt i den vetenskapliga litteraturen som Wiens förskjutningslag. Denna lag gäller även för grå kroppar.
Stefan-Boltzmann och Wiens lagar gör det möjligt att bestämma deras temperaturer baserat på mätningar av energin som avges av en kropp. Denna gren av fysiken kallas optisk pyrometri.
Beroende på våglängden hos synligt ljus och den relativa storleken på partiklarna i den dispergerade fasen får ljusspridningen en annan karaktär.
Om partikelstorleken är mindre än halvvåglängden av det infallande ljuset, observeras diffraktionsspridning av ljus; ljuset tycks kringgå (böja sig runt) partiklarna på vägen. I detta fall uppstår partiell spridning i form av vågor som divergerar i alla riktningar (fig. 8). Som ett resultat av ljusspridning är varje partikel en källa till nya, mindre intensiva vågor, d.v.s. det är som om självluminescens av varje partikel inträffar. Fenomenet med ljusspridning av små partiklar kallas opalescens. Det är främst karakteristiskt för soler (flytande och fasta) och observeras endast i reflekterat ljus, d.v.s. från sidan eller mot en mörk bakgrund. Detta fenomen uttrycks i utseendet av en viss grumlighet i solen och i en förändring ("overflow") av dess färg jämfört med färgen i genomsläppt ljus. Färg i reflekterat ljus förskjuts som regel mot en högre frekvens av den synliga delen av spektrumet. Sålunda blir vita soler (sol av silverklorid, kolofonium, etc.) opaliserande med en blåaktig färg.
Faraday-Tyndall-effekten (Figur 9).
Färg.
Beroende av spridd ljusintensitet ( jag) med ovanstående effekter uttrycks med Rayleigh-formeln:  Var: jag– och intensiteten av spritt ljus i den infallande strålens riktning ┴; TILL– konst inklusive brytningsindex för mediet och fasen, n– antal partiklar i volymenhet,
– våglängd för infallande ljus,
Var: jag– och intensiteten av spritt ljus i den infallande strålens riktning ┴; TILL– konst inklusive brytningsindex för mediet och fasen, n– antal partiklar i volymenhet,
– våglängd för infallande ljus,
V– volymen av varje partikel.
Av formeln är det tydligt jag att spridningen av kortare vågor sker mer intensivt, därför uppträder färglösa solor röda i genomsläppt ljus och blå i spritt ljus.
6. Kolloidala lösningar är relativt mindre stabila jämfört med molekylära lösningar. Under påverkan av olika faktorer ( t 0 , h V, el, MED, mekanisk påverkan, närvaron av föroreningar), och ibland helt enkelt utan uppenbar anledning, irreversibla processer inträffar i kolloidala system, vilket leder till förändringar i partiklarna i den dispergerade fasen och deras utfällning. Sådana processer som leder till spontan förstärkning av partiklar kallas åldrande.
Även om vi för kolloidala system bara kan tala om den relativa stabiliteten hos N.P. Peskov introducerade i vetenskapen begreppet kinetisk Och aggregativ hållbarhet.
Kinetisk stabilitet- dispergerade partiklars förmåga att hållas i suspension under påverkan av Brownsk rörelse. Förutom Brownsk rörelse är faktorer för kinetisk stabilitet dispersion, det dispergerade mediets viskositet, skillnaden i densitet hos det dispergerade mediet och fasen, etc. Av alla faktorer är den viktigaste spridningen, eftersom den har gjort det största inflytande pån. System där deponeringshastigheten är mycket låg kallas kinetiskt stabil.
Aggregativ stabilitet– dispergerade faspartiklars förmåga att motstå sin vidhäftning och därigenom bibehålla en viss grad av dispersion. Förlust av aggregativ stabilitet leder till att partiklar klibbar ihop för att bilda större aggregat.
Aggregatstabilitet förklaras av närvaron av kolloidala partiklar av liknande laddningar, som stör deras anslutning, såväl som närvaron av solvatiseringsskal av lösningsmedelsmolekyler runt kärnan. Ett direkt samband har etablerats mellan tjockleken på solvatiseringsskal och aggregativ stabilitet.
Ett karakteristiskt kännetecken för kolloidala lösningar är processerna för spontan förändring i partikelstorlek: storleken kan minska som ett resultat av ofullständig upplösning av partiklar i den dispergerade fasen minskning av den specifika ytarean av den dispergerade fasen minskning av fri energi - bearbeta upplösning; eller förstora - processen för omkristallisering.
7. Kolloidala system har en stor gränsyta och därför ett överskott av fri energi. Därför är dessa system inte stabila, de tenderar att minska den fria energin, och detta sker i de flesta fall på grund av en minskning av den totala ytan av de kolloidala partiklarna, d.v.s. genom att stärka dem. Denna process för att stärka kolloidala partiklar kallas koagulering. Processen för avsättning av förstorade partiklar av den fasta fasen kallas sedimentation.
Koaguleringsprocessen består av två steg: latent koagulering– koaguleringsprocessen inte detekteras visuellt och uppenbar koagulering– lätt att upptäcka visuellt.
Den viktigaste faktorn i koaguleringen av hydrofoba soler är verkan av elektrolyter. Nästan alla elektrolyter i tillräckliga mängder kan orsaka koagulering. För att orsaka koagulering krävs en viss minimikoncentration av elektrolyt. Den minsta elektrolytkoncentration som kan orsaka koagulering kallas koagulationströskel. Det har fastställts att den koagulerande effekten utövas av en jon vars laddning är motsatt i tecken till laddningen på ytan av den kolloidala partikeln. För (+) laddade soler utövas således koagulerande effekter av anjoner, och för (-) laddade soler verkar katjoner. Dessutom orsakar koagulerande joner med högre laddning vanligtvis koagulering vid betydligt lägre koncentrationer än joner med lägre laddning (Schulze-Gaddi-regeln).
Koaguleringströsklar av samma tecken skiljer sig också från varandra vad gäller koaguleringsförmåga, s.k. lyotropisk serie:
Katjoner: Сs + >Rb + >NH4 + >K + >Na + >Li+; anjoner: I - >NO 3 - >Fr - >Cl -
En blandning av elektrolyter kan också orsaka en koagulerande effekt. I det här fallet är tre fall möjliga:
1) Koagulationseffekten är kumulativ;
2) Koagulationsverkan än individuellt - antagonism;
3) Ömsesidig förbättring av koagulationsverkan - synergism.
Koagulering kan orsakas av att en hydrofob sol i ett visst förhållande blandas med andra hydrofoba sol vars granulat har motsatt laddning, detta fenomen kallas ömsesidig koagulering.Ömsesidig koagulering är möjlig på grund av frånvaron av repulsion mellan motsatt laddade miceller.
8. Som bekant är hydrofoba kolloider instabila i det isoelektriska tillståndet, dvs. elektron-centrala partiklar koagulerar med högsta hastighet.
I fig. Figur 10 visar ett diagram över laddningsavlägsnande från en kolloidal partikel när en elektrolyt med dubbelt laddade anjoner tillsätts.

Som vi kan se blir granulen elektriskt neutral om motjonerna i det diffusa skiktet, laddade negativt, rör sig in i adsorptionsskiktet. Ju högre koncentrationen av den tillsatta elektrolyten är, desto mer komprimeras det diffusa skiktet, desto lägre blir -potentialen och därför desto snabbare börjar koaguleringsprocessen. Vid en viss elektrolytkoncentration kommer nästan alla motjoner att gå in i adsorptionsskiktet, granulladdningen kommer att sjunka till noll och koaguleringen kommer att fortgå med maximal hastighet, eftersom frånvaron av ett diffust skikt kommer att orsaka en signifikant minskning av kiltrycket.
Den koagulerande effekten av elektrolyter är inte begränsad till komprimering av det diffusa skiktet, samtidigt sker selektiv adsorption på den kolloidala partikeln av de elektrolytjoner som har en laddning motsatt granulen. Ju högre jonens laddning är, desto mer intensivt adsorberas den. Ansamlingen av joner i det adsorberade skiktet åtföljs av en minskning inte bara av -potentialen utan även i det diffusa skiktet.
Av allt ovanstående bör man inte dra slutsatsen att huvudorsaken till koagulering är uppnåendet av någon konstant kritisk -potential för alla fall. Forskning har visat att den koagulerande effekten av elektrolyter inte så mycket ligger i den direkta minskningen av repulsiva krafter mellan kolloidala partiklar genom en minskning av -potentialen, utan snarare i det faktum att en förändring i strukturen av det dubbla elektriska lagret och kompression av dess diffusa del medför en minskning av sönderdelningseffekten av hydrat (solvat) skal av diffusa joner som separerar kolloidala partiklar.
9. I vissa fall, när elektrolyter med mångfaldigt laddade joner läggs till soler, vars laddning är motsatt i tecken till laddningen av kolloidala partiklar, inte koagulering, utan stabilisering av solen och en förändring av tecknet för x-potentialen. observeras. Detta fenomen kallas i kolloidkemi ladda omsols. Sålunda, när små mängder järnklorid FeCl3 tillsätts till en platinasol, observeras en minskning av den negativa laddningen av kolloidala platinapartiklar och deras koagulering. En ytterligare ökning av FeCl3-koncentrationen leder till omladdning av kolloidala platinapartiklar; de får en positiv laddning.
Under laddningsprocessen genomgår platinasolen följande förändringar: negativt laddad sol - ingen koagulering; laddningen är noll - koagulering; positivt laddad sol - ingen koagulering; laddningen är noll - koagulering, etc. Denna växling av tillstånd av elektrisk neutralitet och laddning av partiklar kallas växling av koagulationszoner.
Fenomenet med återladdning av kolloidala miceller av en platinasol under inverkan av FeCl3 är tydligt synligt i kurvan för x-potentialförändring (Fig. 11).
10. Eftersom koagulering av någon sol inte sker omedelbart, utan kräver en viss tid, uppstod frågan om koaguleringsprocessens hastighet. Koaguleringsprocessens förlopp över tid kan observeras genom förändringar i egenskaperna hos den kolloidala lösningen, till exempel genom förändringar i färg, ökad grumlighet etc.
Flera studier har visat att den mest tillförlitliga metoden för att observera koaguleringsprocessen över tid är metoden att räkna antalet partiklar under en viss tidsperiod i ett ultramikroskop. Enligt teorin om koagulering av soler anses början av koagulering vara kontakten mellan två kolloidala partiklar och deras vidhäftning till ett aggregat. Dessa dubblerade partiklar, som utför Brownska rörelser och möter andra identiska eller enstaka partiklar, kan bilda trippel-, fyrdubbla, etc. partiklar - ända fram till början av sedimentationen. Skillnaden från kemiska reaktioner ur kinetikens synvinkel är att i fallet med en konventionell kemisk reaktion deltar inte de reagerade molekylerna ytterligare i reaktionen, och kolloidala partiklar, som klibbar ihop vid kollision, fortsätter att delta i koaguleringsprocessen bildar allt mer komplexa komplex.
I början av koaguleringen fortgår bildningen av dubbla, tredubblade, etc. partiklar obemärkt och långsammare, sedan när koncentrationen av den koagulerande elektrolyten ökar, ökar koagulationshastigheten avsevärt. Därmed skiljer man mellan långsam och snabb koagulering. Dessa begrepp bör inte förväxlas med begreppen latent och uppenbar koagulering.
Kurvan för förändringar i solens koaguleringshastighet beroende på elektrolytens koncentration (fig. 12) förklarar väl dessa begrepp och deras samband med andra kvantiteter som kännetecknar koagulationsförloppet.
Processerna för långsam koagulering är mycket dåligt studerade för närvarande. Man tror att den långsamma förekomsten av koaguleringsprocessen beror på det faktum att endast ett mycket litet antal kollisioner av kolloidala partiklar leder till att de klibbar ihop (aggregation). Det har konstaterats att endast de partiklar vars x-potential har minskat till ett kritiskt värde av någon anledning, eller partiklar som har hög hastighet och vid kollision faller in i en sfär av ömsesidig attraktion, håller ihop.
Processerna för snabb koagulering har studerats mycket bättre. Med snabb koagulering leder varje kollision av kolloidala partiklar till deras sammansmältning (förening). Baserat på dessa idéer härledde M. Smoluchowski en ekvation som karakteriserar hastigheten för snabb koagulering:
11. Typiska hydrofoba soler koagulerar lätt när små mängder elektrolyter tillsätts till dem. Lösningar av föreningar med hög molekylvikt är tvärtom mycket resistenta mot elektrolyternas koagulerande effekt. Många studier har funnit att spirallösningar, när de tillsätts till hydrofoba soler, ger dem ökat motstånd mot elektrolyter. Således, om en liten mängd gelatin tillsätts till en guldsol, blir guldhydrosolen mer stabil. Med tillsats av elektrolyter, även i kvantiteter som avsevärt överstiger koagulationströskeln, såväl som under långvarig stående, upplever denna sol praktiskt taget inga förändringar. Om denna sol förångas, då den torra beredningen blandas med vatten, bildas en kolloidal lösning igen. Således verkade en typisk hydrofob guldsol, när gelatin sattes till den, förvärva egenskaperna hos en hydrofil sol och blev reversibel. Detta fenomen kallas skyddsåtgärd eller bara skydd, och själva ämnena som ökar stabiliteten hos hydrofoba soler kallas skyddande. Som regel har högmolekylära ämnen av lyofil natur en skyddande effekt.
Forskning har visat att graden av skyddande effekt av IUD-lösningar beror på naturen hos den lösta polymeren och naturen hos den hydrofoba sol som skyddas. Ett kvantitativt mått på den skyddande effekten av spirallösningar är guld-, rubin- och järntalet. Det mest använda är det enklare och mer lättillgängliga järntalet, som kan definieras som det minsta antalet milligram av en skyddande högpolymer som kan skydda 10 ml järnhydroxidsol från koaguleringseffekten av 1 ml 0,005 N. Na2SO4-lösning. (Gelatin – 5; stärkelse – 20).
Som studier har visat, observeras den största skyddande effekten när den högmolekylära föreningen och kolloiden laddas med samma namn, eftersom de annars neutraliserar laddningen ömsesidigt, och stabiliteten hos det stora kombinerade komplexet minskar naturligt.
Mekanismen för den skyddande verkan förklaras ganska väl av Zsigmondys teori, som är baserad på idén om adsorptionsinteraktion mellan partiklar av de skyddade och skyddande solerna. En större partikel av en hydrofob sol adsorberar mindre BMC-makromolekyler med sina solvatiseringsskal på sin yta, och som ett resultat får den lyofila egenskaper. I detta fall är kolloidala miceller av en irreversibel hydrofob sol skyddade från direkt kontakt med varandra och därför från aggregation, både när det gäller verkan av en elektrolytkoagulator på en sådan sol, och i fallet med att koncentrera solen. . I fig. Fig. 13a, b visar ett diagram över en sådan skyddsåtgärd.
I vissa fall leder tillsatsen av mycket små mängder högpolymer till en hydrofob sol till det raka motsatta resultatet: solens stabilitet minskar kraftigt. Detta fenomen kallas sensibilisering eller astabilisering kolloidal lösning. Enligt teorin av P. N. Peskova och L. D. Landau sker en stabilisering när en skyddande högpolymer tillsätts till en hydrofob sol i små mängder som ligger under gränsvärdet för dess skyddande verkan, dvs under skyddstalet. Med andra ord uppstår en stabilisering när det inte finns tillräckligt med högpolymerpartiklar för att täcka och skydda hela ytan av de kolloidala partiklarna av en hydrofob sol, men det finns tillräckligt med dem för att ta bort stabiliserande joner från den senare genom adsorption. I fig. 10c, c visar ett diagram över en astabiliserad kolloidal partikel. Astabilisering uppnås enklast om båda typerna av partiklar laddas olika.
12. Ofta kan koaguleringsprodukten från hydrofoba soler - ett sediment eller koagel - återföras till suspension genom att behandla den med en viss elektrolyt. Således kan en koagulerad järnhydroxidsol återföras till sitt ursprungliga tillstånd om Fe(OH)3-fällningen behandlas med en vattenlösning av järnklorid. Processen för övergång av sediment till ett suspenderat tillstånd under påverkan av yttre faktorer kallas peptisering.
Ämnen som främjar övergången av koagel till sol kallas peptizers. Vanligtvis är peptiseringsmedel elektrolyter, eller snarare en av jonerna. Men i vissa fall kan icke-elektrolyter, såsom ett lösningsmedel, också ha en peptiserande effekt.
Själva peptiseringsprocessen bestäms huvudsakligen av adsorptionsfenomen, som ett resultat av vilka inte bara en ökning av x-potentialen för dispergerade partiklar inträffar, utan också en ökning av graden av deras solvatisering (hydratisering). Tillförseln av en laddning till de koagulerade partiklarna av den dispergerade fasen av solen främjar å ena sidan den allmänna uppluckringen av sedimentet och å andra sidan överföringen av dessa partiklar till ett suspenderat tillstånd på grund av Brownsk rörelse. I detta fall bildas solvatiseringsskal runt de dispergerade partiklarna, vilket ger deras kileffekt.
Liksom koagulering påverkar inte peptisering av hydrofoba soler de djupa massorna av den kolloidala kärnan. Dessa processer sker i de tunnaste skikten vid gränsytan, så peptisering kräver små mängder elektrolyter jämfört med mängden sediment som omvandlas till ett soltillstånd (Figur 14).
|
|
Så om du tar samma mängd koaguleringsmedel och peptiserar det med olika mängder peptiseringsmedel, sker endast dess adsorption vid små mängder utan att fällningen löses upp (kurva OA, fig. 14); med en ytterligare ökning av koncentrationen av peptiseringsmedel medel, ökar också lösligheten (kurva AB). Om du fortsätter att öka mängden peptizer, når lösligheten, snabbt ökande, en viss gräns och beror inte längre på mängden peptizer (kurvorna BC och CD). Med ett stort överskott av peptizer kan koagulering uppstå (DE-kurva). OD-kurvan vi undersökte ger en typisk bild av adsorptionspeptisering. |
Förutom adsorption förekommer även upplösningspeptisering. Denna typ av peptisering omfattar alla fall där peptiseringsprocessen är förknippad med kemisk reaktion ytbelägna molekyler av kolloidala miceller.
Med en konstant mängd peptizer och en ökande mängd koagel ökar först peptiserbarheten för den senare, når ett maximum och minskar sedan. Detta mönster, etablerat av V. Ostwald och A. Butsag, kallades sedimentregeln.
Gerasimenko Evgenia
Denna presentation ägnas åt en beskrivning av Tyndall-effekten och dess praktiska tillämpning.
Ladda ner:
Förhandsvisning:
För att använda presentationsförhandsvisningar, skapa ett Google-konto och logga in på det: https://accounts.google.com
Bildtexter:
Slutförd av: 11:e klass "B"-elev Evgeniya Gerasimenko Kontrolleras av: kemilärare T.I. Yurkina 2012/2013 akademiskt år Tyndall effekt
John Tyndall irländsk fysiker och ingenjör. Född i Leighlin Bridge, County Carlow. Efter gymnasiet arbetade han som topograf och lantmätare i militära organisationer och med byggande av järnvägar. Samtidigt tog han examen från Mechanical Institute i Preston. Avskedad från den militära geodetiska tjänsten för att ha protesterat mot dåliga arbetsförhållanden. Han undervisade vid Queenwood College (Hampshire), samtidigt som han fortsatte sin självutbildning. Åren 1848–51 deltog i föreläsningar vid universiteten i Marburg och Berlin. När han återvände till England blev han lärare och sedan professor vid Royal Institution i London. Forskarens huvudsakliga arbeten ägnas åt magnetism, akustik, absorption av termisk strålning av gaser och ångor och ljusspridning i grumliga medier. Han studerade strukturen och rörelsen av glaciärer i Alperna. Tyndall var extremt passionerad över idén om att popularisera vetenskapen. Han höll regelbundet offentliga föreläsningar, ofta i form av kostnadsfria föreläsningar för alla: för arbetare på fabriksgårdar under lunchrasterna, julföreläsningar för barn på Kungl. Tyndalls berömmelse som populariserare nådde även andra sidan Atlanten - hela upplagan av den amerikanska upplagan av hans bok Fragments of Science såldes slut på en dag. Han dog en absurd död 1893: medan forskarens fru (som överlevde honom med 47 år) när hon förberedde middagen använde av misstag ett av de kemiska reagenserna som förvarades i köket istället för bordssalt.
Beskrivning av Tyndall-effekten - glöden från ett optiskt inhomogent medium på grund av spridningen av ljus som passerar genom det. Det orsakas av diffraktionen av ljus på enskilda partiklar eller element av strukturell heterogenitet hos mediet, vars storlek är mycket mindre än våglängden för det spridda ljuset. Karakteristiskt för kolloidala system (till exempel hydrosoler, tobaksrök) med en låg koncentration av dispergerade faspartiklar med ett brytningsindex som skiljer sig från dispersionsmediets brytningsindex. Normalt observeras som en ljuskon på mörk bakgrund (Tyndall-kon) när en fokuserad ljusstråle passeras från sidan genom en glaskyvett med planparallella väggar fyllda med en kolloidal lösning. Den kortvågiga komponenten av vitt (icke-monokromatiskt) ljus sprids av kolloidala partiklar starkare än den långvågiga komponenten, därför har Tyndall-konen som bildas av den i en icke-absorberande aska en blå nyans. Tyndall-effekten är i huvudsak densamma som opalescens. Men traditionellt hänvisar den första termen till den intensiva spridningen av ljus i ett begränsat utrymme längs strålens väg, och den andra till den svaga spridningen av ljus av hela volymen av det observerade objektet.
Tyndall-effekten uppfattas av blotta ögat som en enhetlig glöd av någon del av volymen av ett ljusspridande system. Ljus kommer från enskilda punkter - diffraktionsfläckar, tydligt synliga under optiskt mikroskop under tillräckligt stark belysning av den utspädda solen. Intensiteten av ljus som sprids i en given riktning (vid konstanta parametrar för det infallande ljuset) beror på antalet spridande partiklar och deras storlek.
Tidsegenskaper Initieringstid (log till -12 till -6); Livstid (log tc från -12 till 15); Nedbrytningstid (log td från -12 till -6); Tid för optimal utveckling (log tk från -9 till -7). Tekniskt genomförande effekt Effekten kan lätt observeras när du passerar ett ljus helium-neon laser genom en kolloidal lösning (helt enkelt ofärgad stärkelsegelé). Diagram
Tillämpning av effekten Metoder baserade på Tyndall-effekten för att detektera, bestämma storleken och koncentrationen av kolloidala partiklar (ultramikroskopi, nefelometri används ofta i vetenskaplig forskning och industriell praxis).
Exempel. Ultramikroskop. Ett ultramikroskop är ett optiskt instrument för att detektera små (kolloidala) partiklar vars storlekar är mindre än upplösningsgränsen för konventionella ljusmikroskop. Förmågan att detektera sådana partiklar med hjälp av ett ultramikroskop beror på ljusets diffraktion av Tyndall-effekten. Under stark sidobelysning markeras varje partikel i ultramikroskopet av observatören som en ljus punkt (ljusdiffraktionsfläck) på en mörk bakgrund. På grund av diffraktion på de minsta partiklarna finns det väldigt lite ljus, så i ett ultramikroskop används som regel starka ljuskällor. Beroende på belysningsintensiteten, ljusvågens längd, skillnaden i brytningsindex för partikeln och mediet, kan partiklar som sträcker sig i storlek från 20-50 nm till 1-5 mikron detekteras. Det är omöjligt att bestämma den verkliga storleken, formen och strukturen av partiklar från diffraktionsfläckar. Ett ultramikroskop ger inte optiska bilder av föremålen som studeras. Men med hjälp av ett ultramikroskop är det möjligt att bestämma närvaron och den numeriska koncentrationen av partiklar, studera deras rörelser och även beräkna den genomsnittliga partikelstorleken om deras viktkoncentration och densitet är kända. I schemat för ett slitsultramikroskop (fig. 1a) är systemet som studeras orörligt.
I schemat med ett slitsultramikroskop är systemet som studeras orörligt. Schematiskt diagram av ett spaltmikroskop. Kyvett 5 med föremålet som studeras belyses av ljuskälla 1 (2 - kondensator, 4 - belysningslins) genom en smal rektangulär slits 3, vars bild projiceras in i observationszonen. Genom okularet på observationsmikroskopet 6 är lysande punkter av partiklar belägna i spaltens bildplan synliga. Ovanför och under det upplysta området detekteras inte närvaron av partiklar.
I ett flödesultramikroskop rör sig partiklarna som studeras genom röret mot betraktarens öga. Schematisk bild av ett flödesmikroskop När de korsar belysningszonen registreras de som ljusa blixtar visuellt eller med hjälp av en fotometrisk anordning. Genom att justera ljusstyrkan för belysningen av de observerade partiklarna med en rörlig fotometrisk kil 7, är det möjligt att för registrering välja partiklar vars storlek överstiger en specificerad gräns. Med hjälp av ett modernt flödesultramikroskop med en laserljuskälla och ett optiskt-elektroniskt partikeldetektionssystem bestäms koncentrationen av partiklar i aerosoler i intervallet från 1 till 109 partiklar per 1 cm3, och partikelstorleksfördelningsfunktioner finns också. Ultramikroskop används i studien av dispergerade system för att kontrollera renheten hos atmosfärisk luft. Vatten, grad av kontaminering av optiskt transparenta medier med främmande inneslutningar.
Litteratur som används 1. Fysik. Stor encyklopedisk ordbok - M.: Bolshaya Rysk uppslagsverk, 1999.- S.90, 460. 2. New Polytechnic Dictionary.- M.: Big Russian Encyclopedia, 2000.- S.20, 231, 460. Nyckelord lyser optiskt inhomogena tvåfas medium ljusspridande spridd medium
***Ett äpple föll på Newton, kineserna beundrade dropparna på lotusblommor, och John Tyndall, som förmodligen gick genom skogen, lade märke till en ljuskon. Saga? Kanske. Men det är för att hedra den sista hjälten som en av de vackraste effekterna i vår värld heter - Tyndall-effekten...***
Ljusspridning är en av de generella egenskaper mycket spridda system.
Med sidobelysning sprida systemet ett karakteristiskt skimrande, vanligtvis blåaktigt, sken observeras, särskilt tydligt mot en mörk bakgrund.
Denna egenskap, associerad med spridningen av ljus av partiklar i den dispergerade fasen, kallas opalescens, från namnet opal - opalus (latin), ett genomskinligt mineral av blåaktig eller gulaktig-vit färg. 1868 upptäckte han att när en kolloidal lösning belyses från sidan med en ljusstråle från en stark källa, observeras en ljus, likformigt lysande kon - Tyndall kon, eller Tyndall effekt, medan i fallet med en lösning med låg molekylvikt, verkar vätskan vara optiskt tom, dvs. spåret av strålen är osynlig.
till vänster är en 1% stärkelselösning, till höger är vatten.
Tyndall-effekten uppstår vid spridning på suspenderade partiklar vars dimensioner överstiger atomernas dimensioner tiotals gånger. När suspensionspartiklar förstoras till storlekar av storleksordningen 1/20 av ljusets våglängd (från cirka 25 nm och över), blir spridningen polykromatisk, det vill säga ljuset börjar spridas jämnt över hela det synliga färgintervallet från violett till rött . Som ett resultat försvinner Tyndall-effekten. Det är därför tät dimma eller cumulusmoln verkar vita för oss - de består av en tät suspension av vattendamm med partikeldiametrar som sträcker sig från mikron till millimeter, vilket är långt över Tyndalls spridningströskel.
Du kanske tror att himlen verkar blå för oss på grund av Tyndall-effekten, men så är det inte. I frånvaro av moln eller rök blir himlen blå på grund av spridningen av "dagsljus" av luftmolekyler. Denna typ av spridning kallas Rayleigh-spridning (efter Sir Rayleigh). I Rayleigh-spridning sprids blått och cyanljus ännu mer än i Tyndall-effekten: till exempel sprids blått ljus med en våglängd på 400 nm i ren luft nio gånger starkare än rött ljus med en våglängd på 700 nm. Det är därför himlen ser blå ut för oss - solljuset är spritt över hela spektralområdet, men i den blå delen av spektrat är det nästan en storleksordning starkare än i det röda. Ultravioletta strålar som orsakar solning sprids ännu starkare. Det är därför solbrännan fördelas ganska jämnt över kroppen och täcker även de områden på huden som inte utsätts för direkt solljus.
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0