- Обозначение - Zn (Zincum);
- Период - IV;
- Группа - 12 (IIb);
- Атомная масса - 65,39;
- Атомный номер - 30;
- Радиус атома = 138 пм;
- Ковалентный радиус = 125 пм;
- Распределение электронов - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ;
- t плавления = 419,88°C;
- t кипения = 907°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,65/1,66;
- Степень окисления: +2, 0;
- Плотность (н. у.) = 7,13 г/см 3 ;
- Молярный объем = 9,2 см 3 /моль.
Цинк люди использовали еще до нашей эры в виде его сплава с медью - латуни. Впервые чистый цинк удалось выделить англичанину Уильяму Чемпиону в 18 веке.
В земной коре цинка содержится 8,3·10 -3 % по массе. Много цинка содержится в термальных источниках, из которых происходит осаждение сульфидов цинка, имеющих важное промышленное значение. Цинк играет активную роль в жизни животных и растений, являясь важным биогенным микроэлементом.

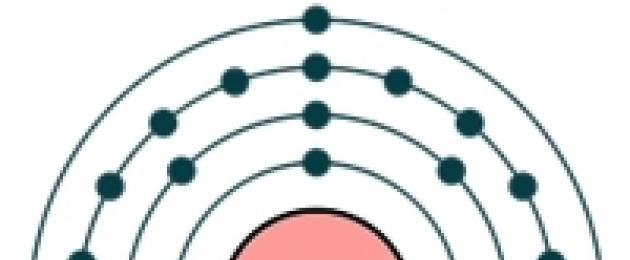
Рис. Строение атома цинка
.
Электронная конфигурация атома цинка - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 (см. Электронная структура атомов). Предпоследний электронный слой атома цинка полностью заполнен, а на внешнем слое находится два s-электрона, которые и взаимодействуют с другими элементами, поэтому в соединениях цинк проявляется степень окисления +2. (см. Валентность). Цинк обладает высокой химической активностью.
Физические свойства цинка:
- голубовато-белый металл;
- хрупкий при н. у.;
- при нагревании более 100°C хорошо куется и прокатывается;
- обладает хорошей тепло- и электропроводностью.
Химические свойства цинка:
- на воздухе быстро окисляется, покрываясь тонкой пленкой оксида цинка, предохраняющей металл от дальнейшей реакции;
- при нагревании реагирует с кислородом, хлором, серой, образуя оксиды, хлориды, сульфиды соответственно:
2Zn + O 2 = 2ZnO; Zn + Cl 2 = ZnCl 2 ; Zn + S = ZnS. - реагирует с разбавленной серной кислотой и растворами кислот неокислителей, вытесняя из них водород:
Zn + H 2 SO 4(рзб.) = ZnSO 4 + H 2 ; Zn + 2HCl = ZnCl 2 + H 2 ; - реагирует с азотной и концентрированной серной кислотой, восстанавливая азот или серу соответственно:
Zn + H 2 SO 4(кнц.) = ZnSO 4 + SO 2 + 2H 2 O; - реагирует при нагревании с растворами щелочей, образуя гидроцинкаты: Zn + 2NaOH + 2H 2 O = Na 2 + H 2 ;
- вытесняет менее активные металлы (см. электрохимический ряд напряжений металлов) из растворов их солей: Zn + CuCl 2 = ZnCl 2 + Cu.
Получение цинка:
- чистый цинк получают электролизом его солей;
- промышленным способом цинк получают из сульфидных руд:
- на первом этапе получают оксид цинка, подвергая руду окислительному обжигу: 2ZnS + 3O 2 = 2ZnO + 2SO 2 ;
- на втором этапе оксид цинка восстанавливают углем при высокой температуре: ZnO + C = Zn + CO.
Применение цинка:
- в качестве антикоррозионного покрытия металлических изделий (цинкование);
- для изготовления сплавов, широко применяющихся в машиностроении;
- в АКБ и сухих элементах;
- в лакокрасочной промышленности (изготовление цинковых белил);
- как восстановитель в реакциях органического синтеза.
Располагается во второй группе, побочной подгруппе периодической системы Менделеева и является переходным металлом. Порядковый номер элемента - 30, масса - 65,37. Электронная конфигурация внешнего слоя атома - 4s2. Единственная и постоянная равна «+2». Для переходных металлов характерно образование комплексных соединений, в которых они выступают в качестве комплексообразователя с разными координационными числами. Это относится и к цинку. Существует 5 устойчивых в природе изотопов с массовыми числами от 64 до 70. При этом изотоп 65Zn является радиоактивным, период его полураспада составляет 244 дня.
Цинк - это серебристо-голубой металл, который на воздухе быстро покрывается защитной оксидной пленкой, скрывающей его блеск. При удалении оксидной пленки цинк проявляет свойства металлов - сияние и характерный яркий блеск. В природе цинк содержится в составе многих минералов и руд. Самые распространенные: клейофан, цинковая обманка (сфалерит), вюрцит, марматит, каламин, смитсонит, виллемит, цинкит, франклинит.
 Смитсонит
Смитсонит
В составе смешанных руд цинк встречается со своими постоянными спутниками: таллием, германием, индием, галлием, кадмием. В земной коре содержится 0,0076% цинка, а 0,07 мг/л этого металла содержится в морской воде в виде солей. Формула цинка как простого вещества - Zn, химическая связь - металлическая. У цинка гексагональная плотная кристаллическая решетка.
Физические и химические свойства цинка
Температура плавления цинка - 420 °С. При нормальных условиях это хрупкий металл. При нагревании до 100-150 °С ковкость и пластичность цинка повышается, возможно изготовление из металла проволоки и прокатка фольги. Температура кипения цинка - 906 °С. Этот металл - отличный проводник. Начиная от 200 °С, цинк легко растирается в серый порошок и теряет пластичность. У металла хорошая теплопроводность и теплоемкость. Описанные физические параметры позволяют использовать цинк в соединениях с другими элементами. Латунь - наиболее известный сплав цинка.
 Духовые инструменты из латуни
Духовые инструменты из латуни
При обычных условиях поверхность цинка мгновенно покрывается оксидом в виде серо-белого тусклого налета. Он образуется из-за того, что кислород воздуха окисляет чистое вещество. Цинк как простое вещество реагирует с халькогенами, галогенами, кислородом, щелочами, кислотами, аммонием (его солями), . Цинк не взаимодействует с азотом, водородом, бором, углеродом и кремнием. Химически чистый цинк не реагирует с растворами кислот и щелочей. - металл амфотерный, и при реакциях со щелочами образует комплексные соединения - гидроксоцинкаты. Нажмите , чтобы узнать, какие опыты на изучение свойств цинка можно провести дома.
Реакция серной кислоты с цинком и получение водорода
Взаимодействие разбавленной серной кислоты с цинком - основной лабораторный способ получения водорода. Для этого используется чистый зерненый (гранулированный) цинк либо технический цинк в виде обрезков и стружек.
Если взяты очень чистые цинк и серная кислота, то водород выделяется медленно, особенно в начале реакции. Поэтому к остывшему после разбавления раствору иногда добавляют немного раствора медного купороса. Осевшая на поверхности цинка металлическая медь ускоряет реакцию. Оптимальный способ разбавить кислоту для получения водорода - разбавить водой концентрированную серную кислоту плотностью 1,19 в соотношении 1:1.
Реакция концентрированной серной кислоты с цинком

В концентрированной серной кислоте окислителем является не катион водорода, а более сильный окислитель - сульфат-ион. Он не проявляет себя как окислитель в разбавленной серной кислоте из-за сильной гидратации, и, как следствие, малоподвижности.
То, как концентрированная серная кислота будет реагировать с цинком, зависит от температуры и концентрации. Уравнения реакций:
Zn + 2H₂SO₄ = ZnSO₄ + SO₂ + 2H₂O
3Zn + 4H₂SO₄ = 3ZnSO₄ + S + 4H₂O
4Zn + 5H₂SO₄ = 4ZnSO₄ + H₂S + 4H₂O
Концентрированная серная кислота является сильным окислителем благодаря степени окисления серы (S⁺⁶). Она взаимодействует даже с малоактивными металлами, то есть с металлами до и после водорода, и, в отличие от разбавленной кислоты, никогда не выделяет водород при этих реакциях. В реакциях концентрированной серной кислоты с металлами всегда образуются три продукта: соль, вода и продукт восстановления серы. Концентрированная серная кислота - это такой сильный окислитель, что окисляет даже некоторые неметаллы (уголь, серу, фосфор).
1. Цинк взаимодействует с раствором
1) CuSO 4 2) MgCl 2 3) Na 2 SO 4 4) CaCl 2
2. Какой оксид реагирует с раствором НСl, но не реагирует с раствором NaOH?
1) CO 2) SO 3 3) P 2 O 5 4) MgO
3. При взаимодействии концентрированной серной кислоты с медью при нагревании образуется
1) сера 2) водород 3) оксид серы (IV) 4) оксид серы (VI)
4. В схеме превращений P 2 O 5 → X 1 → X 2 Ca 3 (PO 4) 2 веществами «X 1 » и «X 2 » являются соответственно
1) PH 3 и CaСO 3 2) H 3 PO 4 и NaOH 3) K 3 PO 4 и CaCl 2 4) Н 3 PO 3 и CaO
5. Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит.
6. Установите соответствие между реагирующими веществами и продуктами реакции.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ | ||
| HCl + KHSO 3 → HCl + K 2 SO 3 → HCl + KHS → HCl + K 2 S → | KCl + H 2 S KCl + H 2 S + H 2 O KCl + SO 2 + H 2 O KCl + H 2 SO 4 KCl + H 2 SO 4 + H 2 O KCl + SO 3 + H 2 O | ||
| А | Б | В | Г |
7. Даны вещества: хлор, гидросульфид натрия, гидроксид калия (раствор), железо.
Напишите уравнения четырёх
8. Среди перечисленных веществ:
А) NaHCO 3 Б) HCOOK В) (NH 4) 2 SO 4 Г) KHSO 3 Д) Na 2 HPO 4 Е) Na 3 PO 4
кислыми солями являются
1) АГД 2) АВЕ 3) БДЕ 4) ВДЕ
9. Щёлочь образуется при взаимодействии воды с
1) алюминием 2) цинком 3) кальцием 4) железом
10. Реакция возможна между
1) H 2 O и ВаО 2) SiO 2 и H 2 O 3) P 2 O 3 и SО 2 4) CO 2 и N 2
№ 31. ФИПИ - ЕГЭ: открытый банк заданий, 2015.
II. Неорганическая химия
1. С соляной кислотой реагирует каждый из двух металлов:
1) Al и Pt 2) Zn и Fe 3) Cr и Au 4) Mg и Hg
2. В схеме превращений S → X1 → X2→ CuS веществами «Х 1 » и «Х 2 » могут быть соответственно
1) H 2 S и SO 2 2) SO 2 и Н 2 SO 4 3) H 2 S и S 4) SO 2 и FeS 2
3. Установите соответствие между реагирующими веществами и продуктами реакции.
4. Даны вещества: оксид азота(IV), медь, раствор гидроксида калия и концентрированная серная кислота. Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
5. Среди перечисленных веществ:
А) Na 2 O Б) СrO 3 В) Al 2 O 3 Г) SiO 2 Д) MgO Е) P 2 O 5
к кислотным оксидам относятся
1) АВД 2) БГЕ 3) БВД 4) ГДЕ
6. Водород образуется при взаимодействии
1) Cu и HNO 3 (р-р) 2) Zn и HCl (р-р) 3) Cu и H 2 SO 4 (конц.) 4) Hg и H 2 SO 4 (конц.)
Химические свойства
Внешняя электронная конфигурация атома Zn 3d 10 4s 2 . Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Цинк как активный металл и энергичный восстановитель. На воздухе при температуре до 100 °С Цинк быстро тускнеет, покрываясь поверхностной пленкой основных карбонатов. На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO.
2Zn + O 2 = 2ZnO
Сухие фтор, хлор и бром не взаимодействуют с Цинком на холоду, но в присутствии паров воды металл может воспламениться, образуя, например, ZnCl 2 . Нагретая смесь порошка цинка с серой дает сульфид цинк ZnS. Сульфид цинк выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Гидрид ZnH 2 получается при взаимодействии LiАlН 4 с Zn(CH 3) 2 и других соединениями цинка; металлоподобное вещество, разлагающееся при нагревании на элементы.
Нитрид Zn 3 N 2 - черный порошок, образуется при нагревании до 600 °С в токе аммиака; на воздухе устойчив до 750 °С, вода его разлагает. Карбид цинка ZnC 2 получен при нагревании цинка в токе ацетилена. Сильные минеральные кислоты энергично растворяют цинк, особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленной НCl и H 2 SO 4 выделяется Н 2 , а с НNО 3 - кроме того, NO, NO 2 , NH 3 . С концентрированной НCl, H 2 SO 4 и HNO 3 Цинк реагирует, выделяя соответственно Н 2 , SO 2 , NO и NO 2 . Растворы и расплавы щелочей окисляют цинк с выделением Н 2 и образованием растворимых в воде цинкитов. Интенсивность действия кислот и щелочей на цинк зависит от наличия в нем примесей. Чистый цинк менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нем водорода. В воде соли Цинка при нагревании гидролизуются, выделяя белый осадок гидрооксида Zn(OH) 2 . Известны комплексные соединения, содержащие Цинк, например SО 4 и другие.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO 3 = Zn(NO 3) 2 + H 2 O
так и щелочами:
ZnO + 2NaOH (сплавление)= Na 2 ZnO 2 + Н 2 О
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl 2 + H2
Zn + H 2 SO 4 = ZnSO 4 + H 2
и растворами щелочей:
Zn + 2NaOH + 2H 2 O = Na 2 + H 2
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO 4 .
При нагревании цинк взаимодействуют с неметаллами (кроме водорода, углерода и азота). Активно реагирует с кислотами:
Zn + H 2 SO 4 (разб.) = ZnSO 4 + H 2
Цинк – единственный элемент группы, который растворяется в водных растворах щелочей с образованием ионов 2– (гидроксоцинкатов):
Zn + 2OH – + 2H 2 O = 2– + H 2
При растворении металлического цинка в растворе аммиака образуется аммиачный комплекс:
Zn + 4NH 3 ·H 2 O = (OH) 2 + 2H 2 O + H 2
Химия...Проверьте правильно ли я рассуждаю... и получил лучший ответ
Ответ от Надежда Лютова[гуру]
Нет, рассуждение совершенно неверное. Представленные уравнения реакций тоже. По легкости отдачи электронов металлы располагаются в ряду активности. Nа, Са, Мg -,более активны, чем Zn.Поэтому, менее активный металл (Zn) не может вытеснить более активный металл из раствора соли. Значит, реакции 2,3,4-не идут.
Реакция 1 возможна, т. к. Сu- менее активный металл, стоящий справа от водорода в ряду активности. Zn, как более активный металл, вытесняет Сu из растворов солей.
Zn +CuSО4=ZnsО4 +Cu.
Запомни пожалуйста: 1)Каждый металл ряда активности вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей.
2)Чем левее стоит в ряду активности металл, тем больше его восстановительная способность.. .
Ответ от Алексей Галушко
[гуру]
ответ верный, но совершенно бредовые рассуждения (без обид)
Поленциал Cu/Cu(2+) выше чем Zn/Zn(2+), а у кого больше потенциал, тот и окислитель. Будет такая реакция:
CuSO4 + Zn = ZnSO4 + Cu