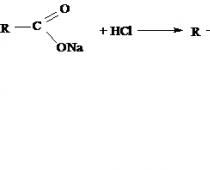
(по материалам сайта http://chemel.ru/2008-05-24-19-19-34/2008-06-01-15-23-43/18-2008-05-29-22-08-32.html)
Известно,
что неметаллы взаимодействуют друг с другом. Рассмотрим механизм возникновения
ковалентной связи на примере образования молекулы водорода:
Н+Н=Н 2 H= - 436кДж/моль
Представим себе, что мы имеем два отдельных изолированных атома водорода. Ядро каждого из свободных атомов водорода окружено сферическим симметричным электронным облаком, образуемым 1s-электроном (см. рис. 1). При сближении атомов до определенного расстояния происходит частичное перекрывание электронных оболочек (орбиталей) (рис. 2).
В результате между центрами обоих ядер возникает
молекулярное двухэлектронное облако, обладающее максимальной электронной
плотностью в пространстве между ядрами; увеличение плотности отрицательного
заряда благоприятствует сильному возрастанию сил притяжения между ядрами и
молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы H 2) это расстояние составляет 0,074 нм (рис. 2).

Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей.
В
результате возникновения химической связи между двумя атомами водорода каждый из
них достигает электронной конфигурации атома благородного газа.
Изображать химические связи принято по-разному:
1) с помощью электронов в виде точек, поставленных у химического знака элемента.
Тогда образование молекулы водорода можно показать схемой:
Н + Н Н:Н
2) с помощью квантовых ячеек (ячеек Гунда), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:

Схема,
расположенная слева, показывает, что молекулярный энергетический уровень ниже
исходных атомных уровней, а значит, молекулярное состояние вещества более
устойчиво, чем атомное.
3) часто, особенно в органической химии, ковалентную связь изображают черточкой (штрихом)
(например Н-Н), которая символизирует пару электронов.
Ковалентная связь в
молекуле хлора также осуществляется с помощью двух общих электронов, или
электронной пары:
Как
видно, каждый атом хлора имеет три неподеленные пары и один неспаренный
электрон.
Образование
химической связи происходит за счет неспаренных электронов каждого атома.
Неспаренные электроны связываются в общую пару электронов, называемую также
общей (поделенной) парой.
Если
между атомами возникла одна ковалентная связь (одна общая электронная пара), то
она называется одинарной; если больше, то кратной (две общие электронные пары),
тройной (три общие электронные пары).
Одинарная
связь изображается одной черточкой (штрихом), двойная - двумя, тройная - тремя.
Черточка между двумя атомами показывает, что у них пара электронов обобщена, в
результате чего и образовалась химическая связь. С помощью таких черточек
изображают последовательность соединения атомов в молекуле.
Итак,
в молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми
электронов (s 2 p 6), причем два из них (электронная пара) в
одинаковой мере принадлежат обоим атомам.
Несколько по-иному изображают связь в молекуле кислорода О 2 . Экспериментально установлено, что кислород является парамагнитным веществом (втягивается в магнитное поле). В его молекуле имеется два неспаренных электрона. Структуру этой молекулы можно изобразить так:
![]()
Однозначное решение об изображении электронной структуры молекулы кислорода еще не найдено. Однако ее нельзя изображать так:
![]()
В молекуле азота N 2 атомы имеют три общие электронные пары:
![]()
Очевидно,
что молекула азота прочнее молекулы кислорода или хлора, чем и обусловлена
значительная инертность азота в химических реакциях.
Химическая связь, осуществляемая электронными парами, называется ковалентной.
Это двухэлектронная и двухцентровая (удерживает два ядра) связь.
Соединения с ковалентной связью называются гомеополярными, или
атомными.
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов.
Примером
являются двухатомные молекулы, состоящие из атомов одного элемента:
Н 2 Cl 2 , О 2 , N 2 , F 2 и др..
в которых электронная пара в одинаковой мере принадлежит обоим атомам.
В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью.
Примером
могут служить молекулы летучих неорганических соединений: НС1, Н 2 О,
H 2 S, NH 3 и др.
Образование
молекулы НС1 можно представить схемой:

Электронная
пара смещена к атому хлора, так как относительная электроотрицательность атома
хлора (2,83) больше, чем атома водорода (2,1).
Ковалентная
связь образуется не только за счет перекрывания одноэлектронных облаков, - это
обменный механизм образования ковалентной связи.
Возможен и
другой механизм образования ковалентной связи - донорно-акцепторный. В этом
случае химическая связь возникает за счет двухэлектронного облака одного атома и
свободной орбитали другого атома. Рассмотрим в качестве примера механизм
образования иона аммония NH +4 . В молекуле аммиака атом азота имеет
неподеленную пару электронов (двухэлектрон-
ное
облако):
У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить так:Н+. При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь.
Процесс образования иона аммония можно представить схемой:

Заряд
иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми
атомами), а двухэлектронное облако (неподеленная электронная пара),
принадлежащее азоту, становится общим с водородом. В схемах изображение ячейки
часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной, или координационной, связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертая N-H-связь в ионе аммония ничем не отличается от остальных связей.
Металлическая
связь
Атомы
большинства металлов на внешнем энергетическом уровне содержат небольшое число
электронов. Так, по одному электрону содержат 16 элементов, по два - 58, по три
- 4 элемента и ни одного - только у Pd. Атомы элементов Ge, Sn и Pb имеют на
внешнем уровне по 4 электрона, Sb и Bi - по 5, Ро - 6, но эти элементы не
являются характерными металлами.
Элементы металлы образуют простые вещества - металлы. В обычных условиях это кристаллические вещества (кроме ртути). На рис. 3 представлена схема кристаллической решетки натрия.
Как
видно, каждый атом натрия окружен восемью соседними. На примере натрия
рассмотрим природу химической связи в металлах.
У атома натрия, как и у других металлов, имеется избыток валентных орбиталей и недостаток электронов.
Так, валентный электрон (3s 1) может занимать одну из девяти свободных орбиталей - 3s (одна), Зр (три) и 3d (пять).
При
сближении
атомов
в результате образования
кристаллической решетки валентные орбитали соседних атомов
перекрываются,
благодаря
чему электроны свободно перемещаются из одной орбитали в другую, осуществляя
связь между всеми атомами кристалла металла. Такой тип химической связи
называется металлической связью.
Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме.
Химическая
связь в металлических кристаллах сильно делокализована, т.е. электроны,
осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему
куску металла, в целом электронейтрального.
Металлическая
связь характерна для металлов в твердом и жидком состоянии. Это свойство
агрегатов атомов, расположенных в непосредственной близости друг к другу. Однако
в парообразном состоянии атомы металлов, как и всех веществ, связаны между собой
ковалентной связью. Пары металлов состоят из отдельных молекул (одноатомных и
двухатомных). Прочность связи в кристалле больше, чем в молекуле металла, а
потому процесс образования металлического кристалла протекает с выделением
энергии.
Металлическая
связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит
обобществление валентных электронов. Однако электроны, которые осуществляют
ковалентную связь, находятся вблизи соединенных атомов и прочно с ними связаны.
Электроны же, осуществляющие металлическую связь, свободно перемещаются по всему
кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной
связью хрупки, а с металлической - пластичны, т.е. они изменяют форму при ударе,
прокатываются в тонкие листы и вытягиваются в проволоку.
Металлической
связью объясняются физические свойства металлов.
Водородная
связь
Водородная
связь - это своеобразная химическая связь. Она может быть межмолекулярной и
внутримолекулярной.
Межмолекулярная
водородная связь возникает между молекулами, в состав которых входят водород и
сильно электроотрицательный элемент - фтор, кислород, азот, реже хлор, сера.
Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к
атому электроотрицательного элемента, а положительный заряд водорода
сконцентрирован в малом объеме, то протон взаимодействует с неподеленной
электронной парой другого атома или иона, обобществляя ее. В результате
образуется вторая, более слабая связь, получившая название водородной.
Ранее
водородную связь сводили к электростатическому притяжению между протоном и
другой полярной группой. Но более правильным следует считать, что в ее
образование вносит вклад и донорно-акцепторное взаимодействие. Для этой связи
характерны направленность в пространстве и насыщаемость.
Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15-20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:

Как видно из этих примеров, посредством водородной связи
объединены две молекулы воды, а в случае уксусной кислоты - две молекулы кислоты
с образованием циклической структуры.
Наличием
водородных связей объясняется более высокая температура кипения воды (100° С) по
сравнению с водородными соединениями элементов подгруппы кислорода (H
2
O
,
H
2
S
,
H
2
Te
). В случае воды надо
затратить дополнительную энергию на разрушение водородных связей.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь .
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY) < E(X) + E(Y)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
В образовании химических связей принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными . Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s- орбитали и 1 на 2p -орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl 4 , H 2 S, CO 2 , NH 3 , SiO 2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH 4 + :
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом , а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом .
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:

Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F − , Cl − , S 2-), а также между простыми катионами и сложными анионами (NO 3 − , SO 4 2- , PO 4 3- , OH −). Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М 0 — ne − = M n + , где М 0 – нейтральный атом металла, а M n + катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
В которой один из атомов отдавал электрон и становился катионом , а другой атом принимал электрон и становился анионом .
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов . Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары» . Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H 2 + .
Молекулярный ион водорода H 2 + содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H 2 +). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α 0 =0,53 А и является центром симметрии молекулярного иона водорода H 2 + .
Энциклопедичный YouTube
-
1 / 5
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома .
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО . Обобществлённые электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение - взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы ».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени .
Образование связи по донорно-акцепторному механизму
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм - взаимодействие разноименно заряженных ионов - протона H + и отрицательного иона водорода H - , называемого гидрид-ионом :
H + + H - → H 2
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным .
H + + H 2 O → H 3 O +
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот .
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония :
NH 3 + H + → NH 4 +
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений , в состав которого входят аммониевые , оксониевые, фосфониевые, сульфониевые и другие соединения .
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H 3 + :
H 2 + H + → H 3 +
Связывающая электронная пара молекулярного иона водорода H 3 + принадлежит одновременно трём протонам.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь . Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью . Такую связь имеют простые вещества , например: 2 , 2 , 2 . Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
- Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами , то такое соединение называется ковалентной полярной связью .
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π {\displaystyle \pi } -связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π {\displaystyle \pi } -связи между этими же атомами углерода. Две π {\displaystyle \pi } -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π {\displaystyle \pi } -связи, а единая π {\displaystyle \pi } диэлектрики или полупроводники . Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями) могут служить
Ковалентная связь Механизм образования по Льюису.
Cвязь между атомами возникает при перекрывании их атомных орбиталей с образованием молекулярных орбиталей (МО). Различают два механизма образования ковалентной связи.
ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону:
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора: \\
Характеристики ковалентной связи не зависят от механизма ее образования.
Свойства ковалентной связи: насыщаемость, направленность, гибридизация, кратность.
Особенностями ковалентной связи являются ее направленность и насыщаемость. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах. Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешней оболочках, которые могут участвовать в образовании ковалентной связи.
Свойства КС:
1. Прочность КС – это свойства характер длинной связи (межъядерное пространство) и энергии энергией связи.
2. Полярность КС . В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью.
Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью .
3. Насыщаемость КС – это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.
4. Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол.
5. Гибридизация КС – при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp, sp 2 , sp 3 – гибридизация. sp – форма молекулы линейная (угол 180 0), sp 2 – форма молекулы плоская треугольная (угол 120 0), sp 3 - форма тетраэдрическая (угол 109 0 28).
6. Кратность КС или делоколизация связи – Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия.
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов.
Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ) невозможен. В этом случае для выполнения необходимо объединение электронов.
В качестве примера обсудим взаимодействие атомов водорода и хлора:
H 1s 1 — один электрон
Cl 1s 2 2s 2 2 p 6 3 s 2 3 p 5 — семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. Лучше всего изображать это с помощью формул Льюиса:
Образование ковалентной связи
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора - восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора. Образовавшаяся при связывании двух атомов частица называется молекулой.
Неполярная ковалентная связь
Ковалентная связь может образоваться и между двумя одинаковыми атомами. Например:

Эта схема объясняет, почему водород и хлор существуют в виде двухатомных молекул. Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О 2 или азота N 2 . Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов, как показано ниже:

Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).

В таблице ниже перечислены основные типы связей и примеры веществ:

Обменный и донорно-акцепторный механизм образования ковалентной связи

1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.