Окисление жирных кислот может быть патологически повышено или патологически снижено.
Увеличение скорости окисления жирных кислот, особенно при недостатке углеводов происходит:
1. При приеме богатой жирами пище.
2. При голодании.
3. При сахарном диабете.
В этом случае из ацетил-КоА, образующего при β-окислении жирных кислот в печени образуется большое количество кетоновых тел. Накопление кетоновых тел приводит к ацидозу и называется кетоз.
Снижение скорости окисления жирных кислот наблюдается при:
1. Недостатке карнитина. Наблюдается у новорожденных, чаще недоношенных детей. Обусловлено либо нарушением биосинтеза карнитина, либо его «утечкой» в почках.
Симптомы:
· приступы гипогликемии, возникающие из-за снижения глюконеогенеза в результате нарушения процесса окисления жирных кислот;
· уменьшения синтеза кетоновых тел, сопровождающееся повышением содержания свободных жирных кислот в плазме крови;
· миастения (мышечная слабость);
· накопление липидов.
Лечение: прием карнитина внутрь.
2. Снижении активности карнитин-пальмитоилтрансферазы.
В печени приводит к гипогликемии и понижению содержания кетоновых тел в плазме крови.
В мышцах - к нарушению процесса окисления жирных кислот, в результате чего возникает мышечная слабость и развивается миоглобинурия.
3. Дикарбоновой ацидурии.
Основной симптом - экскреция С 6 -С 10 -дикарбоновых кислот и развивается гипогликемия, не связанная с повышением кетоновых тел.
Этиология: отсутствие в митохондриях ацетил-КоА дегидрогеназы среднецепочечных жирных кислот, которые укорачиваются до среднецепочечных дикарбоновых кислот, выводимых из организма.
Возникает у людей после употребления незрелых плодов аки, которые содержат токсин гипоглицин, инактивирующий ацил-КоА-дегидрогеназу, в результате чего ингибируется процесс β-окисления.
5. Синдроме Цельвегера (цереброгепаторенальный синдром).
Является редким наследственным заболеванием, при котором во всех тканях отсутствует пероксисомы. У больных страдающих синдромом Цельвегера, в мозге накапливаются С 26 -С 28 -полиеновые кислоты, т.к. из-за отсутствия пероксисом у них не происходит процесс окисления длинноцепочечных жирных кислот.
6. Болезни Рефсума.
Редкое неврологическое заболевание. Связано с врожденным нарушением системы α-окисления, что приводит к накоплению в тканях фитановой кислоты, которая блокирует систему β-окисления.
Определение уровня общих липидов в плазме (сыворотке) крови по цветной реакции с сульфофосфованилиновым реактивом
Общие липиды - обобщенное понятие, включающее неэстерифицированные жирные кислоты, триглицериды, фосфолипиды, свободный и эстерифицированный холестерин, сфингомиелины.
Принцип метода: продукты распада ненасыщенных липидов образуют с реактивом (состоящим из серной, ортофосфорной кислот и ванилина) соединение, интенсивность окраски которого пропорциональна содержанию общих липидов в сыворотке крови.
Реактивы:
1. Концентрированная серная кислота;
2. Фосфорнованилиновая смесь. 4 объема концентрированной ортофосфорной кислоты смешивают с одним объемом 6 г/л раствора ванилина. Смесь хранят в посуде из темного стекла при комнатной температуре.
3. Эталонный раствор триолеина, 8 г/л.
Ход определения
К 0,02 мл сыворотки крови прибавляют 1,5 мл концентрированной серной кислоты. Содержимое перемешивают и помещают на 15 минут в кипящую водяную баню. После охлаждения гидролизата отмеривают 0,1 мл (контрольная проба 0,1 мл концентрированной серной кислоты), который переносят в другие пробирки, содержащие 1,5 мл фосфорнованилинового реактива. После перемешивания пробы инкубируют 50 минут в темном месте при комнатной температуре. Оптическую плотность пробы (А 1) и эталонного раствора (А 2) измеряют на фотоколориметре при длине волны 510-540 нм в кювете толщиной слоя 10 мм против контрольного раствора. Расчет производят по формуле: .
Нормальное содержание в сыворотке крови: 4 - 8 г/л.
Клинико-диагностическое значение. Изменения содержания в крови количественной и качественной составляющей данного показателя наблюдаются при многих заболеваниях и патологических состояниях, которые не рассматриваются в данном пособии. Применительно к мышечной деятельности наблюдается увеличение данного показателя после продолжительной физической нагрузки, что показывает степень включения липидного обмена в энергетическое обеспечение мышечной деятельности. При этом величина данного показателя обычно не выходит за референтные пределы. Более информативным является определение динамики сдвигов при физической нагрузке, составляющих данного показателя.
БИОСИНТЕЗ ЛИПИДОВ
Биосинтез липидов (липогенез) необходим для создания запасных форм. Биосинтез липидов начинается с биосинтеза жирных кислот.
Биосинтез жирных кислот
Система синтеза жирных кислот находится в растворимой цитоплазматической фракции многих органов и тканей, таких какпечень, почки, молочная железа, жировая ткань.
Биосинтез жирных кислот протекает с участием:
1. НАДФН∙Н + ;
5. ацетил-КоА в качестве субстрата и пальмитиновая кислота в качестве конечного продукта.
Особенности биосинтеза жирных кислот
Синтез жирных кислот не является простым обращением реакций β-окисления. Наиболее важными особенностями являются следующие:
1. Синтез жирных кислот протекает в цитоплазме, в отличие от распада который протекает в митохондриях.
2. Промежуточные продукты синтеза жирных кислот ковалентно связаны с сульфгидрильными группами ацилпереносящего белка (АПБ).
3. Многие ферменты синтеза жирных кислот у высших организмов и человека организованы в мультиферментный комплекс, называемый синтетазой жирных кислот.
4. Непосредственно ацетил-КоА используется только как затравка.
5. Растущая цепь жирной кислоты удлиняется путем непосредственного присоединения двухуглеродных компонентов, происходящих из ацетил-КоА. Активированным донором двухуглеродных компонентов на стадии элонгации служит малонил-КоА. Реакция элонгации запускается высвобождением СО 2 .
6. Роль восстановителя при синтезе жирной кислоты выполняет НАДФН·Н + .
7. Синтез жирной кислоты является циклическим процессом протекающим на поверхности синтетазы жирных кислот.
8. Элонгация под действием комплекса синтетазы жирных кислот останавливается на этапе образования пальмитата (С 16). Дальнейшая элонгация и введение двойных связей осуществляется другими ферментными системами.
Этапы биосинтеза жирных кислот
I этап - транспорт ацетил-КоА из митохондрий в цитоплазму
Жирные кислоты синтезируются в цитоплазме, а ацетил-КоА образуется из пирувата в митохондриях. Мембрана митохондрий не проницаема для ацетил-КоА, поэтому транспорт ацетил-КоА через мембрану обеспечивается специальными механизмами. Роль карнитина в транспорте ацетил-КоА не велика, так как он переносит только длинноцепочечные жирные кислоты. Данная проблема решается путем синтеза цитрата.
Митохондрия Цитоплазма
Ацетил-КоА + оксалоацетат ацетил-КоА + оксалоацетат + АДФ + Ф н
НО - С - СООН цитрат + АТФ + HSKoA
СН 2 - СООН
Рис. 20. Схема транспорта ацетил-КоА через мембрану митохондрий
Цитрат образуется в митохондриальном матриксе путем конденсации ацетил-КоА и оксалоацетата. Затем диффундирует в цитоплазму, где расщепляется цитратлиазой. Таким образом, ацетил-КоА и оксалоацетат переносятся из митохондрий в цитоплазму с использованием одной молекулы АТФ.
Источники НАДФН·Н + для биосинтеза жирных кислот
Оксалоацетат, образовавшийся в результате переноса ацетил-КоА в цитоплазму должен быть возвращен обратно в митохондрию. Данный процесс сопряжен с генерацией НАДФН·Н + . Реакция происходит в цитоплазме и протекает в 2 этапа:
1. Оксалоацетат + НАДН·Н + Малат + НАД +
МДГ (декарбоксилирующая)
2. Малат + НАДФ + Пируват + СО 2 + НАДФН·Н +
Образовавшийся пируват легко диффундирует в митохондрии, где он карбоксилируется в оксалоацетат под действием пируваткарбоксилазы (с затратой энергии АТФ).
Пируват + НСО 3 - + АТФ Оксалоацетат + АДФ + Ф н
Нормальное окисление жиров в организме тесно связано с циклом Кребса. Основной путь образования оксалоацетата - карбоксилирование ПВК. Для сгорания 1,5 г жирных кислот, требуется 1 г углеводов. Отсюда, среди биохимиков есть поговорка, что «жиры сгорают в пламени углеводов».
Оксалоацетат, который синтезировался в данной реакции, затем взаимодействует с ацетил-КоА с образованием цитрата, который окисляется в ЦТК.
Таким образом, на каждую молекулу ацетил-КоА, которая переходит из митохондрий в цитоплазму, образуется одна молекула НАДФН·Н + . Следовательно, при переходе 8 молекул ацетил-КоА необходимых для синтеза пальмитиновой кислоты, образуется 8 молекул НАДФН·Н + . Еще 6 молекул требуемых для этого процесса генерируются в пентозофосфатном пути.
II этап - образование малонил-КоА.
Является первой реакцией биосинтеза жирных кислот. Катализируется ферментом ацетил-КоА-карбоксилазой. Коферментом является биотин. Реакция заключается в карбоксилилировании ацетил-КоА, источником СО2 является бикарбонат.
C = O + HCO 3 - + АТФ Е– биотин CН 2 + АДФ+H 3 PO 4
ацетил - KоA малонил - KоA
Рис. 21. Карбоксилирование ацетил-КоА (коферментом ацетил-КоА-карбоксилазы является биотин)
Малонил-КоА, по сути, является активированным ацетил-КоА. Энергия запасается заранее в виде карбоксильной группы и освобождается при декарбоксилировании непосредственно при биосинтезе жирных кислот. В дальнейшем биосинтезе жирных кислот ацетил-КоА используется как затравка, а непосредственно синтез идет из малонил-КоА.
III этап - биосинтез жирных кислот.
протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза.
окисление молекулы жирной кислоты в тканях организма происходит в β-положении. В результате от молекулы жирной кислоты последовательно отщепляются двууглеродные фрагменты со стороны карбоксильной группы.
Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной кислоты.
Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков (fatty acid binding proteins, FABP) – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот . Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg 2+ . Реакция катализируется ферментом ацил-КоА-синтетазой:
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.
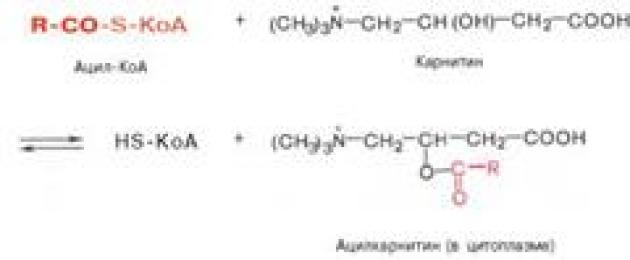
Транспорт жирных кислот внутрь митохондрий . Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:

Реакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в кар-нитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:

Внутримитохондриальное окислениежирных кислот . Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных энзиматических реакций.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:

Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-КоА с определенной длиной углеродной цепи.
Стадия гидратации . Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):

Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата (см. с. 348). В результате гидратации транс-Δ 2 -двойной связи образуется только L-изомер 3-гидроксиацил-КоА.
Вторая стадия дегидрирования . Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД + -зависимые дегидрогеназы:

Тиолазная реакция . В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):

Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА
За один цикл β-окисления образуется 1 молекула ацетил-СоА, окисление которого в цитратном цикле обеспечивает синтез 12 моль ATP . Кроме того, образуется 1 моль FADH 2 и 1 моль NADH+H , при окислении которых в дыхательной цепи синтезируется соответственно 2 и 3 моль ATP (в сумме 5).
Таким образом, при окислении, например, пальмитиновой кислоты (С16) происходит 7 циклов β-окисления, в результате которых образуется 8 моль ацетил-СоА, 7 моль FADH 2 и 7 моль NADH+H. Следовательно, выход ATP составляет 35 молекул в результате β-окисления и 96 ATP в результате цитратного цикла, что соответствует в сумме 131 молекул АТФ.
ЖИРНЫЕ КИСЛОТЫ - алифатические карбоновые кислоты, многие из которых входят в состав животных и растительных жиров; в организме животных и в растениях свободные Жирные кислоты и Жирные кислоты, входящие в состав липидов, выполняют чрезвычайно важную функцию - энергетическую и пластическую. Ненасыщенные Жирные кислоты участвуют в организме человека и животных в биосинтезе особой группы биологически активных веществ - простагландинов (см.). Содержание свободных и эфирносвязанных Жирных кислот в сыворотке крови служит дополнительным диагностическим тестом при ряде заболеваний. Ж. к. широко используются для приготовления различных мыл, в производстве каучука и резиновых изделий, лаков, эмалей и олиф.
В зависимости от числа карбоксильных групп в молекуле различают одно-, двух- и многоосновные Ж. к., а по степени насыщенности углеводородного радикала - насыщенные (предельные) и ненасыщенные (непредельные) Ж. к. По числу углеродных атомов в цепи Ж. к. делятся на низшие (c1-C3), средние (C4-C9) и высшие (C10-C26)- Насыщенные Ж. к. имеют общую молекулярную формулу C n H 2 n O 2 . Общая формула ненасыщенных Ж. к. зависит от числа содержащихся в них двойных или тройных связей.
Для обозначения Ж. к. используют рациональную и систематическую номенклатуру; кроме того, многие Ж. к. имеют исторически сложившиеся названия. По рациональной номенклатуре все Ж. к. рассматривают как производные уксусной к-ты, в молекуле к-рой атом водорода метильной группы замещен углеводородным радикалом. По систематической номенклатуре название Ж. к. происходит от названия углеводорода, молекула к-рого построена из того же числа атомов углерода, включая углерод карбоксильной группы, что и молекула Ж. к. (напр., пропан - пропановая к-та, этан - этановая к-та, гексан - гексановая к-та и т. д.). В названии ненасыщенных Ж. к. указывается число двойных связей (моно-, ди-, три-и т. д.) и прибавляется окончание «еновая». Нумерация атомов углерода Ж. к. начинается с углерода карбоксильной (COOH-) группы и обозначается араб, цифрами. Ближайший к COOH-группе C-атом обозначается как альфа, соседний с ним - бета и концевой атом углерода в углеводородном радикале - омега. Двойную связь в молекуле Ж. к. обозначают символом Δ или просто приводят номер углеродного атома, у к-рого расположена двойная связь с указанием цис- или транс-конфигурации цепи. Некоторые наиболее распространенные Ж. к. и их тривиальные, рациональные и систематические названия приведены в таблице 1.
Физические свойства
Низшие Ж. к. представляют собой летучие жидкости с резким запахом, средние - масла с неприятным прогорклым запахом, высшие - твердые кристаллические вещества, практически лишенные запаха.
С водой смешиваются во всех отношениях только муравьиная кислота (см.), уксусная кислота (см.) и пропионовая к-та; у более высоких членов ряда Ж. к. растворимость быстро уменьшается и, наконец, становится равной нулю. В спирте и эфире Ж. к. растворимы хорошо.
Температуры плавления в гомологическом ряду Ж. к. возрастают, но неравномерно. Ж. к. с четным числом C-атомов плавятся при более высокой температуре, чем следующие за ними Ж. к., имеющие на один C-атом больше (табл. 2). В обоих этих рядах (с четным и нечетным числом C-атомов) разность температур плавления двух следующих друг за другом членов постепенно уменьшается.
Такое своеобразное различие между Ж. к. с четным и нечетным числом С-атомов в молекуле проявляется не только в температурах плавления, но в нек-рой степени в хим. и даже в их биол, свойствах. Так, Ж. к. с четным числом C-атомов распадаются, по данным Г. Эмбдена, при кровоизлиянии в печени до ацетона, а Ж. к. с нечетным числом C-атомов - не распадаются.
Ж. к. сильно ассоциированы и даже при температурах, превышающих их температуру кипения, показывают вдвое больший мол. вес, чем это следует из их формулы. Эта ассоциация объясняется возникновением водородных связей между отдельными молекулами Ж. к.
Химические свойства
Химические свойства Ж. к. определяются свойствами их COOH-групп и углеводородного радикала. В COOH-группе связь O-H ослаблена за счет смещения электронной плотности в двойной C=O связи к кислороду, и поэтому протон может быть легко отщеплен. Это приводит к появлению стабильного аниона к-ты:
Сродство карбонилового остатка к электронам может быть частично удовлетворено за счет соседней метиленовой группы, водородные атомы к-рой наиболее активны по сравнению с остальными. Константа диссоциации COOH-группы Ж. к. равна 10 -4 -10 -5 М, т. е. ее величина гораздо ниже, чем у неорганических к-т. Наиболее сильной из Ж. к. является муравьиная к-та. COOH-группа Ж. к. обладает способностью реагировать в водных р-рах с щелочноземельными металлами. Соли высших Ж. к. с этими металлами называются мылами (см.). Мыла обладают свойствами поверхностно-активных веществ - детергентов (см.). Натриевые мыла твердые, калиевые - жидкие. Гидроксил COOH-групп Ж. к. может быть легко замещен на галоген с образованием галогенангидридов, которые широко используются в органических синтезах. При замещении галогена остатком другой к-ты образуются ангидриды Ж. к., при замещении остатком спирта - их сложные эфиры, аммиаком - амиды, гидразином - гидразиды. Наиболее распространены в природе сложные эфиры трехосновного спирта глицерина и высших Ж. к. - жиры (см.). Водород альфа-углеродного атома Ж. к. может быть легко замещен галогеном с образованием галогенсодержащих Ж. к. Непредельные Ж. к. могут существовать в виде цис- и транс-изомеров. Большинство природных ненасыщенных Ж. к. имеют цис-конфигурацию (см. Изомерия). Степень ненасыщенности Ж. к. определяют йодометрическим титрованием двойных связей. Процесс превращения ненасыщенных Ж. к. в насыщенные получил название гидрогенизации, обратный процесс- дегидрогенизации (см. Гидрогенизация).
Природные Ж. к. получают путем гидролиза жиров (их омыления) с последующей дробной перегонкой или хроматографическим разделением освободившихся Ж. к. Неприродные Ж. к. получают путем окисления углеводородов; реакция протекает через стадию образования гидроперекисей и кетонов.
Окисление жирных кислот
Как энергетический материал Ж. к. используются в процессе бета-окисления. В 1904 г. Ф. Кнооп выдвинул гипотезу, объясняющую механизм окисления Ж. к. в животном организме.
Эта гипотеза была построена на основании установления природы конечных продуктов обмена, выделяемых с мочой, после введения животным co-фенил замещенных Ж. к. В опытах Ф. Кноопа введение животным фенильных замещенных Ж. к., содержащих четное число С-атомов, всегда сопровождалось выделением с мочой фенил уксусной к-ты, а содержащих нечетное число С-атомов - выделением бензойной к-ты. На основании этих данных Ф. Кнооп предположил, что окисление молекулы Ж. к. происходит путем последовательного отсечения от нее двууглеродных фрагментов со стороны карбоксильной группы (схема 1):
Гипотеза Ф. Кноопа, получившая название теории бета-окисления, является основой современных представлений о механизме окисления Ж. к. В развитии этих представлений важную роль сыграли следующие методы и открытия: 1) введение радиоактивной метки (14 C) в молекулу Ж. к. для изучения их обмена; 2) установление Муньо (Munoz) и Лелуаром (L. F. Leloir) факта, что для окисления Ж. к. клеточными гомогенатами требуются те же самые кофакторы, что и для окисления пирувата (неорганический фосфат, ионы Mg 2+ , цитохром с, АТФ и какой-либо субстрат цикла Трикарбоновых к-т - сукцинат, фумарат и т. п.); 3) установление факта, что окисление Ж. к., как и субстратов цикла Трикарбоновых к-т (см. Трикарбоновых кислот цикл), протекает только в митохондриях клетки [Ленинджер (A. L. Lehninger) и Кеннеди (Е. P. Kennedy)]; 4) установление роли карнитина в транспорте Ж. к. из цитоплазмы в митохондрии; 5) открытие Ф. Липманном и Ф. Линеном кофермента А; 6) выделение из животных тканей в очищенном виде мультиферментного комплекса, ответственного за окисление Ж. к.
Процесс окисления Ж. к. в общих чертах складывается из следующих этапов.
Свободная Ж. к. независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться тем или иным превращениям, в т. ч. окислению, пока она не будет активирована.
Активация Ж. к. протекает в цитоплазме клетки, при участии АТФ, восстановленного КоА (KoA-SH) и ионов Mg 2+ .
Реакция катализируется ферментом тиокиназой:
В результате этой реакции образуется ацил-КоА, являющийся активной формой Ж. к. Выделено и изучено несколько тиокиназ. Одна из них катализирует активацию Ж. к. с углеводородной цепью длиной от C2 до C3, другая - от C4 до С12, третья - от C10 до C22.
Транспорт внутрь митохондрий. Коэнзимная форма Ж. к., так же как и свободные Ж. к., не обладает способностью проникать внутрь митохондрий, где собственно и протекает их окисление.
Установлено, что перенос активной формы Ж. к. в митохондрии осуществляется при участии азотистого основания карнитина. Соединяясь с Ж. к. при помощи фермента ацилкарнитиновой трансферазы, карнитин образует ацилкарнитин, обладающий способностью проникать внутрь митохондриальной мембраны.
В случае пальмитиновой к-ты, напр., образование пальмитил-карнитина представляется следующим образом:
Внутри митохондриальной мембраны при участии КоА и митохондриальной пальмитил-карнитиновой трансферазы происходит обратная реакция - расщепление пальмитил-карнитина; при этом карнитин возвращается в цитоплазму клетки, а активная форма пальмитиновой к-ты пальмитил-КоА переходит внутрь митохондрий.
Первая ступень окисления . Внутри митохондрий при участии дегидрогеназ Ж. к. (ФАД-содержащих ферментов) начинается окисление активной формы Ж. к. в соответствии с теорией бета-окисления.
При этом ацил-КоА теряет два водородных атома в альфа- и бета-положении, превращаясь в ненасыщенный ацил-КоА:
Гидратация . Ненасыщенный ацил-КоА присоединяет молекулу воды при участии фермента еноил-гидратазы, в результате чего образуется бета-гидроксиацил-КоА:
Вторая ступень окисления Ж. к., так же как первая, протекает путем дегидрирования, но в этом случае реакцию катализируют НАД-содержащие дегидрогеназы. Окисление происходит по месту бета-углеродного атома с образованием в этом положении кетогруппы:

Завершающим этапом одного полного цикла окисления является расщепление бета-кетоацил-КоА путем тиолиза (а не гидролиза, как предполагал Ф. Кнооп). Реакция протекает при участии КоА и фермента тиолазы. Образуется укороченный на два углеродных атома ацил-КоА и освобождается одна молекула уксусной к-ты в виде ацетил-КоА:

Ацетил-КоА подвергается окислению в цикле Трикарбоновых к-т до CO 2 и H 2 O, а ацил-КоА снова проходит весь путь бета-окисления, и так продолжается до тех пор, пока распад все укорачивающегося на два углеродных атома ацил-КоА не приведет к образованию последней частицы ацетил-КоА (схема 2).
При бета-окислении, напр, пальмитиновой к-ты, повторяются 7 циклов окисления. Поэтому общий итог ее окисления может быть представлен формулой:
C 15 H 31 COOH + АТФ + 8KoA-SH + 7HАД + 7ФАД + 7H 2 O -> 8CH 3 CO-SKoA + АМФ + 7НАД-H 2 + 7ФАД-H 2 + пирофосфат
Последующее окисление 7 молекул НАД-H 2 дает образование 21 молекулы АТФ, окисление 7 молекул ФАД-H 2 - 14 молекул АТФ и окисление 8 молекул ацетил-КоА в цикле Трикарбоновых кислот - 96 молекул АТФ. С учетом одной молекулы АТФ, потраченной в самом начале на активацию пальмитиновой к-ты, общий энергетический выход при полном окислении одной молекулы пальмитиновой к-ты в условиях животного организма составит 130 молекул АТФ (при полном окислении молекулы глюкозы образуется лишь 38 молекул АТФ). Т. к. изменение свободной энергии при полном сгорании одной молекулы пальмитиновой к-ты составляет - 2338 ккал, а богатая энергией фосфатная связь АТФ характеризуется величиной 8 ккал, нетрудно подсчитать, что примерно 48% всей потенциальной энергии пальмитиновой к-ты при ее окислении в организме используется для ресинтеза АТФ, а оставшаяся часть, по-видимому, теряется в виде тепла.
Небольшое количество Ж. к. подвергается в организме омега-окислению (окислению по месту метильной группы) и альфа-окислению (по месту второго C-атома). В первом случае образуется дикарбоновая к-та, во втором - укороченная на один углеродный атом Ж. к. Оба вида окисления протекают в микросомах клетки.
Синтез жирных кислот
Поскольку любая из реакций окисления Ж. к. является сама по себе обратимой, было выдвинуто предположение, что биосинтез Ж. к. представляет собой процесс, обратный их окислению. Так считалось до 1958 г., пока не было установлено, что в экстрактах печени голубя синтез Ж. к. из ацетата мог протекать только в присутствии АТФ и бикарбоната. Бикарбонат оказался абсолютно необходимым компонентом, хотя сам он в молекулу Ж. к. не включался.
Благодаря исследованиям Уокила (S. F. Wakil), Ф. Линена и Вагелоса (Р. В. Vagelos) в 60-70-х гг. 20 в. было установлено, что фактической единицей биосинтеза Ж. к. является не ацетил-КоА, а малонил-КоА. Последний образуется при карбоксилировании ацетил-КоА:

Именно для карбоксилирования ацетил-КоА и требовались бикарбонат, АТФ, а также ионы Mg2+. Фермент, катализирующий эту реакцию, ацетил-КоА - карбоксилаза содержит в качестве простетической группы биотин (см.). Авидин, ингибитор биотина, угнетает эту реакцию, как и синтез Ж. к. в целом.
Суммарно синтез Ж. к., напр, пальмитиновой, при участии малонил-КоА может быть представлен следующим уравнением:
Как следует из этого уравнения, для образования молекулы пальмитиновой к-ты требуется 7 молекул малонил-КоА и только одна молекула ацетил-КоА.
Процесс синтеза Ж. к. детально изучен у Е. coli и некоторых других микроорганизмов. Ферментная система, именуемая синтетазой жирных кислот, состоит у Е. coli из 7 индивидуальных ферментов, связанных с так наз. ацилпереносящим белком (АПБ). АП Б выделен в чистом виде, и его первичная структура изучена. Мол. вес этого белка равен 9750. В его составе имеется фосфорилированный пантетеин со свободной SH-группой. АП Б не обладает ферментативной активностью. Его функция связана только с переносом ацильных радикалов. Последовательность реакций синтеза Ж. к. у Е. coli может быть представлена в следующем виде:
Далее цикл реакций повторяется, бета-кетокапронил-S-АПБ при участии НАДФ-H 2 восстанавливается в бета-гидроксикапронил-S-АПБ, последний подвергается дегидратации с образованием ненасыщенного гексенил-S-АПБ, который затем восстанавливается в насыщенный капронил-S-АПБ, имеющий углеродную цепь на два атома длиннее, чем бутирил-S-АПБ, и т. д.
Т. о., последовательность и характер реакций в синтезе Ж. к., начиная с образования бета-кетоацил-S-АПБ и кончая завершением одного цикла удлинения цепи на два C-атома, являются обратными реакциями окисления Ж. к. Однако пути синтеза и окисления Ж. к. не пересекаются даже частично.
В тканях животных не удалось обнаружить АПБ. Из печени выделен мультиферментный комплекс, содержащий все ферменты, необходимые для синтеза Ж. к. Ферменты этого комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. В комплексе имеются две свободные SH-группы, одна из которых, как и в АПБ, принадлежит фосфорилированному пантетеину, другая - цистеину. Все реакции синтеза Ж. к. протекают на поверхности или внутри этого мультиферментного комплекса. Свободные SH-группы комплекса (а возможно, и гидроксильная группа входящего в его состав серина) принимают участие в связывании ацетил-КоА и малонил-КоА, а во всех последующих реакциях пантетеиновая SH-группа комплекса выполняет такую же роль, как и SH-группа АПБ, т. е. участвует в связывании и переносе ацильного радикала:
Дальнейший ход реакций в животном организме точно такой же, как это представлено выше для Е. coli.
До середины 20 в. считалось, что печень является единственным органом, где происходит синтез Ж. к. Затем было установлено, что синтез Ж. к. происходит также в стенке кишечника, в легочной ткани, в жировой ткани, в костном мозге, в л актирующей молочной железе и даже в сосудистой стенке. Что касается клеточной локализации синтеза, то есть основания считать, что он протекает в цитоплазме клетки. Характерно, что в цитоплазме печеночных клеток синтезируется гл. обр. пальмитиновая к-та. Что касается других Ж. к., то основной путь их образования в печени заключается в удлинении цепи на основе уже синтезированной пальмитиновой кислоты или Ж. к. экзогенного происхождения, поступивших из кишечника. Таким путем образуются, напр., Ж. к., содержащие 18, 20 и 22 С-атома. Образование Ж. к. путем удлинения цепи происходит в митохондриях и микросомах клетки.
Биосинтез Ж. к. в животных тканях регулируется. Давно известно, что печень голодавших животных и животных, больных диабетом, медленно включает 14C-ацетат в Ж. к. То же самое наблюдалось и у животных, к-рым вводили избыточные количества жира. Характерно, что в гомогенатах печени таких животных медленно использовался для синтеза Ж. к. ацетил-КоА, но не малонил-КоА. Это послужило основанием предположить, что реакция, лимитирующая скорость процесса в целом, связана с активностью ацетил-КоА - карбоксилазы. Действительно, Ф. Линен показал, что длинно-цепочечные ацильные производные КоА в концентрации 10 -7 М ингибировали активность этой карбоксилазы. Т. о., само накопление Ж. к. оказывает тормозящее влияние на их биосинтез по механизму обратной связи.
Другим регулирующим фактором в синтезе Ж. к., по-видимому, является лимонная к-та (цитрат). Механизм действия цитрата также связывают с его влиянием на ацетил-КоА - карбоксилазу. В отсутствии цитрата ацетил-КоА - карбоксилаза печени находится в виде неактивного мономера с мол. весом 540 000. В присутствии же цитрата фермент превращается в активный тример, имеющий мол. вес ок. 1 800 000 и обеспечивающий 15- 16-кратное увеличение скорости синтеза Ж. к. Можно допустить, следовательно, что содержание цитрата в цитоплазме печеночных клеток оказывает регулирующее влияние на скорость синтеза Ж. к. Наконец, важное значение для синтеза Ж. к. имеет концентрация НАДФ-Н 2 в клетке.
Обмен ненасыщенных жирных кислот
Получены убедительные доказательства, что в печени животных стеариновая к-та может превращаться в олеиновую, а пальмитиновая - в пальмитоолеиновую к-ту. Эти превращения, протекающие в микросомах клетки, требуют наличия молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. В микросомах может также осуществляться превращение мононенасыщенных к-т в диненасыщенные, напр, олеиновой к-ты в 6,9-октадекадиеновую к-ту. Наряду с десатурацией Ж. к. в микросомах протекает и их элонгация, причем оба эти процесса могут сочетаться и повторяться. Таким путем, напр., из олеиновой к-ты образуются нервоновая и 5, 8, 11-эйкозатетраеновая к-ты.
Вместе с тем ткани человека и ряда животных потеряли способность синтезировать некоторые полиненасыщенные к-ты. К ним относятся линолевая (9,12-октадекадиеновая), линоленовая (6,9,12-октадекатриеновая) и арахидоновая (5, 8, 11, 14-эйкозатетраеновая) к-ты. Эти к-ты относят к категории незаменимых Ж. к. При длительном их отсутствии в пище у животных наблюдается отставание в росте, развиваются характерные поражения со стороны кожи и волосяного покрова. Описаны случаи недостаточности незаменимых Ж. к. и у человека. Линолевая и линоленовая к-ты, содержащие соответственно две и три двойные связи, а также родственные им полиненасыщенные Ж. к. (арахидоновая и др.) условно объединены в группу под названием «витамин F».
Биол, роль незаменимых Ж. к. прояснилась в связи с открытием нового класса физиологически активных соединений - простагландинов (см.). Установлено, что арахидоновая к-та и в меньшей степени линолевая являются предшественниками этих соединений.
Ж. к. входят в состав разнообразных липидов: глицеридов, фосфатидов (см.), эфиров холестерина (см.), сфинголипидов (см.) и восков (см.).
Основная пластическая функция Ж. к. сводится к их участию в составе липидов в построении биол, мембран, составляющих скелет животных и растительных клеток. В биол, мембранах обнаружены гл. обр. эфиры следующих Ж. к.: стеариновой, пальмитиновой, олеиновой, линолевой, линоленовой, арахидоновой и докозагексаеновой. Ненасыщенные Ж. к. липидов биол, мембран могут окисляться с образованием липидных перекисей и гидроперекисей - так наз. перекисное окисление ненасыщенных Ж. к.
В организме животных и человека легко образуются лишь ненасыщенные Ж. к. с одной двойной связью (напр., олеиновая к-та). Гораздо медленнее образуются полиненасыщенные Ж. к., большая часть которых поставляется в организм с пищей (эссенциальные Ж. к.). Существуют специальные жировые депо, из которых после гидролиза (липолиза) жиров Ж. к. могут быть мобилизованы на удовлетворение нужд организма.
Экспериментально показано, что питание жирами, содержащими большие количества насыщенных Ж. к., способствует развитию гиперхолестеринемии; применение же с пищей растительных масел, содержащих большие количества ненасыщенных Ж. к., способствует снижению содержания холестерина в крови (см. Жировой обмен).
Наибольшее внимание медицина уделяет ненасыщенным Ж. к. Установлено, что избыточное окисление их по перекисному механизму может играть существенную роль при развитии различных патол, состояний, напр, при радиационных повреждениях, злокачественных новообразованиях, авитаминозе Е, гипероксии, отравлении четыреххлористым углеродом. Один из продуктов перекисного окисления ненасыщенных Ж. к.- липофусцин - накапливается в тканях при старении. Смесь этиловых эфиров ненасыщенных Ж. к., состоящая из олеиновой к-ты (ок. 15%), линолевой к-ты (ок. 15%) и линоленовой к-ты (ок. 57%), так наз. линетол (см.), используется в профилактике и лечении атеросклероза (см.) и наружно - при ожогах и лучевых поражениях кожи.
В клинике наиболее широко применяются методы количественного определения свободных (неэтерифицированных) и эфирносвязанных Ж. к. Методы количественного определения эфирносвязанных Ж. к. основаны на превращении их в соответствующие гидроксамовые к-ты, которые, взаимодействуя с ионами Fe 3+ , образуют цветные комплексные соли.
В норме в плазме крови содержится от 200 до 450 мг% этерифицированных Ж. к. и от 8 до 20 мг% неэтерифицированных Ж. к. Повышение содержания последних отмечается при диабете, нефрозах, после введения адреналина, при голодании, а также при эмоциональном стрессе. Понижение содержания неэтерифицированных Ж. к. наблюдается при гипотиреозах, при лечении глюкокортикоидами, а также после инъекции инсулина.
Отдельные Ж. к.- см. статьи по их названию (напр., Арахидоновая кислота , Арахиновая кислота , Капроновая кислота , Стеариновая кислота и др.). См. также Жировой обмен , Липиды , Холестериновый обмен .
Таблица 1. НАЗВАНИЯ И ФОРМУЛЫ НЕКОТОРЫХ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ЖИРНЫХ КИСЛОТ
|
Тривиальное название |
Рациональное название |
|||||
|
Неразветвленные насыщенные жирные кислоты (CnH2n+1COOH) |
||||||
|
Муравьиная |
Метановая |
|||||
|
Уксусная |
Этановая |
|||||
|
Пропионовая |
Пропановая |
|||||
|
Масляная |
Бутановая |
|||||
|
Валериановая |
Пентановая |
|||||
|
Капроновая |
Гексановая |
|||||
|
Энантовая |
Гептановая |
|||||
|
Каприловая |
Октановая |
|||||
|
Пеларгоновая |
Нонановая |
|||||
|
Каприновая |
Декановая |
|||||
|
Ундекановая |
||||||
|
Лауриновая |
Додекановая |
|||||
|
Тридекановая |
||||||
|
Миристиновая |
Тетрадекановая |
|||||
|
Пентадекановая |
||||||
|
Пальмитиновая |
Гексадекановая |
|||||
|
Маргариновая |
Гептадекановая |
|||||
|
Стеариновая |
Октадекановая |
|||||
|
Понадекановая |
||||||
|
Арахиновая |
Эйкозановая |
|||||
|
Генэйкозановая |
||||||
|
Бегеновая |
Докозановая |
|||||
|
Лигноцериновая |
Тетракозановая |
|||||
|
Керотиновая |
Гексакозановая |
|||||
|
Монтановая |
Октакозановая |
|||||
|
Мелиссиновая |
Триаконтановая |
СН3(СН2)28СООН |
||||
|
Лацериновая |
Дотриаконтановая |
СН3(СН2)30СООН |
||||
|
Разветвленные насыщенные жирные кислоты (CnH2n-1COOH) |
||||||
|
Туберкулостеариновая |
10-метилоктадекановая |
|||||
|
Фтионовая |
3, 13, 19-триметил-трикозановая |
|||||
|
Неразветвленные мононенасыщенные жирные кислоты (CnH2n-1COOH) |
||||||
|
Кротоновая |
||||||
|
Капролеиновая |
9-деценовая |
CH2=CH(CH2)7COOH |
||||
|
Лауролеиновап |
Дис-9-додеценовая |
СН3СН2СН=СН(СН2)7СООН |
||||
|
Дис-5-додеценовая |
СН3(СН2)5СН=СН(СН2)3СООН |
|||||
|
Миристолеиновая |
Дис-9-тетрадеценовая |
СН3(СН2)3СН=СН(СН2)7СООН |
||||
|
Пальм олеиновая |
Дис-9-гексадеценовая |
СН3(СН2)5СН=СН(СН2)7СООН |
||||
|
Олеиновая |
СН3(СН2)7СН=СН(СН2)7СООН |
|||||
|
Элаидиновая |
СН3(СН2)7СН=СН(СН2)7СООН |
|||||
|
Петрозелиновая |
СН3(СН2)10СН=СН(СН2)4СООН |
|||||
|
Петроселандовая |
СН3(СН2)10СН=СН(СН2)4СООН |
|||||
|
Вакценовая |
СН3(СН2)5СН=СН(СН2)9СООН |
|||||
|
Гадолеиновая |
Дис-9-эйкозеновая |
СН3(СН2)9СН=СН(СН2)7СООН |
||||
|
Цетолеиновая |
Цис-11-докозеновая |
СН3(СН2)9СН=СН(СН2)9СООН |
||||
|
Эруковая |
Цис-13-докозеновая |
СН3(СН2)7СН=СН(СН2)11СООН |
||||
|
Нервоновая |
Цис-15-тетракозеновая |
СН3(СН2)7СН=СН(СН2)13СООН |
||||
|
Ксименовая |
17-гексакозеновая |
СН3(СН2)7СН=СН(СН2)15СООН |
||||
|
Люмекеиновая |
21-триаконтеновая |
СН3(СН2)7СН=СН(СН2)19СООН |
||||
|
Неразветвленные полиненасыщенные жирные кислоты (CnH2n-xCOOH) |
||||||
|
Линолевая |
||||||
|
Линэлаидиновая |
СН3(СН2)4СН=СНСН2СН=СН(СН2)7СООН |
|||||
|
Линоленовая |
||||||
|
Линоленэлаидиновая |
СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)7СООН |
|||||
|
альфа-Элеостеариновая |
||||||
|
бета-Элеостеариновая |
СН3(СН2)3СН=СНСН=СНСН=СН(СН2)7СООН |
|||||
|
гамма-Линоленовая |
СН3(СН2)4СН=СНСН2СН=СНСН2СН=СН(СН2)4СООН |
|||||
|
Пуницивая |
СН3(СН2)3СН=СНСН=СНСН=СН(СН2)7СООН |
|||||
|
Гомо-гамма-линоленовая |
Цис- 8, 11, 14, 17-эйкозатриеновая |
СН3(СН2)7СН=СНСН2СН=СНСН2СН=СН(СН2)3СООН |
||||
|
Арахидоновая |
Цис-5, 8, 11, 14-эйкозатетраеновая |
СН3(СН2)4СН=СНСН2СН==СНСН2СН=СНСН2СН=СН(СН2)3СООН |
||||
|
Цис-8, 11, 14, 17-эйкозатетраеновая |
СН3СН2СН=СНСН2СН=СНСН2СН=СНСН2СН=СН(СН2)6СООН |
|||||
|
Тимнодоновая |
4, 8, 12, 15, 18-эйкозапен-таеновая |
СН3СН=СНСН2СН=СНСН2СН=СН(СН2)2СН=СН(СН2)2СН=СН(СН2)2СООН |
||||
|
Клупанодоновая |
4, 8, 12, 15, 19-докозапентаеновая |
СН3СН2СН=СН(СН2)2СН==СНСН2СН=СН(СН2)2СН=СН(СН2)2СН=СН(СН2)2СООН |
||||
|
Цис-4, 7, 10, 13, 16, 19-докозагексаеновая |
СН3(СН2СН=СН)6(СН2)2СООН |
|||||
|
Низиновая |
4, 8, 12, 15, 18, 21-тетракозагексаеновая |
СН3СН2СН=СНСН2СН=СНСН2СН=СНСН2СН=СН(СН2)2СН=СН(СН2)2СН=СН(СН2)2СООН |
||||
|
Энантовая |
||||||
|
Каприловая |
||||||
|
Пеларгоновая |
||||||
|
Каприновая |
||||||
|
Ундециловая |
||||||
|
Лауриновая |
||||||
|
Тридециловая |
||||||
|
Миристиновая |
||||||
|
Пентадециловая |
||||||
|
Пальмитиновая |
||||||
|
Маргариновая |
||||||
|
Стеариновая |
||||||
|
Нонадециловая |
||||||
|
Арахиновая |
||||||
|
* При давлении 100 мм рт. ст. |
||||||
Зиновьев А. А. Химия жиров, М., 1952; Hьюсхолм Э. и Старт К. Регуляция метаболизма, пер. с англ., М., 1977; Перекалин В. В. и Зонне С. А. Органическая химия, М., 1973; Biochemistry and methodology of lipids, ed. by A. R. Jonson a. J. B. Davenport, N. Y., 1971; Fatty acids, ed. by K. S. Markley, pt 1-3, N. Y.-L., 1960-1964, bibliogr.; Lipid metabolism, ed. by S. J. Wakil, N. Y.-L., 1970.
A. H. Климов, А. И. Арчаков.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg 2+ . Реакция катализируется ферментом ацил-КоА-синтетазой:
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты.

Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):

Вторая стадия дегидрирования. Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакциюкатализируют НАД + -зависимые дегидрогеназы:

Тиолазная реакция. представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):

Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА.
Баланс энергии. При каждом цикле β-окисления образуются одна молекула ФАДН 2 и одна молекула НАДН. Последние в процессеокисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН 2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном β-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одноймолекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты (пальмитоил-КоА), общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 – 1 = 130 молекул АТФ.
Как уже указывалось, значительную часть энергии, извлекаемой в процессе окисления, животный организм получает из жирных кислот, которые расщепляются путем окисления при β-углеродном атоме.
β-Окисление жирных кислот было впервые изучено в 19004 г. Ф. Кноопом. В дальнейшем было установлено, что β-окисление осуществляется только в митохондриях. Благодаря работам Ф. Линена с сотрудниками (1954-1958 г.г.) были выяснены основные ферментативные процессы окисления жирных кислот. В честь ученых, открывших данный путь окисления жирных кислот, процесс β-окисления получил название цикла Кноопа-Линена .
β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА. Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК (цикле трикарбоновых кислот) служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. β-Окисление жирных кислот происходит только в аэробных условиях.
Все реакции многостадийного окисления ускоряются специфическими ферментами. β-окисление высших жирных кислот является универсальным биохимическим процессом, протекающим во всех живых организмах. У млекопитающих этот процесс происходит во многих тканях, в первую очередь в печени, почках и сердце. Окисление жирных кислот происходит в митохондриях. Ненасыщенные высшие жирные кислоты (олеиновая, линолевая, линоленовая и др.) предварительно восстанавливаются до предельных кислот.
Проникновению жирных кислот в митохондриальный матрикс предшествует их активация путем образования соединения с коэнзимом А (НS~КоА), содержащего макроэргическую связь. Последняя, видимо, способствует более гладкому протеканию реакций окисления образовавшегося соединения, которое называют ацилкоэнзимом А (ацил-КоА).
Взаимодействие высших жирных кислот с КоА ускоряется специфическими лигазами - ацил-КоА-синтетазами трех видов, специфичных соответственно для кислот с коротким, средним и длинным углеводородными радикалами. Они локализованы в мембранах эндоплазматической сети и в наружной мембране митохондрий. По-видимому, все ацил-КоА-синтетазы являются мультимерами; так, фермент из микросом печени имеет молекулярную массу 168 кДа и состоит из 6 идентичных субъединиц. Реакция активации жирных кислот протекает в 2 этапа:
а) сначала жирная кислота реагирует с АТФ с образаванием ациладенилата:
RCOOH + ATФ → RCO~AMФ + ФФ
б) затем идет образование активированной формы ацил-КоА:
RCO~AMФ + НS~КоА → RCO~SKoA + AMФ
Пирофосфат (ФФ) быстро гидролизуется под действием пирофосфатазы, в результате чего вся реакция оказывается необратимой: ФФ + H 2 O → 2Ф
Суммарное уравнение :
RCOOH + ATФ+ НS~КоА→ RCO~SKoA + AMФ + 2Ф
Жирные кислоты с короткой и средней длиной цепи (от 4 до 12 атомов углерода) могут проникать в матрикс митохондрий путём диффузии, там происходит их активация. Жирные кислоты с длинной цепью, которые преобладают в организме человека (от 12 до 20 атомов углерода), активируются ацил-КоА синтетазами, расположенными на внешней мембране митохондрий.
Внутренняя мембрана митохондрий непроницаема для длинноцепочных ацил-КоА, образовавшихся в цитоплазме. Переносчиком активированных жирных кислот служит карнитин (витамин В т) , который поступает с пищей или синтезируется из незаменимых аминокислот лизина и метионина.
В наружной мембране митохондрий находится фермент карнитинацилтрансфераза I (карнитин-палъмитоилтрансфераза I), катализи- рующий реакцию с образованием ацилкарнитина:
RCO~SKoA + H 3 C- N + -CH 2 -CH-CH 2 -COOH ↔ H 3 C- N + -CH 2 -CH-CH 2 -COOH + HS~KoA
Ацил-КоА Карнитин (В т) Ацилкарнитин Кофермент А
Этот фермент является регуляторным, он регулирует скорость поступления ацильных групп в митохондрии, а, следовательно, и скорость окисления жирных кислот.
Образовавшийся ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью карнитинацилкарнитинтранслоказы на внутреннюю поверхность внутренней мембраны митохондрий, где фермент карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный КоА, то есть обратную реакцию (рис.9).

Рис.9. Перенос жирных кислот с длинным углеводородным радикалом через мембраны митохондрий
Итак, ацил-КоА становится доступным для ферментов β-окисления. Свободный карнитин возвращается на цитозольную сторону внутренней мембраны митохондрий той же транслоказой. После этого ацил-КоА включается в реакции β-окисления.
В матриксе митохондрий происходит катаболизм (распад) ацил-КоА в результате повторяющейся последовательности из четырех реакций .
1) Первой реакцией в каждом цикле является его окисление ферментом ацил-КоА-дегидрогеназой , коферментом которого является ФАД. Дегидрирование происходит между β - и α - атомами углерода, в результате чего в углеродной цепи образуется двойная связь и продуктом этой реакции является еноил-КоА:
R-CH 2 -CH 2 CO~SKoA + ФАД → R-CH=CHCO~SKoA + ФАДН 2
Ацил-КоА Еноил-КоА
2) На втором этапе цикла окисления жирных кислот происходит гидратация двойной связи еноил-КоА, в результате чего образуется β-гидроксиацил-КоА. Реакция катализируется ферментом еноил-КоА-гидратазой :
R-CH=CHCO~SKoA +Н 2 О → R-CH-CH 2 CO~SKoA
Еноил-КоА β- гидроксиацил-КоА
3) На третьем этапе цикла β-гидроксиацил-КоА подвергается дегидрированию (второму окислению) при участии фермента β-гидроксиацил-КоА-дегидрогеназы , коферментом которой является НАД + . Продуктом данной реакции является β-кетоацил-КоА:
R-CH-CH 2 CO~SKoA + НАД + → R-CОCH 2 CO~SKoA + НАДН + Н +
β- гидроксиацил-КоА β- кетоацил-КоА
4) Последняя реакция цикла окисления жирных кислот катализируется ацетил-КоА-ацилтрансферазой (тиолазой) . На этом этапе β-кетоацил-КоА взаимодействует со свободным КоА и расщепляется с образованием, во-первых, двухуглеродного фрагмента, содержащего два концевых углеродных атома исходной жирной кислоты в виде ацетил-КоА, и, во-вторых, КоА-эфира жирной кислоты, укороченной теперь на два атома углерода. По аналогии с гидролизом эту реакцию называют тиолизом :
R-CОCH 2 CO~SKoA + НS~KoA → CH 3 CO~SKoA + R 1 CO~SKoA
β- кетоацил-КоА Ацетил-КоА Ацил-КоА ,
укороченный на
2 углеродных атома
Укороченный ацил-КоА подвергается далее следующему циклу окисления, начинающемуся с реакции, катализируемой ацил-КоА-дегидрогеназой (окисление), затем следует реакция гидратации, реакция второго окисления, тиолазная реакция, то есть этот процесс многократно повторяется (рис.10).
β- Окисление высших жирных кислот протекает в митохондриях. В них же локализованы ферменты дыхательного цикла, ведущие передачу атомов водорода и электронов на кислород в условиях окислительного фосфорилирования АДФ, поэтому β-окисление высших жирных кислот является источником энергии для синтеза АТФ.

Рис.10. Окисление жирной кислоты
Окончательным продуктом β-окисления высших жирных кислот с четным числом углеродных атомов является ацетил-КоА , а с нечетным - пропионил-КоА .
Если бы ацетил-КоА накапливался в организме, то запасы HS~KoA скоро исчерпались бы, и окисление высших жирных кислот остановилось. Но этого не происходит, так как КоА быстро освобождается из состава ацетил-КоА. К этому приводит ряд процессов: ацетил-КоА включается в цикл трикарбоновых и дикарбоновых кислот или весьма близкий к нему глиоксилевый цикл, или ацетил-КоА используется для синтеза стеролов и соединений, содержащих изопреноидные группировки и т.п.
Пропионил-КоА, являющийся конечным продуктом β-окисления высших жирных кислот с нечетным числом углеродных атомов, превращается в сукцинил-КоА, который утилизируется через цикл трикарбоновых и дикарбоновых кислот.
Около половины жирных кислот в организме человека ненасыщенные .
β-Окисление этих кислот идёт обычным путём до тех пор, пока двойная связь не окажется между третьим и четвёртым атомами углерода. Затем фермент еноил-КоА-изомераза перемещает двойную связь из положения 3-4 в положение 2-3 и изменяет цис-конформацию двойной связи на транс-, которая требуется для β-окисления. В этом цикле β-окисления первая реакция дегидрирования не происходит, так как двойная связь в радикале жирной кислоты уже имеется. Далее циклы β-окисления продолжаются, не отличаясь от обычного пути. Основные пути метаболизма жирных кислот демонстрирует ри.11.

Рис.11.Основные пути метаболизма жирных кислот
Недавно было обнаружено, что помимо β-окисления – основного пути катаболизма жирных кислот, в тканях мозга происходит α-окисление жирных кислот с числом атомов углерода (С 13 -С 18), то есть последовательное отщепление одноуглеродных фрагментов от карбоксильного конца молекулы.
Этот тип окисления наиболее характерен для растительных тканей, но может происходить и в некоторых тканях животных. α-Окисление имеет циклический характер, причем цикл состоит из двух реакций.
Первая реакция заключается в окислении жирной кислоты пероксидом водорода в соответствующий альдегид и СО 2 с участием специфической пероксидазы :

В результате этой реакции углеводородная цепь укорачивается на один атом углерода.
Суть второй реакции заключается в гидратации и окслении образовавшегося альдегида в соответствующую карбоновую кислоту под действием альдегиддегидрогеназы , содержащей окисленную форму кофермента НАД:
Затем цикл α-окисления повторяется снова. В сравнении с β-окислением этот тип окисления энергетически менее выгоден.
ω-Окисление жирных кислот. В печени животных и у некоторых микроорганизмов существует ферментная система, обеспечивающая ω-окисление жирных кислот, то есть окисление по концевой СН 3 -группе, обозначаемой буквой ω. Сначала под действием монооксигеназы происходят гидроксилирование с образованием ω-оксикислоты:

Затем ω-оксикислота окисляется в ω-дикарбоновую кислоту под действием соответствующей дегидрогеназы :
Полученная таким образом ω-дикарбоновая кислота укорачивается с любого конца с помощью реакций β-окисления.