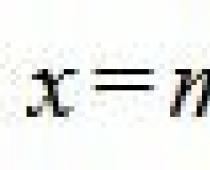(в скобках указаны координац. числа) Ni 2+
0,069 нм (4), 0,077 нм (5), 0,083 нм (6).
Среднее содержание никеля в
земной коре 8-10 -3 % по массе, в океанов 0,002 мг/л. Известно
ок. 50 никеля, из них важнейшие: пентландит (Fe,Ni) 9 S 8 ,
миллерит NiS, гарниерит (Ni,Mg) 3 Si 4 O 10 (OH) 10 . 4H 2 O,
ревдинскит (не-пуит) (Ni,Mg) 3 Si 2 O 5 (OH) 4 ,
никелин NiAs, аннабергит Ni 3 (AsO 4) 2 8Н 2 О.
В основном никель добывают из сульфидных медно-никелевых (Канада, Австралия,
Юж. Африка) и из силикатно-окисленных (Новая Каледония, Куба, Филиппины,
Индонезия и др.). Мировые запасы никеля на суше оцениваются в 70 млн. т.
Свойства.
Никель-серебристо-белый
. Кристаллич. решетка гранецентрир. кубическая, а = 0,35238 нм,
z = 4, пространств. группа Рт3т. Т. пл. 1455 °С. т.
кип. 2900 °С; плота. 8,90 г/см 3 ; C 0 p
26,l Дж/( . К); DH 0 пл 17,5
кДж/ , DH 0 исп 370кДж/ ; S 0 298
29,9 ДжДмоль К); ур-ние температурной зависимости для твердого
никеля lgp(гПа) = 13,369-23013/T+0,520lgT+0,395T (298-1728К),
для жидкого lgp(гПа)=11,742-20830/T+ 0,618 lg Т (1728-
3170 К); температурный
коэф. линейного расширения 13,5 . 10 -6 К -1 (273-373
К); 94,1 Вт/(м х х К) при 273 К, 90,9 Вт/(м. К) при
298 К; g 1,74 Н/м (1520 °С); r 7,5 10 -8 Ом м, температурный коэф.
r 6,75 . 10 -3 К -1 (298-398 К); ,
631 К. Модуль упругости 196-210 ГПа; s раст 280-720 МПа;
относит. удлинение 40-50%; по Бринеллю (отожженного) 700-1000 МПа.
Чистый никель- весьма пластичный , хорошо обрабатывается в холодном и горячем
состоянии, поддается прокатке, волочению, ковке.
Н
икель химически малоактивен,
но тонкодисперсный , полученный соединений никеля
при низких т-рах, пирофорен. Стандартный Ni 0 /Ni 2+
- 0,23 В. При обычных т-рах никель на покрывается тонкой
. Не взаимод. с и влагой . При нагр.
никеля с пов-сти начинается при ~ 800 °С. С соляной, серной, фосфорной, фтористоводородной
к-тами никель реагирует очень медленно. Практически на него не действуют уксусная
и др. орг. к-ты, особенно в отсутствие . Хорошо реагирует с разб. HNO 3 ,
конц. HNO 3 пассивируется. Р-ры и и , а также жидкий NH 3 на никель не действуют. Водные р-ры NH 3
в присут. коррелируют никель.
Н
икель в дисперсном состоянии
обладает большой каталитич. в р-циях , . Используют либо скелетный никель (никель Ренея),
получаемый сплавлением с Аl или Si с послед. , либо никель
на .
Н
икель поглощает Н 2
и образует с ним твердые р-ры. NiH 2 (устойчив ниже 0°С)
и более стабильный NiH получены косвенными путями. почти не поглощается
никелем вплоть до 1400 °С, р-римость N 2 в 0,07% при 450 °С.
Компактный никель не реагирует с NH 3 , дисперсный при 300-450 °С образует
с ним н и т р и д Ni 3 N.
Расплавленный никель растворяет
С с образованием к а р б и д а Ni 3 C, к-рый при
разлагается с выделением ; Ni 3 C в виде серо-черного
(разлагается при ~ 450°С) получают науглероживанием никеля в СО при
250-400 °С. Дисперсный никель с СО дает летучий Ni(CO) 4 .
При сплавлении с Si образует с и л и ц и д ы; Ni 5 Si 2 ,
Ni 2 Si и NiSi плавятся конгруэнтно соотв. при 1282, 1318 и 992 °С,
Ni 3 Si и NiSi 2 -инконг-руэнтно соотв. при 1165 и 1125°С,
Ni 3 Si 2 разлагается, не плавясь, при 845 °С. При сплавлении
с В дает б о р и д ы: Ni 3 B (т. пл. 1175°С), Ni 2 B (1240
°С), Ni 3 B 2 (1163°C), Ni 4 B 3 (1580
°С), NiB 12 (2320 °С), NiB (разлагается при 1600 °С).
С Se никель образует с е л е н и д ы: NiSe (т. пл. 980 °С), Ni 3 Se 2
и NiSe 2 (разлагаются соотв. при 800 и 850 °С), Ni 6 Se 5
и Ni 21 Se 20 (существуют только в твердом состоянии). При
сплавлении никеля с Те получают т е л л у р и д ы: NiTe и NiTe 2 (между
ними образуется, по-видимому, широкая область твердых р-ров) и др.
А р с е н а т Ni 3 (AsO 4) 2 . 8H 2 O-зеленые
; р-римость в 0,022%; к-тами разлагается; выше 200 °С обезвоживается,
при ~ 1000°С разлагается; получения твердого .
С и л и к а т Ni 2 SiO 4 -светло-зеленые
с ромбич. решеткой; плотн. 4,85 г/см 3 ; разлагается, не
плавясь, при 1545°С; в не раств.; минер. к-тами медленно разлагается
при нагревании. А л ю м и н а т NiAl 2 O 4 (никелевая шпи-нель)-голубые
с кубич. решеткой; т. пл. 2110°С; плотн. 4,50 г/см 3 ;
не раств. в ; медленно разлагается к-тами; .
Важнейшие комплексные соед.
никеля-а м м и н ы. Наиб. характерны гексааммины и акватетраммины с соотв.
2+ и 2+ .
Это голубые или фиолетовые кристаллич. в-ва, обычно раств. в , в р-рах ярко-синего
цвета; при кипячении р-ров и при действии к-т разлагаются; образуются в р-рах
при аммиачной переработке никелевых и кобальтовых .
В комплексах Ni(III) и
Ni(IV) координац. число никеля равно 6. Примеры-фиолетовый K 3
и красный K 2 , образующиеся при действии F 2
на смеси NiCl 2 и КСl; сильные . Из др. типов известны
гетеро-поликислот, напр. (NH 4) 6 H 7 . 5H 2 O,
большое число внутрикомплексных соед. Ni(II). См. также Никель-органические
соединения.
Получение.
перерабатывают пиро- и гидромстал-лургич. путем. Для силикатно-окисленных
(не поддаются обогащению) используют либо восстановит. плавку с получением ферроникеля,
к-рый далее подвергают продувке в конвертере с целью и обогащения,
либо плавку на штейн с серосодержащими (FeS 2 или CaSO 4).
Полученный штейн продувают в конвертере для удаления Fe, а затем дробят и обжигают,
из образовавшегося NiO восстановит. плавкой получают металлический никель. Никелевые
концентраты, получаемые при обогащении сульфидных , плавят на штейн с послед.
продувкой в конвертере. Из медно-никелевого штейна после его медленного охлаждения
выделяют концентрат Ni 3 S 2 , к-рый, аналогично
штейнам из окисленных , обжигают и восстанавливают.
Один из путей гидропереработки
окисленных руд-восстановление или смесью Н 2
и N 2 с послед. р-ром NH 3 и СО 2
с продувкой . Р-р очищают от Со . При разложении р-ра
с отгонкой NH 3 осаждается гидроксо-карбонат никеля, к-рый либо прокаливают
и из образовавшегося NiO восстановит. плавкой получают никель, либо повторно раств.
в р-ре NH 3 и после отгонки NH 3 из пульпы
Н 2 получают никель. Др. путь - окисленной серной к-той
в . Из образовавшегося р-ра после его очистки и никель осаждают
под и полученный концентрат NiS перерабатывают подобно
штейнам.
Гидропереработка сульфидных
никелевых материалов (концентратов, штейнов) сводится к автоклавному окислит.
либо р-рами NH 3 (при низком содержании Со), либо H 2 SO 4 .
Из аммиачных р-ров после отделения CuS никель осаждают под .
Для разделения Ni,
Со
и Сu из аммиачных р-ров применяют также экстракц. способы с использованием,
в первую очередь, хелатообразу-ющих экстрагентов.
Автоклавное окислитю с получением сульфатных р-ров применяют как к обогащенным материалам (штейнам) с переводом никеля и др. в р-р, так и к бедным пирротииовым Fe 7 S 8 концентратам. В последнем случае окисляется преим. пирротин, что позволяет выделить элементарную S и сульфидный концентрат, переплавляемый далее на никелевый штейн.
Положение в периодической системе:
Никель -- элемент десятой группы, четвёртого периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 28. Обозначается символом Ni (лат. Niccolum).
Строение атома:
Конфигурация внешних электронных оболочек атома 3s23p63d84s2;э нергии ионизации Ni0 3048-4.jpgNi+ 3048-5.jpgNi2+3048-6.jpgNi3+ 7,634, 18,153 и 35,17 эВ; электроотрицательность по Полингу 1,80; атомный радиус 0,124нм, ионный радиус (в скобках указаны координации числа) Ni2+ 0,069 нм (4), 0,077 нм (5), 0,083 нм (6)
Степени окисления: Образует соединения чаще всего в степени окисления +2 (валентность II), реже -- в степени окисления +3 (валентность III) и очень редко в степенях окисления +1 и +4 (соответственно валентности I и IV).
Никель простое вещество
Распространение в природе:
Никель довольно распространён в природе -- его содержание в земной коре составляет ок. 0,01 %(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8 %). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2 кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 -- 0,41 % Ni. Он изоморфно замещает железо и магний. Небольшая часть никеля присутствует в виде сульфидов. Никель проявляет сидерофильные и халькофильные свойства. При повышенном содержании в магме серы возникают сульфиды никеля вместе с медью, кобальтом, железом и платиноидами. В гидротермальном процессе совместно с кобальтом, мышьяком и серой и иногда с висмутом, ураном и серебром, никель образует повышенные концентрации в виде арсенидов и сульфидов никеля. Никель обычно содержится в сульфидных и мышьяк-содержащих медно-никелевых рудах.
- - никелин (красный никелевый колчедан, купферникель) NiAs,
- - хлоантит (белый никелевый колчедан) (Ni, Co, Fe) As2,
- - гарниерит (Mg, Ni)6(Si4O11)(OH)6*H2O и другие силикаты,
- - магнитный колчедан (Fe, Ni, Cu) S,
- - мышьяково-никелевый блеск (герсдорфит) NiAsS,
- - пентландит (Fe, Ni) 9S8.
О никеле в организмах известно уже немало. Установлено, например, что содержание его в крови человека меняется с возрастом, что у животных количество никеля в организме повышено, наконец, что существуют некоторые растения и микроорганизмы -- «концентраторы» никеля, содержащие в тысячи и даже в сотни тысяч раз больше никеля, чем окружающая среда.
История открытия:
Никель (англ., франц. и нем. Nickel) открыт в 1751 г. Однако задолго до этого саксонские горняки хорошо знали руду, которая внешне походила на медную и применялась в стекловарении для окраски стёкол в зелёный цвет. Все попытки получить из этой руды медь оказались неудачными, в связи с чем в конце XVII в. руда получила название купферникель (Kupfernickel), что приблизительно означает «Медный дьявол». Данную руду (красный никелевый колчедан NiAs) в 1751 г. исследовал шведский минералог Кронштедт. Ему удалось получить зелёный окисел и путём восстановления последнего -- новый металл, названный никелем. Когда Бергман получил металл в более чистом виде, он установил, что по своим свойствам металл похож на железо; более подробно никель изучали многие химики, начиная с Пруста. Никкел -- ругательное слово на языке горняков. Оно образовалось из искажённого Nicolaus -- родового слова, имевшего несколько значений. Но главным образом слово Nicolaus служило для характеристики двуличных людей; кроме того, оно обозначало «озорной маленький дух», «обманчивый бездельник» и т.д. В русской литературе начала XIX в. употреблялись названия николан (Шерер, 1808), николан (Захаров, 1810), николь и никель (Двигубский, 1824)
Физические свойства:
Никель -- ковкий и пластичный металл. Он обладает кубической гранецентрированной кристаллической решеткой (параметра = 0,35238 нм). Температура плавления 1455°C, температура кипения около 2900°C, плотность 8,90 кг/дм3. Никель -- ферромагнетик, точка Кюри около 358°C.
Удельное электрическое сопротивление 0,0684 мкОм м.
Коэффициент линейного теплового расширения б=13,5?10?6 K?1 при 0 °C.
Коэффициент объёмного теплового расширения в=38--39?10?6 K?1.
Модуль упругости 196--210 ГПа.
Химические свойства:
Атомы никеля имеют внешнюю электронную конфигурацию 3d84s2. Наиболее устойчивым для никеля является состояние окисления Ni(II).Никель образует соединения со степенью окисления +1, +2, +3 и +4. При этом соединения никеля со степенью окисления +4 редкие и неустойчивые. Оксид никеля Ni2O3 является сильным окислителем. Никель характеризуется высокой коррозионной стойкостью -- устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию -- образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в разбавленной азотной кислоте:{3 Ni + 8 HNO_3 (30%) 3 Ni(NO_3)_2 + 2 NO + 4 H_2O}и в горячей концентрированной серной:{Ni + 2 H_2SO_4 NiSO_4 + SO_2 + 2 H_2O}
С соляной и с разбавленной серной кислотами реакция протекает медленно. Концентрированная азотная кислота пассивирует никель, однако при нагревании реакция всё же протекает (основной продукт восстановления азота -- NO2).С оксидом углерода CO никель легко образует летучий и очень ядовитый карбонил Ni(CO)4.Тонкодисперсный порошок никеля пирофорный (самовоспламеняется на воздухе).Никель горит только в виде порошка. Образует два оксида NiO и Ni2O3 и соответственно два гидроксида Ni(OH)2 и Ni(OH)3. Важнейшие растворимые соли никеля -- ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зелёный цвет, а безводные соли -- жёлтые или коричнево-жёлтые. К нерастворимым солям относятся оксалат и фосфат (зелёные), три сульфида: NiS (черный), Ni3S2 (желтовато-бронзовый) и Ni3S4 (серебристо-белый). Никель также образует многочисленные координационные и комплексные соединения. Например, диметилглиоксимат никеля Ni(C4H6N2O2)2, дающий чёткую красную окраску в кислой среде, широко используется в качественном анализе для обнаружения никеля. Водный раствор сульфата никеля имеет зелёный цвет. Водные растворы солей никеля(II) содержат ион гексаакваникеля(II) 2+.
Получение:
Общие запасы никеля в рудах на начало 1998 г. оцениваются в количестве 135 млн т., в том числе достоверные -- 49 млн.т. Основные руды никеля -- никелин (купферникель) NiAs, миллерит NiS, пентландит (FeNi)9S8 -- содержат также мышьяк, железо и серу; в магматическом пирротине также встречаются включения пентландита. Другие руды, из которых тоже добывают Ni, содержат примеси Co, Cu, Fe и Mg. Иногда никель является основным продуктом процесса рафинирования, но чаще его получают как побочный продукт в технологиях других металлов. Из достоверных запасов, по разным данным, от 40 до 66 % никеля находится в «окисленных никелевых рудах» (ОНР), 33 % -- в сульфидных, 0,7 % -- в прочих. По состоянию на 1997 г. доля никеля, произведённого переработкой ОНР, составила порядка 40 % от общемирового объёма производства. В промышленных условиях ОНР делят на два типа: магнезиальные и железистые. Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5--50 % Ni+Co, в зависимости от состава сырья и технологических особенностей).Наиболее железистые -- латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90 % Ni), синтер (89 % Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт. Менее железистые -- нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей. Ещё один источник никеля: в золе углей Южного Уэльса в Англии -- до 78 кг никеля на тонну. Повышенное содержание никеля в некоторых каменных углях, пефтях, сланцах говорит о возможности концентрации никеля ископаемым органическим веществом. Причины этого явления пока не выяснены.
Применение:
Никель является основой большинства суперсплавов -- жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок. Монель-металл (65 -- 67 % Ni + 30 -- 32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив; белое золото (например, 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля (или палладия));нихром, сплав никеля и хрома (60 % Ni + 40 % Cr); пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис; инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании; Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина.Никель присутствует в качестве компонента ряда нержавеющих сталей.
Химическая технология.
Во многих химико-технологических процессах в качестве катализатора используется никель Ренея.
Радиационные технологии.
Нуклид 63Ni, излучающий в--частицы, имеет период полураспада 100,1 года и применяется в крайтронах, а также детекторах электронного захвата (ЭЗД) в газовой хроматографии.
Медицина.
Применяется при изготовлении брекет-систем (никелид титана).
Протезирование.
Монетное дело.
Никель широко применяется при производстве монет во многих странах. В США монета достоинством в 5 центов носит разговорное название «никель».
Никель – пластичный металл серебристо-белого цвета с характерным блеском. Относится к тяжелым цветным металлам. Никель ценная легирующая добавка. В природе в чистом виде никель не встречается, обычно входит в состав руд. Чистый никель (Nickel/Никель), Nickel 200 и Nickel 201 , добывают путем специальных технологий.
В соединении с другими металлами никель способен образовывать твердые и прочные никелевые сплавы:
- никель-медный сплав (Monel/Монель) – сплав на медной основе с никелем в качестве легирующей добавки. В составе обычно до 67% никеля и до 38% меди. К этой группе сплавов относят: Monel 400 , Monel 401, Monel 404, Monel R-405 , Monel K-500 и др.
- никель-хромовый сплав (Inconel/Инконель) – аустенитный жаропрочный сплав. К этой группе относят: Inconel 600 , Inconel 601 , Inconel 617 , Inconel 625 , Inconel 690 , Inconel 718 , Inconel 725 , Inconel X-750 и др.
- никель-железо-хромовый сплав (Inconloy/Инколой) – возможно добавление в сплав молибдена, меди, титана. К этой группе относят: Incoloy 20, Incoloy 800 , Incoloy 800H , Incoloy 800HT , Incoloy 825 , Incoloy 925 и др.
- никель-молибденовый сплав (Hastelloy/Хастеллой) – возможно присутствие в составе хрома, железа и углерода. К этой группе относят: Hastelloy C-4 , Hastelloy C-22 , Hastelloy C-276 , Hastelloy B-2 и др.
Свойства никеля
Никель – ферромагнетик, точка Кюри – 358°C, температура плавления – 1455°C, температура кипения – 2730-2915°C. Плотность – 8,9 г/см 3 , коэффициент теплового расширения -13,5∙10 −6 K −1. На воздухе компактный никель – стабилен, а высокодисперсный – пирофорен.
Никель обладает такими свойствами, как:
- пластичность и ковкость;
- прочность при высоких температурных режимах;
- устойчивость к окислению в воде и на воздухе;
- твердость и достаточная вязкость;
- высокая коррозионная стойкость;
- ферромагнетик;
- хороший катализатор;
- хорошо полируется.
Поверхность никеля покрыта тонким слоем оксида NiO, защищающим металл от окисления.
Преимущества и недостатки
Главные плюсы никеля и сплавов - жаропрочность, жаростойкость и повышенная механическая прочность (давление до 440 МПа). К достоинствам также можно отнести эксплуатацию в раскаленных концентрированных щелочных и кислотных растворах. Помимо этого никель способен сохранять магнитные свойства при пониженных температурах.
Главным недостатком никеля является значительное снижение показателей термоЭДС при быстром охлаждении после отжига (до 600°C). Также к минусам никеля можно отнести тот факт, что в природе чистый никель не встречается. Его получают путем дорогих технологий, что сказывается на его стоимости.
Область применения
Основная сфера применения никеля – металлургия. В ней он задействован в производстве высоколегированных нержавеющих сталей. Добавляя в расплав железа никель, металлурги получают прочные и пластичные сплавы, которые обладают повышенной коррозионной стойкостью и устойчивостью к высоким температурам. Стоит отметить, что никелевые сплавы сохраняют свои качества при многократном длительном нагревании.
Благодаря этим свойствам нержавеющая и термостойкая никелевая сталь применяется:
- в пищевой и химической промышленности;
- в нефтехимической промышленности и строительстве;
- в медицине и фармацевтике;
- в авиа- и машиностроении;
- в изготовлении подводных кабелей;
- в изготовлении нагревательных элементов промышленного оборудования;
- в производстве постоянных магнитов;
- в производстве станков и специального оборудования;
- в изготовлении интерьерных элементов зданий;
- в мебельной промышленности;
- в изготовлении бытовых приборов и домашней утвари;
Благодаря своей пластичности и легкости в ковке из никеля получают очень тонкие изделия, например, полосы, ленты и листы из никеля. Также никель активно используют в производстве проволоки и прутков.
Никель – элемент 10 группы таблицы Д.И. Менделеева. Известный сравнительно недавно, также недавно используемый в промышленности. Свое наименование никель получил от имени зловредного гнома, который вместо подбрасывал горнякам минерал никелин, включающий никель и мышьяк. Использовать в те давние времена никель не умели, так что металл-«обманку» стали называть «озорником» от немецкого Nickel.
И сегодня мы рассмотрим физико-химические свойства и применение никеля, дадим ему общую характеристику, изучим никелевые сплавы и марки.
Это переходный металл, то есть, проявляющий свойства и кислотные, и щелочные. Имеет серебристо-белый блеск, пластичный, ковкий, но твердый. Молекулярная масса невелика – 28, так что он относится к веществам легким.
Об особенностях никеля как металла расскажет этот видеоролик:
Понятие и особенности
С точки зрения химии никель – металл очень интересный и необычный. С одной стороны, он в состоянии вступать в реакцию и с кислотами, и с щелочами, но с другой, отличается химической инертностью и даже с концентрированными щелочами и кислотами отказывается реагировать. Причем свойство это настолько ярко выражено, что никель применяют при изготовлении разнообразной кислотоупорной аппаратуры и резервуаров для щелочей.
Металл выплавляется, а затем используется в виде прутков, листов и так далее. И в таком состоянии проявляет обычные металлические свойства малоактивного вещества. А вот превращенный в очень тонкий порошок никель становится пирофорным и способен самовоспламеняться на воздухе.
Секрет в том, что обычное вещество на воздухе, наподобие алюминия, например, покрывается оксидной пленкой, и эта пленка выступает в качестве прочнейшего защитного слоя.
Это качество обуславливает одно из самых старых применений металла – никелирование, то есть, нанесение на поверхность предметов тончайшего слоя никеля. Такой слой полностью защищает от коррозии сталь, чугун, магний, алюминий и так далее.
Изделия из чистого никеля встречаются редко и применяются только на особо ответственных участках. Его использование в промышленности обусловлено другим уникальным качеством: в сплаве никель сообщает материалу ту же превосходную стойкость к коррозии, которой обладает сам. Большинство нержавеющих и конструкционных сталей включает никель в качестве легирующего компонента. Именно он и обеспечивает стойкость стали и ее долговечность.
Сплавы на основе никеля очень разнообразны и отличаются замечательными свойствами: прочностью, жаростойкостью, способностью выдерживать высокие силовые нагрузки при высокой температуре, износостойкостью, нечувствительностью к химически агрессивным веществам и так далее. Из всего объема добываемого вещества в чистом виде используется около 9%. Еще 7% тратится на никелирование, а весь остальной объем расходуется на получение сплавов.
Никель составляет с железом и кобальтом триаду железа. В состав группы также входят и платиновые – осмий, платина, родий. Однако, несмотря на относительную близость, свойства металлов заметно отличаются. По прочности никель мало уступает железу, обладает даже более высокой плотностью, но в отличие от последнего очень стоек к коррозии, в то время как железо на воздухе, а тем более при контакте с водой быстро корродирует.
По сравнению с платиновыми металлами никель куда легче, значительно дешевле и гораздо активнее: платина, осмий и другие относятся к благородным металлам, которые имеют положительный электродный потенциал и являются крайне инертными.
Плюсы и минусы
 Практически все свойства никеля по отношению к народному хозяйству являются преимуществами. К недостаткам металла можно отнести лишь его нахождение в природе. Никель считается элементом распространенным, но встречается только в связанном виде. Самородный никель попадает на землю только в составе метеоритов. Соответственно, получают металл по более дорогим технологиям.
Практически все свойства никеля по отношению к народному хозяйству являются преимуществами. К недостаткам металла можно отнести лишь его нахождение в природе. Никель считается элементом распространенным, но встречается только в связанном виде. Самородный никель попадает на землю только в составе метеоритов. Соответственно, получают металл по более дорогим технологиям.
- Никель обладает неплохой прочностью и твердостью, при этом сохраняя способность к ковке и высокую вязкость: из него можно получать тончайшие листы и прутки.
- Металл обладает замечательной стойкостью к коррозии. Более того, это качество он передает сплавам, в состав которых входит в виде легирующего элемента.
- Сплавы на никелевой основе очень разнообразны и отличаются исключительными качествами. Так, жаропрочные железо-никелевые сплавы применяются при изготовлении частей атомных реакторов и реактивных двигателей. На сегодня описаны и используются около 3000 различных никелевых сплавов.
- Покрытие из никеля и сейчас активно применяется не только в приборо- и станкостроении, но и в быту, в строительстве. Никелированная посуда, столовые приборы, фурнитура и прочее не только эстетически привлекательны, но и абсолютно гигиеничны, безвредны и крайне долговечны. Инертность и гигиеничность металла обуславливает его использование в пищевой промышленности.
- Никель является ферромагнетиком, то есть, веществом склонным к самопроизвольному намагничиванию. Это свойство позволяет использовать металл для производства постоянных магнитов.
- Металл относительно дешев в получении и обладает хорошими характеристиками по электропроводности. Никель заменяет дорогое серебро или в производстве аккумуляторов.
Структура и химический состав никеля рассмотрены ниже.
Структура и состав
Никель, как и другие чистые металлы, обладает однородной, хорошо упорядоченной структурой, что и обеспечивает этим веществам способность проводить ток. Однако фазовый состав материала может быть разным, что влияет на его свойства.
- При нормальных условиях дело имеют с β-модификацией никеля. Она характеризуется гранецентрированной кубической решеткой и обуславливает привычные свойства металла – ковкость, пластичность, способность к механической обработке, ферромагнетизм и так далее.
- Существует и материал другого вида. Никель, подвергнутый катодному распылению в атмосфере водорода, в реакцию не вступает, но и меняет структуру, переходя в α-модификацию. Последняя имеет плотнейшую гексагональную решетку. При нагревании до 200 С α-фаза переходит в β-фазу. В промышленности имеют дело с β-модификацией никеля.
Данное видео расскажет о том, как самому переделать никель-кадмиевый аккумулятор на литий-ионный:
Свойства и характеристики
Характеристики β-фазы, как основной, представляют больший интерес, поскольку само существование α-фазы ограничено. Свойства металла таковы:
- плотность при нормальной температуре – 8,9 г/куб. см;
- температура плавления – 1453 С;
- температура кипения – 3000 С;
- очень низкий коэффициент теплового расширения – 13,5∙10 −6 K −1
- модуль упругости – 196–210 ГПа;
- предел упругости составляет 80 Мн/кв. м;
- предел текучести – 120 Мн/кв. м:
- предел растяжения 40–50 кгс/ кв. мм;
- удельная теплоемкость вещества – 0,440 кдж/(кг·К);
- теплопроводность – 90,1 вт/(м·К);
- удельное электрическое сопротивление – 0,0684 мкОм∙м.
Никель является ферромагнетиком, его точка Кюри – 358 С.
Об изготовлении и производителя никелевых сплавов поговорим ниже.
Производство
 Никель считается довольно распространенным – 13 место среди металлов. Однако распределение его несколько специфично. Металл не зря называют элементом земных глубин, поскольку в ультраосновных породах его в 200 раз больше, чем в кислых. По одной из распространенных теорий земное ядро состоит из никелистого железа.
Никель считается довольно распространенным – 13 место среди металлов. Однако распределение его несколько специфично. Металл не зря называют элементом земных глубин, поскольку в ультраосновных породах его в 200 раз больше, чем в кислых. По одной из распространенных теорий земное ядро состоит из никелистого железа.
Самородный никель на Земле не встречается. В связанном виде он наличествует в медно-никелевых рудах – мышьяксодержащих и сульфидных. Это никелин – красный никелевый колчедан, тот самый, который горняки принимали за , хлоантит – белый никелевый колчедан, гарниерит, медный колчедан и так далее.
Исходным сырьем чаще всего служит сульфидная руда, включающая и , и никель, поэтому в включены дополнительные этапы по разделению металлов.
- Сульфидные руды обычно содержат много влаги и глинистых веществ. Чтобы избавиться от них, руду измельчают, сушат и брикетируют. При слишком высоком содержании серы в руде ее обжигают.
- Плавка на штейн – осуществляются в шахтных или отражательных печах. Получают сплав сульфида никеля и железа, включая небольшое количество меди.
- Разделение никеля и меди.
- Обжиг никелевого концентрата, восстановительная плавка и рафинирование электролизом.
Способ получения никеля из окисленной руды выглядит несколько иначе.
- Руду подвергают сульфидизирующей плавке с частичным восстановлением.
- Получают файнштейн – расплавленный штейн продувают воздухом в конверторах.
- Файнштейн обжигают и очищают от меди;
- Затем восстанавливают никель либо плавят обожженную крицу на ферроникель.
А сколько стоит 1 кг никеля? Цены на такой металл во многом определяются успехом эксплуатации месторождений. Так, в 2013 году Китай увеличил производство никельсодержащего чугуна, что привело к заметному падению цен на металл. В 2016 году осенью стоимость тонны металла составляла 10045$.
Область применения
Никель сам по себе используется достаточно редко. Гораздо шире область .
- В быту чаще всего сталкиваются с никелированными изделиями – краны, смесители, мебельная фурнитура. Металлические части мебели довольно часто покрыты слоем серебристого не тускнеющего металла. То же самое касается столовых приборов и посуды.
- Еще один известный способ использования – белое золото. В его состав входит золото определенной пробы и сплав никеля.
- В электротехнике широчайшее распространение нашли никелевые катоды. Многочисленные аккумуляторы – никель-кадмиевые. Никель- , железо-никелевые и так далее составляют конкуренцию аккумулятором и при этом намного безопаснее.
Однако основным потребителем никеля является цветная и черная металлургия: 67% всего добытого металла используется для получения нержавеющих сталей. А 17% – на изготовление других, не железных сплавов.
- Конструкционная и нержавеющая сталь применяется буквально везде: строительство и машиностроение, электротехника и изготовление трубопроводов, приборостроение и сооружение несущих каркасов. Именно никель придает сталям их стойкость к коррозии.
- Никель-медные сплавы чаще всего применяются при изготовлении кислотоупорной аппаратуры и разнообразных деталей, которые должны работать в условиях агрессивной химической среды.
- Сплавы никеля и хрома знамениты своей жаропрочностью и стойкость к щелочам и кислотам. Их используют в печах, атомных реакторах, двигателях и так далее.
- Сплавы никеля, хрома и железа, кроме того, сохраняют стойкость к высокой нагрузке при очень высоких температурах – до 900 С. Это незаменимый материал для газовых турбин.
Никель – металл с . Прочный, ковкий, стойкий к кислотам и щелочам и способный передать эти свойства практически любому сплаву. Неудивительно, что никель так широко применяется.
Простой и надежный способ восстановления никель-кадмиевых аккумуляторов рассмотрен в видео ниже:
Свойства никеля являются важными параметрами для поиска, переработки и сфер применения металла. Они учитываются при формировании составов с другими материалами.
Свойства никеля определяют его использование в производстве
Никель — это металл со свойственным ему серебристо-белым цветом. При температуре 1453 °C переходит в жидкое состояние, а кипит при 2732 °C. Никель пластичен, легко поддается обработке под воздействием давления.
Химическое свойство никеля характеризуется способностью образовывать соединения с разной степенью окисления. В естественных условиях на поверхности металла возникает тонкая пленка из оксида.
Металл обладает высоким показателем устойчивости к коррозии. Никель не реагирует с рядом концентрированных кислот и щелочей, но активно растворяется в разбавленной азотной кислоте.

Вступая в химические реакции, никель образует летучие металлы и растворимые/нерастворимые соли
С никелем не вступают в реакцию:
- инертные газы;
- литий;
- калий;
- натрий;
- цезий;
- рубидий;
- стронций;
- барий;
- иридий;
- цезий.
С углеродным соединением никель образует карбонил - летучий переходный металл, используемый в процессе получения материалов высокого класса чистоты. Порошок никеля способен самовоспламеняться при соприкосновении с воздухом с образованием оксидов.
Никель продуцирует ряд растворимых и нерастворимых солей. Например, раствор сульфата металла придает жидкости зеленую окраску. Нерастворимые соли обычно имеют насыщенный желтый цвет.
Формы нахождения металла
В естественных условиях никель встречается в сочетании с рядом химических элементов, а в форме самородков находится в железных метеоритах.
В гидротермальных условиях никель формирует соединения с мышьяком, кобальтом, серебром. Повышенные концентрации металла связаны с минеральными образованиями-арсенидами и сульфидами.

В природе никель обычно находится в соединениях с другими элементами
Сырьем для извлечения ценного компонента являются сульфидные, медно-никелевые руды с содержанием мышьяка:
- никелин - соединение с мышьяком;
- хлоантит - белый колчедан, содержащий кобальт и железо;
- гарниерит - силикатная порода с содержанием магния;
- магнитный колчедан - соединение серы с железом и медью;
- герсдорфит - мышьяково-никелевый блеск;
- пентландит - соединение серы, железа и никеля.
Содержание металла в живых организмах зависит от условий и среды обитания. Некоторые представители флоры и фауны способны концентрировать металл.
Основные месторождения руд находятся в Канаде, Российской Федерации, Албании, ЮАР, на Кубе, в Греции.
Процесс извлечения металла из руд предусматривает применение технологий в зависимости от типа сырья. Иногда никель является второстепенным материалом обогащения породы.
Тугоплавкие руды с содержанием магния подвергают электрической выплавке. Содержащие железо латеритовые руды перерабатывают гидрометаллургическим методом с последующей обработкой щелочными растворами.
Породу с меньшим содержанием железа плавят, подвергают обжигу и электрической выплавке. Попутно извлекают металлический кобальт или его соли. Повышенное содержание металла наблюдается в золе каменных углей в Англии. Этот факт связывают с деятельностью микроорганизмов, концентрирующих никель.
Пластичность и другие физические свойства никелевых составов зависят от чистоты материала. Незначительная примесь серы придает металлу хрупкость. Добавление в расплавленный материал магния очищает смесь от второстепенных примесей с образованием соединения с серой.
Отрасли применения никеля
Физико-химические свойства металла определяют его использование:
- в изготовлении нержавеющей стали;
- для формирования сплавов, не содержащих железо;
- с целью нанесения защитных покрытий на изделия гальваническим способом;
- для производства химических реактивов;
- в порошковой металлургии.
Металл применяют при производстве аккумуляторов, с его помощью происходят каталитические процессы химических реакций в промышленном производстве. Сплавы с титаном являются отличным материалом для изготовления протезов и приспособлений для выравнивания зубов.
Состав на основе химического элемента № 28 является сырьем для чеканки монет, изготовления спиралей электронных сигарет. Его используют для обмотки струн музыкальных инструментов.
При изготовлении сердечников для электромагнитов используются составы - пермаллои, включающие 20–60% железа. Никель используется при изготовлении различных деталей и аппаратуры для химической отрасли промышленности.
Оксиды металла применяются при производстве стекла, глазури и керамических изделий. Современное производство специализируется на изготовлении разнообразного проката: проволоки, ленты, фольги, трубок.

Никель имеет широкую сферу применения от покрытий до химических реактивов
Устойчивость к агрессивной среде позволяют использовать прокат из никеля для транспортировки щелочей в химической отрасли.
Инструменты из сплава на основе никеля применяются в медицине и при проведении научных исследований. Металл используется при создании точных приборов для дистанционного управления процессами в атомной энергетике, радиолокационных установок.
Характеристика никелевых сплавов
В составах металл сочетается в основном с железом и кобальтом. Его применяют в качестве лигатурного компонента для производства различных конструкционных видов стали, магнитных и немагнитных сплавов.
Металлические сплавы на основе химического элемента № 28 обладают прочностью, устойчивостью к температурам, деформации, влиянию внешней среды. Их число достигает нескольких тысяч. Самыми распространенными составами являются сочетания с хромом, молибденом, алюминием, титаном, бериллием.
Металл считается лигатурным компонентом золота, придающим ювелирным изделиям характерный белый цвет и прочность. По отношению к этому составу существуют мнения об аллергическом влиянии никеля на кожу.
В сочетании с хромом образуется соединение нихром, обладающее устойчивостью к высокой температуре, минимальным коэффициентом электрического сопротивления, пластичностью.
Его применяют для изготовления нагревательных приборов, деталей, в качестве покрытия. Высокая прочность соединения позволяет подвергать его механической обработке, точению, сварке, штамповке.

Никелевые сплавы обладают высокой прочностью, что позволяет широко использовать их в производстве
Особую группу образуют сплавы, в состав которых включена медь. Среди них самыми популярными являются:
- монель;
- латунь;
- бронза;
- нейзильбер.
Более века назад было установлено, что железно-никелевый состав, содержащий 28% описываемого металла, теряет свои свойства к намагничиванию. Сплавам, содержащим 36% никеля, свойственен незначительный показатель линейного расширения, что позволяет его применять в изготовлении точных приборов и инструментов.
Этот состав, который обозначается FeNi36, называется инваром, то есть «неизменным». Широкое применение в производстве нашел сплав ковар, содержащий 29%никеля, 17% кобальта и 54% железа.
Он обладает высокой адгезией к расплавленному стеклу, что позволяет использовать состав для изготовления электрических выводов, проходящих через данное вещество.