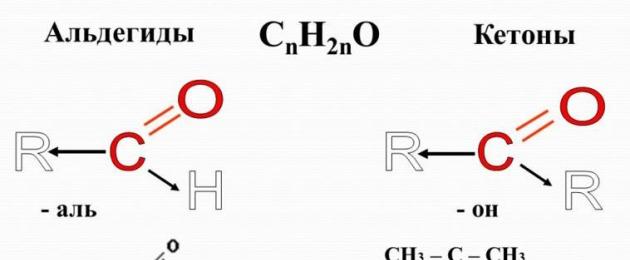
Aldehídos – materia orgánica, cuyas moléculas contienen un grupo carbonilo C=O, conectado a un átomo de hidrógeno y un radical hidrocarbonado.
Aldehídos – materia orgánica, cuyas moléculas contienen un grupo carbonilo C=O, conectado a un átomo de hidrógeno y un radical hidrocarbonado.
La fórmula general de los aldehídos es:

En el aldehído más simple, el formaldehído, el papel de un radical hidrocarbonado lo desempeña otro átomo de hidrógeno:

Un grupo carbonilo unido a un átomo de hidrógeno a menudo se llama aldehído:
Cetonas– sustancias orgánicas en cuyas moléculas el grupo carbonilo está asociado con dos radicales hidrocarbonados. Obviamente, la fórmula general de las cetonas es:

El grupo carbonilo de las cetonas se llama grupo ceto.
En la cetona más simple, la acetona, el grupo carbonilo está unido a dos radicales metilo:

Nomenclatura e isomería de aldehídos y cetonas.
Dependiendo de la estructura del radical hidrocarbonado unido al grupo aldehído, se distinguen aldehídos saturados, insaturados, aromáticos, heterocíclicos y otros:

De acuerdo con la nomenclatura IUPAC, los nombres de los aldehídos saturados se forman a partir del nombre de un alcano con el mismo número de átomos de carbono en la molécula usando el sufijo -Alabama. Por ejemplo:

La numeración de los átomos de carbono de la cadena principal comienza con el átomo de carbono del grupo aldehído. Por tanto, el grupo aldehído siempre está situado en el primer átomo de carbono y no es necesario indicar su posición.
Junto con la nomenclatura sistemática, también se utilizan nombres triviales de aldehídos ampliamente utilizados. Estos nombres suelen derivarse de los nombres de los ácidos carboxílicos correspondientes a los aldehídos.
Para nombrar cetonas según la nomenclatura sistemática, el grupo ceto se designa con el sufijo -Él y un número que indica el número del átomo de carbono del grupo carbonilo (la numeración debe comenzar desde el extremo de la cadena más cercano al grupo ceto). Por ejemplo:
Los aldehídos se caracterizan por un solo tipo de isomería estructural: la isomería del esqueleto de carbono, que es posible con el butanal, y para las cetonas también la isomería de la posición del grupo carbonilo. Además, se caracterizan por la isomería entre clases (propanal y propanona).

Propiedades físicas de los aldehídos.
En una molécula de aldehído o cetona, debido a la mayor electronegatividad del átomo de oxígeno en comparación con el átomo de carbono, el enlace C=O altamente polarizado debido a un cambio en la densidad electrónica π -enlaces al oxígeno:

Los aldehídos y las cetonas son sustancias polares con un exceso de densidad electrónica en el átomo de oxígeno. Los miembros inferiores de la serie de aldehídos y cetonas (formaldehído, acetaldehído, acetona) son ilimitadamente solubles en agua. Sus puntos de ebullición son más bajos que los de los alcoholes correspondientes. Esto se debe al hecho de que en las moléculas de aldehídos y cetonas, a diferencia de los alcoholes, no hay átomos de hidrógeno móviles y no forman asociaciones debido a enlaces de hidrógeno. Los aldehídos inferiores tienen un olor acre; los aldehídos que contienen de cuatro a seis átomos de carbono en la cadena tienen un olor desagradable; Los aldehídos y cetonas superiores tienen olores florales y se utilizan en perfumería. .

Propiedades químicas de aldehídos y cetonas.
La presencia de un grupo aldehído en una molécula determina propiedades características aldehídos.
1. Reacciones de reducción.
La adición de hidrógeno a las moléculas de aldehído se produce a través del doble enlace del grupo carbonilo. El producto de la hidrogenación de los aldehídos son alcoholes primarios y las cetonas son alcoholes secundarios. Así, cuando se hidrogena acetaldehído sobre un catalizador de níquel, se forma alcohol etílico y cuando se hidrogena acetona, se forma 2-propanol.

Hidrogenación de aldehídos.- una reacción de reducción en la que disminuye el estado de oxidación del átomo de carbono incluido en el grupo carbonilo.
2. Reacciones de oxidación. Los aldehídos no sólo se pueden reducir, sino también oxidar. Cuando se oxidan, los aldehídos forman ácidos carboxílicos.
Oxidación por oxígeno atmosférico.. Por ejemplo, el ácido propiónico se forma a partir de aldehído propiónico (propanal):

Oxidación con agentes oxidantes débiles.(solución amoniacal de óxido de plata).

Si la superficie del recipiente en el que se realiza la reacción ha sido previamente desengrasada, la plata formada durante la reacción la cubre con una película fina y uniforme. Esto hace un maravilloso espejo plateado. Por lo tanto, esta reacción se llama reacción del “espejo de plata”. Se utiliza mucho para fabricar espejos, adornos plateados y adornos para árboles de Navidad.
3. Reacción de polimerización:
n CH 2 =O → (-CH 2 -O-) n paraformas n=8-12
Preparación de aldehídos y cetonas.

Aplicación de aldehídos y cetonas.
Formaldehído(metanal, aldehído fórmico) H 2 C=O:
a) para la producción de resinas de fenol-formaldehído;
b) obtención de resinas de urea-formaldehído (urea);
c) polímeros de polioximetileno;
d) síntesis medicamentos(urotropina);
e) desinfectante;
f) un conservante para preparaciones biológicas (debido a la capacidad de coagular proteínas).
acetaldehído(etanal, acetaldehído) CH 3 CH=O:
a) producción de ácido acético;
b) síntesis orgánica.
Acetona CH3-CO-CH3:
a) disolvente para barnices, pinturas, acetatos de celulosa;
b) materias primas para la síntesis de diversas sustancias orgánicas.
El acetaldehído tiene la fórmula química CH3COH. Es incoloro, transparente, con un olor acre, puede hervir ya a temperatura ambiente de 20°C y se disuelve fácilmente en agua y compuestos orgánicos. Dado que la ciencia no se detiene, ahora es bastante sencillo obtener acetaldehído a partir de alcohol etílico.
La naturaleza de las dos sustancias principales.

El acetaldehído (etanal) es común en la naturaleza y se encuentra en los alimentos y en la mayoría de las plantas. El etanal también es un componente de los gases de escape de los automóviles y del humo de los cigarrillos, por lo que pertenece a la categoría de sustancias tóxicas fuertes. Se puede sintetizar artificialmente de diferentes formas. El método más popular es obtener acetaldehído a partir de alcohol etílico. El óxido de cobre (o plata) se utiliza como catalizador. La reacción produce aldehído, hidrógeno y agua.
El alcohol etílico (etanol) es el C2H5OH de calidad alimentaria común. Se utiliza ampliamente en la producción de bebidas alcohólicas, en medicina para desinfección, en la producción de productos químicos domésticos, perfumes, productos de higiene y otros.
El alcohol etílico no se encuentra en la naturaleza; se produce mediante reacciones químicas. Los principales métodos de obtención de la sustancia son los siguientes:

- Fermentación: Ciertas frutas o verduras están expuestas a la levadura.
- Fabricación en condiciones industriales (uso de ácido sulfúrico).
El segundo método proporciona una mayor concentración de etanol. Con la primera opción, sólo se puede conseguir alrededor del 16% de esta sustancia.
Métodos para producir acetaldehído a partir de etanol.
El proceso de obtención de acetaldehído a partir de alcohol etílico se da según la siguiente fórmula: C2H5OH + CuO = CH3CHO + Cu + H2O
En este caso se utiliza etanol y óxido de cobre, bajo la influencia de altas temperaturas se produce una reacción de oxidación y se obtiene acetaldehído.
También existe otro método para producir aldehído: la deshidrogenación del alcohol. Apareció hace unos 60 años y sigue siendo popular hoy en día. La deshidrogenación tiene muchas cualidades positivas:

- no hay emisiones de toxinas tóxicas que envenenen la atmósfera;
- condiciones de reacción cómodas y seguras;
- durante la reacción se libera hidrógeno, que también se puede utilizar;
- No es necesario gastar dinero en componentes adicionales, solo el alcohol etílico es suficiente.
La producción de aldehído mediante este método se produce de la siguiente manera: el etanol se calienta a cuatrocientos grados y se libera hidrógeno catalíticamente. La fórmula del proceso se ve así: C2H5OH ͢ CH3CHO + H2.
La eliminación del hidrógeno se produce por alta temperatura y baja presión. Tan pronto como la temperatura baje y la presión aumente, el H2 regresará y el acetaldehído volverá a convertirse en alcohol.
Cuando se utiliza el método de deshidratación, también se utiliza un catalizador de cobre o zinc. El cobre en este caso es una sustancia muy activa que puede perder actividad durante la reacción. Por lo tanto, se elabora una mezcla de óxidos de cobre, cobalto y cromo, que luego se aplica al amianto. Esto permite llevar a cabo la reacción a una temperatura de 270-300°C. En este caso, la transformación del etanol alcanza del 34 al 50%.
Determinar el mejor método

Si comparamos el método de oxidación del alcohol con el método de deshidratación, el segundo tiene una clara ventaja, ya que produce sustancias mucho menos tóxicas y al mismo tiempo detecta la presencia de una alta concentración de etanal en los gases de contacto. Cuando se deshidratan, estos gases contienen solo acetaldehído e hidrógeno, y cuando se oxidan, contienen etanol diluido con nitrógeno. Por tanto, es más fácil obtener acetaldehído a partir de gases de contacto y sus pérdidas serán mucho menores que durante el proceso de oxidación.

Otra cualidad importante del método de deshidratación es que la sustancia resultante se utiliza para producir ácido acético. Para ello, tome sulfato de mercurio y agua. El resultado es una reacción según el siguiente esquema: CH3CHO + HgSO4 + H2O = CH3COOH + H2SO4 + Hg.
Para completar la reacción se añade sulfato ferroso, que oxida el mercurio. Para aislar el ácido acético, la solución resultante se filtra y se añade una solución alcalina.
Si no hay HgSO4 ya preparado (un compuesto inorgánico de una sal metálica y ácido sulfúrico), entonces se prepara usted mismo. Es necesario añadir 1 parte de óxido de mercurio por 4 partes de ácido sulfúrico.
Método adicional

Existe otra forma de obtener acetaldehído. Se utiliza para determinar la calidad del alcohol resultante. Para implementarlo necesitarás: ácido fucsinoso, alcohol etílico y una mezcla de cromo (K2Cr2O7 + H2SO4).
Vierta la mezcla de cromo (2 ml) en un matraz seco, agregue una piedra para hervir y agregue alcohol etílico (2 ml). Se tapa el tubo de ensayo con un tubo para eliminar gases y se inserta el otro extremo en un recipiente con ácido fucsinoso. La mezcla se calienta y como resultado cambia de color a verde. Durante la reacción, el etanol se oxida y se convierte en acetaldehído, que fluye a través del tubo en forma de vapor y, al entrar en un tubo de ensayo con ácido fucsinoso, lo tiñe de carmesí.
ACETALDEHÍDO (acetaldehído, etanal) - aldehído alifático, CH 3 CHO; Metabolito formado durante la fermentación alcohólica, la oxidación del alcohol etílico, incluso en el cuerpo humano, y en otras reacciones metabólicas. U. a. utilizado en la producción de diversos medicamentos (ver), ácido acético (ver), ácido peracético CH 3 COOOH, anhídrido acético (CH 3 CO) 2 O, acetato de etilo, así como en la producción de resinas sintéticas, etc. industrias constituye un riesgo laboral.
U. a. es un líquido incoloro con un olor acre, temperatura de fusión -123,5°, temperatura de ebullición 20,2°, su densidad relativa a 20° 0,783, índice de refracción a 20° 1,3316, límites de concentración explosiva (CEL) 3, 97 - 57%. Con agua, alcohol etílico, éter y otros disolventes orgánicos U. a. se mezcla en cualquier proporción.
U. a. entra en todas las reacciones características de los aldehídos (ver), en particular se oxida a ácido acético, sufre condensación aldólica y crotónica, forma éter etílico acético según la reacción de Tishchenko y derivados característicos de los aldehídos en el grupo carbonilo. En presencia de ácidos, U. a. polimeriza formando un tetrámero cristalino cíclico de metaldehído o paraldehído líquido. A escala industrial, U. a. se obtiene por hidratación de acetileno (ver) en presencia de catalizadores - sales de mercurio, oxidación de alcohol etílico (ver) y el método más económico - oxidación de etileno (ver Hidrocarburos) en presencia de un catalizador de paladio.
Detección cualitativa de U. a. basado en la aparición de una coloración azul como resultado de la interacción de U. a. con nitroprusiato de sodio en presencia de aminas. La determinación cuantitativa consiste en la obtención de cualquier derivada de U. a. por grupo carbonilo y su peso, volumen (ver Análisis titrimétrico) o determinación colorimétrica (ver Colorimetría).
Educación U. a. como producto intermedio del metabolismo se encuentra tanto en organismos vegetales como animales. La primera etapa de la transformación del alcohol etílico en el cuerpo de humanos y animales es su oxidación a uranio. en presencia de alcohol deshidrogenasa (ver). U. a. también se forma durante la descarboxilación (ver) del piruvato (ver ácido pirúvico) durante la fermentación alcohólica y durante la descomposición de la treonina (ver) bajo la acción de la treonina aldolasa (EC 4.1.2.5). En el cuerpo humano U. a. se oxida a ácido acético. Arr. en el hígado bajo la influencia de la aldehído oxidasa dependiente de NAD (EC 1.2.3.1), la acetaldehído oxidasa y la xantoquinasa. U. a. Participa en la biosíntesis de treonina a partir de glicina (ver). En la sala de tratamiento de drogas En la práctica, el uso de te tu frame (ver) se basa en la capacidad de este fármaco para bloquear específicamente la acetaldehído oxidasa, lo que conduce a la acumulación de U. a. en la sangre. y, como resultado, a una fuerte reacción autonómica: dilatación de los vasos periféricos, palpitaciones, dolor de cabeza, asfixia, náuseas.
El acetaldehído como riesgo laboral
Con crónica exposición de humanos a bajas concentraciones de vapores de U. a. Se observa irritación transitoria de las membranas mucosas del tracto respiratorio superior y la conjuntiva. Parejas U. a. en el aire inhalado, en altas concentraciones, provocan un aumento de la frecuencia cardíaca y de la sudoración; signos de un fuerte efecto irritante de los vapores de U. a. en estos casos se intensifican (especialmente por la noche) y pueden combinarse con asfixia, tos seca dolorosa y dolor de cabeza. Las consecuencias de tal intoxicación son bronquitis y neumonía.
Contacto de la piel con líquido U. a. Puede provocar hiperemia y aparición de infiltrados.
Primeros auxilios y terapia de emergencia.
En caso de intoxicación con vapores de U. a. la víctima debe ser sacada al aire libre, con la inhalación de vapor de agua con amoníaco, si está indicado: inhalación de oxígeno humidificado, medicamentos para el corazón, estimulantes respiratorios (lobelina, citotona), tintura de valeriana, preparaciones de bromo. En caso de irritación grave de las membranas mucosas del tracto respiratorio: inhalaciones alcalinas o oleosas. Para la tos dolorosa: codeína, clorhidrato de etilmorfina (dionina), tiritas de mostaza, tazas. Si la conjuntiva está irritada, lavar abundantemente los ojos con agua o solución isotónica de cloruro de sodio. En caso de intoxicación por la boca, enjuague inmediatamente el estómago con agua con la adición de una solución de amoníaco (amoniaco) y una solución de bicarbonato de sodio al 3%. El tratamiento adicional es sintomático. Al contactar con U. a. en la piel: lave inmediatamente el área afectada con agua, pero preferiblemente con una solución de amoníaco al 5%.
La víctima debe ser retirada del trabajo con sustancias peligrosas hasta su recuperación (ver Enfermedades profesionales).
Medidas para prevenir la intoxicación U. a. consisten en equipos de sellado, funcionamiento sin problemas de la ventilación (ver), mecanización y automatización del embotellado y transporte de U. a. Tienda U. a. necesario en recipientes herméticamente cerrados. En las instalaciones de producción y laboratorios asociados al contacto con productos químicos se deben observar estrictamente las medidas de higiene personal, el uso de ropa y calzado especial, gafas de seguridad y respiradores universales.
Concentración máxima permitida de vapores de U. a. en el aire del área de trabajo 5 mg/m3.
Bibliografía: Sustancias nocivas en la industria, ed. N. V. Lazarev y E. N. Levina, volumen 1, L., 1976; Lebedev N. N. Química y tecnología de síntesis orgánica y petroquímica básica, M., 1981; White A. et al.Fundamentos de bioquímica, trad. Del inglés, volúmenes 1-3, M., 1981,
A. N. Klimov, D. V. Ioffe; N. G. Budkovskaya (concierto),
El acetaldehído pertenece a compuestos orgánicos y pertenece a la clase de los aldehídos. ¿Qué propiedades tiene esta sustancia y cómo es la fórmula del acetaldehído?
características generales
El acetaldehído tiene varios nombres: acetaldehído, etanal, metil formaldehído. Este compuesto es un aldehído de ácido acético y etanol. Su fórmula estructural es la siguiente: CH 3 -CHO.

Arroz. 1. Fórmula química acetaldehído.
La peculiaridad de este aldehído es que se encuentra tanto en la naturaleza como se produce artificialmente. En la industria, el volumen de producción de esta sustancia puede alcanzar hasta 1 millón de toneladas por año.
El etanal se encuentra en alimentos como el café, el pan y también lo sintetizan las plantas durante el metabolismo.
El acetaldehído es un líquido incoloro con un olor acre. Soluble en agua, alcohol y éter. Es venenoso.

Arroz. 2. Acetaldehído.
El líquido hierve a una temperatura bastante baja: 20,2 grados centígrados. Debido a esto, surgen problemas con su almacenamiento y transporte. Por tanto, la sustancia se almacena en forma de paraldehído y a partir de ella se obtiene acetaldehído, si es necesario, calentando con ácido sulfúrico (o cualquier otro ácido mineral). El paraldehído es un trímero cíclico del ácido acético.
Métodos de obtención
El acetaldehído se puede obtener de varias formas. La opción más común es la oxidación de etileno o, como también se llama a este método, el proceso de Wacker:
2CH2 =CH2 +O2 -2CH3CHO
El agente oxidante en esta reacción es el cloruro de paladio.
Además, el acetaldehído se puede obtener haciendo reaccionar acetileno con sales de mercurio. Esta reacción lleva el nombre del científico ruso y se llama reacción de Kucherov. Como resultado del proceso químico, se forma un enol, que se isomeriza a un aldehído.
C2H2 +H2O=CH3CHO

Arroz. 3. Retrato de M. G. Kucherov.
DEFINICIÓN
Aldehídos– sustancias orgánicas que pertenecen a la clase de compuestos carbonílicos que contienen el grupo funcional –CH = O, que se llama carbonilo.
La fórmula general de los aldehídos y cetonas saturados es C n H 2 n O. Los nombres de los aldehídos contienen el sufijo –al.
Los representantes más simples de los aldehídos son formaldehído (formaldehído) -CH 2 = O, acetaldehído (aldehído acético) - CH 3 -CH = O. Hay aldehídos cíclicos, por ejemplo, ciclohexano-carbaldehído; Los aldehídos aromáticos tienen nombres triviales: benzaldehído, vainillina.
El átomo de carbono en el grupo carbonilo está en un estado de hibridación sp 2 y forma enlaces 3σ (dos enlaces C-H y un enlace C-O). El enlace π está formado por los electrones p de los átomos de carbono y oxígeno. El doble enlace C=O es una combinación de enlaces σ y π. La densidad electrónica se desplaza hacia el átomo de oxígeno.
Los aldehídos se caracterizan por la isomería del esqueleto carbonado, así como por la isomería interclase con cetonas:
CH3-CH2-CH2-CH=O (butanal);
CH3-CH(CH3)-CH=O(2-metilpentanal);
CH 3 -C (CH 2 -CH 3) = O (metil etil cetona).
Propiedades químicas de los aldehídos.
Las moléculas de aldehído tienen varios centros de reacción: un centro electrófilo (átomo de carbono carbonilo), que participa en reacciones de adición nucleofílica; el centro principal es un átomo de oxígeno con pares de electrones solitarios; centro ácido α-CH responsable de las reacciones de condensación; conexión C-H, rompiéndose en reacciones de oxidación.
1. Reacciones de suma:
- agua con formación de hemodioles
R-CH = O + H2O ↔ R-CH(OH)-OH;
— alcoholes con formación de hemiacetales
CH3-CH= O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
— tioles con formación de ditioacetales (en un ambiente ácido)
CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5)-SC2H5 + H2O;
— hidrosulfito de sodio con formación de α-hidroxisulfonatos de sodio
C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-SO3Na;
- aminas con formación de iminas N-sustituidas (bases de Schiff)
C6H5CH = O + H2NC6H5 ↔ C6H5CH = NC6H5 + H2O;
- hidracinas para formar hidrazonas
CH3-CH = O + 2 HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
— ácido cianhídrico con formación de nitrilos
CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
- recuperación. Cuando los aldehídos reaccionan con el hidrógeno, se obtienen alcoholes primarios:
R-CH = O + H2 → R-CH2-OH;
2. Oxidación
- reacción del “espejo de plata” - oxidación de aldehídos con una solución amoniacal de óxido de plata
R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓;
- oxidación de aldehídos con hidróxido de cobre (II), que da como resultado la formación de un precipitado rojo de óxido de cobre (I)
CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu2O↓ + 2H2O;
Estas reacciones son reacciones cualitativas a los aldehídos.
Propiedades físicas de los aldehídos.
Primer representante series homólogas aldehídos - formaldehído (formaldehído) - una sustancia gaseosa (n.s.), aldehídos de estructura y composición no ramificada C 2 -C 12 - líquidos, C 13 y más - sólidos. Cuantos más átomos de carbono contenga un aldehído puro, mayor será su punto de ebullición. Con aumento peso molecular aldehídos, aumentan los valores de su viscosidad, densidad e índice de refracción. El formaldehído y el acetaldehído pueden mezclarse con agua en cantidades ilimitadas, sin embargo, con el crecimiento de la cadena de hidrocarburos, esta capacidad de los aldehídos disminuye. Los aldehídos inferiores tienen un olor acre.
Preparación de aldehídos
Los principales métodos para obtener aldehídos:
- hidroformilación de alquenos. Esta reacción consiste en la adición de CO e hidrógeno a un alqueno en presencia de carbonilos de algunos metales del Grupo VIII, por ejemplo, octacarbonil dicobalto (Co 2 (CO) 8).La reacción se lleva a cabo calentando a 130 C y a presión de 300 atm
CH3-CH=CH2+CO+H2 →CH3-CH2-CH2-CH=O + (CH3)2CHCH=O;
- hidratación de alquinos. La interacción de los alquinos con el agua se produce en presencia de sales de mercurio (II) y en un ambiente ácido:
HC≡CH + H2O → CH3-CH = O;
- oxidación de alcoholes primarios (la reacción ocurre cuando se calienta)
CH 3 -CH 2 -OH + CuO → CH 3 -CH = O + Cu + H 2 O.
Aplicación de aldehídos
Los aldehídos se utilizan ampliamente como materia prima para la síntesis de diversos productos. Así, a partir del formaldehído (producción a gran escala) se obtienen diversas resinas (fenol-formaldehído, etc.) y medicamentos (urotropina); El acetaldehído es una materia prima para la síntesis de ácido acético, etanol, diversos derivados de piridina, etc. Muchos aldehídos (butírico, canela, etc.) se utilizan como ingredientes en perfumería.
Ejemplos de resolución de problemas
EJEMPLO 1
| Ejercicio | Por bromación de C n H 2 n +2 obtuvimos 9,5 g de monobromuro que, cuando se trató con una solución diluida de NaOH, se convirtió en un compuesto que contiene oxígeno. Sus vapores con aire pasan a través de una malla de cobre caliente. Cuando la nueva sustancia gaseosa resultante se trató con un exceso de solución de amoníaco de Ag 2 O, se liberaron 43,2 g de sedimento. Qué hidrocarburo se tomó y en qué cantidad, si el rendimiento en la etapa de bromación es del 50%, el resto de reacciones proceden de forma cuantitativa. |
| Solución | Anotemos las ecuaciones de todas las reacciones que ocurren: C norte H 2n+2 + Br 2 = C norte H 2n+1 Br + HBr; C norte H 2 n + 1 Br + NaOH = C norte H 2 n + 1 OH + NaBr; C norte H 2 n + 1 OH → R-CH = O; R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓. El precipitado liberado en la última reacción es plata, por lo tanto, puedes encontrar la cantidad de sustancia liberada plata: M(Ag) = 108 g/mol; v(Ag) = m/M = 43,2/108 = 0,4 mol. Según las condiciones del problema, después de pasar la sustancia obtenida en la reacción 2 sobre una malla metálica caliente, se formó un gas, y el único gas, el aldehído, es el metanal, por lo que la sustancia de partida es el metano. CH4 + Br2 = CH3Br + HBr. Cantidad de sustancia bromometano: v(CH3Br) = m/M = 9,5/95 = 0,1 mol. Entonces, la cantidad de sustancia metano necesaria para obtener un rendimiento del 50% de bromometano es 0,2 moles. M(CH4) = 16 g/mol. Por tanto, la masa y el volumen de metano: m(CH4) = 0,2×16 = 3,2 g; V(CH4) = 0,2 × 22,4 = 4,48 l. |
| Respuesta | Masa de metano - peso 3,2 g, volumen de metano - 4,48 l |
EJEMPLO 2
| Ejercicio | Escribe las ecuaciones de reacción que se pueden utilizar para llevar a cabo las siguientes transformaciones: buteno-1 → 1-bromobutano + NaOH → A – H 2 → B + OH → C + HCl → D. |
| Solución | Para obtener 1-bromobutano a partir de buteno-1, es necesario realizar una reacción de hidrobrominación en presencia de compuestos de peróxido R 2 O 2 (la reacción transcurre en contra de la regla de Markovnikov): CH3-CH2-CH = CH2 + HBr → CH3-CH2-CH2-CH2Br. Al interactuar con una solución acuosa de álcali, el 1-bromobutano sufre hidrólisis para formar butanol-1 (A): CH3-CH2-CH2-CH2Br + NaOH → CH3-CH2-CH2-CH2OH + NaBr. El butanol-1, cuando se deshidrogena, forma un aldehído - butanal (B): CH3-CH2-CH2-CH2OH → CH3-CH2-CH2-CH=O. Una solución de amoníaco de óxido de plata oxida el butanal a sal de amonio: butirato de amonio (C): CH 3 -CH 2 -CH 2 -CH = O + OH →CH 3 -CH 2 -CH 2 -COONH 4 + 3NH 3 + 2Ag↓ +H 2 O. El butirato de amonio reacciona con el ácido clorhídrico para formar ácido butírico (D): CH3-CH2-CH2-COONH4 + HCl → CH3-CH2-CH2-COOH + NH4Cl. |
- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0