MÄÄRATLUS
Nikkel on perioodilise tabeli kahekümne kaheksas element. Nimetus - Ni ladinakeelsest sõnast "niccolum". Asub neljandas perioodis, VIIIB rühm. Viitab metallidele. Tuumalaeng on 28.
Sarnaselt koobaltiga esineb nikkel looduses peamiselt arseeni või väävliga ühendite kujul; sellised on näiteks mineraalid kupfernikkel NiAs, arseeni-nikli läige NiAsS jne. Nikkel on levinum kui koobalt [umbes 0,01% (massist) maakoorest].
Metalliline nikkel on kollaka varjundiga hõbedase värvusega (joonis 1), väga kõva, poleerib hästi ja tõmbab ligi magneti. Seda iseloomustab kõrge korrosioonikindlus - stabiilne atmosfääris, vees, leelistes ja paljudes hapetes. See lahustub aktiivselt lämmastikhappes. Nikli keemiline vastupidavus tuleneb selle kalduvusest passiveerida – pinnale moodustuvad oksiidkiled, millel on tugev kaitsev toime.
Riis. 1. Nikkel. Välimus.
Nikli aatom- ja molekulmass
MÄÄRATLUS
Aine suhteline molekulmass (M r) on arv, mis näitab, mitu korda on antud molekuli mass suurem kui 1/12 süsinikuaatomi massist ja elemendi suhteline aatommass (A r)- mitu korda on keemilise elemendi aatomite keskmine mass suurem kui 1/12 süsinikuaatomi massist.
Kuna nikkel eksisteerib vabas olekus monoatomiliste Ni-molekulide kujul, langevad selle aatom- ja molekulmassi väärtused kokku. Need on võrdsed 58,6934-ga.
Nikli isotoobid
On teada, et nikkel võib looduses esineda viie stabiilse isotoobi 58Ni, 60Ni, 61Ni, 62Ni ja 64Ni kujul. Nende massinumbrid on vastavalt 58, 60, 61, 62 ja 64. Nikli isotoobi 58 Ni tuum sisaldab kakskümmend kaheksa prootonit ja kolmkümmend neutronit ning ülejäänud isotoobid erinevad sellest ainult neutronite arvu poolest.
On kunstlikke ebastabiilseid nikli isotoope massinumbritega 48–78, samuti kaheksa metastabiilset olekut, mille hulgas on pikima elueaga 59 Ni isotoop, mille poolestusaeg on 76 tuhat aastat.
nikli ioonid
Nikli elektronide orbitaalset jaotust näitav elektrooniline valem on järgmine:
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 p 8 4 s 2 .
Keemilise vastasmõju tulemusena loovutab nikkel oma valentselektronid, s.o. on nende doonor ja muutub positiivselt laetud iooniks:
Ni 0 -2e → Ni 2+;
Ni 0 -3e → Ni 3+.
Nikli molekul ja aatom
Vabas olekus eksisteerib nikkel monoatomiliste Ni-molekulide kujul. Siin on mõned omadused, mis iseloomustavad nikli aatomit ja molekuli:
Niklisulamid
Põhiosa niklist kasutatakse mitmesuguste raua, vase, tsingi ja muude metallidega sulamite tootmiseks. Nikli lisamine terasele suurendab selle sitkust ja vastupidavust korrosioonile.
Niklipõhised sulamid võib jagada kuumakindlateks (nimooniline, inconel, hastella [üle 60% niklit, 15-20% kroomi ja muid metalle]), magnetilisteks (permalloy) ja eriomadustega sulamiteks (monelmetall, nikkeliin, konstantaan) , invar, plaatina).
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Kirjutage reaktsioonivõrrandid, mida saab kasutada järgmiste teisenduste läbiviimiseks: NiCl 2 → Ni → NiSO 4 → Ni(NO 3) 2 → Ni(OH) 2 → NiCl 2. Joonistage ioonsetes ja lühendatud ioonsetes vormides lahustes toimuvate reaktsioonide võrrandid. |
| Vastus | Nikkelmetallist aktiivsema nikkel(II)kloriidi lahuse paigutamisega on võimalik saada niklit vabal kujul (asendusreaktsioon): NiCl2 + Zn → Ni + ZnCl2; Ni 2+ + Zn 0 → Ni 0 + Zn 2+ . Nikkel lahustub lahjendatud väävelhappes, moodustades nikkel(II)sulfaadi: Ni + H2SO4 (lahjendatud) → NiSO4 + H2; Ni0 + 2H+ → Ni2+ + H2. Nikkel(II)nitraati saab vahetusreaktsiooniga: NiSO 4 + Ba(NO 3) 2 → Ni(NO 3) 2 + BaSO 4 ↓; SO 4 2- + Ba 2+ → BaSO 4 ↓. Nikkel(II)nitraadil leelisega toimides saab nikkel(II)hüdroksiidi: Ni(NO 3) 2 + 2NaOH → Ni(OH) 2 ↓+ 2NaNO 3 ; Ni 2+ + 2OH - \u003d Ni (OH) 2 ↓. Nikkel(II)kloriidi saab nikkel(II)hüdroksiidist saada neutraliseerimisreaktsioonil vesinikkloriidhappega: Ni(OH)2 + 2HCl → NiCl2 + 2H2O; OH - + H + \u003d H2O. |
NÄIDE 2
| Harjutus | Millise massi nikkel(II)kloriidi saab 17,7 g niklit ja 12 liitrit kloori (n.o.) kuumutamisel? Millise mahu 0,06 M lahust saab sellest soolamassist valmistada? |
| Lahendus | Kirjutame reaktsioonivõrrandi: Ni + Cl 2 \u003d NiCl 2. Leiame nikli (moolmass - 59 g / mol) ja kloori moolide arvu, mis on probleemi tingimuses näidatud andmete abil reageerinud: n (Ni) = m (Ni) / M (Ni); n (Ni) \u003d 17,7 / 59 \u003d 0,3 mol. n (Cl 2) \u003d V (Cl 2) / V m; n (Cl 2) \u003d 12 / 22,4 \u003d 0,54 mol. Ülesande võrrandi n (Ni) järgi: n (Cl 2) = 1:1. See tähendab, et kloori on liiga palju ja kõik edasised arvutused tuleks teha nikli abil. Leiame aine koguse ja saadud nikkel(II)kloriidi massi (moolmass 130 g / mol): n (Ni): n (NiCl2) = 1:1; n (Ni) \u003d n (NiCl 2) \u003d 0,3 mol. m (NiCl2) = n (NiCl2) × M (NiCl2); m (NiCl 2) = 0,3 × 130 \u003d 39 g. Arvutage 0,06 M lahuse maht, mida saab saada 39 g nikkel(II)kloriidist: V (NiCl 2) \u003d n (NiCl 2) / c (NiCl 2); V (NiCl 2) \u003d 0,3 / 0,06 \u003d 0,5 l. |
| Vastus | Nikkel(II)kloriidi mass on 39 g, 0,06 M lahuse maht on 0,5 l (500 ml). |
teemal: Nikkel ja selle omadused
Töö koostasid 5202 rühma 2. kursuse õpilased
Nikitin Dmitri ja Sharhemullin Emil.
Kaasan 2013
Nikli füüsikalised omadused.
Element avastati 1761. aastal. Nikkel on keemiliste elementide perioodilise süsteemi kümnenda rühma, neljanda perioodi element. I. Mendelejev, aatomnumbriga 28. Hõbevalge metall, mis õhu käes ei tuhmu. Puhtal kujul on see väga plastiline ja seda saab survega töödelda. Tegemist on ferromagnetiga, st. läbi selle voolu juhtides on sellel väljendunud magnetilised omadused. Nikli aatomitel on väline elektrooniline konfiguratsioon 3d 8 4s 2 . See on tempermalmist ja tempermalmist valmistatud metall, mis võimaldab toota sellest kõige õhemaid lehti ja torusid.
Nikli keemilised omadused
Keemiliselt sarnaneb Ni Fe ja Co, aga ka Cu ja väärismetallidega. Ühendites on selle valentsus muutuv (enamasti 2-valents). Nikkel on keskmise aktiivsusega metall. Absorbeerib (eriti peeneks jahvatatud olekus) suures koguses gaase
Nikkel põleb ainult pulbrina. Sel juhul moodustab see kaks oksiidi NiO ja Ni 2 O 3 ning vastavalt kaks hüdroksiidi Ni(OH)2 ja Ni(OH)3. Kõige olulisemad lahustuvad niklisoolad on atsetaat, kloriid, nitraat ja sulfaat. Soolade vesilahused on tavaliselt rohelised ja veevabad soolad on kollased või pruunikaskollased. mida kasutatakse sageli analüütilises keemias.
N. küllastumine gaasidega halvendab selle mehaanilisi omadusi. Koostoime hapnikuga algab temperatuuril 500 °C; peenelt hajutatud olekus on N. pürofooriline – süttib õhu käes spontaanselt. Oksiididest on olulisim NiO - vees praktiliselt lahustumatud rohekad kristallid (mineraal bunseniit). Hüdroksiid sadestub leeliste lisamisel niklisoolade lahustest mahuka õunarohelise sademe kujul. Kuumutamisel ühineb H. halogeenidega, moodustades NiX 2 . Väävliaurus põlemisel saadakse Ni 3 S 2 koostisega sarnane sulfiid. Monosulfiidi NiS-i saab saada NiO kuumutamisel väävliga. N. ei reageeri lämmastikuga isegi kõrgetel temperatuuridel (kuni 1400 ° C)
Vedelas olekus lahustab N. märgatava koguse C-d, mis jahtumisel sadestub grafiidi kujul. Grafiidi eraldamisel kaotab N. vormitavuse ja võime töödelda survega.
Nikkel on veekindel. Orgaanilised happed toimivad N.-le alles pärast pikaajalist kokkupuudet sellega. Väävel- ja vesinikkloriidhape lahustavad aeglaselt N.; lahjendatud lämmastikhape - väga lihtne; kontsentreeritud HNO 3 passiveerib N., kuid vähemal määral kui raud. Hapetega suhtlemisel moodustuvad 2-valentse Ni soolad. Peaaegu kõik Ni (II) ja tugevate hapete soolad lahustuvad vees hästi, nende lahused on hüdrolüüsi tõttu happelised.
Nikli komplekssed ühendid.
Nikli sidumine kompleksideks on analüütilise keemia jaoks oluline diagnostiline protsess.
Niklit iseloomustab komplekside moodustumine. Seega moodustab Ni 2+ katioon ammoniaagiga heksaamiinkompleksi 2+ ja dikvatetraamiinkompleksi 2+ . Need kompleksid anioonidega moodustavad siniseid või violetseid ühendeid.
Lahustumatute soolade hulka kuuluvad oksalaat ja fosfaat (roheline värv), kolm sulfiidi: NiS (must), Ni 3 S 2 (kollakas-pronks) ja Ni 3 S 4 (hõbevalge). Või nikkeldimetüülglüoksimaat Ni (C 4 H 6 N 2 O 2) 2, mis annab happelises keskkonnas selge punase värvuse, mida kasutatakse laialdaselt kvalitatiivses analüüsis nikli tuvastamiseks.
Nikkel(II)soolade vesilahused sisaldavad heksaakvaanikkel(II)2+ iooni. Kui neid ioone sisaldavale lahusele lisatakse ammoniaagilahus, sadestub nikkel(II)hüdroksiid, roheline želatiinne aine. See sade lahustub, kui lisatakse liigne kogus ammoniaaki heksamminenikkel(II) 2+ ioonide moodustumise tõttu.
Nikkel moodustab komplekse tetraeedriliste ja lamedate ruudukujuliste struktuuridega. Näiteks tetrakloronikelaat(II)2-kompleksil on tetraeedriline struktuur, samas kui tetratsüanonikelaat(II)2-kompleksil on tasapinnaline ruudukujuline struktuur.
Iseloomulik on Ni 2+ ioonide reaktsioon dimetüülglüoksiimiga, mille tulemusena moodustub roosakaspunane nikkeldimetüülglüoksiim. Seda reaktsiooni kasutatakse nikli kvantitatiivseks määramiseks ning reaktsioonisaadust kasutatakse pigmendina kosmeetikatoodetes ja muudel eesmärkidel.
Elemendi kvantifitseerimine.
See viiakse läbi peamiselt järgmiste meetoditega:
1) Sadestumine nikkeldimetoiglioksimaadi kujul, nagu juba mainitud.
2) sadestumine enikkel-alfa-bensüüldioksiimi kujul.
3) Sadestumine nikkelhüdroksiidi kujul (3) . See reaktsioon viiakse läbi kaustilise kaaliumkloriidi ja broomveega.
4) Sade sulfiidi kujul. Kui kaaluvormina kasutatakse nikkeloksiidi2.
5) Elektrolüütiline meetod
6) Mahuline meetod – st kaaliumtsüaniidi tiitrimine komplekstsüaniidi moodustumiseni (Kaalium 2 nikkel ce en neli korda)
7) Kolorimeetriline meetod, mis põhineb heksamiinnikliiooni või lahustuva kompleksühendi punase värvuse muutumisel, mis tekib nikliioonide 3 reaktsioonil dimetüülglüoksiimiga leeliselises lahuses oksüdeeriva aine juuresolekul. agent.
8) Kompleksomeetriline meetod.
NIKLI MÄÄRAMISE GRAVIMETRILINE MEETOD Meetod põhineb nikli sadestamisel ammoniaagilahuses koos dimetüülglüoksiimiga kui raskesti lahustuva kompleksühendiga sidrun- või viinhappe juuresolekul.
TITRIMEETRILINE MEETOD NIKKLI MÄÄRAMISEKS
Meetod põhineb nikli sadestamisel ammoniaagilahuses koos dimetüülglüoksiimiga kui halvasti lahustuva intrakompleksühendiga sidrun- või viinhappe juuresolekul ja nikli määramisel kompleksomeetrilise tiitrimisega indikaatorina eriokroommust T-ga.
Lugu
Nikkel (inglise, prantsuse ja saksa keeles Nickel) avastati aastal 1751. Kuid juba ammu enne seda teadsid Saksimaa kaevurid maagist hästi, mis nägi välja nagu vasemaak ja mida kasutati klaasi valmistamisel klaasi roheliseks värvimiseks. Kõik katsed sellest maagist vaske saada ebaõnnestusid ja seetõttu 17. sajandi lõpus. Maagi nimi sai Kupfernickel, mis tähendab umbkaudu "vaskkurat". Seda maaki (punane nikkelpüriit NiAs) uuris 1751. aastal Rootsi mineraloog Kronstedt. Tal õnnestus saada rohelist oksiidi ja viimast redutseerides uut metalli, mida nimetatakse nikliks. Kui Bergman sai metalli puhtamal kujul, leidis ta, et metalli omadused on sarnased raua omadega; Niklit on üksikasjalikumalt uurinud paljud keemikud, alustades Proustist. Nikkel on kaevurite keeles sõimusõna. See moodustati moonutatud sõnast Nicolaus, üldsõnast, millel oli mitu tähendust. Kuid peamiselt iseloomustas sõna Nicolaus kahepalgelisi inimesi; lisaks tähendas see "keldavat väikest vaimu", "petlikku lootsikut" jne. 19. sajandi alguse vene kirjanduses. kasutati nimetusi nikolan (Scherer, 1808), nikolan (Zakharov, 1810), nicol ja nikkel (Dvigubsky, 1824).
Füüsikalised omadused
Nikkelmetall on hõbedase värvusega kollaka varjundiga, väga kõva, plastiline ja tempermalmist, poleerib hästi, tõmbab ligi magnet, mis näitab magnetilisi omadusi temperatuuril alla 340 ° C.
Keemilised omadused
Nikkeldikloriid (NiCl2)
Nikli aatomite väline elektrooniline konfiguratsioon on 3d84s2. Ni(II) oksüdatsiooniaste on nikli puhul kõige stabiilsem.
Nikkel moodustab ühendeid oksüdatsiooniastmetega +2 ja +3. Sel juhul on nikkel oksüdatsiooniastmega +3 ainult komplekssoolade kujul. Nikkel +2 ühendite puhul on teada suur hulk tavalisi ja kompleksühendeid. Nikkeloksiid Ni2O3 on tugev oksüdeerija.
Niklit iseloomustab kõrge korrosioonikindlus - see on stabiilne õhus, vees, leelistes, paljudes hapetes. Keemiline vastupidavus tuleneb selle kalduvusest passiveerida - selle pinnale tekib tihe oksiidkile, millel on kaitsev toime. Nikkel lahustub aktiivselt lämmastikhappes.
Süsinikmonooksiidi COga moodustab nikkel kergesti lenduva ja väga mürgise karbonüül-Ni(CO)4.
Peenelt dispergeeritud niklipulber on pürofooriline (süttib õhu käes isesüttima).
Nikkel põleb ainult pulbrina. Moodustab kaks oksiidi NiO ja Ni2O3 ning vastavalt kaks hüdroksiidi Ni(OH)2 ja Ni(OH)3. Kõige olulisemad lahustuvad nikli soolad on atsetaat, kloriid, nitraat ja sulfaat. Lahused on tavaliselt rohelised, veevabad soolad aga kollased või pruunikaskollased. Lahustumatute soolade hulka kuuluvad oksalaat ja fosfaat (roheline), kolm sulfiidi NiS (must), Ni2S3 (kollakas pronks) ja Ni3S4 (must). Nikkel moodustab ka arvukalt koordineerivaid ja kompleksseid ühendeid. Näiteks nikli dimetüülglüoksimaati Ni(C4H6N2O2)2, mis annab happelises keskkonnas selge punase värvuse, kasutatakse nikli tuvastamiseks laialdaselt kvalitatiivses analüüsis.
Nikkelsulfaadi vesilahus purgis on roheline.
Nikkel(II)soolade vesilahused sisaldavad heksaakvaanikkel(II)2+ iooni. Kui neid ioone sisaldavale lahusele lisatakse ammoniaagilahus, sadestub nikkel(II)hüdroksiid, roheline želatiinne aine. See sade lahustub, kui lisatakse liigne kogus ammoniaaki heksamminenikkel(II) 2+ ioonide moodustumise tõttu.
Nikkel moodustab komplekse tetraeedriliste ja lamedate ruudukujuliste struktuuridega. Näiteks tetrakloronikelaat(II)2-kompleksil on tetraeedriline struktuur, samas kui tetratsüanonikelaat(II)2-kompleksil on tasapinnaline ruudukujuline struktuur.
Kvalitatiivses ja kvantitatiivses analüüsis kasutatakse nikli(II)ioonide tuvastamiseks leeliselist butaandioksiidi lahust, mida tuntakse ka kui dimetüülglüoksiimi. Kui see interakteerub nikli(II)ioonidega, moodustub punane koordinatsiooniühend bis(butaandioondioksimato)nikkel(II). See on kelaatühend ja butaanidioksümatoligand on kahehambaline.
Looduses olemine
Nikkel on looduses üsna levinud – selle sisaldus maapõues on u. 0,01% (mass). Maakoores esineb seda ainult seotud kujul, raudmeteoriidid sisaldavad looduslikku niklit (kuni 8%). Selle sisaldus ülialuselistes kivimites on ligikaudu 200 korda suurem kui happelistes (1,2 kg/t ja 8 g/t). Ultramafilistes kivimites on valdav nikli kogus seotud oliviinidega, mis sisaldavad 0,13–0,41% Ni. See asendab rauda ja magneesiumi isomorfselt. Väike osa niklist esineb sulfiidide kujul. Niklil on siderofiilsed ja kalkofiilsed omadused. Suurenenud väävlisisaldusega magmas ilmuvad nikkelsulfiidid koos vase, koobalti, raua ja platinoididega. Hüdrotermilises protsessis moodustab nikkel koos koobalti, arseeni ja väävli ning mõnikord vismuti, uraani ja hõbedaga kõrgendatud kontsentratsioonid nikli arseniidide ja sulfiidide kujul. Niklit leidub tavaliselt sulfiidi ja arseeni sisaldavates vase-nikli maakides.
* Nikkel (punane niklipüriit, kupfernikkel) NiAs
* kloantiit (valge nikkelpüriit) (Ni, Co, Fe)As2
* garnieriit (Mg, Ni)6(Si4O11)(OH)6*H2O ja muud silikaadid
* magnetilised püriidid (Fe, Ni, Cu)S
* arseeni-nikli läige (gersdorfiit) NiAsS,
* pentlandiit (Fe,Ni)9S8
Taimedes keskmiselt 5 × 10 -5 massiprotsenti niklit, mereloomadel - 1,6 × 10 -4, maismaaloomadel - 1 × 10 -6, inimkehas - 1 ... 2 × 10 -6 . Organismides leiduvast niklist on palju teada. Näiteks on kindlaks tehtud, et selle sisaldus inimese veres muutub vanusega, et loomadel suureneb nikli hulk organismis ja lõpuks on mõned taimed ja mikroorganismid - nikli "kontsentraatorid", mis sisaldavad tuhandeid. ja isegi sadu tuhandeid kordi rohkem niklit kui keskkond.
Niklimaakide maardlad
Niklimaakide peamised leiukohad asuvad Kanadas, Venemaal, Uus-Kaledoonias, Filipiinidel, Indoneesias, Hiinas, Soomes ja Austraalias. Nikli looduslikud isotoobid.
Looduslik nikkel sisaldab 5 stabiilset isotoopi: 58Ni (68,27%), 60Ni (26,10%), 61Ni (1,13%), 62Ni (3,59%), 64Ni (0,91%).
Kviitung
Nikli koguvarud maakides on 1998. aasta alguses hinnanguliselt 135 miljonit tonni, sealhulgas usaldusväärsed varud 49 miljonit tonni.
Peamised nikli maagid – nikkel (kupfernikkel) NiAs, milleriit NiS, pentlandiit (FeNi)9S8 – sisaldavad ka arseeni, rauda ja väävlit; Pentlandiidi lisandeid esineb ka tardpürrotiidis. Teised maagid, millest Ni kaevandatakse, sisaldavad ka Co, Cu, Fe ja Mg lisandeid. Mõnikord on nikkel rafineerimisprotsessi põhiprodukt, kuid sagedamini saadakse seda kõrvalsaadusena muudes metallitehnoloogiates. Usaldusväärsetest varudest on erinevate allikate andmetel 40–66% niklist "oksüdeeritud niklimaakides" (ONR), 33% - sulfiidides, 0,7% - teistes. 1997. aasta seisuga moodustas plaatide töötlemisel toodetud nikli osakaal maailma toodangust umbes 40%. Tööstuslikes tingimustes jaguneb OHP kahte tüüpi: magneesium ja raud.
Tulekindlad magneesiumaagid sulatatakse reeglina ferronikli (5-50% Ni + Co, sõltuvalt tooraine koostisest ja tehnoloogilistest omadustest) jaoks elektriliselt.
Kõige ferrugiinsemaid lateriitsemaid maake töödeldakse hüdrometallurgiliste meetoditega, kasutades ammoniaagi-karbonaadi leostust või väävelhappe autoklaavis. Olenevalt tooraine koostisest ja rakendatavatest tehnoloogilistest skeemidest on nende tehnoloogiate lõpptoodeteks: nikkeloksiid (76-90% Ni), paaguti (89% Ni), erineva koostisega sulfiidikontsentraadid, samuti elektrolüütiline metall nikkel, niklipulbrid ja koobalt.
Vähem rauasisaldusega – mittetroniitmaagid sulatatakse matiks. Täistsükliga töötavates ettevõtetes hõlmab edasine töötlemisskeem nikkeloksiidi muundamist, röstimist ja elektrilist sulatamist metallilise nikli saamiseks. Samal ajal toodetakse ekstraheeritud koobaltit metalli ja/või soolade kujul. Veel üks nikli allikas: Inglismaal Lõuna-Walesi söe tuhas - kuni 78 kg niklit tonni kohta. Suurenenud nikli sisaldus mõnes söes, naftas ja kildades viitab nikli kontsentratsiooni võimalusele fossiilse orgaanilise aine poolt. Selle nähtuse põhjused pole veel välja selgitatud.
Põhiosa niklist saadakse garnieriidist ja magnetpüriitidest.
1. Silikaatmaak redutseeritakse söetolmuga pöördahjudes raud-nikli graanuliteks (5-8% Ni), mis seejärel puhastatakse väävlist, kaltsineeritakse ja töödeldakse ammoniaagilahusega. Pärast lahuse hapestamist saadakse sellest elektrolüütiliselt metall.
2. Karbonüülmeetod (Mondi meetod). Esiteks saadakse sulfiidmaagist vask-niklimatt, millest juhitakse kõrge rõhu all üle CO. Tekib kergesti lenduv tetrakarbonüülnikkel, mille termilisel lagunemisel saadakse eriti puhas metall.
3. Aluminotermiline meetod nikli eraldamiseks oksiidmaagist: 3NiO + 2Al = 3Ni + Al2O3
Rakendus
Sulamid
Nikkel on enamiku supersulamite, kõrge temperatuuriga materjalide aluseks, mida kasutatakse kosmosetööstuses elektrijaamade osade jaoks.
* Monel metall (65 - 67% Ni + 30 - 32% Cu + 1% Mn), kuumakindel kuni 500 °C, väga korrosioonikindel;
* valge kuld (näiteks 585 proovi sisaldab 58,5% kulda ning hõbeda ja nikli (või pallaadiumi) sulamit (ligatuuri));
* nikroom, vastupidavussulam (60% Ni + 40% Cr);
* permalloy (76% Ni + 17% Fe + 5% Cu + 2% Cr), on kõrge magnetilise vastuvõtlikkusega väga väikeste hüstereesikadudega;
* Invar (65% Fe + 35% Ni), kuumutamisel peaaegu ei pikene;
* Lisaks hõlmavad niklisulamid nikkel- ja kroom-nikkelteraseid, nikkelhõbedat ja mitmesuguseid vastupidavussulameid, nagu konstantaan, nikliin ja manganiin.
nikeldamine
Nikeldamine on nikkelkatte loomine teise metalli pinnale, et kaitsta seda korrosiooni eest. See viiakse läbi galvaniseerimisega, kasutades elektrolüüte, mis sisaldavad nikkel(II)sulfaati, naatriumkloriidi, boorhüdroksiidi, pindaktiivseid aineid ja läikivaid aineid ning lahustuvaid nikkelanoode. Saadud niklikihi paksus on 12–36 µm. Pinna läike stabiilsuse saab tagada järgneva kroomimisega (kroomikihi paksus 0,3 µm).
Vooluvaba nikeldamine viiakse läbi nikkel(II)kloriidi ja naatriumhüpofosfiidi segu lahuses naatriumtsitraadi juuresolekul:
NiCl2 + NaH2PO2 + H2O = Ni + NaH2PO3 + 2HCl
Protsess viiakse läbi pH 4-6 ja 95 °C juures.
Akude tootmine
Raud-nikkel, nikkel-kaadmium, nikkel-tsink, nikkel-vesinik akude tootmine.
Kiirgustehnoloogiad
β+ osakesi kiirgava 63Ni nukliidi poolestusaeg on 100,1 aastat ja seda kasutatakse krütronites.
Ravim
* Seda kasutatakse kronsteinisüsteemide (titaannikliid) valmistamisel.
* Proteesimine
mündid
Niklit kasutatakse laialdaselt müntide tootmisel paljudes riikides. Ameerika Ühendriikides tuntakse 5-sendist münti kõnekeeles nikli nime all.
Bioloogiline roll
Bioloogiline roll: Nikkel on üks elusorganismide normaalseks arenguks vajalikest mikroelementidest. Selle rollist elusorganismides on aga vähe teada. On teada, et nikkel osaleb loomade ja taimede ensümaatilistes reaktsioonides. Loomadel koguneb see keratiniseeritud kudedesse, eriti sulgedesse. Suurenenud nikli sisaldus pinnases põhjustab endeemilisi haigusi - taimedes tekivad inetud vormid ja loomadel silmahaigused, mis on seotud nikli kuhjumisega sarvkestasse. Toksiline annus (rottidele) - 50 mg. Eriti kahjulikud on lenduvad nikliühendid, eriti selle tetrakarbonüül-Ni(CO)4. Nikliühendite MPC õhus on vahemikus 0,0002 kuni 0,001 mg/m3 (erinevate ühendite puhul).
Füsioloogiline toime
Nikkel on peamine allergia (kontaktdermatiit) põhjustaja nahaga kokkupuutuvate metallide suhtes (ehted, kellad, teksanööbid). Euroopa Liidus on inimese nahaga kokkupuutuvates toodetes nikli sisaldus piiratud.
Nikkelkarbonüül on väga mürgine. Selle aurude maksimaalne lubatud kontsentratsioon tööstusruumide õhus on 0,0005 mg/m³.
20. sajandil leiti, et kõhunääre on väga niklirikas. Pärast insuliini manustamist pikendab nikkel insuliini toimet ja suurendab seeläbi hüpoglükeemilist aktiivsust. Nikkel mõjutab ensümaatilisi protsesse, askorbiinhappe oksüdatsiooni, kiirendab sulfhüdrüülrühmade üleminekut disulfiidrühmadeks. Nikkel võib pärssida adrenaliini toimet ja alandada vererõhku. Liigne nikli tarbimine kehas põhjustab vitiligo. Nikkel ladestub kõhunäärmes ja kõrvalkilpnäärmetes.
Nikkel- lihtne aine, plastiline, tempermalmist, hõbevalge siirdemetall, mis on tavatemperatuuril õhus kaetud õhukese oksiidikilega. Keemiliselt mitteaktiivne. See kuulub raskete värviliste metallide hulka, puhtal kujul maa peal ei esine - see sisaldub tavaliselt erinevates maakides, on kõrge kõvadusega, on hästi poleeritud, on ferromagnet - tõmbab magnetiga, perioodilises süsteemis Mendelejevi puhul on see tähistatud sümboliga Ni ja sellel on 28 seerianumber.
Vaata ka:
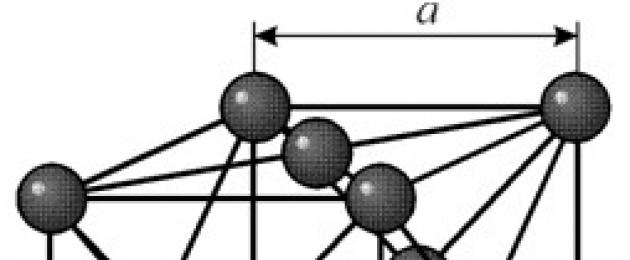
STRUKTUUR
 Sellel on näokeskne kuupvõre perioodiga a = 0,35238 å nm, ruumirühm Fm3m. See kristallstruktuur on rõhukindel vähemalt 70 GPa. Normaaltingimustes eksisteerib nikkel b-modifikatsioonina, millel on näokeskne kuupvõre (a = 3,5236 å). Kuid nikkel, mis on allutatud katoodiga pihustamisele h 2 atmosfääris, moodustab a-modifikatsiooni, millel on kuusnurkne tihedalt tihendatud võre (a = 2,65 å, c = 4,32 å), mis kuumutamisel üle 200 °C muutub kuubik üks. Kompaktse kuupnikli tihedus on 8,9 g / cm 3 (20 ° C), aatomiraadius 1,24 å
Sellel on näokeskne kuupvõre perioodiga a = 0,35238 å nm, ruumirühm Fm3m. See kristallstruktuur on rõhukindel vähemalt 70 GPa. Normaaltingimustes eksisteerib nikkel b-modifikatsioonina, millel on näokeskne kuupvõre (a = 3,5236 å). Kuid nikkel, mis on allutatud katoodiga pihustamisele h 2 atmosfääris, moodustab a-modifikatsiooni, millel on kuusnurkne tihedalt tihendatud võre (a = 2,65 å, c = 4,32 å), mis kuumutamisel üle 200 °C muutub kuubik üks. Kompaktse kuupnikli tihedus on 8,9 g / cm 3 (20 ° C), aatomiraadius 1,24 å OMADUSED
 Nikkel on tempermalmist ja tempermalmist valmistatud metall, millest saab valmistada kõige õhemaid lehti ja torusid. Tõmbetugevus 400-500 MN/m 2, elastsuse piir 80 MN/m 2, voolavuspiir 120 MN/m 2; pikenemine 40%; normaalelastsusmoodul 205 Gn/m 2; Brinelli kõvadus 600-800 MN/m 2. Temperatuurivahemikus 0 kuni 631 K (ülemine piir vastab Curie punktile). Nikli ferromagnetism tuleneb selle aatomite välise elektronkestade struktuuri iseärasustest. Nikkel on kõige olulisemate magnetiliste materjalide ja sulamite komponent, millel on minimaalne soojuspaisumistegur (permalloy, monel metal, invar jne).
Nikkel on tempermalmist ja tempermalmist valmistatud metall, millest saab valmistada kõige õhemaid lehti ja torusid. Tõmbetugevus 400-500 MN/m 2, elastsuse piir 80 MN/m 2, voolavuspiir 120 MN/m 2; pikenemine 40%; normaalelastsusmoodul 205 Gn/m 2; Brinelli kõvadus 600-800 MN/m 2. Temperatuurivahemikus 0 kuni 631 K (ülemine piir vastab Curie punktile). Nikli ferromagnetism tuleneb selle aatomite välise elektronkestade struktuuri iseärasustest. Nikkel on kõige olulisemate magnetiliste materjalide ja sulamite komponent, millel on minimaalne soojuspaisumistegur (permalloy, monel metal, invar jne).
RESERVID JA TOOTMINE
 Nikkel on looduses üsna levinud – selle sisaldus maakoores on umbes 0,01% (massist). Seda leidub maakoores ainult seotuna, raudmeteoriidid sisaldavad looduslikku niklit (kuni 8%). Selle sisaldus ülialuselistes kivimites on ligikaudu 200 korda suurem kui happelistes (1,2 kg/t ja 8 g/t). Ultramafilistes kivimites on valdav nikli kogus seotud oliviinidega, mis sisaldavad 0,13–0,41% Ni.
Nikkel on looduses üsna levinud – selle sisaldus maakoores on umbes 0,01% (massist). Seda leidub maakoores ainult seotuna, raudmeteoriidid sisaldavad looduslikku niklit (kuni 8%). Selle sisaldus ülialuselistes kivimites on ligikaudu 200 korda suurem kui happelistes (1,2 kg/t ja 8 g/t). Ultramafilistes kivimites on valdav nikli kogus seotud oliviinidega, mis sisaldavad 0,13–0,41% Ni.
Taimedes keskmiselt 5 10 -5 massiprotsenti niklit, mereloomadel - 1,6 10 -4, maismaaloomadel - 1 10 -6, inimese kehas - 1 ... 2 10 -6.
Põhiosa niklist saadakse garnieriidist ja magnetpüriitidest.
Silikaatmaak redutseeritakse söetolmuga pöördahjudes raud-nikli graanuliteks (5-8% Ni), mis seejärel puhastatakse väävlist, kaltsineeritakse ja töödeldakse ammoniaagilahusega. Pärast lahuse hapestamist saadakse sellest elektrolüütiliselt metall.
Karbonüülmeetod (Mondi meetod): Esiteks saadakse sulfiidmaagist vask-niklimatt, millest juhitakse kõrge rõhu all üle CO. Tekib kergesti lenduv tetrakarbonüülnikkel, mille termilisel lagunemisel saadakse eriti puhas metall.
Aluminotermiline meetod nikli eraldamiseks oksiidmaagist: 3NiO + 2Al = 3Ni + Al 2 O 3
PÄRITOLU
 Sulfiidi vase-nikli maakide ladestused on seotud lopoliitaoliste või plaaditaoliste kihiliste gabroidide massiividega, mis on piiratud iidsete kilpide ja platvormide sügavate rikete tsoonidega. Vase-nikli maardlate iseloomulikuks tunnuseks üle maailma on maakide ühtlane mineraalne koostis: pürrotiit, pentlandiit, kalkopüriit, magnetiit; lisaks neile leidub maakides püriiti, kubaniiti, polüdüümiiti, nikliliini, milleriiti, violariiti, plaatinarühma mineraale, aeg-ajalt kromiiti, nikli- ja koobaltiarseniidi, galeniiti, sfaleriiti, borniiti, makinaviiti, walleriiti, grafiiti, looduslikku kulda.
Sulfiidi vase-nikli maakide ladestused on seotud lopoliitaoliste või plaaditaoliste kihiliste gabroidide massiividega, mis on piiratud iidsete kilpide ja platvormide sügavate rikete tsoonidega. Vase-nikli maardlate iseloomulikuks tunnuseks üle maailma on maakide ühtlane mineraalne koostis: pürrotiit, pentlandiit, kalkopüriit, magnetiit; lisaks neile leidub maakides püriiti, kubaniiti, polüdüümiiti, nikliliini, milleriiti, violariiti, plaatinarühma mineraale, aeg-ajalt kromiiti, nikli- ja koobaltiarseniidi, galeniiti, sfaleriiti, borniiti, makinaviiti, walleriiti, grafiiti, looduslikku kulda.
Silikaatniklimaakide eksogeenseid ladestusi seostatakse üldiselt üht või teist tüüpi ilmastikumõjuga madukoorikuga. ilmastikuolude ajal toimub mineraalide etapiline lagunemine, samuti liikuvate elementide ülekandmine vee abil maakoore ülemistest osadest alumistesse. Seal need elemendid sadestuvad sekundaarsete mineraalide kujul.
Seda tüüpi maardlad sisaldavad niklivarusid, mis on kolm korda suuremad kui selle sulfiidmaakide varud, ja mõne maardla varud ulatuvad 1 miljoni tonnini või rohkem niklini. Suured silikaatmaakide varud on koondunud Uus-Kaledooniasse, Filipiinidele, Indoneesiasse, Austraaliasse ja teistesse riikidesse. Keskmine nikli sisaldus neis on 1,1-2%. Lisaks sisaldavad maagid sageli koobaltit.
RAKENDUS
Valdav osa niklist kasutatakse sulamite saamiseks teiste metallidega (fe, cr, cu jne), mida eristavad kõrged mehaanilised, korrosioonivastased, magnetilised või elektrilised ja termoelektrilised omadused. Seoses reaktiivtehnoloogia arendamise ja gaasiturbiinitehaste loomisega on kuumuskindlad ja kuumakindlad kroom-nikli sulamid eriti olulised. Niklissulameid kasutatakse tuumareaktorite ehitamisel.
Märkimisväärne kogus niklit kulub leelispatareide ja korrosioonivastaste katete tootmiseks. Tempermalmist niklit puhtal kujul kasutatakse lehtede, torude jms valmistamiseks. Seda kasutatakse ka keemiatööstuses spetsiaalsete keemiaseadmete tootmiseks ja paljude keemiliste protsesside katalüsaatorina. Nikkel on väga napp metall ja võimalusel tuleks see asendada muude, odavamate ja levinumate materjalidega.
Seda kasutatakse kronsteinisüsteemide (titaannikliid) valmistamisel, proteesides. Seda kasutatakse laialdaselt müntide tootmisel paljudes riikides. Ameerika Ühendriikides tuntakse 5-sendist münti kõnekeeles nikli nime all. Niklit kasutatakse ka muusikariistade mähiskeelte tootmiseks.
Nikkel - Ni
KLASSIFIKATSIOON
| Strunz (8. väljaanne) | 1/A.08-10 |
| Nickel-Strunz (10. väljaanne) | 1.AA.05 |
| Dana (7. väljaanne) | 1.1.17.2 |
| Dana (8. väljaanne) | 1.1.11.5 | Tere, CIM Ref | 1.61 |
Nikli omadused on olulised parameetrid metalli leidmisel, töötlemisel ja rakendamisel. Neid võetakse arvesse teiste materjalidega kompositsioonide moodustamisel.
Nikli omadused määravad selle kasutamise tootmises
Nikkel on iseloomuliku hõbevalge värvusega metall. Temperatuuril 1453 °C muutub see vedelaks ja keeb 2732 °C juures. Nikkel on plastiline ja kergesti töödeldav surve all.
Nikli keemilist omadust iseloomustab selle võime moodustada erineva oksüdatsiooniastmega ühendeid. Looduslikes tingimustes tekib metalli pinnale õhuke oksiidkile.
Metallil on kõrge korrosioonikindlus. Nikkel ei reageeri paljude kontsentreeritud hapete ja leelistega, vaid lahustub aktiivselt lahjendatud lämmastikhappes.

Keemilistes reaktsioonides moodustab nikkel lenduvaid metalle ja lahustuvaid/lahustumatuid sooli
Nad ei reageeri nikliga.
- inertgaasid;
- liitium;
- kaalium;
- naatrium;
- tseesium;
- rubiidium;
- strontsium;
- baarium;
- iriidium;
- tseesium.
Nikkel ühineb süsinikuga, moodustades karbonüüli, lenduva siirdemetalli, mida kasutatakse kõrge puhtusastmega materjalide tootmisel. Niklipulber võib kokkupuutel õhuga isesüttida, moodustades oksiide.
Nikkel toodab mitmeid lahustuvaid ja lahustumatuid sooli. Näiteks metallsulfaadi lahus annab vedelikule rohelise värvi. Lahustumatutel sooladel on tavaliselt rikkalik kollane värv.
Metalli leidmise vormid
Looduslikes tingimustes leidub niklit koos mitmete keemiliste elementidega ja tükikeste kujul raudmeteoriitides.
Hüdrotermilistes tingimustes moodustab nikkel ühendeid arseeni, koobalti ja hõbedaga. Suurenenud metallide kontsentratsioon on seotud mineraalsete moodustiste – arseniidide ja sulfiididega.

Looduses leidub niklit tavaliselt ühendites teiste elementidega.
Väärtusliku komponendi ekstraheerimise tooraineks on sulfiid, arseeni sisaldavad vask-niklimaagid:
- nikliin - ühend arseeniga;
- kloantiit - valged püriidid, mis sisaldavad koobaltit ja rauda;
- garnieriit - magneesiumi sisaldav silikaatkivim;
- magnetpüriidid - väävli ühend raua ja vasega;
- gersdorfiit - arseeni-nikli läige;
- pentlandiit on väävli, raua ja nikli ühend.
Metallisisaldus elusorganismides sõltub tingimustest ja keskkonnast. Mõned taimestiku ja loomastiku esindajad suudavad metalli kontsentreerida.
Peamised maagimaardlad asuvad Kanadas, Vene Föderatsioonis, Albaanias, Lõuna-Aafrikas, Kuubal ja Kreekas.
Metalli maakidest kaevandamise protsess hõlmab tehnoloogiate kasutamist sõltuvalt tooraine tüübist. Nikkel on mõnikord kivimit vähesel määral rikastav materjal.
Magneesiumi sisaldavad tulekindlad maagid sulatatakse elektriliselt. Rauda sisaldavaid lateriitseid maake töödeldakse hüdrometallurgilisel meetodil, millele järgneb töötlemine leeliseliste lahustega.
Madalama rauasisaldusega kivimit sulatatakse, põletatakse ja sulatatakse elektriliselt. Teel saadakse metallilist koobaltit või selle sooli. Inglismaal on kivisöe tuhas suurenenud metallisisaldus. Seda asjaolu seostatakse niklit kontsentreerivate mikroorganismide aktiivsusega.
Nikliühendite plastilisus ja muud füüsikalised omadused sõltuvad materjali puhtusest. Väike väävli segu muudab metalli hapraks. Magneesiumi lisamine sulamaterjalile puhastab väiksemate lisandite segu, moodustades väävliga ühendi.
Tööstusharud, kus kasutatakse niklit
Metalli füüsikalised ja keemilised omadused määravad selle kasutamise:
- roostevaba terase valmistamisel;
- rauda mittesisaldavate sulamite moodustamiseks;
- galvaanilisel meetodil toodetele kaitsekatete kandmiseks;
- keemiliste reaktiivide tootmiseks;
- pulbermetallurgias.
Metalli kasutatakse akude valmistamisel, selle abil toimuvad tööstuslikus tootmises keemiliste reaktsioonide katalüütilised protsessid. Titaanisulamid on suurepärane materjal proteeside ja hammaste joondusseadmete valmistamiseks.
Keemilisel elemendil nr 28 põhinev koostis on tooraineks müntide vermimiseks, elektrooniliste sigaretipoolide valmistamiseks. Seda kasutatakse muusikariistade keelte kerimiseks.
Elektromagnetite südamike valmistamisel kasutatakse kompositsioone - permalloide, sealhulgas 20–60% rauda. Niklit kasutatakse keemiatööstuse erinevate osade ja seadmete valmistamisel.
Metalloksiide kasutatakse klaasi, glasuuride ja keraamika tootmisel. Kaasaegne tootmine on spetsialiseerunud mitmesuguste valtstoodete valmistamisele: traat, lint, foolium, torud.

Nikkel on lai valik rakendusi alates pinnakatetest kuni kemikaalideni
Vastupidavus agressiivsele keskkonnale võimaldab kasutada valtsitud niklit leeliste transportimiseks keemiatööstuses.
Niklipõhiseid sulamitööriistu kasutatakse meditsiinis ja teadusuuringutes. Metalli kasutatakse tuumaenergiatööstuse protsesside kaugjuhtimise ja radariseadmete täppisinstrumentide loomiseks.
Niklisulamite omadused
Kompositsioonides on metall kombineeritud peamiselt raua ja koobaltiga. Seda kasutatakse sulami põhikomponendina erinevate konstruktsiooniteraste, magnetiliste ja mittemagnetiliste sulamite tootmisel.
Keemilisel elemendil nr 28 põhinevad metallisulamid omavad tugevust, vastupidavust temperatuuridele, deformatsioonile ja keskkonnamõjudele. Nende arv ulatub mitme tuhandeni. Levinumad kompositsioonid on kombinatsioonid kroomi, molübdeeni, alumiiniumi, titaani, berülliumiga.
Metalli peetakse kulla ligatuurikomponendiks, mis annab ehtele iseloomuliku valge värvuse ja tugevuse. Selle koostisega seoses on arvamusi nikli allergilise mõju kohta nahale.
Koos kroomiga moodustub nikroomi ühend, mis on vastupidav kõrgetele temperatuuridele, millel on minimaalne elektritakistuse koefitsient ja elastsus.
Seda kasutatakse kütteseadmete, osade valmistamiseks, kattekihina. Ühenduse kõrge tugevus võimaldab seda töödelda, treida, keevitada, tembeldada.

Niklisulamitel on kõrge tugevus, mis võimaldab neid tootmises laialdaselt kasutada.
Erirühma moodustavad sulamid, mille hulka kuuluvad vask. Nende hulgas on kõige populaarsemad:
- monel;
- messing;
- pronks;
- nikli hõbe.
Rohkem kui sajand tagasi leiti, et raud-nikli koostis, mis sisaldab 28% kirjeldatud metallist, kaotab oma magnetiseerimisomadused. 36% niklit sisaldavaid sulameid iseloomustab kerge lineaarne paisumine, mis võimaldab seda kasutada täppisinstrumentide ja -tööriistade valmistamisel.
Seda kompositsiooni, mis kannab nimetust FeNi36, nimetatakse invariks, see tähendab "muutumatuks". Kovari sulam, mis sisaldab 29% niklit, 17% koobaltit ja 54% rauda, on leidnud tootmises laialdast rakendust.
Sellel on kõrge nakkuvus sulaklaasiga, mis võimaldab kompositsiooni kasutada seda ainet läbivate elektrijuhtmete valmistamiseks.
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0