Kõige lihtsamad orgaanilised ühendid on küllastunud ja küllastumata süsivesinikud. Nende hulka kuuluvad alkaanide, alküünide, alkeenide klassi kuuluvad ained.
Nende valemid sisaldavad vesiniku ja süsiniku aatomeid teatud järjestuses ja koguses. Neid leidub sageli looduses.
Alkeenide määratlus
Nende teine nimi on olefiinid või etüleensüsivesinikud. Nii nimetati seda ühendite klassi 18. sajandil, kui avastati õline vedelik, etüleenkloriid.
Alkeenid on ained, mis koosnevad vesiniku ja süsiniku elementidest. Need kuuluvad atsükliliste süsivesinike hulka. Nende molekulis on üks kaksikside (küllastumata), mis ühendab kahte süsinikuaatomit üksteisega.
Alkeenide valemid
Igal ühendite klassil on oma keemiline nimetus. Nendes näitavad perioodilise süsteemi elementide sümbolid iga aine sidemete koostist ja struktuuri.

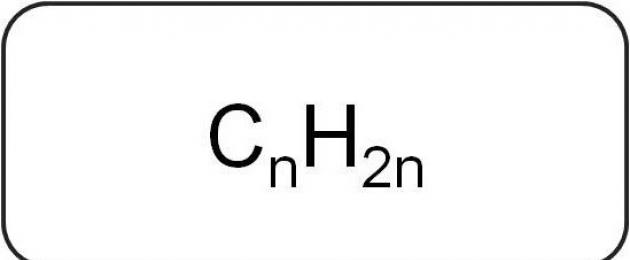
Alkeenide üldvalemit tähistatakse järgmiselt: C n H 2n, kus arv n on suurem või võrdne 2. Selle dešifreerimisel on näha, et iga süsinikuaatomi kohta on kaks vesinikuaatomit.
Homoloogilise seeria alkeenide molekulaarsed valemid on esitatud järgmiste struktuuridega: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16 , C9H18, C10H20. On näha, et iga järgnev süsivesinik sisaldab veel ühte süsinikku ja veel 2 vesinikku.
Molekulis on aatomitevaheliste keemiliste ühendite paiknemise ja järjekorra graafiline tähistus, mis näitab alkeenide struktuurivalemit Valentsjoonte abil näidatakse süsiniku sidet vesinikega.
Alkeenide struktuurivalemit saab näidata laiendatud kujul, kui on näidatud kõik keemilised elemendid ja sidemed. Olefiinide kokkuvõtlikuma väljenduse korral pole näidatud süsiniku ja vesiniku kombinatsiooni valentsjoonte abil.
Skeleti valem tähistab kõige lihtsamat struktuuri. Katkendjoon kujutab molekuli alust, milles süsinikuaatomid on tähistatud selle tippude ja otstega ning vesinik on tähistatud linkidega.
Kuidas olefiinide nimed moodustuvad
CH3-HC \u003d CH2 + H2O → CH3-OHCH-CH3.
Väävelhappega alkeenidega kokkupuutel toimub sulfoneerumisprotsess:
CH3-HC \u003d CH2 + HO-OSO-OH → CH3-CH3CH-O-SO2-OH.
Reaktsioon kulgeb happeestrite, näiteks isopropüülväävelhappe moodustumisega.
Alkeenid oksüdeeruvad nende põlemisel hapniku toimel, moodustades vee ja gaasilise süsinikdioksiidi:
2CH3-HC \u003d CH2 + 9O2 → 6CO2 + 6H2O.
Olefiinsete ühendite ja lahjendatud kaaliumpermanganaadi koostoime lahuse kujul põhjustab glükoolide või kahehüdroksüülsete alkoholide moodustumist. See reaktsioon on ka oksüdatiivne, moodustub etüleenglükool ja lahuse värvus muutub:
3H 2 C = CH 2 + 4H 2 O + 2KMnO4 → 3OHCH-CHOH + 2MnO2 + 2KOH.
Alkeenmolekulid võivad osaleda polümerisatsiooniprotsessis vabade radikaalide või katioon-anioonmehhanismi abil. Esimesel juhul saadakse peroksiidide mõjul polümeer, näiteks polüetüleen.
Teise mehhanismi kohaselt toimivad happed katioonsete katalüsaatoritena ja metallorgaanilised ained on stereoselektiivse polümeeri vabanemisega anioonsed katalüsaatorid.
Mis on alkaanid
Neid nimetatakse ka parafiinideks või küllastunud atsüklilisteks süsivesinikeks. Neil on lineaarne või hargnenud struktuur, mis sisaldab ainult küllastunud lihtsaid sidemeid. Kõigil selle klassi esindajatel on üldvalem C n H 2n+2 .

Need sisaldavad ainult süsiniku ja vesiniku aatomeid. Alkeenide üldvalem moodustub küllastunud süsivesinike tähistamisest.
Alkaanide nimetused ja nende omadused
Selle klassi lihtsaim esindaja on metaan. Sellele järgnevad ained nagu etaan, propaan ja butaan. Nende nimi põhineb kreekakeelse numbritüvel, millele on lisatud järelliide -an. Alkaanide nimetused on loetletud IUPACi nomenklatuuris.
Alkeenide, alküünide, alkaanide üldvalem sisaldab ainult kahte tüüpi aatomeid. Nende hulka kuuluvad süsiniku ja vesiniku elemendid. Süsinikuaatomite arv kõigis kolmes klassis on sama, erinevust täheldatakse ainult vesiniku arvus, mida saab eraldada või lisada. Alates saada küllastumata ühendeid. Parafiinide esindajad molekulis sisaldavad 2 rohkem vesinikuaatomit kui olefiinid, mida kinnitab alkaanide, alkeenide üldvalem. Alkeenstruktuuri peetakse kaksiksideme olemasolu tõttu küllastumatuks.
Kui korreleerida vee-ro-dny ja süsinik-le-ro-dny aatomite arvu al-ka-nah-s, on väärtus võrreldes teiste kivisöe-le-vo klassidega max-si-väike. -ro-dovile.
Alates metaanist ja lõpetades butaaniga (C1 kuni C4) eksisteerivad ained gaasilisel kujul.
Vedelal kujul on süsivesinikud homoloogse intervalliga C5 kuni C16. Alustades alkaanist, mille peaahelas on 17 süsinikuaatomit, toimub füüsikalise oleku üleminek tahkesse vormi.
Neid iseloomustab süsiniku skeleti isomeeria ja molekuli optilised modifikatsioonid.

Parafiinides loetakse süsiniku valentsid täielikult hõivatuks naabruses asuvate süsiniku-le-ro-da-mi või in-do-ro-da-mi poolt, moodustades σ-tüüpi sideme. Keemilisest vaatenurgast tingib see nende nõrgad omadused, mistõttu alkaane nimetatakse pre-del-ny-x või küllastunud-schen-ny-x coal-le-to-do-rodov, millel puudub afiinsus.
Nad osalevad asendusreaktsioonides, mis on seotud molekuli radikaalse halogeenimise, sulfokloorimise või nitreerimisega.
Parafiinid läbivad kõrgetel temperatuuridel oksüdeerumise, põlemise või lagunemise protsessi. Reaktsioonikiirendite toimel toimub vesinikuaatomite elimineerimine või alkaanide dehüdrogeenimine.
Mis on alküünid
Neid nimetatakse ka atsetüleensüsivesinikeks, mille süsinikuahelas on kolmikside. Alküünide struktuuri kirjeldab üldvalem C n H 2 n-2. See näitab, et erinevalt alkaanidest puudub atsetüleensüsivesinikel neli vesinikuaatomit. Need on asendatud kolmiksidemega, mille moodustavad kaks π-ühendit.
See struktuur määrab selle klassi keemilised omadused. Alkeenide ja alküünide struktuurivalem näitab selgelt nende molekulide küllastumatust, samuti kaksiksideme (H 2 C꞊CH 2) ja kolmikside (HC≡CH) olemasolu.
Alküünide nimetused ja nende omadused
Lihtsaim esindaja on atsetüleen või HC≡CH. Seda nimetatakse ka etiiniks. See tuleb küllastunud süsivesiniku nimetusest, milles liide -an on eemaldatud ja -in lisatud. Pikkade alküünide nimetustes näitab number kolmiksideme asukohta.
Teades küllastunud ja küllastumata süsivesinike struktuuri, on võimalik määrata, millise tähe all on näidatud alküünide üldvalem: a) CnH2n; c) CnH2n+2; c) CnH2n-2; d) CnH2n-6. Õige vastus on kolmas variant.
Alustades atsetüleenist ja lõpetades butaaniga (C 2 kuni C 4), on ained oma olemuselt gaasilised.

Vedelal kujul on süsivesinikke homoloogse intervalliga C5 kuni C17. Alustades alküünist, mille peaahelas on 18 süsinikuaatomit, toimub füüsikalise oleku üleminek tahkesse vormi.
Neid iseloomustab isomeeria süsinikskeletis, kolmiksideme asend, samuti molekuli klassidevahelised modifikatsioonid.
Atsetüleeni süsivesinikud on keemiliselt sarnased alkeenidega.
Kui alküünidel on terminaalne kolmikside, toimivad nad happena, moodustades alküniidisooli, näiteks NaC≡CNa. Kahe π-sideme olemasolu muudab naatriumatsetülediini molekuli tugevaks nukleofiiliks, mis astub asendusreaktsioonidesse.
Atsetüleen klooritakse dikloroatsetüleeni saamiseks vaskkloriidi juuresolekul, kondenseerumine haloalküünide toimel koos diatsetüleeni molekulide vabanemisega.
Alküünid osalevad reaktsioonides, mille põhimõte on halogeenimise, hüdrohalogeenimise, hüdratsiooni ja karbonüülimise aluseks. Sellised protsessid kulgevad aga nõrgemalt kui kaksiksidemega alkeenides.
Atsetüleensete süsivesinike puhul on võimalikud alkoholimolekuli, primaarse amiini või vesiniksulfiidi nukleofiilset tüüpi liitumisreaktsioonid.
Alkeenid on küllastumata süsivesinikud, millel on üks kaksikside aatomite vahel. Nende teine nimi on olefiinid, see on seotud selle ühendite klassi avastamise ajalooga. Põhimõtteliselt neid aineid looduses ei esine, vaid inimene sünteesib neid praktilistel eesmärkidel. IUPAC-i nomenklatuuris on nende ühendite nimetused moodustatud samal põhimõttel nagu alkaanide puhul, ainult järelliide “an” asendatakse sõnaga “ene”.
Kokkupuutel
Alkeenide struktuur
Kaks kaksiksideme moodustumisega seotud süsinikuaatomit on alati sp2 hübridisatsioonis ja nendevaheline nurk on 120 kraadi. Kaksikside tekib π -π orbitaalide kattumisel ja see ei ole väga tugev, mistõttu on see side üsna kergesti purunev, mida kasutatakse ainete keemilistes omadustes.
isomeeria
Võrreldes piiravatega, on nendes süsivesinikes see võimalik rohkem liike, nii ruumiline kui ka struktuurne. Struktuurse isomeeria võib samuti jagada mitmeks tüübiks.
Esimene on olemas ka alkaanide jaoks ja seisneb süsinikuaatomite erinevas ühenduses. Seega võivad penteen-2 ja 2-metüülbuteen-2 olla isomeerid. Ja teine on kaksiksideme positsiooni muutus.
Nendes ühendites on ruumiline isomeeria võimalik tänu kaksiksideme ilmnemisele. Seda on kahte tüüpi - geomeetriline ja optiline.
Geomeetriline isomeeria on looduses üks levinumaid tüüpe ja peaaegu alati on geomeetrilistel isomeeridel radikaalselt erinevad füüsikalised ja keemilised omadused. Eristama cis- ja trans-isomeerid. Esimesel juhul paiknevad asendajad mitmiksideme ühel küljel, samas kui trans-isomeerides on nad erinevatel tasapindadel.
Alkeenide saamine
 Need saadi esmakordselt, nagu paljud teised ained, täiesti juhuslikult.
Need saadi esmakordselt, nagu paljud teised ained, täiesti juhuslikult.
Saksa keemik ja teadlane Becher uuris 17. sajandi lõpus väävelhappe mõju etüülalkoholile ja mõistis, et sai tundmatut gaasi, mis on reaktiivsem kui metaan.
Hiljem viisid sarnased uuringud läbi veel mitmed teadlased, kes said ka teada, et see gaas moodustab klooriga suheldes õlise aine.
Seetõttu oli algselt see ühendite klass nimega olefiinid, mis tõlkes tähendab õline. Kuid ikkagi ei suutnud teadlased kindlaks teha selle ühendi koostist ja struktuuri. See juhtus alles peaaegu kaks sajandit hiljem, üheksateistkümnenda sajandi lõpus.
Praegu on alkeenide saamiseks palju võimalusi.
tööstuslikud meetodid
Kviitung tööstuslikud meetodid:
- Küllastunud süsivesinike dehüdrogeenimine. See reaktsioon on võimalik ainult kõrgete temperatuuride (umbes 400 kraadi) ja katalüsaatorite - kas kroomoksiid 3 või alumiinium-plaatina katalüsaatorite - toimel.
- Dihaloalkaanide dehalogeenimine. Tekib ainult tsingi või magneesiumi juuresolekul ja kõrgetel temperatuuridel.
- Haloalkaanide dehüdrohalogeenimine. See viiakse läbi orgaaniliste hapete naatriumi- või kaaliumisoolade abil kõrgendatud temperatuuril.
Tähtis! Need alkeenide saamise meetodid ei anna puhast produkti, reaktsiooni tulemuseks on küllastumata süsivesinike segu. Nende hulgas valitsev ühend määratakse Zaitsevi reegli abil. Selles öeldakse, et vesinik eraldub kõige tõenäolisemalt süsinikuaatomist, millel on vesinikuga kõige vähem sidemeid.
Alkoholide dehüdratsioon. Seda saab läbi viia ainult kuumutamisel ja tugevate mineraalhapete lahuste juuresolekul, millel on vett eemaldav omadus.
alküünide hüdrogeenimine. Võimalik ainult paladiumkatalüsaatorite juuresolekul.
Alkeenide keemilised omadused
Alkeenid on väga keemiliselt aktiivsed ained. See on suuresti tingitud kaksiksideme olemasolust. Selle ühendite klassi kõige iseloomulikumad reaktsioonid on elektrofiilsed ja radikaalide liitumised.
- Alkeenhalogeenimine on klassikaline elektrofiilne liitumisreaktsioon. See esineb ainult inertsete orgaaniliste lahustite, kõige sagedamini süsiniktetrakloriidi juuresolekul.
- Hüdrohalogeenimine. Seda tüüpi kinnitamine toimub vastavalt Markovnikovi reeglile. Ioon kinnitub kaksiksideme lähedal oleva rohkem hüdrogeenitud süsinikuaatomi külge ja vastavalt halogeniidi ioon kinnitub teise süsinikuaatomiga. Seda reeglit rikutakse peroksiidühendite juuresolekul - Harroshi efekt. Vesinikhalogeniidi lisamine toimub täiesti vastupidiselt Markovnikovi reeglile.
- Hüdroboratsioon. Sellel reaktsioonil on märkimisväärne praktiline tähtsus. Seetõttu teadlane, kes avastas ja uuris seda isegi sai Nobeli preemia. See reaktsioon viiakse läbi mitmes etapis, samas kui booriooni lisamist Markovnikovi reegli kohaselt ei toimu.
- Alkeenide hüdratsioon või lisamine. Ka see reaktsioon kulgeb Markovnikovi reegli järgi. Hüdroksiidiioon lisab kaksiksideme juures kõige vähem hüdrogeenitud süsinikuaatomit.
- Alküülimine on veel üks tööstuses sageli kasutatav reaktsioon. See seisneb küllastunud süsivesinike lisamises küllastumata süsivesinikele madalate temperatuuride ja katalüsaatorite mõjul, et suurendada ühendite aatommassi. Kõige tavalisemad katalüsaatorid on tugevad mineraalhapped. Samuti võib see reaktsioon kulgeda vastavalt vabade radikaalide mehhanismile.
- Alkeenide polümerisatsioon on küllastunud süsivesinike jaoks veel üks ebatüüpiline reaktsioon. See hõlmab paljude molekulide ühendamist üksteisega, et moodustada tugev ühendus, mis erineb selle füüsikaliste omaduste poolest.
 n selles reaktsioonis on sidemesse astunud molekulide arv. Rakendamise eelduseks on happeline keskkond, kõrge temperatuur ja suurenenud rõhk.
n selles reaktsioonis on sidemesse astunud molekulide arv. Rakendamise eelduseks on happeline keskkond, kõrge temperatuur ja suurenenud rõhk.
Samuti iseloomustavad alkeene muud elektrofiilsed liitumisreaktsioonid, mis ei ole praktikas laialdaselt kasutatud.
Näiteks alkoholide liitumisreaktsioon eetrite moodustumisega.
Või happekloriidide lisamine koos küllastumata ketoonide tootmisega - Kondakovi reaktsioon.
Märge! See reaktsioon on võimalik ainult tsinkkloriidi katalüsaatori juuresolekul.
Järgmine suurem alkeenidele iseloomulik reaktsioonide klass on radikaalide liitumisreaktsioonid. Need reaktsioonid on võimalikud ainult vabade radikaalide moodustumisel kõrgete temperatuuride, kiirguse ja muude toimingute mõjul. Kõige tüüpilisem radikaali liitumisreaktsioon on hüdrogeenimine küllastunud süsivesinike moodustumisega. See toimub eranditult temperatuuride mõjul ja plaatina katalüsaatori juuresolekul.
Kaksiksideme olemasolu tõttu on alkeenid väga iseloomulikud erinevatele oksüdatsioonireaktsioonid.
- Põlemine on klassikaline oksüdatsioonireaktsioon. See läheb hästi ilma katalüsaatoriteta. Olenevalt hapniku kogusest on võimalikud erinevad lõpp-produktid: süsinikdioksiidist süsinikuni.
- Oksüdeerimine kaaliumpermanganaadiga neutraalses keskkonnas. Toodeteks on mitmehüdroksüülsed alkoholid ja pruun mangaandioksiidi sade. Seda reaktsiooni peetakse alkeenide puhul kvalitatiivseks.
- Samuti saab nõrga oksüdatsiooni läbi viia vesinikperoksiidi, osmiumoksiidi 8 ja muude oksüdeerivate ainetega neutraalses keskkonnas. Alkeenide nõrga oksüdatsiooni korral katkeb ainult üks side, reaktsioonisaaduseks on reeglina mitmehüdroksüülsed alkoholid.
- Võimalik on ka kõva oksüdatsioon, mille käigus katkevad mõlemad sidemed ja tekivad happed või ketoonid. Eelduseks on happeline keskkond, enamasti kasutatakse väävelhapet, kuna ka teised happed võivad oksüdeeruda koos kõrvalsaaduste moodustumisega.
Alkeenide füüsikalised omadused
 Ainsad gaasid tavatingimustes on etüleen, propeen ja buteen.
Ainsad gaasid tavatingimustes on etüleen, propeen ja buteen.
Alates penteenist kuni heptodetseeni on kõik alkeenid vedelas olekus.
Ja kõik ülejäänud on tahked ained.
Sulamis- ja keemistemperatuur tõusevad proportsionaalselt molekulmassiga, kuid võivad isomeeride puhul muutuda.
Kõik alkeenid ei lahustu vees, kuid lahustub kergesti inertsetes orgaanilistes lahustites.
Alkeenide rakendamine
Alkeene kasutatakse tööstuses üsna laialdaselt ja neid kasutatakse paljude ainete sünteesiks. Näiteks etüleeni abil sünteesitakse polüvinüülkloriidi (PVC), stüreeni, etüleenglükooli, etanooli, polüetüleeni, kummisid ja paljusid muid aineid. Polüpropüleeni tootmiseks kasutatakse kõige rohkem propüleeni.
Alkeenid - struktuur, omadused, rakendused
Uurime keemiat - alkeenide omadusi, rakendust tööstuses
Järeldus
Üldiselt võime kindlalt öelda, et alkeenid on oma keemiliste omaduste tõttu tööstuses väga populaarsed. Nad on seotud mitmesuguste plastide, kummide ja paljude muude ainete tootmisega.
Alkeenide füüsikalised omadused on sarnased alkaanide omadega, kuigi neil kõigil on veidi madalamad sulamis- ja keemistemperatuurid kui vastavatel alkaanidel. Näiteks pentaani keemistemperatuur on 36 °C, penteen-1 keemistemperatuur on aga 30 °C. Normaaltingimustes on C2-C4 alkeenid gaasid. C 5 - C 15 - vedelikud, alustades C 16 - tahked ained. Alkeenid ei lahustu vees, lahustuvad orgaanilistes lahustites.
Alkeene leidub looduses harva. Kuna alkeenid on väärtuslikud toorained tööstuslikuks orgaaniliseks sünteesiks, on nende valmistamiseks välja töötatud palju meetodeid.
1. Alkeenide peamine tööstuslik allikas on naftat moodustavate alkaanide krakkimine:
3. Laboritingimustes saadakse alkeenid lõhustamis- (eliminatsiooni) reaktsioonidega, mille käigus naabersüsinikuaatomitest eraldatakse kaks aatomit või kaks aatomirühma ning tekib täiendav p-side. Need reaktsioonid hõlmavad järgmist.
1) Alkoholide dehüdratsioon toimub siis, kui neid kuumutatakse vett eemaldavate ainetega, näiteks väävelhappega temperatuuril üle 150 ° C:
Kui H2O lõhustatakse alkoholidest, HBr ja HCl alküülhalogeniididest, siis vesinikuaatom eraldatakse valdavalt naabersüsinikuaatomitest, mis on seotud väikseima arvu vesinikuaatomitega (vähemalt hüdrogeenitud süsinikuaatomist). Seda mustrit nimetatakse Zaitsevi reegliks.
3) Dehalogeenimine toimub siis, kui dihalogeniide, mille naabersüsinikuaatomites on halogeeniaatomeid, kuumutatakse aktiivsete metallidega:
CH2Br-CHBr-CH3 + Mg → CH2 \u003d CH-CH3 + Mg Br2.
Alkeenide keemilised omadused on määratud kaksiksideme olemasoluga nende molekulides. P-sideme elektrontihedus on üsna liikuv ja reageerib kergesti elektrofiilsete osakestega. Seetõttu kulgevad paljud alkeenide reaktsioonid vastavalt mehhanismile elektrofiilne lisamine, mida tähistatakse sümboliga A E (inglise keelest additioelektrofiilne). Elektrofiilsed liitumisreaktsioonid on ioonsed protsessid, mis toimuvad mitmes etapis.
Esimeses etapis interakteerub elektrofiilne osake (enamasti on see H + prooton) kaksiksideme p-elektronidega ja moodustab p-kompleksi, mis seejärel muutub karbokatiooniks, moodustades sideme vahel kovalentse s-sideme. elektrofiilne osake ja üks süsinikuaatomitest:
alkeen-p-komplekskarbokatatsioon
Teises etapis reageerib karbokatatsioon aniooniga X -, moodustades aniooni elektronpaari tõttu teise s-sideme:

Elektrofiilsete liitumisreaktsioonide vesinikioon kinnitub kaksiksidemes oleva süsinikuaatomi külge, millel on rohkem negatiivset laengut. Laengu jaotuse määrab p-elektronite tiheduse nihe asendajate mõjul:  .
.
Elektrondoonori asendajad, millel on +I efekt, nihutavad p-elektronide tiheduse rohkem hüdrogeenitud süsinikuaatomile ja tekitavad sellele osalise negatiivse laengu. See selgitab Markovnikovi reegel: kui HX-tüüpi polaarsed molekulid (X = Hal, OH, CN jne) on seotud ebasümmeetriliste alkeenidega, kinnitub vesinik eelistatavalt kaksiksideme juures rohkem hüdrogeenitud süsinikuaatomiga.
Mõelge lisamisreaktsioonide konkreetsetele näidetele.
1) Hüdrohalogeenimine. Kui alkeenid interakteeruvad vesinikhalogeniididega (HCl, HBr), tekivad alküülhalogeniidid:
CH3-CH \u003d CH2 + HBr® CH3-CHBr-CH3.
Reaktsiooniproduktid määratakse Markovnikovi reegliga.
Siiski tuleb rõhutada, et orgaanilise peroksiidi juuresolekul ei reageeri polaarsed HX-molekulid Markovnikovi reegli kohaselt alkeenidega:
| R-O-O-R | ||
| CH3-CH \u003d CH2 + HBr | CH3-CH2-CH2Br |
See on tingitud asjaolust, et peroksiidi olemasolu põhjustab pigem radikaali kui ioonreaktsiooni mehhanismi.
2) Niisutus. Kui alkeenid interakteeruvad veega mineraalhapete (väävel-, fosforhape) juuresolekul, tekivad alkoholid. Mineraalhapped toimivad katalüsaatoritena ja on prootonite allikad. Vee lisamine järgib ka Markovnikovi reeglit:
CH3-CH \u003d CH2 + HOH® CH3-CH (OH)-CH3.
3) Halogeenimine. Alkeenid muudavad broomivee värvituks:
CH2 \u003d CH2 + Br2® BrCH2-CH2Br.
See reaktsioon on kaksiksideme jaoks kvalitatiivne.
4) Hüdrogeenimine. Vesiniku lisamine toimub metallkatalüsaatorite toimel:
kus R \u003d H, CH 3, Cl, C 6 H 5 jne. CH 2 \u003d CHR molekuli nimetatakse monomeeriks, saadud ühend on polümeer, arv n on polümerisatsiooniaste.
Erinevate alkeeni derivaatide polümerisatsiooniga saadakse väärtuslikud tööstustooted: polüetüleen, polüpropüleen, polüvinüülkloriid jt.
Lisaks lisandumisele iseloomustavad alkeene ka oksüdatsioonireaktsioonid. Alkeenide kergel oksüdeerimisel kaaliumpermanganaadi vesilahusega (Wagneri reaktsioon) tekivad kahehüdroksüülsed alkoholid:
ZSN 2 \u003d CH 2 + 2KMn O 4 + 4H 2 O ® ZNOCH 2 -CH 2 OH + 2MnO 2 ↓ + 2KOH.
Selle reaktsiooni tulemusena muutub violetne kaaliumpermanganaadi lahus kiiresti värvituks ja sadestub pruun mangaanoksiidi (IV) sade. See reaktsioon, nagu ka broomivee värvitustamine, on kaksiksideme jaoks kvalitatiivne. Alkeenide kõval oksüdeerimisel kaaliumpermanganaadi keeva lahusega happelises keskkonnas toimub kaksiksideme täielik lõhustumine ketoonide, karboksüülhapete või CO 2 moodustumisega, näiteks:
| [ABOUT] | ||
| CH3-CH \u003d CH-CH3 | 2CH3-COOH |
Oksüdatsiooniprodukte saab kasutada kaksiksideme positsiooni määramiseks lähtealkeenis.
Nagu kõik teised süsivesinikud, põlevad alkeenid ja rohke õhuga moodustavad süsinikdioksiidi ja vett:
C n H 2 n + Zn / 2O 2 ® n CO 2 + n H 2 O.
Piiratud õhu juurdepääsu korral võib alkeenide põlemine põhjustada süsinikmonooksiidi ja vee moodustumist:
C n H 2n + nO 2 ® nCO + nH 2 O.
Kui segate alkeeni hapnikuga ja juhite selle segu 200 ° C-ni kuumutatud hõbekatalüsaatorile, moodustub näiteks alkeenoksiid (epoksüalkaan):

Mis tahes temperatuuril alkeenid oksüdeeritakse osooni toimel (osoon on tugevam oksüdeerija kui hapnik). Kui gaasiline osoon lastakse toatemperatuuril madalamal temperatuuril läbi alkeeni lahuse süsiniktetrakloriidis, toimub liitumisreaktsioon ja moodustuvad vastavad osoniidid (tsüklilised peroksiidid). Osoniidid on väga ebastabiilsed ja võivad kergesti plahvatada. Seetõttu neid tavaliselt ei eraldata, vaid vahetult pärast veega lagundamist – sel juhul tekivad karbonüülühendid (aldehüüdid või ketoonid), mille struktuur näitab osoonimisele allutatud alkeeni struktuuri.
Madalamad alkeenid on tööstusliku orgaanilise sünteesi olulised lähteained. Etüleenist saadakse etüülalkohol, polüetüleen, polüstüreen. Propeeni kasutatakse polüpropüleeni, fenooli, atsetooni, glütseriini sünteesiks.
Need, mis sisaldavad pi-sidet, on küllastumata süsivesinikud. Need on alkaanide derivaadid, mille molekulides on eraldunud kaks vesinikuaatomit. Saadud vabad valentsid moodustavad uut tüüpi sideme, mis paikneb risti molekuli tasapinnaga. Nii tekib uus ühendite rühm – alkeenid. Selles artiklis käsitleme selle klassi ainete füüsikalisi omadusi, valmistamist ja kasutamist igapäevaelus ja tööstuses.
Etüleeni homoloogne seeria
Kõigi alkeenideks nimetatavate ühendite üldvalem, mis peegeldab nende kvalitatiivset ja kvantitatiivset koostist, on C n H 2 n. Süsivesinike nimetused süstemaatilise nomenklatuuri järgi on järgmised: vastava alkaani terminis muutub järelliide -an-st -eeniks, näiteks: etaan - eteen, propaan - propeen jne Mõnes allikas saate leidke selle klassi ühenditele teine nimi - olefiinid. Järgmisena uurime kaksiksideme moodustumise protsessi ja alkeenide füüsikalisi omadusi ning määrame ka nende sõltuvuse molekuli struktuurist.
Kuidas tekib kaksikside?
Pi-sideme elektroonilist olemust etüleeni näitel võib kujutada järgmiselt: selle molekuli süsinikuaatomid on sp 2 hübridisatsiooni kujul. Sel juhul moodustub sigma side. Veel kaks hübriidorbitaali, millest igaüks koosneb süsinikuaatomitest, moodustavad vesinikuaatomitega lihtsad sigmasidemed. Kaks järelejäänud vaba süsinikuaatomite hübriidpilve kattuvad molekuli tasapinnast ülal ja all – tekib pi-side. Just tema määrab alkeenide füüsikalised ja keemilised omadused, mida arutatakse hiljem.

Ruumiline isomeeria
Ühendeid, millel on sama kvantitatiivne ja kvalitatiivne molekulide koostis, kuid erinev ruumiline struktuur, nimetatakse isomeerideks. Isomerism esineb ainete rühmas, mida nimetatakse orgaaniliseks. Olefiinide iseloomustamist mõjutab suuresti optilise isomeeria nähtus. See väljendub selles, et etüleeni homoloogid, mis sisaldavad kaksiksideme kahe süsinikuaatomi juures erinevaid radikaale või asendajaid, võivad esineda kahe optilise isomeeri kujul. Need erinevad üksteisest asendajate asukoha poolest ruumis kaksiksideme tasandi suhtes. Sel juhul on alkeenide füüsikalised omadused samuti erinevad. Näiteks kehtib see ainete keemis- ja sulamistemperatuuride kohta. Seega on sirge ahelaga olefiinidel kõrgem keemispunkt kui isomeerühenditel. Samuti on alkeenide cis-isomeeride keemistemperatuur kõrgem kui trans-isomeeridel. Sulamistemperatuuride osas on pilt vastupidine.
Etüleeni ja selle homoloogide füüsikaliste omaduste võrdlusomadused
Esimesed kolm olefiinide esindajat on gaasilised ühendid, siis alates penteenist C 5 H 10 ja kuni alkeenini valemiga C 17 H 34 on need vedelikud ja seejärel tahked ained. Eteeni homoloogid näitavad järgmist trendi: ühendite keemistemperatuurid langevad. Näiteks etüleeni puhul on see indikaator -169,1 °C ja propüleeni puhul -187,6 °C. Kuid keemistemperatuurid suurenevad molekulmassi suurenemisega. Seega on etüleeni puhul -103,7 °C ja propeeni puhul -47,7 °C. Öeldut kokku võttes võime järeldada, et alkeenide füüsikalised omadused sõltuvad nende molekulmassist. Selle suurenemisega muutub ühendite agregaatolek suunas: gaas - vedelik - tahke, samuti väheneb sulamistemperatuur ja keemistemperatuurid tõusevad.

Eteeni omadused
Alkeenide homoloogse seeria esimene esindaja on etüleen. See on värvitu gaas, mis lahustub vees vähe, kuid lahustub hästi orgaanilistes lahustites. Molekulmass - 28, eteen on õhust veidi kergem, sellel on õrn magus lõhn. See reageerib kergesti halogeenide, vesiniku ja vesinikhalogeniididega. Alkeenide ja parafiinide füüsikalised omadused on aga üsna lähedased. Näiteks agregatsiooniseisund, metaani ja etüleeni võime tugevalt oksüdeeruda jne Kuidas alkeene eristada? Kuidas paljastada olefiini küllastumata olemus? Selleks on kvalitatiivsed reaktsioonid, millel peatume üksikasjalikumalt. Tuletage meelde, millised omadused on molekuli struktuuris alkeenidel. Nende ainete füüsikalised ja keemilised omadused on määratud kaksiksideme olemasoluga nende koostises. Selle olemasolu tõestamiseks lastakse gaasiline süsivesinik läbi purpurse kaaliumpermanganaadi või broomivee lahuse. Kui need on värvi muutnud, sisaldab ühend molekulide koostises pi-sidemeid. Etüleen siseneb oksüdatsioonireaktsiooni ja muudab värvituks KMnO 4 ja Br 2 lahused.
Liitmisreaktsioonide mehhanism
Kaksiksideme katkemine lõpeb süsiniku vabadele valentsidele teiste keemiliste elementide aatomite lisamisega. Näiteks etüleeni reaktsioon vesinikuga, mida nimetatakse hüdrogeenimiseks, tekitab etaani. Vaja on katalüsaatorit, näiteks nikli-, pallaadiumi- või plaatinapulbrit. Reaktsioon HCl-ga lõpeb kloroetaani moodustumisega. Alkeenid, mille molekulis on rohkem kui kaks süsinikuaatomit, läbivad V. Markovnikovi reeglit arvestades vesinikhalogeniidide liitumisreaktsiooni.

Kuidas eteeni homoloogid interakteeruvad vesinikhalogeniididega
Kui seisame ülesande ees "Iseloomusta alkeenide füüsikalisi omadusi ja nende valmistamist", siis tuleb V. Markovnikovi reeglit täpsemalt käsitleda. Praktikas on kindlaks tehtud, et etüleeni homoloogid reageerivad kaksiksideme purunemise kohas vesinikkloriidi ja teiste ühenditega, järgides teatud mustrit. See seisneb selles, et vesinikuaatom on seotud kõige hüdrogeenitud süsinikuaatomiga ja kloori-, broomi- või joodiioon on seotud süsinikuaatomiga, mis sisaldab kõige vähem vesinikuaatomeid. Seda liitumisreaktsioonide kulgemise tunnust nimetatakse V. Markovnikovi reegliks.
Hüdratsioon ja polümerisatsioon
Jätkame alkeenide füüsikaliste omaduste ja kasutusala käsitlemist homoloogse seeria esimese esindaja - eteeni - näitel. Selle reaktsiooni veega kasutatakse orgaanilise sünteesi tööstuses ja sellel on suur praktiline tähtsus. Protsessi viis esmakordselt läbi 19. sajandil A.M. Butlerov. Reaktsioon nõuab mitmete tingimuste täitmist. See on esiteks kontsentreeritud väävelhappe või oleumi kasutamine eteeni katalüsaatori ja lahustina, rõhk umbes 10 atm ja temperatuur 70 °. Niisutusprotsess toimub kahes faasis. Algul lisatakse eteenile pi-sideme katkemise kohas sulfaadi molekulid ja moodustub etüülväävelhape. Seejärel reageerib saadud aine veega, saadakse etüülalkohol. Etanool on toiduainetööstuses kasutatav oluline toode plastide, sünteetiliste kummide, lakkide ja muude orgaaniliste kemikaalide tootmiseks.

Olefiinipõhised polümeerid
Jätkates alkeenide klassi kuuluvate ainete kasutamise teema uurimist, uurime nende polümerisatsiooni protsessi, milles saavad osaleda ühendid, mis sisaldavad oma molekulide koostises küllastumata keemilisi sidemeid. Tuntakse mitut tüüpi polümerisatsioonireaktsioone, mille järgi moodustuvad kõrgmolekulaarsed tooted – polümeerid, näiteks polüetüleen, polüpropüleen, polüstüreen jne. Vabade radikaalide mehhanism viib kõrgsurve polüetüleeni tootmiseni. See on üks tööstuses enim kasutatavaid ühendeid. Katioon-ioonne tüüp annab stereoregulaarse struktuuriga polümeeri, näiteks polüstüreeni. Seda peetakse üheks ohutumaks ja mugavamaks kasutamiseks polümeeriks. Polüstüreenist valmistatud tooted on vastupidavad agressiivsetele ainetele: happed ja leelised, mittesüttivad, kergesti värvitavad. Teine polümerisatsioonimehhanismi tüüp on dimerisatsioon, mis viib isobuteeni tootmiseni, mida kasutatakse bensiini dekoputusvastase lisandina.
Kuidas saada
Alkeene, mille füüsikalisi omadusi uurime, saadakse laboris ja tööstuses erinevate meetoditega. Orgaanilise keemia koolikursuse katsetes kasutatakse etüülalkoholi dehüdratsiooni protsessi vett eemaldavate ainete, näiteks fosforpentoksiidi või sulfaathappe abil. Reaktsioon viiakse läbi kuumutamisel ja see on vastupidine etanooli saamise protsessile. Veel üks levinud meetod alkeenide saamiseks on leidnud oma rakendust tööstuses, nimelt: küllastunud süsivesinike halogeenderivaatide, näiteks kloropropaani kuumutamine kontsentreeritud leeliste - naatrium- või kaaliumhüdroksiidi lahustega. Reaktsioonis lõhustub vesinikkloriidi molekul, kohas, kus tekivad süsinikuaatomite vabad valentsid, tekib kaksikside. Keemilise protsessi lõppsaaduseks on olefiin-propeen. Jätkates alkeenide füüsikaliste omaduste käsitlemist, peatume olefiinide saamise põhiprotsessil - pürolüüsil.

Etüleeni seeria küllastumata süsivesinike tööstuslik tootmine
Odavad toorained - nafta krakkimise käigus moodustunud gaasid on keemiatööstuses olefiinide allikaks. Selleks kasutatakse pürolüüsi tehnoloogilist skeemi - gaasisegu lõhestamist, mis toimub süsiniksidemete katkemise ning etüleeni, propeeni ja muude alkeenide moodustumisega. Pürolüüs viiakse läbi spetsiaalsetes ahjudes, mis koosnevad üksikutest pürorullidest. Need loovad temperatuuri suurusjärgus 750-1150°C ja lahjendina on veeaur. Reaktsioonid kulgevad ahelmehhanismi kaudu, mis kulgeb vaheradikaalide moodustumisega. Lõpptoode on etüleen või propeen ja neid toodetakse suurtes kogustes.

Uurisime üksikasjalikult füüsikalisi omadusi, samuti alkeenide saamise rakendust ja meetodeid.
Nad põlevad.
1. Põlemine õhus
2. Oksüdeerimine permanganaadi vesilahusega (Wagneri reaktsioon)
Neutraalses keskkonnas saadakse pruun mangaanoksiid (IV) ja orgaanilise aine kaksiksidemega on seotud kaks OH-rühma:
Vasakul on kaaliumpermanganaadiga alkeen, paremal alkaan. Orgaaniline kiht (ülemine) ei segune veekihiga (alumine). Paremal ei ole permanganaadi värvus muutunud. Riis. 1.

Riis. 1. Wagneri reaktsioon
3. Oksüdeerimine hapendatud permanganaadi lahusega
Happelises keskkonnas muutub lahus värvituks: Mn +7 redutseeritakse Mn +2-ks. Hapendatud kaaliumpermanganaadi lahuse värvimuutus - kvalitatiivne reaktsioon küllastumata ühenditele.
5CH 2 = CH 2 + 12 KMnO 4 + 18H 2 SO 4 = 12 MnSO 4 + 10CO 2 + 6K 2 SO 4 + 28 H 2 O.
Oksüdatsiooniproduktide sõltuvus alkeeni struktuurist:

Radikaalne asendus alkeenides
Propeen ja kloor kõrgel temperatuuril: 400-500 o C (radikaalreaktsioonide jaoks soodsad tingimused) annavad toote mitte lisamise, vaid asendamise.
Tööstuses alkeenid saadakse nafta alkaanide krakkimise või dehüdrogeenimise teel.
Laboratoorsed meetodid lõhustamisreaktsioonide põhjal alkeenide saamine.
1. Dehalogeenimine
Dihaloalkaanide, mille molekulides halogeeniaatomid asuvad naabersüsinikuaatomite juures, reaktsioon magneesiumi või tsingiga viib kaksiksideme moodustumiseni:
CH 2 Cl-CH 2 Cl + Zn → CH 2 \u003d CH 2 + ZnCl 2
2. Dehüdrohalogeenimine
Kui haloalkaanid reageerivad leelise kuuma alkoholilahusega, eraldub vesinikhalogeniidi molekul ja moodustub alkeen:
CH3-CH2-CHCl-CH3 + KOH alkohol. CH3-CH \u003d CH-CH3 + KCl + H2O
3. Dehüdratsioon
Alkoholide kuumutamine kontsentreeritud väävel- või fosforhappega viib vee eemaldamiseni ja alkeeni moodustumiseni.
Ebasümmeetriliste haloalkaanide ja alkoholide eliminatsioonireaktsioonid kulgevad sageli vastavalt Zaitsevi reegel: Vesinikuaatom on valdavalt eraldatud C-aatomite omast, mis on seotud väikseima H-aatomite arvuga.
Zaitsevi reeglit, nagu ka Markovnikovi reeglit, saab seletada reaktsioonis tekkivate vaheosakeste stabiilsuse võrdlemisega.
Etüleen, propeen ja buteenid on naftakeemia sünteesi lähtematerjalid, eelkõige plastide tootmisel.
Kui alkeenidele lisatakse kloori, saadakse kloori derivaadid.
CH2 \u003d CH-CH3+Cl 2 → CH 2 Cl- CHCl- CH 3 (1,2-dikloropropaan)
Kuid juba 1884. aastal leidis vene teadlane Lvov M.D. (Joonis 2) viis propeeni kloorimisreaktsiooni läbi raskemates tingimustes, temperatuuril t = 400 0 C. Selle tulemusena ei olnud produkt mitte kloori lisamine, vaid asendus.
CH2 \u003d CH-CH3+Cl 2 CH2 \u003d CH-CH2Cl + HCl

Riis. 2. Vene teadlane M.D. Lviv
Samade ainete koosmõju erinevates tingimustes annab erinevaid tulemusi. Seda reaktsiooni kasutatakse laialdaselt glütserooli saamiseks. Mõnikord kasutatakse köögiviljapoodides etüleeni, et kiirendada puuviljade valmimist.
Õppetunni kokkuvõte
Selles tunnis käsitlesite teemat „Alkeenid. Keemilised omadused - 2. Alkeenide valmistamine ja kasutamine. Tunnis sai süvendada teadmisi alkeenidest, õppida tundma alkeenide keemilisi omadusi, aga ka alkeenide saamise ja kasutamise iseärasusi.
Bibliograafia
1. Rudzitis G.E. Keemia. Üldkeemia alused. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Keemia. 10. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2008. - 463 lk.
3. Keemia. 11. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2010. - 462 lk.
4. Khomchenko G.P., Khomchenko I.G. Keemiaülesannete kogu ülikoolidesse astujatele. - 4. väljaanne - M.: RIA "Uus laine": Kirjastus Umerenkov, 2012. - 278 lk.
Kodutöö
1. Nr 12, 13 (lk 39) Rudzitis G.E., Feldman F.G. Keemia: orgaaniline keemia. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Mis on etüleeni ja selle homoloogide kvalitatiivne reaktsioon?
3. Propeeni kloorimisel ei saa lisada, kuid asendamine toimub? Millega see seotud on?
- Kokkupuutel 0
- Google Plus 0
- Okei 0
- Facebook 0