La chiralità è l'incompatibilità di un oggetto con la sua immagine speculare mediante qualsiasi combinazione di rotazioni e traslazioni nello spazio tridimensionale. Stiamo parlando solo di uno specchio piano ideale. In esso, una curva a destra si trasforma in una curva a sinistra e viceversa.
La chiralità è tipica delle piante e degli animali e il termine stesso deriva dal greco. χείρ - mano.
Nei crocieri ci sono conchiglie destra e sinistra e persino becchi destro e sinistro (Fig. 1).
La “specularità” è comune anche nella natura inanimata (Fig. 2).
Riso. 2. Foto da scienceblogs.com (“Opzione Trinity” n. 24(218), 06/12/2016)" border="0">
Recentemente sono diventati di moda gli orologi “chirali”, cioè a specchio (notare la scritta sul quadrante) (Fig. 3).
E anche nella linguistica c’è posto per la chiralità! Questi sono palindromi: parole e frasi invertite, ad esempio: I WILL HIT THE UNCLE, AUNT HAPPY, I WILL HITT AUNT, UNCLE HAPPY o LENSON È UN CONTENITORE BOA, MA NON TI HA MANGIATO IL NASO ALL'INFERNO!
La chiralità è molto importante per chimici e farmacisti. La chimica si occupa di oggetti su scala nanometrica (la parola di moda “nano” deriva dal greco. νάννος - nano). Alla chiralità in chimica è dedicata una monografia, sulla cui copertina (nella foto) sulla destra) - colonne chirali e due molecole chirali di esagelicene (da elica- spirale).
E l'importanza della chiralità per la medicina è simboleggiata dalla copertina del numero di giugno di una rivista americana Giornale di educazione chimica per il 1996 (Fig. 4). La formula strutturale della penicillamina è raffigurata sul lato di un cane bonario che scodinzola. Il cane si guarda allo specchio e da lì una terribile bestia con la bocca scoperta e zannuta, gli occhi ardenti di fuoco e il pelo ritto lo guarda. Sul lato della bestia è raffigurata la stessa formula strutturale come immagine speculare della prima. Non meno eloquente era il titolo dell’articolo sui farmaci chirali pubblicato in questo numero: “Quando le molecole dei farmaci si guardano allo specchio”. Perché la “riflessione a specchio” cambia l’aspetto di una molecola in modo così drammatico? E come hai scoperto che due molecole sono “antipodi specchio”?
Polarizzazione della luce e attività ottica
Sin dai tempi di Newton, nella scienza si discute se la luce sia un'onda o una particella. Newton credeva che la luce fosse costituita da particelle con due poli: "nord" e "sud". Il fisico francese Etienne Louis Malus ha introdotto il concetto di luce polarizzata, con una direzione di “poli”. La teoria di Malus non è stata confermata, ma il nome è rimasto.
Nel 1816, il fisico francese Augustin Jean Fresnel espresse l'idea, insolita per l'epoca, che le onde luminose sono trasversali, come le onde sulla superficie dell'acqua.
Fresnel spiegò anche il fenomeno della polarizzazione della luce: nella luce ordinaria le vibrazioni si verificano in modo caotico, in tutte le direzioni perpendicolari alla direzione del raggio. Ma dopo aver attraversato alcuni cristalli, come il longarone islandese o la tormalina, la luce acquisisce proprietà speciali: le onde in essa contenute vibrano solo su un piano. In senso figurato, un raggio di tale luce è come un filo di lana che viene tirato attraverso uno stretto spazio tra due lamette affilate. Se si mette un secondo cristallo dello stesso tipo perpendicolare al primo, la luce polarizzata non lo attraverserà.
Puoi distinguere la luce ordinaria dalla luce polarizzata utilizzando strumenti ottici: polarimetri; Vengono utilizzati, ad esempio, dai fotografi: i filtri polarizzatori aiutano a eliminare i riflessi in una fotografia che si verificano quando la luce viene riflessa dalla superficie dell'acqua.
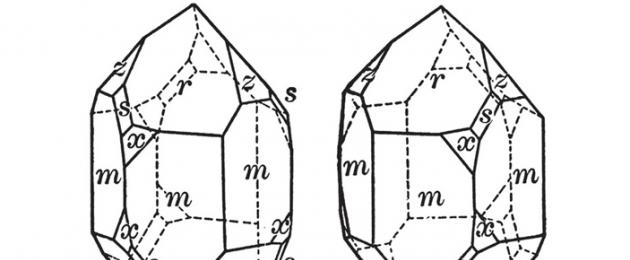
Si è scoperto che quando la luce polarizzata attraversa alcune sostanze, il piano di polarizzazione ruota. Questo fenomeno fu scoperto per la prima volta nel 1811 dal fisico francese Francois Dominique Arago nei cristalli di quarzo. Ciò è dovuto alla struttura del cristallo. I cristalli di quarzo naturale sono asimmetrici e sono di due tipi, che differiscono nella forma, come un oggetto dalla sua immagine speculare (Fig. 5). Questi cristalli ruotano il piano di polarizzazione della luce in direzioni opposte; erano chiamati destrimani e mancini.

Nel 1815, il fisico francese Jean Baptiste Biot e il fisico tedesco Thomas Johann Seebeck scoprirono che alcune sostanze organiche, come lo zucchero e la trementina, hanno anche la capacità di ruotare il piano di polarizzazione, non solo nella sostanza cristallina, ma anche in quella liquida, disciolta e perfino in quella liquida. stati gassosi. Si è scoperto che ogni “raggio colorato” di luce bianca ruota con un angolo diverso. Il piano di polarizzazione ruota di più per i raggi viola, di meno per i raggi rossi. Pertanto, una sostanza incolore può colorarsi alla luce polarizzata.
Come con i cristalli, alcuni composti chimici potrebbero esistere nelle varietà destrorsi o mancini. Tuttavia, non era chiaro a quali proprietà delle molecole fosse associato questo fenomeno: l'analisi chimica più approfondita non è riuscita a rilevare alcuna differenza tra loro! Questi tipi di sostanze erano chiamati isomeri ottici e i composti stessi erano chiamati otticamente attivi. Si è scoperto che le sostanze otticamente attive hanno anche un terzo tipo di isomeri: otticamente inattivi. Questo fu scoperto nel 1830 dal famoso chimico svedese Jons Jakob Berzelius: l'acido dell'uva C 4 H 6 O 6 è otticamente inattivo e l'acido tartarico della stessa identica composizione ha una rotazione giusta in soluzione. Ma nessuno sapeva se esistesse l’acido tartarico “levogiro”, non naturale, agli antipodi dell’acido destrogiro.
La scoperta di Pasteur
I fisici associavano l'attività ottica dei cristalli alla loro asimmetria; i cristalli completamente simmetrici, come i cristalli cubici di sale da cucina, sono otticamente inattivi. Il motivo dell'attività ottica delle molecole è rimasto a lungo completamente misterioso. La prima scoperta che fece luce su questo fenomeno fu fatta nel 1848 dall'allora sconosciuto scienziato francese Louis Pasteur. Mentre era ancora studente, si interessò alla chimica e alla cristallografia, lavorando sotto la guida del già citato Jean Baptiste Biot e dell'eminente chimico organico francese Jean Baptiste Dumas. Dopo essersi diplomato all'Ecole Normale Supérieure di Parigi, il giovane (aveva solo 26 anni) Pasteur lavorò come assistente di laboratorio per Antoine Balard. Balar era già un famoso chimico, divenuto famoso 22 anni prima per la scoperta di un nuovo elemento: il bromo. Diede al suo assistente un argomento sulla cristallografia, non aspettandosi che avrebbe portato a una scoperta eccezionale.
Durante lo studio, Pasteur preparò una soluzione del sale di sodio e ammonio dell'acido d'uva otticamente inattivo e, facendo evaporare lentamente l'acqua, ottenne bellissimi cristalli prismatici di questo sale. Questi cristalli, a differenza dei cristalli dell'acido dell'uva, si sono rivelati asimmetrici. Alcuni cristalli avevano una faccia caratteristica sulla destra, mentre altri ne avevano una sulla sinistra, e nella forma i due tipi di cristalli erano come un'immagine speculare l'uno dell'altro.
C'erano numeri uguali di entrambi i cristalli. Sapendo che in questi casi i cristalli di quarzo ruotano in direzioni diverse, Pasteur decise di verificare se questo fenomeno si sarebbe osservato anche sul sale da lui ottenuto. Armato di lente d'ingrandimento e pinzette, Pasteur separò attentamente i cristalli in due pile. Le loro soluzioni, come ci si aspetterebbe, avevano una rotazione ottica opposta e la miscela di soluzioni era otticamente inattiva (le polarizzazioni destra e sinistra erano reciprocamente compensate). Pasteur non si è fermato qui. Da ciascuna delle due soluzioni, utilizzando acido solforico forte, sostituì un acido organico più debole. Si potrebbe presumere che in entrambi i casi si otterrà l'acido originale dell'uva, che è otticamente inattivo. Tuttavia, si è scoperto che da una soluzione non si formava acido d'uva, ma il noto acido tartarico destrogiro, e da un'altra soluzione si otteneva anche acido tartarico, ma ruotando verso sinistra! Questi acidi sono chiamati D-vino (dal lat. più destro- a destra) e io- vino (dal lat. laevus- Sinistra). Successivamente, la direzione della rotazione ottica cominciò a essere indicata con i segni (+) e (–) e la configurazione assoluta della molecola nello spazio - con lettere R E S. Quindi, l'acido dell'uva inattivo si è rivelato essere una miscela di quantità uguali del noto acido tartarico "destro" e di quello "sinistro" precedentemente sconosciuto. Ecco perché una miscela uguale delle loro molecole in un cristallo o in soluzione non ha attività ottica. Per tale miscela si cominciò ad usare il nome “racemato”, dal lat. racemo- uva. Due antipodi, che mescolati in quantità uguali danno una miscela otticamente inattiva, sono chiamati enantiomeri (dal greco. έναντίος - opposto).
Rendendosi conto del significato del suo esperimento, Pasteur corse fuori dal laboratorio e, incontrando un assistente di laboratorio nell'aula di fisica, si precipitò da lui ed esclamò: "Ho appena fatto una grande scoperta!" A proposito, Pasteur fu molto fortunato con la sostanza: in seguito i chimici scoprirono solo pochi casi simili di cristallizzazione a una certa temperatura di una miscela di cristalli otticamente diversi, abbastanza grandi da poter essere separati sotto una lente d'ingrandimento con una pinzetta.
Pasteur scoprì altri due metodi per separare il racemo in due antipodi. Il metodo biochimico si basa sulla capacità selettiva di alcuni microrganismi di assimilare solo uno degli isomeri. Durante una visita in Germania, uno dei farmacisti gli regalò una vecchia bottiglia di acido d'uva in cui era cresciuta della muffa verde. Nel suo laboratorio, Pasteur scoprì che l'acido una volta inattivo divenne levogiro. Si è rivelata muffa verde Penicillum glaucum“mangia” solo l’isomero destro, lasciando invariato quello sinistro. Questa muffa ha lo stesso effetto sul racemato dell'acido mandelico, solo che in questo caso “mangia” l'isomero levogiro senza toccare l'isomero destrogiro.
Il terzo metodo per separare i racemati era puramente chimico. Per questo era necessario disporre di una sostanza otticamente attiva che, interagendo con una miscela racemica, si legasse in modo diverso a ciascuno degli enantiomeri. Di conseguenza, le due sostanze nella miscela non saranno antipodi (enantiomeri) e potranno essere separate come due sostanze diverse. Ciò può essere spiegato da un tale modello su un aereo. Prendiamo una miscela di due antipodi: I e R. Le loro proprietà chimiche sono le stesse. Aggiungiamo alla miscela un componente asimmetrico (chirale), ad esempio Z, che può reagire con qualsiasi sito di questi enantiomeri. Otteniamo due sostanze: РЗ e ZR (o ЖZ e RZ). Queste strutture non sono simmetriche allo specchio, quindi tali sostanze differiranno puramente fisicamente (punto di fusione, solubilità, ecc.) e potranno essere separate.
Pasteur fece molte altre scoperte, comprese le vaccinazioni contro l'antrace e la rabbia, e introdusse metodi asettici e antisettici.
La ricerca di Pasteur, che ha dimostrato la possibilità di "dividere" un composto otticamente inattivo in antipodi - enantiomeri, inizialmente suscitò sfiducia tra molti chimici, tuttavia, come il suo lavoro successivo, attirò la massima attenzione degli scienziati. Ben presto, il chimico francese Joseph Achille Le Bel, utilizzando il terzo metodo Pasteur, divise diversi alcoli in antipodi otticamente attivi. Il chimico tedesco Johann Wislicenus stabilì che esistono due acidi lattici: otticamente inattivo, che si forma nel latte acido (acido lattico di fermentazione), e destrogiro, che appare nel muscolo che lavora (acido lattico). C'erano sempre più esempi simili ed era necessaria una teoria per spiegare in che modo le molecole degli antipodi differiscono l'una dall'altra.
Teoria di Van non Hoff
Questa teoria fu creata dal giovane scienziato olandese Jacob Hendrik van't Hoff, che nel 1901 ricevette il primo premio Nobel per la chimica. Secondo la sua teoria, le molecole, come i cristalli, possono essere chirali: "destrimano" e "mancino", essendo l'immagine speculare l'una dell'altra. L'esempio più semplice sono le molecole che hanno un cosiddetto atomo di carbonio asimmetrico circondato da quattro gruppi diversi. Ciò può essere dimostrato con l'esempio del più semplice aminoacido alanina. Le due molecole mostrate non possono essere combinate nello spazio mediante alcuna rotazione (Fig. 6, in alto).
Molti scienziati erano diffidenti nei confronti della teoria di Van't Hoff. E il famoso chimico organico tedesco, eccezionale sperimentatore, professore all'Università di Lipsia, Adolf Kolbe, scoppiò con un articolo indecentemente duro in Giornale per la chimica pratica con il titolo malizioso “Zeiche der Zeit” (“Segni dei tempi”). Ha paragonato la teoria di Van't Hoff alla "feccia della mente umana", a "una cocotte vestita con abiti alla moda e che si copre il viso di bianco e rossetto per entrare in una società decente in cui non c'è posto per lei". Kolbe ha scritto che " a quanto pare un certo dottor Van't Hoff, che ricopre una cattedra presso la Scuola Veterinaria di Utrecht, non ama la ricerca chimica precisa. Trovava più piacevole sedersi sul Pegaso (probabilmente preso in prestito dalla scuola di veterinaria) e raccontare al mondo ciò che aveva visto dal Parnaso chimico... I veri ricercatori sono stupiti di come chimici quasi sconosciuti si impegnino a giudicare con tanta sicurezza il problema più alto della chimica - la questione della posizione spaziale degli atomi, che forse non sarà mai risolta... Questo approccio alle questioni scientifiche non è lontano dal credere nelle streghe e negli spiriti. E tali chimici dovrebbero essere esclusi dai ranghi dei veri scienziati e inclusi nel campo dei filosofi naturali, molto poco diversi dagli spiritualisti».
Nel corso del tempo, la teoria di van't Hoff ha ricevuto pieno riconoscimento. Ogni chimico sa che se una miscela contiene un numero uguale di molecole “levogire” e “levogire”, la sostanza nel suo insieme sarà otticamente inattiva. Sono queste sostanze che si ottengono nel pallone come risultato della sintesi chimica convenzionale. E solo negli organismi viventi, con la partecipazione di agenti asimmetrici, come gli enzimi, si formano composti asimmetrici. Pertanto, in natura, predominano gli amminoacidi e gli zuccheri di una sola configurazione e la formazione dei loro antipodi viene soppressa. In alcuni casi, è possibile distinguere diversi enantiomeri senza alcuna attrezzatura, quando interagiscono in modo diverso con i recettori asimmetrici del nostro corpo. Un esempio lampante è l'amminoacido leucina: il suo isomero destrogiro è dolce, mentre il suo isomero levogiro è amaro.
Naturalmente sorge subito la domanda su come siano comparsi sulla Terra i primi composti chimici otticamente attivi, ad esempio lo stesso acido tartarico destrogiro naturale, o su come siano comparsi microrganismi “asimmetrici” che si nutrono di uno solo degli enantiomeri. Infatti, in assenza dell'uomo, non c'era nessuno che effettuasse la sintesi diretta di sostanze otticamente attive, non c'era nessuno che separasse i cristalli in destra e sinistra! Tuttavia, tali domande si sono rivelate così complesse che non esiste ancora una risposta chiara. Gli scienziati concordano solo sul fatto che esistono agenti inorganici o fisici asimmetrici (catalizzatori asimmetrici, luce solare polarizzata, campo magnetico polarizzato) che potrebbero dare l'impulso iniziale alla sintesi asimmetrica delle sostanze organiche. Osserviamo un fenomeno simile nel caso dell'asimmetria “materia - antimateria”, poiché tutti i corpi cosmici sono costituiti solo da materia e la selezione è avvenuta nelle prime fasi della formazione dell'Universo.
Farmaci chirali
I chimici spesso trattano gli enantiomeri come un unico composto perché le loro proprietà chimiche sono identiche. Tuttavia, la loro attività biologica può essere completamente diversa. L'uomo è un essere chirale. E questo vale non solo per il suo aspetto. I farmaci “destrimani” e “mancini”, quando interagiscono con molecole chirali nel corpo, come gli enzimi, possono agire in modo diverso. Il farmaco “giusto” si adatta al suo recettore come la chiave di una serratura e innesca la reazione biochimica desiderata. L'azione dell'antipodo "sbagliato" può essere paragonata a un tentativo di stringere la mano sinistra del tuo ospite con la mano destra. La necessità di enantiomeri otticamente puri si spiega anche con il fatto che spesso solo uno di essi ha l'effetto terapeutico desiderato, mentre il secondo antipodo può nella migliore delle ipotesi essere inutile, e nella peggiore delle ipotesi causare effetti collaterali indesiderati o addirittura essere tossico. Ciò divenne evidente dopo la sensazionale tragica storia della talidomide, un farmaco che veniva prescritto alle donne incinte negli anni '60 come efficace sonnifero e sedativo. Tuttavia, nel tempo, i suoi effetti collaterali teratogeni (dal greco. τέρας - mostro) e molti bambini sono nati con deformità congenite. Solo alla fine degli anni '80 divenne chiaro che solo uno degli enantiomeri della talidomide, l'enantiomero destrogiro, era responsabile degli incidenti, e solo l'isomero levogiro è un potente tranquillante (Fig. 6, in basso). Sfortunatamente, questa differenza nell’azione delle forme farmaceutiche non era nota in precedenza, quindi la talidomide venduta era una miscela racemica di entrambi gli antipodi. Differiscono nella posizione relativa nello spazio di due frammenti della molecola.

Un altro esempio. La penicillamina, la cui struttura è stata disegnata sul cane e sul lupo sulla copertina di una rivista, è un derivato abbastanza semplice dell'amminoacido cisteina. Questa sostanza viene utilizzata per l'avvelenamento acuto e cronico con rame, mercurio, piombo e altri metalli pesanti, poiché ha la capacità di formare forti complessi con gli ioni di questi metalli; i complessi risultanti vengono rimossi dai reni. La penicillamina viene utilizzata anche per varie forme di artrite reumatoide e in numerosi altri casi. In questo caso viene utilizzata solo la forma “sinistra” del farmaco, poiché quella “destra” è tossica e può portare alla cecità.
Accade anche che ogni enantiomero abbia il suo effetto specifico. Sì, mancino S-tiroxina (il farmaco levotroide) è un ormone tiroideo naturale. Un destrogiro R-tiroxina (destroide) abbassa il colesterolo nel sangue. Alcuni produttori inventano nomi commerciali palindromici per questi casi, ad esempio darvon e novrad rispettivamente per un analgesico narcotico sintetico e un medicinale per la tosse.
Attualmente molti farmaci vengono prodotti sotto forma di composti otticamente puri. Si ottengono mediante tre metodi: separazione di miscele racemiche, modifica di composti naturali otticamente attivi e sintesi diretta. Quest'ultimo richiede anche fonti chirali, poiché qualsiasi altro metodo di sintesi tradizionale produce un racemo. Questo, tra l'altro, è uno dei motivi del costo molto elevato di alcuni farmaci, poiché la sintesi mirata di uno solo di essi è un compito difficile. Non sorprende quindi che dei tanti farmaci sintetici chirali prodotti in tutto il mondo, solo una piccola parte sia otticamente pura, il resto siano racemi.
Sulla chiralità delle molecole, vedi anche:
Capitolo L'origine della purezza chirale dal libro di Mikhail Nikitin
Corsi sull'argomento
“Chiralità, possibili meccanismi della sua comparsa. Il ruolo della chiralità nel processo di invecchiamento”
Eseguita:
studente del quarto anno
Facoltà di Bioingegneria
e bioinformatica
Università statale di Mosca dal nome M.V. Lomonosov
Gancharova Olga Sergeevna
I. Introduzione. Il concetto di chiralità. Chiralità in natura
La stragrande maggioranza delle molecole complesse contenenti più di tre atomi non hanno un piano o un centro di simmetria. Tali molecole sono disimmetriche e chirali. Il termine “chiralità” (dal greco antico kheir - mano, cfr. chirurgia, chiromanzia) indica la discrepanza tra una certa struttura e la sua immagine speculare. Le sostanze chirali possono apparire in due forme: destrimano e mancino. Queste due configurazioni non possono essere combinate tra loro mediante alcuna rotazione del sistema nel suo insieme nello spazio; si relazionano tra loro come la mano destra e la mano sinistra
Nel mondo delle molecole, la chiralità più comunemente incontrata è determinata dal cosiddetto atomo di carbonio asimmetrico (solitamente contrassegnato con un asterisco, vedi pag. 36). Nei composti organici saturi (alifatici), i quattro legami di valenza del carbonio si trovano ad angoli tetraedrici tra loro. Se due delle quattro valenze legano gli stessi gruppi, come, ad esempio, nella molecola CX2YZ, allora il piano CYZ è un piano di simmetria e non c'è chiralità. Un atomo di carbonio è asimmetrico se tutti e quattro i gruppi a cui è legato sono diversi: C*XYZV. Una tale molecola non ha un piano pi greco o un centro di simmetria. Pertanto, la chiralità è caratteristica di 19 amminoacidi canonici (tutti tranne la glicina H3N+ CH2C00-). Nella fig. La Figura 2.11 mostra le configurazioni destra (D) e sinistra (L) dell'alanina (antipodi specchio o enantiomeri).
Nella sintesi chimica, dalle molecole iniziali simmetriche, la sostanza si ottiene sempre sotto forma di miscela racemica contenente il 50% ciascuno degli antipodi destro e sinistro. Ciò deriva dalla seconda legge della termodinamica: il racemo corrisponde alla massima entropia.
Una proprietà sorprendente della natura vivente è la fissazione negli organismi di tutte le molecole biologiche più importanti, a cominciare dagli amminoacidi, in una configurazione specifica. I residui di amminoacidi nelle proteine sono sempre “levogiri”, forme L (Fig. 2.11).
Le forme destrimano e mancino reagiscono allo stesso modo con le molecole simmetriche. Differiscono nella loro interazione con la luce polarizzata. Le sostanze chirali, a differenza delle loro miscele racemiche, ruotano il piano di polarizzazione della luce in direzioni diverse e assorbono la luce polarizzata circolarmente in modo diverso a destra e a sinistra (vedi Capitolo 6). Gli amminoacidi L biologici sono così chiamati non perché ruotano il piano di polarizzazione della luce a sinistra e gli amminoacidi D a destra. Tra gli L-aminoacidi ci sono sia quelli mancini che quelli destrimani. Il punto di partenza per la serie L dei composti organici è la gliceraldeide levogira OCH-C*H(OH) - CH20H. In linea di principio tutti i composti L possono essere preparati da esso sostituendo i corrispondenti atomi e gruppi attaccati a C* senza modificare la configurazione complessiva della molecola.
La chiralità è caratteristica delle proteine, dei carboidrati, degli acidi nucleici e di numerosi composti a basso peso molecolare nella cellula. I carboidrati nel DNA e nell'RNA appaiono sempre nella forma D. Le basi azotate hanno una struttura piatta e, quindi, mancano di chiralità. Nei processi metabolici che avvengono senza racemizzazione, cioè senza trasformazioni degli antipodi specchio l'uno nell'altro, la cellula assimila solo quelli che corrispondono alla struttura delle sue molecole biologiche. Il corpo assorbe gli aminoacidi L ma non quelli D. Giunto nell’“antimondo”, in cui piante e animali contengono molecole con configurazioni opposte, l’organismo terrestre morirebbe di fame. Per un organismo, gli antipodi D e L sono diversi. Sono note sostanze che sono velenose in una forma e innocue in una forma speculare; L'acido L-aspartico è insapore, il suo opposto è dolce. Pasteur stabilì anche che alcuni batteri si nutrono prevalentemente di un antipodo di una determinata sostanza.
L'isolamento di antipodi puri in vitro da miscele racemiche (sintesi asimmetrica) viene effettuato utilizzando sostanze chirali di origine biologica (solitamente alcaloidi). Agendo sulla miscela racemica (D, L) con il composto L', otteniamo (D, L) + L' = DL' + LL' I composti DL" e LL' non sono più agli antipodi speculari (sarebbero DL" e LD"). Pertanto, le proprietà fisico-chimiche di DL' e LL' sono diverse e questi composti possono essere separati, ad esempio, mediante cristallizzazione.
Per separare gli antipodi è necessaria l'influenza asimmetrica di una sostanza o di un essere che conosca la differenza tra destra e sinistra. Gli antipodi a specchio furono scoperti da Pasteur nel 1848. Studiò l'acido tartarico e scoprì che ha forme cristalline destrorse e sinistrorse. Selezionandoli, Pasteur ottenne gli antipodi puri dell'acido tartarico. Ha interpretato il ruolo di un fattore asimmetrico: la persona stessa è "chirale" e conosce la differenza tra destra e sinistra. La chiralità esiste nella natura vivente sia a livello molecolare che a livelli di organizzazione più elevati. In definitiva è determinato dalla regolazione “chirale” dei processi enzimatici. Nella fig. La Figura 2.12 mostra due forme del guscio del rizoma Neogloboquadrina packyderma. I gusci ruotati in senso orario si formano a temperature inferiori a 7°C, mentre i gusci ruotati in senso antiorario si formano a temperature più elevate.
In natura la chiralità può essere molecolare o cristallina. Nel primo caso, viene conservato - quando una sostanza si scioglie o si dissolve (ad esempio lo zucchero), nel secondo - è caratteristico solo dello stato cristallino. Il quarzo è costituito da molecole simmetriche di SiO2, ma cristallizza in forme levogire o levogire, che hanno attività ottica opposta. Quando il quarzo si scioglie, l'attività ottica scompare. In ogni deposito, il numero di cristalli destri e sinistri è in media lo stesso. Di conseguenza, è possibile isolare l'antipodo puro mediante cristallizzazione inserendo un seme non racemico destrorso o sinistrorso nella miscela racemica.
Quindi, nella natura vivente, c'è fissazione nelle strutture biologiche di qualsiasi forma di sostanza chirale (ad esempio, nel DNA e nell'RNA c'è sempre la forma D dei carboidrati). Dal punto di vista della biofisica, ciò si spiega con la fissazione dell'informazione, ovvero l'antipodo scelto equivale all'informazione di 1 bit.
La chiralità è la capacità di un oggetto di esistere in due forme speculari simmetriche, ad esempio, come il palmo sinistro e quello destro. La ricerca scientifica dimostra che in qualche modo la divisione tra “sinistra” e “destra” è un prerequisito per l’esistenza della vita! Dopotutto, la chiralità è inerente non solo agli oggetti materiali, ma anche alle molecole. Questo fenomeno fu scoperto a metà del XIX secolo da Louis Pasteur, che studiò l'asimmetria chimica del citoplasma delle cellule viventi.
Come è noto, le molecole organiche contengono un gran numero di atomi diversi e hanno una struttura spaziale. A volte gli stessi atomi possono essere disposti in modi diversi nel corpo di una molecola. Questo è chiamato isomeria. E le forme speculari di isomeri, identiche, ma apparentemente distorte in direzioni diverse, sono chiamate enantiomeri. Le proprietà della sostanza dipendono completamente dalla direzione in cui ruota la molecola; reagiscono diversamente e interagiscono con altre sostanze, soprattutto quelle biologiche, e come farmaci hanno effetti diversi.
Ad esempio, gli enantiomeri ruotano il piano di polarizzazione della luce in diverse direzioni mentre passa attraverso una soluzione. A proposito, secondo la direzione di rotazione del piano di polarizzazione, sono divisi in forme L (o forme S, rotazione sinistrorsa) e forme D (o forme R, rotazione destrorsa). Altri esempi di fenomeni in cui il fenomeno della chiralità si manifesta direttamente sono la cromatografia e l'elettroforesi. La chiralità gioca un ruolo ancora maggiore nella vita e nello sviluppo degli organismi viventi, nella formazione della simmetria dei loro corpi, nei processi di divisione cellulare e nello sviluppo dell'embrione. Pertanto, le foglie dei fagioli L sono superiori alle foglie D nell'intensità della fotosintesi e della respirazione, nonché nel contenuto di pigmenti (clorofille aeb, luteina, violoxantina e carotene) e hanno anche una maggiore siccità e resistenza al calore. I microrganismi formano colonie solo con una certa struttura a spirale (L o D). Anche la stragrande maggioranza dei gusci di molluschi sono ruotati verso sinistra (L).
Tutti i sistemi non viventi hanno una simmetria ordinaria, mentre i sistemi viventi hanno una simmetria speculare. Tutti i composti organici sono in grado di formare enantiomeri, ma solo uno di questi enantiomeri ("sinistra" o "destra") è in grado di sostenere la vita. Pertanto, tutti i recettori, gli enzimi, gli ormoni, gli anticorpi e gli altri elementi del corpo sono presenti negli organismi solo in una delle loro forme speculari. Pertanto, tutti gli zuccheri (carboidrati), i nucleotidi, il DNA e l'RNA hanno una configurazione D e tutte le molecole di enzimi, amminoacidi e proteine hanno una configurazione L.
Senza esagerare, i biologi affermano che la chiralità è una proprietà necessaria della materia che le dà la vita. Ma l'esistenza di tutte le sostanze biologiche in natura solo in una delle sue forme chirali pone fine alla Teoria dell'Evoluzione. Dopotutto, la probabilità che si formi anche una proteina relativamente piccola da 100 amminoacidi della sola configurazione L è “due alla potenza di un centesimo” o “dieci alla potenza di meno trenta”! Allo stesso tempo, l'origine della chiralità rimane un mistero completo e la scienza non ha risposta alla domanda sul perché in natura siano rimasti solo gli isomeri L o D e i loro enantiomeri siano completamente scomparsi.
La chiralità è fondamentale nella scoperta di farmaci. Se sintetizzi qualsiasi sostanza organica complessa in condizioni di laboratorio, ottieni il cosiddetto miscela racemica, che conterrà gli isomeri L e D in quantità uguali. Poiché le loro proprietà biochimiche sono diverse, i farmacisti sono costretti a separare gli enantiomeri gli uni dagli altri. Pertanto, solo la forma S dell'ibuprofene ha un effetto antinfiammatorio, la sua forma R è inattiva. Un altro esempio: solo la L-tiroxina è un ormone tiroideo umano e la sua forma D è una sostanza tossica pericolosa.
Studi recenti sulle cellule tumorali hanno dimostrato che hanno un contenuto maggiore dell'enzima isomerasi (AMACR), che è responsabile dell'inversione chirale - la trasformazione degli enantiomeri “morti” in enantiomeri “vivi”. Pertanto, i biologi affermano che una delle cause del cancro è il consumo di enantiomeri errati: zuccheri, grassi e additivi aromatizzanti sintetizzati artificialmente, che sono essenzialmente miscele racemiche. Altro esempio: solo il senso di rotazione distingue la D-nicotina, creata artificialmente in laboratorio, dalla nota L-nicotina, che fa parte di qualsiasi tabacco, ma se il primo composto è neutro per il corpo umano, allora i fumatori lo sono con fiducia in prima linea nel cancro ai polmoni.
 È interessante notare che il fenomeno della chiralità si riflette negli antichi insegnamenti sul corpo umano. Pertanto, il sistema yoga indica l'esistenza di tre canali nel corpo umano: sinistro, destro e centrale. L'energia si muove lungo il canale sinistro, ruotando in senso antiorario, e attraverso il canale destro, in senso orario. Gli Dei Guardiani dei canali - Shiva e Brahma - hanno come attributi le svastiche, che mostrano la direzione di rotazione. Il sistema di nutrizione separata prevede il consumo di proteine (cioè sostanze con configurazione L) per pulire il canale sinistro e il consumo di carboidrati e grassi (sostanze con configurazione D) per pulire il canale destro. Molta attenzione viene prestata anche alla corretta direzione di rotazione dei chakra, che costituisce la base per la salute e la longevità.
È interessante notare che il fenomeno della chiralità si riflette negli antichi insegnamenti sul corpo umano. Pertanto, il sistema yoga indica l'esistenza di tre canali nel corpo umano: sinistro, destro e centrale. L'energia si muove lungo il canale sinistro, ruotando in senso antiorario, e attraverso il canale destro, in senso orario. Gli Dei Guardiani dei canali - Shiva e Brahma - hanno come attributi le svastiche, che mostrano la direzione di rotazione. Il sistema di nutrizione separata prevede il consumo di proteine (cioè sostanze con configurazione L) per pulire il canale sinistro e il consumo di carboidrati e grassi (sostanze con configurazione D) per pulire il canale destro. Molta attenzione viene prestata anche alla corretta direzione di rotazione dei chakra, che costituisce la base per la salute e la longevità.
Insieme agli isomeri strutturali, nella serie degli alcani ci sono isomeri spaziali. Ciò può essere illustrato utilizzando il 3-metilesano come esempio.
L'atomo di carbonio, designato C*, è collegato a quattro diversi gruppi. In questo idrocarburo, con lo stesso ordine di legame degli atomi, i gruppi alchilici possono essere posizionati diversamente nello spazio attorno all'atomo di carbonio C*. Esistono diversi modi per rappresentare gli isomeri spaziali su un piano (Fig. 6.1, 6.2).
Riso. 6.1. Immagine tridimensionale tramite “cunei”
Riso. 6.2. Formule di proiezione di Fisher
Nella Figura 6.2, l'atomo di carbonio C* è al centro, la linea orizzontale indica il legame tra il carbonio C* e i gruppi che sporgono davanti al piano dell'immagine e la linea verticale tra l'atomo C* e i gruppi situati dietro il piano dell'immagine. Le proiezioni Fischer possono essere ruotate solo nel piano del disegno e solo di 180°, ma non di 90° o 270°. Queste formule rappresentano due composti diversi. Differiscono l'uno dall'altro allo stesso modo di un oggetto e della sua immagine speculare, o di una mano sinistra e di una mano destra. La mano sinistra e quella destra sono due oggetti molto simili tra loro, ma è impossibile combinarli (non mettere il guanto sinistro sulla mano destra), il che significa che sono due oggetti diversi.
Due composti: un oggetto e la sua immagine speculare (I e II), incompatibili tra loro, sono chiamati enantiomeri (dal greco “enantio” - opposto).
La proprietà di un composto di esistere sotto forma di enantiomeri è chiamata chiralità (dal greco “chiros” - mano), e il composto stesso è chiamato chirale.
La molecola del 3-metilesano non ha un piano di simmetria e quindi può esistere sotto forma di enantiomeri (vedi Fig. 6.1).
Una molecola ha chiralità se non ha un piano di simmetria. Esistono numerosi elementi strutturali che possono rendere una molecola non identica alla sua immagine speculare. Il più importante di questi è l’atomo di carbonio chirale.
Un atomo chirale o centro chirale è un atomo di carbonio legato a quattro gruppi diversi ed è designato C*.
Una molecola in cui sono presenti due o più gruppi identici nell'atomo di carbonio ha un piano di simmetria e, quindi, non ha chiralità, poiché la molecola e la sua immagine speculare sono identiche. Tali molecole sono chiamate achirale .
Ad esempio, l'isopentano non può esistere come enantiomero e non ha chiralità.
Gli enantiomeri presentano le stesse proprietà fisiche, tranne una. Ad esempio, la molecola del 2-bromobutano esiste come due enantiomeri. Hanno gli stessi punti di ebollizione, punti di fusione, densità, solubilità e indici di rifrazione. Un enantiomero può essere distinto da un altro dal segno di rotazione della luce polarizzata nel piano. Gli enantiomeri ruotano il piano della luce polarizzata dello stesso angolo, ma in direzioni diverse: uno - in senso orario, l'altro - dello stesso angolo, ma in senso antiorario.
Gli enantiomeri hanno le stesse proprietà chimiche e la velocità della loro interazione con i reagenti che non hanno chiralità è la stessa. Nel caso di una reazione con un reagente otticamente attivo, le velocità di reazione degli enantiomeri sono diverse. A volte differiscono così tanto che la reazione di un dato reagente con uno degli enantiomeri non avviene affatto.
Vengono chiamate molecole che hanno almeno un atomo di carbonio attaccato a quattro diversi sostituenti asimmetrico O chirale. In altre parole, si tratta di molecole che non hanno né un centro né un piano di simmetria.
Chiralità(Greco antico χειρ - mano) - la proprietà di una molecola di non combinarsi nello spazio con la sua immagine speculare. Il termine si basa sull'antico nome greco dell'oggetto chirale più riconoscibile, la mano. Pertanto, le mani sinistra e destra sono immagini speculari, ma non possono essere combinate tra loro nello spazio.
Ora dobbiamo familiarizzare con il concetto di luce polarizzata, poiché questo fenomeno viene utilizzato per studiare e descrivere le molecole chirali. La luce diventa polarizzata in modo piano a causa della luce ordinaria che passa attraverso un polarizzatore.
Se la luce polarizzata nel piano viene fatta passare attraverso una soluzione di una sostanza chirale, il piano in cui si verificano le vibrazioni inizia a ruotare. Vengono chiamate le sostanze che causano tale rotazione otticamente attivo. L'angolo di rotazione viene misurato con uno strumento chiamato polarimetro (o analizzatore).
La capacità di una sostanza di ruotare il piano di polarizzazione della luce è caratterizzata da una rotazione specifica. Rotazione specificaè definito come l'angolo di rotazione del piano di polarizzazione di una soluzione contenente 1 ml di 1 g di sostanza otticamente attiva con una lunghezza del tubo di 0,1 m. L'angolo di rotazione osservato dipende dalla lunghezza del tubo (maggiore è la lunghezza , maggiore è la rotazione) e sulla concentrazione (normalmente minore è la concentrazione, minore è la rotazione).
Se il piano di polarizzazione ruota a destra (in senso orario) dell'osservatore, il collegamento si dice destrogiro, e la rotazione specifica si scrive con il segno (+). Quando si ruota verso sinistra (in senso antiorario), l'articolazione è detta levogira e la rotazione specifica si scrive con un segno (-).
Vediamo come l'attività ottica è correlata alla struttura molecolare di una sostanza. Di seguito è riportata una rappresentazione spaziale di una molecola chirale e della sua immagine speculare:

Isomeri ottici (enantiomeri)
A prima vista potrebbe sembrare che si tratti della stessa molecola, rappresentata in modo diverso. Tuttavia, se raccogli modelli di entrambe le forme e provi a combinarli in modo che tutti gli atomi coincidano tra loro, vedrai rapidamente che ciò è impossibile, ad es. risulta che la molecola è incompatibile con la sua immagine speculare.
Pertanto, due molecole chirali correlate tra loro come un oggetto e la sua immagine speculare non sono identiche. Queste molecole (sostanze) sono chiamate isomeri enantiomeri O isomeri ottici. La maggior parte delle proprietà chimiche e fisiche della coppia di enantiomeri sono identiche. Ciò si riferisce ai punti di ebollizione e fusione, densità, tensione superficiale, solubilità, stabilità e reattività con la maggior parte dei reagenti.
Gli enantiomeri, tuttavia, differiscono tra loro sotto due aspetti.
1) Agiscono diversamente sulla luce polarizzata piana. Un enantiomero ruota di una certa quantità il piano di polarizzazione della luce in una direzione. L'altro enantiomero ruoterà il piano di polarizzazione esattamente della stessa quantità, ma nella direzione opposta.

2) Gli enantiomeri reagiscono diversamente con altre molecole chirali, in particolare con sostanze di origine naturale formate in oggetti biologici. Ad esempio, se uno degli enantiomeri è tossico, l’altro potrebbe non avere questa proprietà. Se uno degli enantiomeri è una vitamina, il secondo non ha tali proprietà. Queste differenze nelle proprietà biochimiche degli enantiomeri sono dovute al fatto che i processi biochimici in un organismo vivente sono catalizzati da enzimi. Gli enzimi sono composti chirali di natura proteica. Affinché un composto sia biologicamente attivo, la sua geometria deve corrispondere alla struttura di una determinata regione dell'enzima.
Quindi, riassumiamo:
Le molecole che non hanno elementi di simmetria sono chiamate chirali. Queste molecole hanno una proprietà insolita: la capacità di ruotare il piano di polarizzazione della luce polarizzata sul piano.
Gli isomeri le cui molecole sono chirali e sono immagini speculari l'una dell'altra sono chiamati enantiomeri.
Gli enantiomeri hanno proprietà fisiche e chimiche identiche e differiscono solo nella direzione di rotazione del piano di polarizzazione della luce e nella natura della loro interazione con altre sostanze chirali, come gli enzimi.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0