Zostały one ułożone zgodnie z obecnością podobnych właściwości w kolejności wzrastającej masy atomowej.
W przeciwieństwie do prac swoich poprzedników, Mendelejew wychodził z założenia o istnieniu pierwiastków nieodkrytych jeszcze na podstawie okresowych zmian fizycznych i fizycznych. właściwości chemiczne znane elementy. Zostawili puste komórki w tabeli dla pierwiastków jeszcze nieodkrytych i przewidzieli ich właściwości. Aby nadać przewidywanym elementom „tymczasowe” nazwy, Mendelejew użył przedrostków „eka”, „dvi” i „trzy” (od sanskryckich słów „jeden”, „dwa” i „trzy”), w zależności od tego, ile pozycji w dół od już odkryty pierwiastek o podobnych właściwościach był przewidywanym pierwiastkiem. Tak więc german przed jego odkryciem w 1886 roku nazywano „ekasilikonem”, a ren odkryty w 1926 roku nazywano „dwimarganem”.
Już w pierwszej wersji układu okresowego, opublikowanej przez D. I. Mendelejewa w 1869 r., uwzględniono więcej pierwiastków niż odkryto w tym czasie. Pozostawiono w nim cztery wolne komórki dla jeszcze nieznanych pierwiastków i wskazano ich masy atomowe (w „udziałach” zbliżonych wartością do masy atomu wodoru).
Rozwijając idee okresowości w latach 1869-1871, D. I. Mendelejew wprowadził pojęcie miejsca pierwiastka w układzie okresowym jako zbiór jego właściwości w porównaniu z właściwościami innych pierwiastków. Aby przewidzieć właściwości prostych substancji i związków, wyszedł z tego, że właściwości każdego pierwiastka są pośrednie między odpowiednimi właściwościami dwóch sąsiednich pierwiastków w grupie układ okresowy pierwiastków, dwa sąsiadujące elementy w okresie i elementy wzdłuż przekątnej - tak zwana „reguła gwiazdy”. Na tej podstawie, w szczególności na podstawie wyników badania sekwencji zmian tlenków szkłotwórczych, skorygowałem wartości mas atomowych 9 pierwiastków. W 1870 roku przewidział istnienie, obliczył masy atomowe i opisał właściwości trzech jeszcze nie odkrytych w tym czasie pierwiastków - "ekaaluminum", "ecabor" i "ecasilicon". Następnie przewidział istnienie jeszcze ośmiu pierwiastków, w tym „ditellurium” – polon, „ekaioda” – astat, „ekamargan” – technet, „ekacezja” – frans.
Wezwano przepowiednie Mendelejewa świat nauki sceptycyzm i ostra krytyka. Tak więc niemiecki fizykochemik Wilhelm Ostwald, przyszły noblista, przekonywał, że odkryto nie prawo, ale zasadę klasyfikowania „czegoś nieokreślonego”. Robert Bunsen, odkrywca rubidu i cezu, napisał, że Mendelejew zachwyca chemików” w naciągany świat czystych abstrakcji”, a Hermann Kolbe w 1870 roku nazwał dzieło Mendelejewa spekulacyjnym. Słuszność Mendelejewa została przekonująco udowodniona, gdy odkryto przewidywane przez niego pierwiastki: gal (Paul Lecoq de Boisbaudran, 1875), skand (Lars Nilsson, 1879) i german (Clemens Winkler, 1886) – odpowiednio ekaglin, ecabor i ekasilicon.
Myślę, że nie ma potrzeby podkreślać wielkiej wagi potwierdzenia teoretycznych wniosków pana MendelejewaNajlżejszemu z gazów grupy zerowej, pierwszemu w układzie okresowym, przypisano teoretyczną masę atomową między 5,3·10-11 a 9,6·10-7 . Cząsteczkom tego gazu, który nazwał newtonem, Mendelejew przypisywał prędkość kinetyczną rzędu 2,5 10 6 m/s. Prawie nieważkie, cząstki obu tych gazów, zdaniem Mendelejewa, powinny z łatwością przejść przez grubość materii, praktycznie bez wnikania w reakcje chemiczne. Wysoka mobilność i bardzo niska masa atomowa gazów transwodorowych prowadziłaby do tego, że mogłyby one być bardzo rozrzedzone, zachowując jednocześnie gęsty wygląd.
Później Mendelejew opublikował teoretyczny rozwój eteru. Książka zatytułowana „Chemiczna koncepcja eteru” ukazała się w 1904 roku i ponownie zawierała wzmiankę o dwóch hipotetycznych gazach obojętnych lżejszych od wodoru, koronie i newtonie. Pod „gazem eterycznym” Mendelejew rozumiał atmosferę międzygwiazdową, składającą się z dwóch gazów transwodorowych z domieszkami innych pierwiastków i powstałych w wyniku procesów wewnętrznych zachodzących na gwiazdach.
W przeciwieństwie do prac swoich poprzedników, Mendelejew wychodził z założenia o istnieniu jeszcze nieodkrytych pierwiastków na podstawie okresowych zmian właściwości fizykochemicznych znanych pierwiastków. Zostawili puste komórki w tabeli dla pierwiastków jeszcze nieodkrytych i przewidzieli ich właściwości. Aby nadać przewidywanym elementom „tymczasowe” nazwy, Mendelejew użył przedrostków „eka”, „dvi” i „trzy” (od sanskryckich słów „jeden”, „dwa” i „trzy”), w zależności od tego, ile pozycji w dół od już odkryty pierwiastek o podobnych właściwościach był przewidywanym pierwiastkiem. Tak więc german przed jego odkryciem w 1886 roku nazywano „ekasilikonem”, a ren odkryty w 1926 roku nazywano „dwimarganem”.
Wstępne przepowiednie (1869-1870)
Już w pierwszej wersji układu okresowego, opublikowanej przez D. I. Mendelejewa w 1869 r., uwzględniono więcej pierwiastków niż odkryto w tym czasie. Pozostawiono w nim cztery wolne komórki dla jeszcze nieznanych pierwiastków i wskazano ich masy atomowe (w „udziałach” zbliżonych wartością do masy atomu wodoru).
Rozwijając idee okresowości w latach 1869-1871, D. I. Mendelejew wprowadził pojęcie miejsca pierwiastka w układzie okresowym jako zbiór jego właściwości w porównaniu z właściwościami innych pierwiastków. Aby przewidzieć właściwości prostych substancji i związków, wyszedł z tego, że właściwości każdego pierwiastka są pośrednie między odpowiednimi właściwościami dwóch sąsiednich pierwiastków w grupie układu okresowego, dwóch sąsiednich pierwiastków w okresie i pierwiastków wzdłuż przekątna - tak zwana „zasada gwiazdy”. Na tej podstawie, w szczególności na podstawie wyników badania sekwencji zmian tlenków szkłotwórczych, skorygowałem wartości mas atomowych 9 pierwiastków. W 1870 roku przewidział istnienie, obliczył masy atomowe i opisał właściwości trzech jeszcze nie odkrytych w tym czasie pierwiastków - "ekaaluminum", "ecabor" i "ecasilicon". Następnie przewidział istnienie jeszcze ośmiu pierwiastków, w tym „ditellurium” – polon, „ekaioda” – astat, „ekamargan” – technet, „ekacezja” – frans.
Prognozy Mendelejewa wywołały sceptycyzm i ostrą krytykę w świecie naukowym. Tak więc niemiecki fizykochemik Wilhelm Ostwald, przyszły noblista, przekonywał, że odkryto nie prawo, ale zasadę klasyfikowania „czegoś nieokreślonego”. Robert Bunsen, odkrywca rubidu i cezu, napisał, że Mendelejew zachwyca chemików” w naciągany świat czystych abstrakcji”, a Hermann Kolbe w 1870 roku nazwał dzieło Mendelejewa spekulacyjnym. Słuszność Mendelejewa została przekonująco udowodniona, gdy odkryto przewidywane przez niego pierwiastki: gal (Paul Lecoq de Boisbaudran, 1875), skand (Lars Nilsson, 1879) i german (Clemens Winkler, 1886) – odpowiednio ekaglin, ecabor i ekasilicon.
Triumf prawa okresowego
Cięższy z dwóch hipotetycznych pierwiastków transwodorowych Mendelejew utożsamił się z koronem, nazwanym tak od związku z niewyjaśnioną linią widmową korony słonecznej. Niewłaściwa kalibracja instrumentu dała długość fali 531,68 nm, którą później skorygowano do 530,3 nm. Ta długość fali została skorelowana przez Grotriana i Edlena w 1939 r. z linią żelaza.
Najlżejszemu z gazów grupy zerowej, pierwszemu w układzie okresowym, przypisano teoretyczną masę atomową między 5,3·10-11 a 9,6·10-7 . Cząsteczkom tego gazu, który nazwał newtonem, Mendelejew przypisywał prędkość kinetyczną rzędu 2,5 10 6 m/s. Według Mendelejewa cząstki obu tych gazów, prawie nieważkie, powinny z łatwością przejść przez grubość materii, praktycznie bez wchodzenia w reakcje chemiczne. Wysoka mobilność i bardzo niska masa atomowa gazów transwodorowych prowadziłaby do tego, że mogłyby one być bardzo rozrzedzone, zachowując jednocześnie gęsty wygląd.
Później Mendelejew opublikował teoretyczny rozwój eteru. Książka zatytułowana „Chemiczna koncepcja eteru” ukazała się w 1904 roku i ponownie zawierała wzmiankę o dwóch hipotetycznych gazach obojętnych lżejszych od wodoru, koronie i newtonie. Pod „gazem eterycznym” Mendelejew rozumiał atmosferę międzygwiazdową, składającą się z dwóch gazów transwodorowych z domieszkami innych pierwiastków i powstałych w wyniku procesów wewnętrznych zachodzących na gwiazdach.
Uwagi
- Kaji, Masanori (2002). „Koncepcja D.I. Mendelejewa dotycząca pierwiastków chemicznych i Zasady chemii(PDF) . Biuletyn Historii Chemii. 27 (1): 4-16. Sprawdzono 14.02.2011.
Plan:
- Wstęp
- 1 przedrostki
- 2
Wstępne przepowiednie, 1870
- 2.1 Ekabor i skand
- 2.2 Ekaglin i gal
- 2.3 Ekamargan i technet
- 2.4 Exasilicon i german
- 3 1871 przepowiednie
- 4 Późniejsze przewidywania Uwagi
- 6 Dodatkowe lektury
Wstęp
W 1869 r. Dmitrij Iwanowicz Mendelejew opublikował Układ okresowy pierwiastków, w którym pierwiastki chemiczne zostały ułożone zgodnie z obecnością podobnych właściwości, w kolejności rosnącej masy atomowej. W tym samym czasie Mendelejew pozostawił w tabeli puste komórki dla pierwiastków jeszcze nieodkrytych i przewidział ich właściwości.
1. Załączniki
Aby nadać przewidywanym elementom nazwy „tymczasowe”, Mendelejew użył przedrostków „eka”, „dvi” i „trzy”, w zależności od tego, o ile pozycji w dół od już odkrytego elementu o podobnych właściwościach był przewidywany element. Tak więc german przed jego odkryciem w 1886 roku nazywano „ekasilikonem”, a ren odkryty w 1926 roku nazywano „dwimarganem”.
Przedrostki oznaczające nieodkryte elementy Mendelejew utworzył z sanskryckich słów „jeden”, „dwa” i „trzy”. Istnieje opinia, że na wybór słów sanskryckich przez Mendelejewa wpłynęło podobieństwo systemu okresowego i sanskryckiej abugidy, która jest zwykle zapisywana w formie tabeli.
Obecnie przedrostek „eka” (rzadziej „dwi”) jest używany do opisu transuran lub jeszcze nieodkrytych pierwiastków: ekaslead (ununquadium), ekaradon (ununoctium), ekaactinium lub dvilantan (untriennium). Oficjalną praktyką IUPAC jest nadawanie nieodkrytym lub nowo odkrytym elementom tymczasowej systematycznej nazwy w oparciu o ich numer ładunku, a nie ich pozycję w układzie okresowym.
2. Wstępne przepowiednie, 1870
Cztery lżejsze od pierwiastków ziem rzadkich - ekabor ( Eb), ekaglin ( Ea), ekamargan ( Em) i ekasilikon ( Es) - dość dobrze pokrywały się właściwościami z pierwiastkami odkrytymi później: odpowiednio skandem, galem, technetem i germanem.
W pierwotnej wersji układu okresowego pierwiastki ziem rzadkich były ułożone inaczej niż obecnie, co wyjaśnia, dlaczego przewidywania Mendelejewa dotyczące cięższych pierwiastków nie sprawdziły się tak dokładnie, jak dla lekkich i dlaczego przewidywania te nie są tak powszechnie znane.
2.1. Ekabor i skand
Tlenek skandu został wyizolowany pod koniec 1879 roku przez szwedzkiego chemika Larsa Frederika Nilsona. Później Per Theodor Cleve udowodnił zbieżność właściwości przewidywanego ekobora i nowo odkrytego skandu i poinformował o tym Mendelejewa. Mendelejew przewidział masę atomową ekabora 44, a masa atomowa skandu 44,955910.
2.2. Ekaglin i gal
W 1871 Mendelejew przewidział istnienie jeszcze nieodkrytego pierwiastka, który nazwał ekaglinem. Poniższa tabela porównuje właściwości przewidywane przez Mendelejewa z rzeczywistymi właściwościami galu, odkrytego w 1875 roku.
2.3. Ekamargan i technet
Technet został wyizolowany przez Carlo Perriera i Emilio Gino Segre w 1937 roku, po śmierci Mendelejewa, z próbek molibdenu bombardowanych jądrami deuteru w cyklotronie przez Ernesta Lawrence'a. Mendelejew przewidział masę atomową około 100 dla ekamarganu, a 98 Tc jest najbardziej stabilnym izotopem technetu.
2.4. Exasilicon i german
German został po raz pierwszy wyizolowany w 1886 roku. Jego odkrycie okazało się najlepszym potwierdzeniem ówczesnej teorii Mendelejewa, ponieważ german w swoich właściwościach różni się znacznie bardziej od sąsiednich pierwiastków niż dwa wcześniej przewidywane pierwiastki.
3. Prognozy z 1871 r.
W 1871 Mendelejew przewidział istnienie pierwiastka znajdującego się między torem a uranem. Trzydzieści lat później, w 1900 roku, William Crookes wyizolował protaktyn jako nieznane zanieczyszczenie radioaktywne w próbce uranu. Różne izotopy protaktynu zostały następnie wyizolowane w Niemczech w latach 1913 i 1918, ale współczesna nazwa element otrzymany dopiero w 1948 roku.
Wersja układu okresowego z 1869 r. przewidywała istnienie cięższego odpowiednika tytanu i cyrkonu, ale w 1871 r. Mendelejew umieścił na jego miejscu lantan. Odkrycie hafnu w 1923 roku potwierdziło początkowe przypuszczenia Mendelejewa.
4. Późniejsze przewidywania
W 1902 roku, po odkryciu helu i argonu, Mendelejew umieścił je w zerowej grupie stołu. Wątpiąc w słuszność teorii atomowej wyjaśniającej prawo stałości składu, nie mógł apriorycznie uważał wodór za najlżejszy z pierwiastków i wierzył, że hipotetyczny, jeszcze lżejszy członek chemicznie obojętnej grupy zerowej może pozostać niezauważony. Istnienie tego pierwiastka Mendelejew próbował wyjaśnić radioaktywność.
Mendelejew zidentyfikował cięższy z dwóch pierwiastków prehelowych z koronem, który został nazwany w związku z niewyjaśnioną linią widmową korony słonecznej. Niewłaściwa kalibracja instrumentu dała długość fali 531,68 nm, którą później skorygowano do 530,3 nm. Ta długość fali została skorelowana przez Grotriana i Edlena w 1939 r. z linią żelaza.
Najlżejszemu z gazów grupy zerowej, pierwszemu w układzie okresowym, przypisano teoretyczną masę atomową między 5,3·10-11 a 9,6·10-7 . Mendelejew przypisywał cząsteczkom tego gazu prędkość kinetyczną rzędu 2,5·106 m/s. Według Mendelejewa cząstki obu tych gazów, prawie nieważkie, powinny z łatwością przejść przez grubość materii, praktycznie bez wchodzenia w reakcje chemiczne. Wysoka mobilność i bardzo niska masa atomowa gazów transwodorowych prowadziłaby do tego, że mogłyby one być bardzo rozrzedzone, zachowując jednocześnie gęsty wygląd. Mendelejew był tak przekonany o istnieniu pierwiastków transwodorowych, że umieścił je w późniejszych wydaniach Układu Okresowego. [ źródło?]
Później Mendelejew opublikował opracowanie teoretyczne dotyczące eteru, które rozwiązało [ źródło?] wiele sprzeczności istniejącej wówczas fizyki. Książka zatytułowana Chemiczna koncepcja eteru ukazała się w 1904 roku i ponownie zawierała wzmiankę o dwóch gazach lżejszych od wodoru. Pod „gazem eterycznym” Mendelejew rozumiał atmosferę międzygwiazdową, składającą się z dwóch gazów transwodorowych z domieszkami innych pierwiastków i powstałych w wyniku procesów wewnętrznych zachodzących na gwiazdach.
Uwagi
- Kaji, Masanori (2002). Koncepcja pierwiastków chemicznych według „D.I. Mendelejewa” Zasady chemii- www.scs.uiuc.edu/~mainzv/HIST/awards/OPA Papers/2005-Kaji.pdf. Biuletyn Historii Chemii 27 (1): 4–16.
- Liczba masowa 98 różni się od masy atomowej tym, że uwzględnia nukleony w jądrze jednego izotopu i nie jest masą próbki średniej (zawierającej naturalny zestaw izotopów) względem 12 C. Masa atomowa izotop 98 Tc to 97,907214. Dla elementów, które są zbyt niestabilne, aby mogły być w skorupa Ziemska Od początku istnienia Ziemi masa atomowa najpowszechniejszego zestawu izotopów w przyrodzie została zastąpiona masą atomową najbardziej stabilnego izotopu. - chemlab.pc.maricopa.edu/OKRESOWY/Tc.html
- Emsley John Bloki konstrukcyjne natury - (twarda oprawa, wydanie pierwsze) - Oxford University Press, 2001. - P. 347. - ISBN 0198503407
- Mendelejew D. Podstawy chemii. - 7. edycja.
- Huśtawki, P. (lipiec 1943). Identyfikacja linii koronalnych „Edlén” z liniami zakazanymi Fe X, XI, XIII, XIV, XV; Ni XII, XIII, XV, XVI; Ca XII, XIII, XV; a X, XIV - adsabs.harvard.edu /cgi-bin/nph-bib_query?1943ApJ....98..116S". Czasopismo Astrofizyczne 98 (119): 116-124. DOI:10.1086/144550 - dx.doi.org/10.1086/144550. oraz - laserstars.org/spectra/Coronium.html
- Mendelejew D. Próba chemicznego zrozumienia eteru świata. - Petersburg, 1903.
Angielskie tłumaczenie:
Mendelejew D. Próba chemicznego poczęcia eteru / G. Kamensky (tłumacz). - Longmans, Green & Co., 1904.
Zobacz też
Bensaude-Vincent, Bernadette (1982). „L'ether, element chimique: un essai malheureux de Mendeleev en 1904”. Brytyjskie czasopismo historii nauki 15 : 183–188. DOI:10.1086/144550 - dx.doi.org/10.1086/144550.
6. Dodatkowe czytanie
- Scerri Eric Układ okresowy pierwiastków: jego historia i znaczenie. - Nowy Jork: Oxford University Press, 2007. - ISBN 0195305736
4.5 Odkrycie prawa okresowego przez DI Mendelejewa. Znaczenie ustawy okresowej dla chemii i nauk przyrodniczych.
Pierwsza wersja układu okresowego pierwiastków została opublikowana przez Dymitra Iwanowicza Mendelejewa w 1869 r. - na długo przed zbadaniem struktury atomu. W tym czasie Mendelejew wykładał chemię na Uniwersytecie w Petersburgu. Przygotowując się do wykładów, zbierając materiał do swojego podręcznika „Podstawy chemii”, D. I. Mendelejew zastanawiał się, jak usystematyzować materiał w taki sposób, aby informacja o właściwościach chemicznych pierwiastków nie wyglądała jak zbiór odmiennych faktów.
W tej pracy D. I. Mendelejew kierował się masy atomowe(masy atomowe) pierwiastków. Po Światowym Kongresie Chemików w 1860 roku, w którym uczestniczył również D. I. Mendelejew, problem prawidłowego wyznaczania mas atomowych był stale w centrum uwagi wielu czołowych chemików świata, w tym D. I. Mendelejewa.
Układając pierwiastki w porządku rosnącym według ich mas atomowych, D. I. Mendelejew odkrył podstawowe prawo natury, które jest obecnie znane jako Prawo Okresu:
Właściwości pierwiastków zmieniają się okresowo w zależności od ich masy atomowej.
Powyższe sformułowanie w niczym nie przeczy współczesnemu, w którym pojęcie „ciężaru atomowego” zastępuje się pojęciem „ładunku jądrowego”. Dziś wiemy, że masa atomowa jest skoncentrowana głównie w jądrze atomu. Jądro składa się z protonów i neutronów. Wraz ze wzrostem liczby protonów, które określają ładunek jądra, wzrasta również liczba neutronów w jądrach, a co za tym idzie masa atomów pierwiastków.
Przed Mendelejewem podjęto kilka prób usystematyzowania elementów według różnych kryteriów. Zasadniczo zjednoczeni podobny pierwiastki zgodnie z ich właściwościami chemicznymi. Na przykład: Li, Na, K. Lub: Cl, Br, I. Te i kilka innych elementów połączono w tzw. „triady”. Tablica pięciu takich „triad” została opublikowana przez Dobereinera już w 1829 roku, ale zawierała tylko niewielką część znanych wówczas elementów.
W 1864 r. Anglik J. Newlands zauważył, że jeśli pierwiastki ułożone są w porządku rosnącym według ich masy atomowej, to mniej więcej co ósmy pierwiastek jest rodzajem powtórzenia pierwszego – tak jak notka „do” (jak każda inna notatka). powtarza się w oktawach muzycznych co 7 nut (prawo oktaw). Poniżej wersja stołu Newlands z 1865 roku. Elementy o tej samej masie atomowej (według ówczesnych danych) zostały umieszczone pod tym samym numerem. Widać trudności, jakie napotkał Newlands – pojawiające się wzorce szybko się załamały, gdyż jego system nie uwzględniał możliwości istnienia nieodkrytych jeszcze pierwiastków. 
Raport Newlandsa „The Law of Octaves and the Causes of Chemical Ratios Among Atomic Weights” był omawiany na spotkaniu Londyńskiego Towarzystwa Chemicznego w dniu 1 marca 1866 r., a krótkie sprawozdanie z niego zostało opublikowane w czasopiśmie „Chemical News”. Newlands był bliski odkryciu prawa okresowego, ale sama idea sekwencyjnej numeracji tylko znanych do tego czasu pierwiastków nie tylko „przełamała” płynną zmianę ich właściwości chemicznych – idea ta wykluczała możliwość istnienia jeszcze nieodkryte elementy, na które po prostu nie było miejsca w systemie Newlands. Zasadnicza nowość Prawa Okresowego, odkryta i sformułowana dokładnie trzy lata później przez D. I. Mendelejewa, była następująca: 
1. Zostało nawiązane połączenie pomiędzy elementami NIE PODOBNYMI w ich właściwościach. Zależność ta polega na tym, że wraz ze wzrostem ich masy atomowej właściwości pierwiastków zmieniają się płynnie iw przybliżeniu równomiernie, a następnie te zmiany są OKRESOWO POWTARZANE.
2. W przypadkach, w których wydawało się, że brakuje jakiegoś ogniwa w sekwencji zmian właściwości pierwiastków, Układ okresowy przewidywał GAPS, które należało wypełnić nieodkrytymi jeszcze pierwiastkami. Ponadto Prawo Okresowe umożliwiło PRZEWIDYWANIE właściwości tych pierwiastków.
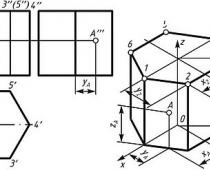
Pierwsza wersja układu okresowego, opublikowana przez Mendelejewa w 1869 r., dla współczesnego czytelnika wygląda niecodziennie (ryc. 4-5). Dopóki nie zostaną naniesione liczby atomowe, przyszłe grupy pierwiastków są ułożone poziomo (a przyszłe okresy - pionowo), gazy obojętne nie zostały jeszcze odkryte, natrafiono na nieznane symbole pierwiastków, wiele mas atomowych znacznie różni się od współczesnych. Jednak ważne jest dla nas, aby zobaczyć, że już w pierwszej wersji układu okresowego D. I. Mendelejew zawierał więcej pierwiastków, niż zostało wówczas odkrytych! Pozostawił 4 komórki swojego stołu wolne dla wciąż nieznanych pierwiastków i był nawet w stanie poprawnie oszacować ich masę atomową. Atomowe jednostki masy (a.m.u.) nie zostały jeszcze zaakceptowane, a masy atomowe pierwiastków mierzono w „udziałach” zbliżonych wartością do masy atomu wodoru.

Ryż. 4-5. Pierwsza wersja układu okresowego, opublikowana w: 1869 rok. Elementy przewidziane przez D. I. Mendelejewa, a następnie odkryte.
We wszystkich dotychczasowych próbach określenia relacji między pierwiastkami inni badacze dążyli do stworzenia zakończony obraz, w którym nie było miejsca na jeszcze nieodkryte elementy. Wręcz przeciwnie, D. I. Mendelejew uważał, że najważniejszą częścią jego układu okresowego są te jego komórki, które były jeszcze puste (znaki zapytania na ryc. 4-5). To sprawiło, że było to możliwe przewidywać istnienie jeszcze nieznanych elementów.
Godne podziwu jest to, że D. I. Mendelejew dokonał swojego odkrycia w czasie, gdy masy atomowe wielu pierwiastków zostały określone bardzo w przybliżeniu, a znane były tylko 63 pierwiastki - czyli nieco ponad połowa znanych nam dzisiaj.
Dogłębna znajomość właściwości chemicznych różnych pierwiastków pozwoliła Mendelejewowi nie tylko wskazać pierwiastki jeszcze nieodkryte, ale także przewidywać ich właściwości! Zobacz, jak dokładnie D. I. Mendelejew przewidział właściwości pierwiastka, który nazwał „eka-krzemem” (na ryc. 4-5 jest to pierwiastek german). Po 16 latach przepowiednia D. I. Mendelejewa została doskonale potwierdzona.
Tabela 4-5. Porównanie właściwości przewidywanych przez D. I. Mendelejewa dla jeszcze nieodkrytego pierwiastka „eka-krzem” z właściwościami pierwiastka germanu (Ge). We współczesnym układzie okresowym german zajmuje miejsce „eka-krzemu”.
W ten sam sposób, za życia D. I. Mendelejewa, znakomicie potwierdzono właściwości „eka-aluminium” (pierwiastek galu Ga) i „eka-bor” (pierwiastek skand Sc).
Potem stało się jasne dla naukowców na całym świecie, że układ okresowy D. I. Mendelejewa nie tylko systematyzuje pierwiastki, ale jest graficznym wyrazem podstawowego prawa natury – Prawa Okresowego.
To prawo ma moc predykcyjną. Pozwolił na prowadzenie ukierunkowanego poszukiwania nowych, nieodkrytych jeszcze elementów. Masy atomowe wielu pierwiastków, wcześniej niewystarczająco dokładnie wyznaczone, zostały poddane weryfikacji i doprecyzowaniu właśnie dlatego, że ich błędne wartości kolidowały z prawem okresowym.
** Jednak nawet po ogromnej i starannej pracy chemików nad korektą masy atomowej, w czterech miejscach Układu Okresowego pierwiastki „naruszają” ścisłą kolejność rozmieszczenia w rosnącej masie atomowej. Są to pary elementów:
18 Ar (39,948) – 19 tys. (39,098);
27 Co (58,933) – 28 Ni (58,69);
52 T (127,60) – 53 T (126,904);
90 tys. (232.038) – 91 Pa (231.0359).
W czasach D. I. Mendelejewa takie odchylenia uważano za wady układu okresowego. Teoria budowy atomu postawiła wszystko na swoim miejscu: pierwiastki ułożone są dość poprawnie - zgodnie z ładunkami ich jąder. Jak zatem wyjaśnić, że masa atomowa argonu jest większa niż masa atomowa potasu?
Masa atomowa dowolnego pierwiastka jest równa średniej masie atomowej wszystkich jego izotopy ze względu na ich rozpowszechnienie z natury (należy pamiętać o paragrafie 2.3 z rozdziału 2). Przypadkowo o masie atomowej argonu decyduje najbardziej „ciężki” izotop (występuje on w naturze w większych ilościach). Natomiast potas jest zdominowany przez jego „lżejszy” izotop (to znaczy izotop o mniejszej liczbie masowej). 
Eksperymentalne oznaczenie ładunków jąder pierwiastków, przeprowadzone przez G. Moseleya w 1914 roku, potwierdziło słuszność D. I. Mendelejewa, który przy określaniu ich ostatecznego miejsca w Układ okresowy pierwiastków.
Od czasu pojawienia się Prawa Okresowego, chemia przestała być nauką opisową. Jak w przenośni zauważył słynny rosyjski chemik N. D. Zelinsky, prawo okresowe było „odkryciem wzajemnego połączenia wszystkich atomów we wszechświecie”.
Kolejne odkrycia w chemii i fizyce wielokrotnie potwierdzały fundamentalne znaczenie prawa okresowego. Odkryto gazy obojętne, które idealnie pasują do układu okresowego pierwiastków - szczególnie wyraźnie pokazuje to długa forma tablicy. Numer seryjny pierwiastka okazał się równy ładunkowi jądra atomu tego pierwiastka. Wiele wcześniej nieznanych pierwiastków odkryto dzięki ukierunkowanym poszukiwaniom dokładnie tych właściwości, które przewidywał układ okresowy pierwiastków.
Odkrycie prawa okresowego[edytuj | edytuj źródło]
Portret DI Mendelejewa (1861)

Układ okresowy D. I. Mendelejewa 1871

Wersja układ okresowy Mendelejew w 1891 roku. Nie zawiera gazów szlachetnych.
W marcu 1869 r. na spotkaniu Rosyjskiego Towarzystwa Chemicznego rosyjski chemik Dmitrij Iwanowicz Mendelejew odczytał wiadomość o swoim odkryciu prawa okresowego pierwiastki chemiczne. W tym samym roku ukazało się pierwsze wydanie podręcznika Mendelejewa „Podstawy chemii”, w którym jego układ okresowy pierwiastków. W listopadzie 1870 r. zgłosił do RCS artykuł „Naturalny układ pierwiastków i jego zastosowanie do wskazania właściwości nieodkrytych pierwiastków”, w którym Mendelejew po raz pierwszy użył terminu „Prawo okresowe” i wskazał na istnienie kilku nieodkrytych elementów.
W 1871 r. W ostatnim artykule „Prawo okresowe pierwiastków chemicznych” Mendelejew podał następujące sformułowanie prawa okresowego: „ właściwości ciał prostych, a także postaci i właściwości związków pierwiastków, a więc właściwości utworzonych przez nie ciał prostych i złożonych, pozostają w okresowej zależności od ich masy atomowej» . W tym samym czasie Mendelejew nadał swojemu układowi okresowemu pierwiastków formę, która stała się klasyczna (tzw. wersja krótkookresowa).
W przeciwieństwie do swoich poprzedników Mendelejew nie tylko skompilował tabelę i wskazał na obecność niewątpliwych wzorców w wartościach liczbowych mas atomowych, ale także postanowił nazwać te wzorce ogólne prawo natury. Opierając się na założeniu, że masa atomowa określa właściwości pierwiastka pozwolił sobie na zmianę przyjętych mas atomowych niektórych pierwiastków i szczegółowe opisanie właściwości pierwiastków jeszcze nieodkrytych. Aby przewidzieć właściwości prostych substancji i związków, Mendelejew wyszedł z tego, że właściwości każdego pierwiastka są pośrednie między odpowiednimi właściwościami dwóch sąsiednich pierwiastków w grupie układu okresowego (czyli powyżej i poniżej) i jednocześnie dwóch sąsiednich elementy w okresie (lewy i prawy) (tj. n „reguła gwiazdy”).
D. I. Mendelejew przez wiele lat walczył o uznanie Prawa Okresowego; jego idee zostały rozpoznane dopiero po odkryciu pierwiastków przewidzianych przez Mendelejewa: galu (Paul Lecoq de Boisbaudran, 1875), skandu (Lars Nilsson, 1879) i germanu (Clemens Winkler, 1886) - odpowiednio ekaaluminum, ecabor i ekasilicon. Od połowy lat 80. XIX w. Prawo Okresowe zostało ostatecznie uznane za jedną z teoretycznych podstaw chemii.



Język angielski: Pomnik układu okresowego pierwiastków przed Wydziałem Technologii Chemicznej i Spożywczej Słowackiego Uniwersytetu Technologicznego w Bratysławie na Słowacji. Pomnik upamiętnia Dymitra Mendelejewa.
Układ okresowy pierwiastków: historia odkrycia, ciekawe fakty i historie
Źródło:
Nauka, Akcenty
Vkontakte5
wydrukować
wyślij pocztą

Odkrycie tablicy okresowych pierwiastków chemicznych było jednym z ważnych kamieni milowych w historii rozwoju chemii jako nauki. Pionierem stołu był rosyjski naukowiec Dmitrij Mendelejew. Niezwykłemu naukowcowi o najszerszych horyzontach naukowych udało się połączyć wszystkie wyobrażenia o naturze pierwiastków chemicznych w jedną spójną koncepcję. O historii odkrycia tablicy pierwiastków okresowych, interesujące fakty związane z odkryciem nowych pierwiastków i opowieści ludowych, które otaczały Mendelejewa i stworzonej przez niego tabeli pierwiastków chemicznych, M24.RU opowie w tym artykule. Historia otwarcia stołu Do połowy XIX wieku odkryto 63 pierwiastki chemiczne, a naukowcy na całym świecie wielokrotnie próbowali połączyć wszystkie istniejące pierwiastki w jedną koncepcję. Zaproponowano, aby pierwiastki były uporządkowane rosnąco według masy atomowej i podzielone na grupy według podobieństwa właściwości chemicznych. W 1863 roku chemik i muzyk John Alexander Newland zaproponował swoją teorię, proponując układ pierwiastków chemicznych podobny do tego odkrytego przez Mendelejewa, ale praca naukowca nie została potraktowana poważnie przez środowisko naukowe ze względu na fakt, że autor był porwany poszukiwaniem harmonii i połączenia muzyki z chemią. W 1869 Mendelejew opublikował swój schemat układu okresowego w czasopiśmie Rosyjskiego Towarzystwa Chemicznego i wysłał zawiadomienie o odkryciu do czołowych naukowców świata. W przyszłości chemik wielokrotnie udoskonalał i ulepszał schemat, aż uzyskał znajomą formę. Istotą odkrycia Mendelejewa jest to, że wraz ze wzrostem masy atomowej właściwości chemiczne pierwiastków nie zmieniają się jednostajnie, ale okresowo. Po określonej liczbie elementów o różnych właściwościach właściwości zaczynają się powtarzać. Tak więc potas jest podobny do sodu, fluor do chloru, a złoto do srebra i miedzi. W 1871 r. Mendelejew ostatecznie połączył te idee w Prawo okresowe. Naukowcy przewidzieli odkrycie kilku nowych pierwiastków chemicznych i opisali ich właściwości chemiczne. Następnie obliczenia chemika zostały w pełni potwierdzone - gal, skand i german w pełni odpowiadały właściwościom, które przypisywał im Mendelejew. Opowieści o Mendelejewie

Grawerowanie przedstawiające Mendelejewa. Zdjęcie: ITAR-TASS
Było wiele opowieści o słynnym naukowcu i jego odkryciach. Ludzie w tamtym czasie nie mieli pojęcia o chemii i wierzyli, że robienie chemii jest czymś w rodzaju jedzenia zupy od niemowląt i kradzieży na skalę przemysłową. Dlatego działalność Mendelejewa szybko zyskała masę plotek i legend. Jedna z legend mówi, że Mendelejew odkrył we śnie tablicę pierwiastków chemicznych. Sprawa nie jest jedyna, August Kekule, który marzył o formule pierścienia benzenowego, tak samo wypowiedział się o swoim odkryciu. Jednak Mendelejew tylko śmiał się z krytyków. „Myślałem o tym może od dwudziestu lat, a ty mówisz: siedziałem i nagle… gotowe!”, powiedział kiedyś o swoim odkryciu naukowiec. Inna historia przypisuje Mendelejewowi odkrycie wódki. W 1865 roku wielki naukowiec obronił swoją rozprawę na temat „Dyskurs o połączeniu alkoholu z wodą”, co od razu dało początek nowej legendzie. Współcześni chemikowi śmiali się, mówiąc, że naukowiec „dobrze radzi sobie pod wpływem alkoholu połączonego z wodą”, a kolejne pokolenia już nazywały Mendelejewa odkrywcą wódki. Śmiali się także ze sposobu życia naukowca, a zwłaszcza z faktu, że Mendelejew wyposażył swoje laboratorium w zagłębieniu ogromnego dębu. Również współcześni drażnili się z pasją Mendelejewa do walizek. Naukowiec w czasie swojej mimowolnej bezczynności w Symferopolu był zmuszony spędzać czas na tkaniu walizek. W przyszłości samodzielnie wykonywał opakowania kartonowe na potrzeby laboratorium. Pomimo wyraźnie „amatorskiego” charakteru tego hobby, Mendelejew był często nazywany „mistrzem walizki”. Odkrycie radu Jedna z najtragiczniejszych i zarazem najsłynniejszych kart w historii chemii i pojawiania się nowych pierwiastków w układzie okresowym wiąże się z odkryciem radu. Nowy pierwiastek chemiczny odkryli małżonkowie Marie i Pierre Curie, którzy odkryli, że odpady pozostałe po oddzieleniu uranu od rudy uranu są bardziej radioaktywne niż czysty uran. Ponieważ nikt wówczas nie wiedział, czym jest radioaktywność, plotka szybko przypisywała nowemu pierwiastkowi właściwości lecznicze i zdolność do leczenia prawie wszystkich chorób znanych nauce. Rad był zawarty w produktach spożywczych, pastach do zębów, kremach do twarzy. Bogaci nosili zegarki, których tarcze były malowane farbą zawierającą rad. Pierwiastek promieniotwórczy był zalecany jako środek poprawiający potencję i łagodzący stres. Taka „produkcja” trwała całe dwadzieścia lat – do lat 30. XX wieku, kiedy naukowcy odkryli prawdziwe właściwości promieniotwórczości i dowiedzieli się, jak szkodliwy wpływ promieniowania na organizm ludzki. Marie Curie zmarła w 1934 roku na chorobę popromienną spowodowaną długotrwałym narażeniem na rad. Nebulium i Coronium

Układ okresowy pierwiastków nie tylko uporządkował pierwiastki chemiczne w jeden spójny układ, ale także pozwolił przewidzieć wiele odkryć nowych pierwiastków. Jednocześnie niektóre „pierwiastki” chemiczne uznano za nieistniejące ze względu na to, że nie mieściły się w pojęciu prawa okresowego. Najbardziej znaną historią jest „odkrycie” nowych pierwiastków mgławicy i korony. Badając atmosferę słoneczną, astronomowie odkryli linie widmowe, których nie mogli zidentyfikować z żadnym z pierwiastków chemicznych znanych na Ziemi. Naukowcy zasugerowali, że linie te należą do nowego pierwiastka, który nazwano koronem (ponieważ linie zostały odkryte podczas badania „korony” Słońca – zewnętrznej warstwy atmosfery gwiazdy). Kilka lat później astronomowie dokonali kolejnego odkrycia, badając widma mgławic gazowych. Odkryte linie, których ponownie nie można było utożsamiać z niczym ziemskim, przypisano innemu pierwiastkowi chemicznemu - nebulium. Odkrycia spotkały się z krytyką, ponieważ w układzie okresowym Mendelejewa nie było już miejsca na pierwiastki o właściwościach nebulium i koronu. Po sprawdzeniu okazało się, że nebulium to zwykły ziemski tlen, a coronium to silnie zjonizowane żelazo. Należy zauważyć, że dziś w Moskiewskim Centralnym Domu Naukowców Rosyjskiej Akademii Nauk zostaną uroczyście przypisane nazwy dwóm pierwiastkom chemicznym odkrytym przez naukowców z Dubnej pod Moskwą.
Mendelejew miał wtedy zaledwie 35 lat.
Mendelejew wysłał wydrukowane arkusze z tabelą pierwiastków do wielu krajowych i zagranicznych chemików, a dopiero potem opuścił Petersburg, aby obejrzeć fabryki serów.
Jeszcze przed wyjazdem udało mu się przekazać N. A. Menshutkinowi, chemikowi organicznemu i przyszłemu historykowi chemii, rękopis artykułu „Związek właściwości z masą atomową pierwiastków” - do publikacji w Journal of the Russian Chemical Society oraz do komunikacji na zbliżającym się spotkaniu stowarzyszenia.
18 marca 1869 r. Mieńszutkin, który był wówczas urzędnikiem towarzystwa, sporządził w imieniu Mendelejewa mały raport na temat Ustawy o okresach. Raport początkowo nie przyciągnął uwagi chemików, a prezes Rosyjskiego Towarzystwa Chemicznego, akademik Nikołaj Nikołajewicz Zinin (1812-1880) stwierdził, że Mendelejew nie robi tego, co powinien robić prawdziwy badacz. To prawda, że dwa lata później, po przeczytaniu artykułu Dmitrija Iwanowicza „Naturalny system pierwiastków i jego zastosowanie do wskazywania właściwości niektórych pierwiastków”, Zinin zmienił zdanie i napisał do Mendelejewa: „Bardzo, bardzo dobrze, bardzo doskonałe przybliżenia, nawet zabawne do przeczytania, niech Bóg zapłać na szczęście w eksperymentalnym potwierdzeniu Twoich wniosków.Szczerze Ci oddany i głęboko szanujący Ciebie N. Zinin.
Czym więc jest okresowość?
Jest to powtarzalność właściwości chemicznych prostych substancji i ich związków przy zmianie numeru seryjnego elementu. Z oraz pojawienie się maksimów i minimów w wielu właściwościach, w zależności od wartości liczby porządkowej (atomowej) pierwiastka.
Na przykład, co umożliwia połączenie wszystkich pierwiastków alkalicznych w jedną grupę?
Przede wszystkim powtarzalność przez pewne przedziały wartości Z elektroniczna Konfiguracja. Atomy wszystkich pierwiastków alkalicznych mają na zewnątrz orbital atomowy tylko jeden elektron, a zatem w swoich związkach wykazują ten sam stopień utlenienia, równy + I. Wzory ich związków są takie same: dla chlorków MCl, dla węglanów - M 2 CO 3, dla octanów - CH 3 COOM i tak dalej (tu litera M oznacza pierwiastek alkaliczny).
Mendelejew miał jeszcze wiele do zrobienia po odkryciu prawa okresowego. Przyczyna okresowej zmiany właściwości pierwiastków pozostawała nieznana, a sama struktura układu okresowego, w którym właściwości powtarzały się przez siedem pierwiastków w ósmym, nie znalazła wyjaśnienia. Jednak pierwsza zasłona tajemnicy została zdjęta z tych liczb: w drugim i trzecim okresie systemu było wtedy tylko siedem elementów każdy.
Mendelejew nie umieścił wszystkich pierwiastków w porządku rosnącym mas atomowych; w niektórych przypadkach kierował się bardziej podobieństwem właściwości chemicznych. Tak, w kobalt Masa atomowa Co jest większa niż nikiel Ni, tak tellur Ona też jest większa niż to jod Ja, ale Mendelejew umieścił je w kolejności Co - Ni, Te - I, a nie odwrotnie. W przeciwnym razie tellur znalazłby się w grupie halogeny, a jod stał się krewny Selena Se.
Najważniejszą rzeczą w odkryciu prawa okresowego jest: Prognoza istnienie jeszcze nieodkrytych pierwiastków chemicznych. Pod aluminium Al Mendelejew zostawił miejsce dla swojego odpowiednika ” ekaglin", pod bor B - dla " Ekabora", i pod krzem Si - dla " eksasilikon W ten sposób Mendelejew nazwał pierwiastki chemiczne, które nie zostały jeszcze odkryte. Nadał im nawet symbole El, Eb i Es.
Odnośnie pierwiastka „ekasilikon” Mendelejew napisał: „Wydaje mi się, że najciekawszym z niewątpliwie brakujących metali będzie ten, który należy do IV grupy analogów węgla, a mianowicie do III serii. Będzie to metal zaraz po krzemie i dlatego nazwiemy jego podniecenie”. Rzeczywiście, ten jeszcze nieodkryty pierwiastek miał stać się rodzajem „zamka” łączącego dwa typowe niemetale – węgiel C i krzem Si - z dwoma typowymi metalami - cyna sn i Ołów Pb.
Nie wszyscy zagraniczni chemicy od razu docenili znaczenie odkrycia Mendelejewa. Bardzo się to zmieniło w świecie ugruntowanych idei. Tak więc niemiecki fizykochemik Wilhelm Ostwald, przyszły noblista, przekonywał, że odkryto nie prawo, ale zasadę klasyfikowania „czegoś nieokreślonego”. Niemiecki chemik Robert Bunsen, który w 1861 r. odkrył dwa nowe pierwiastki alkaliczne, rubid Rb i cez Cs napisał, że Mendelejew zabiera chemików „w naciągany świat czystych abstrakcji”.
Hermann Kolbe, profesor Uniwersytetu w Lipsku, nazwał odkrycie Mendelejewa „spekulacyjnym” w 1870 roku. Kolbe wyróżniał się chamstwem i odrzuceniem nowych poglądów teoretycznych w chemii. W szczególności był przeciwnikiem teorii budowy związków organicznych i swego czasu ostro zaatakował artykuł Jacoba van't Hoffa „Chemia w kosmosie”. Van't Hoff został później pierwszym laureatem Nagrody Nobla za swoje badania. Ale Kolbe zasugerował, że tacy badacze jak van't Hoff „wykluczają z szeregów prawdziwych naukowców i wpisują ich do obozu spirytualistów”!
Co roku Prawo Okresowe podbijało wszystkich jeszcze zwolenników, a jej odkrywca – coraz większe uznanie. W laboratorium Mendelejewa zaczęli pojawiać się wysokiej rangi goście, w tym nawet wielki książę Konstantin Nikołajewicz, szef departamentu morskiego.
Zwycięstwo
Wreszcie nadszedł czas na triumf. W 1875 r. francuski chemik Paul-Emile Lecoq de Boisbaudran odkrył minerał wurcyt- siarczek cynku ZnS - przewidywany przez Mendelejewa " eko-aluminium i nazwał ją po swojej ojczyźnie gal Ga (łacińska nazwa Francji to Gal). Napisał: „Myślę, że nie ma potrzeby podkreślać wielkiej wagi potwierdzenia teoretycznych wniosków pana Mendelejewa”.
Zwróć uwagę, że w nazwie elementu znajduje się wskazówka imienia samego Boisbaudran. Łacińskie słowo „gallus” oznacza koguta, a po francusku kogut to „le coc”. To słowo jest również w imieniu odkrywcy. Co Lecoq de Boisbaudran miał na myśli, gdy nadał nazwę żywiołowi – sobie lub jego krajowi – tego najwyraźniej nigdy się nie dowie.
Mendelejew dokładnie przewidział właściwości ekaglinu: jego masę atomową, gęstość metalu, wzór na tlenek El 2 O 3 , chlorek ElCl 3 , siarczan El 2 (SO 4) 3 . Po odkryciu galu wzory te zaczęto zapisywać jako Ga 2 O 3 , GaCl 3 i Ga 2 (SO 4) 3 . Mendelejew przewidywał, że będzie to bardzo topliwy metal i rzeczywiście, temperatura topnienia galu wyniosła 29,8 ° C. Pod względem topliwości gal ustępuje tylko rtęć Hg i cez CS.
W 1879 roku szwedzki chemik Lars Nilson odkrył skand, przewidywany przez Mendelejewa jako ecabor Eb. Nilson napisał: „Nie ma wątpliwości, że w skandia otwarty Ekabor... Najwyraźniej zatem potwierdzają się rozważania rosyjskiego chemika, które nie tylko pozwoliły przewidzieć istnienie skandu i galu, ale także z góry przewidzieć ich najważniejsze właściwości. Skand został nazwany na cześć ojczyzny Nilsona Skandynawii i odkrył ją w złożonym minerale gadolinicie, którego skład stanowi Be 2 (Y,Sc) 2 FeO 2 (SiO 4) 2.
W 1886 roku profesor Akademii Górniczej we Fryburgu, niemiecki chemik Clemens Winkler, analizując rzadki minerał argyrodyt o składzie Ag 8 GeS 6, odkrył kolejny pierwiastek przewidywany przez Mendelejewa. Winkler nazwał odkryty przez siebie pierwiastek german Ge na cześć ich ojczyzny, ale z jakiegoś powodu wywołało to ostre sprzeciwy ze strony niektórych chemików. Zaczęli oskarżać Winklera o nacjonalizm, o przywłaszczenie odkrycia dokonanego przez Mendelejewa, który już nadał elementowi nazwę „ ekasilikon” i symbol Es. Zniechęcony Winkler zwrócił się o radę do samego Dmitrija Iwanowicza. Wyjaśnił, że to odkrywca nowego pierwiastka powinien nadać mu nazwę.
Mendelejew nie mógł przewidzieć istnienia grupy gazów szlachetnych i początkowo nie znaleźli miejsca w układzie okresowym.
Otwarcie argon Angielscy naukowcy W. Ramsay i J. Rayleigh w 1894 r. natychmiast wywołali gorące dyskusje i wątpliwości dotyczące prawa okresowego i układu okresowego pierwiastków. Mendelejew początkowo uważał argon za alotropową odmianę azotu i dopiero w 1900 r. pod presją niepodważalnych faktów zgodził się z obecnością w układzie okresowym „zerowej” grupy pierwiastków chemicznych, którą zajmowały inne gazy szlachetne odkryte po argonie . Teraz ta grupa znana jest pod numerem VIIIA.
W 1905 r. Mendelejew pisał: „Podobno przyszłość nie zagraża ustawie okresowej zniszczeniem, a jedynie obiecuje nadbudowę i rozwój, chociaż jako Rosjanie chcieli mnie wymazać, zwłaszcza Niemców”.
Odkrycie prawa okresowego przyspieszyło rozwój chemii i odkrycie nowych pierwiastków chemicznych.
- W kontakcie z 0
- Google+ 0
- OK 0
- Facebook 0