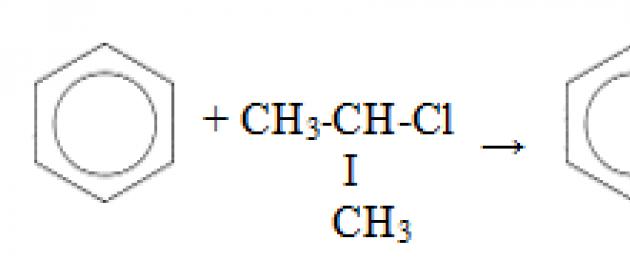DEFINICJA
Benzen(cykloheksatrien - 1,3,5) - materia organiczna, najprostszy przedstawiciel wielu aromatycznych węglowodorów.
Wzór - C 6 H 6 (wzór strukturalny - ryc. 1). Masa cząsteczkowa – 78, 11.
Ryż. 1. Wzory strukturalne i przestrzenne benzenu.
Wszystkie sześć atomów węgla w cząsteczce benzenu znajduje się w stanie hybrydowym sp2. Każdy atom węgla tworzy wiązania 3σ z dwoma innymi atomami węgla i jednym atomem wodoru leżącymi w tej samej płaszczyźnie. Sześć atomów węgla tworzy sześciokąt foremny (σ-szkielet cząsteczki benzenu). Każdy atom węgla ma jeden niezhybrydyzowany orbital p, który zawiera jeden elektron. Sześć p-elektronów tworzy pojedynczy obłok π-elektronów (układ aromatyczny), który jest przedstawiony jako okrąg wewnątrz sześcioczłonowego cyklu. Rodnik węglowodorowy pochodzący z benzenu nazywa się C 6 H 5 - - fenyl (Ph-).
Właściwości chemiczne benzenu
Benzen charakteryzuje się reakcjami podstawienia przebiegającymi zgodnie z mechanizmem elektrofilowym:
- halogenowanie (benzen oddziałuje z chlorem i bromem w obecności katalizatorów - bezwodny AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 \u003d C6H5 -Cl + HCl;
- nitrowanie (benzen łatwo reaguje z mieszaniną nitrującą - mieszaniną stężonego kwasu azotowego i siarkowego)

- alkilacja alkenami
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
Reakcje addycji do benzenu prowadzą do zniszczenia układu aromatycznego i przebiegają tylko w trudnych warunkach:
- uwodornienie (reakcja przebiega po podgrzaniu, katalizatorem jest Pt)

- dodatek chloru (występuje pod wpływem promieniowania UV z utworzeniem produktu stałego - heksachlorocykloheksan (heksachloran) - C 6 H 6 Cl 6)

Jak każdy związek organiczny, benzen wchodzi w reakcję spalania, tworząc produkty reakcji dwutlenek węgla i woda (pali się dymnym płomieniem):
2C6H6 + 15O2 → 12CO2 + 6H2O.
Właściwości fizyczne benzenu
Benzen jest bezbarwną cieczą, ale ma specyficzny ostry zapach. Tworzy mieszaninę azeotropową z wodą, dobrze miesza się z eterami, benzyną i różnymi rozpuszczalnikami organicznymi. Temperatura wrzenia - 80,1C, temperatura topnienia - 5,5C. Toksyczny, rakotwórczy (tj. przyczynia się do rozwoju raka).
Pozyskiwanie i używanie benzenu
Główne metody otrzymywania benzenu:
— dehydrocyklizacja heksanu (katalizatory – Pt, Cr 3 O 2)
CH3-(CH2)4-CH3 → C6H6 + 4H2;
- odwodornienie cykloheksanu (reakcja przebiega po podgrzaniu, katalizatorem jest Pt)
C6H12 → C6H6 + 4H2;
– trimeryzacja acetylenu (reakcja przebiega po podgrzaniu do 600C, katalizatorem jest węgiel aktywny)
3HC≡CH → C6H6.
Benzen służy jako surowiec do produkcji homologów (etylobenzen, kumen), cykloheksan, nitrobenzen, chlorobenzen i inne substancje. Wcześniej benzen był stosowany jako dodatek do benzyny w celu zwiększenia jej liczby oktanowej, jednak obecnie, ze względu na wysoką toksyczność, zawartość benzenu w paliwie jest ściśle regulowana. Czasami jako rozpuszczalnik stosuje się benzen.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenie | Zapisz równania, za pomocą których możesz przeprowadzić następujące przekształcenia: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Rozwiązanie | Aby uzyskać acetylen z metanu, stosuje się następującą reakcję: 2CH4 → C2H2 + 3H2 (t = 1400C). Otrzymywanie benzenu z acetylenu jest możliwe poprzez reakcję trimeryzacji acetylenu, która zachodzi po podgrzaniu (t = 600C) oraz w obecności węgla aktywnego: 3C2H2 → C6H6. Reakcja chlorowania benzenu w celu uzyskania chlorobenzenu jako produktu prowadzona jest w obecności chlorku żelaza (III): C6H6 + Cl2 → C6H5Cl + HCl. |
PRZYKŁAD 2
| Ćwiczenie | Do 39 g benzenu w obecności chlorku żelaza (III) dodano 1 mol wody bromowej. Jaka ilość substancji i ile gramów jakich produktów to spowodowało? |
| Rozwiązanie | Napiszmy równanie reakcji bromowania benzenu w obecności chlorku żelaza (III): C6H6 + Br2 → C6H5Br + HBr. Produktami reakcji są bromobenzen i bromowodór. Masa molowa benzenu obliczona na podstawie tabeli pierwiastki chemiczne DI. Mendelejew - 78 g/mol. Znajdź ilość substancji benzenowej: n(C6H6) = m(C6H6)/M(C6H6); n(C6H6) = 39/78 = 0,5 mol. W zależności od stanu problemu, benzen reagował z 1 molem bromu. W związku z tym brakuje benzenu i dalsze obliczenia zostaną wykonane dla benzenu. Zgodnie z równaniem reakcji n (C 6 H 6): n (C 6 H 5 Br): n (HBr) \u003d 1: 1: 1, zatem n (C 6 H 6) \u003d n (C 6 H 5 Br) \u003d: n(HBr) = 0,5 mola. Wtedy masy bromobenzenu i bromowodoru będą równe: m(C6H5Br) = n(C6H5Br)xM(C6H5Br); m(HBr) = n(HBr)×M(HBr). Masy molowe bromobenzenu i bromowodoru, obliczone na podstawie tabeli pierwiastków chemicznych D.I. Mendelejew - odpowiednio 157 i 81 g/mol. m(C6H5Br) = 0,5 x 157 = 78,5 g; m(HBr) = 0,5 x 81 = 40,5 g. |
| Odpowiedź | Produktami reakcji są bromobenzen i bromowodór. Masy bromobenzenu i bromowodoru wynoszą odpowiednio 78,5 i 40,5 g. |
Areny to aromatyczne węglowodory zawierające jeden lub więcej pierścieni benzenowych. Pierścień benzenowy składa się z 6 atomów węgla, pomiędzy którymi występują naprzemiennie wiązania podwójne i pojedyncze.
Należy zauważyć, że wiązania podwójne w cząsteczce benzenu nie są stałe, ale stale poruszają się po okręgu.
Areny są również nazywane węglowodorami aromatycznymi. Pierwszy członek seria homologiczna- benzen - C 6 H 6 . Ogólny wzór na ich szereg homologiczny to C n H 2n-6.
Wzór strukturalny benzenu przez długi czas pozostawał tajemnicą. Wzór zaproponowany przez Kekule z dwoma potrójnymi wiązaniami nie mógł wyjaśnić faktu, że benzen nie wchodzi w reakcje addycji. Jak wspomniano powyżej, zgodnie ze współczesnymi koncepcjami wiązania podwójne w cząsteczce stale się poruszają, dlatego bardziej słuszne jest narysowanie ich w formie pierścienia.
Wiązania podwójne tworzą koniugację w cząsteczce benzenu. Wszystkie atomy węgla są w stanie hybrydyzacji sp2. Kąt walencyjny - 120°.
Nazewnictwo i izomeria aren
Nazwy arenów powstają przez dodanie nazw podstawników do głównego łańcucha - pierścienia benzenowego: benzen, metylobenzen (toluen), etylobenzen, propylobenzen itp. Podstawniki są, jak zwykle, wymienione w porządku alfabetycznym. Jeśli w pierścieniu benzenowym jest kilka podstawników, wybiera się najkrótszą drogę między nimi.

Areny charakteryzują się izomerią strukturalną związaną z pozycją podstawników. Na przykład dwa podstawniki w pierścieniu benzenowym mogą znajdować się w różnych pozycjach.
Nazwa pozycji podstawników w pierścieniu benzenowym jest tworzona na podstawie ich położenia względem siebie. Jest oznaczony przedrostkami orto-, meta- i para. Poniżej znajdziesz mnemoniczne podpowiedzi do ich pomyślnego zapamiętywania ;)

Zdobywanie aren
Areny zdobywa się na kilka sposobów:

Właściwości chemiczne aren
Areny to aromatyczne węglowodory zawierające pierścień benzenowy ze sprzężonymi podwójnymi wiązaniami. Ta funkcja sprawia, że reakcje dodawania są trudne (ale nadal możliwe!)
Pamiętaj, że w przeciwieństwie do innych związków nienasyconych, benzen i jego homologi nie odbarwiają wody bromowej i roztworu nadmanganianu potasu.

© Bellevich Jurij Siergiejewicz 2018-2020
Ten artykuł został napisany przez Yury Sergeevich Bellevich i jest jego własnością intelektualną. Kopiowanie, rozpowszechnianie (w tym kopiowanie do innych witryn i zasobów w Internecie) lub jakiekolwiek inne wykorzystanie informacji i obiektów bez uprzedniej zgody właściciela praw autorskich jest karalne. W celu uzyskania materiałów artykułu i pozwolenia na ich wykorzystanie prosimy o kontakt
Aromatyczne HC (areny) to węglowodory, których cząsteczki zawierają jeden lub więcej pierścieni benzenowych.
Przykłady węglowodorów aromatycznych:

areny rzędowe benzenu (monocykliczne areny)
Ogólna formuła:C n H 2n-6 , n≥6
Najprostszym przedstawicielem węglowodorów aromatycznych jest benzen, jego wzór empiryczny to C 6 H 6 .
Struktura elektronowa cząsteczki benzenu
Ogólny wzór monocyklicznych arenów CnH2n-6 wskazuje, że są to związki nienasycone.
W 1856 r. niemiecki chemik A.F. Kekule zaproponował cykliczny wzór dla benzenu ze sprzężonymi wiązaniami (naprzemiennie wiązania pojedyncze i podwójne) - cykloheksatrien-1,3,5: 
Ta struktura cząsteczki benzenu nie wyjaśniała wielu właściwości benzenu:
- dla benzenu charakterystyczne są reakcje podstawienia, a nie reakcje addycji charakterystyczne dla związków nienasyconych. Reakcje addycyjne są możliwe, ale są trudniejsze niż dla;
- benzen nie wchodzi w reakcje, które są reakcje jakościowe do węglowodorów nienasyconych (z wodą bromową i roztworem KMnO 4).
Późniejsze badania dyfrakcji elektronów wykazały, że wszystkie wiązania między atomami węgla w cząsteczce benzenu mają tę samą długość 0,140 nm (średnia wartość między długością prostego Połączenia C-C 0,154 nm i podwójne wiązanie C=C 0,134 nm). Kąt między wiązaniami na każdym atomie węgla wynosi 120°. Cząsteczka jest regularnym płaskim sześciokątem.
Współczesna teoria do wyjaśnienia budowy cząsteczki C 6 H 6 wykorzystuje koncepcję hybrydyzacji orbitali atomowych.
Atomy węgla w benzenie są w stanie hybrydyzacji sp2. Każdy atom „C” tworzy trzy wiązania σ (dwa z atomami węgla i jedno z atomem wodoru). Wszystkie wiązania σ znajdują się na tej samej płaszczyźnie:
Każdy atom węgla ma jeden p-elektron, który nie uczestniczy w hybrydyzacji. Niezhybrydyzowane orbitale p atomów węgla znajdują się w płaszczyźnie prostopadłej do płaszczyzny wiązań σ. Każda chmura p nakłada się na dwie sąsiednie chmury p, w wyniku czego powstaje pojedynczy sprzężony układ π (przypomnijmy sobie efekt koniugacji p-elektronów w cząsteczce 1,3-butadienu, omówiony w temacie „Dien węglowodory”):
Połączenie sześciu wiązań σ z jednym układem π nazywa się wiązanie aromatyczne.
Pierścień składający się z sześciu atomów węgla połączonych wiązaniem aromatycznym nazywa się pierścień benzenowy, lub jądro benzenu.
Zgodnie ze współczesnymi pomysłami dotyczącymi struktury elektronowej benzenu cząsteczka C 6 H 6 jest przedstawiona w następujący sposób:

Właściwości fizyczne benzenu
Benzen w normalnych warunkach jest bezbarwną cieczą; t opl = 5,5 o C; pominąć. = 80 około C; ma charakterystyczny zapach; niemieszalny z wodą, dobry rozpuszczalnik, wysoce toksyczny.
Właściwości chemiczne benzenu
Wiązanie aromatyczne określa właściwości chemiczne benzenu i innych węglowodorów aromatycznych.
Układ 6π-elektronowy jest bardziej stabilny niż konwencjonalne dwuelektronowe wiązania π. Dlatego reakcje addycji są mniej typowe dla węglowodorów aromatycznych niż dla węglowodorów nienasyconych. Najbardziej typowe dla arenów są reakcje podstawienia.
i. Reakcje podstawienia
1. Halogenowanie

2. Nitrowanie
Reakcję prowadzi się mieszaniną kwasów (mieszanina azotująca): 
3. Sulfonacja

4. Alkilacja (zastąpienie atomu „H” grupą alkilową) - Reakcje Friedla-Craftsa powstają homologi benzenu:

Zamiast haloalkanów można zastosować alkeny (w obecności katalizatora - AlCl 3 lub kwasu nieorganicznego):

II. Reakcje dodawania
1. Uwodornienie

2. Dodatek chloru

III.Reakcje utleniania
1. Spalanie
2C6H6 + 15O2 → 12CO2 + 6H2O
2. Nie całkowite utlenienie (KMnO 4 lub K 2 Cr 2 O 7 w środowisku kwaśnym). Pierścień benzenowy jest odporny na czynniki utleniające. Reakcja nie zachodzi.
Zdobywanie benzenu
W przemyśle:
1) przerób ropy naftowej i węgla;
2) odwodornienie cykloheksanu:

3) dehydrocyklizacja (aromatyzacja) heksanu:

W laboratorium:
Fuzja soli kwasu benzoesowego z:

Izomeria i nazewnictwo homologów benzenu
Każdy homolog benzenowy ma łańcuch boczny, tj. rodniki alkilowe przyłączone do pierścienia benzenowego. Pierwszy homolog benzenu to jądro benzenowe połączone z rodnikiem metylowym: 
Toluen nie ma izomerów, ponieważ wszystkie pozycje w pierścieniu benzenowym są równoważne.
Dla kolejnych homologów benzenu możliwy jest jeden rodzaj izomerii - izomeria łańcucha bocznego, która może mieć dwa typy:
1) izomeria liczby i struktury podstawników;
2) izomeria pozycji podstawników.



Właściwości fizyczne toluenu
Toluen- bezbarwna ciecz o charakterystycznym zapachu, nierozpuszczalna w wodzie, rozpuszczalna w rozpuszczalnikach organicznych. Toluen jest mniej toksyczny niż benzen.
Właściwości chemiczne toluenu
i. Reakcje podstawienia
1. Reakcje z udziałem pierścienia benzenowego
Metylobenzen wchodzi we wszystkie reakcje substytucji, w których bierze udział benzen, a jednocześnie wykazuje większą reaktywność, reakcje przebiegają szybciej.
Rodnik metylowy zawarty w cząsteczce toluenu jest podstawnikiem rodzaju, dlatego w wyniku reakcji podstawienia w jądrze benzenu otrzymuje się orto- i para-pochodne toluenu lub, przy nadmiarze odczynnika, tri-pochodne ogólnego wzoru:

a) halogenowanie


Po dalszym chlorowaniu otrzymuje się dichlorometylobenzen i trichlorometylobenzen:

II. Reakcje dodawania
uwodornienie

III.Reakcje utleniania
1. Spalanie
C6H5 CH3 + 9O2 → 7CO2 + 4H2O
2. Niepełne utlenianie
W przeciwieństwie do benzenu, jego homologi są utleniane przez niektóre środki utleniające; w tym przypadku łańcuch boczny ulega utlenieniu, w przypadku toluenu grupa metylowa. Łagodne utleniacze, takie jak MnO 2, utleniają go do grupy aldehydowej, silniejsze utleniacze (KMnO 4) powodują dalsze utlenianie do kwasu: 
Każdy homolog benzenu z jednym łańcuchem bocznym jest utleniany silnym środkiem utleniającym, takim jak KMnO4 do kwasu benzoesowego, tj. występuje przerwa w łańcuchu bocznym z utlenianiem jego odciętej części do CO 2; Na przykład: 
W obecności kilku łańcuchów bocznych każdy z nich ulega utlenieniu do grupy karboksylowej, w wyniku czego powstają wielozasadowe kwasy, np.:

Uzyskiwanie toluenu:
W przemyśle:
1) przerób ropy naftowej i węgla;
2) odwodornienie metylocykloheksanu:

3) dehydrocyklizacja heptanu:
W laboratorium:
1) alkilacja Friedla-Craftsa;
2) Reakcja Wurtza-Fittiga(reakcja sodu z mieszaniną halobenzenu i haloalkanu).
Pierwsza grupa reakcji to reakcje podstawienia. Powiedzieliśmy, że areny nie mają wiązań wielokrotnych w strukturze molekularnej, ale zawierają sprzężony układ sześciu elektronów, który jest bardzo stabilny i daje dodatkową siłę pierścieniowi benzenowemu. Dlatego w reakcjach chemicznych następuje przede wszystkim podstawienie atomów wodoru, a nie zniszczenie pierścienia benzenowego.
W przypadku alkanów spotkaliśmy się już z reakcjami substytucji, ale dla nich reakcje te przebiegały zgodnie z mechanizmem radykalnym, podczas gdy areny charakteryzują się jonowym mechanizmem reakcji substytucji.
Pierwszy właściwość chemiczna - halogenowanie. Zastąpienie atomu wodoru atomem halogenu - chlorem lub bromem.
Reakcja przebiega po podgrzaniu i zawsze przy udziale katalizatora. W przypadku chloru może to być chlorek glinu lub trzy chlorek żelaza. Katalizator polaryzuje cząsteczkę halogenu, co powoduje zerwanie wiązań heterolitycznych i otrzymanie jonów.
Dodatnio naładowany jon chlorkowy reaguje z benzenem.
Jeśli reakcja zachodzi z bromem, wówczas jako katalizator działa trójbromek żelaza lub bromek glinu.

Należy zauważyć, że reakcja zachodzi z bromem cząsteczkowym, a nie z wodą bromową. Benzen nie reaguje z wodą bromową.
Halogenowanie homologów benzenowych ma swoją własną charakterystykę. W cząsteczce toluenu grupa metylowa ułatwia substytucję w pierścieniu, wzrasta reaktywność, a reakcja przebiega w łagodniejszych warunkach, czyli już w temperaturze pokojowej.

Należy zauważyć, że podstawienie zawsze występuje w pozycjach orto i para, więc otrzymuje się mieszaninę izomerów.
Drugi właściwość - nitrowanie benzenu, wprowadzenie grupy nitrowej do pierścienia benzenowego.

Powstaje ciężka żółtawa ciecz o zapachu gorzkich migdałów - nitrobenzen, więc reakcja może być jakościowa dla benzenu. Do nitrowania stosuje się mieszaninę nitrującą stężonych kwasów azotowego i siarkowego. Reakcję prowadzi się przez ogrzewanie.
Przypomnę, że do nitrowania alkanów w reakcji Konowałowa zastosowano rozcieńczony kwas azotowy bez dodatku kwasu siarkowego.
Podczas nitrowania toluenu, a także podczas halogenowania powstaje mieszanina izomerów orto i para.

Trzeci właściwość - alkilowanie benzenu haloalkanami.

Ta reakcja umożliwia wprowadzenie rodnika węglowodorowego do pierścienia benzenowego i może być uważana za metodę otrzymywania homologów benzenowych. Jako katalizator stosuje się chlorek glinu, który sprzyja rozkładowi cząsteczki haloalkanu na jony. Potrzebuje również ogrzewania.
Czwarty właściwość - alkilowanie benzenu alkenami.

W ten sposób można otrzymać na przykład kumen lub etylobenzen. Katalizatorem jest chlorek glinu.
2. Reakcje addycji do benzenu
Druga grupa reakcji to reakcje addycji. Powiedzieliśmy, że te reakcje nie są charakterystyczne, ale są możliwe w dość trudnych warunkach, przy zniszczeniu chmury pi-elektronowej i utworzeniu wiązań sześciosigma.
Piąty właściwość na liście ogólnej - uwodornienie, dodanie wodoru.

Temperatura, ciśnienie, katalizator niklowy lub platynowy. Toluen może reagować w ten sam sposób.
szósty właściwość - chlorowanie. Należy pamiętać, że mówimy konkretnie o interakcji z chlorem, ponieważ brom nie wchodzi w tę reakcję.
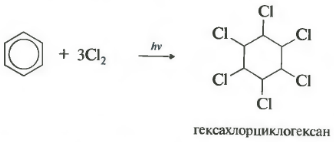
Reakcja przebiega pod wpływem twardego promieniowania ultrafioletowego. Powstaje heksachlorocykloheksan, inna nazwa heksachloranu, ciało stałe.
Należy pamiętać, że w przypadku benzenu niemożliwe reakcje addycji halogenków wodoru (hydrohalogenowanie) i dodatku wody (hydratacja).
3. Substytucja w łańcuchu bocznym homologów benzenowych
Trzecia grupa reakcji dotyczy tylko homologów benzenu - jest to substytucja w łańcuchu bocznym.
siódmy właściwością na liście ogólnej jest halogenowanie przy atomie węgla alfa w łańcuchu bocznym.

Reakcja zachodzi po podgrzaniu lub napromieniowaniu i zawsze tylko na węglu alfa. W miarę kontynuowania halogenowania drugi atom halogenu powróci do pozycji alfa.
4. Utlenianie homologów benzenu
Czwarta grupa reakcji to utlenianie.
Pierścień benzenowy jest zbyt mocny, więc benzen nie utlenia się nadmanganian potasu - nie odbarwia swojego roztworu. Bardzo ważne jest, aby o tym pamiętać.
Z drugiej strony homologi benzenu utleniają się po podgrzaniu zakwaszonym roztworem nadmanganianu potasu. I to jest ósma właściwość chemiczna.

Okazuje się, że kwas benzoesowy. Obserwuje się odbarwienie roztworu. W tym przypadku, bez względu na długość łańcucha węglowego podstawnika, zawsze pęka po pierwszym atomie węgla, a atom alfa utlenia się do grupy karboksylowej z wytworzeniem kwasu benzoesowego. Reszta cząsteczki jest utleniana do odpowiedniego kwasu lub, jeśli jest to tylko jeden atom węgla, do dwutlenku węgla.
Jeśli homolog benzenowy ma więcej niż jeden podstawnik węglowodorowy w pierścieniu aromatycznym, to utlenianie przebiega według tych samych zasad – utlenia się węgiel w pozycji alfa.

W tym przykładzie otrzymuje się dwuzasadowy kwas aromatyczny, który nazywa się kwasem ftalowym.
W szczególny sposób zwracam uwagę na utlenianie kumenu, izopropylobenzenu, tlenem atmosferycznym w obecności kwasu siarkowego.

Jest to tak zwana metoda kumenu do produkcji fenolu. Z reguły z tą reakcją mamy do czynienia w sprawach związanych z produkcją fenolu. To jest sposób przemysłowy.
dziewiąty właściwość - spalanie, całkowite utlenianie tlenem. Benzen i jego homologi spalają się do dwutlenku węgla i wody.
Napiszmy równanie spalania benzenu w postaci ogólnej.
Zgodnie z prawem zachowania masy, z lewej strony powinno być tyle atomów, ile atomów z prawej. Bo przecież w reakcjach chemicznych atomy nigdzie nie idą, a kolejność wiązań między nimi po prostu się zmienia. Będzie więc tyle cząsteczek dwutlenku węgla, ile jest atomów węgla w cząsteczce areny, ponieważ cząsteczka zawiera jeden atom węgla. To jest n cząsteczek CO 2 . Będzie o połowę mniej cząsteczek wody niż atomów wodoru, czyli (2n-6)/2, co oznacza n-3.
Po lewej i po prawej stronie jest taka sama liczba atomów tlenu. Po prawej jest 2n z dwutlenku węgla, ponieważ w każdej cząsteczce są dwa atomy tlenu plus n-3 z wody, co daje w sumie 3n-3. Po lewej stronie jest taka sama liczba atomów tlenu - 3n-3, co oznacza, że cząsteczek jest o połowę mniej, ponieważ cząsteczka zawiera dwa atomy. To znaczy (3n-3)/2 cząsteczki tlenu.
W ten sposób zestawiliśmy równanie spalania homologów benzenu w postaci ogólnej.
PRTSVSH (F) FGBOU VPO
Departament „Bezpieczeństwa Pożarowego”
Test
w dyscyplinie „Teoria spalania i wybuchów”
Zadanie numer 1
Określ konkretne teoretyczne ilości i objętość powietrza wymagane do całkowitego spalenia oparów benzenu. Warunki w jakich znajduje się powietrze charakteryzują temperatura Tv i ciśnienie Pv, a pary benzenu temperatura Tg i ciśnienie Pg. Wyraź wyniki obliczeń w następujących jednostkach: ; ;;;
Dane wyjściowe (N - numer grupy, n - numer wg spisu uczniów:
TV=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 K
Pv \u003d? 10 3 \u003d 95900 Pa;
Тg=300?(?1) N?2?N?(?1) n?0,2?n= 321,6 K;
Pr \u003d? 10 3 \u003d 79400 Pa.
С6Н6+7,5О2+7,5–3,76N2=6CO2+3pO+7,5–3,76N2+Qp (1),
gdzie Qp - ciepło Reakcja chemiczna. Z tego równania można wyznaczyć współczynniki stechiometryczne benzenu i tlenu cząsteczkowego: Vg = 1, V0 = 7,5
2. Określona teoretyczna ilość powietrza - liczbę kilomoli powietrza potrzebną do całkowitego spalenia jednego kilomolu benzenu oblicza się według wzoru:
gdzie 4,76 to ilość powietrza zawierającego jednostkę tlenu, \u003d to stosunek współczynników stechiometrycznych tlenu cząsteczkowego (Vo) i benzenu (Vg)
Podstawiając w (d) wartości Vo i Vg otrzymujemy:
3. Objętość powietrza potrzebną do całkowitego spalenia jednego kilomola benzenu określa się w następujący sposób:
gdzie jest objętość jednego kilomola powietrza o temperaturze Tv i ciśnieniu Pv. Wartość oblicza się ze wzoru
gdzie 22,4 to molowa objętość gazu w normalnych warunkach, Po = 101325 Pa to normalne ciśnienie, To = 273 K to normalna temperatura.
Zastępując Tv, To, Pv, Po w (5), otrzymujemy
Konkretną teoretyczną objętość powietrza oblicza się ze wzoru (4):
4. Objętość powietrza potrzebną do całkowitego spalenia jednostki objętości paliwa gazowego określa się w następujący sposób:
gdzie jest objętość jednego kilomola paliwa - pary benzenu o temperaturze Tg i ciśnieniu Pg. Jeśli się uwzględni
i podstawiając (8) i (5) do (7), otrzymujemy następujące wyrażenie dla określonej teoretycznej objętości powietrza:
Obliczamy wartość tego parametru procesu spalania:
Objętość powietrza potrzebna do całkowitego spalenia jednego kilograma benzenu określa się w następujący sposób:
gdzie - masa molowa paliwa to masa jednego kilomola benzenu, wyrażona w kilogramach. Masa molowa benzenu jest liczbowo równa jego masie cząsteczkowej, którą określa wzór:
Ac?nc + An?nn, UiAi?ni (11)
gdzie Ac i An to masy atomowe węgla i wodoru, nc i nn to liczba atomów węgla w cząsteczce benzenu. Zastępując wartości Ac = 12, nc = 6, An = 1, nn = 6, otrzymujemy:
Określoną teoretyczną objętość powietrza znajdujemy zastępując wartości n we wzorze (10):
Wynik obliczeń:
Zadanie numer 2
Określ konkretną teoretyczną ilość, objętość i skład produktów spalania benzenu, jeśli znany jest współczynnik nadmiaru powietrza c, temperatura Tp i ciśnienie Pp produktów spalania, temperatura Tg i ciśnienie Pg oparów benzenu. Wyraź wyniki obliczeń w ułamkach molowych (w procentach) iw następujących jednostkach: ; ;;
Wstępne dane:
c=1,5+(a1) N<0,1 Rp \u003d? 10 3 \u003d 68400 Pa; Tp=1600a(a1) Ny20aNa(a1) n a2n = 1816 K; Тg=273?(?1) N?2?N+(?1) n?0,2?n = 295,4 K; Rg \u003d? 10 3 \u003d 111600 Pa; roztwór (N=11, n=2). 1. Piszemy równanie stechiometryczne reakcji spalania benzenu w powietrzu: C6H6 +7,5O2 +7,5?3,76N2 \u003d 6CO2 + 3H2O + 7,5?3,76N2 + Qp, (1) gdzie Qp jest ciepłem reakcji chemicznej. Z tego równania wyznaczamy następujące współczynniki stechiometryczne: V CO2 \u003d 6, V pO \u003d 3, V C6H6 \u003d 1, V O2 \u003d 7,5, V N2 \u003d 7,5? 3,76 2. Określ szacunkową ilość produktów spalania jednego kilomola paliwa: Zastępując w (2) wartości współczynników stechiometrycznych produktów spalania i paliwa otrzymujemy: 3. Konkretną teoretyczną ilość powietrza - liczbę kilomoli powietrza niezbędną do całkowitego spalenia jednego kilomola paliwa określamy za pomocą wzoru: Gdzie 4,76 to ilość powietrza zawierająca jednostkę tlenu, Stosunek współczynników stechiometrycznych tlenu cząsteczkowego i benzenu. Zastępując w (4) wartości V O2 =7,5 i V C6H6 =1 otrzymujemy: 4. Nadmiar powietrza, który pada na 1 Kmol paliwa, określa wyrażenie: powietrze do spalania pary benzenu Podstawiając w tym wyrażeniu wartości 37,7(0,2-1)=30,16(7) 5. Całkowitą ilość produktów spalania na jednostkę ilości substancji paliwowej określa suma: Po podstawieniu wartości i otrzymujemy: 6. Ułamki molowe produktów spalania, wyrażone w procentach, określa się w następujący sposób: We wzorach (9) dla ułamków molowych azotu i tlenu w produktach spalania 0,79 i 0,21 to ułamki molowe tych substancji w powietrzu, których nadmiar prowadzi do wzrostu udziału azotu i pojawienia się tlenu w produktach spalania. 7. Aby określić konkretne objętości i produkty spalania, należy obliczyć ich objętość molową - objętość jednego kilomola gazu w warunkach, w których znajdują się produkty: gdzie 22,4 to objętość jednego kilomola gazu w normalnych warunkach, T 0 \u003d 273 K - normalna temperatura, Po \u003d 101325 Pa - normalne ciśnienie. Zastępując w (10) wartości Po, To, otrzymujemy: Objętość produktów, które powstają podczas spalania jednego kilograma paliwa, z wyłączeniem nadmiaru powietrza, oblicza się w następujący sposób: gdzie - masa molowa paliwa to masa jednego kilomola benzenu, wyrażona w kilogramach. Masę molową benzenu określa wzór: gdzie Ac i An to masy atomowe węgla (12) i wodoru (1), n c i n n to liczby atomów węgla (6) i wodoru (6) w cząsteczkach benzenu (C 6 H 6). Podstawiając wartości i w (12) otrzymujemy Nadmiar powietrza na 1 kilogram paliwa określa się w następujący sposób: gdzie jest objętość jednego kilomola nadmiaru powietrza, który jest częścią produktów spalania. Ponieważ temperatura i ciśnienie nadmiaru powietrza odpowiadają temperaturze i ciśnieniu produktów spalania, to \u003d \u003d 220,7. Podstawiając tę wartość, podobnie jak w (14), otrzymujemy: Aby obliczyć określoną objętość produktów całkowitego spalania paliwa, zakładamy, że pary benzenu mają temperaturę Tg przy ciśnieniu: gdzie jest objętość jednego kilomola pary benzenu w temperaturze Tg i ciśnieniu Pg. Molową objętość paliwa oblicza się według wzoru: Podstawiając otrzymaną wartość i takie wartości w (17), otrzymujemy: Nadmiar powietrza na metr sześcienny pary benzenu określa się w następujący sposób: Podstawienie w (20) wartościach \u003d 30,16 , \u003d i daje następujący wynik: Całkowita objętość właściwa produktów spalania, z uwzględnieniem nadmiaru powietrza, jest określona przez sumę Wynik obliczeń: X CO2 \u003d%; X H2O \u003d 4,4%; X N2 =%; X O2 \u003d 11,7% Obliczenie współczynnika palności nitrobenzenu C6H5NO2 i dwusiarczku węgla CS2. Równanie reakcji spalania octanu propylu w powietrzu. Obliczanie objętości powietrza i produktów spalania podczas spalania gazu palnego. Oznaczanie temperatury zapłonu toluenu według wzoru V. Blinova. test, dodano 04.08.2017 Obliczanie objętości powietrza i produktów spalania powstałych podczas spalania substancji. Równanie reakcji spalania glikolu etylenowego w powietrzu. Spalanie mieszaniny gazów palnych. Obliczanie temperatury spalania adiabatycznego dla mieszaniny stechiometrycznej. spalanie propanolu. test, dodano 17.10.2012 Rodzaj spalania i jego główne parametry. Chemiczna konwersja paliwa i utleniacza na produkty spalania. Równania materiału i bilansu cieplnego reakcji spalania. Wpływ współczynnika nadmiaru powietrza na skład produktów spalania i temperaturę spalania. test, dodano 17.01.2013 Wyznaczenie objętości powietrza potrzebnej do całkowitego spalenia masy jednostkowej substancji palnej. Skład produktów spalania o masie jednostkowej substancji palnej. Granice rozprzestrzeniania się płomienia mieszanin gazowych, parowych, pyłowo-powietrznych. Wybuchowe ciśnienie rozkładu. praca semestralna, dodana 23.12.2013 Opracowanie środków zapobiegania powstawaniu pożarów i wybuchów, ocena warunków ich rozwoju i tłumienia. Pojęcie wskaźnika wypalenia, sposób jego definiowania. Procedura zestawiania równania reakcji spalania. Obliczanie objętości powietrza potrzebnego do zapłonu. praca semestralna, dodana 7.10.2014 Oznaczanie składu produktów całkowitego spalania gazu. Obliczanie adiabatycznej temperatury spalania mieszaniny gazów przy stałej objętości i stałym ciśnieniu. Stałe reakcji kinetycznej samozapłonu gazu ziemnego. Granica zapłonu mieszanki gazowej. praca semestralna, dodana 19.02.2014 Charakterystyka przemysłowych metod alkilowania benzenu propylenem. Zasady alkilowania benzenu olefinami w technologii chemicznej. Problemy projektowania instalacji technologicznych do alkilowania benzenu. Opis technologii procesu produkcyjnego. praca dyplomowa, dodana 15.11.2010 Spalanie to potężny proces utleniania. Rodzaje spalania: tlenie i palenie płomieniem. Eksplozja jak szczególny przypadek palenie. Właściwości elektryczne płomienia. Różnorodność produktów spalania w wyniku niepełnego spalania paliwa. Filtracja dymu przez wodę. praca naukowa, dodano 29.07.2009 Wyznaczenie ilości powietrza potrzebnej do całkowitego spalenia danej ilości propanu. Obliczanie zmiany entalpii, entropii i energii Gibbsa z wykorzystaniem konsekwencji prawa Hessa. Wyznaczanie równoważników masy molowej środka utleniającego i środka redukującego. test, dodano 08.02.2012 Metody określania zużycia oleju absorpcyjnego, stężenie benzenu w oleju absorpcyjnym opuszczającym absorber. Obliczanie średnicy i wysokości pakowanego absorbera. Wyznaczenie wymaganej powierzchni grzewczej w kostce kolumny oraz zużycia pary grzewczej.Podobne dokumenty