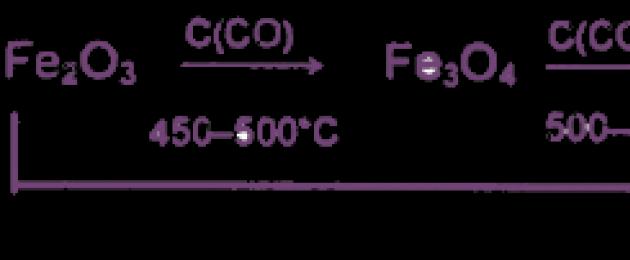Människokroppen innehåller cirka 5 g järn, mest av det (70 %) är en del av blodhemoglobinet.
Fysikaliska egenskaper
I sitt fria tillstånd är järn en silvervit metall med en gråaktig nyans. Rent järn är segt och har ferromagnetiska egenskaper. I praktiken används vanligtvis järnlegeringar - gjutjärn och stål.
Fe är det viktigaste och mest förekommande elementet av de nio d-metallerna i grupp VIII-undergruppen. Tillsammans med kobolt och nickel bildar den "järnfamiljen".
När man bildar föreningar med andra element använder den ofta 2 eller 3 elektroner (B = II, III).
Järn, som nästan alla d-element i grupp VIII, uppvisar inte en högre valens som är lika med gruppnumret. Dess maximala valens når VI och uppträder extremt sällan.
De mest typiska föreningarna är de där Fe-atomerna är i oxidationstillstånd +2 och +3.
Metoder för att få järn
1. Tekniskt järn (legerat med kol och andra föroreningar) erhålls genom karbotermisk reduktion av dess naturliga föreningar enligt följande schema:

Återhämtning sker gradvis, i 3 steg:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3FeO + CO 2
3) FeO + CO = Fe + CO 2
Gjutjärnet som härrör från denna process innehåller mer än 2 % kol. Därefter används gjutjärn för att tillverka stål - järnlegeringar som innehåller mindre än 1,5 % kol.
2. Mycket rent järn erhålls på något av följande sätt:
a) nedbrytning av Fe pentakarbonyl
Fe(CO)5 = Fe + 5СО
b) reduktion av ren FeO med väte
FeO + H2 = Fe + H2O
c) elektrolys av vattenlösningar av Fe+2-salter
FeC 2 O 4 = Fe + 2CO 2
järn(II)oxalat
Kemiska egenskaper
Fe är en metall med medelhög aktivitet och uppvisar allmänna egenskaper som är karakteristiska för metaller.
En unik egenskap är förmågan att "rosta" i fuktig luft:
I frånvaro av fukt med torr luft, börjar järn att reagera märkbart först vid T > 150°C; vid kalcinering bildas "järnskal" Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
Järn löser sig inte i vatten i frånvaro av syre. Vid mycket höga temperaturer reagerar Fe med vattenånga och ersätter väte från vattenmolekyler:
3Fe + 4H2O(g) = 4H2
Mekanismen för rost är elektrokemisk korrosion. Rostprodukten presenteras i en förenklad form. Faktum är att ett löst lager av en blandning av oxider och hydroxider med varierande sammansättning bildas. Till skillnad från Al 2 O 3-filmen skyddar inte detta lager järn från ytterligare förstörelse.
Typer av korrosion

Skyddar järn från korrosion

1. Interaktion med halogener och svavel vid höga temperaturer.
2Fe + 3Cl2 = 2FeCl3
2Fe + 3F 2 = 2FeF 3
Fe + I2 = FeI2
Föreningar bildas där den joniska typen av bindning dominerar.
2. Interaktion med fosfor, kol, kisel (järn förenas inte direkt med N2 och H2, utan löser upp dem).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = Fe x Si y
Ämnen med varierande sammansättning bildas, såsom berthollider (bindningens kovalenta natur dominerar i föreningarna)
3. Interaktion med "icke-oxiderande" syror (HCl, H 2 SO 4 dil.)
Feo + 2H+ → Fe2+ + H2
Eftersom Fe ligger i aktivitetsserien till vänster om väte (E° Fe/Fe 2+ = -0,44 V), kan den ersätta H 2 från vanliga syror.
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
4. Interaktion med "oxiderande" syror (HNO 3, H 2 SO 4 konc.)
Fe 0 - 3e - → Fe 3+
Koncentrerad HNO 3 och H 2 SO 4 "passiverar" järn, så vid vanliga temperaturer löses inte metallen i dem. Vid kraftig uppvärmning sker långsam upplösning (utan att frigöra H 2).
I avsnittet HNO 3 järn löses upp, går i lösning i form av Fe 3+ katjoner och syraanjonen reduceras till NO*:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Mycket löslig i en blandning av HCl och HNO3
5. Relation till alkalier
Fe löses inte i vattenlösningar av alkalier. Det reagerar med smält alkali endast vid mycket höga temperaturer.
6. Interaktion med salter av mindre aktiva metaller
Fe + CuS04 = FeS04 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Interaktion med gasformig kolmonoxid (t = 200°C, P)
Fe (pulver) + 5CO (g) = Feo (CO)5 järnpentakarbonyl
Fe(III)-föreningar
Fe 2 O 3 - järn(III)oxid.
Rödbrunt pulver, n. R. i H 2 O. I naturen - "röd järnmalm".
Metoder för att erhålla:
1) sönderdelning av järn(III)hydroxid
2Fe(OH)3 = Fe2O3 + 3H2O
2) pyritbränning
4FeS 2 + 11O 2 = 8SO 2 + 2Fe 2 O 3
3) nitratnedbrytning
Kemiska egenskaper
Fe 2 O 3 är en basisk oxid med tecken på amfotericitet.
I. Huvudegenskaperna manifesteras i förmågan att reagera med syror:
Fe2O3 + 6H+ = 2Fe3+ + ZH2O
Fe2O3 + 6HCI = 2FeCl3 + 3H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
II. Svaga syraegenskaper. Fe 2 O 3 löser sig inte i vattenlösningar av alkalier, men när det smälts samman med fasta oxider, alkalier och karbonater bildas ferriter:
Fe 2 O 3 + CaO = Ca(FeO 2) 2
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Fe 2 O 3 + MgCO 3 = Mg(FeO 2) 2 + CO 2
III. Fe 2 O 3 - råmaterial för framställning av järn inom metallurgi:
Fe 2 O 3 + ZS = 2Fe + ZSO eller Fe 2 O 3 + ZSO = 2Fe + ZSO 2
Fe(OH)3 - järn(III)hydroxid
Metoder för att erhålla:
Erhålls genom inverkan av alkalier på lösliga Fe 3+-salter:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Vid tidpunkten för beredningen är Fe(OH) 3 ett rödbrunt slemhinne-amorft sediment.
Fe(III)-hydroxid bildas också vid oxidation av Fe och Fe(OH) 2 i fuktig luft:
4Fe + 6H2O + 3O2 = 4Fe(OH) 3
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Fe(III)hydroxid är slutprodukten av hydrolysen av Fe3+-salter.
Kemiska egenskaper
Fe(OH) 3 är en mycket svag bas (mycket svagare än Fe(OH) 2). Visar märkbara sura egenskaper. Således har Fe(OH)3 en amfotär karaktär:
1) reaktioner med syror uppstår lätt:
2) färsk fällning av Fe(OH)3 löses i varm konc. lösningar av KOH eller NaOH med bildning av hydroxokomplex:
Fe(OH)3 + 3KOH = K3
I en alkalisk lösning kan Fe(OH) 3 oxideras till ferrater (salter av järnsyra H 2 FeO 4 frigörs inte i fritt tillstånd):
2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8H2O
Fe 3+ salter
De mest praktiskt viktiga är: Fe 2 (SO 4) 3, FeCl 3, Fe(NO 3) 3, Fe(SCN) 3, K 3 4 - gult blodsalt = Fe 4 3 Preussisk blått (mörkblått fällning)
b) Fe 3+ + 3SCN - = Fe(SCN) 3 tiocyanat Fe(III) (blodröd lösning)
Detaljer Kategori: Visningar: 9555 JÄRN, Fe, kemiskt element, atomvikt 55,84, atomnummer 26; belägen i grupp VIII periodiska systemet i nivå med kobolt och nickel, smältpunkt - 1529°C, kokpunkt - 2450°C; i fast tillstånd har den en blåaktig silverfärg. I sin fria form finns järn endast i meteoriter, som dock innehåller föroreningar av Ni, P, C och andra grundämnen. I naturen är järnföreningar utbredda överallt (jord, mineraler, djurhemoglobin, växtklorofyll), kap. arr. i form av oxider, hydrater av oxider och svavelföreningar samt järnkarbonat, av vilka de flesta järnmalmer består.
JÄRN, Fe, kemiskt element, atomvikt 55,84, atomnummer 26; belägen i grupp VIII periodiska systemet i nivå med kobolt och nickel, smältpunkt - 1529°C, kokpunkt - 2450°C; i fast tillstånd har den en blåaktig silverfärg. I sin fria form finns järn endast i meteoriter, som dock innehåller föroreningar av Ni, P, C och andra grundämnen. I naturen är järnföreningar utbredda överallt (jord, mineraler, djurhemoglobin, växtklorofyll), kap. arr. i form av oxider, hydrater av oxider och svavelföreningar samt järnkarbonat, av vilka de flesta järnmalmer består.
Kemiskt rent järn erhålls genom att värma upp järnoxalat, som vid 440°C först producerar matt järnoxidpulver, som har förmågan att antändas i luft (det så kallade pyrofora järnet); med den efterföljande reduktionen av denna oxid blir det resulterande pulvret grått till färgen och förlorar sina pyrofora egenskaper och förvandlas till metalliskt järn. När järnoxid reduceras vid 700°C frigörs järn i form av små kristaller som sedan smälts samman i vakuum. Ett annat sätt att erhålla kemiskt rent järn är genom elektrolys av en lösning av järnsalter, till exempel FeSO 4 eller FeCl 3 i en blandning med MgSO 4, CaCl 2 eller NH 4 Cl (vid temperaturer över 100°C). Men i detta fall blockerar järn en betydande mängd elektrolytiskt väte, som ett resultat av vilket det förvärvar hårdhet. Vid uppvärmning till 700°C frigörs väte, och järnet blir mjukt och kan skäras med en kniv, som bly (hårdhet på Mohs-skalan är 4,5). Mycket rent järn kan erhållas aluminotermiskt från ren järnoxid. (se Aluminiumtermi). Välformade järnkristaller är sällsynta. Oktaedriska kristaller bildas ibland i håligheterna i stora bitar av gjutjärn. En karakteristisk egenskap hos järn är dess mjukhet, duktilitet och formbarhet vid en temperatur som är betydligt lägre än dess smältpunkt. När den utsätts för starkt järn salpetersyra(som inte innehåller lägre kväveoxider), blir järn täckt med en beläggning av oxider och blir olösligt i salpetersyra.
Järnföreningar
Lätt att kombinera med syre, bildar järn flera oxider: FeO - järnoxid, Fe 2 O 3 - järnoxid, FeO 3 - järnsyraanhydrid och FeO 4 - superglandulär syraanhydrid. Dessutom bildar järn även en blandad oxid Fe 3 O 4 - järnoxid, den sk. järnoxid. I torr luft oxiderar dock inte järn; Rost är vattenhaltiga järnoxider som bildas med deltagande av luftfuktighet och CO 2 . Järnoxid FeO motsvarar hydratet Fe(OH) 2 och ett antal tvåvärda järnsalter som vid oxidation kan omvandlas till järnoxidsalter, Fe 2 O 3, där järn visar sig som ett trevärt grundämne; i luft, järnoxidhydrat, kännetecknad av stark restaurerande egenskaper, oxiderar lätt och förvandlas till järnoxidhydrat. Järnhydroxid är svagt löslig i vatten, och denna lösning har en klart alkalisk reaktion, vilket indikerar den grundläggande naturen hos tvåvärt järn. Järnoxid finns i naturen (se Rött bly), men det kan hittas på konstgjord väg. erhålls i form av ett rött pulver genom att kalcinera järnpulver och bränna svavelkis för att producera svaveldioxid. Vattenfri järnoxid, Fe 2 O 3, m.b. erhålls i två modifikationer, och övergången av en av dem till den andra sker vid uppvärmning och åtföljs av en betydande frigöring av värme (självuppvärmning). När den är starkt kalcinerad frigör Fe 2 O 3 syre och förvandlas till magnetisk oxidoxid, Fe 3 O 4. När alkalier verkar på lösningar av järnsalter, fälls en fällning av hydrat Fe 4 O 9 H 6 (2Fe 2 O 3 · 3H 2 O) ut; vid kokning med vatten bildas hydratet Fe 2 O 3 · H 2 O som är svårt att lösa i syror. Järn bildar föreningar med olika metalloider: med C, P, S, med halogener, såväl som med metaller, till exempel med Mn, Cr, W, Cu, etc.
Järnsalt delas in i järnsalter - tvåvärt järn (ferrosalter) och oxid - järn(III)järn (ferrisalter).
Järnhaltiga salter . Järnklorid, FeCl 2, erhålls genom inverkan av torrt klor på järn, i form av färglösa blad; När järn löses i HCl erhålls järnklorid i form av FeCl 2 ·4H 2 O-hydrat och används i form av vattenhaltiga eller alkoholhaltiga lösningar inom medicinen. Järnjodid, FeJ 2, erhålls från järn och jod under vatten i form av gröna blad och används inom medicin (Sirupus ferri jodati); med ytterligare verkan av jod bildas FeJ 3 (Liquor ferri sesquijodati).
Järnsulfat, järnsulfat, FeSO 4 · 7H 2 O (gröna kristaller) bildas i naturen som ett resultat av oxidation av pyrit och svavelkis; detta salt bildas också som en biprodukt vid framställning av alun; vid vittring eller upphettning till 300°C förvandlas det till vitt vattenfritt salt - FeSO4; bildar även hydrater med 5, 4, 3, 2 och 1 vattenpartiklar; löser sig lätt i kallt vatten (i varmt vatten upp till 300%); lösningen är sur på grund av hydrolys; oxiderar i luft, särskilt lätt i närvaro av ett annat oxiderande ämne, till exempel oxalatsalter, som FeSO 4 involverar i en konjugatoxidationsreaktion, missfärgar KMnO 4; i detta fall fortsätter processen enligt följande ekvation:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Fe2 (SO4)2 + 8H2O.
För detta ändamål används dock Mohrs dubbelsalt (NH 4) 2 Fe(SO 4) 2 6H 2 O, som är mer konstant i luften Järnsulfat används vid gasanalys för att bestämma kväveoxid som absorberas av en lösning av FeSO 4 med bildning av mörkbrun färg av (FeNO)SO 4-komplexet, och även för framställning av bläck (med garvsyror), som betningsmedel för färgning, för att binda stinkande gaser (H 2 S, NH 3) i latriner osv.
Järnoxidsalter används i fotografering på grund av deras förmåga att återställa silverföreningar i den latenta bilden som fångas på en fotografisk platta.
Järnkarbonat, FeCO 3 , förekommer naturligt som siderit eller järnspat; Järnkarbonat, erhållet genom utfällning av vattenhaltiga lösningar av järnsalter av järn med karbonater, förlorar lätt CO 2 och oxideras i luften till Fe 2 O 3.
Järnhaltigt bikarbonat, H 2 Fe(CO 3) 2, är lösligt i vatten och förekommer naturligt i järnhaltiga källor, från vilka det, när det oxideras, frigörs på jordens yta i form av järnoxidhydrat, Fe(OH) 3, som förvandlas till brun järnmalm.
Järnfosfat Fe3(PO4)28H2O, vit fällning; finns i naturen något färgad, på grund av oxidation av järn, blått, i form av vivianit.
Järnoxidsalter . Järnklorid, FeCl 3 (Fe 2 Cl 6), erhålls genom inverkan av överskott av klor på järn i form av hexagonala röda tabletter; järnklorid löses i luft; kristalliserar från vatten i form av FeCl3 6H2O (gula kristaller); lösningarna är sura; under dialys hydrolyserar den gradvis nästan till slutet med bildningen kolloidal lösning Fe(OH)3-hydrat. FeCl3 löser sig i alkohol och i en blandning av alkohol och eter, vid upphettning sönderdelas FeCl3·6H2O till HCl och Fe2O3; används som betningsmedel och som hemostatiskt medel (Liquor ferri sesquichlorati).
Järnsulfatoxid, Fe 2 (SO 4) 3, i vattenfritt tillstånd har den en gulaktig färg, den är starkt hydrolyserad i lösning; när lösningen upphettas fälls basiska salter ut; järnalun, MFe(SO 4) 2 12H 2 O, M - envärd alkalimetall; Ammoniumalun, NH 4 Fe(SO 4) 2 12H 2 O, kristalliserar bäst.
Oxiden FeO 3 är järnsyraanhydrid, liksom hydratet av denna oxid H 2 FeO 4 - järnsyra- i ett fritt tillstånd, inte möjligt. erhållna på grund av deras extrema bräcklighet; men i alkaliska lösningar kan det finnas salter av järnsyra, ferrater (till exempel K 2 FeO 4), som bildas när järnpulver värms upp med nitrat eller KClO 3. Det svårlösliga bariumsaltet av järnsyra BaFeO4 är också känt; Järnsyra är alltså i vissa avseenden mycket lik svavelsyra och kromsyra. 1926 beskrev Kiev-kemisten Goralevich föreningar av åttvärd järnoxid - supfererianhydrid FeO 4, erhållen genom att sammansmälta Fe 2 O 3 med nitrat- eller bertholletsalt i form av kaliumsalt av superglandulär syra K 2 FeO 5; FeO 4 är ett gasformigt ämne som inte bildar superglandulär syra H 2 FeO 5 med vatten, vilket dock kan. isolerad i fritt tillstånd genom sönderdelning av saltet K 2 FeO 5 med syror. Bariumsalt BaFeO 5 ·7H 2 O, samt kalcium- och strontiumsalter, erhölls av Goralevich i form av icke sönderfallande vita kristaller som släpper ut vatten först vid 250-300°C och samtidigt blir gröna.
Järn ger föreningar: med kväve - järnnitrösa(nitrid) Fe 2 N när järnpulver värms upp i en ström av NH 3, med kol - Fe 3 C-karbid när järn är mättat med kol i en elektrisk ugn. Dessutom har ett antal järnföreningar med kolmonoxid studerats - järnkarbonyler pentakarbonyl Fe(CO) 5 är till exempel en svagt färgad vätska med cirka 102,9 ° C (vid 749 mm, specifik vikt 1,4937), sedan orange fast Fe 2 (CO) 9, olöslig i eter och kloroform, med en specifik vikt av 2,085.
är av stor betydelse järncyanidföreningar. Förutom enkla cyanider Fe(CN) 2 och Fe(CN) 3 bildar järn ett antal komplexa föreningar med cyanidsalter, såsom salter av järnsvavelsyra H 4 Fe(CN) 6 och salter av järnsvavelsyra H 3 Fe(CN) 6, till exempel, rött blodsalt, som i sin tur inleder utbytesreaktioner med järn- och järnoxidsalter, vilket bildar färgade Blå färg föreningar - Preussian blue och Turnbull blue. När en CN-grupp i salterna av järnsulfidsyra H 4 Fe(CN) 6 ersätts med envärda grupper (NO, NO 2, NH 3, SO 3, CO) bildas Prusso-salter, t.ex. natriumnitroprussid (natriumnitroferro) sulfid) Na 2 2H 2 O, erhållen genom inverkan av rykande HNO 3 på K 4 Fe(CN) 6, följt av neutralisering med soda, i form av rubinröda kristaller, separerade genom kristallisation från det samtidigt bildade nitratet; motsvarande nitroferrisyra H2 kristalliserar också i form av mörkröda kristaller. Natriumnitroprussid används som ett känsligt reagens för vätesulfid och svavelmetaller, med vilket det ger en blodröd färg som sedan blir blå. När kopparsulfat reagerar med natriumnitroprussid bildas en blekgrön fällning, olöslig i vatten och alkohol, som används för att testa eteriska oljor.
Analytiskt detekteras järn genom verkan av dess salt, i en alkalisk lösning, gult blodsalt. Järnsalter bildar en blå fällning av preussisk blå. Järnsalter bildar en blå fällning av Turnbulls blå när de utsätts för rött blodsalt. Med ammoniumtiocyanat NH 4 CNS bildar järnsalter rhodant järn Fe(CNS) 3, lösligt i vatten med en blodröd färg; Med tannin bildar järnoxidsalter bläck. Kopparsalter av järnsulfidsyra, som finner användning (Uvachrome-metoden) i färgfotografering, utmärker sig också genom sin intensiva färg. Av de järnföreningar som används inom medicinen är förutom de nämnda järnhalogenidföreningarna följande viktiga: metalliskt järn (F. hydrogenio reductum), järncitrat (F. Citricum - 20% Fe), järnmalatextrakt (Extractum ferri pomatum) ), järnalbuminat ( Liquor ferri albuminatum), ferratin - en proteinförening med 6% järn; ferratos - en lösning av ferratin, karniferrin - en förening av järn med nuklein (30% Fe); ferratogen från jästnuklein (1% Fe), hematogen - 70% lösning av hemoglobin i glycerol, hemol - hemoglobin reducerat med zinkdamm.
Fysiska egenskaper hos järn
De numeriska data som finns tillgängliga i litteraturen som karakteriserar järns olika fysikaliska egenskaper fluktuerar på grund av svårigheten att få järn i ett kemiskt rent tillstånd. Därför är de mest tillförlitliga uppgifterna de som erhålls för elektrolytiskt järn, där det totala innehållet av föroreningar (C, Si, Mn, S, P) inte överstiger 0,01-0,03%. Uppgifterna nedan avser i de flesta fall sådan hårdvara. För den är smältpunkten 1528°C ± 3°C (Ruer och Klesper, 1914), och kokpunkten är ≈ 2450°C. I fast tillstånd finns järn i fyra olika modifikationer - α, β, γ och δ, för vilka följande temperaturgränser är ganska noggrant fastställda:

Övergången av järn från en modifiering till en annan detekteras på kyl- och värmekurvorna av kritiska punkter, för vilka följande beteckningar antas:

 Dessa kritiska punkter visas i fig. 1 schematisk värme- och kylkurvor. Förekomsten av modifieringar δ-, γ- och α-Fe anses för närvarande obestridlig, men den oberoende existensen av β-Fe är omtvistad på grund av den otillräckligt skarpa skillnaden mellan dess egenskaper och egenskaperna hos α-Fe. Alla modifieringar av järn kristalliserar i form av en kub, där α, β och δ har ett rumsligt gitter av en centrerad kub, och y-Fe har en kub med centrerade ytor. De mest distinkta kristallografiska egenskaperna hos järnmodifieringar erhålls i röntgenspektra, som visas i fig. 2 (Westgreen, 1929).
Dessa kritiska punkter visas i fig. 1 schematisk värme- och kylkurvor. Förekomsten av modifieringar δ-, γ- och α-Fe anses för närvarande obestridlig, men den oberoende existensen av β-Fe är omtvistad på grund av den otillräckligt skarpa skillnaden mellan dess egenskaper och egenskaperna hos α-Fe. Alla modifieringar av järn kristalliserar i form av en kub, där α, β och δ har ett rumsligt gitter av en centrerad kub, och y-Fe har en kub med centrerade ytor. De mest distinkta kristallografiska egenskaperna hos järnmodifieringar erhålls i röntgenspektra, som visas i fig. 2 (Westgreen, 1929).  Av de givna röntgenmönstren följer att för α-, β- och δ-Fe är linjerna i röntgenspektrumet desamma; de motsvarar ett gitter av en centrerad kub med parametrarna 2,87, 2,90 och 2,93 A, och för γ-Fe motsvarar spektrumet ett gitter av en kub med centrerade ytor och parametrar på 3,63-3,68 A.
Av de givna röntgenmönstren följer att för α-, β- och δ-Fe är linjerna i röntgenspektrumet desamma; de motsvarar ett gitter av en centrerad kub med parametrarna 2,87, 2,90 och 2,93 A, och för γ-Fe motsvarar spektrumet ett gitter av en kub med centrerade ytor och parametrar på 3,63-3,68 A.
Järns specifika vikt sträcker sig från 7,855 till 7,864 (Cross and Gill, 1927). Vid uppvärmning sjunker den specifika vikten av järn på grund av termisk expansion, för vilken koefficienterna ökar med temperaturen, som data i tabell 1 visar. 1 (Driesen, 1914).

Minskningen av expansionskoefficienter i intervallen 20-800°C, 20-900°C, 700-800°C och 800-900°C förklaras av anomalier i expansionen när de passerar genom de kritiska punkterna A C2 och A C3. Denna övergång åtföljs av kompression, särskilt uttalad vid punkt A C3, som visas av kompressions- och expansionskurvorna i fig. 3. Smältningen av järn åtföljs av dess expansion med 4,4 % (Gonda och Enda, 1926). Värmekapaciteten hos järn är ganska betydande jämfört med andra metaller och uttrycks för olika temperaturområden i värden från 0,11 till 0,20 Cal, som visas i tabell. 2 (Obergoffer och Grosse, 1927) och kurvan konstruerad på deras basis (Fig. 4).

 I de givna data detekteras omvandlingarna A 2 , A 3 , A 4 och smältningen av järn så tydligt att termiska effekter lätt kan beräknas för dem: A 3 ... + 6,765 Cal, A 4 ... + 2,531 Cal , smältande järn ... - 64,38 Cal (enligt S. Umino, 1926, - 69,20 Cal).
I de givna data detekteras omvandlingarna A 2 , A 3 , A 4 och smältningen av järn så tydligt att termiska effekter lätt kan beräknas för dem: A 3 ... + 6,765 Cal, A 4 ... + 2,531 Cal , smältande järn ... - 64,38 Cal (enligt S. Umino, 1926, - 69,20 Cal).
Järn kännetecknas av ungefär 6-7 gånger lägre värmeledningsförmåga än silver och 2 gånger mindre än aluminium; nämligen den termiska konduktiviteten hos järn är lika vid 0°C - 0,2070, vid 100°C - 0,1567, vid 200°C - 0,1357 och vid 275°C - 0,1120 Cal/cm·sek·°C. Mest karakteristiska egenskaper järn är magnetiska, uttryckta av ett antal magnetiska konstanter som erhålls under hela cykeln av magnetisering av järn. Dessa konstanter för elektrolytiskt järn uttrycks av följande värden i Gauss (Gumlich, 1909 och 1918):

När man passerar genom punkt A c2 försvinner nästan de ferromagnetiska egenskaperna hos järn och kan. upptäcktes endast med mycket exakta magnetiska mätningar. I praktiken anses β-, γ- och δ-modifieringar vara icke-magnetiska. Den elektriska ledningsförmågan för järn vid 20°C är lika med R -1 m m/mm 2 (där R är den elektriska resistansen för järn, lika med 0,099 Ω mm 2 /m). Temperaturkoefficienten för elektriskt motstånd a0-100° x10 5 sträcker sig från 560 till 660, där
![]()
 Kallbearbetning (valsning, smide, broschning, stämpling) har en mycket märkbar effekt på fysikaliska egenskaper ah järn. Sålunda uttrycks deras % förändring under kallvalsning av följande siffror (Gerens, 1911): koercitiv spänning +323 %, magnetisk hysteres +222 %, elektriskt motstånd + 2 %, specifik vikt - 1 %, magnetisk permeabilitet - 65 %. Den senare omständigheten klargör de betydande fluktuationer i fysikaliska egenskaper som observeras bland olika forskare: påverkan av föroreningar åtföljs ofta av påverkan av kall mekanisk bearbetning.
Kallbearbetning (valsning, smide, broschning, stämpling) har en mycket märkbar effekt på fysikaliska egenskaper ah järn. Sålunda uttrycks deras % förändring under kallvalsning av följande siffror (Gerens, 1911): koercitiv spänning +323 %, magnetisk hysteres +222 %, elektriskt motstånd + 2 %, specifik vikt - 1 %, magnetisk permeabilitet - 65 %. Den senare omständigheten klargör de betydande fluktuationer i fysikaliska egenskaper som observeras bland olika forskare: påverkan av föroreningar åtföljs ofta av påverkan av kall mekanisk bearbetning.
Mycket lite är känt om de mekaniska egenskaperna hos rent järn. Elektrolytiskt järn legerat i ett tomrum visade: draghållfasthet på 25 kg/mm2, töjning - 60%, tvärsnittskompression - 85%, Brinell-hårdhet - från 60 till 70.
Järns struktur beror på innehållet av föroreningar i det (även i små mängder) och förbehandlingen av materialet. Järns mikrostruktur består liksom andra rena metaller av mer eller mindre stora korn (kristalliter), här kallad ferrit


Storleken och skärpan på deras konturer beror på kap. arr. på järnets avkylningshastighet: ju lägre den senare är, desto mer utvecklade är kornen och desto skarpare konturer. På ytan är korn oftast olika färgade på grund av olika kristallografi, deras orientering och olika etsningseffekter av reagenser i olika riktningar i kristallen. Ofta är korn förlängda i en riktning som ett resultat av mekanisk bearbetning. Om bearbetningen skedde vid låga temperaturer, uppträder skjuvlinjer (Neumann-linjer) på kornens yta som ett resultat av glidning enskilda delar kristalliter längs deras klyvningsplan. Dessa linjer är ett av tecknen på härdning och de förändringar i egenskaper som nämndes ovan.
Järn i metallurgi
Termen järn i modern metallurgi hänförs endast till smidesjärn, d.v.s. en produkt med låg kolhalt som erhålls i degliknande tillstånd vid en temperatur som inte är tillräcklig för att smälta järnet, men så hög att dess individuella partiklar är väl svetsade till varandra , vilket ger en homogen mjuk produkt efter smide, accepterar inte härdning. Järn (i den angivna betydelsen av ordet) erhålls: 1) direkt från malm i degliknande tillstånd genom ostblåsningsprocessen; 2) på samma sätt, men vid en lägre temperatur, otillräcklig för svetsning av järnpartiklar; 3) omfördelning av gjutjärn genom en kritisk process; 4) omfördelning av gjutjärn genom pöl.
1) Ostproduktionsprocess för närvarande. tid används endast av okulterade folk och i områden där amerikanskt eller europeiskt järn erhållits från på moderna sätt. Processen utförs i öppna ostugnar och ugnar. Råmaterial Järnmalm (oftast brun järnmalm) och träkol används till det. Kol hälls i smedjan i den halva där sprängningen tillförs, medan malm hälls i en hög på motsatt sida. Kolmonoxid som bildas i ett tjockt lager av brinnande kol passerar genom hela malmens tjocklek och reducerar järn vid hög temperatur. Minskningen av malm sker gradvis - från ytan av enskilda bitar till kärnan. Börjar med övre delarna hög, den accelererar när malmen rör sig in i ett område med mer hög temperatur; I det här fallet omvandlas järnoxid först till magnetisk oxid, sedan till oxid, och slutligen uppträder metalliskt järn på ytan av malmbitarna. Samtidigt förenas malmens jordnära föroreningar (råberget) med den ännu inte reducerade järnoxiden och bildar en smältbar järnslagg, som smälts genom metallskalets sprickor, som bildar ett slags skal i varje bit. av malm. Dessa skal, som värms upp till vit-het värme, svetsar samman och bildar en svampig massa av järn i botten av ugnen - kritsa, genomsyrad av slagg. För att separera från det senare skärs kritsa som tagits från smedjan i flera delar, som var och en är smidd, kokad, efter kylning i samma smedja till remsor eller direkt till produkter (hushållsartiklar, vapen). I Indien utförs ostblåsningsprocessen fortfarande i ostblåsningsugnar, som skiljer sig från smedjor endast i sin något högre höjd - cirka 1,5 m. Ugnarnas väggar är gjorda av lermassa (inte tegel) och tjänar endast en smälta. Blästringen matas in i ugnen genom en munstycke med bälg som drivs av fötter eller händer. En viss mängd träkol (“tomt skal”) laddas i en tom ugn, och sedan växelvis, i separata lager, malm och kol, varvid mängden av det första gradvis ökar tills det når ett förhållande till kol som bestäms av erfarenhet; vikten av all fylld malm bestäms av den önskade vikten av kritsa, som i allmänhet är obetydlig. Restaureringsprocessen är densamma som i smedjan; järn är inte heller helt reducerat, och den resulterande kritsa på flanken innehåller mycket järnslagg. Krisan tas bort genom att bryta spisen och skära i bitar som väger 2-3 kg. Var och en av dem värms upp i en smedja och bearbetas under en hammare; resultatet är utmärkt mjukt järn, som bland annat fungerar som ett material för tillverkning av indiska stål "woots" (damaskstål). Dess sammansättning är följande (i%):
Det obetydliga innehållet av element - järnföroreningar - eller deras fullständiga frånvaro förklaras av malmens renhet, ofullständigheten i reduktionen av järn och den låga temperaturen i ugnen. På grund av den lilla storleken på smedjorna och ugnarna och frekvensen av deras drift är förbrukningen av träkol mycket hög. I Finland, Sverige och Ural smälte man järn i Husgavels ostugn, där det var möjligt att reglera processen för reduktion och mättnad av järn med kol; kolförbrukningen i den var upp till 1,1 per enhet järn, vars utbyte nådde 90 % av dess innehåll i malmen.
2) I framtiden bör vi förvänta oss utvecklingen av produktionen av järn direkt från malm, inte genom att använda ostblåsningsprocessen, utan genom att reducera järn vid en temperatur som är otillräcklig för bildning av slagg och till och med för sintring av avfallsmalm (1000 °C). Fördelarna med denna process är möjligheten att använda lågvärdiga bränslen, vilket eliminerar flöde och värmeförbrukning för att smälta slagg.
3) Produktionen av smidesjärn genom omfördelning av gjutjärn genom ugnsprocessen utförs i ugnarna i kap. arr. i Sverige (i vårt land - i Ural). För bearbetning smälts speciellt gjutjärn, den sk. Lancashire, ger minst avfall. Den innehåller: 0,3-0,45 % Si, 0,5-0,6 % Mn, 0,02 P,<0,01% S. Такой чугун в изломе кажется белым или половинчатым. Горючим в кричных горнах может служить только древесный уголь.
Processen pågår. arr.: smedjan, frigjord från degeln, men med den mogna slaggen av processens slut kvarvarande på bottenbrädet, fylls med kol, kap. arr. tall, på vilken gjutjärn uppvärmt av förbränningsprodukter placeras i en mängd av 165-175 kg (för 3/8 m 2 av härdens tvärsnitt finns det 100 kg gjutjärn). Genom att vrida ventilen i luftkanalen riktas sprängningen genom rör som är placerade i ugnens undervalvsutrymme och värms här till en temperatur på 150-200 ° C, vilket accelererar. smältande gjutjärn. Det smältande tackjärnet stöds ständigt (med hjälp av kofot) på kolet ovanför munstyckena. Under sådant arbete utsätts hela massan av gjutjärn för den oxidativa verkan av luftsyre och koldioxid, som passerar genom förbränningszonen i form av droppar. Deras stora yta bidrar till snabb oxidation av järn och dess föroreningar - kisel, mangan och kol. Beroende på innehållet av dessa föroreningar tappar gjutjärnet dem i större eller mindre utsträckning innan det samlas i botten av härden. Eftersom gjutjärn med låg kiselhalt och låg manganhalt bearbetas i en svensk smedja, förlorar det när det passerar genom tuyere-horisonten allt sitt Si och Mn (vars oxider bildar huvudslaggen med järnoxid) och en betydande del av kol. Smältning av gjutjärn varar 20-25 minuter. I slutet av denna process släpps kall sprängning in i smedjan. Metallen som har lagt sig på botten av härden börjar reagera med de mogna slaggerna som finns där, som innehåller ett stort överskott (jämfört med mängden kiseldioxid) av järnoxider - Fe 3 O 4 och FeO, som oxiderar kol med frigöring av kolmonoxid, vilket får hela metallen att koka. När metallen tjocknar (från förlust av kol) och "sitter som en vara", lyfts den senare med kofot ovanför munstyckena, varma sprängningar släpps igen och "varan" smälts.
Vid sekundärsmältning oxideras metallen av syre från både sprängningen och slaggen som smälts från den. Efter den första stigningen faller metall till botten av smedjan, mjuk nog att samla kritsa från några av dess mognaste delar. Men innan, när man använde kiselkvaliteter av gjutjärn, var det nödvändigt att tillgripa en andra och till och med tredje lyftning av varorna, vilket naturligtvis minskade smedjans produktivitet, ökade bränsleförbrukningen och järnavfallet. Resultatet av arbetet påverkades av avståndet mellan formorna från bottenbrädet (härdens djup) och formornas lutning: ju brantare formorna och ju grundare djupet på härden, desto större effekt har oxiderande atmosfär på metallen. En mjukare lutning av formorna, liksom ett större djup av härden, minskar den direkta effekten av syre i sprängningen, vilket ger en större roll åt slaggverkan på järnföroreningar; oxidation av dem är långsammare, men utan järnavfall. Under alla givna förhållanden bestäms den mest fördelaktiga positionen för formorna i förhållande till bottenplattan av erfarenhet; i en modern svensk smedja installeras formansöglan på ett avstånd av 220 mm från bottenplattan, och formornas lutning varierar inom nära gränser - från 11 till 12°.
Den resulterande kritsan i ugnens botten innehåller, till skillnad från ostblåsningsugnen, mycket lite mekaniskt medbringad slagg; När det gäller de kemiska föroreningarna av järn kan Si, Mn och C vara. helt avlägsnat (det försumbara innehållet av Si och Mn som indikeras genom analys är en del av den mekaniska föroreningen - slagg), och svavel avlägsnas endast delvis, oxideras av sprängningen under smältning. Samtidigt oxideras också fosfor och går in i slaggen i form av fosfor-järnsalt, men det senare reduceras sedan med kol, och den slutliga metallen kan innehålla ännu relativt sett mer fosfor (från järnavfall) än den ursprungliga gjutjärn. Därför använder Sverige, för att få förstklassig metall för export, endast gjutjärn som är rent P-mässigt. Den färdiga kritsa som tas ut ur smedjan skärs i tre delar (vardera 50-55 kg) och komprimeras under en hammare, vilket ger utseendet av en parallellepiped.
Varaktigheten av omfördelningsprocessen i den svenska smedjan är från 65 till 80 minuter; per dag visar det sig från 2,5 till 3,5 ton komprimerade bitar "för eld", med en förbrukning av träkol på endast 0,32-0,40 per enhet färdigt material och dess avkastning är från 89 till 93,5% av gjutjärnet som specificerats för bearbetning. Senast i Sverige genomfördes framgångsrika experiment med omfördelning av flytande tackjärn hämtat från masugnar, och med att påskynda kokningsprocessen genom att röra om metallen med hjälp av mekaniska krattor; samtidigt minskade avfallsförlusten till 7% och kolförbrukningen - till 0,25.
Följande data (i%) ger en uppfattning om den kemiska sammansättningen av svenskt och syduraljärn:
Av alla industriellt framställda järn är svenskt järn närmast kemiskt rent och används istället för det senare i laboratorieverksamhet och forskningsarbete. Det skiljer sig från råjärn i sin enhetlighet och från den mjukaste metallen med öppen härd (gjutjärn) i frånvaro av mangan; den kännetecknas av den högsta graden av svetsbarhet, duktilitet och formbarhet. Svenskt gjutjärn uppvisar låg draghållfasthet - endast cirka 30 kg/mm2, med en töjning på 40% och en minskning i tvärsnitt på 75%. För närvarande har den årliga produktionen av kryogent järn i Sverige sjunkit till 50 000 ton, sedan efter kriget 1914-18. Omfattningen av industriella tillämpningar för detta järn reducerades avsevärt. Den största mängden av det används för tillverkning (i England och Tyskland) av de högsta kvaliteterna av verktygs- och specialstål; i själva Sverige används den för att tillverka specialtråd (”blomtråd”), hästskospik, som lätt smids i kallt tillstånd, kedjor och remsämnen för svetsade rör. För de två sista ändamålen är egenskaperna hos gjutjärn särskilt viktiga: pålitlig svetsbarhet och för rör dessutom den högsta motståndskraften mot rost.
4) Utvecklingen av järnproduktionen som en kritisk process innebar förstörelse av skogar; efter att de sistnämnda i olika länder tagits under skydd av en lag som begränsade deras avverkning till årlig tillväxt, blev Sverige och sedan Ryssland - skogsbevuxna länder överflödande av högkvalitativa malmer - huvudleverantörerna av järn på den internationella marknaden under hela 1700-talet. . År 1784 uppfann engelsmannen Cort puddling - processen att omfördela gjutjärn på härden i en eldig ugn, i vars eldstad kol brändes. Efter Corts död införde Rogers och Gall betydande förbättringar i utformningen av pölugnen, vilket bidrog till den snabba spridningen av pöl i alla industriländer och helt förändrade arten och omfattningen av deras järnproduktion under första hälften av 1800-talet. Denna process producerade den massa metall som behövdes för konstruktion av järnfartyg, järnvägar, lok, ångpannor och bilar.
Bränslet för pöl är kol med långa lågor, men där det inte är tillgängligt var vi tvungna att ta till brunkol och här i Ural - ved. Ved vid tall ger en längre låga än kol; det värmer bra, men fukthalten i träet bör inte överstiga 12 %. Därefter användes en Siemens regenerativ ugn för att pöla i Ural. Slutligen, i USA och här (i Volga- och Kamabassängerna) arbetade pölugnar med olja som sprutades direkt in i ugnens arbetsutrymme.
För att påskynda bearbetningen och minska bränsleförbrukningen är det lämpligt att ha kallt gjutjärn; när man smälter den på koks producerar produkten dock mycket svavel (0,2 och till och med 0,3%) och med högt fosforinnehåll i malmen även fosfor. För vanliga kommersiella järnkvaliteter smältes tidigare sådant gjutjärn med låg kiselhalt (mindre än 1%), kallat tackjärn, i stora mängder. Träkolsgjutjärn, som bearbetades i Ural och centrala Ryssland, innehöll inte svavel och producerade en produkt som även användes för tillverkning av takjärn. För närvarande tjänar puddling till att producera högkvalitativ metall enligt speciella specifikationer, och därför levereras inte vanligt tackjärn till pölugnar, utan högkvalitativt tackjärn, till exempel mangan eller "hematit" (låg fosfor), eller omvänt , hög fosfor för produktion av nötjärn. Nedan är innehållet (i %) av huvudelementen i vissa typer av gjutjärn som används för pöl:

En pölugn, i slutet av föregående operation, har vanligtvis en normal mängd slagg på härden för att fungera med nästa laddning. Vid bearbetning av högkiselhaltigt gjutjärn blir det mycket slagg kvar i ugnen och den måste tömmas; tvärtom lämnar vitt gjutjärn "torra" under ugnen, och arbetet måste börja med att kasta den nödvändiga mängden slagg på undersidan, som tas från under hammaren ("mogen", den rikaste på magnetisk oxid). En laddning av gjutjärn, uppvärmd i en gjutjärnsgryta, kastas på slaggen (250-300 kg i vanliga ugnar och 500-600 kg i dubbla ugnar); sedan kastas en ny portion bränsle i eldstaden, gallren rengörs och fullt drag etableras i ugnen. Inom 25-35 minuter. gjutjärn smälter, genomgår b. eller m. en betydande förändring i dess sammansättning. Fast gjutjärn oxideras av lågans syre, och järn, mangan och kisel producerar dubbelsilikat, som rinner ner i ugnen; smältande gjutjärn exponerar fler och fler lager av fast gjutjärn, som också oxiderar och smälter. I slutet av smältperioden erhålls två flytande lager på härden - gjutjärn och slagg, på vars kontaktyta processen för oxidation av kol med magnetisk järnoxid inträffar, om än i svag utsträckning, vilket framgår av bubblor av kolmonoxid som frigörs från badet. Beroende på innehållet av kisel och mangan i gjutjärn finns en ojämn mängd av dem kvar i den smälta metallen: i kolgjutjärn med låg kiselhalt eller vitt gjutjärn - kokssmältning - kisel brinner i de flesta fall ut helt under smältning; ibland finns en viss mängd av det kvar i metallen (0,3-0,25%), liksom mangan. Fosfor oxiderar också vid denna tidpunkt och förvandlas till järnfosforsalt. På grund av minskningen av metallens vikt när de ovan nämnda föroreningarna brinner ut, kan den procentuella halten av kol till och med öka, även om en del av det utan tvekan förbränns av syre från lågan och slagg som täcker de första delarna av det smälta metall.
För att påskynda utbränningen av de återstående mängderna kisel, mangan och kol, tillgriper de puddling, det vill säga blandar gjutjärn med slagg med hjälp av en pinne med änden böjd i rät vinkel. Om metallen är flytande (grått gjutjärn, mycket kolhaltig) uppnår inte omrörning målet, och badet görs först tjockt genom att kasta kall mogen slagg i det, eller genom att minska draget, etableras ofullständig förbränning i ugnen , åtföljd av en mycket rökig låga (sjudande). Efter några minuter, under vilken kontinuerlig omrörning utförs, uppträder rikliga bubblor av brinnande kolmonoxid på ytan av badet - en produkt av oxidationen av gjutjärnskol av syret från magnetisk oxid löst i den huvudsakliga järnslaggen. När processen fortskrider intensifieras oxidationen av C och förvandlas till en våldsam "kokning" av hela metallmassan, vilket åtföljs av svullnad och en så betydande volymökning att en del av slaggen överskrider arbetshålens tröskel. När C brinner ut ökar metallens smältpunkt och för att kokningen ska fortsätta höjs temperaturen i ugnen kontinuerligt. Kokning avslutad vid låg temperatur ger en råprodukt, dvs. en kolhaltig, svampig massa av järn som inte är kapabel att svetsa; mogna varor "sitter" i en varm ugn. Processen för oxidation av järnföroreningar i en pölugn börjar på grund av slaggens syre, som är en legering av järnkiseldioxid (Fe 2 SiO 4) med magnetisk oxid och järnoxid av varierande sammansättning. I engelska ugnar uttrycks sammansättningen av oxidblandningen med formeln 5Fe 3 O 4 5 FeO; vid slutet av kokningen uttrycks förhållandet mellan oxider i den utarmade slaggen med formeln Fe 3 O 4 5FeO, dvs. 80 % av slaggens totala magnetiska oxid deltar i oxidationsprocessen. Oxidationsreaktioner kan. representeras av följande termokemiska ekvationer:

Som framgår av dessa ekvationer åtföljs oxidationen av Si, P och Mn av frigöring av värme och värmer därför upp badet, medan oxidationen av C under reduktionen av Fe 3 O 4 till FeO absorberar värme och därför kräver hög temperatur. Detta förklarar proceduren för att ta bort järnföroreningar och det faktum att kolutbränningen slutar snabbare i en varm ugn. Reduktionen av Fe 3 O 4 till metall sker inte, eftersom detta kräver en högre temperatur än den vid vilken "kokning" sker.
Den skrumpna "produkten", för att bli ett välsvetsat strykjärn, behöver fortfarande ångas: produkten lämnas i flera minuter i ugnen och då och då vänds den med kofot, och dess nedre delar placeras ovanpå; Under den kombinerade verkan av lågans syre och slaggen som genomsyrar hela massan av järn, fortsätter kolet att brinna ut vid denna tidpunkt. Så snart som en viss mängd välsvetsad metall erhålls, börjar crits att rullas ut ur den, vilket undviker onödig oxidation. Totalt, när varorna mognar, rullar de från 5 till 10 kr (högst 50 kg vardera); Kornen hålls (ångas) vid tröskeln i området för den högsta temperaturen och matas under hammaren för komprimering, vilket uppnår utsläpp av slagg och ger dem formen av en bit (sektion från 10x10 till 15x15 cm ), bekvämt att rulla i rullar. De som följer dem går vidare till platsen för de utfärdade kriterna, tills den sista. Varaktigheten av processen för produktion av högkvalitativ metall (fiberjärn) från moget (högkolhaltig) träkolgjutjärn i Ural var som följer: 1) gjutjärnsplantering - 5 minuter, 2) smältning - 35 minuter, 3) sjudning - 25 minuter, 4) pudling (blandning) - 20 min., 5) ångning av varorna - 20 min., 6) rullande och ångande crits - 40 min., 7) dispensering av crits (10-11 st.) - 20 min.; totalt - 165 min. När man arbetade på vitt gjutjärn, med vanligt kommersiellt järn, reducerades processens varaktighet (i Västeuropa) till 100 och till och med 75 minuter.
När det gäller resultatet av arbetet varierade de i olika metallurgiska regioner beroende på typen av bränsle, kvaliteten på gjutjärnet och vilken typ av järn som produceras. Uralugnar som arbetade på trä gav utbytet av användbart järn per 1 m 3 trä från 0,25 till 0,3 ton; Vår oljeförbrukning per enhet järn är 0,33, kol i europeiska ugnar är från 0,75 till 1,1. Den dagliga produktiviteten för våra stora ugnar (600 kg gjutjärn) vid arbete på torkad ved var 4-5 ton; utbytet av material lämpligt för tillverkning av takjärn var 95-93% av mängden gjutjärn som togs emot för bearbetning. I Europa är den dagliga produktiviteten för vanliga ugnar (avgift 250-300 kg) cirka 3,5 ton med ett avfall på 9%, och för högkvalitativt järn - 2,5 ton med ett avfall på 11%.
När det gäller kemisk sammansättning och fysikaliska egenskaper är pöl en mycket sämre produkt än å ena sidan gjutjärn och å andra sidan gjutjärn med öppen spis. De vanliga typerna av järn, som tidigare framställts i Västeuropa, innehöll mycket svavel och fosfor, eftersom de framställdes av orent koksjärn, och båda dessa skadliga föroreningar endast delvis förvandlas till slagg; mängden slagg i pöl är 3-6%, i högkvalitativ metall överstiger den inte 2%. Närvaron av slagg minskar kraftigt resultaten av mekaniska tester av pöl. Nedan finns några data i % som kännetecknar pöljärn - vanligt västeuropeiskt och bra Ural:

Den värdefulla egenskap för vilken tillverkningen av pöljärn nu stöds är dess utmärkta svetsbarhet, som ibland är av särskild vikt ur säkerhetssynpunkt. Järnvägsspecifikationer samhällen kräver tillverkning av kopplingsanordningar, stänger för strömbrytare och bultar från pöl. På grund av dess bättre motståndskraft mot vattnets frätande effekter används pyttjärn även för tillverkning av vattenrör. Det används också för att göra nötter (en grovkornig fosformetall) och högkvalitativt fibröst järn för nitar och kedjor.
Strukturen av smidesjärn, detekterbar under ett mikroskop även vid låg förstoring, kännetecknas av närvaron av svarta och ljusa komponenter i den fotografiska bilden; de förra hör till slaggen och de senare till korn eller fibrer av järn som erhållits genom att dra metallen.
Handelsjärn
Metallurgiska anläggningar producerar två huvudtyper av järn för industriella behov: 1) plåt och 2) sektionsjärn.
Plåt rullas för närvarande upp till 3 m bred; med en tjocklek på 1-3 mm kallar vi det tunnvalsat; från 3 mm och uppåt (vanligtvis upp till 40 mm) - panna, tank, fartyg, beroende på vilket syfte materialets sammansättning och mekaniska egenskaper motsvarar. Pannjärn är det mjukaste; den innehåller vanligtvis 0,10-0,12% C, 0,4-0,5% Mn, P och S - vardera inte mer än 0,05%; dess tillfälliga draghållfasthet är inte giltig. mer än 41 kg/mm 2 (men inte mindre än 34 kg/mm 2), förlängning vid brott - cirka 28%. Reservoarjärn görs hårdare och mer hållbart; den innehåller 0,12-0,15 % C; 0,5-0,7 % Mn och inte mer än 0,06 % av både P och S; draghållfasthet 41-49 kg/mm2, töjning 25-28%. Längden på plåtarna av panna och reservoarjärn ställs in efter beställning i enlighet med måtten på produkten som nitas från plåtarna (undvika onödiga sömmar och putsningar), men vanligtvis överstiger den inte 8 m, eftersom den för tunna plåt är begränsad genom deras snabba kylning under valsningsprocessen, och för tjocka plåtar - av götets vikt.
Plåt mindre än 1 mm tjockt kallas svart tenn; det används för tillverkning av plåt och som takmaterial. För det senare ändamålet rullar de i Sovjetunionen ark som mäter 1422x711 mm, väger 4-5 kg, med en tjocklek på 0,5-0,625 mm. Takjärn tillverkas av fabriker i förpackningar som väger 82 kg. Utomlands klassificeras svart tenn i handeln enligt speciella kalibernummer - från 20 till 30 (den normala tjockleken på tyskt tenn är från 0,875 till 0,22 mm, och den för engelskt tenn är från 1,0 till 0,31 mm). Tenn tillverkas av det mjukaste gjutjärnet innehållande 0,08-0,10 % C, 0,3-0,35 % Mn om det är tillverkat av träkolsgjutjärn (vårt), och 0,4-0,5 % Mn, om utgångsmaterialet är koksjärn; draghållfasthet - från 31 till 34 kg/mm2, töjning - 28-30%. En typ av plåt är korrugerad plåt. Den delas efter vågornas beskaffenhet i järn med låga och höga vågor; i den första sträcker sig förhållandet mellan vågbredd och djup från 3 till 4, i den andra 1-2. Korrugerad plåt är tillverkad med en tjocklek på 0,75-2,0 mm och en plåtbredd på 0,72-0,81 m (med låga vågor) och 0,4-0,6 m (med höga vågor). Korrugerad plåt används för tak, väggar av lätta strukturer, persienner, och med höga vågor, dessutom används det för konstruktion av takbjälkar.
Graderat järn delas in i två klasser efter dess tvärsnittsform: vanligt graderat järn och formjärn.
Den första klassen inkluderar rundjärn (med en diameter på mindre än 10 mm kallas tråd), fyrkantig, platt eller remsa. Den senare är i sin tur uppdelad i: själva remsan - från 10 till 200 mm bred och mer än 5 mm tjock; båge - samma bredd, men tjocklek från 5 till 1 mm, indikerad av kalibernumret (från 3 till 19 normal tysk och från 6 till 20 ny engelsk kaliber); däck - från 38 till 51 mm brett och upp till 22 mm tjockt; universal - från 200 till 1000 mm bred och minst 6 mm tjock (rullad i specialrullar - universal). Både däck- och ringjärn tillverkas av fabriker i rullar, rullad tråd - i rullar; andra varianter är i form av raka (rätade) remsor, vanligtvis inte mer än 8 m långa (normalt - från 4,5 till 6 m), men på specialbeställning för betongkonstruktioner skärs remsor upp till 18 mm långa, och ibland mer .
De huvudsakliga typerna av formade järn: hörn (lika och ojämlika), box (kanal), T-formad, I-balk (balkar), kolumn (fyrkantig) och zetajärn; Det finns också några andra mindre vanliga typer av formade järn. Enligt vårt normala metriska sortiment anges måtten på formjärn med profilnumret (nr är siffran, se hyllans bredd eller högsta profilhöjd). Angular ojämn och T-järn har dubbelt nr; till exempel betyder nr 16/8 hörn med hyllor på 16 och 8 cm eller tee med en hylla på 16 cm och en tee-höjd på 8 cm. De tyngsta profilerna av formgjutet järn valsat av oss: nr 15 - hörn, nr 30 - tråg, nr 40 - I-balk.
Sammansättningen av vanligt svetsbart järn: 0,12% C, 0,4% Mn, mindre än 0,05% P och S - vardera; dess draghållfasthet är 34-40 kg/mm²; men rundjärn för nitar är gjord av ett mjukare material av kompositionen: mindre än 0,10% C, 0,25-0,35% Mn, cirka 0,03% P och S vardera. Draghållfastheten är 32-35 kg/mm2 och töjningen är 28-32%. Format, osvetsat, men nitat järn ("konstruktionsstål") innehåller: 0,15 - 0,20 % C, 0,5 % Mn, upp till 0,06 % P och S - vardera; dess draghållfasthet är 40-50 kg/mm2, töjning 25-20%. För att tillverka nötter tillverkas järn (Thomas iron), som innehåller cirka 0,1 % C, men från 0,3 till 0,5 % P (ju större nötter, desto mer P). Utomlands, för att möta behoven hos speciella valsverk, används en halvprodukt i handeln - en fyrkantig ämne, vanligtvis 50 x 50 mm i tvärsnitt.
Känd för människor sedan antiken: forskare tillskriver gamla hushållsartiklar gjorda av detta material till det 4:e årtusendet f.Kr.
Det är omöjligt att föreställa sig mänskligt liv utan järn. Man tror att järn används för industriella ändamål oftare än andra metaller. De viktigaste strukturerna är gjorda av det. Järn finns också i små mängder i blodet. Det är innehållet i det tjugosjätte elementet som färgar blodet rött.
Fysiska egenskaper hos järn
Järn brinner i syre och bildar en oxid:
3Fe + 202 = Fe304.
Vid uppvärmning kan järn reagera med icke-metaller:
Även vid en temperatur på 700-900 °C reagerar den med vattenånga:
3Fe + 4H2O = Fe304 + 4H2.
Järnföreningar
Järnoxider har som bekant joner med två oxidationstillstånd: +2 och + 3. Att veta detta är extremt viktigt, eftersom helt olika kvalitativa reaktioner kommer att utföras för olika grundämnen.
Kvalitativa reaktioner på järn
En kvalitativ reaktion behövs så att man enkelt kan bestämma närvaron av joner av ett ämne i lösningar eller föroreningar av ett annat. Låt oss överväga de kvalitativa reaktionerna av tvåvärt och trevärt järn.
Kvalitativa reaktioner på järn (III)
Halten av järn(III)joner i en lösning kan bestämmas med alkali. Om resultatet är positivt bildas en bas - järn(III)hydroxid Fe(OH)3.
 Järn(III)hydroxid Fe(OH)3
Järn(III)hydroxid Fe(OH)3
Det resulterande ämnet är olösligt i vatten och har en brun färg. Det är den bruna fällningen som kan indikera närvaron av järn(III)joner i lösningen:
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl.
Fe(III)-joner kan också bestämmas med användning av K3.
En lösning av järnklorid blandas med en gulaktig lösning av blodsalt. Som ett resultat kan du se en vacker blåaktig fällning, vilket indikerar att järnjoner finns i lösningen. Du kommer att hitta spektakulära experiment för att studera egenskaperna hos järn.
Kvalitativa reaktioner på järn (II)
Fe²⁺-joner reagerar med rött blodsalt K4. Om en blåaktig fällning bildas när salt tillsätts, är dessa joner närvarande i lösningen.

Järn(latin ferrum), fe, kemiskt element av grupp VIII i det periodiska systemet av Mendeleev; atomnummer 26, atommassa 55,847; blank silvervit metall. Grundämnet i naturen består av fyra stabila isotoper: 54 fe (5,84%), 56 fe (91,68%), 57 fe (2,17%) och 58 fe (0,31%).
Historisk referens. Järn var känt redan i förhistorisk tid, men det hittade en utbredd användning långt senare, eftersom det är extremt sällsynt i naturen i ett fritt tillstånd, och dess utvinning från malmer blev möjlig först på en viss nivå av teknisk utveckling. Det var förmodligen första gången som människan blev bekant med meteoritjärn, vilket framgår av dess namn på forntida folks språk: det forntida egyptiska "beni-pet" betyder "himmelskt järn"; Den antika grekiska sideros är förknippad med latinets sidus (genitiv kasus sideris) - stjärna, himlakropp. I hettitiska texter från 1300-talet. före Kristus e. J. nämns som en metall som föll från himlen. Romanska språk behåller roten till namnet som gavs av romarna (till exempel franska fer, italienska ferro).
Metoden att erhålla järn från malmer uppfanns i västra Asien under det 2:a årtusendet f.Kr. e.; Därefter spred sig användningen av järn till Babylon, Egypten och Grekland; för att byta Bronsåldern kom Järnåldern. Homer (i Iliadens 23:e sång) säger att Akilles delade ut en diskus gjord av järn till vinnaren i en diskuskastningstävling. I Europa och det antika Ryssland fick kvinnor under många århundraden osttillverkningsprocess. Järnmalm reducerades med träkol i en smedja byggd i en grop; Luft pumpades in i smedjan med bälg, reduktionsprodukten - kritsan - separerades från slaggen genom hammarslag och olika produkter smiddes från den. När blåsningsmetoderna förbättrades och höjden på härden ökade, ökade processens temperatur och en del av järnet uppkolades, dvs. gjutjärn; denna relativt ömtåliga produkt ansågs vara ett produktionsavfall. Därav namnet på gjutjärn "tackjärn", "tackjärn" - engelskt tackjärn. Senare märktes att när man lastade gjutjärn snarare än järnmalm i smedjan, erhölls också en järnskorpa med låg kolhalt, och en sådan tvåstegsprocess visade sig vara mer lönsam än ostblåsningsprocessen. Under 1100-1200-talen. skrikmetoden var redan utbredd. På 1300-talet Gjutjärn började smältas inte bara som en halvprodukt för vidare bearbetning, utan också som ett material för att gjuta olika produkter. Ombyggnaden av härden till en schaktugn ("domnitsa") och sedan till en masugn går också tillbaka till samma tid. I mitten av 1700-talet. I Europa började degelprocessen användas för att erhålla bli, som var känt i Syrien under tidig medeltid, men som senare visade sig vara bortglömd. I denna metod framställdes stål genom att smälta metallladdningar i små kärl (deglar) från en mycket eldfast massa. Under 1700-talets sista fjärdedel. Pölsprocessen att omvandla tackjärn till järn på botten av en brinnande efterklangsugn började utvecklas. Den industriella revolutionen på 1700- och början av 1800-talet, uppfinningen av ångmaskinen och byggandet av järnvägar, stora broar och en ångflotta skapade en enorm efterfrågan på järn och dess legeringar. Alla befintliga metoder för att framställa järn kunde dock inte tillfredsställa marknadens behov. Massproduktion av stål började först i mitten av 1800-talet, när processerna Bessemer, Thomas och öppen härd utvecklades. På 1900-talet Den elektriska ugnssmältningsprocessen uppstod och blev utbredd och producerade högkvalitativt stål.
Prevalens i naturen. När det gäller innehållet i litosfären (4,65 viktprocent) hamnar järn på andra plats bland metaller (aluminium på första plats). Den vandrar kraftigt i jordskorpan och bildar cirka 300 mineraler (oxider, sulfider, silikater, karbonater, titanater, fosfater etc.). Järn deltar aktivt i magmatiska, hydrotermiska och supergenprocesser, som är förknippade med bildandet av olika typer av dess avlagringar. Järn är en metall på jordens djup; den ackumuleras i de tidiga stadierna av magmakristallisation, i ultrabasiska (9,85%) och basiska (8,56%) bergarter (i graniter är det bara 2,7%). I biosfären ackumuleras järn i många marina och kontinentala sediment och bildar sedimentära malmer.
En viktig roll i järns geokemi spelas av redoxreaktioner - övergången av 2-valent järn till 3-valent järn och vice versa. I biosfären, i närvaro av organiska ämnen, reduceras fe 3+ till fe 2+ och migrerar lätt, och när det möter atmosfäriskt syre oxideras fe 2+ och bildar ansamlingar av hydroxider av 3-valent järn. 3-valent järn är röd, gul, brun färg. Detta bestämmer färgen på många sedimentära bergarter och deras namn - "rödfärgad formation" (röd och brun lera och lera, gul sand, etc.).
Fysiska och kemiska egenskaper. Järns betydelse i modern teknik bestäms inte bara av dess breda spridning i naturen, utan också av en kombination av mycket värdefulla egenskaper. Den är plast, smidd lätt i både kallt och uppvärmt tillstånd, och kan rullas, stämplas och ritas. Förmågan att lösa upp kol och andra element tjänar som grund för produktion av olika järnlegeringar.
Vätska kan existera i form av två kristallgitter: a - och g - kroppscentrerad kubisk (bcc) och ansiktscentrerad kubisk (fcc). Under 910 °C är a - fe med ett bcc-gitter stabilt (a = 2,86645 å vid 20 °C). Mellan 910°C och 1400°C är g-modifikationen med ett fcc-gitter stabil (a = 3,64 å). Över 1400°C bildas bcc d-fe-gittret (a = 2,94 å) igen, stabilt upp till smälttemperaturen (1539°C). a - fe är ferromagnetisk upp till 769°C (Curiepunkt). Modifiering g -fe och d -fe är paramagnetiska.
De polymorfa omvandlingarna av järn och stål vid uppvärmning och kylning upptäcktes 1868 av D.K. Chernov. Kol bildas med J. fasta lösningar implantationer där C-atomer, med liten atomradie (0,77 å), är belägna i mellanrummen i metallkristallgittret, bestående av större atomer (atomradie fe 1,26 å). En fast lösning av kol i g-fe kallas. austenit, och i (a -fe- ferrit. Mättad fast lösning av kol i g - fe innehåller 2,0 viktprocent C vid 1130°C; a-fe löser endast 0,02-0,04 % C vid 723°C och mindre än 0,01 % vid rumstemperatur. Därför, när härdning austenit bildas martensit - en övermättad fast lösning av kol i a - fe, mycket hård och spröd. Kombination av härdning med semester(genom uppvärmning till relativt låga temperaturer för att minska inre spänningar) gör det möjligt att ge stål den erforderliga kombinationen av hårdhet och duktilitet.
Järns fysiska egenskaper beror på dess renhet. Industriella järnmaterial innehåller vanligtvis föroreningar av kol, kväve, syre, väte, svavel och fosfor. Även vid mycket låga koncentrationer förändrar dessa föroreningar i hög grad metallens egenskaper. Så orsakar svavel den så kallade. röd sprödhet, fosfor (även 10 -20 % P) - kyla; kol och kväve minskar plast och väte ökar bräcklighet G. (s.k. väteförsprödning). Reduktion av föroreningshalt till 10 -7 - 10 -9 % leder till betydande förändringar i metallens egenskaper, i synnerhet till en ökning av duktiliteten.
Följande är de fysikaliska egenskaperna hos järn, huvudsakligen relaterade till metall med en total föroreningshalt på mindre än 0,01 viktprocent:
Atomradie 1,26 å
Jonradier fe 2+ o.80 å, fe 3+ o.67 å
Densitet (20 o c) 7,874 g/cm 3
t pl 1539°C
t kip ca 3200 oC
Temperaturkoefficient för linjär expansion (20°C) 11,7·10 -6
Värmeledningsförmåga (25°C) 74,04 tis/(m K)
Vätskans värmekapacitet beror på dess struktur och förändras på ett komplext sätt med temperaturen; genomsnittlig specifik värmekapacitet (0-1000 o c) 640,57 j/(kg·TILL).
Elektrisk resistivitet (20°C)
9,7·10 -8 ohm m
Temperaturkoefficient för elektriskt motstånd
(0-100°C) 6,51·10-3
Youngs modul 190-210 10 3 Mn/m. 2
(19-21 10 3 kgf/mm 2)
Temperaturkoefficient för Youngs modul
Skjuvmodul 84,0 10 3 Mn/m 2
Kortvarig draghållfasthet
170-210 Mn/m 2
Töjning 45-55 %
Brinell hårdhet 350-450 Mn/m 2
Sträckgräns 100 Mn/m 2
Slaghållfasthet 300 Mn/m 2
Konfiguration av det yttre elektronskalet hos fe 3-atomen d 6 4s 2 . Järn uppvisar variabel valens (föreningar av 2- och 3-valent järn är de mest stabila). Med syre bildar järn feo oxid, fe 2 o 3 oxid, och fe 3 o 4 oxid-oxid (en förening av feo med fe 2 o 3, som har strukturen spineller) . I fuktig luft vid normala temperaturer blir järn täckt av lös rost (f.eks. 2 o 3 n h 2 o). På grund av sin porositet hindrar rost inte åtkomsten av syre och fukt till metallen och skyddar den därför inte från ytterligare oxidation. Till följd av olika typer av korrosion förloras miljontals ton järn årligen När järn värms upp i torr luft över 200°C täcks det av en tunn oxidfilm, som skyddar metallen från korrosion vid normala temperaturer; detta är grunden för den tekniska metoden för att skydda Zh. - blåelse. Vid upphettning i vattenånga oxiderar järn och bildar fe 3 o 4 (under 570°C) eller feo (över 570°C) och frigör väte.
Fe(oh)2-hydroxid bildas i form av en vit fällning när kaustiska alkalier eller ammoniak verkar på vattenhaltiga lösningar av fe2+-salter i en atmosfär av väte eller kväve. När det kommer i kontakt med luft blir fe(oh)2 först grönt, sedan svart och slutligen snabbt till den rödbruna hydroxiden fe(oh)3. Feooxid uppvisar grundläggande egenskaper. Fe 2 o 3 oxid är amfotär och har en svagt uttryckt sur funktion; reagerar med mer basiska oxider (till exempel mgo) och bildar ferriter - föreningar av typen fe 2 o 3 n meo, som har ferromagnetiska egenskaper och används i stor utsträckning inom radioelektronik. Sura egenskaper uttrycks också i sexvärt järn, som finns i form av ferrater, till exempel k 2 feo 4, salter av järnsyra som inte isoleras i fritt tillstånd.
F. reagerar lätt med halogener och vätehalogenider, vilket ger salter, till exempel kloriderna fecl 2 och fecl 3. När vätska värms upp med svavel bildas sulfiderna fes och fes 2. Carbides Zh. - fe 3 c ( cementit) och fe 2c (e-karbid) - utfällning från fasta lösningar av kol i vätska vid kylning. fe 3 c frigörs också från lösningar av kol i flytande vätska vid höga koncentrationer av kväve. Kväve, liksom kol, ger interstitiell fasta lösningar från vätska; Av dessa frigörs nitrider fe 4 n och fe 2 n. Med väte producerar järn endast instabila hydrider, vars sammansättning inte har fastställts exakt. Vid upphettning reagerar järn kraftigt med kisel och fosfor och bildar silicider (till exempel fe 3 si) och fosfider (till exempel fe 3 p).
Flytande föreningar med många grundämnen (O, s, etc.) som bildar en kristallin struktur har en varierande sammansättning (till exempel kan svavelhalten i monosulfid variera från 50 till 53,3 at.%). Detta beror på defekter i kristallstrukturen. Till exempel, i järnoxid ersätts några av fe 2+-jonerna vid gitterställen med fe 3+-joner; för att upprätthålla elektrisk neutralitet förblir vissa gitterplatser som tillhörde fe 2+ joner tomma och fasen (wüstite) under normala förhållanden har formeln fe 0,947 o.
J:s interaktion med salpetersyra. Koncentrerad hno 3 (densitet 1,45 g/cm 3) passiverar järnet på grund av utseendet av en skyddande oxidfilm på dess yta; en mer utspädd hno 3 löser vätska med bildning av fe 2+ eller fe 3+ joner, reduceras till mh 3 eller n 2 o och n 2.
Lösningar av tvåvärda järnsalter i luft är instabila - fe 2+ oxiderar gradvis till fe 3+. Vattenlösningar av flytande salter pga hydrolys har en sur reaktion. Tillsatsen av fe 3+ tiocyanatjoner scn - till lösningar av salter ger en ljus blodröd färg på grund av uppkomsten av fe (scn) 3, vilket gör det möjligt att upptäcka närvaron av 1 del fe 3+ i cirka 10 6 delar av vatten. J. präglas av utbildning komplexa föreningar.
Kvitto och ansökan. Rent järn erhålls i relativt små mängder genom elektrolys av vattenlösningar av dess salter eller genom reduktion av dess oxider med väte. En metod utvecklas för direkt framställning av järn från malmer genom elektrolys av smältor. Produktionen av tillräckligt rent järn ökar gradvis genom sin direkta reduktion från malmkoncentrat med väte, naturgas eller kol vid relativt låga temperaturer.
Järn är den viktigaste metallen i modern teknik. I sin rena form används järn praktiskt taget inte på grund av dess låga hållfasthet, även om stål- eller gjutjärnsprodukter ofta kallas "järn". Huvuddelen av järn används i form av legeringar med mycket olika sammansättning och egenskaper. Järnlegeringar står för cirka 95 % av alla metallprodukter. Kolrika legeringar (över 2 viktprocent) - gjutjärn - smälts i masugnar från anrikade järnmalmer. Stål av olika kvaliteter (kolhalt mindre än 2 viktprocent) smälts av gjutjärn i öppen spis och elektriska ugnar och konverterare genom att oxidera (bränna ut) överskott av kol, avlägsna skadliga föroreningar (främst s, P, O) och tillsätta legeringselement. Höglegerade stål (med hög halt av nickel, krom, volfram och andra grundämnen) smälts i ljusbågs- och induktionsugnar. För tillverkning av stål och järnlegeringar för särskilt kritiska ändamål används nya processer - vakuum, elektroslaggomsmältning, plasma- och elektronstrålesmältning etc. Metoder utvecklas för stålsmältning i kontinuerligt arbetande enheter som säkerställer högkvalitativ metall och automatisering av stål. processen.
Baserat på järn skapas material som tål effekterna av höga och låga temperaturer, vakuum och höga tryck, aggressiva miljöer, höga växelspänningar, kärnstrålning etc. Produktionen av järn och dess legeringar växer ständigt. 1971 smältes 89,3 miljoner i Sovjetunionen. T gjutjärn och 121 milj T bli.
L. A. Shvartsman, L. V. Vanyukova.
Järn som konstnärligt material har använts sedan antiken i Egypten (huvudstativ från Tutankhamons grav nära Thebe, mitten av 1300-talet f.Kr., Ashmolean Museum, Oxford), Mesopotamien (dolkar hittade nära Carchemish, 500 f.Kr., British Museum, London) , Indien (järnkolonn i Delhi, 415). Sedan medeltiden har många mycket konstnärliga produkter från järn och stål bevarats i europeiska länder (England, Frankrike, Italien, Ryssland, etc.) - smidda staket, dörrgångjärn, väggfästen, väderflöjlar, bröstkarmar och lampor. Genomsmidda produkter gjorda av stavar och produkter gjorda av sträckmetallplåt (ofta med glimmerfoder) kännetecknas av sina platta former, en tydlig linjär grafisk siluett och är effektivt synliga mot en ljus och luftig bakgrund. På 1900-talet Järn används för tillverkning av galler, staket, genombrutna inre skiljeväggar, ljusstakar och monument.
T.L.
Järn i kroppen. Järn finns i organismerna hos alla djur och växter (i genomsnitt cirka 0,02%); det är nödvändigt främst för syremetabolism och oxidativa processer. Det finns organismer (så kallade koncentratorer) som kan ackumulera det i stora mängder (t.ex. järnbakterier - upp till 17-20 % F.). Nästan allt fett i djur- och växtorganismer är förknippat med proteiner. Brist på fett orsakar tillväxthämning och symtom växtkloros, förknippas med minskad utbildning klorofyll.Överskott av järn har också en skadlig effekt på växtutvecklingen och orsakar till exempel sterilitet hos risblommor och kloros. I alkaliska jordar bildas järnföreningar som är otillgängliga för absorption av växtrötter, och växter får det inte i tillräckliga mängder; i sura jordar går järn över i lösliga föreningar i överskott. När det finns brist eller överskott av assimilerbara järnföreningar i jorden kan växtsjukdomar uppstå över stora ytor.
Fiber kommer in i kroppen hos djur och människor med mat (de rikaste källorna i det är lever, kött, ägg, baljväxter, bröd, spannmål, spenat och rödbetor). Normalt får en person 60-110 med en diet mg J., vilket väsentligt överstiger hans dagsbehov. Absorption av befruktning från mat sker i den övre delen av tunntarmen, varifrån den kommer in i blodet i en form bunden med proteiner och förs med blodet till olika organ och vävnader, där det deponeras i form av ett befruktningsmedel. proteinkomplex - ferritin. Den huvudsakliga depån av fett i kroppen är levern och mjälten. På grund av järnferritin syntetiseras alla järnhaltiga föreningar i kroppen: andningspigment syntetiseras i benmärgen hemoglobin, i musklerna - myoglobin, i olika vävnader cytokromer och andra järnhaltiga enzymer. Fett utsöndras från kroppen huvudsakligen genom tjocktarmens vägg (hos människor finns det ca 6-10 mg per dag) och i liten utsträckning av njurarna. Kroppens behov av fett förändras med ålder och fysisk kondition. För 1 kg vikt behöver barn - 0,6, vuxna - 0,1 och gravida kvinnor - 0,3 mg J. per dag. Hos djur är behovet av fett ungefär (per 1 kg torrsubstans i kosten): för mjölkkor - minst 50 mg, för unga djur - 30-50 mg, för smågrisar - upp till 200 mg, för dräktiga grisar - 60 mg.
V. V. Kovalsky.
Inom medicinen används medicinska preparat av järn (reducerat järn, järnlaktat, järnglycerofosfat, tvåvärt järnsulfat, Blo-tabletter, malatlösning, feramid, hemostimulin, etc.) vid behandling av sjukdomar som åtföljs av järnbrist. i kroppen ( järnbristanemi), samt som en allmän tonic (efter infektionssjukdomar etc.). Isotoper av järn (52 fe, 55 fe och 59 fe) används som indikatorer inom biomedicinsk forskning och diagnos av blodsjukdomar (anemi, leukemi, polycytemi, etc.).
Belyst.: General metallurgy, M., 1967; Nekrasov B.V., Fundamentals of General Chemistry, vol 3, M., 1970; Remi G., Kurs i oorganisk kemi, övers. från German, vol 2, M., 1966; Brief chemical encyclopedia, vol 2, M., 1963; Levinson N. R., [Products made of non-ferrous and ferrous metal], i boken: Russian decorative art, vol. 1-3, M., 1962-65; Vernadsky V.I., Biogeokemiska uppsatser. 1922-1932, M. - L., 1940; Granik S., Järnmetabolism hos djur och växter, i samlingen: Microelements, trans. från English, M., 1962; Dixon M., Webb F., enzymer, trans. från English, M., 1966; neogi s., järn i det antika Indien, Calcutta, 1914; vän j. n., järn i antiken, l., 1926; frank e. b. gammalt franskt järnverk, kamb. (massa), 1950; Lister R., dekorativt smidesverk i Storbritannien, l., 1960.
ladda ner abstrakt
Järn
JÄRN-A; ons
1. Kemiskt element (Fe), en formbar silverfärgad metall som kombineras med kol för att bilda stål och gjutjärn.
2. Det vanliga namnet för lågkolhaltigt stål, en silverfärgad metall. Förfalska Vinden rasslar i järntaket.
3. Om vad som är starkt, solidt, starkt (om yttre fysiska egenskaper). Dina händer är bra! // Om det som är tufft, orubbligt (om inre moraliska egenskaper). Hans karaktär är...
4. Razg. Om ett läkemedel som innehåller körtelämnen. Kroppen saknar järn. Drick väl. Äpplen innehåller w.
5. Razg. tech. Datorhårdvara (till skillnad från mjukvara). Köp det saknade järnet.
◊ Bränn med ett varmt strykjärn. Att utrota, förstöra något, ta till extrema nödåtgärder. Slå till medan järnet är varmt (se Forge).
◁ Järn; Körtel; Järn; Järn (se).
järn(lat. Ferrum), kemiskt grundämne i grupp VIII i det periodiska systemet. Glänsande silver-vit metall. Bildar polymorfa modifieringar; vid vanliga temperaturer är α-Fe stabil (kristallgitter - kroppscentrerad kubisk) med en densitet av 7,874 g/cm 3 . α-Fe upp till 769°C (Curiepunkt) är ferromagnetisk; t pl 1535°C. I luften oxiderar den och blir täckt av lös rost. När det gäller förekomsten av grundämnen i naturen ligger järn på 4:e plats; bildar cirka 300 mineraler. Legeringar av järn med kol och andra grundämnen står för cirka 95 % av alla metallprodukter (gjutjärn, stål, ferrolegeringar). I sin rena form används det praktiskt taget inte (i vardagslivet kallas stål- eller gjutjärnsprodukter ofta järn). Nödvändigt för djurorganismers liv; är en del av hemoglobin.
JÄRNJÄRN (lat. Ferrum), Fe (läs "ferrum"), kemiskt grundämne, atomnummer 26, atommassa 55.847. Ursprunget till både de latinska och ryska namnen på elementet har inte klart fastställts. Naturligt järn är en blandning av fyra nuklider (centimeter. NUKLID) med masstal 54 (innehåll i naturlig blandning 5,82 viktprocent), 56 (91,66 %), 57 (2,19 %) och 58 (0,33 %). Konfiguration av två yttre elektroniska lager 3 s 2
sid 6
d 6
4s 2
. Bildar typiskt föreningar i oxidationstillstånden +3 (valens III) och +2 (valens II). Föreningar med järnatomer i oxidationstillstånd +4, +6 och några andra är också kända.
I Mendeleevs periodiska system ingår järn i grupp VIIIB. I den fjärde perioden, till vilken järn hör, omfattar denna grupp även kobolt (centimeter. KOBOLT) och nickel (centimeter. NICKEL). Dessa tre element bildar en triad och har liknande egenskaper.
Radien för den neutrala järnatomen är 0,126 nm, radien för Fe 2+-jonen är 0,080 nm och Fe 3+-jonen är 0,067 nm. Energierna för sekventiell jonisering av järnatomen är 7,893, 16,18, 30,65, 57, 79 eV. Elektronaffinitet 0,58 eV. Enligt Paulingskalan är järnets elektronegativitet cirka 1,8.
Högrent järn är en blank silvergrå, seg metall som lätt kan bearbetas på en mängd olika sätt.
Att vara i naturen
Järn är ganska utbrett i jordskorpan - det står för cirka 4,1% av massan av jordskorpan (4:e plats bland alla element, 2:a bland metaller). Ett stort antal malmer och mineraler som innehåller järn är kända. Röda järnmalmer (hematitmalm) är av största praktiska betydelse (centimeter. HEMATIT) Fe2O3; innehåller upp till 70 % Fe), magnetiska järnmalmer (magnetitmalm (centimeter. MAGNETIT) Fe3O4; innehåller 72,4% Fe), bruna järnmalmer (hydrogoetite НFeO 2 malm n H 2 O), samt sparjärnmalm (sideritmalm (centimeter. SIDERITE) järnkarbonat, FeCO3; innehåller cirka 48 % Fe). Stora fyndigheter av pyrit finns också i naturen. (centimeter. PYRIT) FeS 2 (andra namn är svavelkis, järnkis, järndisulfid och andra), men malmer med hög svavelhalt är ännu inte av praktisk betydelse. Ryssland rankas först i världen när det gäller järnmalmsreserver. Havsvatten innehåller 1·10 -5 -1·10 -8 % järn.
Järnproduktionens historia
Järn har spelat och fortsätter att spela en exceptionell roll i mänsklighetens materiella historia. Det första metalliska järnet som föll i mänskliga händer var förmodligen av meteorit-ursprung. Järnmalmer är utbredda och finns ofta även på jordens yta, men inhemskt järn på ytan är extremt sällsynt. Förmodligen, för flera tusen år sedan, märkte en person att efter att ha bränt en eld, i vissa fall observerades bildning av järn från de malmbitar som av misstag hamnade i elden. När en eld brinner sker reduktionen av järn från malm på grund av malmens reaktion både direkt med kol och med kolmonoxid (II) CO som bildas vid förbränning. Möjligheten att få järn från malmer underlättades avsevärt av upptäckten av att när malm värms upp med kol uppstår en metall som sedan kan renas ytterligare under smide. Utvinningen av järn från malm med hjälp av ostblåsningsprocessen uppfanns i västra Asien under det andra årtusendet f.Kr. e. Period från 900- till 700-talet. före Kristus e. när många stammar i Europa och Asien utvecklade järnmetallurgi, kallades det järnåldern, (centimeter. JÄRNÅLDERN) som ersatte bronsåldern (centimeter. BRONSÅLDERN). Förbättringar i blåsningsmetoderna (naturligt drag ersattes av bälgar) och en ökning av smedjans höjd (lågskaftade ugnar dök upp) ledde till tillverkningen av gjutjärn, som började smälta i stor utsträckning i Västeuropa från 1300-talet. Det resulterande gjutjärnet omvandlades till stål. Sedan mitten av 1700-talet började kolkoks användas i masugnsprocessen istället för träkol. (centimeter. KOKS). Därefter förbättrades metoderna för att erhålla järn från malmer avsevärt, och för närvarande används speciella anordningar för detta - masugnar, syreomvandlare, elektriska ljusbågsugnar.
Fysiska och kemiska egenskaper
Vid temperaturer från rum till 917 °C, såväl som i temperaturområdet 1394-1535 °C, finns a-Fe med ett kubiskt kroppscentrerat gitter, vid rumstemperatur gitterparametern a = 0,286645 nm. Vid temperaturer på 917-1394 °C är b-Fe med ett kubiskt ytcentrerat gitter T (a = 0,36468 nm) stabilt. Vid temperaturer från rumstemperatur till 769 °C (den så kallade Curie-punkten (centimeter. KURIEPUNKT)) järn har starka magnetiska egenskaper (det sägs vara ferromagnetiskt), vid högre temperaturer beter sig järn som ett paramagnetiskt. Ibland anses paramagnetisk a-Fe med ett kubiskt kroppscentrerat gitter, stabilt vid temperaturer från 769 till 917 °C, som en g-modifiering av järn, och b-Fe, stabilt vid höga temperaturer (1394-1535 °C), kallas traditionellt d-Fe (idén om förekomsten av fyra modifikationer av järn - a, b, g och d - uppstod när röntgendiffraktionsanalys ännu inte existerade och det inte fanns någon objektiv information om den interna strukturen hos järn). Smältpunkt 1535 °C, kokpunkt 2750 °C, densitet 7,87 g/cm3. Standardpotentialen för Fe 2+ /Fe 0-paret är –0,447V, Fe 3+ /Fe 2+-paret är +0,771V.
Vid förvaring i luft vid temperaturer upp till 200 °C täcks järn gradvis med en tät film av oxid, vilket förhindrar ytterligare oxidation av metallen. I fuktig luft blir järn täckt med ett löst lager av rost, vilket inte hindrar åtkomsten av syre och fukt till metallen och dess förstörelse. Rost har inte en konstant kemisk sammansättning, ungefär dess kemiska formel kan skrivas som Fe 2 O 3 xH 2 O.
Järn reagerar med syre vid upphettning. När järn brinner i luft bildas Fe 2 O 3-oxid, vid förbränning i rent syre bildas Fe 3 O 4-oxid. Om syre eller luft leds genom smält järn bildas FeO-oxid. När svavel och järnpulver värms upp bildas sulfid, vars ungefärliga formel kan skrivas som FeS.
Järn reagerar med halogener vid upphettning (centimeter. HALOGEN). Eftersom FeF 3 är icke-flyktigt är järn resistent mot fluor upp till temperaturer på 200-300°C. När järn kloreras (vid en temperatur av ca 200°C) bildas flyktig FeCl3. Om växelverkan mellan järn och brom sker vid rumstemperatur eller med uppvärmning och ökat bromångtryck, bildas FeBr 3. Vid upphettning spjälkar FeCl3 och speciellt FeBr3 av halogenen och förvandlas till järn(II)halider. När järn och jod interagerar bildas jodid Fe 3 I 8.
Vid upphettning reagerar järn med kväve, bildar järnnitrid Fe 3 N, med fosfor, bildar fosfider FeP, Fe 2 P och Fe 3 P, med kol, bildar karbid Fe 3 C, med kisel, bildar flera silicider, till exempel FeSi .
Vid förhöjt tryck reagerar metalliskt järn med kolmonoxid CO, och flytande, under normala förhållanden, bildas mycket flyktigt järnpentakarbonyl Fe(CO) 5. Järnkarbonyler med kompositionerna Fe2(CO)9 och Fe3(CO)12 är också kända. Järnkarbonyler fungerar som utgångsmaterial vid syntesen av organiska järnföreningar, inklusive ferrocen (centimeter. FERROCEN) sammansättning
Rent metalliskt järn är stabilt i vatten och utspädda alkalilösningar. Järn löser sig inte i koncentrerad svavelsyra och salpetersyra, eftersom en stark oxidfilm passiverar dess yta.
Järn reagerar med saltsyra och utspädda (cirka 20%) svavelsyror för att bilda järn(II)salter:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
När järn reagerar med cirka 70 % svavelsyra fortsätter reaktionen att bilda järn(III)sulfat:
2Fe + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 4H 2 O
Järn(II)oxid FeO har grundläggande egenskaper, basen Fe(OH)2 motsvarar den. Järn(III)oxid Fe 2 O 3 är svagt amfoter, den matchas av en ännu svagare bas än Fe(OH) 2, Fe(OH) 3, som reagerar med syror:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Järn(III)hydroxid Fe(OH)3 uppvisar svagt amfotära egenskaper; det kan endast reagera med koncentrerade lösningar av alkalier:
Fe(OH)3 + KOH = K
De resulterande hydroxokomplexen av järn (III) är stabila i starkt alkaliska lösningar. När lösningar späds med vatten förstörs de och järn(III)hydroxid Fe(OH)3 fälls ut.
Järn (III) föreningar i lösningar reduceras med metalliskt järn:
Fe + 2FeCl3 = 3FeCl2
Vid lagring av vattenlösningar av järn(II)salter observeras oxidation av järn(II) till järn(III):
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
Av järn(II)-salterna i vattenlösningar är det mest stabila Mohrs salt - dubbel ammonium och järn(II)sulfat (NH 4) 2 Fe(SO 4) 2 6H 2 O.
Järn (III) kan bilda dubbla sulfater med enkelladdade katjoner såsom alun, till exempel KFe(SO 4) 2 - järn-kaliumalun, (NH 4)Fe(SO 4) 2 - järn-ammoniumalun, etc. .
När klorgas eller ozon verkar på alkaliska lösningar av järn(III)föreningar, bildas järn(VI)föreningar - ferrater, till exempel kaliumferrat (VI) K 2 FeO 4. Det finns rapporter om produktion av järn (VIII) föreningar under påverkan av starka oxidationsmedel.
För att detektera järn(III)-föreningar i lösning används en kvalitativ reaktion av Fe 3+-joner med tiocyanatjoner CNS -. När Fe 3+-joner interagerar med CNS - anjoner, bildas knallrött järntiocyanat Fe(CNS) 3. Ett annat reagens för Fe 3+-joner är kaliumhexacyanoferrat (II) K 4 (tidigare kallades detta ämne gult blodsalt). När Fe 3+ och 4- joner interagerar bildas en klarblå fällning.
Reagenset för Fe 2+-joner i lösning kan vara en lösning av kaliumhexacyanoferrat (III) K 3 , tidigare kallat rött blodsalt. När Fe 3+ och 3-joner interagerar bildas en klarblå fällning med samma sammansättning som i fallet med interaktionen av Fe 3+ och 4-joner.
Järn-kol-legeringar
Järn används främst i legeringar, främst i legeringar med kol - olika gjutjärn och stål. I gjutjärn är kolhalten högre än 2,14 viktprocent (vanligtvis på nivån 3,5-4%), i stål är kolhalten lägre (vanligtvis i nivån 0,8-1%).
Gjutjärn tillverkas i masugnar. En masugn är en gigantisk (upp till 30-40 m hög) stympad kon, ihålig inuti. Masugnens innerväggar är klädda med eldfast tegel, murverkets tjocklek är flera meter. Ovanifrån berikad (befriad från gråsten) järnmalm, reducerande koks (speciella kolsorter som utsätts för koksning - uppvärmd till en temperatur på cirka 1000 °C utan lufttillgång), samt smältmaterial (kalksten och andra) som främjar separation laddas in i masugnen med vagnar.från den smälta metallen finns föroreningar - slagg. Blast (rent syre eller syreberikad luft) matas in i masugnen underifrån. När de material som laddas i masugnen sänks stiger deras temperatur till 1200-1300 °C. Som ett resultat av reduktionsreaktioner som huvudsakligen sker med deltagande av koks C och CO:
Fe2O3 + 3C = 2Fe + 3CO;
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
Metalliskt järn dyker upp, som är mättat med kol och rinner ner.
Denna smälta frigörs periodiskt från masugnen genom ett speciellt hål - ett kranhål - och smältan får stelna i speciella former. Gjutjärn kan vara vitt, det så kallade tackjärnet (det används för att tillverka stål) och grått, eller gjutjärn. Vitt gjutjärn är en fast lösning av kol i järn. I mikrostrukturen av grått gjutjärn kan mikrokristaller av grafit urskiljas. På grund av förekomsten av grafit lämnar grått gjutjärn ett märke på vitt papper.
Gjutjärn är ömtåligt och går sönder när det påverkas, så fjädrar, bladfjädrar eller andra produkter som behöver böjas kan inte tillverkas av det.
Massivt gjutjärn är lättare än smält gjutjärn, så när det stelnar drar det sig inte ihop (som är vanligt när man stelnar metaller och legeringar), utan expanderar. Denna funktion låter dig göra olika gjutgods från gjutjärn, inklusive att använda det som ett material för konstnärlig gjutning.
Om kolhalten i gjutjärn sänks till 1,0-1,5 %, bildas stål. Stål kan vara kol (sådana stål har inga andra komponenter förutom Fe och C) och legerade (sådana stål innehåller tillsatser av krom, nickel, molybden, kobolt och andra metaller som förbättrar stålets mekaniska och andra egenskaper).
Stål tillverkas genom att bearbeta gjutjärn och metallskrot i en syreomvandlare, ljusbåge eller ugnar med öppen härd. Med sådan bearbetning reduceras kolinnehållet i legeringen till den nivå som krävs, som de säger, överskottet av kol brinner ut.
Stålets fysikaliska egenskaper skiljer sig avsevärt från egenskaperna hos gjutjärn: stål är elastiskt, det kan smidas och valsas. Eftersom stål, till skillnad från gjutjärn, drar ihop sig under stelningen, utsätts de resulterande stålgjutgodset för kompression i valsverk. Efter valsning försvinner hålrummen och håligheterna som uppstod under stelningen av smältorna i metallens volym.
Stålproduktion har en lång, djup tradition i Ryssland, och stålet som tillverkas av våra metallurger är av hög kvalitet.
Applicering av järn, dess legeringar och föreningar
Rent järn har ganska begränsade användningsområden. Det används vid tillverkning av elektromagnetiska kärnor, som en katalysator för kemiska processer och för vissa andra ändamål. Men järnlegeringar - gjutjärn och stål - utgör grunden för modern teknik. Många järnföreningar används också i stor utsträckning. Således används järn(III)sulfat vid vattenbehandling, järnoxider och cyanid fungerar som pigment vid tillverkning av färgämnen och så vidare.
Järn i kroppen
Järn finns i alla växters och djurs kroppar som ett spårämne. (centimeter. MIKROELEMENT) det vill säga i mycket små mängder (i genomsnitt ca 0,02%). Däremot järnbakterier (centimeter. JÄRNBAKTERIER), med användning av energin från oxidation av järn (II) till järn (III) för kemosyntes (centimeter. KEMOSYNTES), kan samla upp till 17-20% järn i sina celler. Järns huvudsakliga biologiska funktion är deltagande i syretransport och oxidativa processer. Järn utför denna funktion som en del av komplexa proteiner - hemoproteiner (centimeter. HEMOPROTEIDER), vars protesgrupp är järnporfyrinkomplexet - hem (centimeter. PÄRLA). Bland de viktigaste hemoproteinerna är luftvägspigmenten hemoglobin (centimeter. HEMOGLOBIN) och myoglobin, (centimeter. MYOGLOBIN) universella elektronbärare i reaktionerna av cellandning, oxidation och fotosyntes, cytokromer, (centimeter. CYTOKROM) katalos- och peroxidenzymer och andra. Hos vissa ryggradslösa djur har de järnhaltiga andningspigmenten heloerytrin och klorokruorin en struktur som skiljer sig från hemoglobiner. Under biosyntesen av hemoproteiner överförs järn till dem från proteinet ferritin (centimeter. FERRITIN), som lagrar och transporterar järn. Detta protein, varav en molekyl innehåller cirka 4 500 järnatomer, är koncentrerat i levern, mjälten, benmärgen och tarmslemhinnan hos däggdjur och människor. En persons dagliga behov av järn (6-20 mg) täcks rikligt av mat (kött, lever, ägg, bröd, spenat, rödbetor och andra är rika på järn). Kroppen hos en genomsnittlig person (kroppsvikt 70 kg) innehåller 4,2 g järn, 1 liter blod innehåller cirka 450 mg. När det är järnbrist i kroppen utvecklas körtelanemi som behandlas med läkemedel som innehåller järn. Järntillskott används också som allmänna stärkande medel. En för hög dos järn (200 mg eller mer) kan ha en toxisk effekt. Järn är också nödvändigt för växternas normala utveckling, varför det finns mikrogödsel baserade på järnpreparat.
encyklopedisk ordbok. 2009 .
Synonymer:Se vad "hårdvara" är i andra ordböcker:
ons. hall(ar) söder, väster metall, smula, smält ur malm i form av gjutjärn och smidd av detta senare under en skrikande hammare. När det kombineras med kol bildar det stål. Järn säljs i form av: band eller sektionerat; den första är rak... Dahls förklarande ordbok
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0