1.1. Neuronstruktur
Enligt moderna koncept är en nervcell (neuron) det huvudsakliga funktionella elementet i nervsystemet, bearbetar information som tas emot av den och överför resultatet av bearbetningen till andra neuroner.
1.1.1. Soma, dendriter, axon
En neuron består av en cellkropp - soma, många förgreningsprocesser - dendriter, genom vilka signaler tas emot, och vanligtvis en utgående fiber - axonet. Den intracellulära miljön avgränsas från den extracellulära miljön av ett tunt membran - membranet.
På membranet av soma och dendriter finns synapser - ändarna av axonerna hos andra neuroner. En neurons soma består av en kärna som innehåller den genetiska apparatur och cytoplasman i vilken proteinsyntes sker. I neuronkroppen, i dendriterna och axonerna finns mikrotubuli med en diameter på cirka 200 A, som förmodligen tjänar till transport av proteiner som syntetiseras i neuronkroppen.
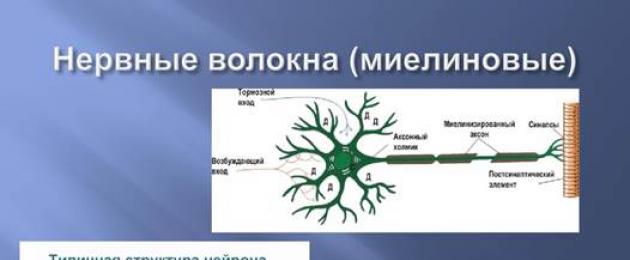
Övergången av neuron soma till axonen kallas axonkullen och kännetecknas av hög excitabilitet. Axonerna hos vissa nervceller i nervsystemet är täckta med höljen som består av Schwann-celler eller gliaceller. Utrymmen mellan dem är noder av Ranvier (Fig. 1.1).
Olika typer av nervceller kännetecknas av olika geometriska strukturer av dendriter. Dendriter är ganska långa, sträcker sig från soma till ett avstånd av 30-40 somadiametrar och har liten förgrening. Andra dendriter spänner över ett avstånd i storleksordningen av somas diameter och har ett stort antal förgrenande noder.
1.1.2. Neuronmembranets struktur
Membranet, 70-80 A tjockt, som skiljer neurons cytoplasma från den yttre miljön, består av ett lager av fosfolipidmolekyler, som har lager av proteinmolekyler på de yttre och inre sidorna. Det centrala fosfolipidskiktet har en symmetrisk struktur där fettsyrorna i lipiderna vetter mot insidan av membranet.
Membranets diameter genomborras av kanaler genom vilka vissa joner kan röra sig. Receptiva proteiner som kontrollerar jonkanalernas tillstånd byggs in i membranet (Fig. 1.2). I membranmodellen representeras en uppsättning kanaler av resistans, och en uppsättning dielektriska sektioner representeras av en parallellkopplad kapacitans.
Membranet som omger en nervcell (soma, dendriter och axon) är av två typer: passivt och aktivt.
Ett passivt membran kan leda elektrisk excitation endast elektrotoniskt (med dämpning), som en kabel. Ett aktivt membran kan bilda och leda en puls som inte avtar med avståndet. Dessa två typer av membran kan varvas.
Det har fastställts att det i det aktiva membranet finns speciella områden - kanaler, som kan vara i öppet eller stängt tillstånd. Vanligtvis finns det två typer av kanaler: ledande natriumjoner, ledande kaliumjoner.
Var och en av dessa typer av kanaler leder endast en typ av jon (antingen bara kalium eller bara natrium). Kontrollen (öppning, stängning) av kanalerna utförs av multivalenta katjoner, huvudsakligen kalcium. I ett oexciterat membran är kalciumkatjoner i ett bundet tillstånd med molekyler som bildar kanaler och stänger kanalerna. Förskjutningen av de polära områdena i vissa membranmolekyler öppnar kanaler för natrium- och kaliumjoner, vilket leder till excitation av membranet och generering av en fortplantningsverkanspotential.
1.1.3. Synapser, typer av synapser
Synapser - områden av interaktion mellan axonterminaler och neuronmembranet - är av två typer: excitatoriska och inhiberande. Excitatoriska ökar membrandepolarisering, hämmande ökar membranhyperpolarisering.
Baserat på principen om deras inflytande på membranet delas synapser in i kemiska och elektriska. Dessutom särskiljs axo-axonala, axosomatiska, axodendritiska, dendrodendritiska och somatosomatiska synapser (Fig. 1.3).
Även om tätheten av distribution av synapser på soma och dendriter är i genomsnitt densamma, uppstår en högre täthet av distribution av synapser vid förgrenade noder och i området för lokala förlängningar av dendriter.
Därför är dendritförgrenande noder av särskild betydelse för en neurons funktion.
På nervcellers soma är synapser i de flesta fall små, deras linjära dimensioner överstiger inte 0,2-0,4 μm (för däggdjursnervsystemet), medan på dendriter är en betydande del av synapserna cirka 1 μm långa.
Det finns speciella typer av synaptiska kontakter på dendriter, de så kallade "ryggradssynapserna", som ligger på svampformade processer. Ryggraden består av en tunn stjälk, vars ände är förtjockad 3-5 gånger och bildar ryggradens huvud. Huvudet innehåller en eller flera vanliga synaptiska kontakter. I vissa delar av hjärnan finns de allra flesta synapser på ryggar.
1.2. Membranprocesser
Membranet innehåller passiva och aktiva sektioner. Ett passivt membran har förmågan att leda potentiella avvikelser vid vilken punkt som helst från jämviktsvärdet till andra punkter med dämpning proportionell mot avståndet. En våg av regenererande excitation fortplantar sig i det aktiva membranet på grund av en spänningsberoende förändring i jonkanalernas konduktivitet.
När membranet är i vila har miljön inuti cellen en viss "vilopotential" (cirka 70 mV) i förhållande till den yttre miljön. Denna potentialskillnad bestäms av olika koncentrationer av joner av ett antal grundämnen, främst natrium- och kaliumjoner. I vila är koncentrationen av kaliumjoner en storleksordning lägre än på insidan (inne i nervcellen eller fibern).
Membranets inre yta är negativt laddad i förhållande till dess yttre yta. Den observerade skillnaden i jonkoncentrationer och potentialer på båda sidor av membranet beror på cellulära metaboliska processer - en viss hypotetisk "metabolisk pump" som pumpar ut några natriumjoner och pumpar in några kaliumjoner i cellen.
Den intracellulära potentialen kan öka (depolarisering) eller minska ytterligare (hyperpolarisering).
Förändringen i potential mot depolarisering kallas även excitatorisk postsynaptisk potential (EPSP), och mot hyperpolarisering - hämmande postsynaptisk potential (IPSP). Följaktligen kallas alla faktorer, inklusive verkan av synapser, excitatoriska eller hämmande, beroende på om de ökar eller minskar potentialen på insidan av membranet.
En spännande effekt som orsakar en ökning av den intracellulära potentialen (depolarisering) kommer inte att leda till aktiv excitation av membranet om excitationsnivån inte uppnås, d.v.s. förändringen i potential var mindre än tröskeln. I det här fallet beror potentialtröskeln på formen på den exciterande pulsen: positionen för pulsens stigande kant, desto högre tröskelvärde. Subtröskelförändringar i potential åtföljs av en transmembranström som bildas av en kapacitiv ström och en läckström.
Under undertröskelprocesser förändras inte membranets permeabilitet för joner nämnvärt, och därför klassificeras processerna som passiva.
Den aktiva processen börjar från det ögonblick då den intracellulära potentialen överstiger nivån av tröskelexcitation. Från och med detta ögonblick ökar membranets permeabilitet för natriumjoner kraftigt. Genom att passera från utsidan genom membranet in i cellen (fibern), ökar natriumjoner ytterligare den inre potentialen, ökar potentialen ökar permeabiliteten för natriumjoner. Processen växer som en lavin tills potentialskillnaden mellan den inre och yttre miljön når motsatt tecken, sedan minskar natriumströmmen. Men membranets permeabilitet för kaliumjoner ökar gradvis. Kaliumströmmen flyter mot natrium. Den når också ett maximum och faller sedan. På grund av natriumströmmen når denna potential sitt maximum, och kaliumströmmen minskar återigen membranpotentialen till det värde som är karakteristiskt för vilopotentialen.
1.2.1. Aktiv transport av joner över membranet
Enligt moderna begrepp har en neuron initialt olika koncentrationer av kaliumjoner inuti och utanför cellen. Jämviktspotentialen "blockerar" utsläppet av kaliumjoner från cellen. Den negativa potentialen skapar dock förutsättningar för förflyttning av natriumjoner in i cellen från den yttre miljön, vilket i sin tur minskar nivån av negativ membranpotential, vilket underlättar frisättningen av kalium under påverkan av koncentrationsskillnaden. Gradvis kommer koncentrationerna av kalium- och natriumjoner inuti och utanför att plana ut. För att upprätthålla denna koncentrationsskillnad måste det finnas en mekanism för att avlägsna natriumjoner från cellen och transportera kaliumjoner in i cellen.
Denna mekanism kallas natrium-kaliumpumpen. Intracellulärt natrium på membranets insida kombineras med bärarsubstans B. NaB-komplexet är elektriskt neutralt och kommer på grund av diffusion ut där det delas. Den frigjorda bäraren B, under inverkan av enzymet, omvandlas till form C och fäster kaliumjonen K+. KS-komplexet diffunderar in i cellen och frigör kaliumjoner. Transportör C, med deltagande av ATP, omvandlas till form B med hjälp av cellens inre energi (Fig. 1.4), och cykeln upprepas.
1.2.2. Elektrotonisk potential.
Spänningsklämma
När en strömpuls appliceras genom en mikroelektrod som sätts in i kroppen av en neuron, kan det konstateras att neuronpotentialen, registrerad av den andra mikroelektroden, förändras. Neuronen depolariseras när positiva laddningar injiceras och hyperpolariseras när negativa laddningar injiceras. Schematiskt kan membranet av en neuron representeras som en kapacitans och motstånd kopplade parallellt. Kapacitansen bildas av ett dielektrikum - fosfolipider i membranet. Motstånd skapas av jonledningskanaler. När membranet når vilopotentialen, bestämd av förhållandet mellan jämviktspotentialerna för olika joner, är den totala strömmen noll.
När en strömpuls appliceras flyter den först genom kapacitansen (kapacitiv ström). Spänningsfallet över motståndet är noll. När kondensatorn laddas flyter en ökande andel av strömmen genom motståndet.
Efter laddning av kondensatorn flyter ström genom membranet, vilket skapar ett spänningsfall över det (fig. 1.5).
1.2.3. Agerande potential
Med hjälp av spänningsklämmametoden visades det att neuronmembranet har en snabbt inaktiverande natriumledningsförmåga och en ihållande bibehållen kaliumledningsförmåga. Om vi inte tar hänsyn till påverkan av kapacitanser, kan en neuron representeras av en krets som består av två batterier och två variabla motstånd. Ett batteri bestäms av jämviktspotentialen för kalium (-75 mV). Variabel resistans reproducerar förändringen i kaliumledningsförmåga. Det andra batteriet bestäms av natriumjämviktspotentialen (+55 mV) och en variabel resistans som återger natriumkonduktivitet. Dessa batterier och resistanser bildar en krets som bildar en aktionspotential. I detta fall bestäms spänningsfallet över membranet av konduktivitetsförhållandet (fig. 1.6).
1.2.4. Summering av elektrotoniska potentialer
De elektriska egenskaperna hos ett neuronmembran kännetecknas av två konstanter: en tidskonstant och en konstant längd. Membranets tidskonstant bestämmer den tidsmässiga summeringen av elektrotoniska potentialer: när två elektrotoniska potentialer anländer till samma område av membranet, summeras de över ett tidsintervall som är proportionellt mot tidskonstanten. Membranlängdkonstanten bestämmer den rumsliga summeringen av elektrotoniska potentialer: om två elektrotoniska potentialer appliceras samtidigt på två intilliggande sektioner av ett passivt membran, så adderas en del av potentialen för den angränsande sektionen till den inneboende potentialen för varje sektion, proportionell mot avståndet mellan sektionerna dividerat med membranlängdkonstanten.
När elektrotoniska potentialer uppstår i olika delar av membranet vid olika tidpunkter bestäms deras summering av både tidskonstanten och membranets konstanta längd - den så kallade spatiotemporala summeringen sker.
Celler med stora ^värden av dessa konstanter summerar signaler mer effektivt. Summering tillåter membranpotentialen att nå ett kritiskt värde för att generera en aktionspotential även när individuella elektrotoniska potentialer inte når denna nivå. Elektrotoniska potentialer bestäms av membranets passiva egenskaper - kapacitans och motstånd. Emellertid kan källan till elektrotoniska potentialer i passiva områden av membranet vara potentiella förändringar som inträffar i angränsande områden orsakade av förändringar i jonkonduktivitet. Sålunda skapar den aktionspotential som genereras som ett resultat av öppnandet av natriumkanaler en depolarisationsförskjutning i angränsande områden som ännu inte täcks av processen för öppning av natriumkanaler, bestämt av membranlängdkonstanten. På liknande sätt bidrar tidskonstanten och längdkonstanten till summeringen av elektrotoniska potentialer orsakade av andra källor: postsynaptiska potentialer och pacemakerpotentialer.
1.2.5. Pacemaker potential
I ett antal neuroner, även efter fullständig isolering av deras soma (amputering av dendriter och axoner), under intracellulär registrering, observeras potentiella oscillationer med en amplitud på 10-20 mV och en frekvens på 1,0 till 2,5 Hz, kallade pacemakerpotentialer. . Dessa potentialer kan vara regelbundna eller bilda individuella spindlar där potentialernas amplitud gradvis ökar, når ett maximum och minskar. En jämförelse av pacemakerpotentialerna för en neuron före och efter isolering från andra nervceller indikerar att källan till oscillationer är endogena processer, eftersom typen av aktivitet bevaras i en helt isolerad neuron. Om pacemakerpotentialer når tröskeln för att generera aktionspotentialer, utlöser de deras generering.
Således, på grund av närvaron av pacemakerpotentialer, blir neuronen en aktiv generator. Dessutom, eftersom en viss typ av neuron behåller sin typ av pacemakeraktivitet även i fullständig isolering, är denna aktivitet genetiskt bestämd. Samtidigt är pacemakerpotentialen mycket känslig för förändringar i nivån av membranpotential: en lätt depolarisering av cellen med en ström på upp till 1 nA är tillräcklig för att öka frekvensen och amplituden av pacemakerpotentialen, och hyperpolarisering inom Samma gränser leder till en avmattning av pacemakerns oscillationer, deras avmattning, en minskning av amplituden och slutligen, fullständig undertryckning.
Genom att analysera pacemakerpotentialer kan man märka att när deras amplitud ökar blir depolarisationsvågen mer akut. Detta förklaras av att pacemakerpotentialen förenas av en lokal potential som inte når tröskeln för utvecklingen av en lavinliknande process förknippad med genereringen av en aktionspotential.
Pacemakerpotentialernas känslighet för förändringar i membranpotential gör dem lätta att kontrollera av yttre påverkan.
I ett antal neuroner kan flera loci av pacemakeroscillationer detekteras med olika egenskaper och olika bidrag till mekanismerna för generering av aktionspotentialer. Källan till pacemakeroscillationer verkar vara de elektrogena effekterna av aktiv jontransport. Övergångar från depolarisering till hyperpolarisering, som bildar en pacemakervåg, åtföljs inte av en förändring i membranmotstånd. Aktiv transport av natriumjoner begränsas med utvecklingen av hyperpolarisering. Aktiv transport av klorjoner begränsas av utvecklingen av depolarisering. Således har pacemakerpotentialen en optimal zon, begränsad ovanför av en viss depolarisering, och under av en viss hyperpolarisering av neuronen.
1.2.6. Elektrisk synaps
En elektrisk synaps bildas genom sammansmältning av membran av presynaptiska och postsynaptiska neuroner. En ström som injiceras i en neuron genom kanaler som förbinder båda membranen flyter passivt in i den postsynaptiska neuronen och registreras på dess membran i form av en elektrotonisk potential.
Om en (presynaptisk) neuron genererar en aktionspotential, så uppvisar den andra (postsynaptiska) neuronen en elektrotonisk potential, som i en förvrängd form reproducerar aktionspotentialen hos det presynaptiska membranet i form av en difasisk potential på grund av de passiva egenskaperna hos membran. Vid summering av difasiska potentialer genererar den postsynaptiska neuronen själv en aktionspotential som fortplantar sig längs axonet.
1.2.7. Kvantmekanism för kemisk synaps
Den elektriska synapsen innehåller kanaler som direkt förbinder de pre- och postsynaptiska membranen och ger elektrotonisk kommunikation mellan neuroner.
Till skillnad från den elektriska är i en kemisk synaps de pre- och postsynaptiska membranen separerade, och den elektrotoniska potentialen deltar inte i anslutningen av neuroner. Kommunikation realiseras genom kemiska sändare - förmedlare. Mediatorn är belägen i speciella granuler - vesiklar belägna i den presynaptiska terminalen. Under påverkan av en impuls som anländer till den presynaptiska terminalen, fäster vesikeln på det presynaptiska membranet, och en del av sändarkvantumet släpps ut i den synaptiska klyftan mot det postsynaptiska membranet. I detta fall verkar mediatorn på det receptiva proteinet i det postsynaptiska membranet. Detta receptiva protein kontrollerar jonkonduktanskanaler. Beroende på vilka joner i den postsynaptiska cellen registreras en postsynaptisk miniatyrpotential (0,5-1 mV) och hur konduktiviteten förändras, frigörs kvantum av sändaren spontant och bildar i den postsynaptiska neuronen en sekvens av miniatyrpotentialer med konstant amplitud med slumpmässiga intervall. mellan dem . Miniatyrpotentialer försvinner om receptorer specifika för en given mediator blockeras. Kalcium deltar i regleringen av mediatorfrisättning. Under depolarisering kommer kalcium in i den presynaptiska delen av synapsen och flyttar till områden där vesiklar fäster vid områden av det presynaptiska membranet. Kalcium underlättar sammansmältningen av vesikelmembranet med det terminala membranet, vilket resulterar i frisättning av ett kvantum av mediatorn.
Aktionspotentialen som anländer till den presynaptiska terminalen depolariserar terminalen, vilket leder till att kalciumledningskanaler öppnas, vilket starkt beror på nivån på membranpotentialen. Inflödet av kalcium leder till en massiv frisättning av sändaren från ett stort antal synaptiska vesiklar på en gång. Summeringen av flera sändarkvantor som frigörs som svar på en aktionspotential bildar en elementär postsynaptisk potential.
1.2.8. Transsynaptisk enzyminduktion
När en mediator verkar på en receptor uppstår ett komplex där proteinet har en specifik konfiguration. Ett sådant protein kan fungera som en inducerare: transporteras till cellkärnan och binder till en repressor, det sätter på transkriptionsmekanismen i ett visst operon, vilket säkerställer syntesen av en grupp funktionellt besläktade enzymer. Enzymer, som kommer in på ställena för neurotransmittorsyntes, förbättrar syntesen av mediatorn i den presynaptiska terminalen av neuronen som katalysatorer. Således implementeras mediatorschemat -> - transformation av det receptiva proteinet -> - inkludering av en operon på en DNA-molekyl -*■ -> - transkription som syntes av mRNA -> - syntes av enzymer -> -> - transport av enzymer längs axonet till den presynaptiska terminalen - * ökad neurotransmittorsyntes i presynapsen (Fig. 1.7). Denna process kallas transsynaptisk induktion av enzymer.
Transsynaptisk induktion av enzymer har studerats mest i detalj på adrenerga nervceller i det cervikala gangliet, som syntetiserar transmittorn noradrenalin (eller på annat sätt noradrenalin) i terminalerna av deras axoner. Neuronerna i denna nod, som har muskorin- och nikotinreceptorer, är känsliga för acetylkolin. När acetylkolin fäster på nikotinreceptorer ökar efter 24 timmar innehållet av enzymer i neuronen som fungerar som katalysatorer i syntesen av noradrenalin. Enzymer som syntetiseras i neuronkroppen transporteras längs axonet till de presynaptiska terminalerna, där ökad syntes av noradrenalin inträffar. Ökningen av enzymsyntes orsakad av verkan av acetylkolin på nikotinreceptorer förmedlas av transkriptionsprocessen med deltagande av mRNA. Detta bevisas av det faktum att antibiotikumet aktinomycin-D, som förebygger
Ris. 1.7. Transsynaptisk induktion av enzymer för bildning av en mRNA-molekyl på en DNA-mall inkluderar transsynaptisk induktion av enzymer som katalyserar syntesen av noradrenalin. Det bör betonas att induktionen av enzymer som är ansvariga för syntesen av noradrenalin sker endast om acetylkolin verkar på nikotinreceptorer. Om dessa receptorer blockeras sker inte induktionen av de enzymer som är ansvariga för syntesen av noradrenalin.
Således ingår en mekanism som liknar enzymatisk anpassning i regleringen av neurons effektivitet på nivån av neurotransmittorsyntes.
1.3. Neurala nätverk
Det finns två extrema typer av neurala nätverk: icke-lokala neurala nätverk och lokala. I icke-lokala nätverk fungerar neuronen som en strukturell enhet för informationsbehandling. Lokala kretsar skiljer sig fundamentalt från icke-lokala kretsar genom att enheten för informationsbehandling i dem inte är hela neuronen, utan en separat del av dess soma, dendrit eller axon. Local är en krets som bildas av lokala sektioner av en eller flera angränsande neuroner, så att förändringar i varje sektion inte påverkar hela neuronen som helhet.
Informationsegenskaperna hos en enskild neuron eller en del av den beror väsentligt på processerna som sker i dendritiska och axonala formationerna och egenskaperna hos dess membran. Membranet hos dendriterna från många typer av neuroner kan vara exciterbart och kan utföra aktiv excitation. Morfologiska data indikerar närvaron av geometriskt heterogena områden i förgreningssystemen av dendriter och axoner: förlängningar, grennoder.
ryggar, tangentiella kontakter. Sådana heterogeniteter är involverade i processerna för informationsbearbetning av en neuron och är de elementära länkarna i en neuron som transformerar information. Nära inhomogeniteter förändras excitationshastigheten, amplituden av aktiva och passiva processer och formen på excitationspulsen. Beroende på typen av heterogenitet kommer utsignalen att vara resultatet av en eller annan operation.
Informationsegenskaperna för lokala kretsar bestäms av de strukturella och funktionella egenskaperna hos neuronsektionerna som ingår i kretsen, och bestäms också av arten av laterala excitatoriska och hämmande interaktioner mellan neuronerna i nätverket.
1.3.1. Lokala kretsar
Vi kan villkorligt särskilja lokala dendritiska, lokala axonala och blandade lokala kretsar. Lokala dendritiska kedjor är de formationer där det finns dendro-dendritiska kontakter både i strukturen av en neuron och mellan dendriterna i angränsande neuroner.
Lokala axonkedjor bildar axo-axonala tangentiella kontakter och anastomotiska anslutningar av axonerna hos olika neuroner. Vi kallar blandade lokala kedjor för strukturer av axonala och dendritiska grenar där det finns kontakter av olika typer: dendro-denritiska, axo-axonala, axo-dendritiska, dendro-somatiska, etc. (Fig. 1.8). Dendriter och axoner kan ha strukturella och funktionella heterogeniteter som bidrar till expansionen av den uppsättning operationer som utförs i lokala kretsar.
Det enklaste fallet med lokala kretsar är lokala axonkedjor med axo-axonala synapser, när, under påverkan av en impuls som passerar längs axonet hos en neuron, en av axonterminalerna hos en annan - oexciterad neuron - triggas utan att påverka axonet grenar av denna neuron. I det här fallet utför neurons soma funktionen att mata grenarna, och informationsprocesser i grenarna utvecklas oberoende.
Mer komplexa lokala kretsar bildas som ett resultat av dendro-dendritiska kontakter av olika neuroner.
I detta fall sker lokal informationsbehandling vid flera punkter för lokal interaktion mellan dendriter. Det bör beaktas att vid lokal interaktion på nära avstånd är pulsgenerering inte nödvändig. Det räcker för en synaps att utöva sitt inflytande i närheten av en annan och att dess effektivitet förändras på grund av den elektrotoniska effekten som är förknippad med inträdet av kalcium i den lokala regionen av membranet i fråga.
Möjligheten att oberoende parallellt arbetande lokala kretsar bildas av separata sektioner av neuronmembranet innebär att enheten för bearbetning inte är neuronen som helhet, utan dess individuella loci. I detta avseende är funktionen hos icke-lokala nätverk sekundär i förhållande till information som förbehandlats i lokala neurala kretsar. Med hjälp av axonsystem sänds sedan signaler från det neurala nätverket över avsevärda avstånd.
1.3.2. Organisation av neurala nätverk i hjärnan
Ett neuralt nätverk förstås som ett icke-lokalt neuralt nätverk av nervceller, mellan vilka korsade (laterala) excitatoriska och hämmande interaktioner specificeras, som ett resultat av vilka de neurala nätverken är anpassade att utföra olika informationstransformationer.
Det finns flera typer av hämmande laterala interaktioner mellan neuroner i nätverket: direkt lateral hämning av angränsande neuroner genom hämmande kollateraler; kollateral inhibering genom en interkalärhämmande neuron; återkommande hämning, som består i det faktum att utsignalen från neuronen återvänder till den genom axonets hämmande kollateral och leder till hämning av neurons aktivitet. Returinhibition kan utföras som direkt eller sidoinhibition. Presynaptisk är påverkan av en neurons synaptiska kontakter på en annans synaptiska kontakter, vilket minskar aktiviteten hos dessa kontakter.
Hämning mellan neuroner kan ske genom både kemiska och elektriska synapser.
Det finns isotrop lateral hämning, jämnt fördelad mellan neuroner, och anisotrop lateral hämning, när det finns mer eller mindre hämning i en riktning än i andra.
Låt oss överväga organisationen av neurala nätverk i olika delar av hjärnan.
Ny bark. Den huvudsakliga strukturella och funktionella enheten (elementära neurala nätverk) i den nya cortex är kolumnen - en vertikalt placerad grupp av celler sammankopplade huvudsakligen av vertikala anslutningar. Den kortikala kolumnen av neuroner bildar en informationsbearbetningsmodul som väljer en specifik signalfunktion. Arrangemanget av neuroner i form av många kolumner gör det möjligt att identifiera flera variabler i ett lokalt område av den topografiska kortikala representationen. Med hjälp av vertikala kolumner byggs således en apparat för multidimensionell visning av den yttre miljön in i neocortexens tredimensionella struktur.
Således är formen på kroppens hudyta representerad som en karta på den postcentrala somatosensoriska cortexen.
Varje hudområde representeras av en grupp lokala kolumner, som var och en innehåller neuroner som svarar på en given stimulansmodalitet i ett givet hudområde. Ett annat exempel på den kolumnära organisationen av hjärnbarken är representationen av råttmorrhår i cortex.
Varje vibrissa representeras av en kolumn av celler som exciteras endast när denna vibrissa rör sig.
Följande typer av kortikala kolonner särskiljs: 1) mikrokolumner - de representerar graderingar av den framstående egenskapen; 2) hyperkolumner, som var och en innehåller en uppsättning mikrokolumner (en hyperkolumn presenterar en uppsättning graderingar av en given egenskap); 3) makrokolumner, som var och en innehåller en uppsättning hyperkolumner (varje makrokolumn representerar en uppsättning funktioner i ett givet topografiskt lokalt område av hjärnbarken, som representerar en del av den mottagliga ytan).
En hyperkolonn är den kortikala delen av en lokal analysator av en viss egenskap.
En makrokolumn representerar en uppsättning sådana lokala analysatorer.
Tangentiella gråsubstansfibrer som sträcker sig 1–2 mm verkar skapa lateral hämning mellan hyperkolonner som utsöndrar samma egenskaper i olika makrokolonner. Följaktligen sker informationsbehandling om olika signalegenskaper vid olika punkter i rymden i parallella kanaler.
Signaldisplayneuroner går upp från lager IV; neuroner i lager V och VI är exekutiva element. Neuronelementet i mikrokolumnen är en detektorneuron. En uppsättning detektorer av samma klass i en hyperkolumn av ett topografiskt lokus bildar en kvasi-receptiv yta. Syncentrum. Den visuella cortex hos primater bildas av vertikala kolonner av neuroner. Dessa kolumner representerar de dominerande ögonen, såväl som kolumner av neuroner som är känsliga för olika orienteringar av linjesegmentet som ligger inom det topografiskt lokala området av retinalprojektionen. Ett rakt linjesegment i synfältet exciterar en grupp makrokolumner, i vilka i sin tur hyperkolumner av en viss klass exciteras, nämligen hyperkolumner som markerar linjens orientering. I dessa hyperkolumner kommer endast de mikrokolumner att exciteras vars optimala känslighet för linjeorientering sammanfaller med linjeorienteringen.
Enkla celler i synbarken.
I enlighet med de funktionella egenskaperna särskiljs två huvudklasser av neuroner i kattens visuella cortex: celler med enkla receptiva fält (enkla) och celler med komplexa receptiva fält (komplexa). Området i det mottagliga fältet där en stationär stimulans producerar en urladdning kallas urladdningsfältet. Urladdningsfältet utgör endast en del av det receptiva fältet. Andra delar av det receptiva fältet har en förstärkande eller försvagande effekt. Enkla celler svarar optimalt vid en viss orientering av en linje i deras receptiva fält. Inhiberande zoner ligger intill det excitatoriska receptiva fältet hos celler.
Det finns två typer av enkla celler. Vissa är byggda av koncentriska neuroner i den laterala genikulära kroppen med excitatoriska centra, andra från neuroner med hämmande centra. Hämmande zoner är byggda av samma element som excitatoriska. Således svarar vissa celler på ljusa linjer på en mörk bakgrund, andra svarar på mörka linjer på en ljus bakgrund. Celler i den laterala genikulära kroppen, i motsats till enkla kortikala celler, har koncentriska snarare än högt komprimerade elliptiska mottagliga fält. De excitatoriska och inhiberande fälten i en enkel receptiv cell är inte centralt inriktade.
Den optimala orienteringen av det receptiva fältet är vinkelrät mot linjen som förbinder mitten av de excitatoriska och inhiberande fälten.
Komplexa celler i synbarken. Till skillnad från enkla celler kännetecknas komplexa celler i den visuella cortex av stora mottagliga fält.
Linjen med optimal orientering belägen i det receptiva fältet hos en sådan cell orsakar ett på-av-svar. En komplex cell svarar med en serie urladdningar när en linje rör sig i sitt mottagliga fält.
Det receptiva fältet av komplexa celler är uppbyggt av celler i den laterala genikulära kroppen med excitatoriska och hämmande centra. Detta gäller de excitatoriska och hämmande zonerna.
Komplexa celler, som enkla celler, har off-center, överlappande mottagliga fält.
Linjens optimala lutning är vinkelrät mot linjen som förbinder fältens mittpunkter. Komplexa celler exciteras av både ljusa och mörka ränder. Dessutom kompenseras reaktionen på ljus och mörker omedelbart av signaler av motsatt tecken. Den största skillnaden mellan enkla och komplexa celler beror alltså på olika typer av ingångar. Enkla celler har insignaler från antingen OH- eller OFF-neuroner. Komplexa celler tar emot signaler från både OH- och OFF-neuroner. När den utsätts för både mörka och ljusa ränder uppstår stark hämning vid kanterna av det receptiva fältet.
Retinotopisk projektion i synbarken. I apans visuella cortex finns en topografisk karta över synfältet. Denna karta kännetecknas av en "förstoringsfaktor", som indikerar vilken storlek lapp ett givet område av synfältet representerar. Förstoringsfaktorn mäts i mm/grad. Förstoringsfaktorn som presenteras som en funktion av excentricitet visar att foveala regionen representeras i synbarken av större ytor än de perifera delarna av synfältet. Det maximala värdet på förstoringsfaktorn är 6 mm/grad.
Synskärpan mäts av den minsta särskiljningsvinkeln mellan punkter på näthinnan. För fovea är synskärpan 0,67 minuter. I den visuella cortex motsvarar denna signalupplösning ett avstånd på 67 µm. Vid mätning av storleken på det receptiva fältet för en neuron i synbarken visade det sig att hyperkolumner (en komplett uppsättning av kolumner av neuroner med olika optimal orientering) finns i den visuella cortexen på ett avstånd av 1-2 mm. En lokal bild i den visuella cortex visas inom en hyperkolumn. Skillnaden mellan två stimuli på kortikal nivå bestäms av storleken på det receptiva fältet.
Utveckling av neuroner i synsystemet. Neuroner i den laterala genikulära kroppen i reläkärnan i det visuella systemet bildas under veckan runt den 40:e dagen av embryonal utveckling. Den synaptiska apparaten börjar ta form 20 dagar senare. En snabb ökning av storlek och cellkroppar sker under den första månaden av livet efter födseln. Under förhållanden av visuell deprivation störs denna process. I de sena prenatala och tidiga postnatala perioderna detekteras redan en skiktad struktur. De viktigaste tecknen på neuronal omognad är närvaron av ett stort antal hårliknande utsprång på dendriterna och förtjockningar i form av kottar som är associerade med tillväxtprocessen.
I slutet av den första månaden efter födseln försvinner hårstrån och förtjockningar på dendriterna. Graden av morfologiska förändringar varierar mellan olika typer av neuroner.
Multipolära neuroner kännetecknas av flera huvuddendriter som härrör från neuronens soma. Sådana neuroner finns i alla lager från det första till det sjätte. Det finns dock en gradient i deras mognadsgrad. Således, när det första lagret innehåller neuroner med ett utvecklat dendritiskt träd utan hår och förtjockningar, har dendriterna i multipolära neuroner i det femte och sjätte lagret fortfarande hår och förtjockningar, och deras dendritiska grenar är dåligt utvecklade.
Bipolära neuroner har antingen två huvuddendriter eller tre, i det senare fallet har de en triangelform. Bipolära neuroner har en högre grad av mognad än multipolära neuroner.
Neuroner med en axonliknande dendrit kännetecknas av tunna, cylindriska dendriter som ökar i längd under utvecklingen. Neuroner med solfjäderformade dendriter förvärvar egenskaperna hos ett vuxentillstånd även i embryonalstadiet.
Det allmänna mönstret för mognad av neuroner i den laterala genikulära kroppen inkluderar: 1) utseendet av tillväxtområden i form av koner (tidig prenatal period); 2) utseendet av tunna hårstrån på dendriter (sen prenatal period); 3) minskning av tillväxtområden och försvinnande av hårstrån (flera dagar efter förlossningen).
Effektiviteten hos apans synsystem, omedelbart efter födseln, är en konsekvens av prenatal differentiering av neuroner i den laterala genikulära kroppen. Senare följer endast mognad med bildandet av ryggar och distala sektioner av dendritiska grenar. Full mognad av det dendritiska systemet avslutas fyra veckor efter födseln.
Neuroner i den visuella cortex bildas under påverkan av miljöfaktorer. I det här fallet är neuroner i cortex IV-lagret, som tar emot afferenter från den externa geniculate kroppen, genetiskt inställda selektivt till en viss lutning av linjen. När det gäller neuronerna i de övre lagren av cortex, som bildar en kolumn, förvärvar de selektivitet beroende på vilka neuroner i lager IV som exciteras av externa signaler. Sålunda bildar de i den "vertikala miljön" förbindelser med detektorerna för vertikala linjer i IV-lagret och i den "horisontella miljön" - med detektorerna för de horisontella linjerna i IV-lagret. Som ett resultat, i en begränsad miljö, bildas endast sådana kolumner som har egenskaperna hos exciterbara neuroner i lager IV.
Studier av absorptionen av dioxiglukos av neuroner i den visuella cortex under förhållanden av stimulering av kattens öga med vertikala eller horisontella gitter har visat att celler med generell orienteringsselektivitet bildar parallella ränder på ytan av cortex, ortogonala mot representationen av vertikalen. meridian. Neuroner som kännetecknas av en allmän selektiv orientering bildar en kolumn. Systemet för representation av det dominerande ögat är organiserat på ett liknande sätt.
Om kattungar växte upp i en "horisontell" eller "vertikal" miljö, var glukosupptaget annorlunda med vertikal och horisontell stimulering.
När orienteringen av linjerna i djurets erfarenhet sammanföll med orienteringen av teststimulansen fann man bredare ränder bildade av neuroner med samma orientering.
När det fanns en missmatchning var ränderna smala och bildades nästan uteslutande av neuroner i lager IV av cortex, som tar emot afferenter från den laterala genikulära kroppen
Således har lager IV-neuroner orienteringsselektivitet, som bestäms genetiskt och inte beror på visuell erfarenhet. Neuroner i högre lager av cortex förvärvar orienteringsselektivitet under påverkan av visuell stimulering, som försvinner under den kritiska utvecklingsperioden.
En neuron, till skillnad från andra celler, kan exciteras. Excitation av en neuron hänvisar till genereringen av en aktionspotential av neuronen. Huvudrollen i excitation tillhör en annan typ av jonkanaler, när de öppnas rusar natriumjoner in i cellen. Låt oss komma ihåg att på grund av den konstanta driften av pumpkanalerna är koncentrationen av natriumjoner utanför cellen ungefär 50 gånger högre än i cellen, därför, när natriumkanaler öppnas, rusar natriumjoner in i cellen och kaliumjoner börjar lämna cellen genom öppna kaliumkanaler. Varje typ av jon, natrium och kalium, har sin egen typ av jonkanal. Rörelsen av joner genom dessa kanaler sker längs koncentrationsgradienter, dvs. från en plats med hög koncentration till en plats med lägre koncentration.
Låt oss svara på frågan: hur öppnar och stänger jonkanaler? I en vilande neuron är membranets natriumkanaler stängda och, som beskrivits ovan, registreras en vilopotential på cirka -70 mV på membranet (negativitet i cytoplasman). Om membranpotentialen är depolariserad (minskad
Ris. 2.6. Drift av den spänningsstyrda natriumkanalen.
A - kanal är öppen; B - kanal inaktiverad; B - kanalen är inaktiverad och stängd; 1 - membran; 2 - potentialberoende kanal; 3 - inaktiverande partikel.
membranpolarisering) med cirka 10 mV, öppnas natriumjonkanalen (Fig. 2.6). Faktum är att kanalen har en sorts ventil som reagerar på membranpotentialen och öppnar denna kanal när potentialen når ett visst värde. Denna kanal kallas potentiellt beroende. Så snart kanalen öppnas rusar natriumjoner in i neurons cytoplasma från den intercellulära miljön, av vilka det finns cirka 50 gånger fler än i cytoplasman. Denna rörelse av joner är en konsekvens av en enkel fysisk lag: joner rör sig längs en koncentrationsgradient. Således kommer natriumjoner in i neuronen, de är positivt laddade. Med andra ord kommer en inkommande ström av natriumjoner att flöda genom membranet, vilket kommer att förskjuta membranpotentialen mot avpolarisering, d.v.s. minska membranpolarisation. Ju mer natriumjoner som kommer in i cytoplasman hos en neuron, desto mer depolariseras dess membran. Membranpotentialen kommer att öka, vilket öppnar fler och fler natriumkanaler. Men denna potential kommer inte att växa i det oändliga, utan bara tills den blir ungefär +55 mV. Denna potential motsvarar de natriumjonkoncentrationer som finns i och utanför neuronen, vilket är anledningen till att den kallas natriumjämviktspotential. Kom ihåg att i vila hade membranet en potential på -70 mV, då blir potentialens absoluta amplitud cirka 125 mV. Vi säger "om", "ungefär" eftersom celler av olika storlekar och typer har detta
Ris. 2.7. Schema av händelser under neuron excitation.
potentialen kan skilja sig något, vilket beror på formen på dessa celler (till exempel antalet processer), såväl som egenskaperna hos deras membran.
Allt ovanstående kan formellt beskrivas enligt följande. I vila beter sig cellen som en "kaliumelektrod", och när den är exciterad beter den sig som en "natriumelektrod". Men efter att potentialen på membranet når sitt maximala värde på +55 mV, är natriumjonkanalen på sidan som vetter mot cytoplasman igensatt med en speciell proteinmolekyl. Detta är den så kallade "natriuminaktiveringen" (se fig. 2.6); det inträffar på ungefär 0,5-1 ms och beror inte på membranpotentialen. Membranet blir ogenomträngligt för natriumjoner. För att membranpotentialen ska återgå till sitt ursprungliga tillstånd - vilotillståndet, är det nödvändigt att en ström av positiva partiklar lämnar cellen. Sådana partiklar i neuroner är kaliumjoner. De börjar komma ut genom öppna kaliumkanaler. Kom ihåg att kaliumjoner ackumuleras i en cell i vila, så när kaliumkanaler öppnas lämnar dessa joner neuronen och återför membranpotentialen till sin ursprungliga nivå (vilonivå). Som ett resultat av dessa processer återgår neuronmembranet till sitt viloläge (-70 mV) och neuronen förbereder sig för nästa excitationsakt.
Sålunda är uttrycket av neuronexcitation genereringen på neuronmembranet agerande potential. Dess varaktighet
Ris. 2.8. Aktionspotential hos en hunds hjärtkammarcell.
i nervceller är värdet ca 1/1000 s (1 ms). Den beskrivna händelseförloppet visas i fig. 2.7.
Liknande aktionspotentialer kan förekomma i andra celler, vars syfte är att exciteras och överföra denna excitation till andra celler. Till exempel innehåller hjärtmuskeln speciella muskelfibrer som säkerställer en oavbruten funktion av hjärtat i ett automatiskt läge. Aktionspotentialer genereras också i dessa celler (Fig. 2.8). De har dock en utdragen, nästan platt topp, och varaktigheten av en sådan aktionspotential kan vara upp till flera hundra millisekunder (jämför med 1 ms för en neuron). Denna karaktär av hjärtmuskelcellens aktionspotential är fysiologiskt motiverad, eftersom excitationen av hjärtmuskeln måste förlängas så att blodet hinner lämna ventrikeln. Vad är orsaken till en så långvarig aktionspotential i denna typ av celler? Det visade sig att i membranet av dessa celler stänger natriumjonkanalerna inte lika snabbt som i neuroner, d.v.s. natriuminaktivering försenas.
Som framgår av denna beskrivning ersätts nervcellens excitation (aktionspotential) med den så kallade "vilan". Det råder dock ingen fred under denna period. Som nämnts ovan finns det även pumpkanaler i membranet, vars antal är ungefär 10 gånger större än jonkanalerna, och de arbetar hela tiden, pumpar ut överskott av natriumjoner från cytoplasman och pumpar in de saknade kaliumjonerna. Tack vare det outtröttliga arbetet med dessa kanaler är neuronen alltid redo att skjuta.
Mekanismen för cellexcitation som beskrivs ovan (naturligtvis kan inte alla celler i vår kropp exciteras) är i princip densamma, inte bara i mänskliga neuroner och muskelceller, utan också i liknande celler från andra organismer. Till exempel, i neuroner hos blötdjur, maskar, råttor och apor, inträffar händelsesekvenserna som beskrivs ovan när de exciteras. Dessutom är designen av membran, inklusive kanaler, också ungefär densamma i alla organismer på jorden.
Som redan nämnts är kanaler proteinmolekyler som "häftar" membranet (en del av molekylen är belägen i cytoplasman och den andra i den extracellulära miljön). Intressant nog håller dessa proteinmolekyler som bildar jon- eller pumpkanaler inte för evigt, utan ersätts ständigt med nya (ungefär med några timmars mellanrum). Allt detta indikerar den mycket höga dynamiken i neuronstrukturen.
Neuronen är kapabel till excitation, vilket består i det faktum att neurons membran i vilotillstånd har en potential av storleksordningen -70 mV (negativitet av β-cytoplasman), och β i excitationstillståndet får en potential av + 55 mV. Sålunda är det absoluta värdet av aktionspotentialen cirka 125 mV. Varaktigheten av en neurons aktionspotential är endast cirka 1 ms (1/1000 s).
Neuronen är bunden av ett lipoprotein (fett-protein) membran. Membranpotentialen hos en neuron påverkar processerna för transmembranmetabolism. Membranpotentialen hos en vilande cell kallas vilopotential.
Diffusionshastigheten för ämnen genom ett membran beror huvudsakligen på molekylernas storlek och deras relativa löslighet i fetter.
Translokasproteiner finns i cellmembran. Genom att interagera med en specifik ligand säkerställer de dess diffusion (transport från ett område med högre koncentration till ett område med lägre koncentration) över membranet.
Särskilda molekylära receptorer placerade på membranet kan kopplas till signalerande (kontroll)ämnen, som ett resultat av vilket tillståndet hos membranet och hela cellen kan förändras. Molekylära receptorer utlöser biokemiska reaktioner som svar på anslutningen av lagander (kontrollämnen) med dem.
katalytisk enzymaktivitet. Enzymer kan vara inbäddade i membranet eller associerade med dess yta (både inuti och utanför cellen), och där utför de sina enzymatiska aktiviteter.
Som du kan se är huvudegenskapen hos ett membran dess permeabilitet för olika ämnen.
Fettlösliga, opolära små molekyler passerar lättare och bäst genom membranet. Således passerar små opolära molekyler som O2, steroider, sköldkörtelhormoner och fettsyror lättast genom membranet genom enkel diffusion. Små polära oladdade molekyler diffunderar något långsammare genom lipidskiktet: CO2, NH3, H2O, etanol, urea. Diffusionen av glycerol är redan mycket långsammare, och glukos kan praktiskt taget inte passera genom membranet på egen hand. För alla laddade molekyler, oavsett storlek, är lipidmembranet praktiskt taget ogenomträngligt. Det är alltså endast fettlösliga ämnen som kan lösas upp i membranets fetthaltiga (lipid) skikt som fritt kan penetrera genom membranet in i cellen och tillbaka. Transport av andra ämnen över membranet kräver speciella mekanismer. Vilka ämnen behöver dras genom membranet "med tvång"? Dessa är alla polära molekyler som är olösliga i fett: vattenmolekyler, joner (elektrolyter) och större näringsmolekyler som glukos och aminosyror.
För att transportera in i cellen ämnen som har dålig förmåga att diffundera genom membranets lipidskikt krävs speciella transportstrukturer.
Typer av membrantransportstrukturer:
1. Jonkanaler är speciella porer (hål) i membranet, bildade av kanalproteiner, vilket gör att joner kan passera genom membranet i båda riktningarna: både inåt och utåt.
2. Translokaser är speciella membranproteiner som underlättar ett ämnes passage genom membranet på grund av deras tillfälliga bindning till det diffuserande ämnet. De kräver ingen energi och arbetar i båda riktningarna beroende på koncentrationen av det överförda ämnet.
3. Transportörer är proteinstrukturer som med kraft drar vissa ämnen genom cellmembranet i en viss riktning med energiförbrukning. Jonpumpar är jontransportörer. Beroende på hur de använder energi för sitt arbete kan transportörer delas in i "import" och "antiport". Symporttransportörer använder gemensam transport i en riktning av två ämnen: en av dem måste ha större potentiell energi för att röra sig genom membranet. Till exempel symport av glukos in i cellen med natriumjoner, eller symport av kalciumjoner med natriumjoner. Antiporttransportörer (växlare) använder mottransport av två ämnen med olika potentiella diffusionsenergier. Så fungerar till exempel natrium-kaliumjonpumpen.
Så överföringen av ämnen över cellmembranet sker på olika sätt.
Mekanismer för transport av ämnen över membranet:
1. Enkel diffusion av fettlösliga (hydrofoba) ämnen genom membranets fettskikt. Detta är en passiv process under påverkan av en gradient (skillnad) i koncentrationen av ett ämne på olika sidor av membranet. (Se video: passiv transport över membranet).
2. Okontrollerad diffusion (okontrollerad passiv överföring) av vattenlösliga ämnen genom konstant öppna jonkanaler i membranet.
3. Kontrollerad diffusion (kontrollerad passiv transport) av vattenlösliga ämnen genom kontrollerade jonkanaler i membranet.
4. Aktiv transport av vattenlösliga ämnen med hjälp av speciella proteintransportstrukturer (transportörer) på grund av användningen av energin från ATP-nedbrytning.
En av membranets viktigaste transportstrukturer är ATPase-enzymet. ATPaser av olika typer transporterar joner över membranet. De överför dem både inuti cellen och omvänt utanför.
Namnet ATPas betyder att det är ett enzym som syftar till att bryta ner ATP (adenosintrifosfatas)
6. Neuronverkanspotential. Förändringar i excitabilitet vid upphetsning.
En aktionspotential är en elektrofysiologisk process som uttrycks i den snabba fluktuationen av den vilande membranpotentialen på grund av jonernas rörelse in i och ut ur cellen och kan fortplanta sig utan att dämpas. PD säkerställer överföring av signaler mellan nervceller, mellan nervcentra och arbetsorgan.
Aktionspotentialen är den elektriska impuls som levererar information från receptorer till hjärnan, och med vars hjälp hjärnan styr kroppen. För dess existens behövs specialdesignade celler, neuroner, vars membran är täckta på båda sidor med positivt och negativt laddade joner, som bara väntar på en signal för att bära denna elektriska impuls längs hela cellens längd. Huvudplatsen för aktionspotentialen är neurons axon. Dendriterna hos vissa typer av neuroner kan också leda elektriska impulser.
Förändringar i excitabilitet vid upphetsning. Vid upphetsning ändras excitabilitet i faser.
1) primär exaltationsfas - excitabilitet över det normala, reaktion på pulver och subtröskelstimuli
2) absolut refraktär fas - det finns inget svar på stimulansen, vilket beror på inaktivering av natriumkanaler
3) fas av relativ eldfasthet - excitabilitet återställs, och svaret blir möjligt endast under påverkan av en stimulans av övertröskelstyrka, vilket beror på den utgående kaliumströmmen
4) sekundär exaltationsfas - svar på en subtröskelstimulus
5) fas av subnormal excitabilitet - excitabilitet är under det normala, ett svar är möjligt på verkan av en övertröskelkraft.
Natrium-kalium-pumpen är ansvarig för att återställa den ursprungliga positionen "natrium utanför, kalium inuti", ta bort tre Na+ från cellen och samtidigt bära två K+ inuti.
Som du kan se är allt väldigt enkelt, det viktigaste är att öppna de nödvändiga jonkanalerna. Stimulusstyrda jonkanaler öppnas av ett irriterande ämne (stimulus). Kemo-gated jonkanaler öppnas av en sändare (excitatorisk eller hämmande). Mer exakt, beroende på vilka kanaler (natrium, kalium eller klorid) mediatorn kommer att verka på, så kommer den lokala potentialen - excitatorisk eller hämmande. Och mediatorn för både excitatoriska lokala potentialer och hämmande kan vara densamma; det är viktigt vilka jonkanaler som kommer att binda till den med sina molekylära receptorer - natrium, kalium eller klorid.
7. Nervfibrer, deras klassificering. Funktioner för ledning av excitation längs icke-myeliniserade och myeliniserade fibrer.

Nervfibrer är processer av nervceller omgivna av höljen av neurogliaceller.
Baserat på närvaron (eller frånvaron) av myelinskidan delas nervfibrer in i myelinerade och icke-myeliniserade.
Lloyd-Hunt-klassificeringen av nervfibrer tar hänsyn till fiberdiameter och impulsledningshastighet, men används endast för sensoriska fibrer.
Erlanger-Gasser-klassificeringen av nervfibrer är baserad på studiet av den sammansatta aktionspotentialen hos en blandad perifer nerv (till exempel ischiasnerven).
Egenskaper för excitationsförökning längs omyeliniserade fibrer:
1. Excitation sprider sig kontinuerligt och hela fibern täcks omedelbart av excitation.
2. Excitation sprider sig vid låg hastighet.
3. Excitation sprids med avtagande (minskande strömstyrka mot slutet av nervfibern).
Excitation förs genom omyeliniserade fibrer till de inre organen från nervcentra.
Funktioner för utbredning av excitation längs myelinfibrer:
1. Utbredningen av AP i myeliniserade nervfibrer sker på ett saltande sätt - krampaktigt från interception till interception, d.v.s. excitation (AD) verkar "hoppa" genom delar av nervfibern täckta med myelin, från en interception till en annan, och hela fibern täcks inte omedelbart av excitation.
2. Excitation sprider sig med hög hastighet.
Excitation sprids längs myelinfibrer från analysatorerna till centrala nervsystemet, till skelettmusklerna, d.v.s. där höghastighetsrespons krävs.
HUVUDSKILLNADEN ÄR ATT MYELINFIBRRNA BÄR MYCKET SNABBARE.
Omyeliniserade nervfibrer- ett lager av Schwann-celler, mellan dem finns det slitsliknande utrymmen. Cellmembranet är i kontakt med omgivningen genomgående. När irritation appliceras sker excitation vid det irriterande ämnets verkningsställe. Omyeliniserade nervfibrer har elektrogena egenskaper (förmågan att generera nervimpulser) över hela sin längd.
Myeliniserade nervfibrer- täckt med lager av Schwann-celler, som på vissa ställen bildar noder av Ranvier (områden utan myelin) var 1 mm. Varaktigheten av Ranviers nod är 1 µm. Myelinskidan utför trofiska och isolerande funktioner (högt motstånd). Områden täckta med myelin har inte elektrogena egenskaper. De är besatta av noder av Ranvier. Excitation sker vid noden av Ranvier närmast verkansplatsen för stimulansen. Vid Ranviers noder finns det en hög täthet av Na-kanaler, så vid varje nod av Ranvier finns en ökning av nervimpulser.
Ranviers noder fungerar som reläer (genererar och förstärker nervimpulser).
8. Lagar för ledning av excitation längs nerven.
1) Excitation är möjlig i alla riktningar
2) Excitation kan endast utföras längs en hel nerv (inte skadad)
Lagen om isolerad ledning av excitation längs en nervfiber. Som en del av en nerv sprids excitation längs en nervfiber isolerat utan att överföras till andra fibrer som finns i nerven.
Lagen om tvåvägsuppförande excitation längs nervfibern Nerver har bilateral konduktivitet, d.v.s. excitation kan spridas i vilken riktning som helst från det exciterade området (orten för dess ursprung), d.v.s. centripetalt och centrifugalt. Detta kan bevisas om inspelningselektroder placeras på nervfibern på ett visst avstånd från varandra, och irritation appliceras mellan dem. Excitationen kommer att registreras av elektroder på båda sidor av irritationsplatsen. Den naturliga utbredningsriktningen för excitation är: i afferenta ledare - från receptorn till cellen, i efferenta ledare - från cellen till arbetsorganet.
Lagen om nervfiberns anatomiska och fysiologiska integritet Genomförande excitation längs en nervfiber är möjlig endast om dess anatomiska och fysiologiska integritet bevaras, d.v.s. överföring av excitation är endast möjlig genom en strukturellt och funktionellt oförändrad, oskadad nerv (lagar om anatomisk och fysiologisk integritet).
Lagen om isolerad ledning av excitation längs en nervfiber.B I nervens sammansättning sprider sig excitation längs nervfibern isolerat utan att överföras till andra fibrer som finns i nerven. Isolerad ledning av excitation beror på det faktum att motståndet hos vätskan som fyller de intercellulära utrymmena är betydligt lägre än motståndet hos nervfibermembranet. Därför passerar huvuddelen av strömmen som uppstår mellan de exciterade och icke-exciterade sektionerna av nervfibern genom de intercellulära luckorna, utan att påverka närliggande nervfibrer. Isolerad ledning av excitation är viktig. Nerven innehåller ett stort antal nervfibrer (sensoriska, motoriska, autonoma), som innerverar effektorer (celler, vävnader, organ) av olika strukturer och funktioner. Om excitationen inuti nerven spred sig från en nervfiber till en annan, skulle organens normala funktion vara omöjlig.
9. Synapser. Centrala och perifera synapser.
En synaps är en kontaktpunkt mellan två neuroner eller mellan en neuron och en effektorcell som tar emot en signal. Perifera synapser: neuromuskulära
neurosekretorisk (axo-vasal)
receptor-neuronal
Centrala synapser
axo-dendritisk - med dendriter, inklusive
axo-ryggrad - med dendritiska taggar, utväxter på dendriter;
axo-somatisk - med nervcellers kroppar;
axo-axonal - mellan axoner;
dendro-dendritisk - mellan dendriter;
Centrala synapser
I nervsystemet bildas synapser mellan olika nervcellers processer, samt mellan processerna och cellkropparna. Följaktligen kallas de:
- Axo-axonal,
- Axo-dendritisk,
- Axo-somatisk,
- Dendro-somatisk,
- Dendro-dendritisk.
Antalet synapser på en neuron är mycket stort och når flera tusen.
 Fig.3.4. Struktur av den axosomatiska synapsen.
Fig.3.4. Struktur av den axosomatiska synapsen.
Som ett exempel kan vi betrakta en axosomatisk synaps (mellan en nervcells axon och en annans kropp), vars struktur visas i fig. 3.4. Ett axon som närmar sig en annan neurons kropp bildar en förlängning som kallas presynaptisk ändelse eller terminal. Ett membran av en sådan ände kallas presynaptisk. Nedanför ligger den synaptisk klyfta, vars bredd är 10-50 mikron. Bakom den synaptiska klyftan ligger neuronkroppens membran, kallat synaps postsynaptisk.
1 - axon,
2 - synaptisk knapp,
3 - presynaptiskt membran,
4 - förlorat synaptiskt membran,
5 - receptorer av det postsynaptiska membranet,
6 - synaptiska vesiklar med en sändare,
7 - sändarkvanta i den synaptiska klyftan,
8 - mitokondrier.
CaCB är ett kalciumbindande protein.
Perifera synapser
Perifera synapser bildas mellan ändarna av den efferenta nerven och effektormembranet. För somatiska reflexer är dessa synapser mellan motornerven och skelettmuskeln, därför kallas de även neuromuskulära synapser (Fig. 3.7). På grund av formen av synaptisk bildning fick de namnet ändplattor. Strukturen och de grundläggande egenskaperna hos ändplattor liknar i allmänhet centrala synapser. Mediatorn vid neuromuskulära synapser är acetylkolin, frisatt i kvanta. Förstörelsen av sändaren i det synaptiska höljet sker på grund av enzymet kolinesteras. Receptorerna i det postsynaptiska membranet är av den nikotinkänsliga typen (n-kolinoreceptorer) och blockeras konkurrerande av curaregift, vilket stoppar neuromuskulär överföring. Mediator-receptorkomplexet som bildas på det postsynaptiska membranet aktiverar kemokänsliga receptorstyrda Na-kanaler, orsakar natriumström in i cellen, depolarisering och bildandet av en potential som kallas ändplattaspotential(PKP), som är en analog EPSP centrala synapser.
Den viktigaste särskiljande egenskapen hos neuromuskulära synapser från centrala är deras höga amplitud PKP, som alltid överskrider den kritiska nivån av membrandepolarisering, därför kräver EPP inte summering som EPSP, och varje EPP leder till generering av en aktionspotential, excitation och sammandragning av muskelcellen.
 Fig.3.7. Strukturen av den neuromuskulära synapsen.
Fig.3.7. Strukturen av den neuromuskulära synapsen.
Detta kan bero på det faktum att det postsynaptiska membranet har många veck, vilket avsevärt ökar ytan av interaktion mellan sändaren och receptorerna (Fig. 3.7).
1 - presynaptisk ändplatta,
2 - synaptiska vesiklar med en sändare,
3 - mitokondrier,
4 - synaptisk klyfta med mediator quanta,
5 - vikt postsynaptisk membran,
6 - receptorer av det postsynaptiska membranet,
7 - sarkoplasmatiskt retikulum,
8 - kontraktil apparat (myofibriller) av muskelcellen.
10. Synapser med en elektrisk signalöverföringsmekanism. Egenskaper.
Elektrisk synaps, eller ephaps, är en elektrisk gap-kontakt mellan två intilliggande neuroner eller andra exciterbara celler, som bildas i form av ett smalt gap som innehåller element som endast är karakteristiska för denna typ av kontakt
Vad är en elektrisk synaps? Elektriska synapser är intercellulära formationer genom vilka överföringen av en excitationsimpuls säkerställs. Denna process uppstår på grund av uppkomsten av en elektrisk ström mellan två sektioner som kallas presynaptisk och postsynaptisk.
Viktigt arbete med elektriska synapser Egenskaperna hos elektriska synapser är följande:
Snabb verkan (mycket överlägsen aktivitet i synapser av kemisk typ); ---- svaga spåreffekter (det finns praktiskt taget ingen summering från successiva pulser);
Pålitlig överföring av excitation;
Hög plasticitet;
Överför i en och båda riktningarna.
Funktioner i strukturen.

11. Synapser med en kemisk signalöverföringsmekanism. Egenskaper.
En kemisk synaps är en speciell typ av intercellulär kontakt mellan en neuron och en målcell. I denna typ av synaps spelas rollen som en mellanhand (förmedlare) av överföring av en kemisk substans.
Synaptiska kontakter kan vara mellan axon och dendrit (axodendritisk), axon och cellsoma (axosomatisk), axon (axoaxonal), dendriter (dendrodendritisk), dendriter och cellsoma.
I vila kommer sändaren in i den synaptiska klyftan konstant, men i små mängder. Under påverkan av den inkommande spänningen ökar mängden medlare kraftigt. Sedan förflyttar sig transmittern till det postsynaptiska membranet, verkar på dess specifika receptorer och bildar ett transmitter-receptorkomplex på membranet. Detta komplex förändrar membranets permeabilitet för K+- och Na+-joner, som ett resultat av vilket dess vilopotential förändras.

- lyckades. Genom kontrollmekanism: elektriskt, kemiskt och mekaniskt styrd;
- okontrollerbar. De har ingen grindmekanism och är alltid öppna, joner flödar konstant, men långsamt.
Vilande potential- detta är skillnaden i elektrisk potential mellan cellens yttre och inre miljö.
Mekanismen för bildandet av vilande potentialer. Den omedelbara orsaken till vilopotentialen är den ojämna koncentrationen av anjoner och katjoner inuti och utanför cellen. För det första motiveras detta arrangemang av joner av skillnaden i permeabilitet. För det andra lämnar betydligt mer kaliumjoner cellen än natrium.
Agerande potential- detta är excitationen av cellen, den snabba fluktuationen av membranpotentialen på grund av diffusion av joner in i och ut ur cellen.
När en stimulans verkar på celler i exciterbar vävnad, aktiveras och inaktiveras natriumkanaler först mycket snabbt, sedan aktiveras och inaktiveras kaliumkanaler med viss fördröjning.
Som ett resultat diffunderar joner snabbt in i eller ut ur cellen längs en elektrokemisk gradient. Det här är spänning. Baserat på förändringen i storleken och tecknet på cellladdningen särskiljs tre faser:
- 1:a fasen - depolarisering. Minska cellladdningen till noll. Natrium rör sig mot cellen enligt en koncentration och elektrisk gradient. Rörelsetillstånd: natriumkanalport öppen;
- 2:a fasen - inversion. Vända laddningsskylten. Inversion innefattar två delar: stigande och fallande.
Den stigande delen. Natrium fortsätter att röra sig in i cellen enligt koncentrationsgradienten, men mot den elektriska gradienten (det stör).
Fallande del. Kalium börjar lämna cellen enligt en koncentration och elektrisk gradient. Porten till kaliumkanalen är öppen;
- 3:e fasen - repolarisering. Kalium fortsätter att lämna cellen enligt koncentrationsgradienten, men tvärtemot den elektriska gradienten.
Upphetsningskriterier
Med utvecklingen av en aktionspotential uppstår en förändring i vävnadsexcitabilitet. Denna förändring sker i etapper. Tillståndet för den initiala polariseringen av membranet återspeglar typiskt den vilande membranpotentialen, som motsvarar det initiala tillståndet av excitabilitet och därför det initiala tillståndet för den exciterbara cellen. Detta är en normal nivå av excitabilitet. Pre-spike-perioden är perioden för aktionspotentialens början. Vävnadsexcitabilitet är något ökad. Denna fas av excitabilitet är primär exaltation (primär övernormal excitabilitet). Under utvecklingen av prespiken närmar sig membranpotentialen den kritiska nivån av depolarisering, och för att uppnå denna nivå kan stimulansstyrkan vara mindre än tröskeln.
Under utvecklingen av spiken (topppotential) sker ett lavinliknande flöde av natriumjoner in i cellen, som ett resultat av vilket membranet laddas upp och det förlorar förmågan att reagera med excitation på stimuli ovanför -tröskelstyrka. Denna fas av excitabilitet kallas absolut eldfasthet, dvs. absolut orimlighet, som varar till slutet av membranuppladdningen. Absolut membranrefraktärhet uppstår på grund av att natriumkanaler helt öppnas och sedan inaktiveras.
Efter slutet av laddningsfasen återställs dess excitabilitet gradvis till sin ursprungliga nivå - detta är en fas av relativ eldfasthet, d.v.s. relativ oupphetsning. Det fortsätter tills membranladdningen återställs till ett värde som motsvarar den kritiska nivån av depolarisering. Eftersom den vilande membranpotentialen ännu inte har återställts under denna period, reduceras vävnadens excitabilitet, och ny excitation kan endast uppstå under verkan av en supertröskelstimulus. Minskningen av excitabilitet i den relativa eldfasta fasen är associerad med partiell inaktivering av natriumkanaler och aktivering av kaliumkanaler.
Nästa period motsvarar en ökad nivå av excitabilitet: fasen av sekundär exaltation eller sekundär övernormal excitabilitet. Eftersom membranpotentialen i denna fas är närmare den kritiska nivån av depolarisering, jämfört med vilotillståndet för den initiala polarisationen, reduceras stimuleringströskeln, d.v.s. cellexcitabilitet ökar. Under denna fas kan ny excitation uppstå från verkan av stimuli av undertröskelstyrka. Natriumkanaler är inte helt inaktiverade under denna fas. Membranpotentialen ökar - ett tillstånd av membranhyperpolarisering inträffar. När man rör sig bort från den kritiska nivån av depolarisering, ökar stimuleringströskeln något, och ny excitation kan endast uppstå under påverkan av stimuli med ett övertröskelvärde.
Mekanismen för uppkomsten av vilande membranpotential
Varje cell i vila kännetecknas av närvaron av en transmembranpotentialskillnad (vilopotential). Typiskt är laddningsskillnaden mellan de inre och yttre ytorna av membranen -80 till -100 mV och kan mätas med hjälp av externa och intracellulära mikroelektroder (Fig. 1).
Potentialskillnaden mellan cellmembranets yttre och inre sida i viloläge kallas membranpotential (vilopotential).
Skapandet av vilopotentialen säkerställs av två huvudprocesser - den ojämna fördelningen av oorganiska joner mellan de intra- och extracellulära utrymmena och den ojämna permeabiliteten hos cellmembranet för dem. Analys av den kemiska sammansättningen av extra- och intracellulär vätska indikerar en extremt ojämn fördelning av joner (tabell 1).
I vila finns det många anjoner av organiska syror och K+-joner inuti cellen, vars koncentration är 30 gånger högre än utanför; Tvärtom finns det 10 gånger fler Na+-joner utanför cellen än inuti; CI- är också större på utsidan.
I vila är nervcellernas membran mest permeabelt för K+, mindre permeabelt för CI- och väldigt lite permeabelt för Na+ Nervfibermembranets permeabilitet för Na+ i vila är 100 gånger mindre än för K+. För många anjoner av organiska syror är membranet i vila helt ogenomträngligt.
Ris. 1. Mätning av vilopotentialen för en muskelfiber (A) med användning av en intracellulär mikroelektrod: M - mikroelektrod; I - likgiltig elektrod. Strålen på oscilloskopskärmen (B) visar att innan membranet genomborrades av mikroelektroden var potentialskillnaden mellan M och I lika med noll. Vid punkteringsögonblicket (visas med en pil) upptäcktes en potentialskillnad, vilket indikerar att membranets insida är negativt laddad i förhållande till dess yttre yta (enligt B.I. Khodorov)
Tabell. Intra- och extracellulära koncentrationer av joner i muskelcellen hos ett varmblodigt djur, mmol/l (enligt J. Dudel)
|
Intracellulär koncentration |
Extracellulär koncentration |
|
|
A- (anjoner av organiska föreningar) |
På grund av koncentrationsgradienten når K+ cellens yttre yta och utför sin positiva laddning. Anjoner med hög molekylvikt kan inte följa K+ eftersom membranet är ogenomträngligt för dem. Na+-jonen kan inte heller ersätta de förlorade kaliumjonerna, eftersom membranets permeabilitet för den är mycket mindre. CI- längs koncentrationsgradienten kan bara röra sig inuti cellen, vilket ökar den negativa laddningen av membranets inre yta. Som ett resultat av denna rörelse av joner uppstår polarisering av membranet när dess yttre yta laddas positivt och den inre ytan laddas negativt.
Det elektriska fältet som skapas på membranet stör aktivt fördelningen av joner mellan cellens inre och yttre innehåll. När den positiva laddningen på cellens yttre yta ökar, blir det allt svårare för K+-jonen, som är positivt laddad, att röra sig från insidan till utsidan. Det verkar gå uppför. Ju större positiv laddning på den yttre ytan, desto mindre K+-joner kan nå cellytan. Vid en viss potential på membranet visar sig antalet K+-joner som korsar membranet i båda riktningarna vara lika, d.v.s. Kaliumkoncentrationsgradienten balanseras av potentialen som finns över membranet. Potentialen vid vilken diffusionsflödet av joner blir lika med flödet av liknande joner som rör sig i motsatt riktning kallas jämviktspotentialen för en given jon. För K+-joner är jämviktspotentialen -90 mV. I myeliniserade nervfibrer är värdet på jämviktspotentialen för CI-joner nära värdet på vilomembranpotentialen (-70 mV). Därför, trots att koncentrationen av CI-joner utanför fibern är större än inuti den, observeras inte deras envägsström i enlighet med koncentrationsgradienten. I detta fall balanseras koncentrationsskillnaden av potentialen som finns på membranet.
Na+-jonen längs koncentrationsgradienten bör komma in i cellen (dess jämviktspotential är +60 mV), och närvaron av en negativ laddning inuti cellen bör inte störa detta flöde. I detta fall skulle det inkommande Na+ neutralisera de negativa laddningarna inuti cellen. Detta händer dock inte, eftersom membranet i vila är dåligt permeabelt för Na+.
Den viktigaste mekanismen som upprätthåller en låg intracellulär koncentration av Na+-joner och en hög koncentration av K+-joner är natrium-kaliumpumpen (aktiv transport). Det är känt att i cellmembranet finns ett system av bärare, som var och en är bunden av stigbygeln Na+-joner som finns inuti cellen och bär ut dem. Från utsidan binder bäraren till två K+-joner som ligger utanför cellen, vilka överförs till cytoplasman. Energiförsörjningen för drift av transportsystem tillhandahålls av ATP. Driften av en pump som använder ett sådant system leder till följande resultat:
- en hög koncentration av K+-joner upprätthålls inuti cellen, vilket säkerställer ett konstant värde på vilopotentialen. På grund av det faktum att under en jonbytescykel en mer positiv jon avlägsnas från cellen än vad som införs, spelar aktiv transport en roll för att skapa vilopotentialen. I det här fallet talar de om en elektrogen pump, eftersom den själv skapar en liten men konstant ström av positiva laddningar från cellen och därför ger ett direkt bidrag till bildandet av en negativ potential inuti den. Emellertid är bidraget från den elektrogena pumpen till den totala vilopotentialen vanligtvis litet och uppgår till flera millivolt;
- en låg koncentration av Na+-joner upprätthålls inuti cellen, vilket å ena sidan säkerställer driften av mekanismen för generering av aktionspotential, och å andra sidan säkerställer bevarandet av normal osmolaritet och cellvolym;
- bibehåller en stabil koncentrationsgradient av Na+, natrium-kaliumpumpen främjar den kopplade K+, Na+-transporten av aminosyror och sockerarter över cellmembranet.
Förekomsten av en transmembranpotentialskillnad (vilopotential) beror alltså på cellmembranets höga ledningsförmåga i vila för K+, CI-joner, jonisymmetri i koncentrationerna av K+-joner och CI-joner, arbetet med aktiva transportsystem (Na + / K + -ATPas), som skapar och upprätthåller jonisymmetri.
Nervfiberns aktionspotential, nervimpuls
Agerande potential - Detta är en kortvarig fluktuation i potentialskillnaden för membranet i en exciterbar cell, åtföljd av en förändring i dess laddningstecken.
Aktionspotentialen är det huvudsakliga specifika tecknet på excitation. Dess registrering indikerar att cellen eller dess strukturer svarade på stöten med excitation. Men som redan nämnts kan PD i vissa celler uppstå spontant (spontant). Sådana celler finns i hjärtats pacemakers, blodkärlens väggar och nervsystemet. AP används som en bärare av information och överför den i form av elektriska signaler (elektrisk signalering) längs afferenta och efferenta nervfibrer, hjärtats ledningssystem och även för att initiera kontraktion av muskelceller.
Låt oss överväga orsakerna och mekanismen för AP-generering i de afferenta nervfibrerna som bildar de primära sensoriska receptorerna. Den omedelbara orsaken till förekomsten (genereringen) av AP i dem är receptorpotentialen.
Om vi mäter potentialskillnaden på membranet i noden av Ranvier närmast nervändan, så förblir den oförändrad (70 mV) i intervallen mellan påverkan på Pacinian-kroppkapseln, och under exponering depolariseras den nästan samtidigt med depolarisering av nervändans receptormembran.
Med en ökning av tryckkraften på Pacinian-kroppen, vilket orsakar en ökning av receptorpotentialen till 10 mV, registreras vanligtvis en snabb oscillation av membranpotentialen vid den närmaste noden av Ranvier, åtföljd av omladdning av membranet - aktionspotentialen (AP), eller nervimpuls (Fig. 2). Om tryckkraften på kroppen ökar ännu mer, ökar amplituden på receptorpotentialen och ett antal aktionspotentialer med en viss frekvens genereras i nervändan.

Ris. 2. Schematisk representation av mekanismen för att omvandla receptorpotentialen till en aktionspotential (nervimpuls) och föröka impulsen längs nervfibern
Kärnan i mekanismen för AP-generering är att receptorpotentialen orsakar uppkomsten av lokala cirkulära strömmar mellan det depolariserade receptormembranet i den omyeliniserade delen av nervändan och membranet i Ranviers första nod. Dessa strömmar, som bärs av Na+, K+, CI- och andra mineraljoner, "strömmar" inte bara längs utan också över nervfiberns membran i området kring Ranviers nod. I membranet av Ranviers noder, i motsats till receptormembranet i själva nervändan, finns en hög täthet av jonspänningsberoende natrium- och kaliumkanaler.
När depolarisationsvärdet på cirka 10 mV uppnås vid Ranvier-interceptionsmembranet öppnas snabba spänningsberoende natriumkanaler och genom dem rusar ett flöde av Na+-joner in i axoplasman längs den elektrokemiska gradienten. Det orsakar snabb depolarisering och omladdning av membranet vid noden av Ranvier. Men samtidigt med öppnandet av snabba spänningsstyrda natriumkanaler i membranet av noden av Ranvier, öppnas långsamma spänningsstyrda kaliumkanaler och K+-joner börjar lämna axoillasma.Deras uteffekt släpar efter inträdet av Na+-joner. Således depolariserar Na+-joner som kommer in i axoplasman med hög hastighet snabbt och laddar om membranet under en kort tid (0,3-0,5 ms), och K+-joner som lämnar återställer den ursprungliga fördelningen av laddningar på membranet (repolarisera membranet). Som ett resultat, under en mekanisk påverkan på Pacinian-kroppen med en kraft som är lika med eller överstiger tröskeln, observeras en kortvarig potentiell oscillation på membranet av den närmaste noden av Ranvier i form av snabb depolarisering och repolarisering av membranet , dvs. PD (nervimpuls) genereras.
Eftersom den direkta orsaken till AP-generering är receptorpotentialen, kallas det i detta fall även generatorpotentialen. Antalet nervimpulser med samma amplitud och varaktighet som genereras per tidsenhet är proportionell mot amplituden av receptorpotentialen och därför mot tryckkraften på receptorn. Processen att omvandla information om påverkanskraften i amplituden av receptorpotentialen till ett antal diskreta nervimpulser kallas diskret informationskodning.
Jonmekanismerna och tidsdynamiken för AP-genereringsprocesser studerades mer i detalj under experimentella förhållanden under artificiell exponering av nervfibern för elektrisk ström av varierande styrka och varaktighet.
Typen av nervfiberns aktionspotential (nervimpuls)
Nervfibermembranet vid lokaliseringen av den stimulerande elektroden reagerar på påverkan av en mycket svag ström som ännu inte har nått tröskelvärdet. Detta svar kallas lokal, och oscillationen av potentialskillnaden på membranet kallas lokal potential.
En lokal respons på membranet av en exciterbar cell kan föregå uppkomsten av en aktionspotential eller uppstå som en oberoende process. Det representerar en kortvarig fluktuation (depolarisering och repolarisering) av vilopotentialen, som inte åtföljs av membranuppladdning. Depolarisering av membranet under utvecklingen av lokal potential beror på det avancerade inträdet av Na+-joner i axoplasman, och repolarisering beror på det fördröjda utträdet av K+-joner från axoplasman.
Om membranet utsätts för en elektrisk ström med ökande styrka, då vid detta värde, kallat tröskeln, kan depolariseringen av membranet nå en kritisk nivå - Ec, vid vilken öppningen av snabba spänningsberoende natriumkanaler inträffar. Som ett resultat sker en lavinliknande ökning av flödet av Na+-joner in i cellen genom dem. Den inducerade depolariseringsprocessen blir självaccelererande, och den lokala potentialen utvecklas till en handlingspotential.
Det har redan nämnts att ett karakteristiskt tecken på PD är en kortvarig inversion (ändring) av tecknet för laddningen på membranet. Utanför blir den negativt laddad under en kort tid (0,3-2 ms), och positivt laddad inuti. Storleken på inversionen kan vara upp till 30 mV, och storleken på hela aktionspotentialen är 60-130 mV (fig. 3).
Tabell. Jämförande egenskaper för lokal potential och handlingspotential
|
Karakteristisk |
Lokal potential |
Agerande potential |
|
Ledningsförmåga |
Sprider sig lokalt, 1-2 mm med dämpning (minska) |
Sprider sig utan dämpning över långa avstånd längs nervfiberns hela längd |
|
Lagen om "kraft" |
Skickar in |
Lyder inte |
|
Allt eller inget lag |
Lyder inte |
Skickar in |
|
Summationsfenomen |
Sammanfattar, ökar med upprepad frekvent stimulering under tröskelvärdet |
Stämmer inte |
|
Amplitudvärde |
||
|
Upphetsning |
Ökar |
Minskar till en punkt av fullständig oupphetsning (eldfasthet) |
|
Stimulans storlek |
Subliminal |
Tröskel och supertröskel |
Aktionspotentialen, beroende på arten av förändringen i laddningar på den inre ytan av membranet, är uppdelad i faser av depolarisering, repolarisering och hyperpolarisering av membranet. Avpolarisering anropa hela den stigande delen av PD, där områden som motsvarar den lokala potentialen identifieras (från nivån E 0 innan E k), snabb depolarisering (från nivån E k till nivå 0 mV), inversioner laddningstecken (från 0 mV till toppvärdet eller början av repolarisering). Repolarisering kallas den nedåtgående delen av AP, vilket återspeglar processen för återställande av den ursprungliga polariseringen av membranet. Till en början sker repolarisering snabbt, men när den närmar sig nivån E 0, hastigheten kan sakta ner och denna sektion kallas spåra negativitet(eller spåra negativ potential). I vissa celler utvecklas hyperpolarisering efter repolarisering (en ökning av membranpolarisering). De ringer henne spåra positiv potential.
Den initiala snabbflödesdelen med hög amplitud av AP kallas också topp, eller spika. Det inkluderar faser av depolarisering och snabb repolarisering.
I mekanismen för utveckling av PD tillhör den viktigaste rollen spänningsberoende jonkanaler och en icke-samtidig ökning av cellmembranets permeabilitet för Na+ och K+ joner. Sålunda, när en elektrisk ström verkar på en cell, orsakar den depolarisering av membranet och, när membranladdningen minskar till en kritisk nivå (Ec), öppnas spänningsstyrda natriumkanaler. Som redan nämnts bildas dessa kanaler av proteinmolekyler inbäddade i membranet, inuti vilket det finns en por och två grindmekanismer. En av grindmekanismerna, aktivering, säkerställer (med deltagande av segment 4) öppningen (aktivering) av kanalen under membrandepolarisering, och den andra (med deltagande av den intracellulära slingan mellan den 3:e och 4:e domänen) säkerställer dess inaktivering , som utvecklas när membranet laddas om (fig. 4). Eftersom båda dessa mekanismer snabbt ändrar positionen för kanalgrinden, är spänningsstyrda natriumkanaler snabba jonkanaler. Denna omständighet är av avgörande betydelse för genereringen av AP i exciterbara vävnader och för dess ledning längs nerv- och muskelfibrernas membran.

Ris. 3. Aktionspotential, dess faser och jonströmmar (a, o). Beskrivning i texten

Ris. 4. Grindläge och aktivitetstillstånd för spänningsstyrda natrium- och kaliumkanaler vid olika nivåer av membranpolarisation
För att den spänningsstyrda natriumkanalen ska släppa in Na+-joner i cellen måste endast aktiveringsporten öppnas, eftersom inaktiveringsporten är öppen under vilande förhållanden. Detta är vad som händer när membrandepolarisering når en nivå E k(Fig. 3, 4).
Öppnandet av aktiveringsporten för natriumkanaler leder till ett lavinliknande inträde av natrium i cellen, driven av krafterna från dess elektrokemiska gradient. Eftersom Na+-joner bär en positiv laddning, neutraliserar de överskott av negativa laddningar på membranets inre yta, minskar potentialskillnaden över membranet och depolariserar det. Snart ger Na+-joner ett överskott av positiva laddningar till den inre ytan av membranet, vilket åtföljs av en inversion (ändring) av laddningstecknet från negativt till positivt.
Natriumkanalerna förblir dock öppna i endast cirka 0,5 ms och efter denna tidsperiod från början
AP stänger inaktiveringsporten, natriumkanaler blir inaktiverade och ogenomträngliga för Na+-joner, vars inträde i cellen är kraftigt begränsad.
Från ögonblicket av membrandepolarisering till nivån E k aktivering av kaliumkanaler och öppning av deras portar för K+-joner observeras också. K+-joner, under påverkan av koncentrationsgradientkrafter, lämnar cellen och tar bort positiva laddningar från den. Emellertid är grindmekanismen för kaliumkanaler långsamt fungerande och hastigheten för utträde av positiva laddningar med K+-joner från cellen till utsidan släpar efter inträdet av Na+-joner. Flödet av K+-joner, som tar bort överskott av positiva laddningar från cellen, orsakar återställandet av den ursprungliga fördelningen av laddningar på membranet eller dess repolarisering, och på insidan, ett ögonblick efter omladdningen, återställs den negativa laddningen.
Förekomsten av AP på exciterbara membran och den efterföljande återställandet av den ursprungliga vilpotentialen på membranet är möjlig eftersom dynamiken för inträde och utträde av de positiva laddningarna av Na+ och K+ joner in i cellen och utträde från cellen är olika. Na+-jonens ingång ligger före K+-jonens utgång. Om dessa processer var i jämvikt, skulle potentialskillnaden över membranet inte förändras. Utvecklingen av förmågan att excitera och generera AP av exciterbara muskel- och nervceller berodde på bildandet av två typer av jonkanaler med olika hastighet i deras membran - snabbt natrium och långsamt kalium.
För att generera en enda AP kommer ett relativt litet antal Na+-joner in i cellen, vilket inte stör dess distribution utanför och inuti cellen. Om ett stort antal AP genereras kan fördelningen av joner på båda sidor av cellmembranet störas. Men under normala förhållanden förhindras detta genom driften av Na+, K+-pumpen.
Under naturliga förhållanden, i nervceller i det centrala nervsystemet, uppstår aktionspotentialen främst i regionen av axonkullen, i afferenta neuroner - i noden av Ranvier i nervändan närmast sensoriska receptorn, dvs. i de delar av membranet där det finns snabba selektiva spänningsstyrda natriumkanaler och långsamma kaliumkanaler. I andra typer av celler (till exempel pacemaker, släta myocyter) spelar inte bara natrium- och kaliumkanaler utan även kalciumkanaler en roll vid uppkomsten av AP.
Mekanismerna för perception och transformation av signaler till aktionspotentialer i sekundära sensoriska receptorer skiljer sig från de mekanismer som diskuteras för primära sensoriska receptorer. I dessa receptorer utförs uppfattningen av signaler av specialiserade neurosensoriska (fotoreceptor, lukt) eller sensoroepitelial (smak, hörsel, vestibulära) celler. Var och en av dessa känsliga celler har sin egen speciella mekanism för att uppfatta signaler. Men i alla celler omvandlas energin hos den uppfattade signalen (stimulus) till en oscillation av plasmamembranets potentialskillnad, dvs. till receptorpotential.
Sålunda är nyckelpunkten i de mekanismer genom vilka sensoriska celler omvandlar uppfattade signaler till receptorpotential en förändring i permeabiliteten hos jonkanaler som svar på stimulansen. Öppnandet av Na+, Ca 2+, K+-jonkanaler under signaluppfattning och transformation uppnås i dessa celler med deltagande av G-proteiner, andra intracellulära budbärare, bindning till ligander och fosforylering av jonkanaler. Som regel orsakar receptorpotentialen som uppstår i sensoriska celler frisättningen av en signalsubstans från dem till den synaptiska klyftan, vilket säkerställer överföringen av en signal till det postsynaptiska membranet i den afferenta nervändan och genereringen av en nervimpuls på dess membran. Dessa processer beskrivs i detalj i kapitlet om sensoriska system.
Aktionspotentialen kan karakteriseras av amplitud och varaktighet, som för samma nervfiber förblir desamma när verkan utbreder sig längs fibern. Därför kallas aktionspotentialen en diskret potential.
Det finns ett visst samband mellan arten av påverkan på sensoriska receptorer och antalet AP som uppstår i den afferenta nervfibern som svar på påverkan. Det ligger i det faktum att med större styrka eller varaktighet av exponeringen bildas ett större antal nervimpulser i nervfibern, d.v.s. när effekten ökar kommer impulser med högre frekvens att skickas från receptorn till nervsystemet. Processerna att omvandla information om effektens natur till frekvens och andra parametrar för nervimpulser som överförs till centrala nervsystemet kallas diskret informationskodning.
De olika koncentrationerna av ämnen i och utanför cellen är ett av de viktigaste tecknen på liv. Varje cell som är i fullständig koncentrationsjämvikt med sin omgivning är död. Det är sant att många ämnen, främst vatten, penetrerar cellen längs sin koncentrationsgradient. Det finns dock ett stort antal ämnen som inte följer denna regel.
Om vi delar in olika ämnen i klasser efter deras permeabilitet, kan följande huvudgrupper urskiljas bland dem. Icke-polära ämnen, kännetecknad av en enhetlig fördelning av elektroner mellan atomerna som bildar molekylen. Ofullständiga polära föreningar, där elektronerna som förbinder atomerna är mer attraherade av en av dem, vilket resulterar i att molekylen förvandlas till en dipol. Joniska föreningar eller elektrolyter, där valenselektronerna är associerade med endast en av atomerna eller radikalerna. I medier med hög dielektricitetskonstant är dessa bindningar kraftigt försvagade och enskilda delar av molekylen beter sig som oberoende joner. Här dissocierar elektrolyten till joner: positiva - anjoner och negativa - katjoner.
Bortsett från frågan om penetrationen av föreningar av de två första klasserna in i cellen, låt oss uppehålla oss mer i detalj vid arten av penetrationen och fördelningen av olika joner mellan cellen och dess miljö, eftersom det är denna fördelning som ligger till grund för membranpotential (MP) hos cellen.
Det har nu experimentellt bevisats att innehållet i cellen är negativt laddat i förhållande till dess yttre yta och miljön. Denna laddning är inte densamma i olika celler och sträcker sig i de flesta fall från -50 till -100 mV (tabell 9). Närvaron av en elektrisk laddning indikerar en ojämn fördelning av elektrolyter på båda sidor av cellytmembranet, vilket vanligtvis kallas jonisk asymmetri.
Tabell 9. Värden på membranpotentialer (MP) för olika exciterbara celler (enligt Latmanizova, 1965)
Hur uppstår jonisymmetri på olika sidor av cellmembranet? För att klargöra denna fråga är det nödvändigt att överväga, åtminstone i allmän form, beteendet hos elektrolyter när de passerar genom vilket semi-permeabelt membran som helst.
Alla lösta ämnen, inklusive joniserade, rör sig (vid ojämn fördelning i lösningen) enligt en koncentrationsgradient från områden med högre koncentration till områden med lägre koncentration. Om områden av en lösning med ojämna koncentrationer separeras av någon form av membran, så saktas diffusionen av lösta ämnen mer eller mindre ner. De joniska komponenterna i lösta elektrolyter - anjoner och katjoner - har ofta olika permeabiliteter och följaktligen olika rörlighet. Detta beror på jonernas storlek och konfiguration, såväl som storleken på deras hydratiseringsskal. Till exempel har Na + katjonen och Cl - anjonen som bildas under dissocieringen av bordssalt olika rörlighet. Rörligheten och permeabiliteten för Na + är mycket lägre än Cl - . Detta motsvarar deras hydratiserade diametrar på 2,14 Å för Cl- och 3,4 Å för Na+. Under diffusionspenetration genom membranet från ett område med högre elektrolytkoncentration till ett område med lägre elektrolytkoncentration kommer Cl - joner att flytta till andra sidan av membranet mycket snabbare än Na + joner, så att en av dess ytor kommer att laddas positivt under en tid, och den andra negativt.
Om membranet visar sig vara permeabelt endast för Cl - joner och ogenomträngligt för Na + joner, så uppstår en permanent, snarare än tillfällig, potentialskillnad mellan lösningarna på båda sidor av membranet. Denna potentialskillnad kallas koncentrationspotentialskillnad och kan beräknas med hjälp av Nernst-ekvationen:
![]()
där E är potentialskillnaden, i mV; R - gaskonstant; T - absolut temperatur; n - valens; Ci - högre, C2 - lägre av de två koncentrationerna; F - Faraday-nummer.
Ovanstående principer gäller för fallet när lösningar placerade på båda sidor av ett semipermeabelt membran innehåller samma joner, men i olika koncentrationer.
Men som bekant skiljer sig cellens och den extracellulära vätskans protoplasma inte bara i koncentrationer utan också i jonsammansättningen, därför är idéer om koncentrationspotentialen otillräckliga för att förklara händelserna som äger rum i cellens region. membran.
Låt oss överväga ett förenklat fall som är närmare de verkliga förhållandena mellan elektrolyter i en cell. Låt oss anta att ett visst membran separerar två olika elektrolyter NaCl och KCl med samma koncentration:
Låt oss också anta att detta membran är permeabelt för både Cl - anjoner och båda katjoner, men dess permeabilitet för K + är betydligt högre än för Na +. Då fördelas K+, som en mer rörlig jon, jämnt på båda sidor av membranet mycket snabbare än Na+, och under hela tiden som Na+-koncentrationerna förblir utjämnade, är en av sidorna av membranet, nämligen den där NaCl var ursprungligen lokaliserad, kommer att laddas positivt med avseende på den motsatta sidan. Den potential som uppstår på detta sätt brukar kallas den kemiska potentialen. Om membranet var helt ogenomträngligt för Na+ skulle denna potential bli konstant.
När det gäller cellulär MP är alla processer mycket mer komplexa. För det första är elektrolytsammansättningen i den intracellulära och extracellulära miljön ganska komplex och innehåller förutom KCl och NaCl ett antal andra joner, bland vilka stora organiska anjoner, som inte kan penetrera cellmembranet, spelar en särskilt viktig roll för att skapa membranpotentialen. De ungefärliga koncentrationerna av olika joner i däggdjursmuskelceller ges i tabell. 10.

Tabell 10. Ungefärliga jonkoncentrationer och jämviktspotentialer i däggdjursmuskelfibrer och extracellulär vätska (efter J. W. Woodbury, 1963)
* (Beräknat från membranpotential med hjälp av Nernst-ekvationen.)
Som framgår av tabellen kännetecknas den extracellulära miljön av en relativt hög koncentration av Na + och Cl - joner och en låg koncentration av K + joner. Den intracellulära miljön, tvärtom, innehåller små mängder Na + och Cl -, men kännetecknas av en hög halt av K +. Dessutom finns det inuti cellen över 150 mM organiska anjoner A med hög molekylvikt per 1 liter intracellulärt vatten, uppenbarligen av proteinursprung. När man konstruerar ytterligare resonemang är det därför nödvändigt att ta hänsyn till denna ytterligare faktor.
I fig. Figur 20 visar ett mycket förenklat diagram över de processer som sker på cellmembranet. När man betraktar diagrammet görs antagandet att membranet är ogenomträngligt inte bara för högmolekylära A-anjoner utan även för Na+-joner.

Ris. 20. Bildning av transmembranpotential under påverkan av koncentrationsgradienter. (Woodbury, 1963). Storleken på symbolerna i höger och vänster kolumn indikerar den relativa koncentrationen av joner i den extra- och intracellulära vätskan. Prickade pilar och cirklar indikerar jonernas rörelseriktning, K + , A - , Na + och Cl - när K + eller Cl - rör sig genom membranporer. Övriga förklaringar i texten
Låt vid något första ögonblick på båda sidor av membranet mediet med joner lösta i det vara elektriskt neutralt, det vill säga positiva och negativa partiklar på båda sidor av membranet balanserar varandra. Låt oss spåra beteendet hos partiklar som kan penetrera genom "membranporer". * På grund av den höga intracellulära koncentrationen av K+-joner kommer dessa joner att diffundera över cellmembranet från insidan till utsidan enligt koncentrationsgradienten. Högmolekylära anjoner som balanserar den elektriska laddningen av K+-joner kan inte följa med dem på grund av att membranet är ogenomträngligt för dem. Na + joner kan inte heller ersätta dem i den intracellulära miljön, eftersom de enligt antagandet inte penetrerar membranet från utsidan till insidan. Resultatet är en partiell separation av laddningar runt membranet. Dess yttre sida, som ett resultat av överskottet av kalium i den extracellulära miljön, börjar laddas positivt, och den inre sidan, på grund av uppkomsten av högmolekylära A-joner som inte neutraliseras av kalium, blir negativt laddade. Ett elektriskt fält uppstår i membranområdet, vilket börjar störa den pågående processen, eftersom de diffuserande K+-jonerna har en laddning. Som bekant stöter bort elektriska laddningar med samma namn, därför börjar den positiva laddningen som uppstår i den extracellulära miljön motverka det ytterligare flödet av K+-joner från insidan av cellen till utsidan. Sålunda orsakar diffusionen av K+ från cellen till utsidan uppkomsten av elektrostatiska krafter som stör den primära diffusionsprocessen, det vill säga en negativ återkoppling skapas som begränsar frisättningen av K+ från cellen. När den positiva potentialen hos den yttre miljön i förhållande till den motsvarande ökande intracellulära negativa potentialen når ett visst värde, etableras en dynamisk jämvikt mellan antalet K+-joner som lämnar cellen och antalet dessa joner som kommer in i cellen. Den potentialskillnad som motsvarar detta moment på båda sidor av membranet betecknas vanligtvis som jämviktspotential för en given jon. Från resonemangets gång är det tydligt att dess värde beror på förhållandet mellan de inre och yttre koncentrationerna av denna jon och kan beräknas från Nernst-ekvationen.
* (Uttrycket "membranporer" ska inte bokstavligen förstås som öppningar av en viss storlek. Membranets ojämna permeabilitet för olika partiklar verkar bero på komplexa interaktioner mellan membranmolekyler och dessa partiklar. Icke desto mindre spelar storleken på de penetrerande partiklarna, såsom kommer att framgå av följande diskussion, en betydande roll.)
Liknande resonemang kan föras i förhållande till Cl-jonen. Denna anjon börjar flöda vid ett villkorat initialt ögonblick från utsidan till insidan på grund av dess relativt höga koncentration i den extracellulära vätskan. I det här fallet skapas en negativ laddning inuti cellen, och en positiv laddning skapas på membranets yttre yta. Liksom i fallet med K+ skapas en negativ återkoppling, som i slutändan begränsar flödet av Cl - joner in i cellen när jämviktspotentialen uppnås mellan den yttre och inre miljön.
Naturligtvis samverkar processen med att K+ lämnar cellen och processen för Cl-joner som kommer in i cellen och nivån på den etablerade potentialskillnaden bestäms av totalen av händelser som inträffar.
Med hjälp av diagrammet ovan är det inte svårt att förstå några av mekanismerna för MP-bildning i en vilande levande cell. * Kvantitativa beräkningar med hjälp av Nernst-ekvationen visar att Cl - och K + joner är fördelade på båda sidor av membranet ungefär i enlighet med magnituden på magnetfältet, så att de elektriska och koncentrationsgradienterna balanserar varandra.
* (En cell som inte utför sina specifika aktiviteter kallas konventionellt stilla. Som kommer att framgå nedan är begreppet vila en fysiologisk abstraktion.)
Den beskrivna mekanismen för uppkomsten av MP skulle faktiskt kunna ske om cellmembranet var helt ogenomträngligt för Na+-joner. De eleganta och rigorösa studierna av Hodgkin och Keynes (Keynes, 1954; Hodgkin a. Keynes, 1955) med användning av den radioaktiva natriumisotopen Na24 visade dock att cellmembranet är permeabelt för Na+, även om dess permeabilitet är ungefär 50 gånger lägre än permeabilitet för K+ och Cl-. Det visades experimentellt på grodan gastrocnemius-muskeln (Keynes, 1954) att cirka 10 -11 M Na+ tränger in i muskelfibern per sekund genom 1 cm 2 av cellytan. Med ett sådant "flöde" av Na + in i cellen utan ett motsvarande "flöde ut" ur den, skulle dess intracellulära koncentration behöva fördubblas inom en timme. Detta händer dock inte, även om både koncentration och elektriska gradienter "tvingar" Na + att komma in i cellen. Därför måste det finnas några speciella mekanismer som säkerställer passagen av Na+-joner genom membranet mot den elektrokemiska gradienten, d.v.s. från insidan till utsidan. Dessa mekanismer kallas aktiv överföring. För att utföra det senare krävs en konstant energiförbrukning, producerad som ett resultat av cellulära metaboliska processer.
Tyvärr är det fortfarande oklart hur energin från cellulär metabolism används under aktiv överföring, men det finns ganska tydliga experimentella data om deltagandet av adenosintrifosfat och vissa andra fosfater i denna process (Caldwell a. Keynes, 1957; Caldwell, Hodgkin Keynes a. Shaw, 1960a; Hogdkin, 1964).
Den direkta kopplingen mellan aktiv transport och ämnesomsättning visades först av Hodgkin och Keynes (Hodgkin och Keynes, 1955) i deras studier om det gigantiska axonet av bläckfisk (sepia). Forskningsmetodiken baserades på användningen av natriumradioisotop Na 24 och gjorde det möjligt att identifiera ett antal intressanta mönster för aktiv överföring. Först och främst visade det sig att metaboliska inhibitorer (dinitrofenol, cyanid, azid), som blockerar vissa delar av metaboliska oxidativa reaktioner, nästan helt undertrycker processen att ta bort Na + från cellen *. En minskning av läkemedlets temperatur har en liknande effekt, vilket kraftigt minskar nivån av metaboliska processer (Fig. 21).
* (På senare tid har den blockerande effekten av azid på den aktiva transporten av Na+-joner i motorneuroner i ryggmärgen hos katter också visats (Ito och Oshima, 1964).)

Ris. 21. Frisättningen av Na+-joner från ett gigantiskt axon (bläckfisk) när sammansättningen av tvättlösningen ändras genom tillsats av dinitrofenol (DNP) (A) och en förändring av temperaturen (B) (Hodgkin a. Keynes, 1955). Abskissaxeln är tid, i minuter; längs ordinatan - frigörandet av radioaktivt Na 24 från cellen, mätt i pulser per minut. Det totala utbytet av N + (radioaktivt och normalt) är proportionellt mot utbytet av radioaktivt Na +, exklusive de förändringar som är resultatet av den gradvisa utspädningen av radioaktivt Na + med normal på grund av naturliga jonbytesprocesser (denna gradvisa minskning av koncentrationen av radioaktivt Na + visas i kolumnen "havsvatten")
Det visade sig vidare att utsöndringen av Na+ i allmänhet är proportionell mot dess inre koncentration och är oberoende av dess externa koncentration. Samtidigt minskar Na+-utbytet kraftigt med en minskning av kaliumkoncentrationen i den yttre miljön och ökar med en ökning av den externa K+-koncentrationen. Detta beroende visas också i fig. 21. Dessutom visade det sig att metabola gifter också minskar flödet av K+ från den yttre miljön in i axonet och att denna process blockeras av dessa effekter nästan i samma utsträckning som avlägsnandet av Na+ från cellen. Allt detta gjorde det möjligt för oss att dra slutsatsen att den aktiva transportmekanismen fungerar enligt principen om elektroneutralitet, "ta bort" Na+-joner från cellen och "införa" en ekvivalent mängd K+-joner i cellen (Hodgkin, 1958). *
* (Senare upptäcktes att sambandet mellan utsöndringen av Na + och införandet av K + i cellen under aktiv överföring är ganska löst, åtminstone inte av absolut stel typ (en till en), som man från början antog (Caldwell, Hodgkin, Keynes a. Shaw, 1960a, 1960b). Tills nyligen trodde man att aktiv transport bestämdes av nivån av intern Na+-koncentration (Hodkin och Keynes, 1956; Hodgkin, 1958). Nya verk av Eccles och hans kollegor ger bevis för att kaliumkomponenten i aktiv transport aktiveras av en minskning av den inre koncentrationen av K och att samtidigt KCl aktivt överförs till cellen (Eccles, 1964; Eccles, Eccles a. Ito, 1964).)
Frågan uppstår om hur en mekanism baserad på principen om elektrisk neutralitet kan skapa membranpolarisering. Detta är inte svårt att förstå om vi betänker att inuti cellen finns en betydande mängd A - anjoner med hög molekylvikt och att permeabiliteten för Na + joner är 50 gånger lägre än permeabiliteten för K + joner. Efter att ha avlägsnats från cellen av den aktiva transportmekanismen, återgår natrium, på grund av diffusion, till cellen 50 gånger långsammare än vad kalium infört i cellen lämnar den i form av ett diffusionsflöde. Dessutom diffunderar kalium ut ur cellen, åtföljd av Cl - jonen som neutraliserar den. Som ett resultat av ovanstående processer minskar det absoluta antalet positiva joner inuti cellen: Na + utsöndras aktivt och kalium, åtföljt av Cl-joner, utsöndras passivt. Ett överskott av negativa laddningar uppstår i cellen på grund av närvaron av A-joner med hög molekylvikt.
Detta är naturligtvis ett mycket förenklat resonemangssystem. Icke desto mindre återspeglar det i allmänna termer fenomenets väsen, utan att beröra några komplicerande detaljer, till exempel frågan om fördelningen av vatten under dessa förhållanden.
Det finns många olika hypoteser som försöker förklara mekanismen för aktiv transport, men ingen av dem har bevisats experimentellt. De mest attraktiva systemen är de med den så kallade "mellanbäraren". Ett exempel är Shaw-Glynn-schemat (Glynn, 1957) (Fig. 22) Fördelen med ett sådant schema är att det inte förutsätter ett strikt samband mellan utsöndringen av Na + och inträdet av K + i cellen. Således kan bevarandet av partiell utsöndring av Na + i fullständig frånvaro av K + i den yttre miljön förklaras av det faktum att Na + också har viss affinitet för ämnet X. Det hypotetiska schemat bör förklara denna möjlighet, eftersom Na+-utsöndring verkligen delvis bevaras även i fullständig frånvaro av K+ i den extracellulära miljön.

Ris. 22. Hypotetiskt diagram över en kalium-natriumutbytespump. (Glynn, 1957). Ämnen X och Y antas fungera inom membranet. X har en hög affinitet för K+; Y har en hög affinitet för Na+. X och Y rör sig över membranet endast i kombination med motsvarande jon
Fram till nu har alla fenomen och mekanismer associerade med genereringen av MF:er beskrivits endast från en kvalitativ synvinkel för enkelhetens skull. Men för en tydligare uppfattning om de processer som äger rum, är det tillrådligt att tillhandahålla några kvantitativa egenskaper för membranpolarisering, särskilt eftersom detta också kommer att göra det möjligt att få en tydligare bild av volymen av jonbytesprocesser som äger rum. *
* (Följande digitala material är hämtat från "Neurophysiology" av T. Roux et al (Ruch et al., 1963).)
Kapacitansen för det grodstrimmiga muskelfibermembranet bestämdes experimentellt och är cirka 10 mikrofarad per cm 2. Mängden laddning på membranet - denna biologiska kondensator - bestäms av storleken på potentialskillnaden på båda sidor av membranet (E m) och dess kapacitans (C m): q = C m ⋅ E m. Vi tar E m som 90 mV. Då laddningen q = 10 × 10 -6 f/cm 2 × 0,09 V = 9 × 10 -7 coulombs per 1 cm 2. Om vi räknar om det resulterande laddningsvärdet med antalet joner som deltar i dess bildning får vi följande resultat.
Enligt Avogadros lag innehåller 1 gram molekyl 6,023 × 10 23 molekyler. I det här fallet har vi att göra med envärda joner som bär 1 enhet. laddning lika stor som laddningen av en elektron. Elektronladdningen, uttryckt i coulombs, är 1,6 × 10 -19. Då är laddningen av en mol envärda katjoner 1,6 × 10 -19 × 6,023 × 10 23 = 96500 coulombs. Eftersom laddningen på cellmembranet i en muskelfiber är 9 × 10 -7 coulombs cm 2, betyder detta att detta membran i en yta av 1 cm 2 endast separerar 9 × 10 -7 / 96500 = 9,5 × 10 -12 mol av joniserade envärda partiklar. Samtidigt innehåller 1 cm 3 intracellulär vätska 1,5 × 10-6 mol katjoner eller anjoner, dvs flera miljoner gånger mer. Beräkningar visar att ett lager av intracellulär vätska bara 6 Å tjockt ger tillräckligt med joner för att skapa en potential på 90 mV över membranet.
Dessa värden förklarar vilket litet antal joner från deras totala antal i cellen som deltar i att upprätthålla MP och, som kommer att visas nedan, i genereringen av aktionspotentialen.
Det bör också noteras att cellen har tillräckliga energiresurser för att utföra aktiv Na+-överföring. Keynes och Maisel (Keynes a. Maisel, 1954) visade experimentellt att energiförbrukningen för aktiv överföring av Na + i grodans skelettmuskel är betydligt mindre än cellens totala energiförbrukning, räknat från syreförbrukningen. * I de flesta experiment med vilande muskler går endast cirka 10 % av energiförbrukningen till aktiv utsöndring av Na+. Om vi antar att verkningsgraden för aktiv överföring endast är 50 % eller till och med mindre, så utgör energiförbrukningen för denna process fortfarande en relativt liten del av energin som produceras av cellen. Dessa kvantitativa data stärker avsevärt konceptet med en aktiv överföringsmekanism, vilket visar att ur cellens energibalans är en sådan process fullt möjlig.
17 ..- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0