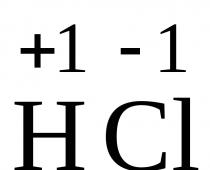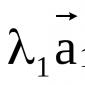Järn är ett element i den sekundära undergruppen av den åttonde gruppen av den fjärde perioden periodiska systemet kemiska grundämnen D.I. Mendeleev med atomnummer 26. Betecknas med symbolen Fe (latin Ferrum). En av de vanligaste inom jordskorpan metaller (andra plats efter aluminium). Medelaktiv metall, reduktionsmedel.
Huvudoxidationstillstånd - +2, +3
Det enkla ämnet järn är en formbar silvervit metall med hög kemisk reaktivitet: järn korroderar snabbt vid höga temperaturer eller hög luftfuktighet. Järn brinner i rent syre, och i fint dispergerat tillstånd antänds det spontant i luften.
Kemiska egenskaper hos ett enkelt ämne - järn:

Rostar och brinner i syre
1) I luft oxiderar järn lätt i närvaro av fukt (rostning):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
Varm järntråd brinner i syre och bildar avlagringar - järnoxid (II, III):
3Fe + 2O 2 → Fe 3 O 4
3Fe+2O2 →(Fe II Fe2III)O4 (160 °C)
2) När hög temperatur(700–900°C) järn reagerar med vattenånga:
3Fe + 4H 2 O – t° → Fe 3 O 4 + 4H 2
3) Järn reagerar med icke-metaller vid upphettning:
2Fe+3Cl2 →2FeCl3 (200 °C)
Fe + S – t° → FeS (600 °C)
Fe+2S → Fe+2 (S2-1) (700°C)
4) I spänningsserien ligger den till vänster om väte, reagerar med utspädda syror HCl och H 2 SO 4, och järn(II)-salter bildas och väte frigörs:
Fe + 2HCl → FeCl 2 + H 2 (reaktioner utförs utan lufttillgång, annars omvandlas Fe +2 gradvis av syre till Fe +3)
Fe + H2SO4 (utspädd) → FeSO4 + H2
I koncentrerade oxiderande syror löses järn endast när det upphettas; det omvandlas omedelbart till Fe 3+ katjonen:
2Fe + 6H 2 SO 4 (konc.) – t° → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (konc.) – t° → Fe(NO 3) 3 + 3NO 2 + 3H 2 O
(i den kalla, koncentrerad salpetersyra och svavelsyra passivisera

En järnspik nedsänkt i en blåaktig lösning av kopparsulfat blir gradvis belagd med en beläggning av röd metallisk koppar.
5) Järn förskjuter metaller som ligger till höger om det från lösningar av deras salter.
Fe + CuS04 → FeS04 + Cu
Järns amfotera egenskaper visas endast i koncentrerade alkalier under kokning:
Fe + 2NaOH (50%) + 2H2O= Na2↓+ H2
och en fällning av natriumtetrahydroxoferrat(II) bildas.
Teknisk hårdvara- legeringar av järn och kol: gjutjärn innehåller 2,06-6,67 % C, stål 0,02-2,06% C, andra naturliga föroreningar (S, P, Si) och artificiellt införda specialtillsatser (Mn, Ni, Cr) förekommer ofta, vilket ger järnlegeringar tekniskt användbara egenskaper - hårdhet, termisk och korrosionsbeständighet, formbarhet, etc. . .
Process för tillverkning av masugnsjärn
Masugnsprocessen för framställning av gjutjärn består av följande steg:
a) beredning (rostning) av sulfid- och karbonatmalmer - omvandling till oxidmalm:
FeS 2 → Fe 2 O 3 (O 2 800°C, -SO 2) FeCO 3 → Fe 2 O 3 (O 2 500-600°C, -CO 2)
b) förbränning av koks med varmblästring:
C (koks) + O 2 (luft) → CO 2 (600-700 ° C) CO 2 + C (koks) ⇌ 2 CO (700-1000 ° C)
c) reduktion av oxidmalm med kolmonoxid CO sekventiellt:
Fe2O3 →(CO)(Fe II Fe 2 III) O 4 →(CO) FeO →(CO) Fe
d) uppkolning av järn (upp till 6,67 % C) och smältning av gjutjärn:
Fe (t ) →(C(koks)900-1200°C) Fe (vätska) (gjutjärn, smältpunkt 1145°C)
Gjutjärn innehåller alltid cementit Fe 2 C och grafit i form av korn.
Stålproduktion
Omvandlingen av gjutjärn till stål utförs i speciella ugnar (omvandlare, öppen härd, elektrisk), som skiljer sig åt i uppvärmningsmetoden; processtemperatur 1700-2000 °C. Att blåsa luft berikad med syre leder till förbränning av överskott av kol, samt svavel, fosfor och kisel i form av oxider från gjutjärnet. I detta fall fångas oxiderna antingen upp i form av avgaser (CO 2, SO 2), eller binds till en lätt separerad slagg - en blandning av Ca 3 (PO 4) 2 och CaSiO 3. För att tillverka specialstål införs legeringstillsatser av andra metaller i ugnen.
Mottagande rent järn i industrin - elektrolys av en lösning av järnsalter, till exempel:
FeСl 2 → Fe↓ + Сl 2 (90°С) (elektrolys)
(det finns andra speciella metoder, inklusive reduktion av järnoxider med väte).
Rent järn används vid tillverkning av speciallegeringar, vid tillverkning av kärnor av elektromagneter och transformatorer, gjutjärn - vid tillverkning av gjutgods och stål, stål - som struktur- och verktygsmaterial, inklusive slitage-, värme- och korrosionsbeständiga ettor.
Järn(II)oxid F EO . En amfoter oxid med en hög övervikt av grundläggande egenskaper. Svart, har en jonstruktur Fe 2+ O 2- . Vid uppvärmning sönderdelas det först och bildas sedan igen. Det bildas inte när järn brinner i luften. Reagerar inte med vatten. Nedbryts med syror, smälter samman med alkalier. Oxiderar långsamt i fuktig luft. Reduceras av väte och koks. Deltar i masugnsprocessen vid järnsmältning. Det används som en komponent i keramik och mineralfärger. Ekvationer av de viktigaste reaktionerna:
4FeO ⇌(Fe II Fe 2 III) + Fe (560-700 °C, 900-1000 °C)
FeO + 2HC1 (utspädd) = FeC12 + H2O
FeO + 4HNO3 (konc.) = Fe(NO3)3 +NO2 + 2H2O
FeO + 4NaOH = 2H2O+ Nen 4FeO3 (röd.) trioxoferrat(II)(400-500 °C)
FeO + H2 =H2O + Fe (extra ren) (350°C)
FeO + C (koks) = Fe + CO (över 1000 °C)
FeO + CO = Fe + CO 2 (900°C)
4FeO + 2H2O (fukt) + O2 (luft) →4FeO(OH) (t)
6FeO + O2 = 2(Fe II Fe2III) O4 (300-500°C)
Mottagande V laboratorier: termisk nedbrytning av järn(II)föreningar utan lufttillgång:
Fe(OH)2 = FeO + H2O (150-200 °C)
FeCO3 = FeO + CO 2 (490-550 °C)
Dijärn(III)oxid - järn( II ) ( Fe II Fe 2 III)O 4 . Dubbel oxid. Svart, har jonstrukturen Fe 2+ (Fe 3+) 2 (O 2-) 4. Termiskt stabil upp till höga temperaturer. Reagerar inte med vatten. Nedbryts med syror. Reduceras av väte, varmt järn. Deltar i masugnsprocessen vid tillverkning av gjutjärn. Används som en komponent i mineralfärger ( blymönja), keramik, färgad cement. Produkt av speciell oxidation av ytan på stålprodukter ( svärtande, blånande). Sammansättningen motsvarar brunrost och mörk skala på järn. Användningen av bruttoformeln Fe 3 O 4 rekommenderas inte. Ekvationer av de viktigaste reaktionerna:
2(Fe II Fe2III)O4 = 6FeO + O2 (över 1538 °C)
(Fe II Fe 2 III) O 4 + 8НС1 (dil.) = FeС1 2 + 2FeС1 3 + 4Н 2 O
(Fe II Fe2III) O4 +10HNO3 (konc.) = 3Fe(NO3)3 + NO2 + 5H2O
(Fe II Fe 2 III) O 4 + O 2 (luft) = 6 Fe 2 O 3 (450-600 ° C)
(Fe II Fe2III)O4 + 4H2 = 4H2O + 3Fe (extra ren, 1000 °C)
(Fe II Fe2III) O4 + CO = 3 FeO + CO2 (500-800°C)
(Fe II Fe 2 III)O4 + Fe ⇌4FeO (900-1000 °C, 560-700 °C)
Mottagande: förbränning av järn (se) i luft.
magnetit.
Järn(III)oxid F e2O3 . Amfoter oxid med övervägande basegenskaper. Rödbrun, har jonstruktur (Fe 3+) 2 (O 2-) 3. Termiskt stabil upp till höga temperaturer. Det bildas inte när järn brinner i luften. Reagerar inte med vatten, brunt amorft hydrat Fe 2 O 3 nH 2 O fälls ut från lösningen Reagerar långsamt med syror och alkalier. Reduceras av kolmonoxid, smält järn. smälter samman med oxider av andra metaller och bildar dubbeloxider - spineller(tekniska produkter kallas ferriter). Det används som råmaterial vid smältning av gjutjärn i masugnsprocessen, en katalysator vid framställning av ammoniak, en komponent i keramik, färgade cement och mineralfärger, vid termitsvetsning av stålkonstruktioner, som bärare av ljud och bild på magnetband, som poleringsmedel för stål och glas.
Ekvationer av de viktigaste reaktionerna:
6Fe2O3 = 4(Fe II Fe2III)O4 +O2 (1200-1300 °C)
Fe 2 O 3 + 6НС1 (utspädd) →2FeС1 3 + ЗН 2 O (t) (600°С,р)
Fe2O3 + 2NaOH (konc.) →H2O+ 2 NAFeO 2 (röd)dioxoferrat(III)
Fe 2 O 3 + MO=(M II Fe 2 II I) O 4 (M=Cu, Mn, Fe, Ni, Zn)
Fe 2 O 3 + ZN 2 = ZN 2 O+ 2Fe (extra ren, 1050-1100 °C)
Fe 2 O 3 + Fe = 3FeO (900 °C)
3Fe 2 O 3 + CO = 2 (Fe II Fe 2 III) O 4 + CO 2 (400-600 °C)
Mottagande i laboratoriet - termisk nedbrytning av järn (III) salter i luft:
Fe 2 (SO 4) 3 = Fe 2 O 3 + 3 SO 3 (500-700 °C)
4(Fe(NO 3) 3 9 H 2 O) = 2Fe a O 3 + 12NO 2 + 3O 2 + 36 H 2 O (600-700 °C)
I naturen - järnoxidmalmer hematit Fe 2 O 3 och limonit Fe2O3nH2O
Järn(II)hydroxid F e(OH)2. Amfoter hydroxid med övervägande basegenskaper. Vita (ibland med en grönaktig nyans), Fe-OH-bindningar är övervägande kovalenta. Termiskt instabil. Oxiderar lätt i luft, speciellt när det är vått (det mörknar). Olösligt i vatten. Reagerar med utspädda syror och koncentrerade alkalier. Typisk reducering. En mellanprodukt vid rostning av järn. Det används vid tillverkning av den aktiva massan av järn-nickel-batterier.
Ekvationer av de viktigaste reaktionerna:
Fe(OH)2 = FeO + H2O (150-200 °C, atm.N2)
Fe(OH)2 + 2HC1 (utspädd) = FeC12 + 2H2O
Fe(OH) 2 + 2 NaOH (> 50%) = Na 2 ↓ (blågrön) (kokande)
4Fe(OH)2 (suspension) + O2 (luft) →4FeO(OH)↓ + 2H2O (t)
2Fe(OH)2 (suspension) +H2O2 (utspädd) = 2FeO(OH)↓ + 2H2O
Fe(OH)2 + KNO3 (konc.) = FeO(OH)↓ + NO+ KOH (60 °C)
Mottagande: utfällning från lösning med alkalier eller ammoniakhydrat i en inert atmosfär:
Fe2+ + 2OH (utspädd) = Fe(OH)2 ↓
Fe2+ + 2(NH3H2O) = Fe(OH)2 ↓+ 2NH4
Järnmetahydroxid F eO(OH). Amfoter hydroxid med övervägande basegenskaper. Ljusbruna, Fe - O- och Fe - OH-bindningar är övervägande kovalenta. Vid upphettning sönderdelas den utan att smälta. Olösligt i vatten. Fälls ut från lösningen i form av ett brunt amorft polyhydrat Fe 2 O 3 nH 2 O, som, när det hålls under en utspädd alkalisk lösning eller vid torkning, övergår till FeO(OH). Reagerar med syror och fasta alkalier. Svagt oxiderande och reduktionsmedel. Sintrad med Fe(OH) 2. En mellanprodukt vid rostning av järn. Den används som bas för gula mineralfärger och emaljer, en absorbator för avfallsgaser och en katalysator vid organisk syntes.
Föreningen med sammansättningen Fe(OH)3 är okänd (inte erhållen).
Ekvationer av de viktigaste reaktionerna:
Fe2O3. nH2O→( 200-250 °C, —H 2 O) FeO(OH)→( 560-700°C i luft, -H2O)→Fe2O3
FeO(OH) + ZNS1 (utspädd) = FeCl3 + 2H2O
FeO(OH)→ Fe 2 O 3 . nH 2 O-kolloid(NaOH (konc.))
FeO(OH)→ Nen 3 [Fe(OH)6]vit Na5 respektive K4; i båda fallen fälls en blå produkt av samma sammansättning och struktur, KFe III, ut. I laboratoriet kallas denna fällning Preussisk blå, eller turnbull blå:
Fe 2+ + K + + 3- = KFe III ↓
Fe 3+ + K + + 4- = KFe III ↓
Kemiska namn på startreagenserna och reaktionsprodukterna:
K 3 Fe III - kaliumhexacyanoferrat (III)
K 4 Fe III - kaliumhexacyanoferrat (II)
КFe III - järn (III) kaliumhexacyanoferrat (II)
Ett bra reagens för Fe 3+-joner är dessutom tiocyanatjonen NСS -, järn (III) kombineras med det, och en ljusröd ("blodig") färg visas:
Fe 3+ + 6NCS - = 3-
Detta reagens (till exempel i form av KNCS-salt) kan till och med upptäcka spår av järn (III) i kranvatten om det passerar genom järnrör belagda med rost på insidan.


Känd för människor sedan antiken: forskare tillskriver gamla hushållsartiklar gjorda av detta material till det 4:e årtusendet f.Kr.
Det är omöjligt att föreställa sig mänskligt liv utan järn. Man tror att järn används för industriella ändamål oftare än andra metaller. De viktigaste strukturerna är gjorda av det. Järn finns också i små mängder i blodet. Det är innehållet i det tjugosjätte elementet som färgar blodet rött.
Fysiska egenskaper hos järn
Järn brinner i syre och bildar en oxid:
3Fe + 202 = Fe304.
Vid uppvärmning kan järn reagera med icke-metaller:
Även vid en temperatur på 700-900 °C reagerar den med vattenånga:
3Fe + 4H2O = Fe304 + 4H2.
Järnföreningar
Järnoxider har som bekant joner med två oxidationstillstånd: +2 och + 3. Att veta detta är oerhört viktigt, eftersom olika element kommer att hållas helt annorlunda kvalitativa reaktioner.
Kvalitativa reaktioner på järn
En kvalitativ reaktion behövs så att man enkelt kan bestämma närvaron av joner av ett ämne i lösningar eller föroreningar av ett annat. Låt oss överväga de kvalitativa reaktionerna av tvåvärt och trevärt järn.
Kvalitativa reaktioner på järn (III)
Halten av järn(III)joner i en lösning kan bestämmas med alkali. Om resultatet är positivt bildas en bas - järn(III)hydroxid Fe(OH)3.
 Järn(III)hydroxid Fe(OH)3
Järn(III)hydroxid Fe(OH)3
Det resulterande ämnet är olösligt i vatten och har en brun färg. Det är den bruna fällningen som kan indikera närvaron av järn(III)joner i lösningen:
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl.
Fe(III)-joner kan också bestämmas med användning av K3.
En lösning av järnklorid blandas med en gulaktig lösning av blodsalt. Som ett resultat kan du se en vacker blåaktig fällning, vilket indikerar att järnjoner finns i lösningen. Du kommer att hitta spektakulära experiment för att studera egenskaperna hos järn.
Kvalitativa reaktioner på järn (II)
Fe²⁺-joner reagerar med rött blodsalt K4. Om en blåaktig fällning bildas när salt tillsätts, är dessa joner närvarande i lösningen.

Vet du att järn skyddar planeten från "kosmiska attacker"? Tack vare enorma ansamlingar av detta element bildas jordens magnetfält. Som en skärm skyddar fältet den från asteroider...
Järn spelar en roll inte bara i sådana globala saker, utan också i vår Vardagsliv: stål och de flesta legeringar skapas just på basis av detta element. Allt från bestick till bilar till mikroelektronik kunde alltså inte fungera utan hårdvara.
Slutligen skulle vårt liv vara omöjligt utan det, eftersom detta mineral är en del av hemoglobin - innehållet i röda blodkroppar, tack vare vilka vävnader kan använda syre. Detta underbara element döljer många fler användbara egenskaper. Läs mer om järnets funktioner för vår hälsa i den här artikeln.
Järnhalt i produkter (per 100 g):
Lever 10-20 mg
Jäst 18 mg
Havskål 16 mg
Linser 12 mg
Bovete 8,2 mg
Gula 7,2 mg
Kanin 4,4 mg
Svart kaviar 2,5 mg
Vad är järn?
Det är metall. I organ och vävnader finns järn i cirka 3-5 gram. Detta är inte mycket, men en så liten dos räcker för att kroppen framgångsrikt ska kunna fortsätta sin existens. Fyra femtedelar av allt järn finns i hemoglobin, resten sprids i hela kroppen och fördelas i levern, musklerna, benen osv. En del av det inre järnet ingår i enzymer.
Med tiden uppstår en naturlig förlust av mineralet, och därför behöver en person konstant tillförsel av vissa doser av järn. Det går förlorat i urin och svett, hos kvinnor är järnkonsumtion också förknippat med månatliga förluster under menstruationen.
Järnrik mat
Grundämnet är så utbrett i naturen att järn finns i de flesta livsmedel. De bästa källorna är djur - kött och lever. I dem är järn i den mest smältbara formen. Det finns vanligtvis mindre av det i vegetabiliska livsmedel än i animaliska livsmedel, men detta är också en viktig källa till mineralet. Det finns i citrusfrukter, granatäpplen, rödbetor, bovete, baljväxter, nötter, pumpa, äpplen, tång och persimmons.
Dagligt järnbehov
Män har som regel ett större behov av vitaminer och mineraler än kvinnor, men i det här fallet är det inte så: kvinnor behöver högre doser av järn. De kräver 18 mg av mineralet, medan män kräver cirka 10 mg. För barn är normen inte exakt bestämd, enligt olika källor kan den variera från 4 till 15 mg.
Ökat järnbehov
 Ett ökat behov av järn är inneboende i följande grupper av människor:
Ett ökat behov av järn är inneboende i följande grupper av människor:
Kvinnor under perioden efter menstruation. Blodförlust, även om den är liten, kräver kompensation för hemoglobinhalten i blodet.
. Gravid och ammande. Under graviditeten genomförs en betydande konsumtion av järn för att bygga fostrets kropp, och ammande mödrar spenderar sitt järn på att mata barnet (det går över i bröstmjölken). Bokstavligen varannan gravid kvinna visar tecken på järnbrist, vilket indikerar en signifikant ökning av behovet av detta element hos blivande mödrar.
. Efter skador, blodförlust, allvarliga kirurgiska operationer.
Järn är ett mycket värdefullt element. I detta avseende har kroppen lärt sig att återanvända den. Under den naturliga förstörelsen av gamla röda blodkroppar fångar speciella bärarproteiner det frigjorda järnet och transporterar det till de hematopoetiska organen, där det används igen.
Men förlusten av mineralet är fortfarande ganska stor, så många behöver ytterligare järntillskott i vardagen. Om du har ett ökat behov av detta ämne bör du börja ta kosttillskott som innehåller detta ämne.
Absorption av järn från mat
 Även under idealiska förhållanden absorberas inte mer än 10 % av det intagna järnet från maten. Det finns ett antal faktorer som ytterligare minskar denna siffra. Samtidigt finns det vissa faktorer som ökar upptaget av mineralet. Vad bestämmer graden av järnabsorption?
Även under idealiska förhållanden absorberas inte mer än 10 % av det intagna järnet från maten. Det finns ett antal faktorer som ytterligare minskar denna siffra. Samtidigt finns det vissa faktorer som ökar upptaget av mineralet. Vad bestämmer graden av järnabsorption?
1. Källa. Animaliska produkter innehåller järn i en lättupptaglig tvåvärd form. I växter är det trivalent. För att tillgodogöra sig det och använda det måste kroppen förbruka energi för att återställa mineralet till dess tvåvärda form. Det är därför mest av järn som levereras med bovete eller granatäpplejuice gynnar inte kroppen.
2. Matsmältningshälsa. Med minskad surhet av magsaft, gastrit och enterit minskar järnabsorptionen avsevärt. Det är optimalt för en hälsosam matsmältningskanal.
3. Livsmedelssammansättning.
4. Järn absorberas bättre i närvaro av C-vitamin, organiska syror från grönsaker och frukter, aminosyror lysin och histidin, samt vissa kolhydrater som fruktos och sorbitol. Kött och lever bör alltså alltid kombineras med en fräsch grönsakssallad.
5. Järn absorberas mindre lätt i närvaro av tanniner, kostfibrer (de "samlar" järnmolekyler och tar bort dem från kroppen), fytin och oxalsyra. Det betyder att om du är ute efter att få i dig mer järn, rekommenderas det att undvika att äta mat som baljväxter, syra, spenat och kli för ofta. Kalcium är en ganska stark antagonist av järn, produkter som innehåller det (främst mejeriprodukter) hämmar dess absorption.
Järns biologiska roll
Järnets funktioner är:
Det är ett oumbärligt element för hematopoiesis, råmaterialet för bildandet av andningspigmentet hemoglobin och bildandet av röda blodkroppar.
. Viktigt för syntesen av sköldkörtelhormoner
. Stärker immunförsvaret, hjälper till att öka kroppens försvar
. Förbättrar funktionen hos vissa vitaminer som vitamin B6, B12, B9
. Förbättrar effekterna av ett antal spårämnen som kobolt, mangan, koppar
. Innehåller enzymer som ger avgiftning skadliga ämnen i organismen
. Ger förmågan för vävnader att andas, och detta ger inte bara en helande, utan också en kosmetisk effekt. Med normalt intag av järn i kroppen förblir en persons hud, hår och naglar i gott skick.
. Skyddar mot överansträngning och kronisk trötthet
. Det är av stor betydelse för nervsystemets funktion.
Tecken på järnbrist
 Brist på mineralet och behov av regelbundet järntillskott är extremt vanligt. Det allra första och främsta tecknet på elementbrist i kroppen är anemi.
Brist på mineralet och behov av regelbundet järntillskott är extremt vanligt. Det allra första och främsta tecknet på elementbrist i kroppen är anemi.
En minskning av antalet röda blodkroppar och nivån av hemoglobin i blodet leder till följande symtom: svaghet, snabbt insättande trötthet, instabilitet i fysisk aktivitet, förstoppning eller diarré, aptit- och smakrubbningar, domningar och kyla i extremiteter, blek och torr hud, försämring av naglar, håravfall, försvagat immunförsvar, etc. Ofta tillåter dessa tecken oss att gissa om järnbrist i kroppen. Personen går till läkaren, undersöks och anemi upptäcks.
Tecken på överskott av järn
Även när man äter mat som innehåller höga koncentrationer av järn uppstår inte järnöverskott. Detta beror på det faktum att kroppen självständigt "filtrerar" överskott av mineralföreningar och tar exakt så mycket järn som den behöver.
Det är mycket svårare för honom att motstå de ultrahöga doserna av järn som förses med droger. Om järnhaltiga produkter och kosttillskott används för intensivt kan förgiftning uppstå. Det gör sig känt av kräkningar, huvudvärk, avföringsrubbningar och andra symtom.
Överskott av järn ses också i ett sällsynt tillstånd som kallas hemokromatos. Med denna sjukdom utför kroppen en patologisk ackumulering av järn, vilket manifesteras av allvarliga störningar i levern och andra organ.
Faktorer som påverkar järnhalten i livsmedel
Om du lagar mat under en längre tid, minskar innehållet av smältbart järn i dem, eftersom det förvandlas till en form som är otillgänglig för absorption. Därför, om du köper kött eller lever, välj produkter av högsta kvalitet som inte kommer att vara för sega och som inte behöver kokas eller stekas för länge.
Järn anses vara en av de vanligaste metallerna i jordskorpan efter aluminium. Dess fysikaliska och kemiska egenskaper är sådana att den har utmärkt elektrisk ledningsförmåga, termisk ledningsförmåga och formbarhet, har en silvervit färg och hög kemisk reaktivitet för att snabbt korrodera vid hög luftfuktighet eller höga temperaturer. Eftersom den är i fint spridd tillstånd brinner den i rent syre och antänds spontant i luften.
Början på järnets historia
Under det tredje årtusendet f.Kr. e. folk började bryta och lärde sig att bearbeta brons och koppar. De användes inte i stor utsträckning på grund av deras höga kostnader. Jakten på ny metall fortsatte. Järnets historia började under det första århundradet f.Kr. e. I naturen kan det bara hittas i form av föreningar med syre. För att få ren metall är det nödvändigt att separera det sista elementet. Det tog lång tid att smälta järnet, eftersom det måste värmas till 1539 grader. Och först med tillkomsten av osttillverkningsugnar under det första årtusendet f.Kr. började de erhålla denna metall. Till en början var den ömtålig och innehöll mycket avfall.
Med tillkomsten av smedjor förbättrades kvaliteten på järn avsevärt. Den vidareförädlades i en smed, där slaggen separerades med hammarslag. Smide har blivit en av huvudtyperna av metallbearbetning, och smide har blivit en oumbärlig produktionsgren. Järn i sin rena form är en mycket mjuk metall. Det används främst i en legering med kol. Detta tillägg förstärker detta fysikalisk egenskap järnliknande hårdhet. Det billiga materialet trängde snart brett in i alla sfärer av mänsklig verksamhet och revolutionerade samhällsutvecklingen. Trots allt, även i antiken, var järnprodukter täckta med ett tjockt lager av guld. Den hade ett högt pris jämfört med ädelmetallen.
Järn i naturen
Litosfären innehåller mer aluminium än järn. I naturen kan det bara hittas i form av föreningar. Järnjärn, som reagerar, gör jorden brun och ger sanden en gulaktig nyans. Järnoxider och sulfider är utspridda i jordskorpan, ibland finns det ansamlingar av mineraler, från vilka metallen sedan utvinns. Innehållet av järnhaltigt järn i vissa mineralkällor ger vattnet en speciell smak.

Rostigt vatten som rinner från gamla vattenrör färgas av den trevärda metallen. Dess atomer finns också i människokroppen. De finns i hemoglobin (järnhaltigt protein) i blodet, som förser kroppen med syre och tar bort koldioxid. Vissa meteoriter innehåller rent järn, ibland hittas hela tackor.
Vilka fysikaliska egenskaper har järn?
Det är en seg silvervit metall med en gråaktig nyans och en metallisk glans. Han är en bra guide elektrisk ström och värme. Tack vare sin formbarhet lämpar den sig perfekt för smide och valsning. Järn löser sig inte i vatten, utan blir flytande i kvicksilver, smälter vid en temperatur av 1539 och kokar vid 2862 grader Celsius och har en densitet på 7,9 g/cm³. Ett kännetecken för de fysiska egenskaperna hos järn är att metallen attraheras av en magnet och efter upphävandet av det yttre magnetiskt fält lagrar magnetisering. Med hjälp av dessa egenskaper kan den användas för att göra magneter.
Kemiska egenskaper
Järn har följande egenskaper:
- i luft och vatten oxiderar det lätt och blir täckt av rost;
- i syre brinner den heta tråden (och beläggningar bildas i form av järnoxid);
- vid en temperatur på 700-900 grader Celsius reagerar den med vattenånga;
- vid upphettning, reagerar med icke-metaller (klor, svavel, brom);
- reagerar med utspädda syror, vilket resulterar i järnsalter och väte;
- löses inte i alkalier;
- är kapabel att ersätta metaller från lösningar av deras salter (en järnspik i en lösning av kopparsulfat blir täckt med en röd beläggning - detta är frigörandet av koppar);
- I koncentrerade alkalier vid kokning manifesteras amfotericiteten av järn.
Funktionsegenskaper
En av de fysiska egenskaperna hos järn är ferromagneticitet. I praktiken påträffas ofta de magnetiska egenskaperna hos detta material. Detta är den enda metallen som har en så sällsynt egenskap.

Under påverkan av ett magnetfält magnetiseras järn. Bildas magnetiska egenskaper metallen håller länge och förblir i sig själv en magnet. Detta exceptionella fenomen förklaras av det faktum att järnets struktur innehåller ett stort antal fria elektroner som kan röra sig.
Reserver och produktion
Ett av de vanligaste grundämnena på jorden är järn. Sett till innehållet i jordskorpan hamnar den på fjärde plats. Det finns många kända malmer som innehåller det, till exempel magnetisk och brun järnmalm. Metallen tillverkas inom industrin huvudsakligen av hematit- och magnetitmalmer med masugnsprocessen. Först reduceras det med kol i en ugn vid en hög temperatur på 2000 grader Celsius.

För att göra detta matas järnmalm, koks och flussmedel in i masugnen ovanifrån och en ström av varm luft injiceras underifrån. En direkt process för att erhålla järn används också. Den krossade malmen blandas med speciell lera för att bilda pellets. Därefter eldas de och behandlas med väte i en schaktugn, där det lätt kan återställas. De får fast järn och smälter det sedan i elektriska ugnar. Ren metall reduceras från oxider genom elektrolys av vattenhaltiga saltlösningar.
Fördelarna med järn
Järnämnets grundläggande fysikaliska egenskaper ger det och dess legeringar följande fördelar jämfört med andra metaller:

Brister
Bortsett från stort antal positiva egenskaper, det finns ett antal negativa egenskaper hos metall:
- Produkter är känsliga för korrosion. För att eliminera denna oönskade effekt framställs rostfria stål genom legering, och i andra fall utförs speciell korrosionsskyddsbehandling på strukturer och delar.
- Järn ackumulerar statisk elektricitet, så produkter som innehåller det utsätts för elektrokemisk korrosion och kräver också ytterligare bearbetning.
- Metallens specifika vikt är 7,13 g/cm³. Denna fysiska egenskap hos järn ger strukturer och delar ökad vikt.
Sammansättning och struktur
Järn har fyra kristallina modifikationer som skiljer sig åt i struktur och gitterparametrar. För smältning av legeringar är det förekomsten av fasövergångar och legeringstillsatser som är av stor betydelse. Följande tillstånd särskiljs:
- Alfafas. Den varar upp till 769 grader Celsius. I detta tillstånd behåller järn egenskaperna hos en ferromagnet och har ett kroppscentrerat kubiskt gitter.
- Betafasen. Finns vid temperaturer från 769 till 917 grader Celsius. Den har något annorlunda gitterparametrar än i det första fallet. Alla fysiska egenskaper hos järn förblir desamma, med undantag för magnetiska, som det förlorar.
- Gammafas. Gitterstrukturen blir ansiktscentrerad. Denna fas uppträder i intervallet 917-1394 grader Celsius.
- Omega fas. Detta tillstånd hos metallen uppträder vid temperaturer över 1394 grader Celsius. Det skiljer sig från den föregående endast i gitterparametrarna.

Järn är den mest eftertraktade metallen i världen. Mer än 90 procent av all metallurgisk produktion faller på den.
Ansökan
Människor började först använda meteoritjärn, som värderades högre än guld. Sedan dess har omfattningen av denna metall bara utökats. Följande är användningen av järn baserat på dess fysikaliska egenskaper:
- ferromagnetiska oxider används för produktion av magnetiska material: industriella installationer, kylskåp, souvenirer;
- järnoxider används som mineralfärger;
- järnklorid är oumbärlig i amatörradiopraxis;
- Järnsulfater används i textilindustrin;
- magnetisk järnoxid är ett av de viktiga materialen för produktion av långtidsminnesenheter för datorer;
- ultrafint järnpulver används i svartvita laserskrivare;
- metallens styrka gör det möjligt att tillverka vapen och rustningar;
- slitstarkt gjutjärn kan användas för att tillverka bromsar, kopplingsskivor och delar till pumpar;
- värmebeständig - för masugnar, termiska ugnar, ugnar med öppen härd;
- värmebeständig - för kompressorutrustning, dieselmotorer;
- högkvalitativt stål används för gasledningar, höljen till värmepannor, torktumlare, tvättmaskiner och diskmaskiner.
Slutsats
Järn betyder ofta inte själva metallen, utan dess legering - kolstål med låg kolhalt. Att få rent järn är en ganska komplex process, och därför används den endast för produktion av magnetiska material. Som redan noterats är den exceptionella fysiska egenskapen hos det enkla ämnet järn ferromagnetism, det vill säga förmågan att magnetiseras i närvaro av ett magnetfält.

De magnetiska egenskaperna hos ren metall är upp till 200 gånger högre än hos tekniskt stål. Denna egenskap påverkas också av metallens kornstorlek. Ju större korn, desto högre magnetiska egenskaper. Mekanisk bearbetning har också effekt till viss del. Sådant rent järn som uppfyller dessa krav används för att producera magnetiska material.
Rent järn erhålls med olika metoder. Den viktigaste metoden är termisk nedbrytning av järnpentakarbonyl (se § 193) och elektrolys av vattenlösningar av dess salter.
I fuktig luft rostar järn snabbt, det vill säga det blir täckt med en brun beläggning av hydratiserad järnoxid, som på grund av sin sprödhet inte skyddar järnet från ytterligare oxidation. I vatten korroderar järn intensivt; med riklig tillgång till syre bildas hydratformer av järn(III)oxid:
När det finns brist på syre eller när det är svårt att komma åt det bildas blandad oxid Fe 3 O 4 (FeO Fe 2 O 3):
Järn löser sig i saltsyra i vilken koncentration som helst:
Upplösning i utspädd svavelsyra sker på liknande sätt:
I koncentrerade lösningar av svavelsyra oxideras järn till järn(III):
Men i svavelsyra, vars koncentration är nära 100%, blir järn passivt och praktiskt taget ingen interaktion inträffar.
Järn löser sig i utspädda och måttligt koncentrerade lösningar av salpetersyra:
Vid höga koncentrationer av HNO 3 saktar upplösningen ner och järn blir passivt.
Järn kännetecknas av två serier av föreningar: järn(II)-föreningar och järn(III)-föreningar. Den första motsvarar järn(II)oxid, eller järnoxid, FeO, den andra - till järn(III)oxid, eller järnoxid, Fe 2 O 3.
Dessutom är salter av järnsyra H 2 FeO 4 kända, i vilka järnets oxidationstillstånd är +6.
Järn(II)-föreningar.
Järn(II)salter bildas när järn löses i andra utspädda syror än salpetersyra. Den viktigaste av dem är järn(II)sulfat, eller järnsulfat, FeSO 4 ·7H 2 O, som bildar ljusgröna kristaller som är mycket lösliga i vatten. I luft eroderar järnsulfat gradvis och oxiderar samtidigt från ytan och förvandlas till ett gulbrunt basiskt järn(III)salt.
Järn(II)sulfat framställs genom att lösa upp stålskrot i 20-30 % svavelsyra:
Järn(II)sulfat används för att bekämpa växtskadegörare, vid tillverkning av bläck och mineralfärger och vid textilfärgning.
När järnsulfat värms upp frigörs vatten och en vit massa av vattenfritt salt FeSO 4 erhålls. Vid temperaturer över 480°C sönderdelas det vattenfria saltet för att frigöra svaveldioxid och svaveltrioxid; den senare i fuktig luft bildar tunga vita ångor av svavelsyra:
När en lösning av ett järn(II)salt reagerar med ett alkali, fälls en vit fällning av järn(II)hydroxid Fe(OH) 2 ut, som i luften på grund av oxidation snabbt får en grönaktig och sedan brun färg och övergår till järn. (III) hydroxid.
Vattenfri järn(II)oxid FeO kan erhållas i form av ett svart, lättoxiderat pulver genom att reducera järn(III)oxid med kol(II)oxid vid 500°C:
Karbonater alkaliska metaller vitt järn(II)karbonat FeCO 3 fälls ut från lösningar av järn(II)salter. När det utsätts för vatten som innehåller CO 2 omvandlas järnkarbonat, liksom kalciumkarbonat, delvis till det mer lösliga sura saltet Fe(HCO 3) 2 . Järn finns i form av detta salt i naturliga järnhaltiga vatten.
Järn (II) salter kan lätt omvandlas till järn (III) salter genom inverkan av olika oxidationsmedel - salpetersyra, kaliumpermanganat, klor, till exempel:
På grund av sin förmåga att lätt oxidera används ofta järn(II)salter som reduktionsmedel.
Järn (III) föreningar.
Järn(III)klorid FeCl3 är en mörkbrun kristall med en grönaktig nyans. Detta ämne är mycket hygroskopiskt; absorberar fukt från luften, det förvandlas till kristallina hydrater som innehåller varierande mängder vatten och sprider sig i luften. I detta tillstånd har järn(III)klorid en brun-orange färg. I en utspädd lösning hydrolyserar FeCl3 till basiska salter. I ånga har järn(III)klorid en struktur som liknar den hos aluminiumklorid (s. 615) och motsvarar formeln Fe 2 Cl 6 ; märkbar dissociation av Fe2Cl6 till FeCl3-molekyler börjar vid temperaturer runt 500°C.
Järn(III)klorid används som koaguleringsmedel vid vattenrening och som katalysator i synteser organiskt material, inom textilindustrin.
Järn (III) sulfat Fe 2 (SO 4) 3 - mycket hygroskopiska, vita kristaller som diffunderar i luften. Bildar kristallint hydrat Fe 2 (SO 4) 3 · 9H 2 O (gula kristaller). I vattenlösningar hydrolyseras järn(III)sulfat i hög grad. Med alkalimetall- och ammoniumsulfater bildar den dubbelsalter - alun, till exempel järnammoniumalun (NH 4) Fe (SO 4) 2 · 12H 2 O - ljuslila kristaller som är mycket lösliga i vatten. Vid uppvärmning över 500°C sönderdelas järn(III)sulfat enligt ekvationen:
Järn(III)sulfat används, liksom FeCl 3 , som koaguleringsmedel vid vattenrening, såväl som för etsning av metaller. En lösning av Fe 2 (SO 4) 3 kan lösa upp Cu 2 S och CuS för att bilda koppar(II)sulfat, detta används vid hydrometallurgisk framställning av koppar.
När alkalier verkar på lösningar av järn(III)-salter fälls rödbrun järn(III)hydroxid Fe(OH) 3, olöslig i överskott av alkali, ut.
Järn(III)hydroxid är en svagare bas än järn(II)hydroxid; detta uttrycks i det faktum att järn(III)salter är starkt hydrolyserade och med svaga syror (till exempel kolsyra, svavelväte) Fe(OH) 3 salter bildas inte. Hydrolys förklarar också färgen på lösningar av järn(III)-salter: trots att Fe 3+ är nästan färglös är lösningar som innehåller det gulbruna, vilket förklaras av närvaron av järnhydroxojoner eller Fe(OH) 3 molekyler, som bildas på grund av hydrolys:

Vid upphettning mörknar färgen, och när syror tillsätts blir den ljusare på grund av undertryckandet av hydrolys.
När den bränns förvandlas järn(III)hydroxid, som förlorar vatten, till järn(III)oxid eller järnoxid, Fe 2 O 3. Järn(III)oxid förekommer naturligt i form av röd järnmalm och används som brun färg - rött bly, eller mumie.
En karakteristisk reaktion som skiljer järn(III)salter från järn(II)salter är verkan av kaliumtiocyanat KSCN eller ammoniumtiocyanat NH 4 SCN på järnsalter. En lösning av kaliumtiocyanat innehåller färglösa SCN-joner, som kombineras med Fe(III)-joner och bildar blodröda, svagt dissocierade järn(III)tiocyanat Fe(SCN) 3 . När den interagerar med tiocyanater av järn(II)joner förblir lösningen färglös.
Järncyanidföreningar. När lösningar av järn(II)-salter utsätts för lösliga cyanider, till exempel kaliumcyanid, erhålls en vit fällning av järn(II)cyanid:
I ett överskott av kaliumcyanid löses fällningen på grund av bildningen av komplexsaltet K 4 av kaliumhexacyanoferrat (II)
Kaliumhexacyanoferrat(II) K 4 ·3H 2 O kristalliseras i form av stora ljusgula prismor. Detta salt kallas även gult blodsalt. När saltet löses i vatten dissocierar det till kaliumjoner och extremt stabila komplexa 4-joner. I praktiken innehåller en sådan lösning inte alls Fe 2+-joner och ger inga reaktioner som är karakteristiska för järn(II).
Kaliumhexacyanoferrat (II) fungerar som ett känsligt reagens för järn (III) joner, eftersom 4-joner, som interagerar med Fe 3+ joner, bildar ett vattenolösligt salt av järn (III) hexacyanoferrat (II) Fe 4 3 karakteristiska av blå färg; Detta salt kallas preussiskt blått:
Preussisk blått används som färg.
När klor eller brom verkar på en lösning av gult blodsalt oxideras dess anjon och förvandlas till 3-
Saltet K3 som motsvarar denna anjon kallas kaliumhexacyanoferrat(III), eller rött blodsalt. Det bildar röda vattenfria kristaller.
Om du applicerar kaliumhexacyanoferrat(III) på en lösning av järn(II)salt får du en fällning av hexacyanoferrat(III), järn(I) (Turnboole blue), som ser väldigt likt preussisk blått, men har en annan sammansättning :
Med järn(III)salter bildar K 3 en grönbrun lösning.
I de flesta andra komplexa föreningar, som i de övervägda cyanoferraterna, är koordinationstalet för järn(II) och järn(III) sex.
Ferriter. När järn(III)oxid smälts samman med natrium- eller kaliumkarbonater, bildas ferriter - salter av järn(III)syra HFeO 2 som inte erhålls i fritt tillstånd, till exempel natriumferrit NaFeO 2:
När legeringen löses i vatten erhålls en rödviolett lösning, från vilken det vattenolösliga bariumferraten BaFeO 4 kan fällas ut genom inverkan av bariumklorid.
Alla ferrater är mycket starka oxidationsmedel (starkare än permanganater). Järnsyra H 2 FeO 4 motsvarande ferrater och dess anhydrid FeO 3 i fritt tillstånd har inte erhållits.
Järnkarbonyler. Järn bildar flyktiga föreningar med kolmonoxid som kallas järnkarbonyler. Järnpentakarbonyl Fe(CO) 5 är en blekgul vätska, kokande vid 105°C, olöslig i vatten, men löslig i många organiska lösningsmedel. Fe(CO)5 erhålls genom att passera CO över järnpulver vid 150-200°C och ett tryck av 10 MPa. Föroreningarna i järn reagerar inte med CO, vilket resulterar i en mycket ren produkt. Vid upphettning i vakuum sönderdelas järnpentakarbonyl till järn och CO; detta används för att producera högrent pulveriserat järn - karbonyljärn (se § 193).
Natur kemiska bindningar i Fe(CO)5-molekylen diskuteras på sidan 430.
| <<< Назад
|
Vidarebefordra >>> |
- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0