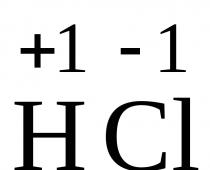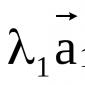Elektrolyter – ämnen vars vattenlösningar och smälta leder elektrisk ström. Dessa ämnen har joniska och kovalenta högpolära bindningar. Elektrolyter är syror, baser och salter. Beteendet hos elektrolyter i lösning förklaras av teorin om elektrolytisk dissociation, formulerad Svante Arrheniusår 1887:
Ämnen vars lösningar är elektrolyter, när de löses upp, sönderdelas till partiklar (joner) som bär positiva och negativa laddningar.
Processen att elektrolyter bryts ner till joner kallas elektrolytisk dissociation. Under påverkan av elektrisk spänning rör sig positivt laddade joner mot katoden och negativt laddade mot anoden.
Joner som är positivt laddade kallas katjoner och negativt laddade joner – anjoner. Katjoner är positivt laddade metalljoner, vätejoner, NH 4+, anjoner - syrarester och hydroxidjon. Mängden laddning på jonen sammanfaller med valensen av atomen eller den sura resten, och antalet positiva laddningar är lika med antalet negativa. Därför är lösningen som helhet elektriskt neutral. Processen för elektrolytisk dissociation avbildas enligt följande:
NaCl ↔ Na + + Cl‾
H 2 SO 4 ↔ 2H + + SO 4 2–
Arrhenius teori förklarade många fenomen förknippade med egenskaperna hos elektrolytlösningar, men svarade inte på frågan: varför vissa ämnen är elektrolyter och andra inte är det, och även vilken roll lösningsmedlet spelar i bildandet av joner.
2 . Dissociationsmekanism
Teorin om dissociationsprocessen utvecklades av I.A. Klackskor (1891).
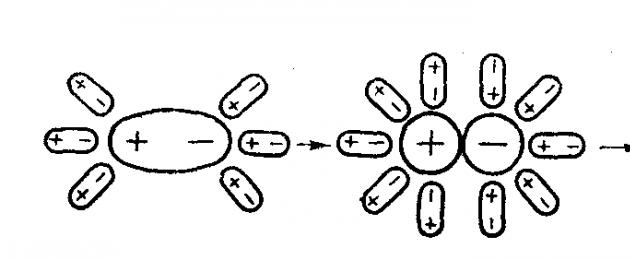
Låt oss föreställa oss att en jonisk kristall, till exempel NaCl, tillsätts vatten. Varje jon som ligger på kristallens yta bildar ett elektriskt fält runt sig själv. Nära Na + skapas ett fält med ett positivt tecken, nära Cl - ett elektrostatiskt fält med ett negativt tecken ges. Inverkan av dessa fält sträcker sig över ett visst avstånd från kristallen. I lösning är kristallen omgiven på alla sidor av slumpmässigt rörliga vattenmolekyler. När de kommer in i verkningsfältet för elektriskt laddade joner ändrar de sin rörelse: i kristallens omedelbara närhet är de orienterade på ett sådant sätt att vattendipolerna är riktade mot den negativt laddade Cl - jonen med en positivt laddad pol, och mot den positivt laddade Na + jonen – med en negativt laddad pol ( Fig. 1). Detta fenomen kallas orienteringen av polära molekyler i ett elektrostatiskt fält. Coulombs attraktionskrafter verkar mellan jonerna och vattendipolerna. Som ett resultat av jon-dipol-interaktion frigörs energi, vilket bidrar till att jonbindningar bryts i kristallen och att jonen överförs från kristallen till lösningen. Jonerna som separeras från varandra, omedelbart efter att bindningen mellan dem har brutits, är tätt omgivna av polära vattenmolekyler och blir helt hydrerad. Fenomenet med interaktion av joner med vattenmolekyler, vilket resulterar i bildandet av ett hydratiseringsskal, kallas hydrering av joner.
Ris. 1. Dissociation av joniska föreningar
Hydrerade joner som har motsatta laddningar kan interagera med varandra. Men eftersom jonerna rör sig i lösningen tillsammans med hydratiseringsskalen, reduceras kraften i deras interaktion avsevärt, och de kan existera oberoende.
När polära föreningar löses upp, orienteras vattendipoler runt de lösta molekylerna, vilket gör att de blir ännu mer polariserade. Polär kovalent bindning mellan atomer blir jonisk. Det delade elektronparet rör sig till en av atomerna (fig. 2).

Ris. 2. Dissociation av molekyler med polära kovalenta bindningar
Till exempel, i HCl, skiftar ett elektronpar till kloratomen, som förvandlas till en hydratiserad klorjon, och protonen med en vattenmolekyl bildar en komplex positivt laddad partikel H 3 O + - hydroniumjon.
HCl + xH 2 O ↔ H 3 O + + Cl – ∙yH 2 O
Således kan elektrolyter endast vara föreningar med joniska eller polära kovalenta bindningar. Elektrolyter kan bara dissociera i polära lösningsmedel.
Grundläggande principer för teorin om elektrolytisk dissociation
Teorin om elektrolytisk dissociation utvecklades 1887 av den svenske vetenskapsmannen S. Arrhenius. Enligt denna teori finns det ämnen som kan sönderdelas (dissocieras) till joner i lösningar och smältor, vilket gör att lösningar och smältor av dessa ämnen leder elektrisk ström. Dessa ämnen kallades elektrolyter. Elektrolyter i vattenlösningar är syror, baser och salter. När de är upplösta dissocierar elektrolyterna till positivt laddade joner (katjoner) och negativt laddade joner (anjoner). Arrhenius teori tog dock inte hänsyn till den fulla komplexiteten hos fenomen i lösningar. I synnerhet ansåg hon joner som fria partiklar oberoende av lösningsmedelsmolekyler. Det är för närvarande känt att när elektrolyter löses i vatten, samtidigt med processen för deras dissociation till joner, inträffar processen för jonhydratisering.
Förloppet av dissociationsprocessen för lösliga ämnen beror på deras struktur i vattenfritt tillstånd. De mest typiska är två fall: dissociationen av salter och alkalier (dvs. kristaller med en jonstruktur) och dissociationen av syror (dvs. ämnen som består av molekyler med polära kovalenta bindningar).
hydratiserat tillstånd. Följande
bakom det första lagret av joner i lösning
går över till nästa lager och så
Således löses kristallen gradvis upp (fig. 7.1).
Dissociationen av polära molekyler, till exempel HCl, fortskrider annorlunda (Fig. 7.2). Precis som en vattenmolekyl är en vätekloridmolekyl en dipol. Under inverkan av elektrostatiska krafter attraheras vattenmolekyler till polerna hos den polära HCl-molekylen (dipol-dipol-interaktion), och polariserar den därigenom ännu mer, d.v.s. öka polariteten för bindningen mellan väteatomen och kloratomen tills bildandet av H + och Cl – joner. Denna polarisering, i kombination med den vibrationella termiska rörelsen hos atomerna i den aktuella molekylen och den kontinuerliga termiska rörelsen hos omgivande vattenmolekyler, gör att den polära molekylen sönderfaller till joner. Liksom med upplösningen av en jonisk kristall blir dessa joner hydratiserade. I det här fallet visar sig vätejonen H + vara fast bunden till vattenmolekylen till hydroniumjonen H 3 O + .
Processen för elektrolytisk dissociation avbildas med hjälp av kemiska ekvationer; i detta fall är jonernas hydratiserade tillstånd som regel inte indikerat: HCl ® H + + Cl – ; BaCl 2 ® Ba 2+ + 2 Cl – .
Dissociationen av ämnen med både jonisk och molekylär struktur underlättas av polariteten hos lösningsmedelsmolekyler. Därför inte bara vatten utan även andra vätskor som består av polära molekyler ( myrsyra, etylalkohol, ammoniak) är joniserande lösningsmedel: salter, syror och baser lösta i dessa vätskor dissocierar till joner. I både vattenhaltiga och icke-vattenhaltiga lösningar är joner i ett solvatiserat tillstånd.
1. Elektrolyter, när de löses i vatten, bryts upp (dissocieras) till joner - positiva och negativa.
2. Under påverkan elektrisk ström joner får riktningsrörelse: positivt laddade partiklar rör sig mot katoden, negativt laddade partiklar rör sig mot anoden. Därför kallas positivt laddade partiklar katjoner och negativt laddade partiklar kallas anjoner.
3. Riktad rörelse uppstår som ett resultat av attraktion av deras motsatt laddade elektroder (katoden är negativt laddad och anoden är positivt laddad).
4. Jonisering är en reversibel process: parallellt med sönderdelningen av molekyler till joner (dissociation) sker processen att kombinera joner till molekyler (association).
Baserat på teorin om elektrolytisk dissociation kan följande definitioner ges för huvudklasserna av föreningar:
Syror är elektrolyter vars dissociation endast producerar vätejoner som katjoner. Till exempel,
HCl → H+ + Cl-;
CH3COOH H+ + CH3COO-.
Basiciteten av en syra bestäms av antalet vätekatjoner som bildas under dissociation. Således är HCl, HNO3 enbasiska syror, H2SO4, H2CO3 är tvåbasiska, H3PO4, H3AsO4 är tribasiska.
Baser är elektrolyter vars dissociation endast producerar hydroxidjoner som anjoner. Till exempel,
KOH → K+ + OH-,
NH4OH NH4+ + OH-.
Baser lösliga i vatten kallas alkalier.
Surheten hos en bas bestäms av antalet hydroxylgrupper. Till exempel är KOH, NaOH ensyra baser, Ca(OH)2 är tvåsyra, Sn(OH)4 är fyrsyra, etc.
Salter är elektrolyter vars dissociation ger metallkatjoner (liksom NH4+-jonen) och anjoner av sura rester. Till exempel,
CaCl2→ Ca2+ + 2Cl-,
NaF → Na+ + F-.
Elektrolyter, under dissociationen av vilka, beroende på förhållandena, samtidigt kan bilda både vätekatjoner och anjoner - hydroxidjoner kallas amfotära. Till exempel,
Zn(OH)2Zn2+ + 2OH-,
Zn(OH)2 2H+ + ZnO22- eller
Zn(OH)2 + 2H2O2- + 2H+.
Dissociation av syror, baser och salter i vattenlösningar
Med hjälp av teorin om elektrolytisk dissociation definierar och beskriver de egenskaperna hos syror, baser och salter.
Dissociation av syror
Syror kallas elektrolyter, vid dissociation av vilka endast vätekatjoner (H+) bildas som katjoner.
Till exempel,
HCl -> H + + Cl -
HNO3 -> H + + NO3 -
Flerbasiska syror dissocierar stegvis :
H 3 PO 4 ↔ H + + H 2 PO - 4 (första steget) – diväteortofosfatjon
H 2 PO - 4 ↔ H + + HPO 2- 4 (andra steget) – väteortofosfatjon
NPO 2- 4 ↔ N + + PO Z- 4 (tredje steget) – ortofosfatjon
Dissociationen av en flerbasisk syra sker huvudsakligen genom det första steget, i mindre utsträckning genom det andra, och endast i liten utsträckning genom det tredje.
Basdissociation
Skäl kallas elektrolyter, vid dissociation av vilka endast hydroxidjoner (OH -) bildas som anjoner .
| Dissociation av alkalier | Dissociation av amfotera baser (amfolyter) |
| Kom ihåg! alkalier– Det är baser som är lösliga i vatten. Dessa är alkaliska baser och alkaliska jordartsmetaller : LiOH, NaOH, KOH, Rb OH, C s OH, Fr OH och Ca(OH) 2, Sr(OH) 2, Ba(OH) 2, Ra(OH) 2, såväl som NH 4 OH | Amfolyter är elektrolyter som vid dissociation samtidigt bildar vätekatjoner (H +) och hydroxidjoner (OH -). |
| Exempel på alkalidissociationsekvationer KOH -> K + + OH - ; NH 4 OH ↔ NH + 4 + OH - Polysyrabaser dissocierar stegvis: Ba(OH) 2 -> Ba(OH) + + OH - (första steget) Ba(OH) + ↔ Ba 2+ +OH - (andra steget) | Exempel på dissociationsekvationer för amfolyter H 2 O ↔ H + + OH - Dissociationen av amfoter zinkhydroxid Zn(OH) 2 kan uttryckas med ekvationen: 2OH - + Zn 2+ + 2H 2 O ↔ Zn (OH) 2 + 2H 2 O ↔ 2- + 2H + |
Dissociation av salter
Salter kallas elektrolyter, vid dissociation av vilka metallkatjoner bildas, samt ammoniumkatjon (NH + 4) och anjoner av syrarester.
Till exempel dissociation av mediumsalter:
(NH4)2SO4-> 2NH + 4 + SO2-4;
Na 3 PO 4 -> 3 Na + + PO 3- 4
Sura och basiska salter dissocierar stegvis:
Till exempel,
BILJETT nr 22
Grad av dissociation. Starka och svaga elektrolyter. Joniska ekvationer reaktioner.
Dissociationsgraden är en kvantitet som kännetecknar jämviktstillståndet i dissociationsreaktionen i homogena (homogena) system.
Lektionens mål:
Pedagogisk -
- formulera huvudbestämmelserna i teorin om elektrolytisk dissociation;
- sammanfatta information om joner;
- konsolidera förmågan att skriva ner dissociationsprocessen med hjälp av kemiska symboler och formler.
Pedagogisk - odla en vilja att lära sig aktivt, med intresse, ingjuta medveten disciplin, tydlighet och organisation i arbetet.
Utvecklandet - att utveckla elevernas förmåga att utifrån teoretisk kunskap jämföra, analysera, generalisera, resonera logiskt, dra slutsatser och utveckla muntligt tal.
Lär ut metoder: förklaring, samtal, jämförelse, formulering och lösning av utbildningsproblem, kemiskt experiment (video), självständigt individuellt arbete.
Utbildningsmedel: multimediaprojektor, dator, tabell över löslighet av syror, baser och salter i vatten, träningsövningar, utbildningslitteratur: ”Kemi. 8:e klass”, författare – O.S. Gabrielyan - M.: Bustard, 2008.
Under lektionerna
jag. Att organisera tid.
II. Inledande samtal: presentation av ämnet, förklaring av lektionens mål och mål.
(2 minuter) /bild 1, 2/
Ämnet för lektionen idag är "Grundläggande principer för teorin om elektrolytisk dissociation." Detta ämne är en fortsättning på föregående lektion. Därför är målet med vår lektion idag att sammanfatta information om joner, konsolidera förmågan att skriva ner dissociationsprocessen med hjälp av kemiska symboler och formler, och formulera de grundläggande principerna för teorin om elektrolytisk dissociation
III. Uppdatering av det material som omfattas: kontrollera läxor.
Låt oss kolla läxa. Du har arbetsblad på dina skrivbord. Skriv ditt för- och efternamn i det övre högra hörnet. Låt oss börja uppgiften. Att slutföra uppgiften – 5 minuter.
Övning 1/bild 3/
Testa dina kunskaper. Fyll i definitionerna.
- Ämnen vars lösningar leder elektrisk ström kallas... (elektrolyter)
- Processen för elektrolytnedbrytning till joner kallas ... (elektrolytisk dissociation)
- Ämnen vars lösningar inte leder elektrisk ström kallas ... (icke-elektrolyter)
- Förhållandet mellan antalet partiklar som sönderfaller till joner till Totala numret lösta partiklar kallas ... (grad av elektrolytisk dissociation)
Uppgift 2 /bild 4/
Testa dina kunskaper. Fyll i diagrammet.
Uppgift 3 /bild 5/
Testa dina kunskaper. Fyll bordet.
Uppgift 4/bild 6/
Du har 3 minuter på dig att svara.
Använd diagrammet på skärmen och berätta om sekvensen av processer som inträffar under dissociation
A)ämnen med jonbindningar
- orientering av molekyler - vattendipoler nära kristalljoner;
- hydratisering (interaktion) av vattenmolekyler med motsatt laddade joner av kristallens ytskikt;
- dissociation (sönderfall) av en elektrolytkristall till hydratiserade joner.
B)ämnen med polära kovalenta bindningar
- orientering av vattenmolekyler runt polerna hos en elektrolytmolekyl;
- hydrering (interaktion) av vattenmolekyler med elektrolytmolekyler;
- jonisering av elektrolytmolekyler (omvandling av kovalent polär anslutning till jonisk);
- dissociation (sönderfall) av elektrolytmolekyler till hydratiserade joner.
IV. Att lära sig nytt material.
Historien om upptäckten av teorin om elektrolytisk dissociation. /bild 7/
Den svenska forskaren Svante Arrhenius, som studerade den elektriska ledningsförmågan hos lösningar av olika ämnen, kom till slutsatsen att orsaken till elektrisk ledningsförmåga är närvaron i lösningen av joner som bildas när elektrolyten löses i vatten. Denna process kallas elektrolytisk dissociation. År 1887 formulerade Arrhenius de grundläggande principerna för teorin om elektrolytisk dissociation. Låt oss överväga huvudbestämmelserna i teorin om elektrolytisk dissociation (i dess förkortade version, TED). /bild 8/
Grundläggande bestämmelser i teorin om TED
1. När elektrolyterna löses upp i vatten dissocierar (bryts upp) till positiva och negativa joner.
Till exempel: NaCl = Na + + Cl -
Joner är en av existensformerna kemiskt element. Joner skiljer sig från atomer i antalet elektroner, d.v.s. elektrisk laddning. Atomer är neutrala partiklar, joner har en laddning (positiv eller negativ). Dessa två omständigheter avgör skillnaden i deras egenskaper.
/bild 9/
Följaktligen är joner positivt eller negativt laddade partiklar till vilka atomer eller grupper av atomer omvandlas till följd av förlust eller tillsats av elektroner. Denna transformationsprocess kan representeras i form av ett diagram.
Låt oss undersöka skillnaden i egenskaperna hos atomer och joner med hjälp av exemplet på ett välkänt ämne - bordsalt. 1 elektron är mycket för att ändra egenskaper, så egenskaperna hos joner är helt olika egenskaperna hos atomerna som bildade dem. Metalliskt natrium är ett mycket reaktivt ämne, som till och med lagras under ett lager av fotogen, annars kommer natriumet att börja interagera med komponenterna miljö. Natrium reagerar kraftigt med vatten och bildar alkali och väte, medan positiva natriumjoner inte bildar sådana produkter. Klor har en gulgrön färg och en stickande lukt och är giftig, medan klorjoner är färglösa, giftfria och luktfria. Ingen skulle kunna tänka sig att använda metalliskt natrium och klorgas i mat, medan utan natriumklorid, bestående av natrium- och klorjoner, är matlagning omöjlig. Dessa två partiklar skiljer sig endast i en elektron.
Ordet "jon" översatt från grekiska betyder "vandrare". I lösningar rör sig joner slumpmässigt ("färdas") i olika riktningar. Enligt deras sammansättning delas joner in i enkla - Cl -, Na + komplex - NH 4 +, SO 4 -.

Grundläggande bestämmelser i teorin om TED
2. Orsaken till dissociationen av en elektrolyt i en vattenlösning är dess hydratisering, dvs. interaktion av elektrolyt med vattenmolekyler och bristning kemisk bindning i honom.
Som ett resultat av interaktionen av elektrolyten med vattenmolekyler bildas hydratiserade, dvs. joner associerade med vattenmolekyler.
Följaktligen, beroende på närvaron av ett vattenhaltigt skal, delas joner in i hydratiserade (i lösningar och kristallina hydrater) och icke-hydratiserade (i vattenfria salter). Till exempel: kristallhydrater - Glubers salt, kopparsulfat; vattenfria salter - kopparsulfat, natriumnitrat. Egenskaperna för hydratiserade och icke-hydratiserade joner är olika, som du kan se från exemplet med kopparjoner.
IONS (baserat på närvaron av ett vattenskal)
- hydrerad
i lösningar och kristallina hydrater: CuSO 4 * 5H 2 O, Na 2 SO 4 * 10 H 2 O - ohydratiserad
i vattenfria salter: Cu 2+ SO 4 2-, Na + NO 3 -
Grundläggande bestämmelser i TED
3. Under påverkan av elektrisk ström rör sig positivt laddade joner till strömkällans negativa pol - katoden, därför kallas de katjoner, och negativt laddade joner rör sig till strömkällans positiva pol - anoden, därför kallas anjoner.
Följaktligen finns det en annan klassificering av joner - enligt tecknet på deras laddning.
JONER
*katjoner (positivt laddade partiklar)
*anjoner (negativt laddade partiklar)
I elektrolytlösningar är summan av laddningarna av katjonerna lika med summan av anjonernas laddningar, vilket resulterar i att dessa lösningar är elektriskt neutrala.
Grundläggande bestämmelser i TED
Elektrolytisk dissociation är en reversibel process för svaga elektrolyter. Tillsammans med dissociationsprocessen (nedbrytning av elektrolyten till joner) sker också den omvända processen - association (kombination av joner). Därför, i ekvationerna för elektrolytisk dissociation, istället för likhetstecknet, används reversibilitetstecknet, till exempel:
HNO 2 ↔ H + + NO 2-
/bild 17/
Grundläggande bestämmelser i TED
5. Alla elektrolyter dissocierar inte till joner i samma utsträckning.
Graden av dissociation beror på elektrolytens natur och dess koncentration.
Baserat på graden av dissociation delas elektrolyter in i svaga och starka.
Grundläggande bestämmelser i TED
6. Kemiska egenskaper elektrolytlösningar bestäms av egenskaperna hos de joner de bildar under dissociation.
Baserat på arten av jonerna som bildas under dissociationen av elektrolyter, särskiljs tre typer av elektrolyter: syror, baser och salter.

Låt oss nu försöka slutföra uppgiften med hjälp av den mottagna informationen. När du slutför uppgiften, var uppmärksam på om ämnet är en elektrolyt.
- HNO3
- H2SiO3
Baserat på de sammanställda diagrammen, försök att definiera syror från TED:s synvinkel.
LÄGG TILL DEFINITION
Syror är elektrolyter som dissocierar till katjoner... och anjoner...
SYROR- Dessa är elektrolyter som vid dissociation bildar vätekatjoner och anjoner av en sur rest.
Till exempel:
HCl = H + + Cl -
HNO3 = H+ + NO3 -
För flerbasiska syror sker stegvis dissociation. Till exempel för fosforsyra H3PO4:
1: a steget – bildandet av divätefosfatjoner:
H 3 PO 4 ↔ H + + H 2 PO 4 -
2:a steget - bildning av vätefosfatjoner:
H 2 PO 4 - ↔ H + + HPO 4 2-
Det bör beaktas att dissociationen av elektrolyter i det andra steget är mycket svagare än i det första. Dissociation i det tredje steget sker nästan inte under normala förhållanden.
Alla syror har det gemensamt att de vid dissociation nödvändigtvis bildar vätekatjoner. Därför är det logiskt att anta att de allmänna karakteristiska egenskaperna hos syror - sur smak, förändringar i färgen på indikatorer etc. - orsakas just av vätekatjoner.
Låt oss slutföra följande uppgift baserat på huvudbestämmelserna i TED.
Skriv ner möjliga ekvationer för elektrolytisk dissociation av ämnen i vattenlösningar.
- Fe(OH)2
Namnge klassen av dessa ämnen.
Baserat på de sammanställda diagrammen, försök att definiera grunderna från TED:s synvinkel.
LÄGG TILL DEFINITION
Baser är elektrolyter som dissocierar till katjoner... och anjoner...
BASER- Dessa är elektrolyter som vid dissociation bildar metallkatjoner och hydroxidanjoner.
Till exempel:
NaOH = Na + + OH -
KOH = K + + OH -
Polysyrabaser dissocierar stegvis, främst i det första steget. Till exempel bariumhydroxid Ba (OH)2:
1:a steget – bildning av hydroxojoner:
Ba (OH) 2 ↔ OH - + BaOH +
2:a steget - bildning av bariumjoner:
BaOH+ ↔ Ba 2+ + OH -
Alla vanliga egenskaper hos baser - tvålighet vid beröring, förändring i färg på indikatorer etc. - beror på hydroxidjonerna OH - gemensamma för alla baser.
Låt oss slutföra följande uppgift.
Skriv ner möjliga ekvationer för elektrolytisk dissociation av ämnen i vattenlösningar.
- VET 3
- BaSO4
Namnge klassen av dessa ämnen.
Baserat på de sammanställda diagrammen, försök att definiera salter från TED:s synvinkel.
LÄGG TILL DEFINITION
Salter är elektrolyter som dissocierar till katjoner... och anjoner...
SALT- dessa är elektrolyter som vid dissociation bildar metallkatjoner (eller ammonium NH 4) och anjoner av sura rester.
Till exempel:
K 3 PO 4 = 3K + + PO 4 3-
NH4Cl = NH4+ + Cl -
Det är uppenbart att egenskaperna hos salter bestäms av både metallkatjoner och anjoner av syraresten. Således har ammoniumsalter både allmänna egenskaper på grund av NH4+-joner och specifika egenskaper på grund av olika anjoner. På liknande sätt bestäms de allmänna egenskaperna hos sulfater - salter av svavelsyra - av SO 4 2-joner och olika - av olika katjoner. Till skillnad från flerbasiska syror och baser som innehåller flera hydroxidjoner, dissocierar salter som K 2 SO 4, Al 2 (SO 4) 3, etc. helt på en gång, och inte stegvis.
Låt oss nu göra en svårare uppgift, baserat på allt material vi lärde oss i klassen.
TESTA DINA KUNSKAPER
Använd löslighetstabellen och ge exempel på tre ämnen som bildar sulfatjoner i lösningar. Skriv ner ekvationerna för den elektrolytiska dissociationen av dessa ämnen.
Till exempel:
H 2 SO 4 ↔ H + + SO 4 -
HSO 4 ↔ H + + SO 4 2-
I slutet av lektionen uppmärksammar jag en videoinspelning av ett experiment som visar nedbrytningen av en kopparkloridlösning till joner under påverkan av en elektrisk ström.
Vi öppnar våra dagböcker och skriver ner våra läxor.
- §36, skriv ner bestämmelserna i TED i en anteckningsbok, lär dig utantill;
- Lär dig definitionerna av syror, baser och salter utantill;
- Uppgift nr 5, sid 203 (skriftlig).
>> Kemi: Grundläggande bestämmelser i teorin om elektrolytisk dissociation Låt oss sammanfatta informationen om elektrolytisk dissociation i form av de grundläggande bestämmelserna i den nu allmänt accepterade teorin. De är följande.
Som ett resultat av denna interaktion bildas hydratiserade joner, det vill säga associerade med vattenmolekyler.
Följaktligen, beroende på närvaron av ett vattenhaltigt skal, delas joner in i hydratiserade (i lösningar och kristallina hydrater) och icke-hydratiserade (i vattenfria salter).
Egenskaperna för hydratiserade och icke-hydratiserade joner skiljer sig åt, vilket du redan kan se från exemplet med kopparjoner.
När det är löst i vatten, elektrolyter ta avstånd(bryts ner) i positiva och negativa joner.
Jonernas egenskaper skiljer sig helt från egenskaperna hos de atomer som bildade dem. Joner – Det här är en av existensformerna för ett kemiskt element. Till exempel interagerar natriummetallatomer kraftigt med vatten och bildar alkali och väte H, medan natriumjoner inte bildar sådana produkter. Klor har en gulgrön färg och en skarp lukt, det är giftigt och klorjoner är färglösa, giftfria och luktfria. Ingen skulle kunna tänka sig att använda metalliskt natrium och klorgas i mat, medan utan natriumklorid, bestående av natrium- och klorjoner, är matlagning omöjlig.
Lektionens innehåll lektionsanteckningar stödja frame lektion presentation acceleration metoder interaktiv teknik Öva uppgifter och övningar självtest workshops, utbildningar, fall, uppdrag läxor diskussionsfrågor retoriska frågor från elever Illustrationer ljud, videoklipp och multimedia fotografier, bilder, grafik, tabeller, diagram, humor, anekdoter, skämt, serier, liknelser, ordspråk, korsord, citat Tillägg sammandrag artiklar knep för nyfikna spjälsängar läroböcker grundläggande och ytterligare ordbok över termer andra Förbättra läroböcker och lektionerrätta fel i läroboken uppdatera ett fragment i en lärobok, inslag av innovation i lektionen, ersätta föråldrad kunskap med nya Endast för lärare perfekta lektioner kalenderplan för året riktlinjer diskussionsprogram Integrerade lektioner- I kontakt med 0
- Google+ 0
- OK 0
- Facebook 0