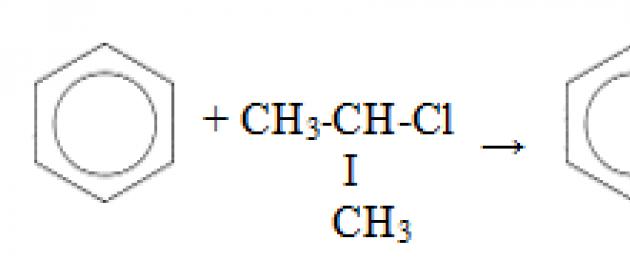ОПРЕДЕЛЕНИЕ
Бензол (циклогексатриен – 1,3,5) – органическое вещество, простейший представитель ряда ароматических углеводородов.
Формула – С 6 Н 6 (структурная формула – рис. 1). Молекулярная масса – 78, 11.
Рис. 1. Структурные и пространственная формулы бензола.
Все шесть атомов углерода в молекуле бензола находятся в sp 2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла. Углеводородный радикал, полученный от бензола носит название C 6 H 5 – — фенил (Ph-).
Химические свойства бензола
Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl 3 , FeCl 3 , AlBr 3)
C 6 H 6 + Cl 2 = C 6 H 5 -Cl + HCl;
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)

— алкилирование алкенами
C 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH(CH 3) 2 ;
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор – Pt)

— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C 6 H 6 Cl 6)

Как и любое органическое соединение бензол вступает в реакцию горения с образованием в качестве продуктов реакции углекислого газа и воды (горит коптящим пламенем):
2C 6 H 6 +15O 2 → 12CO 2 + 6H 2 O.
Физические свойства бензола
Бензол – жидкость без цвета, но обладающая специфическим резким запахом. Образует с водой азеотропную смесь, хорошо смешивается с эфирами, бензином и различными органическими растворителями. Температура кипения – 80,1С, плавления – 5,5С. Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний).
Получение и применение бензола
Основные способы получения бензола:
— дегидроциклизация гексана (катализаторы – Pt, Cr 3 O 2)
CH 3 –(CH 2) 4 -CH 3 → С 6 Н 6 + 4H 2 ;
— дегидрирование циклогексана (реакция протекает при нагревании, катализатор – Pt)
С 6 Н 12 → С 6 Н 6 + 4H 2 ;
— тримеризация ацетилена (реакция протекает при нагревании до 600С, катализатор – активированный уголь)
3HC≡CH → C 6 H 6 .
Бензол служит сырьем для производства гомологов (этилбензола, кумола), циклогексана, нитробензола, хлорбензола и др. веществ. Ранее бензол использовали в качестве присадки к бензину для повышения его октанового числа, однако, сейчас, в связи с его высокой токсичностью содержание бензола в топливе строго нормируется. Иногда бензол используют в качестве растворителя.
Примеры решения задач
ПРИМЕР 1
| Задание | Запишите уравнения, с помощью которых можно осуществить следующие превращения: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Решение |
Для получения ацетилена из метана используют следующую реакцию:
2CH 4 → C 2 H 2 + 3Н 2 (t = 1400C). Получение бензола из ацетилена возможно по реакции тримеризации ацетилена, протекающей при нагревании (t = 600C) и в присутствии активированного угля: 3C 2 H 2 → C 6 H 6 . Реакция хлорирования бензола с получением в качестве продукта хлорбензола осуществляется в присутствии хлорида железа (III): C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
ПРИМЕР 2
| Задание | К 39 г бензола в присутствии хлорида железа (III) добавили 1 моль бромной воды. Какое количество вещества и сколько граммов каких продуктов при этом получилось? |
| Решение |
Запишем уравнение реакции бромирования бензола в присутствии хлорида железа (III):
C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Продуктами реакции являются бромбензол и бромоводород. Молярная масса бензола, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 78 г/моль. Найдем количество вещества бензола: n(C 6 H 6) = m(C 6 H 6) / M(C 6 H 6); n(C 6 H 6) = 39 / 78 = 0,5 моль. По условию задачи бензол вступил в реакцию с 1 моль брома. Следовательно, бензол находится в недостатке и дальнейшие расчеты будем производить по бензолу. Согласно уравнению реакции n(C 6 H 6): n(C 6 H 5 Br) : n(HBr) = 1:1:1, следовательно n(C 6 H 6) = n(C 6 H 5 Br) = : n(HBr) = 0,5 моль. Тогда, массы бромбензола и бромоводорода будут равны: m(C 6 H 5 Br) = n(C 6 H 5 Br)×M(C 6 H 5 Br); m(HBr) = n(HBr)×M(HBr). Молярные массы бромбензола и бромоводорода, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 157 и 81 г/моль, соответственно. m(C 6 H 5 Br) = 0,5×157 = 78,5 г; m(HBr) = 0,5×81 = 40,5 г. |
| Ответ | Продуктами реакции являются бромбензол и бромоводород. Массы бромбензола и бромоводорода – 78,5 и 40,5 г, соответственно. |
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C 6 H 6 . Общая формула их гомологического ряда - C n H 2n-6 .
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям, двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол - 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.

Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания;)

Получение аренов
Арены получают несколькими способами:

Химические свойства аренов
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:

Арены ряда бензола (моноциклические арены)
Общая формула: C n H 2n-6 , n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С 6 Н 6 .
Электронное строение молекулы бензола
Общая формула моноциклических аренов C n H 2 n -6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) - циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для ;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО 4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С-С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С 6 Н 6 использует представление о гибридизации орбиталей атома .
Атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром .
В соответствии с современными представлениями об электронном строении бензола молекулу С 6 Н 6 изображают следующим образом:

Физические свойства бензола
Бензол при обычных условиях - бесцветная жидкость; t o пл = 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I . Реакции замещения
1.Галогенирование

2. Нитрование
Реакцию осуществляют смесью и кислот (нитрующая смесь):
3.Сульфирование

4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса , образуются гомологи бензола:

Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl 3 или неорганической кислоты):

II . Реакции присоединения
1.Гидрирование

2.Присоединение хлора

III. Реакции окисления
1. Горение
2С 6 Н 6 + 15О 2 → 12СО 2 + 6Н 2 О
2. Неполное окисление (KMnO 4 или K 2 Cr 2 O 7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
В промышленности:
1) переработка нефти и угля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизация) гексана:

В лаборатории:
Сплавление солей бензойной кислоты со :

Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.



Физические свойства толуола
Толуол - бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I . Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента - трипроизводные общей формулы:

а) галогенирование


При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:

II . Реакции присоединения
Гидрирование

III. Реакции окисления
1.Горение
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO 2 окисляют его до альдегидной группы, более сильные окислители (KMnO 4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО 2 ; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:

Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:

3) дегидроциклизация гептана:
В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана).
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
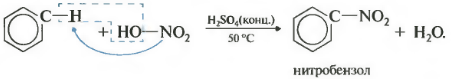
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.

Третье свойство алкилирование бензола галогеналканами.

Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
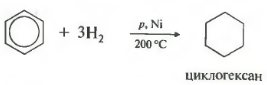
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
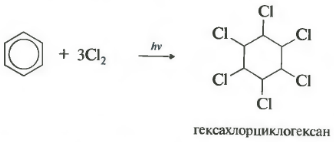
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
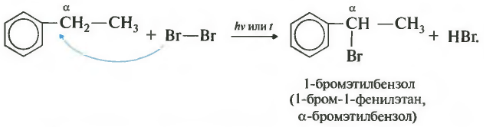
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
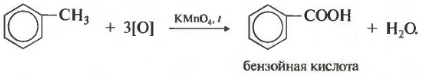
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
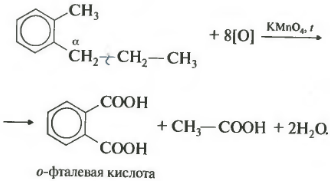
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.

Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
ПРЦВШ (Ф) ФГБОУ ВПО
Кафедра «Пожарная безопасность»
Контрольная работа
по дисциплине «Теория горения и взрывов»
Задание № 1
Определить удельные теоретические количества и объем воздуха, необходимого для полного сгорания паров бензола. Условия, в которых находится воздух, характеризуются температурой Тв и давлением Рв, а пары бензола -- температурой Тг и давлением Рг. Результаты расчетов выразить в следующих единицах: ; ;;;
Исходные данные (N -- номер группы, n -- номер по списку студентов:
Тв=300+(-1) N *2*N-(-1) n *0.2*n= 277,6 K
Рв=?10 3 =95900 Па;
Тг=300?(?1) N ?2?N?(?1) n ?0,2?n= 321,6 К;
Рr=?10 3 =79400 Па.
С6Н6+7,5О2+7,5?3,76N2=6CO2+3pO+7,5?3,76N2+Qp (1),
где Qр - теплота химической реакции. Из данного уравнения можно определить стехиометрические коэффициенты бензола и молекулярного кислорода: Vг =1, V0 = 7,5
2. Удельное теоретическое количество воздуха -- число киломолей воздуха, которые необходимы для полного сгорания одного киломоля бензола, рассчитывается по формуле:
где 4,76 - количество воздуха, в котором содержится единица количества кислорода, = - отношение стехиометрических коэффициентов молекулярного кислорода (Vо) и бензола (Vг)
Подставляя в (г) значения Vо и Vг,получаем:
3. Объем воздуха, необходимого для полного сгорания одного киломоля бензола, определяется так:
где - объем одного киломоля воздуха при температуре Тв и давлением Рв. Значение рассчитывается по формуле
где 22,4 - мольный объем газа при нормальных условиях, Ро = 101325 Па -- нормальное давление, То = 273 К -- нормальная температура.
Подставляя Тв, То, Рв, Ро в (5), получаем
Удельный теоретический объем воздуха рассчитывается по формуле (4):
4. Объем воздуха, необходимого полного сгорания единицы объема газообразного горючего, определяется так:
где - объем одного киломоля горючего -- паров бензола при температуре Тг и давления Рг. Учитывая, что
и подставляя (8) и (5) в (7), получаем следующее выражение для удельного теоретического объема воздуха:
Вычисляем значение данного параметра процесса горения:
Объем воздуха, необходимого для полного сгорания одного килограмма бензола, определяется так:
где - мольная масса горючего -- масса одного киломоля бензола, выраженная в килограммах. Мольная масса бензола численно равна его молекулярному весу находится по формуле:
Ас?nc+Aн?nн, УiAi?ni (11)
где Ас и Ан - атомные веса углерода и водорода, nc и nн - числа атомов углерода в молекуле бензола. Подставляя значения Ас = 12, nc = 6, Ан = 1, nн = 6, получаем:
Удельный теоретический объем воздуха находим, подставляя значения n в и в формулу (10):
Результат расчетов:
Задание № 2
Определить удельные теоретические количество, объем и состав продуктов горения бензола, если известны коэффициент избытка воздуха в, температура Тп и давление Рп продуктов сгорания, температура Тг и давление Рг паров бензола. Результаты расчетов выразить в мольных долях (в процентах) и в следующих единицах: ; ;;
Исходные данные:
в=1,5+(?1) N ?0,1?N?(?1) n ?0,01?n = 0,2 ;
Рп=?10 3 = 68400 Па;
Тп=1600?(?1) N ?20?N?(?1) n ?2?n = 1816 К;
Тг=273?(?1) N ?2?N+(?1) n ?0,2?n = 295,4 К;
Рг=?10 3 = 111600 Па;
решение (N=11, n=2).
1. Запишем стехиометрическое уравнение реакции горения бензола в воздухе:
С 6 Н 6 +7,5О 2 +7,5?3,76N 2 =6CO 2 +3H 2 O+7,5?3,76N 2 +Qp , (1)
где Qp - теплота химической реакции. Из данного уравнения определяем следующие стехиометрические коэффициенты:
V CO2 =6 , V pO =3 , V C6H6 =1 , V O2 =7,5 , V N2 =7,5?3,76
2. Определяем расчетное количество продуктов сгорания одного киломоля горючего:
Подставляя в (2) значения стехиометрических коэффициентов продуктов сгорания и горючего, получаем:
3. Удельное теоретическое количество воздуха -- число киломолей воздуха, необходимого для полного сгорания одного киломоля горючего, определим с помощью формулы:
Где 4,76 - количество воздуха, в котором содержится единица количества кислорода,
Отношение стехиометрических коэффициентов молекулярного кислорода и бензола.
Подставляя в (4) значения V O2 =7,5 и V C6H6 =1 , получаем:
4. Избыточное количество воздуха, которое приходится на 1 Кмоль горючего, определяется выражением:
бензол пар сгорание воздух
Подставляя в данное выражение значения
37,7(0,2-1)=30,16(7)
5. Общее количество продуктов сгорания единицы количества вещества горючего определяется суммой:
После подстановки значений и получаем:
6. Мольные доли продуктов сгорания, выраженные в процентах, определяются так:
В формулах (9) для мольных долей азота и кислорода в продуктах сгорания 0,79 и 0,21 -- мольные доли данных веществ в воздухе, избыток которого приводит к увеличению доли азота и появлению кислорода в продуктах сгорания.
7. Для определения удельных объемов и продуктов сгорания необходимо рассчитать их мольный объем -- объем одного киломоля газа при условиях, в которых находятся продукты:
где 22,4 - объем одного киломоля газа при нормальных условиях, Т 0 =273К - нормальная температура, Ро=101325Па - нормальное давление.
Подставляя в (10) значения,Ро,То, получаем:
Объем продуктов, которые образуются при сгорании одного килограмма горючего, без учета избытка воздуха, рассчитывается так:
где - мольная масса горючего -- масса одного киломоля бензола, выраженная в килограммах. Мольная масса бензола находится по формуле:
где Ас и Ан - атомные веса углерода (12) и водорода (1), n c и n н - числа атомов углерода (6) и водорода (6) в малекулах бензола (С 6 Н 6).
Подставляя значения, и в (12) получаем
Избыточный объем воздуха, приходящийся на 1 килограмм горючего, определяется так:
где - объем одного киломоля избыточного воздуха, который находится в составе продуктов сгорания. Так как температура и давление избыточного воздуха соответствуют температуре и давлению продуктов сгорания, то = =220,7 .
Подставляя данное значение, а такжев в (14), получим:
Для расчета удельного объема продуктов полного сгорания горючего будем считать, что пары бензола имеют температуру Тг при давлении:
где - объем одного киломоля паров бензола при температуре Тг и давлении Рг. Мольный объем горючего рассчитывается по формуле:
Подставляя полученное значение, а такие значения и в (17), получаем:
Избыточный объем воздуха, приходящийся на один кубический метр паров бензола, определяется так:
Подстановка в (20) значений =30,16 , =и
дает следующий результат:
Общий удельный объем продуктов сгорания с учетом избытка воздуха определяется суммой
Результат расчетов:
Х СО2 = % ; Х Н2О =4,4 % ; Х N2 =%; Х О2 =11,7%
Подобные документы
Расчет коэффициента горючести нитробензола С6Н5NО2 и сероуглерода CS2. Уравнение реакции горения пропилацетата в воздухе. Расчет объема воздуха и продуктов горения при сгорании горючего газа. Определение температуры вспышки толуола по формуле В. Блинова.
контрольная работа , добавлен 08.04.2017
Расчет объема воздуха и продуктов горения, образующихся при сгорании вещества. Уравнение реакции горения этиленгликоля в воздухе. Горение смеси горючих газов. Расчет адиабатической температуры горения для стехиометрической смеси. Горение пропанола.
контрольная работа , добавлен 17.10.2012
Вид горения и его основные параметры. Химическое превращение горючего и окислителя в продукты горения. Уравнения материального и теплового баланса реакции горения. Влияние коэффициента избытка воздуха на состав продуктов горения и температуру горения.
контрольная работа , добавлен 17.01.2013
Определение объема воздуха, необходимого для полного сгорания единицы массы горючего вещества. Состав продуктов сгорания единицы масс горючего вещества. Пределы распространения пламени газо-, паро-, пылевоздушных смесей. Давление взрывчатого разложения.
курсовая работа , добавлен 23.12.2013
Разработка мер предотвращения возникновения пожаров и взрывов, оценка условий их развития и подавления. Понятие скорости выгорания, способ ее определения. Порядок составления уравнения реакции горения. Расчет объема воздуха, необходимого для возгорания.
курсовая работа , добавлен 10.07.2014
Определение состава продуктов полного сгорания газа. Расчет адиабатной температуры горения газовой смеси при постоянном объеме и при постоянном давлении. Кинетические константы реакции самовоспламенения природного газа. Предел воспламенения газовой смеси.
курсовая работа , добавлен 19.02.2014
Характеристика промышленных способов алкилирования бензола пропиленом. Принципы алкилирования бензола олефинами в химической технологии. Проблемы проектирования технологических установок алкилирования бензола. Описание технологии процесса производства.
дипломная работа , добавлен 15.11.2010
Горение как мощный процесс окисления. Типы горения: тление и горение с пламенем. Взрыв как частный случай горения. Электрические свойства пламени. Многообразие продуктов горения как следствие неполного сгорания топлива. Фильтрация дыма через воду.
научная работа , добавлен 29.07.2009
Определение объема воздуха необходимого для полного сгорания заданного количества пропана. Вычисление изменения энтальпии, энтропии и энергии Гиббса, при помощи следствий из закона Гесса. Определение молярных масс эквивалентов окислителя и восстановителя.
контрольная работа , добавлен 08.02.2012
Способы определения расхода поглотительного масла, концентрации бензола в поглотительном масле, выходящем из абсорбера. Расчет диаметра и высоты насадочного абсорбера. Определение требуемой поверхности нагрева в кубе колонны и расхода греющего пара.