Las enzimas redox que catalizan la transferencia de electrones y la fosforilación oxidativa se localizan en la capa lipídica de la membrana interna de las células mitocondriales.
El transporte de electrones a oxígeno en las mitocondrias (Fig. 13.3) ocurre en varias etapas y es una cadena de transportadores de electrones, en la que, a medida que se acerca al oxígeno, aumenta el potencial redox (el potencial de reducción disminuye en consecuencia). Estos sistemas de transporte se denominan cadenas respiratorias.
Arroz. 13.3.
La mayoría de los pares de electrones entran en la cadena respiratoria por la acción de enzimas (deshidrogenasas) que utilizan las coenzimas NAD+ y NADP+ como aceptores de electrones. Todo este grupo de enzimas se denomina deshidrogenasas dependientes de NAO(P).
Las coenzimas NAD + (nicotinamida adenina dinucleótido), FAD y FMN (flavina adenina dinucleótido y flavina mononucleótido), la coenzima Q (CoQ), la familia de proteínas que contienen hemo - citocromos (denominados citocromos b, Q, C, A, A 3) y las proteínas que contienen hierro no hemo son portadores intermedios en la cadena respiratoria en los organismos superiores. El proceso comienza con la transferencia de protones y electrones del sustrato oxidado a las coenzimas NAD+ o FAD y la formación de NADH y FADH2.
El movimiento subsiguiente de electrones de NADH y FADH 2 a oxígeno puede compararse con rodar por una escalera, cuyos peldaños son portadores de electrones. Con cada paso de un paso a otro, se libera una porción de energía libre (ver Fig. 13.3).
La transferencia de electrones desde sustratos orgánicos al oxígeno molecular involucra tres complejos proteicos (I, III, IV) y dos moléculas portadoras móviles: ubiquinona (coenzima Q) y citocromo C.

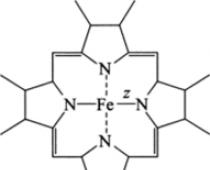
Arroz. 13.4. La estructura de la molécula de hemo, z = 2* o 3+
La succinato deshidrogenasa, que pertenece al propio ciclo de Krebs, también puede considerarse como complejo II de la cadena respiratoria.
Los complejos de la cadena respiratoria se construyen a partir de una variedad de polipéptidos y contienen varias coenzimas redox diferentes asociadas con proteínas.
portadores de electrones citocromos(llamadas así por su coloración) son proteínas que contienen varios grupos a modo de grupo prostético gemas Tipo gemas b corresponden a las hemoglobinas. El hemo está unido covalentemente a una proteína (fig. 13.4).
Común a los citocromos es la capacidad del ion de hierro en el hemo para cambiar el estado de oxidación tras la transferencia de electrones: 
Deshidrogenasas dependientes de flavina- estas son proteínas en las que los grupos sulfhidrilo de la cisteína, que forma parte de la proteína, se asocian con átomos de hierro, lo que da como resultado la formación de complejos (centros) de hierro y azufre. Al igual que en los citocromos, los átomos de hierro en dichos centros pueden donar y aceptar electrones, pasando alternativamente a los estados ferri- (Fe +3) y ferro- (Fe +2).
Los centros de hierro y azufre funcionan junto con las enzimas FAD o FMN que contienen flavina.
Fpavina adenina dinucleótido(FAD) es un derivado de la vitamina B 2 (riboflavina). Al recuperarse, FAD (forma oxidada) agrega dos átomos de hidrógeno y se convierte en FADH 2 (forma reducida):

Otro transportador de electrones que pertenece a este grupo, el mononucleótido de flavina (FMN), también es un derivado de la vitamina B 2 (se diferencia de la vitamina B 2 solo en la presencia de un grupo fosfato).
Ambas coenzimas de flavina también pueden existir en forma de los llamados semiquinonas- radicales libres, que se forman como resultado de la transferencia de un solo electrón a FAD o FMN:

La designación general de varias flavoproteínas que difieren en el componente proteico de la enzima es FPn.
Deshidrogenasas dependientes de piridina recibió este nombre porque la coenzima para ellos es NAD + y NADP +, en cuyas moléculas hay un derivado piridina - nicotinamida:

Las reacciones catalizadas por estas enzimas se pueden representar de la siguiente manera:

Las deshidrogenasas asociadas con NAD+ están involucradas principalmente en el proceso de respiración, es decir, en el proceso de transferencia de electrones desde los sustratos al oxígeno, mientras que las deshidrogenasas asociadas con NADP+ están involucradas principalmente en la transferencia de electrones desde los sustratos resultantes de reacciones catabólicas a reacciones de reducción de la biosíntesis.
El único portador de electrones no proteico es la ubiquinona, llamada así porque esta quinona se encuentra en todas partes (desde ubicuo- omnipresente). Se abrevia como CoQ o simplemente Q. Cuando se reduce, la ubiquinona agrega no solo electrones, sino también protones. Con una transferencia de un electrón, se convierte en semiquinona, dos electrones - en hidroquinona.
La secuencia de transportadores de electrones en la cadena respiratoria de las mitocondrias se puede representar mediante el siguiente esquema:

Este esquema se describe mediante una cadena de reacciones sucesivas: 

De esta forma, a través de la cadena respiratoria, los electrones de los sustratos llegan al aceptor final: el oxígeno atmosférico. El agua resultante se llama agua metabólica.
La separación del hidrógeno en protones y electrones en la membrana mitocondrial es una cadena de transporte de electrones que funciona como una bomba de protones, bombeando iones de hidrógeno desde el espacio intercelular hacia el exterior de la membrana.
ETC se localiza en el CPM, en eucariotas, en la membrana interna de las mitocondrias. Los transportadores se ubican de acuerdo a su potencial redox, el transporte de electrones a lo largo de la cadena procede espontáneamente.
El potencial de protones es convertido por la ATP sintasa en la energía de enlace químico de ATP. El trabajo conjugado de ETC y ATP sintasa se denomina fosforilación oxidativa.
Cadena de transporte de electrones mitocondrial
Influencia del potencial de oxidación
| Agente reductor | oxidante | Eo´, V |
|---|---|---|
| H2 | 2 + | - 0,42 |
| SOBRE H + H+ | SOBRE+ | - 0,32 |
| NADP H + H+ | NADP+ | - 0,32 |
| Flavoproteína (restaurada) | Flavoproteína (oxidada) | - 0,12 |
| Coenzima Q H2 | Coenzima Q | + 0,04 |
| Citocromo B (Fe2+) | Citocromo B (Fe3+) | + 0,07 |
| Citocromo C 1 (Fe2+) | Citocromo C 1 (Fe3+) | + 0,23 |
| Citocromos A (Fe2+) | Citocromos A(Fe3+) | + 0,29 |
| Citocromos A3 (Fe2+) | Citocromos A3 (Fe3+) | +0,55 |
| H2O | ½ O2 | + 0,82 |
Inhibidores de la cadena respiratoria
Algunas sustancias bloquean la transferencia de electrones a través de los complejos I, II, III, IV.
- Inhibidores del complejo I: barbitúricos, rotenona, piericidina
- El inhibidor del complejo II es el malonato.
- Inhibidor del complejo III - antimicina A, mixotiazol, estigmattelina
- Inhibidores del complejo IV: sulfuro de hidrógeno, cianuros, monóxido de carbono, óxido nítrico, azida de sodio
Cadenas de electrotransporte de bacterias.
Las bacterias, a diferencia de las mitocondrias, utilizan un gran conjunto de donantes y aceptores de electrones, así como diferentes formas de transferencia de electrones entre ellos. Estos caminos se pueden realizar simultáneamente, por ejemplo, E. coli cuando se cultiva en un medio que contiene glucosa como principal fuente de materia orgánica, utiliza dos NADH deshidrogenasas y dos quinol oxidasas, lo que significa que hay 4 vías de transporte de electrones. La mayoría de las enzimas ETC son inducibles y se sintetizan solo si la vía en la que entran tiene demanda.
Además de la materia orgánica en las bacterias, los donantes de electrones pueden ser hidrógeno molecular, monóxido de carbono, amonio, nitrito, azufre, sulfuro, hierro ferroso. En lugar de NADH y succinato deshidrogenasa, pueden estar presentes formiato, lactato, gliceraldehído-3-fosfato deshidrogenasa, hidrogenasa, etc.. En lugar de oxidasa, que se usa en condiciones aeróbicas, en ausencia de oxígeno, las bacterias pueden usar reductasas que restauran varios aceptores finales de electrones: fumarato reductasa, nitrato y nitrito reductasa, etc.
ver también
Escriba una reseña sobre el artículo "Cadena de transporte de electrones respiratorios"
notas
Un extracto que caracteriza la cadena de transporte de electrones respiratorio
- Su señoría, al general. Aquí están parados en una cabaña, - dijeron los fuegos artificiales, acercándose a Tushin.- Ahora, paloma.
Tushin se levantó y, abrochándose el abrigo y recuperándose, se alejó del fuego...
No lejos del fuego de los artilleros, en la cabaña preparada para él, el Príncipe Bagration estaba sentado cenando, hablando con algunos de los comandantes de las unidades que se habían reunido en su lugar. Había un anciano con los ojos entrecerrados, mordisqueando con avidez un hueso de cordero, y un general impecable de veintidós años, sonrojado por un vaso de vodka y cena, y un oficial de estado mayor con un anillo personal, y Zherkov, mirando a todos con inquietud, y el príncipe Andrei, pálido, con los labios fruncidos y los ojos febrilmente brillantes.
En la cabaña había un estandarte francés tomado apoyado en la esquina, y el auditor, con cara de ingenuo, palpó la tela del estandarte y sacudió la cabeza con desconcierto, quizás porque estaba realmente interesado en la apariencia del estandarte, o quizás también porque le costaba aparentar hambre en la cena, para la cual no tenía suficiente equipo. En una choza vecina había un coronel francés hecho prisionero por los dragones. Nuestros oficiales se apiñaron a su alrededor, examinándolo. El Príncipe Bagration agradeció a los comandantes individuales y preguntó sobre los detalles del caso y sobre las pérdidas. El comandante del regimiento, que se presentó cerca de Braunau, informó al príncipe que tan pronto como comenzó el caso, se retiró del bosque, reunió a los leñadores y, dejándolos pasar, golpeó con dos batallones con bayonetas y volcó a los franceses.
- Como vi, Vuestra Excelencia, que el primer batallón estaba volcado, me paré en el camino y pensé: “A estos los dejaré pasar y los encontraré con fuego de batalla”; también lo hizo.
El comandante del regimiento tenía tantas ganas de hacer esto, lamentaba tanto no haber tenido tiempo para hacerlo, que le parecía que todo esto definitivamente había sucedido. ¿Tal vez incluso sucedió realmente? ¿Era posible distinguir en esta confusión lo que era y lo que no era?
“Además, debo señalar, Su Excelencia”, continuó, recordando la conversación de Dolokhov con Kutuzov y su último encuentro con el degradado, “que el privado, degradado Dolokhov, capturó a un oficial francés frente a mis ojos y se distinguió especialmente.
"Aquí, Su Excelencia, vi el ataque de los pavlograditas", intervino Zherkov, mirando a su alrededor con inquietud, quien no vio a los húsares en todo ese día, pero solo escuchó sobre ellos por un oficial de infantería. - Aplastaron dos cuadrados, su excelencia.
Algunos sonrieron ante las palabras de Zherkov, ya que siempre esperaban una broma de él; pero, viendo que lo que decía se inclinaba también hacia la gloria de nuestras armas y de la actualidad, adoptaron una expresión seria, aunque muchos sabían muy bien que lo que decía Zherkov era mentira, sin base alguna. El príncipe Bagration se volvió hacia el anciano coronel.
- Gracias a todos señores, todas las unidades actuaron heroicamente: infantería, caballería y artillería. ¿Cómo se dejan dos pistolas en el centro? preguntó, buscando a alguien con sus ojos. (El príncipe Bagration no preguntó por las armas del flanco izquierdo; ya sabía que todas las armas fueron arrojadas allí desde el comienzo del caso). "Creo que te pregunté", se volvió hacia el oficial de estado mayor de turno.
- Uno fue alcanzado, - respondió el oficial de guardia, - y el otro, no lo puedo entender; Yo mismo estuve allí todo el tiempo y tomé órdenes, y recién me había ido... Hacía calor, de verdad', agregó con modestia.
Alguien dijo que el Capitán Tushin estaba parado aquí cerca del pueblo mismo, y que ya lo habían llamado.
"Sí, aquí estabas", dijo el Príncipe Bagration, volviéndose hacia el Príncipe Andrei.
"Bueno, no nos reunimos ni un poco", dijo el oficial de turno en la sede, sonriendo amablemente a Bolkonsky.
"No tuve el placer de verte", dijo el príncipe Andrei con frialdad y sequedad.
Todo el mundo estaba en silencio. Tushin apareció en el umbral, abriéndose paso tímidamente desde detrás de los generales. Pasando por alto a los generales en una choza estrecha, avergonzado, como siempre, al ver a sus superiores, Tushin no vio el asta de la bandera y tropezó con ella. Varias voces se rieron.
¿Cómo quedó el arma? Bagration preguntó, frunciendo el ceño no tanto al capitán como a los que se reían, entre los cuales la voz de Zherkov era la más fuerte.
Tushin ahora solo, a la vista de las formidables autoridades, con todo horror imaginó su culpa y vergüenza por el hecho de que, habiendo permanecido con vida, había perdido dos armas. Estaba tan emocionado que hasta ahora no tenía tiempo para pensar en ello. La risa de los oficiales lo confundió aún más. Se paró frente a Bagration con la mandíbula inferior temblorosa y apenas dijo:
"No sé... Su Excelencia... No había gente, Su Excelencia".
- ¡Podrías sacarlo de la cubierta!
Que no había tapadera, Tushin no dijo esto, aunque era la absoluta verdad. Tenía miedo de decepcionar al otro jefe por esto y en silencio, con los ojos fijos, miró directamente a la cara de Bagration, tal como un estudiante que se ha descarriado mira a los ojos del examinador.
El silencio fue bastante largo. El príncipe Bagration, aparentemente sin querer ser estricto, no tenía nada que decir; el resto no se atrevió a intervenir en la conversación. El príncipe Andrei miró a Tushin por debajo de sus cejas y sus dedos se movieron nerviosamente.
“Su Excelencia”, el Príncipe Andrei interrumpió el silencio con su voz áspera, “se dignó enviarme a la batería del Capitán Tushin. Estuve allí y encontré dos tercios de los hombres y caballos muertos, dos armas destrozadas y sin cobertura.
El Príncipe Bagration y Tushin ahora miraban con la misma obstinación a Bolkonsky, quien habló con moderación y entusiasmo.
"Y si, Su Excelencia, permítame expresar mi opinión", continuó, "el éxito del día se lo debemos sobre todo a la acción de esta batería y al heroico aguante del Capitán Tushin con su compañía", dijo el Príncipe Andrei y, sin esperar una respuesta, se levantó de inmediato y se alejó de la mesa.
En la cadena respiratoria corta se oxida el sustrato, por lo que el aceptor primario de electrones es la flaproteína (no hay etapa de oxidación del sustrato NAD-DH). Sustancias de cadena corta: ácido succínico, formas activas de ácidos grasos, glicerofosfato).
Primera reacción de oxidación:
Posteriormente, el FADH 2, con participación de (FeS*) + KoQ, se oxida:
CoQ reducido como en la longitud de la cadena respiratoria por el sistema de citocromos:

Estas cadenas respiratorias se pueden dividir en fragmentos estructural-funcionales llamados complejos oxidativos. Hay 3 complejos en la cadena larga y 2 en la cadena corta.
1. Se ubica entre NADH 2 y KoQ e incluye FP y el complejo FeS.
2. KoQH 2 -DG (complejo de citocromo C-reductasa) se encuentra entre KoQ y cC e incluye cB, FeS, proteínas, cC 1
3. Complejo de citocromo oxidasa: oxida cC e incluye cAA 3
4. El complejo succinato deshidrogenasa incluye FP* y FeS, succinato DG
Cada complejo respiratorio puede desconectarse del trabajo de la cadena respiratoria mediante ciertas sustancias: inhibidores.
El primer complejo - amytal, barbitúricos, rotenol
El segundo complejo es el malonato.
El tercer complejo es la antimicina A.
El cuarto complejo - H 2 S, cianuros, CO
La oxidación intramitocondrial está estrechamente relacionada con el metabolismo energético. intercambio de energía- balance de las reacciones de formación y reacciones de uso de energía.
Las reacciones que liberan energía se llaman exórgico reacciones de absorción endorgánico. El principal proceso exorgánico en el cuerpo es el transporte de electrones a través de la cadena respiratoria. Componentes iniciales NAD oxidado, NAD reducido:
 Por lo tanto, los electrones con alta energía se mueven en el CPE y se libera energía en el proceso de transporte de electrones. La energía que se puede utilizar para hacer algún trabajo. energía gratis. En la cadena respiratoria se calcula la energía.
Por lo tanto, los electrones con alta energía se mueven en el CPE y se libera energía en el proceso de transporte de electrones. La energía que se puede utilizar para hacer algún trabajo. energía gratis. En la cadena respiratoria se calcula la energía.
ΔF = -23*n*Δe,
donde n es el número de electrones transferidos por átomo de O 2 (2e), Δe es la diferencia de ORP entre el comienzo y el final del CPE.
Δe \u003d 0.82 - (-0.32) \u003d 1.14V
ΔF \u003d -23 * 2 * 1.14 \u003d -52 kcal / mol
Esta energía puede ser utilizada por el organismo para realizar diversos procesos:
- Mecánica - contracción muscular
- Químico - para la síntesis de nuevas sustancias
- Osmótico: transporte de iones contra un gradiente de concentración.
- Eléctrico: la aparición de potenciales en el sistema nervioso.
Todos los organismos, dependiendo de la energía que utilizan, se dividen en dos tipos: fotótrofos- puede utilizar la energía de la luz solar, quimiovares- Puede usar la energía solo de enlaces químicos de sustancias macroérgicas especiales.
sustancias macroérgicas- sustancias durante la hidrólisis de enlaces de los cuales se libera energía más de 5 kcal / mol. Estos incluyen fosfoenolpiruvato, fosfato de creatina, fosfato de 1,3-difosfoglicerol, acilos de ácidos grasos, ATP (GTP, CTP, UCF). Entre los macroergios enumerados, ATP ocupa un lugar central. El ATP es una batería y una fuente de energía química. El ATP molecular contiene una energía de 7,3 kcal/mol (en condiciones estándar) y hasta 12 kcal/mol en condiciones fisiológicas. La composición de ATP: adenil-ribosa-H 3 RO 4 - H 3 RO 4 -H 3 RO 4. El ATP se sintetiza a partir del ADP. La descomposición del ATP es un proceso exoorgánico. La principal fuente de energía para la síntesis de ATP es el transporte de electrones a través de la cadena respiratoria. La adición de H 3 RO 4 se denomina fosforilación.
Fosforilación oxidativa
El proceso de síntesis de ATP a partir de ADP y H 3 RO 4, debido a la energía de transporte a lo largo del CPE. Los procesos de oxidación de la cadena respiratoria y la síntesis de ATP están íntimamente relacionados. En este caso, el proceso principal es el transporte de electrones, acompañado de la fosforilación. Las regiones de la cadena respiratoria donde se produce la síntesis de ATP se denominan regiones de conjugación. Hay tres de ellos en la cadena larga (1, 3, 4 - complejos oxidativos), en la cadena respiratoria corta hay dos de ellos (3.4). Si una sustancia se oxida en la cadena respiratoria, se sintetizan un máximo de tres moléculas de ATP. La eficiencia de acoplamiento de la fosforilación oxidativa se expresa mediante el coeficiente de fosforilación. Muestra cuántas moléculas de H 3 RO 4 se unen al ADP cuando se transfieren dos electrones a un átomo de oxígeno, es decir, cuántas moléculas de ATP se sintetizan por átomo de oxígeno. Para una cadena larga, el coeficiente = 3 para una cadena corta 2.
Mecanismo de fosforilación oxidativa.
Por primera vez en los años treinta, el bioquímico ruso Engelhardt identificó el acto de síntesis de ATP en el proceso de oxidación. La principal hipótesis para explicar el mecanismo de la fosforilación oxidativa fue la quimioosmótica.  La teoría de Mitchell. Según él, durante el transporte de electrones a lo largo de la cadena respiratoria surge un potencial protónico, que acumula la energía liberada durante la transferencia de un electrón. Posteriormente, el potencial de protones se utiliza para sintetizar ATP. La aparición del potencial de protones se debe a la impermeabilidad a los protones de la membrana interna de las mitocondrias. Como resultado del transporte de electrones a lo largo de la cadena respiratoria, el H+ es empujado simultáneamente fuera de la matriz hacia el espacio intermembrana. Transferido 6 - 10 H+.
La teoría de Mitchell. Según él, durante el transporte de electrones a lo largo de la cadena respiratoria surge un potencial protónico, que acumula la energía liberada durante la transferencia de un electrón. Posteriormente, el potencial de protones se utiliza para sintetizar ATP. La aparición del potencial de protones se debe a la impermeabilidad a los protones de la membrana interna de las mitocondrias. Como resultado del transporte de electrones a lo largo de la cadena respiratoria, el H+ es empujado simultáneamente fuera de la matriz hacia el espacio intermembrana. Transferido 6 - 10 H+.
cadena respiratoria es parte del proceso fosforilación oxidativa. Los componentes de la cadena respiratoria catalizan la transferencia de electrones desde NADH + H + o ubiquinona reducida (QH 2) al oxígeno molecular. Debido a la gran diferencia en los potenciales redox del donante (NADH + H + y, en consecuencia, QH 2) y el aceptor (O 2), la reacción es altamente exergónico. La mayor parte de la energía liberada durante esto se usa para crear un gradiente de protones y, finalmente, para formar ATP con la ayuda de ATP sintasa.
Componentes de la cadena respiratoria
La cadena respiratoria incluye tres complejos proteicos ( complejos I, III y IV), incrustado en la membrana mitocondrial interna, y dos móviles moléculas transportadoras- ubiquinona (coenzima Q) y citocromo c. succinato deshidrogenasa, perteneciente al propio ciclo del citrato, también puede considerarse como complejo II de la cadena respiratoria. ATP sintasa aveces llamado complejo V, aunque no interviene en la transferencia de electrones.
Los complejos de la cadena respiratoria se construyen a partir de muchos polipéptidos y contienen varios coenzimas redox asociado a proteínas. pertenecen a flavina[FMN (FMN) o FAD (FAD), en los complejos I y II], centros de hierro-azufre(en I, II y III) y grupos hemo(en II, III y IV). La estructura detallada de la mayoría de los complejos aún no se ha establecido.
Los electrones ingresan a la cadena respiratoria de varias maneras. Durante la oxidación de NADH + H + complejo yo transfiere electrones a través de los centros FMN y Fe/S a la ubiquinona. Los electrones formados durante la oxidación de succinato, acil-CoA y otros sustratos se transfieren a la ubiquinona complejo II u otro deshidrogenasa mitocondrial a través de FADH2 ligado a enzimas o flavoproteína. En este caso, la forma oxidada de la coenzima Q se reduce a aromática ubihidroquinona. Este último transfiere electrones a complejo III, que los entrega a través de dos hemo b, un centro Fe/S y hemo c 1 a una pequeña proteína que contiene hemo citocromo c. Este último transfiere electrones al complejo IV, citocromo c oxidasa. La citocromo c-oxidasa contiene dos centros que contienen cobre (Cu A y Cu B) y los hemos a y a 3 para las reacciones redox, a través de las cuales finalmente ingresan los electrones. al oxígeno. Cuando se reduce el O 2 , se forma un anión O 2 básico fuerte, que se une a dos protones y pasa al agua. El flujo de electrones se conjuga con los complejos formados I, III y IV. gradiente de protones .
Organización de la cadena respiratoria
Procede la transferencia de protones por los complejos I, III y IV vector desde la matriz hasta el espacio intermembrana. Cuando se transfieren electrones en la cadena respiratoria, la concentración de iones H+ aumenta, es decir, el valor del pH disminuye. En las mitocondrias intactas, esencialmente solo ATP sintasa permite el movimiento inverso de protones hacia la matriz. Esta es la base para la conjugación importante desde el punto de vista regulatorio de la transferencia de electrones con la formación de ATP.
Como ya se mencionó, todos los complejos I a V están integrados en la membrana mitocondrial interna, sin embargo, por lo general no se contactan entre sí, ya que los electrones son transferidos por la ubiquinona y el citocromo c. La ubiquinona, debido a la cadena lateral no polar, se mueve libremente en la membrana. El citocromo c soluble en agua se encuentra en afuera membrana interna.
La oxidación de NADH (NADH) por el complejo I ocurre en el lado interno de la membrana, así como en la matriz, donde también ocurre el ciclo del citrato y la β-oxidación, las fuentes más importantes de NADH. Además, en la matriz tiene lugar la reducción de O 2 y la formación de ATP (ATP). El ATP resultante se transfiere por el mecanismo antipuerto (contra ADP) al espacio intermembrana, desde donde penetra en el citoplasma a través de las porinas.
Total cadena de transporte de electrones(Inglés) cadena de transporte de electrones) incluye una variedad de proteínas que se organizan en 4 grandes complejos multienzimáticos unidos a la membrana. También hay otro complejo involucrado no en la transferencia de electrones, sino en la síntesis de ATP.
La estructura de los complejos enzimáticos.
cadena respiratoria
1 complejo. NADH-CoQ oxidorreductasa
Este complejo también tiene un título de trabajo NADH deshidrogenasa, contiene FMN, 42 moléculas de proteína, de las cuales al menos 6 son proteínas de hierro-azufre.
Función
- Acepta electrones del NADH y los transfiere a coenzima Q(ubiquinona).
Las proteínas de hierro y azufre (proteínas FeS) son proteínas que contienen átomos de hierro que están conectados a átomos de azufre y al azufre de los residuos de cisteína. Como resultado, se forma un centro de hierro y azufre.

2 complejo. Deshidrogenasas dependientes de FAD
Este complejo como tal no existe, su asignación es condicional. Incluye Enzimas dependientes de FAD ubicado en la membrana interna, por ejemplo, acil-SCoA deshidrogenasa(β-oxidación de ácidos grasos), succinato deshidrogenasa(ciclo del ácido tricarboxílico), mitocondrial glicerol-3-fosfato deshidrogenasa(mecanismo de lanzadera para la transferencia de átomos de hidrógeno).
Función
- Recuperación de FAD en reacciones redox.
- Asegurando la transferencia de electrones desde FADH 2 a proteínas de hierro-azufre de la membrana interna de las mitocondrias. Estos electrones luego van a coenzima Q (ubiquinona).
3 complejo. KoQ-citocromo C-oxidorreductasa
De otra manera, este complejo se llama citocromo. Con reductasa. Contiene moléculas citocromo b Y citocromo C 1 , hierro-azufre proteinas El complejo consta de 2 monómeros, cada uno de los cuales tiene 11 cadenas polipeptídicas.
Función
- acepta electrones de coenzima Q y los envía a citocromo Con .
- Transfiere 2 iones H+ a la superficie externa de la membrana mitocondrial interna.
Hay desacuerdos sobre la cantidad de iones H + transportados con la participación de los complejos 3 y 4. Según unos datos, el tercer complejo entrega 2 iones H+ y el cuarto complejo entrega 4 iones H+. Según otros autores, por el contrario, el tercer complejo transfiere 4 iones H+ y el cuarto complejo transfiere 2 iones H+.
4 complejo. Citocromo c-oxígeno oxidorreductasa
En este complejo se encuentran citocromos A Y un 3 , También es llamado citocromo oxidasa, consta de 13 subunidades. El complejo contiene iones cobre, conectados a las proteínas del complejo a través de los grupos HS de la cisteína, y formando centros similares a los que se encuentran en las proteínas de hierro-azufre.
Función
- acepta electrones de citocromo Con y los envía a oxígeno con la formación de agua.
- Transfiere 4 iones H+ a la superficie externa de la membrana mitocondrial interna.
5 complejo
El quinto complejo es una enzima. ATP sintasa, que consta de muchas cadenas de proteínas, divididas en dos grandes grupos:
- se forma un grupo subunidad F o(pronunciado con el sonido "o", no "cero" porque es sensible a la oligomicina) - su función formación de canales, a lo largo de él, los protones de hidrógeno bombeados hacia afuera se precipitan hacia la matriz.
- se forma otro grupo subunidad F 1- su función catalítico, es ella quien, utilizando la energía de los protones, sintetiza ATP.
El mecanismo de la ATP sintasa se llama
- En contacto con 0
- Google Mas 0
- DE ACUERDO 0
- Facebook 0