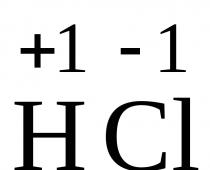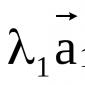Electrolitos – sustancias cuyas soluciones acuosas y masas fundidas conducen corriente eléctrica. Estas sustancias tienen enlaces iónicos y covalentes altamente polares. Los electrolitos son ácidos, bases y sales. El comportamiento de los electrolitos en solución se explica por la teoría de la disociación electrolítica, formulada Svante Arrhenius en 1887:
Las sustancias cuyas soluciones son electrolitos, cuando se disuelven, se desintegran en partículas (iones) que llevan cargas positivas y negativas.
El proceso de descomposición del electrolito en iones se llama disociación electrolítica. Bajo la influencia del voltaje eléctrico, los iones cargados positivamente se mueven hacia el cátodo y los iones cargados negativamente hacia el ánodo.
Los iones que tienen carga positiva se llaman cationes, e iones cargados negativamente – aniones. Los cationes son iones metálicos cargados positivamente, iones de hidrógeno, NH 4 +, aniones, residuos ácidos e iones de hidróxido. La cantidad de carga del ion coincide con la valencia del átomo o residuo ácido, y el número de cargas positivas es igual al número de negativas. Por tanto, la solución en su conjunto es eléctricamente neutra. El proceso de disociación electrolítica se describe a continuación:
NaCl ↔ Na + + Cl‾
H 2 SO 4 ↔ 2H + + SO 4 2–
La teoría de Arrhenius explica muchos fenómenos asociados con las propiedades de las soluciones de electrolitos, pero no responde a la pregunta: por qué algunas sustancias son electrolitos y otras no, y qué papel juega el disolvente en la formación de iones.
2 . Mecanismo de disociación
La teoría del proceso de disociación fue desarrollada por I.A. Tacones (1891).
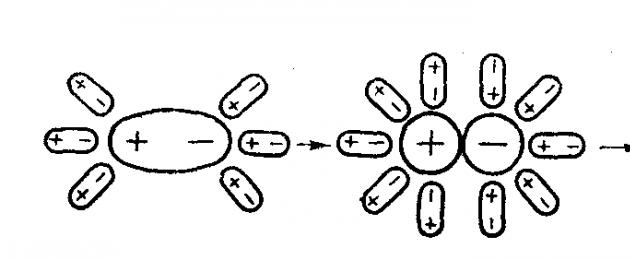
Imaginemos que se añade al agua un cristal iónico, por ejemplo NaCl. Cada ion situado en la superficie del cristal forma un campo eléctrico a su alrededor. Cerca de Na + se crea un campo de signo positivo, cerca de Cl – se da un campo electrostático de signo negativo. La influencia de estos campos se extiende a una cierta distancia del cristal. En solución, el cristal está rodeado por todos lados por moléculas de agua que se mueven aleatoriamente. Cuando entran en el campo de acción de los iones cargados eléctricamente, cambian su movimiento: en las inmediaciones del cristal están orientados de tal manera que los dipolos de agua se dirigen hacia el ion Cl – cargado negativamente con un polo cargado positivamente, y hacia el ion Na + cargado positivamente – con un polo cargado negativamente ( Fig. 1). Este fenómeno se llama orientación de las moléculas polares en un campo electrostático. Las fuerzas de atracción de Coulomb actúan entre los iones y los dipolos de agua. Como resultado de la interacción ion-dipolo, se libera energía, lo que contribuye a la ruptura de los enlaces iónicos en el cristal y a la transferencia del ion del cristal a la solución. Los iones separados entre sí, inmediatamente después de romperse el enlace entre ellos, quedan estrechamente rodeados por moléculas de agua polares y se vuelven completamente hidratado. El fenómeno de interacción de iones con moléculas de agua, como resultado de lo cual se forma una capa de hidratación, se llama hidratación de iones.
Arroz. 1. Disociación de compuestos iónicos.
Los iones hidratados que tienen cargas opuestas pueden interactuar entre sí. Pero dado que los iones se mueven en la solución junto con las capas de hidratación, la fuerza de su interacción se reduce significativamente y son capaces de existir de forma independiente.
Cuando se disuelven compuestos polares, los dipolos de agua se orientan alrededor de las moléculas disueltas, lo que hace que se polaricen aún más. Polar enlace covalente entre átomos se vuelve iónico. El par de electrones compartido se mueve hacia uno de los átomos (Fig. 2).

Arroz. 2. Disociación de moléculas con enlaces covalentes polares.
Por ejemplo, en el HCl, un par de electrones se desplaza hacia un átomo de cloro, que se convierte en un ion de cloro hidratado, y un protón con una molécula de agua forma una partícula compleja cargada positivamente H 3 O + - ion hidronio.
HCl + xH 2 O ↔ H 3 O + + Cl – ∙yH 2 O
Por tanto, los electrolitos sólo pueden ser compuestos con enlaces covalentes iónicos o polares. Los electrolitos sólo pueden disociarse en disolventes polares.
Principios básicos de la teoría de la disociación electrolítica.
La teoría de la disociación electrolítica fue desarrollada en 1887 por el científico sueco S. Arrhenius. Según esta teoría, existen sustancias que pueden desintegrarse (disociarse) en iones en soluciones y masas fundidas, como resultado de lo cual las soluciones y masas fundidas de estas sustancias conducen corriente eléctrica. Estas sustancias se denominaron electrolitos. Los electrolitos en soluciones acuosas son ácidos, bases y sales. Cuando se disuelven, los electrolitos se disocian en iones cargados positivamente (cationes) e iones cargados negativamente (aniones). La teoría de Arrhenius, sin embargo, no tuvo en cuenta toda la complejidad de los fenómenos en las soluciones. En particular, consideraba los iones como partículas libres independientes de las moléculas de disolvente. Actualmente se sabe que cuando los electrolitos se disuelven en agua, simultáneamente con el proceso de su disociación en iones, se produce el proceso de hidratación iónica.
El curso del proceso de disociación de sustancias solubles depende de su estructura en estado anhidro. Los más típicos son dos casos: la disociación de sales y álcalis (es decir, cristales con estructura iónica) y la disociación de ácidos (es decir, sustancias formadas por moléculas con enlaces covalentes polares).
estado hidratado. Siguiente
detrás de la primera capa de iones en solución
pasa a la siguiente capa, y así
Así, el cristal se disuelve gradualmente (Fig. 7.1).
La disociación de moléculas polares, por ejemplo HCl, se produce de manera diferente (fig. 7.2). Al igual que una molécula de agua, una molécula de cloruro de hidrógeno es un dipolo. Bajo la influencia de fuerzas electrostáticas, las moléculas de agua son atraídas por los polos de la molécula polar de HCl (interacción dipolo-dipolo) y, por lo tanto, la polarizan aún más, es decir, aumentar la polaridad del enlace entre el átomo de hidrógeno y el átomo de cloro hasta la formación de iones H+ y Cl-. Esta polarización, combinada con el movimiento térmico vibratorio de los átomos de la molécula en cuestión y el movimiento térmico continuo de las moléculas de agua circundantes, hace que la molécula polar se desintegre en iones. Al igual que ocurre con la disolución de un cristal iónico, estos iones se hidratan. En este caso, el ion hidrógeno H + está firmemente unido a la molécula de agua formando el ion hidronio H 3 O + .
El proceso de disociación electrolítica se representa utilizando ecuaciones químicas; en este caso, por regla general, no se indica el estado hidratado de los iones: HCl ® H + + Cl – ; BaCl 2 ® Ba 2+ + 2 Cl – .
La disociación de sustancias de estructura tanto iónica como molecular se ve facilitada por la polaridad de las moléculas del disolvente. Por lo tanto, no solo el agua, sino también otros líquidos formados por moléculas polares ( ácido fórmico, alcohol etílico, amoníaco) son disolventes ionizantes: las sales, ácidos y bases disueltas en estos líquidos se disocian en iones. Tanto en soluciones acuosas como no acuosas, los iones se encuentran en estado solvatado.
1. Los electrolitos, cuando se disuelven en agua, se dividen (disocian) en iones, positivos y negativos.
2. Bajo la influencia corriente eléctrica Los iones adquieren un movimiento direccional: las partículas cargadas positivamente se mueven hacia el cátodo, las partículas cargadas negativamente se mueven hacia el ánodo. Por lo tanto, las partículas con carga positiva se denominan cationes y las partículas con carga negativa, aniones.
3. El movimiento dirigido se produce como resultado de la atracción de sus electrodos con carga opuesta (el cátodo tiene carga negativa y el ánodo, carga positiva).
4. La ionización es un proceso reversible: paralelamente a la desintegración de moléculas en iones (disociación), se produce el proceso de combinar iones en moléculas (asociación).
Basándose en la teoría de la disociación electrolítica, se pueden dar las siguientes definiciones para las principales clases de compuestos:
Los ácidos son electrolitos cuya disociación produce únicamente iones de hidrógeno como cationes. Por ejemplo,
HCl → H+ + Cl-;
CH3COOH H+ + CH3COO-.
La basicidad de un ácido está determinada por la cantidad de cationes de hidrógeno que se forman durante la disociación. Así, HCl, HNO3 son ácidos monobásicos, H2SO4, H2CO3 son dibásicos, H3PO4, H3AsO4 son tribásicos.
Las bases son electrolitos cuya disociación produce únicamente iones hidróxido como aniones. Por ejemplo,
KOH → K+ + OH-,
NH4OH NH4+ + OH-.
Las bases solubles en agua se llaman álcalis.
La acidez de una base está determinada por el número de sus grupos hidroxilo. Por ejemplo, KOH, NaOH son bases de un ácido, Ca(OH)2 es de dos ácidos, Sn(OH)4 es de cuatro ácidos, etc.
Las sales son electrolitos cuya disociación produce cationes metálicos (así como el ion NH4+) y aniones de residuos ácidos. Por ejemplo,
CaCl2→ Ca2+ + 2Cl-,
NaF → Na+ + F-.
Los electrolitos, durante cuya disociación, dependiendo de las condiciones, pueden formar simultáneamente cationes de hidrógeno y aniones (iones de hidróxido) se denominan anfóteros. Por ejemplo,
Zn(OH)2 Zn2+ + 2OH-,
Zn(OH)2 2H+ + ZnO22- o
Zn(OH)2 + 2H2O 2- + 2H+.
Disociación de ácidos, bases y sales en soluciones acuosas.
Utilizando la teoría de la disociación electrolítica, definen y describen las propiedades de ácidos, bases y sales.
Disociación de ácidos
Ácidos se llaman electrolitos, tras la disociación de los cuales solo se forman cationes de hidrógeno (H +) como cationes.
Por ejemplo,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Los ácidos polibásicos se disocian paso a paso. :
H 3 PO 4 ↔ H + + H 2 PO - 4 (primer paso) – ion ortofosfato de dihidrógeno
H 2 PO - 4 ↔ H + + HPO 2- 4 (segunda etapa) – ion ortofosfato de hidrógeno
NPO 2- 4 ↔ N + + PO Z- 4 (tercera etapa) – ion ortofosfato
La disociación de un ácido polibásico se produce principalmente en el primer paso, en menor medida en el segundo y sólo en pequeña medida en el tercero.
Disociación básica
Razones se llaman electrolitos, al disociarse solo se forman iones hidróxido (OH -) como aniones .
| Disociación de álcalis | Disociación de bases anfóteras (anfolitos) |
| ¡Recordar! álcalis- Son bases que son solubles en agua. Estas son bases alcalinas y metales alcalinotérreos : LiOH, NaOH, KOH, Rb OH, C s OH, Fr OH y Ca(OH) 2, Sr(OH) 2, Ba(OH) 2, Ra(OH) 2, así como NH 4 OH | Los anfolitos son electrolitos que, al disociarse, forman simultáneamente cationes de hidrógeno (H +) e iones de hidróxido (OH -). |
| Ejemplos de ecuaciones de disociación alcalina KOH -> K++ OH - ; NH 4 OH ↔ NH + 4 + OH - Las bases poliácidas se disocian paso a paso: Ba(OH) 2 -> Ba(OH) + + OH - (primera etapa) Ba(OH) + ↔ Ba 2+ +OH - (segunda etapa) | Ejemplos de ecuaciones de disociación para anfolitos H 2 O ↔ H + + OH - La disociación del hidróxido de zinc anfótero Zn(OH) 2 se puede expresar mediante la ecuación: 2OH - + Zn 2+ + 2H 2 O ↔ Zn (OH) 2 + 2H 2 O ↔ 2- + 2H + |
Disociación de sales
Sales son llamados electrolitos, tras la disociación de los cuales se forman cationes metálicos, así como cationes de amonio (NH + 4) y aniones de residuos ácidos.
Por ejemplo, disociación de sales medianas:
(NH4)2SO4->2NH+4+SO2-4;
Na 3 PO 4 -> 3 Na + + PO 3- 4
Las sales ácidas y básicas se disocian paso a paso:
Por ejemplo,
BOLETO N° 22
Grado de disociación. Electrolitos fuertes y débiles. ecuaciones iónicas reacciones.
El grado de disociación es una cantidad que caracteriza el estado de equilibrio en la reacción de disociación en sistemas homogéneos (homogéneos).
Objetivos de la lección:
Educativo –
- formular las principales disposiciones de la teoría de la disociación electrolítica;
- resumir información sobre iones;
- consolidar la capacidad de escribir el proceso de disociación utilizando símbolos y fórmulas químicas.
Educativo – cultivar el deseo de aprender activamente, con interés, inculcar disciplina consciente, claridad y organización en el trabajo.
Desarrollo – Desarrollar la capacidad de los estudiantes, a partir de conocimientos teóricos, para comparar, analizar, generalizar, razonar lógicamente, sacar conclusiones y desarrollar el habla oral.
Métodos de enseñanza: explicación, conversación, comparación, formulación y solución de problemas educativos, experimento químico (video), trabajo individual independiente.
Medios de educación: proyector multimedia, computadora, tabla de solubilidad de ácidos, bases y sales en agua, ejercicios de entrenamiento, literatura educativa: "Química. 8vo grado”, autores – O.S. Gabrielyan - M.: Avutarda, 2008.
durante las clases
I. Organizar el tiempo.
II. Conversación introductoria: presentación del tema, explicación de las metas y objetivos de la lección.
(2 minutos) /diapositiva 1, 2/
El tema de la lección de hoy es "Principios básicos de la teoría de la disociación electrolítica". Este tema es una continuación de la lección anterior. Por lo tanto, hoy el objetivo de nuestra lección será resumir información sobre iones, consolidar la capacidad de escribir el proceso de disociación utilizando símbolos y fórmulas químicos y formular los principios básicos de la teoría de la disociación electrolítica.
III. Actualización del material tratado: revisión de deberes.
Vamos a revisar tarea. Tienes hojas de trabajo en tus escritorios. Escriba su nombre y apellido en la esquina superior derecha. Comencemos la tarea. Para completar la tarea – 5 minutos.
Ejercicio 1/diapositiva 3/
Prueba tus conocimientos. Completa las definiciones.
- Las sustancias cuyas soluciones conducen corriente eléctrica se llaman... (electrolitos)
- El proceso de descomposición de electrolitos en iones se llama ... (disociación electrolítica)
- Las sustancias cuyas soluciones no conducen corriente eléctrica se denominan... (no electrolitos)
- La relación entre el número de partículas que se descomponen en iones y numero total las partículas disueltas se llaman ... (grado de disociación electrolítica)
Tarea 2 /diapositiva 4/
Prueba tus conocimientos. Completa el diagrama.
Tarea 3 /diapositiva 5/
Prueba tus conocimientos. Llena la mesa.
Tarea 4/diapositiva 6/
Tienes 3 minutos para responder.
Usando el diagrama en la pantalla, cuéntenos sobre la secuencia de procesos que ocurren durante la disociación.
A) sustancias con enlaces iónicos
- orientación de moléculas: dipolos de agua cerca de iones cristalinos;
- hidratación (interacción) de moléculas de agua con iones con carga opuesta de la capa superficial del cristal;
- disociación (desintegración) de un cristal de electrolito en iones hidratados.
B) sustancias con enlaces covalentes polares
- orientación de las moléculas de agua alrededor de los polos de una molécula de electrolito;
- hidratación (interacción) de moléculas de agua con moléculas de electrolitos;
- ionización de moléculas de electrolitos (conversión de covalentes conexión polar a iónico);
- disociación (desintegración) de moléculas de electrolitos en iones hidratados.
IV. Aprender material nuevo.
Historia del descubrimiento de la teoría de la disociación electrolítica. /diapositiva 7/
El científico sueco Svante Arrhenius, al estudiar la conductividad eléctrica de soluciones de diversas sustancias, llegó a la conclusión de que la causa de la conductividad eléctrica es la presencia en la solución de iones que se forman cuando el electrolito se disuelve en agua. Este proceso se llama disociación electrolítica. En 1887, Arrhenius formuló los principios básicos de la teoría de la disociación electrolítica. Consideremos las principales disposiciones de la teoría de la disociación electrolítica (en su versión abreviada, TED). /diapositiva 8/
Disposiciones básicas de la teoría de TED.
1. Cuando se disuelven en agua, los electrolitos se disocian (rompen) en iones positivos y negativos.
Por ejemplo: NaCl = Na + + Cl -
Los iones son una de las formas de existencia. elemento químico. Los iones se diferencian de los átomos en el número de electrones, es decir carga eléctrica. Los átomos son partículas neutras, los iones tienen carga (positiva o negativa). Estas dos circunstancias determinan la diferencia en sus propiedades.
/diapositiva 9/
En consecuencia, los iones son partículas cargadas positiva o negativamente en las que se transforman átomos o grupos de átomos como consecuencia de la pérdida o adición de electrones. Este proceso de transformación se puede representar en forma de diagrama.
Examinemos la diferencia en las propiedades de los átomos y los iones usando el ejemplo de una sustancia bien conocida: la sal de mesa. 1 electrón es mucho para cambiar las propiedades, por lo que las propiedades de los iones son completamente diferentes de las propiedades de los átomos que los formaron. El sodio metálico es una sustancia muy reactiva que incluso se almacena bajo una capa de queroseno; de lo contrario, el sodio comenzará a interactuar con los componentes. ambiente. El sodio reacciona vigorosamente con el agua, formando álcali e hidrógeno, mientras que los iones de sodio positivos no forman tales productos. El cloro tiene un color amarillo verdoso y un olor acre, y es venenoso, mientras que los iones de cloro son incoloros, no tóxicos e inodoros. A nadie se le ocurriría utilizar sodio metálico y cloro gaseoso en los alimentos, mientras que sin el cloruro de sodio, formado por iones de sodio y cloro, es imposible cocinar. Estas dos partículas se diferencian en un solo electrón.
La palabra "ion" traducida del griego significa "vagabundo". En las soluciones, los iones se mueven aleatoriamente (“viajan”) en diferentes direcciones. Según su composición, los iones se dividen en simples - Cl -, complejos Na + - NH 4 +, SO 4 -.

Disposiciones básicas de la teoría de TED.
2. El motivo de la disociación de un electrolito en una solución acuosa es su hidratación, es decir Interacción del electrolito con moléculas de agua y ruptura. enlace químico en él.
Como resultado de la interacción del electrolito con agua se forman moléculas hidratadas, es decir. Iones asociados con moléculas de agua.
En consecuencia, según la presencia de una capa acuosa, los iones se dividen en hidratados (en soluciones e hidratos cristalinos) y no hidratados (en sales anhidras). Por ejemplo: hidratos de cristal: sal de Gluber, sulfato de cobre; sales anhidras: sulfato de cobre, nitrato de sodio. Las propiedades de los iones hidratados y no hidratados son diferentes, como se puede ver en el ejemplo de los iones de cobre.
IONES (basados en la presencia de una capa de agua)
- hidratado
en soluciones e hidratos cristalinos: CuSO 4 *5H 2 O, Na 2 SO 4 *10H 2 O - sin hidratar
en sales anhidras: Cu 2+ SO 4 2-, Na + NO 3 -
Disposiciones básicas de la TED
3. Bajo la influencia de la corriente eléctrica, los iones cargados positivamente se mueven al polo negativo de la fuente de corriente, el cátodo, por eso se llaman cationes, y los iones cargados negativamente se mueven al polo positivo de la fuente de corriente, el ánodo, por lo tanto se llaman aniones.
En consecuencia, existe otra clasificación de iones, según el signo de su carga.
IONES
*cationes (partículas cargadas positivamente)
*aniones (partículas cargadas negativamente)
En soluciones de electrolitos, la suma de las cargas de los cationes es igual a la suma de las cargas de los aniones, por lo que estas soluciones son eléctricamente neutras.
Disposiciones básicas de la TED
La disociación electrolítica es un proceso reversible para electrolitos débiles. Junto con el proceso de disociación (descomposición del electrolito en iones), también ocurre el proceso inverso: asociación (combinación de iones). Por tanto, en las ecuaciones de disociación electrolítica, en lugar del signo igual, se utiliza el signo de reversibilidad, por ejemplo:
HNO 2 ↔ H + + NO 2-
/diapositiva 17/
Disposiciones básicas de la TED
5. No todos los electrolitos se disocian en iones en la misma medida.
El grado de disociación depende de la naturaleza del electrolito y su concentración.
Según el grado de disociación, los electrolitos se dividen en débiles y fuertes.
Disposiciones básicas de la TED
6. Propiedades químicas Las soluciones de electrolitos están determinadas por las propiedades de los iones que forman durante la disociación.
Según la naturaleza de los iones formados durante la disociación de electrolitos, se distinguen tres tipos de electrolitos: ácidos, bases y sales.

Intentemos ahora completar la tarea utilizando la información recibida. Al completar la tarea, preste atención a si la sustancia es un electrolito.
- HNO3
- H2SiO3
Basándose en los diagramas compilados, intente definir los ácidos desde el punto de vista de TED.
AÑADIR DEFINICIÓN
Los ácidos son electrolitos que se disocian en cationes... y aniones...
ÁCIDOS- Estos son electrolitos que, al disociarse, forman cationes de hidrógeno y aniones de un residuo ácido.
Por ejemplo:
HCl = H + + Cl -
HNO 3 = H + + NO 3 -
Para los ácidos polibásicos, se produce una disociación gradual. Por ejemplo, para ácido fosfórico H3PO4:
1.ª etapa – formación de iones de dihidrógeno fosfato:
H 3 PO 4 ↔ H + + H 2 PO 4 -
2da etapa – formación de iones de hidrógeno fosfato:
H 2 PO 4 - ↔ H + + HPO 4 2-
Hay que tener en cuenta que la disociación de electrolitos en la segunda etapa es mucho más débil que en la primera. La disociación del tercer paso casi no ocurre en condiciones normales.
Todos los ácidos tienen en común el hecho de que al disociarse necesariamente forman cationes de hidrógeno. Por lo tanto, es lógico suponer que las propiedades características generales de los ácidos (sabor amargo, cambios en el color de los indicadores, etc.) son causadas precisamente por cationes de hidrógeno.
Completemos la siguiente tarea basándonos en las principales disposiciones del TED.
Escriba posibles ecuaciones para la disociación electrolítica de sustancias en soluciones acuosas.
- Fe(OH)2
Nombra la clase de estas sustancias.
A partir de los diagramas compilados, intente definir los motivos desde el punto de vista de TED.
AÑADIR DEFINICIÓN
Las bases son electrolitos que se disocian en cationes... y aniones...
BASES- Se trata de electrolitos que, al disociarse, forman cationes metálicos y aniones hidróxido.
Por ejemplo:
NaOH = Na + + OH -
KOH = K + + OH -
Las bases poliácidas se disocian paso a paso, principalmente en el primer paso. Por ejemplo, hidróxido de bario Ba (OH)2:
1.a etapa – formación de iones hidroxo:
Ba(OH)2 ↔ OH - + BaOH +
2da etapa – formación de iones de bario:
BaOH+ ↔ Ba 2+ + OH -
Todas las propiedades comunes de las bases (jabonesidad al tacto, cambio de color de los indicadores, etc.) se deben a los iones de hidróxido OH, comunes a todas las bases.
Completemos la siguiente tarea.
Escriba posibles ecuaciones para la disociación electrolítica de sustancias en soluciones acuosas.
- KNO 3
- BaSO4
Nombra la clase de estas sustancias.
A partir de los diagramas compilados, intente definir las sales desde el punto de vista de TED.
AÑADIR DEFINICIÓN
Las sales son electrolitos que se disocian en cationes... y aniones...
SAL- Se trata de electrolitos que, al disociarse, forman cationes metálicos (o NH 4 de amonio) y aniones de residuos ácidos.
Por ejemplo:
K 3 PO 4 = 3K + + PO 4 3-
NH 4 Cl = NH 4 + + Cl -
Es obvio que las propiedades de las sales están determinadas tanto por los cationes metálicos como por los aniones del residuo ácido. Por tanto, las sales de amonio tienen propiedades generales debidas a los iones NH 4 + y propiedades específicas debidas a varios aniones. De manera similar, las propiedades generales de los sulfatos (sales de ácido sulfúrico) están determinadas por los iones SO 4 2- y otras diferentes, por diferentes cationes. A diferencia de los ácidos polibásicos y las bases que contienen varios iones hidróxido, las sales como K 2 SO 4, Al 2 (SO 4) 3, etc. se disocian completamente de una vez y no en pasos.
Ahora hagamos una tarea más difícil, basada en todo el material que aprendimos en clase.
PRUEBA TUS CONOCIMIENTOS
Utilizando la tabla de solubilidad, dé ejemplos de tres sustancias que forman iones sulfato en soluciones. Escriba las ecuaciones para la disociación electrolítica de estas sustancias.
Por ejemplo:
H 2 SO 4 ↔ H + + SO 4 -
HSO 4 ↔ H + + SO 4 2-
Al final de la lección, les traigo una grabación en video de un experimento que muestra la descomposición de una solución de cloruro de cobre en iones bajo la influencia de una corriente eléctrica.
Abrimos nuestras agendas y anotamos nuestros deberes.
- §36, anotar las disposiciones del TED en un cuaderno, aprender de memoria;
- Aprenda de memoria las definiciones de ácidos, bases y sales;
- Tarea No. 5, página 203 (escrita).
>> Química: disposiciones básicas de la teoría de la disociación electrolítica. Resumamos la información sobre la disociación electrolítica en forma de disposiciones básicas de la teoría ahora generalmente aceptada. Son los siguientes.
Como resultado de esta interacción se forman iones hidratados, es decir, asociados a moléculas de agua.
En consecuencia, según la presencia de una capa acuosa, los iones se dividen en hidratados (en soluciones e hidratos cristalinos) y no hidratados (en sales anhidras).
Las propiedades de los iones hidratados y no hidratados difieren, como ya se puede ver en el ejemplo de los iones de cobre.
Cuando se disuelven en agua, los electrolitos disociar(descomponerse) en iones positivos y negativos.
Las propiedades de los iones son completamente diferentes a las propiedades de los átomos que los formaron. iones - Esta es una de las formas de existencia de un elemento químico. Por ejemplo, los átomos de sodio metálico interactúan vigorosamente con el agua, formando álcali e hidrógeno H, mientras que los iones de sodio no forman tales productos. El cloro tiene un color amarillo verdoso y un olor acre, es venenoso y los iones de cloro son incoloros, no tóxicos e inodoros. A nadie se le ocurriría utilizar sodio metálico y cloro gaseoso en los alimentos, mientras que sin el cloruro de sodio, formado por iones de sodio y cloro, es imposible cocinar.
Contenido de la lección notas de la lección marco de apoyo presentación de lecciones métodos de aceleración tecnologías interactivas Práctica tareas y ejercicios talleres de autoevaluación, capacitaciones, casos, misiones preguntas de discusión de tareas preguntas retóricas de los estudiantes Ilustraciones audio, videoclips y multimedia fotografías, cuadros, gráficos, tablas, diagramas, humor, anécdotas, chistes, historietas, parábolas, refranes, crucigramas, citas Complementos resúmenes artículos trucos para los curiosos cunas libros de texto diccionario de términos básico y adicional otros Mejorar los libros de texto y las lecciones.corregir errores en el libro de texto actualizar un fragmento de un libro de texto, elementos de innovación en la lección, reemplazar conocimientos obsoletos por otros nuevos Sólo para profesores lecciones perfectas plan de calendario para el año pautas programas de discusión Lecciones integradas- En contacto con 0
- Google+ 0
- DE ACUERDO 0
- Facebook 0