La base dei sali di ammonio è l'ammoniaca. Viene utilizzato nella produzione di molte sostanze organiche. In generale, si può sostenere che l'utilità dei sali di ammonio è pari all'utilità del sale da cucina.
Di tutti i campi di applicazione dei sali di ammonio, particolare attenzione dovrebbe essere prestata al loro utilizzo nella medicina popolare. Il sale di ammonio più comune è . È comunemente usato sotto forma di soluzione alcolica al 10%. L'azione di questa soluzione si basa su una potente irritazione delle terminazioni nervose del tratto respiratorio superiore.
L'azione viene utilizzata principalmente per portare una persona in uno stato cosciente. Può anche essere usato per risvegliarti durante il sonno naturale e farti uscire rapidamente dallo stato di svenimento. In misura minore, l'ammoniaca è efficace per l'avvelenamento da monossido di carbonio, l'annegamento e il soffocamento, perché È difficile determinare il momento in cui gli agenti topici non sono più efficaci.
Applicare l'ammoniaca nel modo seguente. Alcune gocce di alcol vengono applicate su un batuffolo di cotone (benda, tovagliolo) e portate al naso della vittima a una distanza di 0,5–1 cm per 1–2 minuti.
Un articolo separato per l'uso dell'ammoniaca è considerato un'emergenza per le persone che hanno consumato eccessivamente bevande alcoliche. In molti casi, in caso di avvelenamento da alcol, viene utilizzata una soluzione acquosa di ammoniaca. Questa ricetta è semplice: aggiungere 5-6 gocce di ammoniaca in un bicchiere d'acqua e darlo da bere alla persona che ha bisogno di rianimarsi.
Rispetto ai mezzi più familiari, come versare acqua o stropicciarsi le orecchie, questo metodo consente non solo di svegliarsi, ma anche di far tornare completamente sobrio una persona; diventa in grado di esprimere chiaramente i suoi pensieri e rispondere alle domande.
Ammoniaca
L'ammoniaca può essere utilizzata per sterilizzare, ad esempio, un ago che verrà utilizzato per rimuovere una scheggia da un dito. Basta pulirlo con un batuffolo di cotone imbevuto di alcol o immergerlo per qualche secondo in una bottiglia di alcol.
Allo stato non diluito, si consiglia l'uso dell'ammoniaca come agente cauterizzante per la rimozione dei papillomi. Per fare questo, prendi un batuffolo di cotone, immergilo nell'alcool e premilo sulla zona della pelle con papilloma per 5-6 secondi. È importante che l'alcol non venga a contatto con la pelle sana, altrimenti potresti subire un'ustione chimica.
E se lo diluisci 10 volte, aiuta molto a liberarti del prurito nelle zone colpite da punture di insetti o bruciature
I sali di ammonio sono molto particolari. Tutti si decompongono facilmente, alcuni spontaneamente, ad esempio il carbonato di ammonio:
(NH4)2CO3 = 2NH3 + H2O + CO2 (la reazione accelera quando riscaldato).
Altri sali, ad esempio il cloruro di ammonio (ammoniaca), sublimano quando riscaldati, cioè si decompongono prima in ammoniaca e cloruro sotto l'influenza del riscaldamento, e quando la temperatura diminuisce, sulle parti fredde della nave si forma nuovamente cloruro di ammonio:
riscaldamento
NH4Cl ⇄ NH3 + HCl
raffreddamento
Quando riscaldato, il nitrato di ammonio si decompone in protossido di azoto e acqua. Questa reazione può avvenire in modo esplosivo:
NH4NO3 = N2O + H2O
Il nitrito di ammonio NH4NO2 si decompone quando riscaldato per formare azoto e acqua, quindi viene utilizzato in laboratorio per ottenere azoto.
Quando i sali di ammonio sono esposti agli alcali, viene rilasciata ammoniaca:
NH4Cl + NaOH = NaCl + NH3 + H2O
Il rilascio di ammoniaca è un segno caratteristico per il riconoscimento dei sali di ammonio. Tutti i sali di ammonio sono composti complessi.
L'ammoniaca e i sali di ammonio sono ampiamente utilizzati. L'ammoniaca viene utilizzata come materia prima per la produzione di acido nitrico e dei suoi sali, nonché di sali di ammonio, che fungono da buoni fertilizzanti azotati. Tali fertilizzanti sono il solfato di ammonio (NH4)2SO4 e soprattutto il nitrato di ammonio NH4NO3 o nitrato di ammonio, la cui molecola contiene due atomi di azoto: uno di ammonio, l'altro di nitrato. Le piante assorbono prima l'ammoniaca e poi i nitrati. Questa conclusione appartiene al fondatore dell'agrochimica russa, Acad. D. N. Pryanishnikov, che dedicò le sue opere alla fisiologia vegetale e dimostrò l'importanza dei fertilizzanti minerali in agricoltura.
L'ammoniaca sotto forma di ammoniaca viene utilizzata in medicina. L'ammoniaca liquida viene utilizzata nelle unità di refrigerazione. Il cloruro di ammonio viene utilizzato per realizzare la cella galvanica a secco Leclanché. Una miscela di nitrato di ammonio con alluminio e carbone, chiamata ammonal, è un potente esplosivo.
Il carbonato di ammonio è utilizzato nell'industria dolciaria come agente lievitante.
■ 25. Su quali proprietà del carbonato di ammonio si basa il suo utilizzo per sciogliere l'impasto?
26. Come rilevare lo ione ammonio nel sale?
27. Come effettuare una serie di trasformazioni:
N2 ⇄ NH3 → NO
↓
NH4N03
Composti dell'ossigeno dell'azoto
Forma diversi composti con l'ossigeno, in cui presenta diversi stati di ossidazione.
C'è il protossido di azoto N2O o, come viene chiamato, "gas esilarante". Presenta uno stato di ossidazione di + 1. Nell'ossido di azoto NO, l'azoto presenta uno stato di ossidazione di + 2, nell'anidride nitrosa N2O3 - + 3, nel biossido di azoto NO2 - +4, nel pentossido di azoto o nitrico
anidride, N2O5 - +5.
Il protossido di azoto N2O è un ossido che non forma sali. Questo è un gas abbastanza solubile in acqua, ma non reagisce con l'acqua. Il protossido d'azoto miscelato con ossigeno (80% N2O e 20% O2) produce un effetto narcotico e viene utilizzato per la cosiddetta anestesia gassosa, il cui vantaggio è che non ha un effetto prolungato.
Il resto dell'azoto è altamente velenoso. Il loro effetto tossico di solito si manifesta entro poche ore dall'inalazione. Il primo soccorso consiste nell'ingerire una grande quantità di latte, nell'inalare ossigeno puro e nel far riposare la vittima.
■ 28. Elencare i possibili stati di ossidazione dell'azoto e i corrispondenti stati di ossidazione.
29. Quali misure di primo soccorso dovrebbero essere adottate in caso di avvelenamento da ossidi di azoto?
Gli ossidi di azoto più interessanti e importanti sono l'ossido di azoto e il biossido di azoto, che studieremo.
L'ossido nitrico NO si forma da azoto e ossigeno durante forti scariche elettriche. La formazione di ossido di azoto si osserva talvolta nell'aria durante un temporale, ma in quantità molto piccole. L'ossido nitrico è un gas incolore e inodore. L'ossido nitrico è insolubile in acqua, quindi può essere raccolto sopra l'acqua nei casi in cui la preparazione viene effettuata in laboratorio. In laboratorio l'ossido nitrico si ottiene dall'acido nitrico moderatamente concentrato mediante la sua azione su:
HNO3 + Cu → Cu(NO3)2 + NO + H2O
Disponi tu stesso i coefficienti di questa equazione.
L'ossido nitrico può essere prodotto in altri modi, ad esempio nella fiamma dell'arco elettrico:
N2 + O2 ⇄ 2NO.
Nella produzione dell'acido nitrico, l'ossido nitrico si ottiene mediante l'ossidazione catalitica dell'ammoniaca, di cui si è parlato nel § 68, pagina 235.
L'ossido nitrico è un ossido che non forma sale. Viene facilmente ossidato dall'ossigeno atmosferico e si trasforma in biossido di azoto NO2. Se l'ossidazione viene eseguita in un recipiente di vetro, l'ossido nitrico incolore si trasforma in un gas marrone: il biossido di azoto.
■ 30. Quando il rame interagisce con l'acido nitrico, vengono rilasciati 5,6 litri di ossido nitrico. Calcola quanto rame ha reagito e quanto sale si è formato.
Il biossido di azoto NO2 è un gas marrone con un odore caratteristico. È altamente solubile in acqua, poiché reagisce con l'acqua secondo l'equazione:
3NO2 + H2O = 2HNO3 + NO
In presenza di ossigeno si può ottenere solo acido nitrico:
4NO2 + 2H2O + O2 = 4HNO3
Le molecole di biossido di azoto NO2 si combinano abbastanza facilmente in coppie e formano il tetrossido di azoto N2O4, un liquido incolore, la cui formula strutturale è
Questo processo avviene al freddo. Quando riscaldato, il tetrossido di azoto si trasforma nuovamente in biossido di azoto.
Il biossido di azoto è un ossido acido perché può reagire con gli alcali per formare sale e acqua. Tuttavia, a causa del fatto che gli atomi di azoto nella modifica N2O4 hanno un numero diverso di legami di valenza, quando il biossido di azoto reagisce con gli alcali, si formano due sali: nitrato e nitrito:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Il biossido di azoto si ottiene, come accennato in precedenza, per ossidazione dell'ossido:
2NO+O2 = 2NO2
Inoltre, il biossido di azoto viene prodotto dall'azione dell'acido nitrico concentrato su:
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(concentrato)
o meglio calcinando il nitrato di piombo:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
■ 31. Elencare i metodi per produrre biossido di azoto, fornendo le equazioni per le reazioni corrispondenti.
32. Disegna un diagramma della struttura dell'atomo di azoto nello stato di ossidazione +4 e spiega quale dovrebbe essere il suo comportamento nelle reazioni redox.
33. 32 g di una miscela di rame e ossido di rame furono posti in acido nitrico concentrato. Il contenuto di rame nella miscela è del 20%. Quale volume di quale gas verrà rilasciato? Quante molecole di sale vengono prodotte?
Acido nitroso e nitriti
L'acido nitroso HNO2 è un acido molto debole e instabile. Esiste solo in soluzioni diluite (a = 6,3% in una soluzione 0,1 N). L'acido nitroso si decompone facilmente per formare ossido di azoto e biossido di azoto
2HNO2 = NO + NO2 + H2O.
Lo stato di ossidazione dell'azoto nell'acido nitroso è +3. Con questo grado di ossidazione si può convenzionalmente supporre che dallo strato esterno dell'atomo di azoto siano stati ceduti 3 elettroni e che siano rimasti 2 elettroni di valenza. A questo proposito, ci sono due possibilità per N+3 nelle reazioni redox: può presentare proprietà sia ossidanti che riducenti, a seconda dell'ambiente - ossidativo o riducente - in cui entra.
I sali dell'acido nitroso sono chiamati nitriti. Trattando i nitriti con acido solforico si ottiene acido nitroso:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2.
I nitriti sono sali abbastanza solubili in acqua. Come lo stesso acido nitroso, i nitriti possono mostrare proprietà ossidanti quando reagiscono con agenti riducenti, ad esempio:
NaNO2 + KI + H2SO4 → I2 + NO…
Prova a trovare i prodotti finali e organizza tu stesso i coefficienti in base alla bilancia elettronica.
Poiché il rilascio è facile da rilevare utilizzando l'amido, questa reazione può servire come modo per rilevare anche piccole quantità di nitriti nell'acqua potabile, la cui presenza è indesiderata a causa della tossicità. D'altra parte, l'azoto nitrito può essere ossidato a N +5 sotto l'influenza di un forte agente ossidante.
NaNO2 + K2Cr2O7 + H2SO4 → NaNO3 + Cr2(SO4)3 + …
Trova tu stesso i restanti prodotti di reazione, redige un bilancio elettronico e organizza i coefficienti.
■ 34. Completa l'equazione.
HNO2 + KMnO4 + H2SO4 → … (N+5, Mn+2).
35. Elencare le proprietà dell'acido nitroso e dei nitriti.
Acido nitrico
HNO3 è un elettrolita forte. Questo è un liquido volatile. Puro bolle ad una temperatura di 86°, non ha colore; la sua densità è 1,53. I laboratori ricevono tipicamente il 65% di HNO3 con una densità di 1,40.
fuma nell'aria, poiché i suoi vapori, salendo nell'aria e combinandosi con il vapore acqueo, formano goccioline di nebbia. L'acido nitrico si mescola con l'acqua in qualsiasi rapporto. Ha un odore pungente ed evapora facilmente, quindi l'acido nitrico concentrato deve essere versato solo sotto pressione. Se entra in contatto con la pelle, l'acido nitrico può causare gravi ustioni. Una piccola bruciatura si manifesta come una caratteristica macchia gialla sulla pelle. Ustioni gravi possono causare ulcere. Se l'acido nitrico entra in contatto con la pelle, deve essere rapidamente lavato via con abbondante acqua e quindi neutralizzato con una soluzione debole di soda.
L'acido nitrico concentrato al 96-98% entra raramente in laboratorio e durante lo stoccaggio abbastanza facilmente, soprattutto alla luce, si decompone secondo l'equazione:
4HNO3 = 2H2O + 4NO2 + O2
È permanentemente colorato di giallo dal biossido di azoto. Il biossido di azoto in eccesso evapora gradualmente dalla soluzione, si accumula nella soluzione e l'acido continua a decomporsi. A questo proposito, la concentrazione di acido nitrico diminuisce gradualmente. Ad una concentrazione del 65%, l'acido nitrico può essere conservato a lungo.
L'acido nitrico è uno degli agenti ossidanti più forti. Reagisce con quasi tutti i metalli, ma senza rilasciare idrogeno. Le pronunciate proprietà ossidanti dell'acido nitrico hanno un cosiddetto effetto passivante su alcuni (,) composti. Ciò è particolarmente vero per gli acidi concentrati. Quando esposto ad esso, sulla superficie del metallo si forma una pellicola di ossido insolubile in acido molto densa, che protegge il metallo da un'ulteriore esposizione all'acido. Il metallo diventa "passivo". .
Tuttavia, l'acido nitrico reagisce con la maggior parte dei metalli. In tutte le reazioni con i metalli, l'azoto viene ridotto nell'acido nitrico e, quanto più completamente, tanto più diluito è l'acido e tanto più attivo è il metallo.
L'acido concentrato viene ridotto a biossido di azoto. Un esempio di ciò è la reazione con il rame sopra riportata (vedi § 70). L'acido nitrico diluito con rame viene ridotto a ossido nitrico (vedi § 70). Quelli più attivi, ad esempio, riducono l’acido nitrico diluito in protossido di azoto.
Sn + HNO3 → Sn(NO3)2 + N2O
Con una diluizione molto forte con un metallo attivo, ad esempio lo zinco, la reazione arriva alla formazione di un sale di ammonio:
Zn + HNO3 → Zn(NO3)2 + NH4NO3
In tutti gli schemi di reazione forniti, organizza i coefficienti creando tu stesso una bilancia elettronica.
■ 36. Perché la concentrazione di acido nitrico diminuisce se conservato in laboratorio, anche in contenitori ben chiusi?
37. Perché l'acido nitrico concentrato ha un colore bruno-giallastro?
38. Scrivi l'equazione per la reazione dell'acido nitrico diluito con il ferro. I prodotti della reazione sono nitrato di ferro (III) e viene rilasciato un gas marrone.
39. Annota sul tuo quaderno tutte le equazioni di reazione che caratterizzano l'interazione dell'acido nitrico con i metalli. Elencare quali metalli, oltre ai nitrati metallici, si formano in queste reazioni.
Molti possono bruciare nell'acido nitrico, come il carbone e:
C + HNO3 → NO + CO2
P + HNO3 → NO + H3PO4
Quello libero viene ossidato ad acido fosforico. bollito in acido nitrico si trasforma in S+6 e dallo zolfo libero si forma:
HNO3 + S → NO + H2SO4
Completa tu stesso le equazioni di reazione.
Quelli complessi possono anche bruciare nell'acido nitrico. Ad esempio, la trementina e la segatura riscaldata bruciano nell'acido nitrico.
L'acido nitrico può anche ossidare l'acido cloridrico. Una miscela di tre parti di acido cloridrico e una parte di acido nitrico è chiamata acqua regia. Questo nome viene dato perché questa miscela ossida anche il platino, che non viene intaccato da nessun acido. La reazione procede nelle seguenti fasi: nella miscela stessa, lo ione cloro viene ossidato in uno libero e l'azoto viene ridotto per formare cloruro di nitrosile:
HNO3 + 3HCl ⇄ Cl2 + 2H2O + NOCl
cloruro di nitrosile dell'acqua regia
Quest'ultimo si decompone facilmente in ossido nitrico ed è libero secondo l'equazione:
2NOCl = 2NO + Cl2
Il metallo posto nell'acqua regia viene facilmente ossidato dal cloruro di nitrosile:
Au + 3NOCl = AuCl3 + 3NO
L'acido nitrico può reagire con nitrazione con sostanze organiche. In questo caso deve essere presente il concentrato. Una miscela di acidi nitrico e solforico concentrati è chiamata miscela nitrante. Utilizzando tale miscela, la nitroglicerina può essere ottenuta dalla glicerina, il nitrobenzene dal benzene, la nitrocellulosa dalla fibra, ecc. In uno stato altamente diluito, l'acido nitrico presenta le proprietà caratteristiche degli acidi.
■ 40. Fornisci i tuoi esempi di proprietà tipiche degli acidi in relazione all'acido nitrico. Scrivi le equazioni in molecolare e. forme ioniche.
41. Perché è vietato il trasporto di bottiglie di acido nitrico concentrato imballate in trucioli di legno?
42. Quando l'acido nitrico concentrato viene testato con la fenolftaleina, la fenolftaleina acquisisce un colore arancione anziché rimanere incolore. Cosa spiega questo?
È molto facile ottenere l'acido nitrico in laboratorio. Di solito si ottiene sostituendo i suoi sali con acido solforico, ad esempio:
2KNO3 + H2SO4 = K2SO4 + 2HNO3
Nella fig. 61 mostra un impianto di laboratorio per la produzione di acido nitrico.
Nell'industria, l'ammoniaca viene utilizzata come materia prima per la produzione di acido nitrico. Come risultato dell'ossidazione dell'ammoniaca in presenza di un catalizzatore di platino, si forma ossido di azoto:
4NH3 + 5O2 = 4NO + 6H2O
Come affermato sopra, l'ossido nitrico viene facilmente ossidato dall'ossigeno atmosferico in biossido di azoto:
2NO+O2 = 2NO2
e il biossido di azoto, combinandosi con l'acqua, forma acido nitrico e ancora ossido nitrico secondo l'equazione:
3NO2 + H2O = 2HNO3 + NO.
Quindi l'ossido nitrico viene nuovamente fornito per l'ossidazione:
La prima fase del processo - l'ossidazione dell'ammoniaca in ossido di azoto - viene effettuata in un apparecchio a contatto ad una temperatura di 820°. Il catalizzatore è una griglia di platino con aggiunta di rodio, che viene riscaldata prima di avviare l'apparecchio. Poiché la reazione è esotermica, le griglie vengono successivamente riscaldate a causa del calore della reazione stessa. L'ossido di azoto rilasciato dall'apparato di contatto viene raffreddato ad una temperatura di circa 40°, poiché il processo di ossidazione dell'ossido di azoto procede più velocemente ad una temperatura inferiore. Ad una temperatura di 140° il biossido di azoto risultante si decompone nuovamente in ossidi di azoto e ossigeno.
L'ossidazione dell'ossido di azoto in biossido viene effettuata in torri dette assorbitori, solitamente ad una pressione di 8-10 atm. Assorbono (assorbono) simultaneamente il biossido di azoto risultante con acqua. Per assorbire meglio il biossido di azoto, la soluzione viene raffreddata. Il risultato è il 50-60% di acido nitrico.
La concentrazione dell'acido nitrico viene effettuata in presenza di acido solforico concentrato in colonne di distillazione. forma idrati con l'acqua disponibile con punto di ebollizione superiore a quello dell'acido nitrico, per cui i vapori di acido nitrico si liberano abbastanza facilmente dalla miscela. Condensando questi vapori si può ottenere acido nitrico al 98-99%. In genere, viene utilizzato raramente un acido più concentrato.
■ 43. Annota sul tuo quaderno tutte le equazioni delle reazioni che si verificano quando si produce acido nitrico con metodi di laboratorio e industriali.
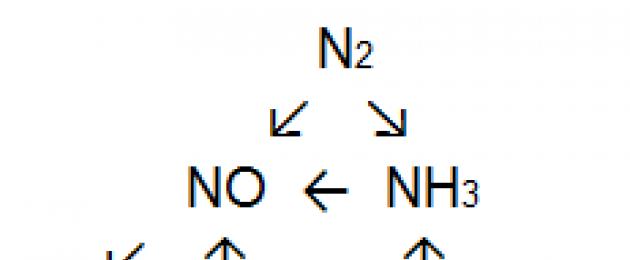
44. Come effettuare una serie di trasformazioni:

45. Quanta soluzione al 10% può essere preparata dall'acido nitrico ottenuto facendo reagire 2,02 kg di nitrato di potassio con un eccesso di acido solforico?
46. Determinare la molarità dell'acido nitrico al 63%.
47. Quanto acido nitrico può essere ottenuto da 1 tonnellata di ammoniaca con una resa del 70%?
48. Il cilindro è stato riempito con ossido nitrico spostando l'acqua. Quindi, senza rimuoverlo dall'acqua, sotto di esso è stato posto un tubo di un gasometro.
(vedi Fig. 34) e cominciò a saltare. Descrivere cosa si dovrebbe osservare nella bombola se non fosse consentito l'eccesso di ossigeno. Giustifica la tua risposta con le equazioni di reazione.

Riso. 62. Combustione del carbone nel salnitro fuso. 1 - salnitro fuso; 2 - carbone che brucia; 3 - sabbia.
Sali dell'acido nitrico
I sali dell'acido nitrico sono chiamati nitrati. I nitrati dei metalli alcalini, così come il calcio e l'ammonio, sono chiamati nitrati. Ad esempio, KNO3 è nitrato di potassio, NH4NO3 è nitrato di ammonio. In Cile si trovano depositi naturali di nitrato di sodio in grandi quantità, motivo per cui questo sale è chiamato nitrato cileno.
Riso. 62. Carbone che brucia nel salnitro fuso. 1 - salnitro fuso; 2 - carbone che brucia; 3 - sabbia.
I sali dell'acido nitrico, come lo stesso, sono forti agenti ossidanti. Ad esempio, i sali di metalli alcalini vengono separati durante la fusione secondo l'equazione:
2KNO3 = 2KNO2+O2
Grazie a ciò, il carbone e altre sostanze infiammabili bruciano nel salnitro fuso (Fig. 62).
Anche i sali di metalli pesanti si decompongono con il rilascio di ossigeno, ma secondo uno schema diverso.
2Pb(NO3)2 = 2PbO + 4NO2 + O2

Riso. 63. Ciclo dell'azoto in natura
Il nitrato di potassio viene utilizzato per produrre polvere da sparo nera. Per fare questo, viene mescolato con carbone e zolfo. Non viene utilizzato per questo scopo poiché è igroscopico. Quando viene accesa, la polvere nera brucia intensamente secondo l'equazione:
2KNO3 + 3С + S = N2 + 3CO2 + K2S
I nitrati di calcio e di ammonio sono ottimi fertilizzanti azotati. Recentemente si è diffuso anche il nitrato di potassio come fertilizzante.
L'acido nitrico è ampiamente utilizzato nella produzione di prodotti chimici farmaceutici (streptocidi), coloranti organici, celluloide, pellicole e pellicole fotografiche. I sali dell'acido nitrico sono ampiamente utilizzati nella pirotecnica.
In natura esiste un ciclo dell’azoto in cui le piante, quando muoiono, restituiscono al terreno l’azoto ricevuto. Gli animali, nutrendosi di piante, restituiscono l'azoto al suolo sotto forma di feci e, dopo la morte, i loro cadaveri marciscono e quindi restituiscono anche l'azoto ricevuto da esso al suolo (Fig. 63). Raccogliendo un raccolto, una persona interferisce con questo ciclo, lo interrompe e quindi impoverisce il terreno di azoto, quindi è necessario applicare l'azoto ai campi sotto forma di fertilizzanti minerali.
■ 49. Come effettuare una serie di trasformazioni

Acido nitrico tecnico La produzione dell'acido nitrico avviene in tre modi, che descriveremo nell'ordine in cui iniziarono ad essere utilizzati...
VERIFICA DEL COMPLETAMENTO DEI COMPITI E RISPOSTE ALLE DOMANDE 4. Per rispondere a queste domande leggere attentamente il §...
Sali di ammonio Quando le soluzioni di ammoniaca neutralizzate vengono evaporate, gli ioni di ammonio si combinano con gli anioni degli acidi prelevati, formando sostanze solide cristalline con...
>> Chimica: Sali di ammonio
Come già detto, il catione ammonio NH4+ svolge il ruolo di catione metallico e forma sali con residui acidi: NH4NO3 - nitrato di ammonio, o nitrato di ammonio, (NH4)2SO4 - solfato di ammonio, ecc.
Tutti i sali di ammonio sono solidi cristallini, altamente solubili in acqua. In numerose proprietà sono simili ai sali dei metalli alcalini e principalmente ai sali di potassio, poiché i raggi degli ioni K+ e NH+ sono approssimativamente uguali.
I sali di ammonio si ottengono facendo reagire l'ammoniaca o la sua soluzione acquosa con acidi.
Possiedono tutte le proprietà dei sali dovute alla presenza di residui acidi. Ad esempio, il cloruro o il solfato di ammonio reagiscono rispettivamente con il nitrato d'argento o il cloruro di bario, formando precipitati caratteristici. Il carbonato di ammonio reagisce con gli acidi perché la reazione produce anidride carbonica.
Inoltre, lo ione ammonio fornisce un'altra proprietà comune a tutti i sali di ammonio: i suoi sali reagiscono con gli alcali quando riscaldati per rilasciare ammoniaca.
Questa reazione è una reazione qualitativa ai sali di ammonio, poiché l'ammoniaca formata viene facilmente rilevata (come esattamente?).
Il terzo gruppo di proprietà dei sali di ammonio è la loro capacità di decomporsi se riscaldati, rilasciando gas di ammoniaca, ad esempio:
NH4Сl = NH3 + HCl
Questa reazione produce anche acido cloridrico gassoso, che evapora insieme all'ammoniaca, e raffreddandosi si combina nuovamente con esso, formando un sale, cioè, quando riscaldato in una provetta, il cloruro di ammonio secco sublima, ma compaiono cristalli bianchi sulle pareti fredde superiori di nuovamente la provetta NН4Сl (Fig. 32).
Le principali aree di applicazione dei sali di ammonio sono state mostrate in precedenza, nella Figura 31. Qui attiriamo la vostra attenzione sul fatto che quasi tutti i sali di ammonio sono utilizzati come fertilizzanti azotati. Come sapete, le piante sono in grado di assorbire l'azoto solo in forma legata, cioè sotto forma di ioni NH4 o N03. L'eminente agrochimico russo D.N. Pryanishnikov ha scoperto che se una pianta può scegliere, preferisce il catione ammonio all'anione nitrato, quindi l'uso dei sali di ammonio come fertilizzanti azotati è particolarmente efficace. Un fertilizzante azotato molto prezioso è il nitrato di ammonio NH4NO3.
Notiamo altre aree di applicazione di alcuni sali di ammonio.
Per la saldatura viene utilizzato il cloruro di ammonio NH4Cl, poiché pulisce la superficie metallica dalla pellicola di ossido e la saldatura aderisce bene ad essa.
Il bicarbonato di ammonio NH4NC03 e il carbonato di ammonio (NH4)2CO3 sono utilizzati in pasticceria, poiché si decompongono facilmente quando riscaldati e formano gas che allentano l'impasto e lo rendono soffice, ad esempio:
NH4HC03 = NH3 + H20 + CO2
Il nitrato di ammonio NН4NO3 mescolato con polveri di alluminio e carbone viene utilizzato come esplosivo - ammonale, ampiamente utilizzato nelle miniere.
1. Sali di ammonio.
2. Proprietà dei sali di ammonio dovute allo ione ammonio, residui acidi. Decomposizione dei sali di ammonio.
3. Reazione qualitativa allo ione ammonio.
4. Cloruro, nitrato, carbonato di ammonio e loro applicazioni.
Scrivere le equazioni di reazione (in forma molecolare e ionica) tra le seguenti coppie di sostanze: a) solfato di ammonio e cloruro di bario; b) cloruro di ammonio e nitrato d'argento.
Scrivere equazioni di reazione che caratterizzano le proprietà del carbonato di ammonio: interazione con acido, alcali, sale e reazione di decomposizione. Scrivi le prime tre equazioni anche in forma ionica.
Con gli acidi polibasici, l'ammoniaca forma non solo sali intermedi, ma anche acidi. Scrivere le formule dei sali acidi che può dare reagendo con l'acido fosforico. Assegna loro un nome e scrivi le equazioni di dissociazione per questi sali.
Elaborare equazioni di reazione molecolari e, ove possibile, ioniche che possano essere utilizzate per effettuare le seguenti transizioni:
N2 -> NH3 -> (NH4)2 HPO4 -> NH4Cl -> NH4NO3
Determinare la quantità di sostanza, volume e massa di ammoniaca necessaria per produrre 250 kg di solfato di ammonio utilizzato come fertilizzante.
Contenuto della lezione appunti di lezione metodi di accelerazione della presentazione delle lezioni con frame di supporto tecnologie interattive Pratica compiti ed esercizi autotest workshop, corsi di formazione, casi, ricerche compiti a casa domande di discussione domande retoriche degli studenti Illustrazioni audio, video clip e contenuti multimediali fotografie, immagini, grafica, tabelle, diagrammi, umorismo, aneddoti, barzellette, fumetti, parabole, detti, cruciverba, citazioni Componenti aggiuntivi abstract articoli trucchi per i curiosi presepi libri di testo dizionario base e aggiuntivo dei termini altro Miglioramento di libri di testo e lezionicorreggere gli errori nel libro di testo aggiornamento di un frammento in un libro di testo, elementi di innovazione nella lezione, sostituzione di conoscenze obsolete con nuove Solo per insegnanti lezioni perfette piano di calendario per l'anno; raccomandazioni metodologiche; programmi di discussione Lezioni integrateSali di ammonio
A Lo ione ammonio NH4+ svolge il ruolo di catione metallico e forma sali con residui acidi: NH4NO3 - nitrato di ammonio o nitrato di ammonio, (NH4)2SO4 - solfato di ammonio, ecc.
Tutti i sali di ammonio sono solidi cristallini, altamente solubili in acqua. In numerose proprietà sono simili ai sali dei metalli alcalini e principalmente ai sali di potassio, poiché i raggi degli ioni K+ e NH+ sono approssimativamente uguali.
I sali di ammonio si ottengono facendo reagire l'ammoniaca o la sua soluzione acquosa con acidi.
Possiedono tutte le proprietà dei sali dovute alla presenza di residui acidi. Ad esempio, il cloruro o il solfato di ammonio reagiscono rispettivamente con il nitrato d'argento o il cloruro di bario, formando precipitati caratteristici. Il carbonato di ammonio reagisce con gli acidi perché la reazione produce anidride carbonica.
Inoltre, lo ione ammonio fornisce un'altra proprietà comune a tutti i sali di ammonio: i suoi sali reagiscono con gli alcali quando riscaldati per rilasciare ammoniaca.
Questa reazione è una reazione qualitativa ai sali di ammonio, poiché l'ammoniaca formata viene facilmente rilevata (come esattamente?).
Il terzo gruppo di proprietà dei sali di ammonio è la loro capacità di decomporsi se riscaldati, rilasciando gas di ammoniaca, ad esempio:
NH4Сl = NH3 + HCl
Questa reazione produce anche acido cloridrico gassoso, che evapora insieme all'ammoniaca, e raffreddandosi si combina nuovamente con esso, formando un sale, cioè, quando riscaldato in una provetta, il cloruro di ammonio secco sublima, ma compaiono cristalli bianchi sulle pareti fredde superiori di nuovamente la provetta NН4Сl (Fig. 32).
Le principali aree di applicazione dei sali di ammonio sono state mostrate in precedenza, nella Figura 31. Qui attiriamo la vostra attenzione sul fatto che quasi tutti i sali di ammonio sono utilizzati come fertilizzanti azotati. Come sapete, le piante sono in grado di assorbire l'azoto solo in forma legata, cioè sotto forma di ioni NH4 o N03. L'eminente agrochimico russo D.N. Pryanishnikov ha scoperto che se una pianta può scegliere, preferisce il catione ammonio all'anione nitrato, quindi l'uso dei sali di ammonio come fertilizzanti azotati è particolarmente efficace. Un fertilizzante azotato molto prezioso è il nitrato di ammonio NH4NO3.
Notiamo altre aree di applicazione di alcuni sali di ammonio.
Per la saldatura viene utilizzato il cloruro di ammonio NH4Cl, poiché pulisce la superficie metallica dalla pellicola di ossido e la saldatura aderisce bene ad essa.
Il bicarbonato di ammonio NH4NC03 e il carbonato di ammonio (NH4)2CO3 sono utilizzati in pasticceria, poiché si decompongono facilmente quando riscaldati e formano gas che allentano l'impasto e lo rendono soffice, ad esempio:
NH4HC03 = NH3 + H20 + CO2
Il nitrato di ammonio NН4NO3 mescolato con polveri di alluminio e carbone viene utilizzato come esplosivo - ammonale, ampiamente utilizzato nelle miniere.
Nei composti chimici, NH4+ si manifesta come un catione di metallo alcalino a carica singola positivo. Quando interagiscono con anioni acidi, si formano sostanze con una struttura cristallina: sali NH4N03, cloruro NH4C1, solfato (NH4)2S04, che consistono in un anione acido e un gruppo ammonio.
I sali di ammonio si ottengono durante la reazione dell'ammoniaca con acidi.
I sali di ammonio, come, in linea di principio, la maggior parte dei metalli alcalini, possono dissociarsi (dividersi in cationi e anioni) in soluzioni acquose in ioni: i sali di ammonio, come i sali di metalli alcalini, si dissociano in ioni:
NH4N03 ↔ NH4++ NO3-
Durante il processo di riscaldamento, i sali di ammonio secchi si decompongono in ammoniaca e acido; Questo processo è anche chiamato dissociazione termica.
L'acido risultante (ad esempio l'acido cloridrico) evapora insieme a NH3 e, dopo il raffreddamento, si combina con l'ammoniaca per formare un sale. Va detto che è possibile anche un processo di decomposizione reversibile:
NH3 + HCl ↔ NH4Cl
Pertanto, quando riscaldata, l'ammoniaca sublima, tuttavia, dopo un po ', sulle parti superiori della provetta appare uno strato bianco di cloruro di ammonio. Come risultato della formazione di un sale da parte di un acido non volatile, ad esempio (NH4)2S04, durante il riscaldamento evapora solo NH3 e l'acido rimane. Questo processo è chiamato decomposizione irreversibile.
Tutti i sali di ammonio si decompongono bene con gli alcali (quando riscaldati) rilasciando ammoniaca:
NH4++OH-↔NH3+ H20
Questa reazione viene utilizzata per riconoscere i fertilizzanti minerali con la forma ammoniacale dell'azoto.
Quando il carbonato di ammonio interagisce con i minerali, viene rilasciata anidride carbonica. Quando il solfato o il cloruro di ammonio reagiscono con AgNO3 o BaCl, si formano caratteristici precipitati bianchi.
Sali di ammonio: esempi
I sali di ammonio sono ampiamente utilizzati in agricoltura. Questo è un materiale eccellente per l'alimentazione minerale delle piante (ad esempio solfato di ammonio - (NH4)2S04). Come è noto, le piante possono assorbire solo l'azoto in forma legata (NO3, NH4). Pertanto, i composti dell'azoto sono molto efficaci. Di grande importanza è il nitrato di ammonio, che contiene ammonio NH4 e nitrato NO3-azoto.
Il diidrogeno fosfato e l'ammonio idrogeno fosfato, conosciuti con i nomi ammophos NH4H2P04 e diammophos (NH4)2НР04, contengono due nutrienti chimici per le piante: azoto e fosforo. I sali di ammonio fanno parte delle miscele di fertilizzanti.
Quando l'ammoniaca reagisce con l'ossido di carbonio (IV), viene sintetizzata l'urea o la carbammide NH2-CO-NH2.
Il cloruro di ammonio (NH4C1) o ammoniaca viene utilizzato nelle celle galvaniche, nella tintura e nella stampa di calicò, nella stagnatura e nella saldatura. A contatto con il metallo riscaldato, l'ammoniaca si decompone in acido cloridrico e ammoniaca. interagisce con l'ossido contaminando la superficie metallica, dando luogo alla formazione di un sale volatile.
Si prega di notare che la saldatura aderisce molto bene alla superficie pulita. NH4NO3 (nitrato di ammonio) insieme al carbone e ai sali di alluminio sono parte integrante dell'esplosivo: l'ammonale. Questi composti sono utilizzati nello sviluppo delle rocce. (NH4НСО3) è molto spesso utilizzato nell'industria alimentare e dolciaria. Questo composto viene utilizzato anche come conservante per vari tipi di mangimi. NH4HCO3 ha proprietà denitrificanti, che accelera la maturazione del raccolto.
Reazione qualitativa ai sali di ammonio. Quando viene riscaldata una soluzione di sali di ammonio e alcali, si forma la soluzione che si divide liberando ammoniaca.
La presenza di ammoniaca può essere determinata dal suo odore specifico, nonché utilizzando indicatori di carta colorata. Per effettuare questa reazione è necessario prendere 1,0 cm3 di soluzione di sale di ammonio, aggiungere 0,5 cm3 della soluzione e riscaldarla. Durante il processo di riscaldamento, viene rilasciata ammoniaca, si forma un odore caratteristico e il tornasole rosso diventa blu.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0