Alkany:
Alkany to węglowodory nasycone, w których cząsteczkach wszystkie atomy są połączone wiązaniami pojedynczymi. Formuła -
Właściwości fizyczne:
- Temperatury topnienia i wrzenia rosną wraz z masą cząsteczkową i długością szkieletu węglowego
- W normalnych warunkach nierozgałęzione alkany od CH 4 do C 4 H 10 są gazami; od C 5 H 12 do C 13 H 28 - ciecze; po C 14 H 30 - ciała stałe.
- Temperatury topnienia i wrzenia spadają z mniej rozgałęzionych do bardziej rozgałęzionych. Na przykład w temperaturze 20°C n-pentan jest cieczą, a neopentan jest gazem.
Właściwości chemiczne:
· Halogenowanie
jest to jedna z reakcji podstawienia. Najmniej uwodorniony atom węgla jest halogenowany jako pierwszy (atom trzeciorzędowy, następnie drugorzędowy, atomy pierwszorzędowe są halogenowane jako ostatnie). Halogenowanie alkanów zachodzi etapami - w jednym etapie zastępuje się nie więcej niż jeden atom wodoru:
- CH 4 + Cl 2 → CH 3 Cl + HCl (chlorometan)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (dichlorometan)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (trichlorometan)
- CHCl 3 + Cl 2 → CCl 4 + HCl (czterochlorek węgla).
Pod wpływem światła cząsteczka chloru rozpada się na rodniki, następnie atakują cząsteczki alkanów, odbierając im atom wodoru, w wyniku czego powstają rodniki metylowe CH3, które zderzają się z cząsteczkami chloru, niszcząc je i tworząc nowi radykałowie.
· Spalanie
Główną właściwością chemiczną węglowodorów nasyconych, która decyduje o ich zastosowaniu jako paliwa, jest reakcja spalania. Przykład:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
W przypadku braku tlenu zamiast dwutlenek węgla otrzymuje się tlenek węgla lub węgiel (w zależności od stężenia tlenu).
Ogólnie reakcję spalania alkanów można zapisać w następujący sposób:
Z N H 2 N+2 +(1,5N+0,5)O2 = N CO2 + ( N+1)H2O
· Rozkład
Reakcje rozkładu zachodzą dopiero pod wpływem wysokich temperatur. Wzrost temperatury prowadzi do zerwania wiązań węglowych i powstania wolnych rodników.
Przykłady:
CH 4 → C + 2H 2 (t > 1000°C)
C 2 H 6 → 2C + 3H 2
Alkeny:
Alkeny to nienasycone węglowodory zawierające w cząsteczce oprócz wiązań pojedynczych jedno wiązanie podwójne węgiel-węgiel Wzór - C n H 2n
Przynależność węglowodoru do klasy alkenów jest odzwierciedlona przez rodzajowy przyrostek –en w jego nazwie.
Właściwości fizyczne:
- Temperatury topnienia i wrzenia alkenów (w uproszczeniu) rosną wraz z masą cząsteczkową i długością szkieletu węglowego.
- W normalnych warunkach alkeny od C2H4 do C4H8 są gazami; od C 5 H 10 do C 17 H 34 - ciecze, po C 18 H 36 - ciała stałe. Alkeny są nierozpuszczalne w wodzie, ale są dobrze rozpuszczalne w rozpuszczalnikach organicznych.
Właściwości chemiczne:
· Odwodnienie to proces oddzielenia cząsteczki wody od cząsteczki związku organicznego.
· Polimeryzacja to proces chemiczny polegający na łączeniu wielu początkowych cząsteczek substancji o niskiej masie cząsteczkowej w duże cząsteczki polimeru.
Polimer jest związkiem wielkocząsteczkowym, którego cząsteczki składają się z wielu identycznych jednostek strukturalnych.
Alkadieny:
Alkadieny to nienasycone węglowodory zawierające w cząsteczce oprócz wiązań pojedynczych, wiązania podwójne węgiel-węgiel.
. Dieny są strukturalnymi izomerami alkinów.Właściwości fizyczne:
Butadien to gaz (temperatura wrzenia -4,5°C), izopren to ciecz wrząca w temperaturze 34°C, dimetylobutadien to ciecz wrząca w temperaturze 70°C. Izopren i inne węglowodory dienowe są zdolne do polimeryzacji w gumę. Kauczuk naturalny w stanie oczyszczonym jest polimerem o wzorze ogólnym (C5H8)n otrzymywanym z mlecznego soku niektórych rośliny tropikalne.
Kauczuk jest dobrze rozpuszczalny w benzenie, benzynie i dwusiarczku węgla. W niskich temperaturach po podgrzaniu staje się kruchy i lepki. Aby poprawić właściwości mechaniczne i chemiczne gumy, przekształca się ją w gumę poprzez wulkanizację. Aby otrzymać wyroby gumowe, najpierw formuje się je z mieszaniny gumy z siarką, a także wypełniaczy: sadzy, kredy, gliny i niektórych związki organiczne, służący do przyspieszenia wulkanizacji. Następnie produkty są podgrzewane – wulkanizacja na gorąco. Podczas wulkanizacji siarka wiąże się chemicznie z gumą. Ponadto wulkanizowana guma zawiera siarkę w stanie wolnym w postaci drobnych cząstek.
Węglowodory dienowe łatwo polimeryzują. Reakcja polimeryzacji węglowodorów dienowych leży u podstaw syntezy kauczuku. Ulegają reakcjom addycji (uwodornienia, halogenowania, hydrohalogenacji):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
Alkiny:
Alkiny to nienasycone węglowodory, których cząsteczki zawierają, oprócz wiązań pojedynczych, jedno potrójne wiązanie węgiel-węgiel. Wzór-CnH2n-2
Właściwości fizyczne:
Alkiny przypominają odpowiednie alkeny pod względem właściwości fizycznych. Niższe (do C4) są bezbarwne i bezwonne gazy, które mają wyższą temperaturę wrzenia niż ich analogi w alkenach.
Alkiny są słabo rozpuszczalne w wodzie, ale lepiej w rozpuszczalnikach organicznych.
Właściwości chemiczne:
Reakcje halogenowania
Alkiny mogą dodawać jedną lub dwie cząsteczki halogenu, tworząc odpowiednie pochodne halogenowe:
Uwodnienie
W obecności soli rtęci alkiny dodają wodę, tworząc aldehyd octowy (w przypadku acetylenu) lub keton (w przypadku innych alkinów)
Struktura alkanów
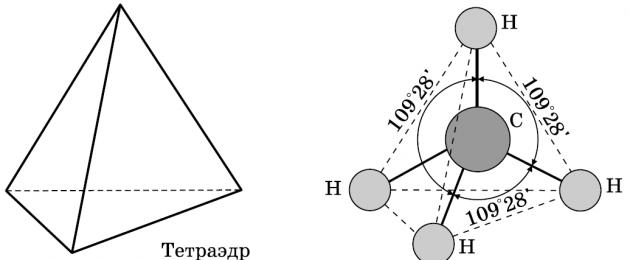
Alkany to węglowodory, w których cząsteczkach atomy są połączone wiązaniami pojedynczymi i które odpowiadają wzorowi ogólnemu CnH2n+2. W cząsteczkach alkanów wszystkie atomy węgla znajdują się w stanie sp 3 -hybrydyzacja.
Oznacza to, że wszystkie cztery orbitale hybrydowe atomu węgla mają identyczny kształt, energię i są skierowane pod kątami równobocznymi. trójkątna piramida - czworościan. Kąty między orbitalami wynoszą 109° 28′. Możliwa jest prawie swobodna rotacja wokół pojedynczego wiązania węgiel-węgiel, a najwięcej mogą pozyskać cząsteczki alkanów różne kształty z kątami przy atomach węgla bliskimi czworościennym (109° 28′), na przykład w cząsteczce n-pentanu.

Szczególnie warto przypomnieć wiązania w cząsteczkach alkanów. Wszystkie wiązania w cząsteczkach węglowodorów nasyconych są pojedyncze. Nakładanie się następuje wzdłuż osi łączącej jądra atomów, czyli tzw wiązania σ. Wiązania węgiel-węgiel są niepolarne i słabo polaryzowalne. Długość wiązania CC w alkanach wynosi 0,154 nm (1,54 · 10 · 10 m). Wiązania CH są nieco krótsze. Gęstość elektronów jest nieznacznie przesunięta w stronę bardziej elektroujemnego atomu węgla, tj. wiązania C-H słabo polarny.
Seria homologiczna metanu
Homologie- substancje o podobnej budowie i właściwościach oraz różniące się między sobą jedną lub więcej grup CH 2 .


Węglowodory nasycone stanowią homologiczną serię metanu.
Izomeria i nazewnictwo alkanów
Alkany charakteryzują się tzw izomeria strukturalna. Izomery strukturalne różnią się między sobą budową szkieletu węglowego. Najprostszym alkanem, który charakteryzuje się izomerami strukturalnymi, jest butan.

Rozważmy bardziej szczegółowo podstawową nomenklaturę alkanów IUPAC.
1. Wybór obwodu głównego. Tworzenie nazwy węglowodoru rozpoczyna się od zdefiniowania głównego łańcucha - najdłuższego łańcucha atomów węgla w cząsteczce, który jest niejako jego podstawą.
2. Numeracja atomów łańcucha głównego. Atomy głównego łańcucha mają przypisane numery. Numeracja atomów łańcucha głównego rozpoczyna się od końca, do którego podstawnik jest najbliższy (struktury A, B). Jeżeli podstawniki znajdują się w równej odległości od końca łańcucha, to numerację rozpoczyna się od końca, na którym jest ich więcej (struktura B). Jeżeli różne podstawniki znajdują się w równych odległościach od końców łańcucha, to numerację rozpoczyna się od końca, do którego najbliżej jest starszy (struktura D). Starszeństwo podstawników węglowodorowych określa kolejność, w jakiej litera, od której zaczyna się ich nazwa, pojawia się w alfabecie: metyl (-CH 3), następnie propyl (-CH 2 -CH 2 -CH 3), etyl (-CH 2 -CH3) itd.
Należy pamiętać, że nazwę podstawnika tworzy się poprzez zastąpienie przyrostka -ane przyrostkiem -yl w nazwie odpowiedniego alkanu.
3. Tworzenie imienia. Na początku nazwy wskazane są liczby - liczby atomów węgla, przy których znajdują się podstawniki. Jeżeli przy danym atomie jest kilka podstawników, to odpowiadająca im liczba w nazwie powtarza się dwukrotnie, oddzielona przecinkiem (2,2-). Po liczbie łącznik wskazuje liczbę podstawników (di - dwa, trzy - trzy, tetra - cztery, penta - pięć) i nazwę podstawnika (metyl, etyl, propyl). Następnie bez spacji i myślników nazwa głównego łańcucha. Główny łańcuch nazywa się węglowodorem - członkiem homologicznej serii metanu (metan, etan, propan itp.).




Nazwy substancji, których wzory strukturalne podano powyżej, są następujące:
Struktura A: 2-metylopropan;
Struktura B: 3-etyloheksan;
Struktura B: 2,2,4-trimetylopentan;
Struktura D: 2-metylo-4-etyloheksan.
Brak nasyconych węglowodorów w cząsteczkach wiązania polarne prowadzi do nich słabo rozpuszczalny w wodzie, nie oddziałują z naładowanymi cząsteczkami (jonami). Najbardziej charakterystycznymi reakcjami dla alkanów są reakcje z udziałem wolne rodniki.
Właściwości fizyczne alkanów
Pierwsi czterej przedstawiciele homologicznej serii metanu to gazy. Najprostszym z nich jest metan - bezbarwny, pozbawiony smaku i zapachu gaz (zapach „gazu”, gdy go poczujesz, należy zadzwonić pod numer 04, określa zapach merkaptanów - związków zawierających siarkę specjalnie dodawanych do metanu używanego w domowych i przemysłowych urządzeniach gazowych, aby osoby znajdujące się w ich pobliżu mogły wykryć wyciek po zapachu).
Węglowodory o składzie z Z 5 N 12 zanim Z 15 N 32 - płyny; cięższe węglowodory są ciałami stałymi. Temperatury wrzenia i topnienia alkanów stopniowo rosną wraz ze wzrostem długości łańcucha węglowego. Wszystkie węglowodory są słabo rozpuszczalne w wodzie; ciekłe węglowodory są powszechnymi rozpuszczalnikami organicznymi.


Właściwości chemiczne alkanów
Reakcje podstawienia.
Najbardziej charakterystycznymi reakcjami dla alkanów są substytucja wolnych rodników, podczas którego atom wodoru zostaje zastąpiony atomem halogenu lub jakąś grupą.
Przedstawmy równania charakterystyczne reakcje halogenowania:
W przypadku nadmiaru halogenu chlorowanie może postępować dalej, aż do całkowitego zastąpienia wszystkich atomów wodoru chlorem:

Powstałe substancje są szeroko stosowane jako rozpuszczalniki i materiały wyjściowe w syntezach organicznych.
Reakcja odwodornienia(pobieranie wodoru).
Podczas przepuszczania alkanów przez katalizator (Pt, Ni, Al 2 O 3, Cr 2 O 3) w temperaturze wysoka temperatura(400-600°C) cząsteczka wodoru jest eliminowana i tworzy się alken:
Reakcje, którym towarzyszy zniszczenie łańcucha węglowego. Wszystkie węglowodory nasycone płoną z utworzeniem dwutlenku węgla i wody. Węglowodory gazowe zmieszane z powietrzem w określonych proporcjach mogą eksplodować.
1. Spalanie węglowodorów nasyconych jest wolnorodnikową reakcją egzotermiczną, która ma bardzo bardzo ważne w przypadku stosowania alkanów jako paliwa:
Ogólnie reakcję spalania alkanów można zapisać w następujący sposób:
2. Rozszczepianie termiczne węglowodorów.
Proces przebiega wg mechanizm wolnorodnikowy. Wzrost temperatury prowadzi do homolitycznego rozerwania wiązania węgiel-węgiel i powstania wolnych rodników.
Rodniki te oddziałują ze sobą, wymieniając atom wodoru, tworząc cząsteczkę cząsteczka alkanu i alkenu:
Reakcje rozkładu termicznego stanowią podstawę procesu przemysłowego - kraking węglowodorów. Proces ten jest najważniejszym etapem rafinacji ropy naftowej.
3. Piroliza. Gdy metan zostanie podgrzany do temperatury 1000°C, piroliza metanu- rozkład na substancje proste:
Po podgrzaniu do temperatury 1500°C tworzy się acetylen:
4. Izomeryzacja. Gdy liniowe węglowodory ogrzewa się za pomocą katalizatora izomeryzacji (chlorku glinu), substancje z rozgałęziony szkielet węglowy:

5. Aromatyzacja. Alkany zawierające sześć lub więcej atomów węgla w łańcuchu cyklizują w obecności katalizatora, tworząc benzen i jego pochodne:

Alkany wchodzą w reakcje, które przebiegają zgodnie z mechanizmem wolnorodnikowym, gdyż wszystkie atomy węgla w cząsteczkach alkanów znajdują się w stanie hybrydyzacji sp 3. Cząsteczki tych substancji zbudowane są przy użyciu kowalencji niepolarne C-C wiązania (węgiel - węgiel) i słabo polarne wiązania C-H (węgiel - wodór). Nie zawierają obszarów o zwiększonej lub zmniejszonej gęstości elektronowej, wiązań łatwo spolaryzowanych, czyli takich wiązań gęstość elektronów w którym może się przemieszczać pod wpływem czynników zewnętrznych (pola elektrostatyczne jonów). W konsekwencji alkany nie będą reagować z naładowanymi cząstkami, ponieważ wiązania w cząsteczkach alkanów nie są przerywane przez mechanizm heterolityczny.
Węglowodory nasycone to związki będące cząsteczkami składającymi się z atomów węgla w stanie hybrydyzacji sp 3. Są one połączone ze sobą wyłącznie kowalencyjnymi wiązaniami sigma. Nazwa węglowodory „nasycone” lub „nasycone” wzięła się stąd, że związki te nie mają zdolności przyłączania żadnych atomów. Są ekstremalne, całkowicie nasycone. Wyjątkiem są cykloalkany.
Co to są alkany?
Alkany to węglowodory nasycone, a ich łańcuch węglowy jest otwarty i składa się z atomów węgla połączonych ze sobą wiązaniami pojedynczymi. Nie zawiera innych (to znaczy podwójnych, jak alkeny lub potrójnych, jak alkile) wiązań. Alkany nazywane są także parafinami. Otrzymali tę nazwę, ponieważ dobrze znane parafiny są mieszaniną głównie tych nasyconych węglowodorów C18-C35 o szczególnej obojętności.
Ogólne informacje o alkanach i ich rodnikach
Ich wzór: C n P 2 n +2, tutaj n jest większe lub równe 1. Masę molową oblicza się ze wzoru: M = 14n + 2. Funkcja: Końcówki ich imion to „-an”. Pozostałości ich cząsteczek, które powstają w wyniku zastąpienia atomów wodoru innymi atomami, nazywane są rodnikami alifatycznymi lub alkilami. Są one oznaczone literą R. Ogólna formuła jednowartościowe rodniki alifatyczne: C n P 2 n +1, tutaj n jest większe lub równe 1. Masa cząsteczkowa rodniki alifatyczne oblicza się ze wzoru: M = 14n + 1. Cecha charakterystyczna rodników alifatycznych: końcówki w nazwach to „-yl”. Cząsteczki alkanów mają swoje własne cechy strukturalne:
- Wiązanie CC charakteryzuje się długością 0,154 nm;
- Wiązanie CH charakteryzuje się długością 0,109 nm;
- kąt wiązania (kąt między wiązaniami węgiel-węgiel) wynosi 109 stopni i 28 minut.

Zaczynają szereg homologiczny alkany: metan, etan, propan, butan i tak dalej.
Właściwości fizyczne alkanów
Alkany to substancje bezbarwne i nierozpuszczalne w wodzie. Temperatura, w której alkany zaczynają się topić, i temperatura wrzenia rosną wraz ze wzrostem waga molekularna i długość łańcucha węglowodorowego. Od mniej rozgałęzionych do bardziej rozgałęzionych alkanów, temperatura wrzenia i topnienia spada. Gazowe alkany mogą palić się bladoniebieskim lub bezbarwnym płomieniem i wytwarzać dość dużo ciepła. CH 4 -C 4 H 10 to gazy, które również nie mają zapachu. C 5 H 12 -C 15 H 32 to ciecze o specyficznym zapachu. C 15 N 32 i tak dalej - to jest ciała stałe, które są również bezwonne.
Właściwości chemiczne alkanów
Związki te są chemicznie nieaktywne, co można wytłumaczyć siłą trudnych do rozerwania wiązań sigma - C-C i C-H. Warto to również rozważyć Połączenia SS są niepolarne, a C-H są niskopolarne. Są to wiązania niskospolaryzowane, należące do typu sigma i w związku z tym najprawdopodobniej zostaną rozerwane w wyniku mechanizmu homolitycznego, w wyniku czego powstaną rodniki. Zatem, Właściwości chemiczne alkany ograniczają się głównie do reakcji podstawienia rodnikowego.

Reakcje nitrowania
Alkany reagują tylko z kwasem azotowym o stężeniu 10% lub z czterowartościowym tlenkiem azotu w środowisku gazowym w temperaturze 140°C. Reakcję nitrowania alkanów nazywa się reakcją Konovalova. W rezultacie powstają związki nitrowe i woda: CH 4 + kwas azotowy (rozcieńczony) = CH 3 - NO 2 (nitrometan) + woda.
Reakcje spalania
Węglowodory nasycone są bardzo często stosowane jako paliwo, co uzasadnia ich zdolność do spalania: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Reakcje utleniania
Właściwości chemiczne alkanów obejmują również ich zdolność do utleniania. W zależności od warunków towarzyszących reakcji i sposobu ich zmiany, z tej samej substancji można otrzymać różne produkty końcowe. Łagodne utlenianie metanu tlenem w obecności katalizatora przyspieszającego reakcję i temperaturze około 200°C może skutkować powstaniem następujących substancji:
1) 2CH 4 (utlenianie tlenem) = 2CH 3OH (alkohol - metanol).
2) CH 4 (utlenianie tlenem) = CH 2 O (aldehyd - metanal lub formaldehyd) + H 2 O.
3) 2CH 4 (utlenianie tlenem) = 2HCOOH (kwas karboksylowy - metan lub mrówkowy) + 2H 2 O.

Utlenianie alkanów można również przeprowadzić w ośrodku gazowym lub ciekłym za pomocą powietrza. Takie reakcje prowadzą do powstania wyższych alkoholi tłuszczowych i odpowiednich kwasów.
Związek z ciepłem
W temperaturach nieprzekraczających +150-250°C, zawsze w obecności katalizatora, następuje strukturalne przegrupowanie substancji organicznych, polegające na zmianie kolejności łączenia atomów. Proces ten nazywa się izomeryzacją, a substancje powstałe w wyniku reakcji nazywane są izomerami. W ten sposób ze zwykłego butanu otrzymuje się jego izomer - izobutan. W temperaturach 300-600°C i obecności katalizatora wiązania C-H rozrywają się z utworzeniem cząsteczek wodoru (reakcje odwodornienia), cząsteczek wodoru z zamknięciem łańcucha węglowego w cykl (reakcje cyklizacji lub aromatyzacji alkanów) :
1) 2CH 4 = C 2 H 4 (eten) + 2H 2.
2) 2CH 4 = C 2 H 2 (etyn) + 3H 2.
3) C 7 H 16 (normalny heptan) = C 6 H 5 - CH 3 (toluen) + 4 H 2.

Reakcje halogenowania
Reakcje takie polegają na wprowadzeniu halogenów (ich atomów) do cząsteczki substancji organicznej, w wyniku czego powstaje wiązanie C-halogen. Kiedy alkany reagują z halogenami, powstają pochodne halogenowe. Reakcja ta ma specyficzne cechy. Zachodzi on według radykalnego mechanizmu i aby go zainicjować, należy poddać mieszaninę halogenów i alkanów działaniu promieniowania ultrafioletowego lub po prostu ją ogrzać. Właściwości alkanów pozwalają na przebieg reakcji halogenowania aż do całkowitego zastąpienia atomami halogenu. Oznacza to, że chlorowanie metanu nie zakończy się na jednym etapie i wytworzeniu chlorku metylu. Reakcja będzie przebiegać dalej, powstaną wszystkie możliwe produkty podstawienia, zaczynając od chlorometanu, a kończąc na czterochlorku węgla. Wystawienie innych alkanów na działanie chloru w tych warunkach spowoduje powstanie różnych produktów w wyniku podstawienia wodoru przy różnych atomach węgla. Temperatura, w której zachodzi reakcja, będzie zależeć od stosunku produkty końcowe i tempo ich powstawania. Im dłuższy łańcuch węglowodorowy alkanu, tym łatwiejsza będzie reakcja. Podczas halogenowania jako pierwszy zostanie wymieniony najmniej uwodorniony (trzeciorzędowy) atom węgla. Pierwszy zareaguje po wszystkich pozostałych. Reakcja halogenowania będzie zachodzić etapami. W pierwszym etapie wymieniany jest tylko jeden atom wodoru. Z roztworami halogenów (chloru i woda bromowa) alkany nie oddziałują.

Reakcje sulfochlorowania
Właściwości chemiczne alkanów uzupełnia także reakcja sulfochlorowania (zwana reakcją Reeda). Pod wpływem promieniowania ultrafioletowego alkany mogą reagować z mieszaniną chloru i dwutlenku siarki. W rezultacie powstaje chlorowodór, a także rodnik alkilowy, który dodaje dwutlenek siarki. Rezultatem jest złożony związek, który staje się stabilny w wyniku wychwytu atomu chloru i zniszczenia jego kolejnej cząsteczki: R-H + SO 2 + Cl 2 + promieniowanie ultrafioletowe = R-SO 2 Cl + HCl. Powstałe w wyniku reakcji chlorki sulfonylu znajdują szerokie zastosowanie w produkcji środków powierzchniowo czynnych.
Węglowodory nasycone, czyli parafiny, to biozwiązki, w których cząsteczkach atomy węgla są połączone prostym (pojedynczym) wiązaniem, a wszystkie pozostałe jednostki wartościowości są nasycone atomami wodoru.
Alkany: właściwości fizyczne
Pobranie wodoru z cząsteczki alkanu lub odwodornienie w obecności katalizatorów i po podgrzaniu (do 460 ° C) pozwala otrzymać niezbędne alkeny. Opracowano metody utleniania alkanów w niskich temperaturach w obecności katalizatorów (sole magnezowe). Pozwala to w konkretny sposób wpłynąć na przebieg reakcji i uzyskać niezbędne produkty utleniania w procesie syntezy chemicznej. Na przykład utlenianie wyższych alkanów powoduje powstawanie różnych wyższych lub wyższych alkoholi kwas tłuszczowy.
Rozszczepianie alkanów zachodzi także w innych warunkach (spalanie, kraking). Węglowodory nasycone spalają się niebieskim płomieniem, wydzielając ogromne ilości ciepła. Właściwości te pozwalają na wykorzystanie ich jako wysokokalorycznego paliwa zarówno w życiu codziennym, jak i w przemyśle.
Strona 1
Właściwości chemiczne alkanów.
Wszystkie wiązania w alkanach są niskopolarne, dlatego charakteryzują się reakcjami rodnikowymi. Brak wiązań pi uniemożliwia reakcje addycji. Alkany charakteryzują się reakcjami podstawienia, eliminacji i spalania.
|
Rodzaj i nazwa reakcji |
Przykład |
|
1. Reakcje podstawienia | |
|
A) z halogenami(Z chlorkl 2 -w świetle, br 2 - po podgrzaniu) reakcja jest posłuszna Reguła Markownika (Reguły Markownikowa ) - przede wszystkim halogenzastępuje wodór wnajmniej uwodorniony nowy atom węgla. Reakcja odbywa się etapami – w jednym etapie zastąpiony nie więcej niż jeden atom wodoru. Jod reaguje najtrudniej, a ponadto reakcja nie przebiega do końca, ponieważ np. Podczas reakcji metanu z jodem powstaje jodowodór, który reaguje z jodkiem metylu, tworząc metan i jod (reakcja odwracalna): |
CH 4 + Cl 2 → CH 3 Cl + HCl (chlorometan) CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (dichlorometan) CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (trichlorometan) CHCl 3 + Cl 2 → CCl 4 + HCl (czterochlorek węgla). |
B) Azotowanie (reakcja Konovalova)Alkany reagują z 10% kwasem azotowym lub tlenkiem azotu N 2 O 4 w fazie gazowej w temperaturze 140° i pod niskim ciśnieniem z utworzeniem nitropochodnych. Reakcja również podlega regule Markownikowa. O dynę atomów wodoru zastępuje się resztą NO 2 (grupa nitrowa) i uwalnia się woda | |
|
2. Reakcje eliminacji | |
|
A) odwodornienie– eliminacja wodoru. Warunki reakcji katalizatora – platyna i temperatura. |
CH 3 - CH 3 → CH 2 = CH 2 + H 2
|
|
B) pękanie proces termicznego rozkładu węglowodorów, który polega na reakcjach rozszczepienia łańcucha węglowego dużych cząsteczek z utworzeniem związków o krótszym łańcuchu. W temperaturze 450–700 o Alkany C rozkładają się w wyniku rozerwania wiązania SS (silniejsze połączenia CII konserwują się w tej temperaturze) oraz powstają alkany i alkeny o mniejszej liczbie atomów węgla |
C 6 H 14 C 2 H 6 + C 4 H 8 |
|
B) całkowity rozkład termiczny |
CH4C + 2H2 |
|
3. Reakcje utleniania | |
|
A) reakcja spalania Po zapaleniu (t = 600 o C) alkany reagują z tlenem i utleniają się do dwutlenku węgla i wody. |
C n H 2n+2 + O 2 ––>CO 2 + H 2 O + Q CH 4 + 2O 2 ––>CO 2 + 2H 2 O + Q |
|
B) Utlenianie katalityczne-w stosunkowo niskiej temperaturze i przy użyciu katalizatorów towarzyszy mu zerwanie tylko części wiązań C–C mniej więcej w środku cząsteczki oraz C–H i służy do otrzymania wartościowych produktów: kwasy karboksylowe, ketony, aldehydy, alkohole. |
Na przykład przy niepełnym utlenieniu butanu (rozszczepienie wiązania C2 –C3) otrzymuje się kwas octowy |
|
4. Reakcje izomeryzacji nie są typowe dla wszystkich alkanów. Zwrócono uwagę na możliwość przekształcenia niektórych izomerów w inne oraz obecność katalizatorów. |
C 4 H 10 C 4 H 10 |
|
5.. Alkany o głównym łańcuchu składającym się z 6 lub więcej atomów węgla także zareagujdehydrocyklizacja ale zawsze tworzą pierścień 6-członowy (cykloheksan i jego pochodne). W warunkach reakcji cykl ten ulega dalszemu odwodornieniu i przekształca się w energetycznie bardziej stabilny pierścień benzenowy węglowodoru aromatycznego (arenu). |
 |
Metody otrzymywania alkanów.
Alkany otrzymuje się w dużych ilościach z gazu ziemnego i ropy naftowej.
Z proste substancje w wyładowaniu elektrycznym:
Hydroliza węglika glinu
Ogrzewanie monohaloalkanów metalicznym sodem (reakcja Wurtza)
Jeśli haloalkany są różne, wynikiem będzie mieszanina trzech produktów:
Dekarboksylacja. Fuzja octanu sodu z zasadą. Wytworzony w ten sposób alkan będzie miał o jeden atom węgla mniej.
Hydroliza odczynnika Grignarda:
Alkany o symetrycznej budowie można otrzymać poprzez elektrolizę soli kwasów karboksylowych. (reakcja Kolba)
Strona 1
- W kontakcie z 0
- Google+ 0
- OK 0
- Facebook 0